Антигельминтные средства (лечение гельминтозов) — различия между версиями
(→Применение) |
Dormiz (обсуждение | вклад) (→Перспективы) |
||
| Строка 324: | Строка 324: | ||
Вместе с тем гельминтозы остаются огромной проблемой для человечества, и в итоге общество будет вынуждено пойти на высокие затраты, которых требует разработка новых антигельминтных средств и вакцин. Технические возможности для этого либо уже существуют, либо появятся в ближайшем будущем. | Вместе с тем гельминтозы остаются огромной проблемой для человечества, и в итоге общество будет вынуждено пойти на высокие затраты, которых требует разработка новых антигельминтных средств и вакцин. Технические возможности для этого либо уже существуют, либо появятся в ближайшем будущем. | ||
| + | |||
| + | == Читайте также == | ||
| + | *[[Тропические болезни]] | ||
| + | *[[Антипаразитарные средства (препараты)]] | ||
| + | *[[Противомалярийные средства (препараты)]] | ||
| + | *[[Антипротозойные средства (препараты)]] | ||
| + | *[[Лекарства и паразиты]] | ||
| + | *[[Лечение малярии (препараты)]] | ||
| + | *[[Лечение амебиаза (препараты)]] | ||
| + | *[[Лечение токсоплазмоза (препараты)]] | ||
| + | *[[Лечение стронгилоиздоза (препараты)]] | ||
Версия 20:01, 9 ноября 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
- 1 Антигельминтные средства
- 2 Лечение гельминтозов
- 3 Антигельминтные средства
- 4 Перспективы
- 5 Читайте также
Антигельминтные средства
Гельминтозами в мире страдают более 2 млрд человек. Особенно они распространены в тропиках, где нередко отмечают смешанные инвазии, вызванные сразу несколькими паразитами. Распространению гельминтозов способствуют туризм, миграция населения, войны.
Гельминты — многоклеточные организмы. Для человека патогенны представители типа круглых червей (нематод) и двух классов, относящихся к типу плоских червей, — сосальщиков (трематод) и ленточных червей (цестод). Все они отличаются друг от друга жизненным циклом, особенностями строения, развития, физиологии, локализацией в организме хозяина и чувствительностью к антигельминт-ным препаратам. Проникая в организм человека через кожу или ЖКТ, личинки гельминтов со временем превращаются в хорошо дифференцированные половозрелые формы с характерной для каждого вида локализацией в тканях. У большинства паразитов (кроме Strongyloides spp. и Echinococcus spp.) часть жизненного цикла проходит в организме промежуточного хозяина, тогда как в организме человека размножаться они не могут. Поэтому тяжесть заболевания зависит от числа попавших в организм паразитов, а анти-гельминтные средства, вызывающие гибель взрослых червей, в отсутствие повторной инвазии приводят к излечению. Как правило, в организм попадает небольшое число паразитов, тогда как случаи массивной инвазии относительно редки. Именно такие случаи характеризуются тяжелим течением и служат источником заражения.
Антигельминтные средства могут оказывать местное и резорбтивное действие. В первом случае препараты способствуют изгнанию паразитов из ЖКТ, во втором — вызывают гибель гельминтов (на разных стадиях развития), паразитирующих в органах и тканях. В настоящее время разработан целый ряд антигельминтных препаратов (особенно в ветеринарии), и некоторые из них, обладая широким спектром действия, могут оказаться эффективными для лечения большинства трематодозов и кишечных гельминтозов человека. Но многие инвазии, при которых гельминты паразитируют в тканях (в том числе цистицеркоз, эхинококкоз, филяриатозы и трихинеллез), в лучшем случае поддаются лишь частичному излечению. Большинство гельминтов — долгоживущие организмы со сложным жизненным циклом, поэтому лекарственная устойчивость паразитов пока еще не стала существенным фактором, ограничивающим эффективность лечения. Впрочем, вполне возможно, что такая устойчивость у патогенных для человека гельминтов уже возникла — вследствие широкого применения антигельминтных средств (в частности, производных бен-зимидазола) в ветеринарии.
В начале главы приведены краткие сведения о препаратах, применяемых для лечения наиболее распространенных гельминтозов человека. Затем в алфавитном порядке перечислены антигельминтные средства и рассмотрены их свойства. В конце главы обсуждаются перспективы медикаментозного лечения гельминтозов.
Лечение гельминтозов
Нематодозы
Аскаридоз
Во всем мире аскаридозом заражены более 1,4 млрд человек. Это заболевание особенно широко распространено в тропиках (в некоторых районах заболеваемость достигает 70—90%), но нередко встречается и в странах с умеренным климатом. В США аскаридозом чаше всего болеют дети из бедных семей, живущих в сельской местности на юге страны. Заражение происходит при проглатывании пищи или частиц почвы, содержащих зрелые яйца Ascaris lumbricoides.
В настоящее время для лечения аскаридоза почти везде вместо традиционных применяют более эффективные и менее токсичные средства, чаше всего — мебендазол, пирантел и альбендазол. Эффективен и пиперазин, но его применяют реже из-за побочных эффектов (нейротоксического действия и аллергических реакций). Эти препараты помогают почти всегда, поэтому назначать их следует всем инфицированным. При бессимптомном или умеренном аскаридозе предпочтительны альбендазол и мебендазол. Эти производные бензимидазсша вызывают гибель аскарид и, благодаря широкому спектру действия, эффективны при смешанных кишечных нематодозах. Альбендазол эффективен также при тканевых нематодозах и некоторых цестодозах (табл. VII. 1). При тяжелом аскаридозе (в том числе в сочетании с анкилостомидозами) оба препарата следует применять с осторожностью, так как изредка они могут спровоцировать миграцию аскарид, что приводит к тяжелым осложнениям, в том числе к аппендициту, обструкции общего желчного протока, кишечной непроходимости и перфорации кишечника с перитонитом. При тяжелых аскаридозах рекомендуют пирантел и пиперазин, которые лишь обездвиживают паразита. Пирантел эффективен также при аскаридозе в сочетании с анкилостомидозами. Применение названных препаратов не исключает полностью необходимости в хирургическом вмешательстве. Пирантел и пиперазин можно назначать беременным, но производные бензимидазола могут оказывать тератогенное действие и потому противопоказаны в I триместре беременности.
В США пирантел и альбендазол разрешены при ряде инвазий, но при аскаридозе они пока считаются экспериментальными средствами.
Анкилостомидозы
Возбудители — два родственных вида круглых червей Ancylostoma duodenale и Necatoramericanus. Во всем мире анкилостомидозами страдают около 1,3 млрд человек — в основном между 30° южной и 40” северной широты. Necator americanus распространен главным образом на Американском континенте и в Западной, Экваториальной и Южной Африке; Ancylostoma duodenale преобладает в Южной Европе, Северной Африке и на севере Азии. Анкилостомы встречаются и гораздо севернее — в местах, где поддерживается необычно высокая для этих широт температура (в шахтах, в туннелях), отсюда устаревшие названия анкилостомидозов анемия Сен-Готардского туннеля и анемия шахтеров. Личинки анкилостом обитают в почве.
В человеческий организм они проникают через кожу, с кровью заносятся в легкие, проходят через альвеолы в бронхи и при заглатывании мокроты попадают в тонкую кишку. Впиваясь в слизистую тощей кишки, взрослые анкилостомы сосут кровь и межклеточную жидкость. При тяжелой инвазии на фоне плохого питания и недостаточного поступления железа возможны железодефицитная анемия и истощение.
Лечение анкилостомидозов преследует две взаимосвязанные цели: нормализовать картину крови и изгнать гельминтов из кишечника. Справиться с анемией можно с помощью правильного питания и приема препаратов железа. Иногда может потребоваться переливание крови. Препаратами первого ряда для лечения как анкилостомоза, так и некатороза сейчас служат альбендазол и мебендазол. Оба они активны в отношении и других нематод, что немаловажно при смешанных инвазиях. Однако при тяжелых смешанных инвазиях, когда анкилосто-мидоз сопровождается аскаридозом, применять эти препараты нельзя, так как они могут вызвать миграцию аскарид. Безопаснее в таких случаях пирантел (см. выше). При кожной форме синдрома larva migrans, который возникает при попадании в кожу личинок анкилостом — чаше всего Ancylostoma braziliense (паразита собак), — назначают тиабендазол (местно или внутрь). Трихоцефалез. Трихоцефалезом (возбудитель — Trichuris trichi-ura, или власоглав) в мире заражены около 1 млрд человек. Чаще всего он встречается у детей в странах с теплым и влажным климатом, нередко сопутствует аскаридозу и анкилостомидо-зам. Заражение происходит при проглатывании яиц гельминтов с пищей. Реакция организма на взрослых гельминтов обычно выражена слабо. Исключение составляют дети младшего возраста, у которых при тяжелой инвазии могут возникать боль в животе, понос и анемия. В редких случаях гельминты поселяются в аппендиксе или пронизывают стенку кишки, вызывая перитонит. Наиболее безопасными и эффективными средствами лечения трихоцефалеза (в том числе в сочетании с аскаридозом и анкилостомидозами) считаются мебендазол и альбендазол. Пирантел при этом заболевании неэффективен.
Стронгилоидоз
Strongyloides stercoralis (кишечная угрица) отличается от остальных гельминтов тем, что ее жизненный цикл протекает целиком в человеческом организме. Стронгилоидозом в мире заражены более 200 млн человек — в основном в тропиках и районах с жарким и влажным климатом. В США чаше всего болеют дети в сельских районах на юге страны. Кроме того, стронгилоидоз обнаруживается в домах престарелых и интернатах с плохими санитарными условиями, а также среди иммигрантов, путешественников и военных, приезжающих из эндемических районов. Человек заражается стронгилоидозом при внедрении в кожу или слизистые личинок из загрязненной калом почвы. Затем личинки с кровью заносятся в легкие, проходят через альвеолы в бронхи и при заглатывании мокроты попадают в тонкую кишку. Там они превращаются в половозрелых гельминтов, которые паразитируют в слизистой проксимального отдела тонкой кишки. Обычно инвазия протекает бессимптомно, но иногда возникают сыпь и желудочно-кишечные нарушения. Из-за аутоинвазии Strongyloides stercoralis могут паразитировать на человеке десятилетиями, и при иммунодефицитах возможна диссеминация большого числа филяриевидных личинок, грозящая смертью. В США большая часть смертельных исходов при паразитарных инвазиях, по-видимому, приходится на гиперинвазию личинок Strongyloides stercoralis. Лучшее средство для лечения кишечного стронгилоидоза — ивермектин. Почти столь же эффективен тиабендазол, но он вызывает больше побочных эффектов. Несколько менее эффективны альбендазол и мебендазол.
Эктеробиоз
Это самый распространенный гельминтоз в США, им страдают более 40 млн школьников. Возбудитель энтеробиоза — Enterobius vermicularis, или острица. В умеренном климате острицы встречаются чаще, чем в тропическом. Серьезные осложнения при энтеробиозе редки. Основной симптом — анальный зуд — может быть очень сильным. Расчесы могут привести к присоединению вторичной инфекции. У женщин гельминты могут заползать в половые органы, а оттуда проникать в брюшную полость, вызывая сальпингит и даже перитонит. Поскольку энтеробиоз легко передается от человека к человеку (в семье, в школе, в доме престарелых), лечение часто назначают всем, находящимся в тесном контакте с больным. Иногда необходим повторный курс лечения.
При энтеробиозе весьма эффективны пирантел, мебендазол и альбендазол. Их принимают внутрь однократно с интервалом 2 нед. При условии строгого соблюдения правил личной гигиены в большинстве случаев такого лечения бывает достаточно. Побочные эффекты редки. Из-за возможного тератогенного действия производные бензимидазола при беременности не применяют. Эффективен также пиперазин 1 раз в сутки в течение недели, но такая схема лечения менее удобна.
Трихинеллез
Возбудители — Тrichinella spiralis — распространены повсеместно и способны развиваться вне организма хозяина. Их обнаруживают в Канаде, в Восточной Европе и, теперь (реже, в США. Люди чаше всего заболевают трихинеллезом при употреблении в пищу сырого или плохо прожаренного зараженного мяса, особенно свинины. В желудке хозяина под действием соляной кислоты личинки трихинелл освобождаются от капсул. Затем они внедряются в слизистую тонкой кишки и превращаются во взрослых гельминтов. Примерно неделю спустя самки трихинелл начинают давать потомство. Новорожденные личинки проникают в кровоток и заносятся в ткани, в особенности в скелетные мышцы и сердце. Тяжелая инвазия, как правило, сопровождается выраженной миалгией и сердечнососудистыми осложнениями; возможен и смертельный исход. К счастью, трихинеллеза легко избежать. Д ля этого надо тщательно прожаривать или проваривать свинину, употребляемую в пищу. При температуре 60*С инкапсулированные личинки погибают через 5 мин.
На ранней стадии трихинеллеза, до появления личинок, по-видимому, эффективны альбендазол и мебендазол. Но действие этих и других антигельминтных препаратов на личинок, находящихся в мышцах, остается под вопросом. На этой стадии инвазии могут оказаться полезными глюкокортикоиды, которые смягчают течение заболевания.
Филяриатозы
Эти заболевания вызываются половозрелыми гельминтами, паразитирующими в лимфатической системе (Wur-chereria bancrofti. Brugia malavi. Brugia timori) или в других тканях (Loa loa. Onchocerca volvulus, Mansonella spp.). Лимфатическими филяриатозами заражаются при укусе комаров. В мире филяриатозами больны около 90 млн человек, причем возбудителями служат в основном два вида гельминтов — Wurchereria bancrofti (около 90% случаев) и Brugia malayi (около 10% случаев). Wurchereria bancrofti широко распространены в тропиках, но риск заразиться особенно высок в Экваториальной Африке, Южной Америке, Индии и на юге Китая. Brugia malayi встречаются лишь в Индонезии, Юго-Восточной Азии и Центральной Индии, a Brugia timori — только в Индонезии. При вухерериозе и бругиозе реакция организма на взрослых гельминтов проявляется лихорадкой, димфангиитом и лимфаденитом. На более поздней стадии возникает обструкция лимфатических сосудов сопровождающаяся лимфатическим отеком, гидроцеле и слоновостью. В ряде случаев возникает реакция на микрофилярий которая проявляется тропической легочной эозинофилией. Возбудители лоаоза Loa loa обитают вблизи крупных рек Западной и Экваториальной Африки и переносятся слепнями-златоглазиками (Chrysopsspp.). Взрослые гельминты обычно паразитируют в подкожной клетчатке, вызывая время от времени кала-барскую опухоль с аллергической реакцией; иногда они внедряются в кожу и конъюнктиву. Изредка при тяжелой инвазии могут возникать энцефалопатия, дилатационная кардиомиопатия или нефропатия. Возбудитель онхоцеркоза Onchocerca volvulus встречается вблизи рек и ручьев с быстрым течением; переносчиком служат мошки рода Simulium. В Экваториальной Африке онхоцеркозом заражены около 13 млн человек. На Американском континенте он встречается реже — в отдельных районах Мексики и Южной Америки больных не более 100 000. Проявления онхоцеркоза обусловлены в большей степени микрофи-ляриями, чем взрослыми паразитами. Поражение затрагивает подкожную клетчатку, глаза и лимфоузлы. Онхоцеркоз занимает второе место в мире среди инфекционных и паразитарных причин слепоты. К редким филяриатозам относятся мансонел-лезы, возбудители которых (Mansonella spp.) переносятся в основном мокрецами. Лечению антигельминтными средствами мансонеллезы поддаются не всегда.
При лимфатических филяриатозах препаратами первого ряда служат диэтилкарбамазин и ивермектин. Массовое ежегодное назначение однократно внутрь диэтилкарбамазина или ивермектина в сочетании с альбендазол ом, по-видимому, способно значительно снизить уровень микрофиляриемии у носителей и предупредить распространение инвазии (Ottesen et al., 1999). Ивермектин безопаснее применять в тех районах, где вухерериозу могут сопутствовать лоаоз или онхоцеркоз; диэтилкарбамазин с альбендазолом можно применять повсеместно.
При вухерериозе и бругиозе антигельминтные средства наиболее эффективны, если лечение начато на ранней стадии; до обструкции лимфатических сосудов. Впрочем, некоторого улучшения можно достичь и на более поздней стадии. В запущенных случаях (слоновость в течение длительного времени) для улучшения лимфооттока и удаления излишка тканей необходимо хирургическое вмешательство. При лоаозе лучшим средством для монотерапии в настоящее время считается диэтил кар-бамазин. Но так как разрушение микрофилярий вызывает аллергическую реакцию, лечение рекомендуется начинать с небольших доз. Для подавления аллергических реакций часто назначают глюкокортикоиды. Случается, что лечение лоаоза диэтил карбамазином вызывает серьезные неврологические нарушения — возможно, из-за разрушения микрофилярий в головном мозге. При локализации Loa loa в области глазницы (на нее может указывать, например, сильная головная боль) выбирать начальную дозу нужно особенно тщательно.
При онхоцеркозе лучший препарат для монотерапии — ивермектин. Применять диэтилкарбамазин теперь не рекомендуют. Оба препарата действуют только на микрофилярий Onchocerca volvulus, но ивермектин дает более легкие побочные эффекты и почти не вызывает поражения глаз, в отличие от диэтилкарбамазина, который может вызвать особенно тяжелые осложнения, если глаза поражены еще до начала лечения. Сурамин губителен для взрослых гельминтов, но из-за высокой токсичности назначают его редко, отдавая предпочтение другим препаратам (гл. 41).
Дракункулез
Возбудителем служит Dracunculus medinensis (ришта). Заболеваемость дракункулезом сейчас невысока, большинство случаев приходится на жителей сельских районов Судана и Западной Африки. Заражение происходит при употреблении воды, в которой содержатся веслоногие рачки рода Cyclops — промежуточные хозяева ришты. В ЖКТ личинки покидают рачков и развиваются в половозрелых гельминтов. Самка ришты мигрирует, чтобы спустя примерно год после заражения оказаться под кожей, обычно где-нибудь на ноге.
Препаратов, действующих непосредственно на ришту, не существует. Это тяжелое заболевание традиционно лечат, постепенно удаляя живого гельминта наматыванием его на палочку (ежедневно вытягивают по нескольку сантиметров). Однако в случае обрыва гельминта такой способ грозит тяжелой инфекцией. Метронидазол (250 мг внутрь 3 раза в сутки в течение 10 сут) дает симптоматическое улучшение и, подавляя воспалительную реакцию, облегчает удаление паразита. Эффективный путь снижения заболеваемости дракункулезом — фильтрация питьевой воды и ограничение контактов инфицированных лиц с источниками воды.
Цестодозы
Тениаринхоз
Человек — единственный окончательный хозяин Taenia saginata (бычьего цепня) — возбудителя тениаринхоза и наиболее распространенного ленточного червя. Чаще всего больные замечают, что заражены, обнаружив членики гельминта в кале. Болезнь распространена везде, где употребляют в пищу сырую или полусырую говядину, но наиболее широко — в Западной, Экваториальной и Южной Африке, на Ближнем Востоке и в Средней Азии. Как правило, тениаринхоз протекает бессимптомно, однако необходима дифференциальная диагностика с тениозом. Основной способ профилактики — кулинарная обработка говядины (в течение хотя бы S мин при температуре 60‘С).
Препаратом первого ряда при тениаринхозе считают празиквантел, но нередко применяют и никлозамид из-за его низкой стоимости и доступности. Оба препарата эффективны, удобны для применения и довольно хорошо переносятся. Подтвердить излечение бывает непросто, так как членики и сколекс гельминта часто выводятся в полупереваренном виде. Если диагноз тениаринхоза не подтвержден и есть опасность цистицеркоза (см. ниже), рекомендуется использовать празиквантел.
Тениоз
Возбудительтениоза Тaenia solium (свиной цепень) также распространен повсеместно. В США основной источник этого паразита, как правило, представляют иммигранты. Человек — единственный окончательный хозяин Taenia solium, промежуточными хозяевами обычно служат свиньи. Свиной цепень вызывает две формы заболевания. Кишечную форму (тениоз) вызывают взрослые гельминты, паразитирующие в кишечнике. Она возникает при употреблении полусырой финнозной свинины, поэтому избежать тениоза можно путем тщательной кулинарной обработки мяса. Намного опаснее другая форма заболевания — цистицеркоз, который нередко сочетается с тениозом. Его вызывают личинки Taenia solium, паразитирующие в тканях (Garcia and Del Brutto, 2000). Человек заражается, либо проглатывая вместе с пищей яйца Taenia solium (при загрязнении пищи нечистотами), либо путем аутоинвазии. В последнем случае яйца заносятся в рот грязными руками или зрелый членик, заполненный яйцами, ретроградно попадает в двенадцатиперстную кишку, где его оболочки перевариваются. Так или иначе личинки поступают в кровоток и со временем оседают в тканях (то есть человек играет роль не только окончательного, но и промежуточного хозяина). Тяжесть заболевания зависит от того, какие ткани поражены. Особую опасность представляет часто встречающийся цистицеркоз головного мозга, который может сопровождаться эпилептическими припадками, менингитом и повышением внутричерепного давления (клинические проявления и их тяжесть определяются размером и локализацией цистицерков, а также реакцией организма на них). При тениозе рекомендуют празиквантел, а при цистицеркозе — альбендазол и празиквантел (альбендазол, по-видимому, более эффективен). Антигельминтные средства действуют только на живых цистицерков. Чтобы уменьшить аллергическую реакцию на погибших паразитов, перед началом лечения следует назначить глюкокортикоиды (Evans et al., 1997).
Дифиллоботриоз
Возбудитель — Diphyllobothrium latum (широкий лентец) — обитает в реках и озерах северного полушария. В Северной Америке вторым промежуточным хозяином паразита в основном служит щука. Человек заражается дифиллоботриозом при употреблении в пищу сырой рыбы. В кишечнике человека из личинки развивается взрослый гельминт, длина которого может достигать 25 м. Чаше всего заболевание протекает бессимптомно, но в ряде случаев наряду с желудочно-кишеч-ными нарушениями и потерей веса может возникать мегало-бластная анемия. Она обусловлена дефицитом витамина В12, в больших количествах поглощаемого паразитом. Весьма эффективен празиквантел — он вызывает гибель гельминтов и нормализует показатели крови.
Гименолепидоз
Это самый распространенный цестодоз человека, вызываемый самым маленьким из ленточных червей — карликовым цепнем (Hymenolepis папа). Заболевание встречается повсеместно, но в тропиках чаще, чем в странах с умеренным климатом. В США инвазии наиболее подвержены дети, живущие в интернатах и детских домах на юге страны. Hymenolepis папа — единственная цестода, которая не нуждается в промежуточном хозяине. В организме человека обитают и личинки, и взрослые особи. Из проглоченного яйца выходит онкосфера, которая внедряется в кишечные ворсинки, где из нее образуется цистицеркоид. Впоследствии цистицеркоиды возвращаются в просвет кишки и превращаются там во взрослых гельминтов. Онкосферы могут выйти из яиц еще до того, как те попадут в кал. В этом случае возникает аутоинвазия, и численность гельминтов в кишечнике возрастает. При гименолепидозах эффективен празиквантел (он действует и на взрослых особей, и на цистицеркоидов), но иногда курс лечения приходится повторять. Появление яиц в кале через 4 нед после последней дозы указывает на неэффективность лечения или на повторную инвазию.
Эхинококкоз
Человек — один из промежуточных хозяев Echinococcus spp.: в организме человека развиваются личинки (финны) гельминта. Окончательные хозяева — собаки, выделяющие яйца эхинококков с калом. Заглатывая их вместе с травой, заражается домашний скот. Финна Echinococcus granulosus медленно растет в виде однокамерного пузыря, финна Echinococcus multilocularis — в виде многокамерного. И те, и другие чаще всего локализуются в печени и легких. Основной метод лечения — иссечение пузыря вместе с оболочками. Однако разрыв пузыря и утечка жидкости во время операции чреваты диссеминацией сколексов. По некоторым данным, эффективны длительные курсы альбендазола (в том числе в сочетании с хирургическим лечением), но иногда даже повторные курсы не помогают. Лечение зараженных собак празиквантелом прерывает жизненный цикл гельминта и предотвращает распространение инвазии.
Трематодозы
Шистосомозы
Самые распространенные виды шистосом, вызывающие шистосомозы человека — Schistosoma haematobium (мочеполовой шистосомоз), Schistosoma mansoni (кишечный шистосомоз) и Schistosoma japonicum (японский шистосомоз). К более редким видам относятся Schistosoma intercalatum и Schistosoma mekongi (интеркалатный и меконгский шистосомозы). Шистосомозами в мире страдают около 200 млн человек, а риску заразиться подвержены более 600 млн. Заболевание широко распространено в Южной Америке и в ряде стран Карибского бассейна (Schistosoma mansoni), в Африке и на Аравийском полуострове (Schistosoma mansoni и Schistosoma haematobium), а также в Китае, на Филиппинах и в Индонезии (Schistosoma japonicum); с развитием сельского хозяйства, орошения и водоснабжения оно распространяется все больше. Промежуточным хозяином шистосом служат пресноводные моллюски. Клинические проявления зависят от тяжести инвазии; поражаются в основном печень, селезенка и ЖКТ (Schistosoma mansoni и Schistosoma japonicum), нижние мочевые пути и половые органы (Schistosoma haematobium). В некоторых эндемических районах тяжелые инвазии Schistosoma haematobium, по-видимому, могут вызывать плоскоклеточный рак мочевого пузыря.
При всех шистосомозах человека препаратом первого ряда считается празиквантел, который хорошо переносится и удобен для применения. Дозу принимают внутрь либо однократно, либо за несколько приемов в течение 1 сут. Благодаря этому празиквантел особенно удобно использовать для массовых лечебных мероприятий. Оксамнихин эффективен только при кишечном шистосомозе, причем в Южной Америке большинство штаммов Schistosoma mansoni настолько чувствительны к препарату. что излечение часто наступает после однократного приема. Вместе с тем описана устойчивость шистосом к оксамни-хину — и у лабораторных, и у диких штаммов. Так. в Африке шистосомозы. вызванные местными штаммами Schistosoma mansoni. требуют более высоких доз этого препарата, чем вызванные бразильскими штаммами. При мочеполовом шистосомозе с успехом применяли метрифонат, но при кишечном и японском шистосомозах он неэффективен. Метрифонат — относительно недорогой препарат, и при смешанных инвазиях, вызванных Schistosoma haematobium и Schistosoma japonicum. его можно применять в сочетании с оксамнихином.
Парагонимоз
Возбудителем парагонимоза человека и хищных животных чаше всего выступает Paragonimus westermani (легочный сосальщик): инвазии, вызванные другими представителями рода Paragonimus. встречаются реже. Легочные сосальщики обитают на Дальнем Востоке, в Африке и в Южной Америке. Промежуточными хозяевами для них служат моллюски и ракообразные; человек обычно заражается при употреблении сырых или полусырых крабов и раков. Заболевание вызывают взрослые гельминты, паразитирующие в легких и в других тканях. In vitro активность празиквантела в отношении этих гельминтов невелика, но при клиническом применении он эффективен. Кпонорхоз и описторхоз. Эти заболевания вызываются близко-родственными трематодами, обитающими на Дальнем Востоке (Clonorchis sinensis, или китайский сосальщик, и Opisthorchis viverrini, или беличья двуустка) н в отдельных районах Восточной Европы (Opisthorchis felineus, или кошачья двуустка). Человек заражается при употреблении сырой или полусырой рыбы, содержащей метацеркариев. В организме они превращаются во взрослых гельминтов, которые паразитируют в желчных путях. При тяжелой инвазии возможны закупорка желчных путей и протока поджелудочной железы, которые могут осложниться холециститом и панкреатитом; повышается риск холангиокар-циномы. Весьма эффективен празиквантел при приеме в течение I сут.
Фасциолез
Возбудитель — Fasciola hepatica, или печеночная двуустка, — паразитирует в организме овец, крупного рогатого скота и других жвачных животных. Печеночная двуустка распространена повсеместно. Заражение наступает при проглатывании адолескариев, прикрепленных к водным растениям. Люди заражаются при употреблении в пищу водяного кресса. Адолескарии проникают сквозь стенку кишки в брюшную полость, внедряются в печень и в конце концов оседают в желчных протоках. В острой стадии фасциолеза возникают лихорадка, крапивница, боль в животе, тошнота и понос. Хронический фасциолез протекает так же, как и другие печеночные трематодозы, однако холангиокарцинома для него не характерна. В отличие от других трематодозов, фасциолез, как правило, не поддается лечению празиквантелом. В настоящее время применяют бити-онол (30—50 мг/кг через день, всего 10—15 доз). В США этот препарат можно получить в Центре по контролю заболеваемости США (Centers for Disease Control and Prevention Drug Service, Atlanta, GA). Обнадеживающие результаты получены в ходе ограниченных испытаний триклабендазола — антигельминтно-го средства с узким спектром действия, применяемого в ветеринарии (Arjona et al., 1995).
Кишечные трематодозы
Трематоды, паразитирующие в печени и в кишечнике, — Fasciolopsis buski, Heterophyes heterophyes, Metagonimusyokogawai, Nanophyetussalmincola — служат возбудителями соответственно фасциолопсидоза, гетерофиоза, мета гони моча и нанофиетоза. Fasciolopsis buski — одна из самых крупных трематод, поражающих человека. В Юго-Восточной Азии люди заражаются при употреблении в пищу клубней водяного ореха. Прочие возбудители кишечных трематодозов гораздо меньше Fasciolopsis buski по размеру и распространены во многих географических областях. Ими заражаются при употреблении в пищу полусырой рыбы. Инвазия обычно проявляется лишь легкими нарушениями со стороны ЖКТ, но при тяжелом фасциолопсидозе возможны кишечная непроходимость и перитонит.
Антигельминтные средства
Производные бензимидазола
Историческая справка
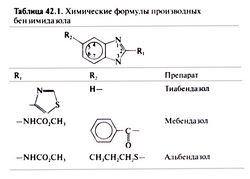
Открытие высокой активности тиабендазола в отношении возбудителей кишечных нематодозов в 1961 г. (Brown etal., 1961) положило начало применению производных бензимидазола для лечения гельминтозов человека и животных. Исследовав сотни соединений, установили, что наибольшей активностью обладали те из них, у которых заместители располагались в положениях 2 и 5 бензимидазольного кольца (Townsend and Wise, 1990). Для лечения гельминтозов человека широко применяются три препарата — тиабендазол, мебендазол и альбендазол. Их химические формулы приведены в табл. 42.1. Тиабендазол (содержит заместитель — тиазольное кольцо — в положении 2) действует на целый ряд нематод, паразитирующих в кишечнике. Но из-за побочных эффектов от этого препарата вскоре пришлось отказаться. На смену ему пришел мебендазол — первый из бензимидазолкарбаматов — также активный в отношении возбудителей кишечных нематодозов (Brugmans et al., 1971). Не так давно широкое применение нашел еще один бензимидазолкарбамат — альбендазол. Он действует на кишечных и тканевых нематод, а также на личинок некоторых цестод (de Silva et al., 1997; Venkatesan, 1998). Альбендазол считается лучшим средством лечения цистицеркоза (Sotelo and Jung, 1998; Garcia and Del Brutto, 2000) и эхинококком (Horton, 1997). Однако при фасциолезе он неэффективен. Ежегодный однократный прием внутрь альбендазола в сочетании с диэтилкарбамазином или ивермектином — перспективный метод массового лечения лимфатических филяриатозов, в том числе смешанных (Ouesen et al., 1999). Такое лечение позволяет снизить заболеваемость и другими кишечными нематодозами среди детей школьного возраста (Albonico et al., 1999).
Антигельмннтное действие
Производные бензимидазола (в частности, мебендазол и альбендазол) — антигельминтные средства широкого спектра действия. Особенно они эффективны при кишечных нематодозах, когда важна высокая концентрация препарата в кишечнике. При правильном подборе дозы оба препарата высокоэффективны при аскаридозе, капилляриозе, энтеробиозе, трихоцефалезе и анкилостомидозах (в том числе при смешанных инвазиях). Препараты действуют как на личинок, так и на половозрелых нематод; уничтожают яйца аскарид и власоглава. Паразиты теряют подвижность и погибают, но действие препаратов развивается довольно медленно, и полное изгнание гельминтов из ЖКТ занимает несколько дней. При анкилостомидозах у детей альбендазол эффективнее мебенда-зола (de Silva et al., 1997; Bennett and Guyatt, 2000). Он также более эффективен при стронгилоидозе (Liu and Weller, 1993), эхинококкозе, вызванном Echinococcus granulosus (Horton, 1997; Davis et al., 1989), и цистицеркозе головного мозга (Evans et al., 1997; Garcia and Del Brutto, 2000). Предполагают, что производные бензимидазола активны в отношении взрослых форм Тпс-hinella spiralis, но на личинок, находящихся в тканях, они, по-ви-димому, не действуют. Альбендазол высокоэффективен при кожной форме синдрома larva migrans, вызываемого анкилостомами собак и кошек; иногда назначают также препараты тиа-бендазола для местного применения. Как уже говорилось, ежегодный однократный прием внутрь альбендазола в сочетании с диэтилкарбамазином или ивермектином — перспективный метод массового лечения лимфатических филяриатозов, в том числе смешанных (Ottesen et al., 1999). Альбендазол можно использовать при кишечных микроспоридиозах у больных СПИДом: заболевания, вызванные Encephalitozoon intestinalis и родственными видами, излечиваются полностью; если же возбудителем служит Enterocytozoon bieneusi, наступает лишь частичное улучшение. In vitro в отношении Encephalitozoon intestinalis особенноактивен альбендазопсульфоксид — один из метаболитов препарата (Katiyarand Edlind, 1997). Альбендазол обладает некоторой активностью в отношении анаэробных простейших, в том числе Тrichomonas vaginalis и Giardia lambiia (Ottesen et al., 1999). Оказывает он и противогрибковое действие, но при грибковых поражениях у человека его используют редко.
Механизм действия
Действие производных бензимидазола на нематод опосредовано различными механизмами. Эти препараты подавляют активность митохондриальной фумаратредуктазы, замедляют транспорт глюкозы и вызывают разобщение окислительного фосфорилирования (Lacey, 1988). Однако немало данных указывают на то, что в основе механизма действия лежит подавление сборки микротрубочек путем связывания с Р-тубулином (Lacey, 1988; Lacey, 1990; Prichard, 1994). С Р-тубулином нематод производные бензимидазола взаимодействуют намного в более низких концентрациях, чем с р-тубулином млекопитающих, — именно этим и определяется избирательность действия этих препаратов. Механизм их действия удалось прояснить благодаря изучению нематод, устойчивых к производным бензимидазола, — свободноживущих Caenorhabditis ele-gans (Driscoll et al., 1989) и паразитирующих у овец Haemonchus contort us (Lacey, 1990; Prichard, 1994). Оказалось, что β-тубулин устойчивых Haemonchus contortus (как лабораторных, так и диких) обладает меньшим сродством к производным бензимидазола (Lubega and Prichard, 1991). Показано также, что степень устойчивости коррелирует с экспрессией генов разных изотипов р-тубулина(Kwaetal., 1993; Kwaetal., 1995; Roos, 1997).Таким образом, устойчивость нематод к производным бензимидазола возникает за счет постепенного вытеснения «чувствительного» р-тубулина «устойчивым*, причем установлено, что этот процесс опосредован точечной мутацией, в результате которой Фен200 р-тубулина замещается тирозином (Roos, 1997; Sangster and Gill, 1999). Поскольку у человека в положении 200 гена Р-тубулина также находится тирозин, новые производные бензимидазола, токсичные для «устойчивого* р-тубулина паразитов, вероятно, окажутся токсичными и для человека. Впрочем, у ряда паразитов (например, у Giardia lambiia) устойчивость к производным бензимидазола опосредована другими механизмами (Upcroft et al., 1996).
Фармакокинетика
Производные бензимидазола малорастворимы в воде, поэтому даже незначительные различия в растворимости отдельных препаратов сильно сказываются на их всасывании. Тиабендазол быстро всасывается при приеме внутрь, а его сывороточная концентрация достигает максимальной примерно через 1 ч. За сутки ббльшая часть препарата выводится с мочой в виде 5-гидрокситиабендазола (конъюгата с глюкуроновой или серной кислотой). Напротив, мебендазол при приеме внутрь всасывается плохо и неравномерно, сывороточная концентрация препарата фактически не зависит от дозы (Witasseketal., 1981). Низкая биодоступность мебендазола (22%) обусловлена как его плохим всасыванием, так и быстрым разрушением при первом прохождении через печень. В плазме мебендазол на 95% связан с белками. Он быстро метаболизируется, причем два его основных метаболита — метил-5-(а-гидроксибензил)-2-бензими-дазолкарбамат и 2-амино-5-бензоилбензимидазол — элиминируются медленнее самого мебендазола (Braithwaite etal., 1982). Метаболиты, по-видимому, лишены антиге-льминтного действия (Gottschall et al., 1990). В желчи обнаружены конъюгаты и мебендазола, и метаболитов; в мочу мебендазол в неизмененном виде поступает лишь в незначительном количестве.
Всасывание альбендазола при приеме внутрь также неравномерно. При приеме с жирной пищей и, возможно, в присутствии желчных кислот оно улучшается. При приеме в дозе 400 мг альбендазол в сыворотке не обнаруживают — настолько быстро он превращается (в печени и, возможно, в кишечнике) в альбендазолсульфоксид, который и обладает высокой активностью в отношении гельминтов (Marrineret al., 1986; Moroni et al., 1995; Redondo et al., 1999). Альбендазолсульфоксид существует в виде пары оптических изомеров, но у человека левовращающий изомер выводится гораздо быстрее, поэтому сывороточная концентрация правовращающего изомера значительно выше (Delatour et al., 1991; Marques et al.,1999). Максимальная сывороточная концентрация аль-бендазолсульфоксида составляет около 300 нг/мл, но у разных больных она может сильно различаться. Альбендазолсульфоксид на 70% связан с белками, а его Т1/2 может колебаться от 4 до 154(DelatouretaL, 1991; Jung etal., 1992; Marques et al., 1999). Он хорошо проникает в ткани, в том числе в гидатидные цисты, где его концентрация примерно в 5 раз ниже сывороточной (Marriner et al., 1986; Morris et al., 1987). Очевидно, именно поэтому аль-бендазол эффективнее мебендазола при эхинококкозе. Альбендазолсульфоксид образуется в печени (и, возможно, в кишечнике) при участии микросомальной флавин-содержащей монооксигеназы и изоферментов цитохрома Р450 (Redondo et al., 1999). Видимо, флавинсодержа-щая монооксигеназа отвечает за образование правовращающего изомера, а цитохром Р450 — левовращающего (Delatour et al., 1991). Впоследствии оба изомера альбен-дазолсульфоксида окисляются до сульфонового производного, не обладающего ни оптической, ни биологической активностью. Полагают, что именно этой реакцией определяется скорость элиминации изомеров — во всяком случае, левовращающий изомер, который, как уже упоминалось, элиминируется быстрее, быстрее же и окисляется (Delatour et al., 1991). Значительные индивидуальные различия Т1/2 альбендазолсульфоксида могут объясняться индукцией ферментов, принимающих участие в превращении правовращающего изомера в сульфоновое производное. На лабораторных животных показано, что производным бензимидазола действительно свойственна аутоиндукция метаболизма (Gleizeset al., 1991). Метаболиты альбендазола выводятся главным образом с мочой.
Применение
Появление тиабендазола стало несомненным прорывом в лечении кожной формы синдрома larva migrans и стронгилоидоза. Состояние большинства больных кожной формой синдрома larva migrans значительно улучшается при лечении тиабендазолом для местного применения: 15% крем наносят на пораженные участки 2—Зраза в сутки в течение 5 сут. Доля излеченных весьма высока (Davies et al., 1993). При стронгилоидозе тиабендазол назначают внутрь в дозе 25 мг/кг 2 раза в сутки после еды в течение 2 сут; максимальная доза не должна превышать 3 г/сут. При диссеминированном стронгилоидозе такое лечение продолжают в течение 5—7 сут или до полного изгнания паразитов. При кишечном стронгилоидозе вместо тиабендазола теперь чаще назначают однократный прием ивермектина (см. ниже, «Ивермектин*), но тиабендазол пока остается единственным эффективным средством лечения диссеминированной формы (Gann etal., 1994; Liu and Weller, 1998). В дозе 25 мг/кг 2 раза в сутки в течение 7 сут тиабендазол может дать эффект на ранней стадии трихинеллеза, но после миграции личинок в мышцы он неэффективен. Тиабендазол эффективен и при кишечных нематодозах, но из-за токсичности в этих случаях его больше не назначают.
При кишечных нематодозах, особенно при смешанных инвазиях, высокоэффективен мебендазол. Принимают его только внутрь, детям старше 2 лет дают ту же дозу, что и взрослым. При энтеробиозе назначают 100 мг (1 таблетку) однократно; прием повторяют через 2 нед. При аскаридозе, трихоцефалезе и анкилостомидозах рекомендуют принимать по 100 мг мебендазола утром и вечером в течение 3 сут. При неполном изгнании гельминтов через 3 нед курс повторяют. При смешанных инвазиях такой трехдневный курс мебендазола эффективнее однократного приема 500 мг мебендазола или 400 мг альбендазола. При трихоцефалезе однократный прием 500 мг мебендазола может быть несколько эффективнее, чем однократный прием 400 мг альбендазола, а при анкилостомидозах — наоборот (de Silva et al., 1997; Bennett and Guyatt, 2000).
Capillaria philippinensis более устойчивы к мебендазолу. При капилляриозе препарат назначают по 200 мг 2 раза в сутки в течение по крайней мере 20 сут (Cross, 1992). Мебендазол применяли и для лечения эхинококкоза, но теперь более эффективным средством считают альбендазол. В любом случае лечение эхинококкоза начинают с хирургического вмешательства (Horton, 1997).
Как и мебендазол, альбендазол высокоэффективен при кишечных нематодозах, в том числе при смешанных инвазиях. При энтеробиозе, аскаридозе, трихоцефалезе и анкилостом идозах взрослым и детям старше 2 лет назначают 400 мг альбендазола внутрь однократно. При легком и умеренном аскаридозе излечение наступает более чем в 97% случаев; при тяжелом аскаридозе прием препарата продолжают еще 2—3 сут. Однократный прием 400 мг альбендазола эффективнее однократного приема 500 мг мебендазола излечивает анкилостомидозы и уменьшает число яиц анкилостом в кале (Sacko et al., 1999; Bennett and Guyatt, 2000). При стронгилоидозе эффективность альбендазола (400 мг/сут в течение 3 сут) непостоянна; в этом случае более эффективны тиабендазол и ивермектин.
Альбендазол — лучший препарат для лечения эхинококкозов, хотя сам по себе он малоэффективен. Эффективность лечения значительно повышается при назначении альбендазола до и после хирургического иссечения или дренирования кисты с введением в ее полость средств, убивающих сколексы (Horton, 1997; Schantz, 1999). Взрослым обычно назначают 400 мг 2 раза в сутки в течение 28 сут; при необходимости курс повторяют. Показано, что в дозе 10—12 мг/кг/сут альбендазол можно принимать в течение 3—6 мес, не опасаясь тяжелых побочных эффектов (Franchi et al., 1999). Хотя альбендазол остается наиболее эффективным средством лечения эхинококко-зов, при многокамерном эхинококкозе он малоэффективен (Venkatesan, 1998). Альбендазол служит также препаратом выбора при цистицеркозе головного мозга (Evans et al., 1997; Sotelo and Jung, 1998; Garcia and Del Brutto,2000). Взрослым назначают по 400 мг 2 раза в сутки в течение 3—28 сут (длительность лечения зависит от количества, типа и локализации цистицерков). Перед альбендазолом, как правило, назначают глюкокортикоиды, которые уменьшают местную воспалительную реакцию на погибающих цистицерков. Глюкокортикоиды повышают также сывороточную концентрацию альбендазолсу-льфоксида. При приеме 400 мг/сут альбендазол оказался эффективен при кишечном микроспоридиозе у больных СПИДом, причем Encephalitozoon intestinalis, по-видимому, более чувствительны к препарату, чем Enterocyto-zoon bieneusi (Venkatesan, 1998).
В последнее время альбендазол в сочетании с диэтил-карбамазином или ивермектином стали успешно применять для массового лечения лимфатических филяриато-зов (Ottesen et al., 1999). При монотерапии действие альбендазола на микрофилярий развивается медленно, на взрослых гельминтов он не действует, обладая лишь слабой активностью в отношении Wuchereria bancrofti. В то же время однократного приема альбендазола (400—600 мг) в сочетании с диэтилкарбамазином (6 мг/кг) или ивермектином (200—400 мкг/кг) достаточно для заметного снижения микрофиляриемии у больных вухерериозом, причем эффект длится более года. Ежегодный прием этих препаратов в течение 4—6 лет должен снизить мик-рофиляриемию настолько, что передача паразита станет невозможной. Продолжительность лечения определяется временем, в течение которого взрослые особи сохраняют плодовитость. Альбендазол с диэтилкарбамазином применяют для лечения вухерериоза и бругиоза повсюду, за исключением тех районов, где лимфатическим филя-риатозам может сопутствовать онхоцеркоз или лоаоз. В таких случаях во избежание тяжелой аллергической реакции на гибнущих паразитов альбендазол назначают в сочетании с ивермектином.
Побочные эффекты, меры предосторожности и противопоказания
Применение тиабендазола ограничено из-за выраженных побочных эффектов. При приеме в терапевтических дозах наиболее часты снижение аппетита, тошнота, рвота и дурнота. Реже отмечаются понос, чувство усталости, сонливость, головокружение и головная боль. Описаны также лихорадка, сыпь, полиморфная экссудативная эритема, галлюцинации, нарушения чувствительности и синдром Стивенса—Джонсона. К редким осложнениям относятся отек Квинке, шок, шум в ушах, эпилептические припадки и внутрипеченочный холестаз. Метаболит тиабендазола может придавать моче запах как после употребления спаржи. Изредка возникает кристаллурия без гематурии, при отмене препарата она быстро исчезает. У некоторых больных наблюдается преходящая лейкопения. Абсолютных противопоказаний к приему тиабендазола нет. Так как нередки побочные эффекты со стороны ЦНС, на время лечения следует воздержаться от деятельности, требующей повышенного внимания и быстрой реакции (например, вождения автомобиля). Тиабендазол может оказывать гепатотокси-ческое действие, поэтому при поражении печени или снижении ее функции препарат следует применять с осторожностью. Действие тиабендазола при беременности изучено не полностью, и беременным его назначают лишь в особо тяжелых случаях.
В отличие от тиабендазола, мебендазол обычно не дает выраженных побочных эффектов — даже на фоне анемии и истощения. По-видимому, это связано с его низкой биодоступностью. При тяжелой инвазии массивное изгнание гельминтов может сопровождаться преходящей болью в животе, вздутием живота и поносом. При приеме больших доз мебендазола изредка наблюдаются аллергические реакции, алопеция, обратимая нейтропе-ния, агранулоцитоз, олигоспермия, обратимое повышение активности аминотрансфераз. У лабораторных животных мебендазол оказывал эмбриотоксическое и тератогенное действие: эффект наблюдали при однократном скармливании беременным крысам 10 мг/кг препарата. Таким образом, хотя тератогенное действие мебендазола у человека не доказано, его не рекомендуется назначать беременным и детям до 2 лет. Мебендазол противопоказан при аллергических реакциях на него в анамнезе.
При лечении кишечных нематодозов короткими курсами альбендазола — даже при тяжелой инвазии — препарат дает мало побочных эффектов. Иногда возникают преходящая боль в животе, понос, тошнота, дурнота и головная боль. При эхинококкозах и цистицеркозе головного мозга, требующих длительного приема альбендазола, большинство больных также переносят его хорошо. Из побочных эффектов чаще всего отмечается повышение активности аминотрансфераз; из-за внутрипече-ночного холестаза может возникать желтуха. После отмены препарата функция печени нормализуется. При длительном применении следует периодически определять активность печеночных ферментов; при циррозе печени альбендазол применять не рекомендуется (Davis et al., 1989). При цистицеркозе головного мозга лечение альбендазолом (особенно без предварительного назначения глюкокортикоидов) чревато неврологическими осложнениями, характер которых зависит от локализации цистицерков. При длительном лечении описаны также боль в животе, сильная головная боль, лихорадка, повышенная утомляемость, алопеция, лейкопения и тромбоци-топения. У лабораторных животных альбендазол оказывает тератогенное и эмбриотоксическое действие, поэтому при беременности его назначать не рекомендуется. Безопасность альбендазола у детей младше 2 лет не доказана.
Производные бензимидазола дают на удивление мало клинически значимых взаимодействий с другими препаратами. Альбендазол — наиболее универсальный препарат этой группы — вероятно, способен к аутоиндукции, а сывороточные концентрации обоих изомеров альбенда-золсульфоксида повышаются при приеме альбендазола вместе с глюкокортикоидами и, возможно, с празиквантелом. Рекомендуется соблюдать осторожность при приеме высоких доз альбендазола одновременно с ингибиторами микросомальных ферментов печени.
Диэтилкарбамазин
Историческая справка
Более 1500 случаев филяриатозов среди американских военнослужащих в годы Второй мировой войны побудили к поиску новых, более эффективных средств лечения этих заболеваний. Наиболее перспективными из изученных соединений оказались производные пиперазина и самый важный их представитель — диэтилкарбамазин (Hawking, 1979; Mackenzie and Kron, 1985). Он служит препаратом первого ряда для профилактики и лечения лимфатических филяриатозов и тропической легочной эозинофилии, вызываемой микрофиляриями Wuchereria bancrofti и Brugia malayi (Ottesen and Ramachand-ran, 1995). Этот препарат эффективен также при онхоцеркозе и лоаозе, но его применение при этих инвазиях чревато тяжелой аллергической реакцией на гибнущих микрофилярий. Поэтому для лечения онхоцеркоза сейчас используют ивермектин. При лоаозе же диэтилкарбамазин, несмотря на токсичность, остается лучшим средством. Во многих районах (за исключением эндемических очагов онхоцеркоза и лоаоза) ежегодный однократный прием внутрь диэтилкарбамазина и альбендазола позволяет существенно снизить заболеваемость лимфатическими филяриатозами (Ottesen et al., 1999).
Строение
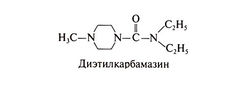
Диэтилкарбамазин выпускают в виде водорастворимой соли лимонной кислоты, содержащей в пересчете на основание 51% активного вещества. Поскольку диэтилкарбамазин не имеет вкуса и запаха и устойчив к действию высоких температур, в некоторых странах его добавляют в поваренную соль (до 0,2—0,4% по весу). Если в других странах препарат свободно продается, то в США его можно получить только в Центре по контролю заболеваемости (тел. 404-639-3670). Структурная формула диэтилкарбамазина следующая:
Антигельминтное действие
Действию диэтилкарбамазина наиболее подвержены микрофилярии Wuchereria bancrofti, Brugia malayi и Loa loa; на фоне лечения их количество в крови быстро снижается. Микрофилярии Onchocerca volvulus под действием диэтилкарбамазина исчезают из кожи, но остаются в подкожных узлах, где находятся и взрослые самки гельминтов. Диэтилкарбамазин проникает в жидкость, которая скапливается между оболочками яичка при гидроцеле, но на микрофилярий в ней он не действует. Механизм действия диэтилкарбамазина на микрофилярий полностью не ясен (Martin et al., 1997; de Silva et al., 1997). In vitro он оказывает на гельминтов слабое действие, но in vivo действует быстро. Предполагают, что диэтилкарбамазин нарушает метаболизм арахидоновой кислоты как у микрофилярий, так и в эндотелиальных клетках хозяина. В результате сосуды сужаются, а вокруг микрофилярий с поврежденными покровами скапливаются тромбоциты и гранулоциты. Паразиты при этом теряют подвижность. По-видимому, диэтилкарбамазин активирует лишь неспецифические факторы защиты (Ма-izels and Denham, 1992; Maizelset al., 1993), по другим данным, препарат может оказывать влияние и на специфический иммунитет, но механизм этого влияния пока не известен (Mackenzie and Kron, 1985; Martin etal., 1997). Диэтилкарбамазин вызывает гибель взрослых особей Loa loa и, возможно, взрослых особей Wuchereria bancrofti и Brugia malayi, но на взрослых особей Onchocerca volvulus он почти не действует. Механизм действия препарата на взрослых гельминтов не известен (Hawking, 1979). По некоторым данным, диэтилкарбамазин нарушает посттрансляционную модификацию ряда белков и их транспорт к клеточной мембране (Spiro et al., 1986).
Фармакокинетика
Диэтилкарбамазин быстро всасывается в ЖКТ. Его сывороточная концентрация достигает максимальной через 1—2 ч после однократного приема внутрь, а Т1/2 составляет 2—10 ч (в зависимости от pH мочи). В организме значительная часть препарата быстро метаболизируется (Faulkner and Smith, 1972). Основной метаболит — диэтилкарбамазин-1^-оксид — обладает биологической активностью. Препарат выводится как с мочой, так и с калом. В кислой моче обнаруживают до 50% неизмененного диэтилкарбамазина, в щелочной — меньше (Edwards et al., 1981). Ощелачивание мочи может привести к повышению сывороточной концентрации и Т|/2 диэтилкарбамазина, усилить его действие и токсичность (Awadzi et al., 1986). Поэтому при нарушении функции почек или постоянно высоком pH мочи может потребоваться коррекция дозы.
Применение
Дозы диэтилкарбамазина для лечения и профилактики лимфатических филяриатозов подбирались эмпирически, и в разных районах они могут различаться. Выбор схемы определяется целью, с которой назначают диэтилкарбамазин — снижение уровня микро-филяриемии среди населения, лечение или профилактика филяриатозов.
Вухерериоз и бругиоз. Для снижения микрофиляриемии среди населения до уровня, при котором передача паразита невозможна, препарат добавляют в поваренную соль (0,2—0,4% из расчета на основание). Благодаря этому во многих эндемических районах удалось уменьшить распространенность и облегчить течение лимфатических филяриатозов (Gelband, 1994). Более того, оказалось, что прием 6 мг/кг диэтилкарбамазина внутрь 1—2 раза в год столь же эффективен, что и применявшаяся ранее схема с длительными курсами ежедневного приема препарата. Важным открытием стало то, что уровень микрофиляриемии заметно снижается при ежегодном однократном приеме диэтилкарбамазина внутрь в сочетании с другим антигельминтным препаратом (Ottesen et al., 1999). Вначале испытывали диэтилкарбамазин с ивермектином, но впоследствии оказалось, что еще лучшие результаты дает комбинация с 400 мг альбендазола (см. выше, «Производные бензимидазола»). Реакция на гибнущих микрофилярий при приеме диэтилкарбамазина в таблетках, как правило, выражена сильнее, чем при добавлении его в соль, но в обоих случаях переносится препарат неплохо. Тем не менее массовое лечение диэтилкарбамазином нельзя применять там, где наряду с лимфатическими филяриатозами встречаются онхоцеркоз и лоаоз. При этих двух инвазиях даже в небольших дозах, которые добавля -ют в поваренную саль, препарат может вызвать весьма тяжелые побочные эффекты, выраженность которых зависит от тяжести инвазии.
Проявления тропической легочной эозинофилии — воспалительной и аллергической реакции на осевших в легких микрофилярий Wuchereria bancrofti или Brugia malayi — быстро проходят при приеме диэтилкарбамазина в дозе 2 мг/кг 3 раза в сутки в течение 14 сут. Лицам с бессимптомной микрофиляриемией назначают стандартный курс диэтилкарбамазина: 2—3 мг/кг 3 раза в сутки в течение 14—21 сут. При бругиозе лечение длится 21 сут. Начинают с пробной дозы 50 мг. Такая схема уменьшает риск дальнейшего поражения лимфатических сосудов и почек. Однако при тяжелых осложнениях фипяриато-зов, в том числе при лимфангиите и слоновости, диэтилкарбамазин неэффективен. При лимфангиите назначают антибиотики, а при слоновости важно соблюдать гигиену. Для профилактики лимфатических филяриатозов эффективен прием диэтилкарбамазина в дозе 50 мг 1 раз в месяц.
Онхоцеркоз и лоаоз. Лечение онхоцеркоза больше не рекомендуют начинать с диэтилкарбамазина, так как он вызывает тяжелые реакции, связанные с гибелью и разрушением микрофилярий (см. ниже). При приеме ивермектина эти реакции протекают намного легче, и сейчас при онхоцеркозе предпочтение отдают именно этому препарату. Несмотря на недостатки, диэтилкарбамазин остается лучшим средством лечения лоаоза. Лечение начинают с пробной дозы 1 мг/кг/сут в течение 2—3 суг, после чего в течение 2—3 нед дозу постепенно увеличивают до максимальной, 8—10 мг/кг/сут. В первые 2—3 сут наряду с пробной дозой диэтилкарбамазина часто назначают глюкокортикоиды или Н,-блокаторы — это помогает ослабить реакцию на гибель паразитов. При инвазии паразитами ЦНС помимо аллергической реакции могут развиться менингоэнцефалит и кома. Для излечения лоаоза могут потребоваться повторные курсы диэтилкарбамазина с интервалом в 3—4 нед. Для профилактики заражения эффективен прием 300 мг/нед диэтилкарбамазина внутрь. Ивермектин при лоаозе не годится; больным же, которые не переносят диэтилкарбамазин, и тем, у кого лечение им оказалось безрезультатным, назначают апьбендазол (Klion et al.. 1999).
Диэтилкарбамазин эффективен при стрептоцеркозе (возбудитель Mansonella streptocerca, ранее — Dipetalone-ma streptocerca). Он действует и на микрофилярий, и на взрослых гельминтов. Однако при филяриатозах, вызванных Mansonella perstans, Mansonella ozzardi и Dirofi-laria immitis, диэтилкарбамазин почти неэффективен. В дозе 2 мг/кг 3 раза в сутки в течение 7—10 сут диэтилкарбамазин рекомендован для лечения токсокароза, хотя при этом заболевании препарат все еще считают экспериментальным.
Побочные эффекты
Если доза диэтилкарбамазина не превышает 8—10 мг/кг/сут, побочные эффекты редко бывают тяжелыми и обычно проходят через несколько дней лечения. К ним относятся снижение аппетита, головная боль, тошнота, а при приеме в больших дозах — рвота. Самые серьезные осложнения, особенно при тяжелой инвазии Onchocerca volvulus, прямо или косвенно обусловлены реакцией на гибнущих паразитов, в основном микрофилярий. При бругиозе и лоаозе они протекают легче и совсем легко — при вухерериозе. Однако при тяжелой инвазии Loa loa препарат может вызвать кровоизлияния в сетчатку и тяжелый энцефалит. При онхоцеркозе через несколько часов после приема внутрь первой дозы диэтилкарбамазина нередко развивается реакция Маззотги. У больных возникает сильный зуд, увеличиваются и становятся болезненными лимфоузлы, иногда появляются мелкая папулезная сыпь, лихорадка, тахикардия, артралгия и головная боль. Симптомы держатся в течение 3—7 сут, затем исчезают, а переносимость диэтилкарбамазина, даже в больших дозах, улучшается. Возможны также поражения глаз, в том числе лимбит, точечный кератит, увеиты, атрофия пигментного эпителия сетчатки (Rivas-Alcala et al., 1981; Dominguez-Vazquez et al., 1983). При вухерериозе и бругиозе вдоль лимфатических сосудов могут образовываться подкожные узлы; нередко развивается лимфаденит. Но и эти симптомы обычно проходят через несколько дней. Почти всегда на фоне приема диэтилкарбамазина возникает лейкоцитоз. Появляясь на 2-е сутки, он достигает максимума на 4-е или 5-е сутки, а затем постепенно проходит в течение нескольких недель. Иногда отмечается преходящая протеинурия. Кроме того, на фоне приема препарата может усугубляться эозинофилия, которая часто сопутствует филяриатозам. Более поздние реакции вызваны гибелью взрослых гельминтов. При бругиозе и вухерериозе это лимфангиит, увеличение лимфоузлов и абсцессы над лимфатическими сосудами; при лоаозе — мелкие волдыри. Диэтилкарбамазин можно принимать во время беременности.
Меры предосторожности
Массовое лечение диэтилкарбамазином не следует проводить в эндемических очагах онхоцеркоза и лоаоза. Вместе с тем лицам, выезжающим в такие районы, препарат можно назначать с профилактической целью. Для ослабления реакции на гибель микрофилярий перед приемом диэтилкарбамазина часто назначают глюкокортикоиды или Н,-блокаторы. При нарушении функции почек или постоянно высоком pH мочи может потребоваться коррекция дозы.
Ивермектин
Историческая справка
В середине 1970-х гт. в ходе исследования ряда природных веществ было обнаружено, что бульон, полученный при ферментации почвенных актиномицетов Strep-tomyces avermitilis, дает лечебный эффект при инвазии Nema-tospiroides dubius у мышей (Burg et al., 1979; Egerton et al., 1979; Miller etal., 1979). Вскоре из культур Streptomyces avermitilis выделили активные компоненты, обладающие антигельминтным действием. Среди них оказались и 16-членные лактоны авермектины, в том числе абамектин, впоследствии применявшийся в сельском хозяйстве в качестве инсектицида (Campbell, 1989). Ивермектин — полусинтетическое производное абамек-тина — широко применяется в ветеринарии для лечения и профилактики паразитарных инвазий, вызванных круглыми червями, клещами и насекомыми (Campbell and Benz, 1984; Campbell, 1993). В 19% г. ФДА одобрило ивермектин для лечения онхоцеркоза и кишечного стронгилоидоза у человека. Однократный прием ивермектина внутрь 1 —2 раза в год составляет основу многих программ по борьбе с онхоцеркозом. Как уже упоминалось, ежегодный однократный прием ивермектина (особенно в сочетании с альбенлазолом) внутрь заметно снижает микрофиляриемию при вухерериозе и бругиозе (Ottesen et al., 1999; Plaisieret al., 2000; см. также выше, «Производные бензимидазола»). Прием ивермектина в сочетании с альбендазолом входит сейчас в программы по борьбе с лимфатическими филяриатозами. Такая схема предпочтительна там, где лимфатическим филяриатозам сопутствуют онхоцеркоз или лоаоз. Ивермектин — препарат первого ряда при стронгилоидозе и других кишечных нематодозах человека (Naquira et al., 1989; Gann et al., 1994; de Silva et al., 1997). Кроме того, он успешно применяется при чесотке и педикулезе.
Как и авермектины, мильбимицины относятся к макроциклическим лактонам. И те, и другие, по-видимому, обладают единым механизмом действия и сходным спектром антипаразитарной активности (Fisher and Mrozik, 1992; Arena etal., 1995).
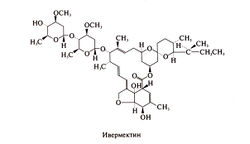
Структурная формула ивермектина следующая:
Механизм действия и устойчивость
Механизму действия авермектинов и мильбимицинов и устойчивости паразитов к ним посвящено несколько обзоров (Cully et al., 1996; Sangster, 19%; Martin et al., 1997; Sangster and Gill, 1999). Ивермектин высокоактивен в отношении некоторых стадий развития нематод и эктопаразитов, вызывающих заболевания животных и человека. Препарат обездвиживает паразитов, вызывая у них паралич мышц. Опыты на свободноживущих нематодах Caenorhabditis elegans показали, что авермектины действуют на глутаматзави-симые хлорные каналы, обнаруженные только у беспозвоночных. Две субъединицы этих каналов были клонированы и экспрессированы в ооцитах шпорцевой лягушки. В ходе эксперимента установлена четкая связь между сродством авермектинов и мильбимицина D к рецепторам хлорных каналов, активацией каналов и губительным действием препаратов на нематод (Arena et al., 1995; Cully et al., 1996). Более того, глутаматзависимые хлорные каналы обнаруживаются в мышечных клетках глотки гельминтов, что хорошо согласуется с замедлением питания паразитов в присутствии авермектинов и мильбимицинов (Sangster and Gill, 1999). Механизмы устойчивости нематод — особенно паразитирующих у домашнего скота — к аверме ктинам довольно сложны. Описаны гельминты, устойчивые к авермектинам. однако еще предстоит выяснить, чем они отличаются от природных гельминтов по подтипам рецепторов авермектинов, их локализации, количеству и сродству к препаратам (Sangster and Gill, 1999; Hejmadi et al., 2000). У устойчивых Haemonchus contortus обнаружены мутации генов, кодирующих аналоги Р-гликопротеида (переносчики авермектинов), а также генов, кодирующих предполагаемые компоненты глутаматзависимых хлорных каналов (Xu etal., 1998; Blackball et al., 1998). Показано, что у нематод, устойчивых к ивермекгину, значительно выше количество рецепторов с низким сродством к глутамату, но как это связано с устойчивостью, пока не ясно (Hejmadi et al., 2000). У насекомых и ракообразных глутаматзависимые хлорные каналы, по-видимому, также служат одной из мишеней ивермектина (Duce and Scott, 1985; Scott and Duce, 1985; Zufall et al., 1989). У аскарид и насекомых авермектины с высоким сродством связываются с хлорными каналами, зависимыми от ГАМ К и других лигандов, но результаты и роль этого взаимодействия изучены мало. У цестод и трематод нет высокоаффинных рецепторов авермектинов — очевидно, этим объясняется нечувствительность гельминтов к ивермектину (Shoop et al., 1995). Сродство авермектинов к рецепторам ГАМК в головном мозге млекопитающих и других позвоночных примерно в 100 раз ниже, чем к рецепторам ГАМ К беспозвоночных (Schaeffer and Haines, 1989).
При онхоцеркозе вскоре после приема ивермектина заметно снижается количество микрофилярий в коже и в тканях глаза; эффект длится 6—12 мес (Greene et al., 1987; Newland et al., 1988). На взрослых особей ивермектин почти не действует, однако он активен в отношении развивающихся личинок и подавляет выход микрофилярий из матки половозрелой самки (Awadzi et al., 1985; Court et al., 1985). Снижая количество микрофилярий в коже, ивермектин тем самым затрудняет передачу паразита переносчикам онхоцеркоза — мошкам рода Simulium (Cupp etal., 1986,1989). Ивермектин активен также в отношении микрофилярий (но не взрослых особей) Wuchereria bancrofti, Brugia malayi, Loa loa и Mansonella ozzardi (de Silva et al., 1997). Препарат весьма эффективен и при аскаридозе, стронгилоидозе и кожной форме синдрома larva migrans. Другие кишечные нематоды либо поддаются действию ивермектина лишь частично (Trichuris trichuria и Enterobius vermicularis), либо не поддаются вовсе (Necator americanus и Ancylostoma duodenale) (Naquira et al., 1989; de Silva et al., 1997).
Фармакокинетика
При приеме ивермектина внутрь его сывороточная концентрация достигает максимальной через4—5 ч. Длительный конечный Т1/2 (57 ч у взрослых) обусловлен главным образом низким клиренсом (около 1—2л/ч) и высоким объемом распределения (Приложе-j ние II). Ивермектин примерно на 93% связан с белками плазмы (Klotz et al., 1990). Значительная часть препарата метаболизируется в печени под действием изофермента IIIA4 цитохрома Р450 с образованием по крайней мере 10 соединений, большей частью гидроксилированных и деметилированных производных (Zeng et al., 1998). Ни ивермектина в неизмененном виде, ни его конъюгатов в моче почти не обнаруживается (Krishna and Klotz, 1993). У животных он выводится с калом (в основном в неизмененном виде), а максимальные концентрации ивермектина достигаются в печени и жировой ткани. Ивермектин жирорастворим, и можно было бы ожидать, что он будет хорошо проникать через гематоэнцефалический барьер, однако в головном мозге его концентрация очень низка. Эксперименты на трансгенных мышах указывают на то, что накоплению ивермектина в ЦНС препятствует трансмембранный Р-гликопротеид, который входит в состав гематоэнцефалического барьера и способствует активному выведению препаратов из клеток (Schinkel et al.,1994). Вероятно, именно поэтому, а также вследствие низкого сродства ивермектина к рецепторам в ЦНС побочные эффекты препарата со стороны ЦНС незначительны и сам он довольно хорошо переносится.
Применение
Онхоцеркоз. Однократный прием 150 мкг/кг ивермектина внутрь 1—2 раза в год считается эффективным, безопасным и удобным способом лечения онхоцеркоза у взрослых и детей старше 5 лет (Goa etal., 1991). Существенно, что при такой схеме лечения уменьшаются лимфоузлы, проходят острые воспалительные изменения в тканях глаза, а поражение глаз, обусловленное микрофиляриями, перестает прогрессировать. Количество микрофилярий в коже и в тканях глаза заметно снижается уже через несколько дней после приема ивермектина, и действие препарата длится 6—12 мес, после чего его надо принимать снова. Полное излечение не наступает, так как на взрослых гельминтов ивермектин не действует. С 1987 г. компания «Мерк Шарп и Доум Идеа» бесплатно поставляет ивермектин для лечения онхоцеркоза во всех 34 странах (Африки, Ближнего Востока и Латинской Америки), являющихся эндемическими очагами этого гельминтоза. Около 20 млн человек получали препарат хотя бы однажды, а многие — от 6 до 9 раз (Dull and Meredith, 1998). Ежегодный прием ивермектина безопасен и позволяет значительно снизить распространение паразита (Brown, 1998; Boatin et al., 1998). Сколько лет нужно принимать ивермектин, пока не известно.
Лимфатические филяриатозы. Первые испытания ивермектина показали, что ежегодный прием 400 мкг/кг препарата — эффективное и безопасное средство массового лечения вухерериоза и бругиоза (Ottesen and Ramachand-ran, 1995). Для борьбы с лимфатическими филяриатозами ивермектин столь же эффективен, как и диэтилкарбамазин, но, в отличие от диэтилкарбамазина, его можно применять в эндемических очагах онхоцеркоза и лоаоза. По последним данным, еще более эффективен ежегодный прием ивермектина (200—400 мг/кг) в сочетаний с альбендазолом (400 мг). С учетом плодовитости взрослых гельминтов препараты рекомендуется принимать в течение 4—6 лет. Кроме того, прием двух препаратов одновременно снижает заболеваемость кишечными нематодозами. Оба препарата бесплатно поставляются компаниями «Мерк Шарп и Доум Идеа* (ивермектин) и «Смйт-клайн Бичем» (альбендазол), благодаря чему данная схема теперь стала стандартом массового лечения и профилактики лимфатических филяриатозов (Ottesen et al., 1999; см. также выше, «Производные бензимидазола»).
Кишечные нематодозы. Однократным приемом ивермектина в дозе 150—200 мкг/кг излечивается стронгилоидоз человека. Препарат эффективен также при сопутствующих аскаридозе, трихоцефалезе и энтеробиозе (Naquira et al., 1989). По сравнению с традиционной схемой лечения кишечного стронгилоидоза тиабендазопом однократный прием ивермектина в дозе 100 мкг/кг столь же эффективен, но вызывает меньше побочных эффектов (Gann et al.,1994). Вместе с тем эффективность ивермектина при диссеминированном стронгилоидозе пока не доказана.
Другие гельминтозы. Несмотря на активность в отношении микрофилярий (но не взрослых особей) Loa loa и Mansonella ozzardi, для лечения лоаоза и мансонеллеза ивермектин не применяют. В дозе 150—200 мкг/кг однократно внутрь ивермектин служит препаратом первого ряда при кожной форме синдрома larva migrans, вызванной анкилостомами собак и кошек. Те же дозы препарата — безопасное и высокоэффективное средство лечения педикулеза и чесотки (чесотка излечивается даже на фоне СПИДа) (de Silva et al., 1997).
Побочные эффекты и меры предосторожности
В отсутствие инвазии ивермектин хорошо переносится как людьми, так и животными (млекопитающими). У животных побочные эффекты со стороны ЦНС (сонливость, атаксия, мидриаз, тремор) и смерть наступают лишь при приеме очень высоких доз ивермектина. Хуже всего препарат переносят собаки, особенно колли (Campbell and Benz, 1984). У человека побочные эффекты ивермектина почти всегда связаны с реакцией на гибнущих микрофилярий (реакция Маззотти). Ее проявления и интенсивность зависят от количества микрофилярий в организме, длительности инвазии и вида возбудителя. Так, при лечении онхоцеркоза побочные эффекты возникают у 5—35% больных и обычно ограничиваются легким зудом, увеличением и болезненностью лимфоузлов; проявления длятся несколько дней и уменьшаются под действием аспирина или Н,-блокаторов (Goa et al., 1991). Реже возникают более тяжелые побочные эффекты: высокая лихорадка, тахикардия, артериальная гипотония, резкая слабость, дурнота, головная боль, миалгия, артралгия, понос, отеки (в том числе лица) — эти симптомы ослабевают при введении глюкокортикоидов. По сравнению с диэтилкарбамазином ивермектин вызывает менее тяжелые побочные эффекты и редко усугубляет поражение глаз при онхоцеркозе. При сопутствующем онхоцеркозу тяжелом лоаозе с большим количеством микрофилярий побочные эффекты ивермектина могут быть особенно серьезными— вплоть до энцефалопатии и инвалидизации (Gar-donetal., 1997). Тератогенное и канцерогенное действие ивермектина не доказано.
Так как ивермектин связывается с рецепторами ГАМ К в ЦНС, он противопоказан при нарушении гематоэнце-фалического барьера, например при сонной болезни и менингите. С осторожностью следует назначать ивермектин одновременно с другими средствами, угнетающими ЦНС. Предполагаемые взаимодействия ивермектина с препаратами, метаболизм которых протекает под действием изофермента IIIA4, еще не изучены. Ивермектин пока не разрешен к применению у беременных и детей младше 5 лет, хотя и те, и другие наверняка получали препарат в ходе массовых лечебных мероприятий. Небольшое количество препарата проникает в молоко, но последствия для грудных детей не изучены.
Метрифонат
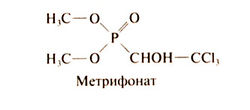
Метрифонат — фосфорорганический инсектицид, нашедший применение в качестве антигельминтного средства, особенно при мочеполовом шистосомозе. Структурная формула метрифоната следующая:
Сам по себе метрифонат неактивен. При физиологических значениях pH он без участия ферментов превращается в 2,2-ди-хлорвинилфосфат (дихлорфос) — мощный ингибитор АХЭ (Hinzet al., 1996). Однако одним подавлением активности АХЭ вряд ли можно объяснить действие метрифоната на шистосом (Bloom, 1981). In vitro активность дихлорфоса почти одинакова в отношении Schistosoma mansoni и Schistosoma haematobium, но in vivo при кишечном шистосомозе метрифонат неэффективен. Объяснения такая избирательность пока не нашла.
Сывороточная концентрация метрифоната (30 мкмоль) и дихлорфоса (0,3 мкмоль) достигает максимальной в течение I ч после однократного приема 10 мг/кг метрифоната внутрь. Tt/3 обоих соединений составляет 1,5—2 ч; примерно таков же Т1/2 самопроизвольного превращения метрифоната в дихлорфос при физиологических значениях pH (Abdi and Villen, 1991).
Благодаря низкой стоимости, эффективности и удобству приема метрифонат может служить достойной заменой празиквантелу при мочеполовом шистосомозе. Препарат обычно назначают в дозе 7,5—10 мг/кг внутрь в 3 приема с интервалом в 2 нед. В последнее время метрифонат испытывают как средство лечения болезни Альцгеймера (Williams, 1999). В США метрифонат к применению в качестве лекарственного средства не разрешен.
В терапевтических дозах метрифонат подавляет активность холинэстеразы плазмы и АХЭ эритроцитов (спустя несколько недель после отмены препарата активность обоих ферментов нормализуется). Несмотря на это, метрифонат хорошо переносится. Иногда отмечаются дозозависимые побочные эффекты, в том числе легкое головокружение, повышенная утомляемость, тошнота и кишечные колики. Препарат нельзя назначать больным, которые незадолго перед началом лечения подвергались действию инсектицидов, иначе подавление активности АХЭ будет слишком сильным. Кроме того, в течение 48 ч после последнего приема метрифоната нельзя назначать деполяризующие миорелаксанты.
Никлозамид
Галоген замещенное производное салициланилида никлозамид применяется для лечения цестодозов с 1960-х гт. Препарат недорог, эффективен и свободно продается во многих странах. Никлозамид служит препаратом второго ряда (после празик-вантела) для лечения тениаринхоза, дифиллоботриоза, гимено-лепидоза и других цестодозов. Но при тениозе такое лечение может оказаться небезопасным: из разрушенных никлозами-дом зрелых члеников высвобождаются яйца Taenia solium, а из них выходят личинки, вызывающие цистицеркоз — тяжелую инвазию, которая плохо поддается лечению. В США никлозамид больше не применяется. Фармакология и применение ник-лозам ида подробно рассмотрены в 9-м и более ранних изданиях этой книги.
Оксамнихин
Оксамнихин — производное 2-аминометилтетрагидрохиноли-на — применяется как препарат второго ряда (после празикван-тела) для лечения шистосомозов. Оксамнихин высокоактивен в отношении большинства штаммов Schistosoma mansoni, но на Schistosoma haematobium и Schistosoma japonicum он в терапевтических дозах почти не действует. Побочные эффекты оксам-нихина нетяжелые и возникают нечасто, а эффект достигается уже при однократном приеме внутрь, так что препарат продолжают активно использовать в рамках программ по борьбе с кишечным шистосомозом, особенно в Южной Америке. Фармакология и применение оксамнихина подробно описаны в 9-м и более ранних изданиях этой книги.
Пиперазин
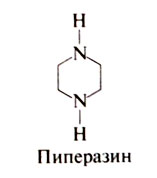
Открытие антигельминтных свойств пиперазина обычно связывают с именем Файара (Fayard, 1949), однако впервые они были описаны руанским фармацевтом Буамаром. на которого Файар ссылается в своей работе. Многие замещенные производные пиперазина обладают антигельминтной активностью, но в клиническую практику вошел только диэтилкарбамазин (Standen, 1963). Пиперазин — циклический вторичный амин со следующей структурной формулой:
Пиперазин высокоактивен в отношении Ascaris lumbricoides и Enterobius vermicularis. Под действием пиперазина у аскарид наступает вялый паралич, и они изгоняются из ЖКТ за счет перистальтики. Однако этот эффект обратим — in vitro при выдержке паразитов в среде, не содержащей пиперазина, паралич проходит. Пиперазин действует как агонист ГАМК: он повышает хлорную проницаемость мембран мышечных клеток аскарид, в результате возникает гиперполяризация, снижается возбудимость клеток, что приводит к расслаблению мышц и вялому параличу (Martin, 1985). Избирательность действия пиперазина пока не получила объяснения, возможно, ответить на этот вопрос удастся после изучения действия препарата на хлорные каналы в эксперименте (подобно тому, как исследовали механизм действия ивермектина) (Arena et al., 1995). При приеме внутрь пиперазин быстро всасывается. Около 20% дозы выводится с мочой в неизмененном виде (Fletcher et al., 1982).
В США пиперазин выпускают в виде соли лимонной кислоты. Это эффективный и недорогой препарат второго ряда, который можно назначать вместо мебендазола или пирантела для лечения аскаридоза с сопутствующим энтеробиозом. Пиперазин назначают внутрь в таблетках или в виде раствора (для детей). Принимать его натощак, а также использовать слабительные и клизмы нет необходимости. Существует несколько схем лечения. При аскаридозе взрослым и детям обычно назначают 75 мг/кг пиперазина (максимальная доза 3,5 г) 1 раз в сутки в течение 2 сут. Излечение наступает почти всегда. Преимущество пиперазина в том, что он уменьшает подвижность аскарид, снижая риск осложнений, вызванных миграцией гельминтов. Так как аскариды выводятся с калом живыми, всасывание продуктов распада гельминтов маловероятно. При частичной кишечной непроходимости раствор пиперазина вводят через назогастральный зонд. Вместе с другими мерами это позволяет избежать хирургического вмешательства.
При энтеробиозе пиперазин назначают в дозе 65 мг/кг (максимальная доза 2,5 г) 1 раз в сутки в течение 7 сут; излечение наступает в 95—100% случаев. Так как при энтеробиозе легко происходит повторное заражение, амбулаторным больным проводят еще один курс лечения спустя 1—2 нед после первого. Часто рекомендуют назначать пиперазин сразу всем членам семьи, без предварительного соскоба с перианальных складок.
В терапевтических дозах пиперазин редко вызывает побочные эффекты. Иногда отмечаются желудочно-кишечные нарушения, преходящие неврологические осложнения и крапивница. Препарат безопасен при беременности. Смертельная доза пиперазина вызывает судороги и угнетение дыхания. При эпилепсии в анамнезе пиперазин противопоказан. При нарушении функции почек пиперазин может оказывать нейротоксическое действие, так как выводится он в основном с мочой.
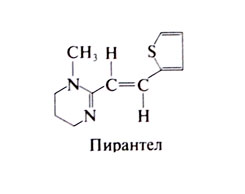
Пирантел
Пирантел впервые начали применять в ветеринарии — как антигел ьминтный препарат широкого спектра действия для лечения энтеробиоза, нематодозов и анкилостомидозов (Austin et al., 1966). Препарат оказался эффективным и хорошо переносился животными, и после клинических испытаний его стали применять при кишечных гельминтозах человека (Bumbalo et al., 1969). При трихоцефалезе эффективен однократный прием оксантела — метоксифенольного аналога пирантела. Пирантел выпускают в виде памоата (З-окси-2-нафтоата). Структурная формула пирантела следующая:
Пирантел и его аналоги относятся к деполяризующим блокаторам нервно-мышечного проведения. Они открывают неизбирательные катионные каналы и вызывают стойкую активацию N-холинорецепторов. В результате у гельминтов наступает спастический паралич (Robertson et al., 1994). Кроме того, пирантел подавляет активность холинэстераз. У аскарид он вызывает медленно развивающийся спазм мышц. Чтобы такой же эффект наступил под действием ацетилхолина, его концентрация должна быть в 100 раз выше концентрации пирантела. В одиночных мышечных клетках аскарид пирантел вызывает деполяризацию и повышает частоту потенциалов действия, что сопровождается усилением их тонического сокращения. Пирантел эффективен при анкилостомидозах, энтеробиозе и других нематодозах; при трихоцефалезе он, в отличие от оксантела, не действует.
Пирантел плохо всасывается в ЖКТ, благодаря чему он особенно эффективен при кишечных нематодозах. С мочой в неизмененном виде и в виде метаболитов выводится менее 15% дозы; большая часть препарата выводится с калом.
При аскаридозе и энтеробиозе пирантел можно применять вместо мебендазола. В большинстве случаев для полного излечения достаточно однократного приема 11 мг/кг пирантела внутрь (максимальная доза — 1 г). Пирантел эффективен также при анкилостомозе и некаторозе, хотя при тяжелой инвазии Necatoramericanus часто требуется повторный прием. При смешанных инвазиях, одна из которых — трихоцефалез, пирантел следует применять в сочетании с оксантелом. При энтеробиозе спустя 2 нед после первого приема пирантел желательно назначить повторно.
При парентеральном введении пирантел может вызвать у животных полную блокаду нервно-мышечного проведения; при приеме же внутрь его токсическое действие проявляется лишь в очень высоких дозах. У людей иногда отмечаются преходящие и легкие желудочно-кишечные нарушения, головная боль, дурнота, сыпь и лихорадка. Действие пирантела при беременности не изучено, поэтому назначать его беременным и детям до 2 лет не рекомендуется. Пирантел не следует назначать одновременно с пиперазином, который оказывает противоположный эффект на мышцы гельминтов.
Празиквантел
Историческая справка
В 1972 г. обнаружили, что производные пиразинизохинолина обладают антигельминтной активностью. Дальнейшее изучение этих соединений в скором времени привело к разработке и введению в практику празиквантела. Этот препарат эффективен при многих цестодозах и трематодозах человека и животных, на нематод же он почти не действует (Symposium, 1981; Andrews, 1985). Структурная формула празиквантела следующая:
Антигельминтная активность присуща главным образом левовращающему изомеру празиквантела.
Антигельминтная активность
Празиквантел быстро, но обратимо захватывается взрослыми шистосомами и оказывает на них двоякое действие. В минимальных терапевтических концентрациях он усиливает мышечный тонус паразитов, вызывая у них длительное сокращение мышц и спастический паралич. В результате шистосомы отделяются от стенок кровеносных сосудов и по брыжеечным венам попадают в печень. В более высоких концентрациях празиквантел вызывает разрушение тегумента, при этом обнажаются его антигены и запускается иммунный ответ хозяина (Redman et al., 1996). По-видимому, клиническая эффективность празиквантела в большей степени определяется разрушением тегумента — на это указывают данные, полученные при сравнении чувствительности Schistosoma mansoni на разных стадиях к препарату in vitro и in vivo (Xiao et al., 1985). У мышей с подавленным иммунитетом чувствительность Schistosoma mansoni и Schistosoma japonicum к празиквантелу ниже (Fallon et al., 1996). Значимость состояния иммунной системы человека для эффективности празиквантела еще предстоит установить.
Под действием празиквантела повышается проницаемость тегумента для ионов кальция, что способствует сокращению мышц (в среде, не содержащей кальция, эффект не реализуется). Предложено несколько возможных мишеней празиквантела, но в точности механизм действия пока не известен (Redman et al., 1996). Празиквантел может вызывать биохимические нарушения у паразитов, и все же в основе его эффектов, по-видимому, лежит действие на тегумент (Andrews, 1985). Большая часть данных о механизме действия празиквантела получена при исследовании шистосом. Считается, что на других трематод и цестод он действует так же, как и на шистосом, но доказательств этому пока нет.
Фармакокинетика
При приеме внутрь празиквантел быстро всасывается, и его сывороточная концентрация достигает максимальной спустя 1—2 ч после приема. Фармакокинетика препарата зависит от дозы. Биодоступность празиквантела невелика, так как значительная часть препарата метаболизируется при первом прохождении через печень с образованием целого ряда гидро-ксилированных и конъюгированных производных. Сывороточная концентрация метаболитов по крайней мере в 100 раз превышает концентрацию самого празиквантела. Примерно 80% препарата связывается с белками плазмы. В зависимости от дозы Т1/2 празиквантела составляет 0,8—3 ч, тогда как Т1/2 метаболитов — от 4 до 6 ч. При тяжелом поражении печени (в том числе перипортальном фиброзе с портальной гипертензией — самом тяжелом осложнении кишечного, японского и меконгского шистосомозов) Т1/2 празиквантела может увеличиваться. После приема внутрь около 70% препарата выводится с мочой в течение 24 ч в виде метаболитов; оставшаяся часть в дальнейшем метаболизируется в печени и выводится с желчью.
Применение
В США празиквантел разрешен только для лечения шистосомозов и печеночных трематодозов. За пределами США этот отличающийся широким спектром действия и безопасностью препарат применяют и при других трематодозах и цестодозах (табл. VI 1.1). Празиквантел следует хранить при температуре не выше 30“С. Из-за горького вкуса таблетки лучше не разжевывать, а глотать, запивая водой.
Празиквантел — лучшее средство лечения шистосомозов человека. Схемы лечения могут несколько различаться. При приеме препарата внутрь в дозе 40 мг/кг 1 раз в сутки или 20 мг/кг 3 раза в сутки (с интервалом в 4—6 ч) излечиваются, как правило, 70—95% больных, а количество яиц в кале снижается более чем у 85% больных. Однако и устойчивость к препарату не заставила себя ждать. В лаборатории получены устойчивые к празиквантелу штаммы Schistosoma mansoni и Schistosoma japonicum (Fallon et al., 1996). Снижение эффективности празиквантела отмечено в двух эндемических очагах кишечного шистосомоза: один — на севере Сенегала (Van Lieshout etal., 1999), другой — в Египте, где 1—2% больных не излечивались даже после двух или трех курсов препарата (Ismail et al., 1999). Тем не менее устойчивость к празиквантелу в целом пока не препятствует успешному лечению шистосомозов (Fallon et al., 19%).
Прием празиквантела в дозе 25 мг/кг 3 раза в сутки в течение 1 сут (с интервалом 4—8 ч) в большинстве случаев излечивает печеночные трематодозы, вызванные С1оnorchis sinensis и Opisthorchis viverrini, а также кишечные трематодозы, вызванные Fasciolopsis buski, Heterophyes heterophyes и Metagonimus yokogawai. Прием препарата по той же схеме, но в течение 2 сут высокоэффективен при парагонимозе. В то же время фасциолез не поддается лечению даже высокими дозами празиквантела, хотя препарат и обнаруживают в Fasciola hepatica. Причины такой избирательности не выяснены.
В низких дозах празиквантел эффективен для изгнания из кишечника половозрелых цестод. Так, при гиме-нолепидозе препарат назначают в дозе 25 мг/кг однократно; при тениозе, тениаринхозе и дифиллоботриозе—10—20 мг/кг однократно. При тяжелом гименолепи-дозе рекомендуют принять препарат повторно спустя 7—10 сут после первого курса лечения. Хотя препаратом выбора при цистицеркозе служит альбендазол, вместо него можно назначить длительный курс празиквантела в высоких дозах (Evans et al., 1997). Эхинококкозы лечению празиквантелом не поддаются; в этом случае назначают альбендазол (Horton, 1997; Schantz, 1999).
Побочные эффекты, меры предосторожности и лекарственные взаимодействия
Вскоре после приема празиквантела могут появиться неприятные ощущения и боль в животе, тошнота, головная боль и дурнота. Эти побочные эффекты преходящи, обусловлены прямым действием препарата и зависят от дозы. В ряде случаев — особенно при тяжелой инвазии — могут возникать непрямые побочные эффекты, вызванные реакцией иммунной системы на поврежденных гельминтов и их яйца. К непрямым эффектам относятся лихорадка, зуд, крапивница, сыпь, артралгия, миалгия и эозинофилия. При лечении празиквантелом цистицеркоза головного мозга могут отмечаться менингизм, эпилептические припадки, психические расстройства и цитоз в СМЖ. Эти осложнения возникают позднее, длятся 2—3 сут и проходят при назначении анальгетиков и противосудорожныхсредств.
Препарат безопасен для детей старше 4 лет, более того, они, по-видимому, переносят его лучше, чем взрослые. Низкие концентрации препарата обнаруживаются в молоке, но данных, указывающих на мутагенное или канцерогенное действие празиквантела, нет. Тем не менее в высоких дозах он увеличивает частоту самопроизвольных абортов у крыс, поэтому при беременности его применять не рекомендуется.
Индукторы изоферментов цитохрома Р450 (например, карбамазепин и фенобарбитал) снижают биодосгупносгь празиквантела; ингибиторы этих изоферментов оказывают противоположное действие (Bittencourt et al.. 1992; Dachman et al., 1994). Биодосгупносгь празиквантела снижается и при одновременном введении дексаметазона, но механизм этого эффекта не известен. При определенных условиях празиквантел может повышать биодоступность альбендазола (Homeida et al., 1994).
Празиквантел противопоказан при цистицеркозе глаз, так как реакция иммунной системы при этом может вызывать необратимое поражение глаз. После приема препарата в течение некоторого времени следует избегать деятельности, требующей повышенного внимания (вождение автомобиля и др.). Т1/2 празиквантела может повышаться при тяжелом поражении печени; таким больным может потребоваться коррекция дозы (Mandouret al., 1990).
Перспективы
До тех пор пока существуют бедные слои населения, полное искоренение гельминтозов представляется маловероятным. Заболевания эти вовсе не редкость и распространены повсеместно, но их проявления могут быть столь малозаметны, что зачастую больные обращаются к врачу лишь на поздней стадии. Заболеваемость гельмин-тозами особенно высока в районах с теплым климатом, где уделяется недостаточно внимания гигиене, борьбе с резервуарами и переносчиками паразитов, а также обеззараживанию источников воды и пищи. Но и высокий уровень жизни не гарантирует от заражения гельминто-зами, которым особенно подвержены дети и ослабленные больные.
Наиболее эффективный, удобный и недорогой метод борьбы с гельминтозами в настоящее время — медикаментозное лечение. Этот метод по-прежнему останется востребованным, даже если появятся эффективные вакцины. В борьбе с гельминтозами лучше всего сочетать лечение с профилактическими мероприятиями — улучшением санитарных условий, устранением переносчиков и резервуаров паразитов. Успех самого медикаментозного лечения зависит от соблюдения его схемы и своевременной поставки препаратов, а также от возможности наблюдать за больными во время лечения. Так как лишь немногие гельминты способны размножаться в организме человека, несколько курсов эффективных антигельминтных препаратов могут свести распространение гельминтозов на нет, снизив количество паразитов в организме до уровня, когда передача их от человека к человеку станет невозможна.
Основная задача сейчас состоит в разработке более эффективных препаратов для лечения системных гельминтозов (филяриатозов, эхинококкозов, фасциолеза, трихинеллеза, токсокароза и цистицеркоза), так как они недостаточно хорошо поддаются лечению существующими средствами. В этом смысле особенно важно создать препараты, действующие на все стадии развития паразита (например, не только на микрофилярий, но и на взрослых гельминтов). Большинство эффективных антигельминтных средств применяются уже многие годы, и рано или поздно к ним возникнет устойчивость. И хотя сейчас устойчивость еще не стала помехой лечению гельминтозов человека, в ветеринарии уже никого не удивляют случаи устойчивости к производным бензимидазола и авермектинам. Этот призрак устойчивости заставляет искать новые препараты — даже для лечения инвазий, с которыми пока неплохо справляются имеющиеся средства.
Из-за финансовой незаинтересованности производителей разработка антигельминтных средств отстает от прогресса технологии. Применение в гельминтологии современных методов исследования (определение нуклеотидной последовательности геномов, высокопроизводительные методы анализа белковых смесей и др.) должно способствовать выявлению новых мишеней лекарственного воздействия и лучшему пониманию механизмов устойчивости. Так, изучение клонированных рецепторов хлорных каналов и изменений, возникающих в этих рецепторах под действием авермектинов, возможно, позволит понять, как формируется устойчивость к этим препаратам у гельминтов in vivo. Возможна также автоматизированная проверка большого числа соединений на способность взаимодействовать с жизненно важными молекулами паразитов, что позволит выявить вещества с антигельминтными свойствами.
Однако помимо разработки новых препаратов существуют и другие способы улучшить борьбу с гельминтозами. Один из них — оптимизация применения существующих препаратов. Хорошим примером такого подхода стало использование диэтилкарбамазина в качестве добавки к поваренной соли, благодаря чему заметно снизилась заболеваемость лимфатическими филяриатозами. Другой пример — проведение повторных курсов лечения празиквантелом (шистосомозы) и диэтилкарбамазином или ивермектином (лимфатические филяриатозы). При этом снижается число возбудителей в организме, скорость распространения и тяжесть заболеваний. Эмпирические схемы лечения требуют дальнейшей проверки на практике; благодаря такой проверке уже снижены дозы диэтилкарбамазина и ивермектина, рекомендованные прежде для лечения филяриатозов. Обнадеживающие результаты дает совместное назначение препаратов, по-разному действующих на одних и тех же паразитов. Примером служит периодический прием альбендазола в сочетании с диэтилкарбамазином или ивермектином для лечения лимфатических филяриатозов. В местах, где часты смешанные инвазии, вызванные гельминтами разных классов, может стать эффективным прием населением комбинаций из двух или более препаратов, различающихся по спектру действия. Так, совместный прием альбендазола и ивермектина, с успехом применяемый для лечения лимфатических филяриатозов, оказался высокоэффективным и при кишечных нематодозах. А комбинацию из празиквантела, ивермектина и альбендазола рекомендуют назначать при смешанных инвазиях, вызванных гельминтами разных видов.
Еще один подход к лечению гельминтозов (намного более дешевый, чем разработка новых препаратов) состоит в адаптации для человека ветеринарных средств и проверке на антигельминтную активность препаратов, назначаемых по совсем другим показаниям. Так, авермектины и производные бензимидазола изначально разрабатывались для применения в ветеринарии; впоследствии ивермектин и альбендазол были бесплатно предоставлены производителями для лечения гельминтозов человека. Ограниченные испытания показали, что ветеринарный препарат триклабендазол (производное бензимидазола) — едва ли не самое эффективное средство для лечения фасциолеза человека. У моксидектина (ветеринарного препарата, родственного авермектинам) обнаружена активность в отношении взрослых возбудителей онхоцеркоза и лимфатических филяриатозов. Готовятся клинические испытания этого препарата. В ветеринарии применяется также лекарственная форма ивермектина для п/к введения. Это позволяет избежать разрушения препарата в печени, добиться более высокой сывороточной концентрации и повысить его эффективность при некоторых системных гельминтозах, обычно плохо поддающихся лечению. Да и сами больные гельминтозами животные могут служить моделью для изучения устойчивости кантигельминтным препаратам.
Вместе с тем гельминтозы остаются огромной проблемой для человечества, и в итоге общество будет вынуждено пойти на высокие затраты, которых требует разработка новых антигельминтных средств и вакцин. Технические возможности для этого либо уже существуют, либо появятся в ближайшем будущем.