Антипротозойные средства (препараты) — различия между версиями
Ars (обсуждение | вклад) (→Читайте также) |
(→Трихомоноз) |
||
| Строка 22: | Строка 22: | ||
=== Трихомоноз === | === Трихомоноз === | ||
| − | Возбудитель трихомоноза — жгутиковое простейшее Trichomonas vaginalis. Этот микроорганизм паразитируете мочевых путях и половых органах. Он вызывает вагинит у женщин и уретрит (впрочем, нечасто) — у мужчин. Заражение происходит половым путем. В мире трихомонозом ежегодно заражаются свыше 200 млн человек. В США каждый год заражаются по крайней мере 3 млн женщин, причем трихомоноз наиболее распространен среди лиц, ведущих беспорядочную половую жизнь (Heine and McGregor, 1993). В выделениях из влагалища обнаруживаются лишь трофозоиты Trichomonas vaginalis. Подтвержденные случаи трихомоноза успешно излечиваются мет-ронидазолом. Наиболее частые причины его неэффективности — несоблюдение схемы лечения или повторное заражение от не-леченного партнера, у которого инфекция протекает бессимптомно. Однако в последнее время от больных все чаше выделяют штаммы Trichomonas vaginalis, устойчивые к метронидазолу, и не исключена вероятность их повсеместного распространения (Sobel et al., 1999). За пределами США для лечения трихомоноза предпочитают применять аналоги нитроимидазола, например тинидазол. Но и к этим препаратам развивается устойчивость, поэтому ведутся испытания других средств (в частности, паромомицина для интравагинального введения). Токсоплазмоз | + | Возбудитель трихомоноза — жгутиковое простейшее Trichomonas vaginalis. Этот микроорганизм паразитируете мочевых путях и половых органах. Он вызывает вагинит у женщин и уретрит (впрочем, нечасто) — у мужчин. Заражение происходит половым путем. В мире трихомонозом ежегодно заражаются свыше 200 млн человек. В США каждый год заражаются по крайней мере 3 млн женщин, причем трихомоноз наиболее распространен среди лиц, ведущих беспорядочную половую жизнь (Heine and McGregor, 1993). В выделениях из влагалища обнаруживаются лишь трофозоиты Trichomonas vaginalis. Подтвержденные случаи трихомоноза успешно излечиваются мет-ронидазолом. Наиболее частые причины его неэффективности — несоблюдение схемы лечения или повторное заражение от не-леченного партнера, у которого инфекция протекает бессимптомно. Однако в последнее время от больных все чаше выделяют штаммы Trichomonas vaginalis, устойчивые к метронидазолу, и не исключена вероятность их повсеместного распространения (Sobel et al., 1999). За пределами США для лечения трихомоноза предпочитают применять аналоги нитроимидазола, например тинидазол. Но и к этим препаратам развивается устойчивость, поэтому ведутся испытания других средств (в частности, паромомицина для интравагинального введения). |
| + | |||
| + | === Токсоплазмоз === | ||
| + | |||
| + | Токсоплазмоз — это зоонозная инфекция, возбудителем которой служит облигатный внутриклеточный паразит Toxoplasma gondii (Wong and Remington, 1993). Это заболевание распространено по всему миру. Хотя природными хозяевами паразита служат домашние кошки и другие представители семейства кошачьих, цисты (цистоюиты) выделены от всех изученных видов млекопитающих. Основные пути заражения человека: I) употребление в пишу непроверенного или недожаренного мяса, содержащего цисты, 2) употребление зелени и овощей, загрязненных почвой, в которой содержатся ооцисты, 3) попадание ооцист из фекалий больных токсоплазмозом кошек, 4) трансплацентарная передача плоду эндозоитов от инфицированной матери. | ||
У лиц с нормальным иммунитетом симптомы возникают лишь в 10—20% случаев заражения. В то же время в США серопозитивны около 70% взрослого населения. При нормальном иммунитете острый токсоплазмоз обычно проходит без лечения. Врожденный токсоплазмоз (как правило, в виде хориоретинита) может проявиться даже через IS—20 лет. Лица с нарушенным иммунитетом предрасположены к токсоплазменному энцефалиту, который обусловлен выходом цистозоитов из цист непосредственно в головном мозге. Токсоплазменный энцефалит — основная причина смерти у больных СПИДом, и именно для этой группы больных разработка эффективных методов лечения токсоплазмоза стоит особенно остро. Лечение токсоп-лазменного энцефалита начинают с антагонистов фолиевой кислоты пириметамина и сульфадиазина — во избежание рецидивов эти препараты назначают на длительный срок (Georgiev, 1994). Однако примерно в 50% случаев лечение приходится прерывать из-за токсичности (главным образом, сульфадиазина). В таких случаях сульфадиазин чаще всего заменяют на клинда-мицин, хотя, поданным предварительных испытаний, сходный эффект дают и другие антимикробные препараты (например, спирамицин и триметрексат). Атоваквон, действующий как на эндозоиты, так и на цисты Toxoplasma gondii, переносится лучше пириметамина и сульфадиазина, но может быть не столь эффективным (Torres etal., 1997;см. также гл. 40). Поскольку спирамицин накапливается в плаценте, его рекомендуют применять при токсоплазмозе у беременных (в первые 20 нед беременности) для снижения риска врожденного токсоплазмоза. На более поздних сроках беременности либо продолжают лечение спирамицином, либо заменяют его пириметамином и суль-фадиазином (Georgiev, 1994). | У лиц с нормальным иммунитетом симптомы возникают лишь в 10—20% случаев заражения. В то же время в США серопозитивны около 70% взрослого населения. При нормальном иммунитете острый токсоплазмоз обычно проходит без лечения. Врожденный токсоплазмоз (как правило, в виде хориоретинита) может проявиться даже через IS—20 лет. Лица с нарушенным иммунитетом предрасположены к токсоплазменному энцефалиту, который обусловлен выходом цистозоитов из цист непосредственно в головном мозге. Токсоплазменный энцефалит — основная причина смерти у больных СПИДом, и именно для этой группы больных разработка эффективных методов лечения токсоплазмоза стоит особенно остро. Лечение токсоп-лазменного энцефалита начинают с антагонистов фолиевой кислоты пириметамина и сульфадиазина — во избежание рецидивов эти препараты назначают на длительный срок (Georgiev, 1994). Однако примерно в 50% случаев лечение приходится прерывать из-за токсичности (главным образом, сульфадиазина). В таких случаях сульфадиазин чаще всего заменяют на клинда-мицин, хотя, поданным предварительных испытаний, сходный эффект дают и другие антимикробные препараты (например, спирамицин и триметрексат). Атоваквон, действующий как на эндозоиты, так и на цисты Toxoplasma gondii, переносится лучше пириметамина и сульфадиазина, но может быть не столь эффективным (Torres etal., 1997;см. также гл. 40). Поскольку спирамицин накапливается в плаценте, его рекомендуют применять при токсоплазмозе у беременных (в первые 20 нед беременности) для снижения риска врожденного токсоплазмоза. На более поздних сроках беременности либо продолжают лечение спирамицином, либо заменяют его пириметамином и суль-фадиазином (Georgiev, 1994). | ||
Текущая версия на 11:38, 25 мая 2015
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
- 1 Антипротозойные средства
- 2 Протозойные инфекции человека
- 3 Производные 8-гидроксихинолина
- 4 Антибиотикотерапия протозойных инфекций
- 5 Перспективы
- 6 Читайте также
Антипротозойные средства[править | править код]
Человек служит резервуаром для множества возбудителей протозойных инфекций, которые переносятся насекомыми, передаются непосредственно от других млекопитающих или от человека к человеку. Поскольку простейшие быстро размножаются в организме хозяина, а эффективные вакцины пока недоступны, медикаментозное лечение остается единственным методом борьбы с протозойными инфекциями и их распространением. Важнейшую роль в защите организма от протозойных инфекций играет иммунная система. Поэтому оппортунистические протозойные инфекции чаще встречаются у детей, у лиц, страдающих злокачественными новообразованиями или перенесших трансплантацию органов, у получающих иммунодепрессанты или большие дозы антибиотиков, а также на поздних стадиях ВИЧ-инфекции. Лечить такие инфекции на фоне иммунодефицита особенно сложно, и результат часто оказывается неудовлетворительным.
Несмотря на значительный прогресс в паразитологии, иммунологии и изучении патогенеза протозойных инфекций, новых антипротозойных средств очень мало. По-прежнему нет эффективных препаратов для лечения сонной болезни и хронической стадии болезни Чагаса. Многие препараты токсичны уже в терапевтических дозах, а с появлением устойчивых штаммов ситуация только усугубляется. Более того, распространение устойчивости ставит под угрозу применение и других, менее токсичных, препаратов.
В данной главе описаны важнейшие протозойные инфекции у человека (за исключением малярии) и препараты, применяемые для их лечения. Вначале рассмотрены амебиаз, лямблиоз и трихомоноз — повсеместно распространенные инфекции, вызываемые анаэробными простейшими. Затем следует описание токсоплазмоза и криптоспоридиоза — заболеваний, особенно опасных на фоне иммунодефицита, в частности у больных ВИЧ-инфекцией. Рассмотрены также трипаносомозы и лейишаниозы — тяжелейшие инфекции, вызываемые различными представителями отряда Kinetoplastidae и поражающие миллионы людей в тропических странах. Упоминаются и не столь распространенные инфекции, такие, как балантидиаз и бабезиоз. Подробно рассмотрены фармакологические свойства и применение антипротозойных средств первого ряда — дилоксанида, эф-лорнитина, меларсопрола, метронидазола, нифуртимокса, пентамидина, стибоглюконата натрия и сурамина. Менее подробно описаны препараты второго ряда и средства, представляющие лишь исторический интерес (хлорохин, эметина гидрохлорид, дегидроэметин, дийодгидроксихинолин, мепакрин и ряд антибиотиков). В конце главы кратко обсуждаются перспективы антимикробной терапии протозойных инфекций.
Протозойные инфекции человека[править | править код]
Амебиаз[править | править код]
Амебиазом страдает около 10% населения; ежегодно им заболевают около 50 млн человек, из которых около 100 000 умирают. Случаи заражения амебиазом в США довольно редки, его распространенность среди населения составляет 2—4%. Чаще всего амебиаз встречается в малообеспеченных слоях населения и в перенаселенных закрытых учреждениях, где не соблюдаются правила гигиены. От инфицированных лиц выделены два штамма Entamoeba spp. (Entamoeba histolytica и Entamoeba dispar), которые морфологически одинаковы, но различаются по генетическим и биохимическим признакам. Из двух видов заболевание вызывает только Entamoeba histolytica (10% случаев), при заражении Entamoeba dispar (90% случаев) развивается носительство. Кроме человека, другие хозяева для этих простейших не известны. Единственный механизм передачи — фекально-оральный. Заражение происходит при попадании в организм цист из загрязненной калом воды или пищи. Цисты выдерживают высокую кислотность желудочного содержимого и в тонкой кишке превращаются в трофозоитов, которые обычно входят в состав нормальной микрофлоры толстой кишки: здесь они образуют новые цисты, не причиняя вреда организму. Однако примерно в 1% случаев трофозоиты Entamoeba histolytica поражают слизистую кишечника и вызывают амебный колит разной степени тяжести (от легкого до тяжелого), который может быть как острым, так и хроническим. В ряде случаев развивается внекишечный амебиаз с образованием абсцессов в печени (реже, в головном мозге и в других органах) и общими симптомами (Ravdin, 1995).
Лекарственные средства, используемые для лечения амебиаза, можно разделить на три группы: просветные (прямые) амебоциды, тканевые амебоциды и универсальные амебоциды. Просветные амебоциды действуют только на просветные формы амеб. К препаратам этой группы относятся дилоксанид, дийодгидроксихинолин и паромомицин (аминогликозид, который плохо всасывается в ЖКТ). Их применяют при носительстве и легком кишечном амебиазе, а также после амебоиидов других групп — для уничтожения цист возбудителя. Тканевые амебоциды — дегидроэметин и хлорохин — действуют только на возбудителей, находящихся в тканях. Эти препараты назначают при тяжелом амебном колите (дегидроэметин) или амебном абсцессе печени (дегидроэметин или хлорохин), но только в том случае, если другие препараты не действуют или вызывают тяжелые побочные эффекты. Универсальные амебоциды — в первую очередь метронидазол (производное нитроимидазола) — эффективны и при кишечном, и при внекишечном амебиазе. Появление метронидазола и его аналогов тинидазола и орнидазола стало крупным достижением в лечении амебиаза (в США выпускается только метронидазол). Метронидазол хорошо всасывается, и его концентрация в толстой кишке может быть ниже терапевтической, поэтому он наиболее эффективен при внекишечном амебиазе. При тяжелом кишечном амебиазе метронидазол можно применять в сочетании с антибиотиками (например, паромо-мицином или тетрациклином). После метронидазола обычно назначают какой-либо просветный амебоцид для уничтожения цист. При носительстве, то есть бессимптомном выделении цист, определяют антигены Entamoeba spp. в кале (Haque et al., 1998) и при выявлении Entamoeba histolytica назначают просветные амебоциды. Если провести такое исследование и исключить заражение Entamoeba histolytica невозможно, также назначают просветные амебоциды (World Health Organization, 1997).
Лямблиоз[править | править код]
Возбудитель лямблиоза — жгутиковое простейшее Giardia lambiia. Это заболевание распространено повсеместно; в США из протозойных кишечных инфекций оно встречается чаше других (Farthing, 19%). В большинстве случаев лямблиоз протекает бессимптомно, но может проявляться преходящим или хроническим поносом. Заболевание может носить спорадический или эпидемический характер. Лямблиоз следует предположить, если понос без примеси крови продолжается 2 нед и больше. При лямблиозе может нарушаться всасывание, что проявляется стеатореей и потерей веса. При гипогаммаглобулине-мии инфекция может представлять угрозу для жизни. Заражение происходит при попадании в организм цист возбудителя — чаще всего из загрязненной калом воды или пиши. Хотя некоторые виды млекопитающих могут служить резервуарами Giardia lambiia, наличие промежуточного хозяина необязательно. Передача возбудителя от человека к человеку часто происходит в детских садах и яслях, закрытых учреждениях и среди гомосексуалистов. Цисты длительное время сохраняются в холодной воде, поэтому туристы могут заразиться, употребляя некипяченую воду из естественных источников. Местные вспышки лямблиоза возникают, как правило, вследствие попадания цист в системы водоснабжения. В верхних отделах тонкой кишки из цист выходят подвижные трофозоиты, которые, однако, не обязательно вызывают заболевание. Диагноз лямблиоза устанавливают при обнаружении цист или трофозоитов в кале либо трофозоитов в содержимом двенадцатиперстной кишки. Обычно эффективен прием метронидазола внутрь в течение 5 сут, хотя в ряде случаев может потребоваться повторный или более длительный курс лечения. Однократный прием тинидазола — аналога нитроимидазола, применяемого за пределами США, по-видимому, еще более эффективен, чем лечение метронида-золом. Детям часто назначают фуразолидон: он несколько менее эффективен, но его выпускают в жидкой лекарственной форме с приятным вкусом. Беременным назначают паромомицин — аминогликозид, который плохо всасывается в ЖКТ и потому не оказывает мутагенного действия. Как ни странно, единственный разрешенный ФДА препарат для лечения лямблиоза в США — фуразолидон (Ortega and Adam, 1997).
Трихомоноз[править | править код]
Возбудитель трихомоноза — жгутиковое простейшее Trichomonas vaginalis. Этот микроорганизм паразитируете мочевых путях и половых органах. Он вызывает вагинит у женщин и уретрит (впрочем, нечасто) — у мужчин. Заражение происходит половым путем. В мире трихомонозом ежегодно заражаются свыше 200 млн человек. В США каждый год заражаются по крайней мере 3 млн женщин, причем трихомоноз наиболее распространен среди лиц, ведущих беспорядочную половую жизнь (Heine and McGregor, 1993). В выделениях из влагалища обнаруживаются лишь трофозоиты Trichomonas vaginalis. Подтвержденные случаи трихомоноза успешно излечиваются мет-ронидазолом. Наиболее частые причины его неэффективности — несоблюдение схемы лечения или повторное заражение от не-леченного партнера, у которого инфекция протекает бессимптомно. Однако в последнее время от больных все чаше выделяют штаммы Trichomonas vaginalis, устойчивые к метронидазолу, и не исключена вероятность их повсеместного распространения (Sobel et al., 1999). За пределами США для лечения трихомоноза предпочитают применять аналоги нитроимидазола, например тинидазол. Но и к этим препаратам развивается устойчивость, поэтому ведутся испытания других средств (в частности, паромомицина для интравагинального введения).
Токсоплазмоз[править | править код]
Токсоплазмоз — это зоонозная инфекция, возбудителем которой служит облигатный внутриклеточный паразит Toxoplasma gondii (Wong and Remington, 1993). Это заболевание распространено по всему миру. Хотя природными хозяевами паразита служат домашние кошки и другие представители семейства кошачьих, цисты (цистоюиты) выделены от всех изученных видов млекопитающих. Основные пути заражения человека: I) употребление в пишу непроверенного или недожаренного мяса, содержащего цисты, 2) употребление зелени и овощей, загрязненных почвой, в которой содержатся ооцисты, 3) попадание ооцист из фекалий больных токсоплазмозом кошек, 4) трансплацентарная передача плоду эндозоитов от инфицированной матери.
У лиц с нормальным иммунитетом симптомы возникают лишь в 10—20% случаев заражения. В то же время в США серопозитивны около 70% взрослого населения. При нормальном иммунитете острый токсоплазмоз обычно проходит без лечения. Врожденный токсоплазмоз (как правило, в виде хориоретинита) может проявиться даже через IS—20 лет. Лица с нарушенным иммунитетом предрасположены к токсоплазменному энцефалиту, который обусловлен выходом цистозоитов из цист непосредственно в головном мозге. Токсоплазменный энцефалит — основная причина смерти у больных СПИДом, и именно для этой группы больных разработка эффективных методов лечения токсоплазмоза стоит особенно остро. Лечение токсоп-лазменного энцефалита начинают с антагонистов фолиевой кислоты пириметамина и сульфадиазина — во избежание рецидивов эти препараты назначают на длительный срок (Georgiev, 1994). Однако примерно в 50% случаев лечение приходится прерывать из-за токсичности (главным образом, сульфадиазина). В таких случаях сульфадиазин чаще всего заменяют на клинда-мицин, хотя, поданным предварительных испытаний, сходный эффект дают и другие антимикробные препараты (например, спирамицин и триметрексат). Атоваквон, действующий как на эндозоиты, так и на цисты Toxoplasma gondii, переносится лучше пириметамина и сульфадиазина, но может быть не столь эффективным (Torres etal., 1997;см. также гл. 40). Поскольку спирамицин накапливается в плаценте, его рекомендуют применять при токсоплазмозе у беременных (в первые 20 нед беременности) для снижения риска врожденного токсоплазмоза. На более поздних сроках беременности либо продолжают лечение спирамицином, либо заменяют его пириметамином и суль-фадиазином (Georgiev, 1994).
Криптоспоридиоз[править | править код]
Кокцидии рода Cryptosporidium обнаружены у млекопитающих, рыб, птиц и пресмыкающихся. Патогенность кокцидий для человека установлена в 1976 г. У человека и домашних животных эти простейшие могут вызывать тяжелый водянистый понос (Griffiths, 1998). Заразные ооцисты, выделяемые с калом, могут передаваться как непосредственно от человека к человеку, так и через загрязненные источники водоснабжения. Именно последний путь передачи характерен для эпидемических вспышек криптоспоридиоза. В группу риска входят путешественники, дети в детских садах, гомосексуалисты, лица, работающие с животными (дрессировщики, ветеринары), и медицинские работники. Криптоспоридиозу особенно подвержены лица со сниженным иммунитетом. Заражение происходит при проглатывании зрелых ооцист возбудителя. В кишечнике их оболочка разрушается, высвобождая спорозоитов, которые внедряются в эпителий кишки. Впрочем, в цитоплазму клеток они не проникают, задерживаясь у апикальной мембраны энтероцитов. В большинстве случаев заболевание не требует никакого лечения. Однако на фоне иммунодефицита (в частности, при СПИДе) криптоспоридиоз проявляется профузным секреторным поносом, и во избежание тяжелых электролитных нарушений и обезвоживания больных госпитализируют и проводят симптоматическое лечение. При хроническом крипто-споридиозе на фоне СПИДа иногда назначают паромомицин в сочетании с азитромицином (Sniuh et al.. 1998). Однако действительно эффективных средств для лечения криптоспоридиоза пока нет.
Трипаносомозы[править | править код]
Сонная болезнь (африканский трипаносомоз)[править | править код]
Это заболевание вызывают жгутиковые простейшие, относящиеся к виду Trypanosoma brucei. Они переносятся кровососущими мухами рода Glossina (муха це-це). Возбудители встречаются в Центральной, Западной и Восточной Африке, где они вызывают болезнь скота (нагана). У человека в отсутствие лечения заражение часто приводит к смертельному исходу. Благодаря строгим профилактическим мерам, уничтожению мух и раннему началу лечения распространение сонной болезни к началу 1960-х гг. сократилось до минимума. Однако из-за ослабления профилактических мер, массовой миграции населения и социальных потрясений в связи с вооруженными конфликтами в 1990-х гг. заболеваемость вновь резко выросла. По оценкам, среди жителей Африки носителями Тrypanosoma brucei являются 300—500 млн человек. Среди жителей США, возвращающихся из Африки, случаи носительства довольно редки. Заболеванию предшествует диссеминация возбудителя по всему организму. Ранняя, или гематмфатическая, стадия сонной болезни, когда поражения ЦНС еще нет, характеризуется лихорадкой, увеличением лимфоузлов, спленомегалией и, в ряде случаев, миокардитом. Вовлечение в патологический процесс ЦНС знаменует позднюю, или менинго'знцефалитическую, стадию заболевания. Возбудителями родезийской (восточноафриканской) и гамбийской (западноафриканской) форм сонной болезни служат два подвида возбудителя — соответственно Тrypanosoma brucei rhodesiense и Trypanosoma brucei gambiense. При заражении Trypanosoma brucei rhodesiense рано возникает поражение ЦНС, заболевание быстро прогрессирует и обычно заканчивается смертью от сердечной недостаточности. Гамбийская форма протекает не столь быстро, а нарушения со стороны ЦНС появляются позже. Многие десятилетия для лечения сонной болезни применяют одни и те же стандартные препараты — сурамин, пентамидин и меларсопрол. Их вводят в/в в течение длительного времени, но в некоторых случаях они оказываются неэффективны. Кроме того, все три препарата токсичны (Рёрхп and Milord, 1994). На менингоэнцефалитической стадии эффективен только меларсопрол, но в 10% случаев он вызывает лекарственную энцефалопатию, приводящую к смерти. В последнее время все чаще отмечается устойчивость к этому препарату. Несмотря на то что у Тrypanosoma brucei выявлено множество молекулярных мишеней и экспериментально установлена эффективность целого ряда новых препаратов, лишь немногие из них нашли применение на практике (Wang, 1995,1997). Один из таких препаратов — эфлорнитин — необратимо ингибирует орнитиндекарбоксилазу (ключевой фермент метаболизма полиаминов у простейших). Этот препарат, который вначале разрабатывали как противоопухолевое средство, оказался весьма эффективен как на гемолимфатической, так и на менингоэнцефалитической стадиях гамбийской формы сонной болезни, иногда даже у больных, которым не помогло лечение меларсопро-лом. Однако при в/в введении в высокой дозе и затем при приеме внутрь в течение нескольких недель примерно в 40% случаев эфлорнитин давал серьезные побочные эффекты. Кроме того, этот препарат дорог и малоэффективен при лечении родезийской формы сонной болезни (см. ниже, «Эфлорнитин»). Таким образом, широкое его применение представляется маловероятным (P6pin and Milord, 1994).
Болезнь Чагаса (американский трипаносомоз)[править | править код]
Это зоонозная инфекция, вызываемая Trypanosoma cruzi. На пространстве от Южной Калифорнии до Аргентины и Чили болезнью Чагаса поражены около 24 млн человек (Tanowitzet al., 1992; KirchhofT, 19%), причем хроническая форма инфекции у взрослых служит важнейшей причиной дилатационной кардиомиопатии. мегаэзофагуса. мегаколона и смерти. Дети чаше всего заражаются при укусах кровососущих триатомовых клопов (Triatoma spp.), обитающих в бедных сельских постройках. В эндемических районах возбудитель может передаваться трансплацентарно. В месте внедрения возбудителя появляется плотный выступающий над кожей болезненный инфильтрат (чагома). Возможны также лихорадка, увеличение регионарных лимфоузлов, сыпь и гепа-госпленомегапия. В редких случаях возникает острый миокардит и наступает смерть. Заразные трипомастиготы содержатся в экскрементах клопов. При попадании экскрементов на поврежденную кожу и слизистые трипомастиготы внедряются в клетки (особенно в макрофаги), где превращаются в амастигот. Амастиготы активно размножаются и вновь превращаются в трипомастигот. которые попадают в кровоток, а затем внедряются в новые клетки или заглатываются клопом при питании кровью хозяина. Вне клеток Trypanosoma cruzi не размножаются. Острая стадия обычно разрешается за несколько недель или месяцев, и в течение ряда лет инфекция может протекать бессимптомно, лишь время от времени возникает паразитемия. При этом существует опасность передачи возбудителя при переливании крови или заражения сотрудников лаборатории. Со временем болезнь переходит в хроническую стадию, для которой наиболее характерно поражение сердца и ЖКТ. Некоторые штаммы Trypanosoma cruzi обладают особой тропностью к мышечной и нервной ткани, вызывая постепенное разрушение кардиомиоцитов и нейронов межмышечного сплетения кишечника. Участие какого-либо аутоиммунного процесса в патогенезе болезни Чагаса остается под вопросом, особенно в свете недавнего исследования, которое выявило Trypanosoma cruzi в пораженных участках миокарда (Urbina, 1999). Несомненно, однако, что иммунитет (особенно клеточный) играет важную роль в развитии заболевания. Для лечения применяются два препарата — нифуртимокс (относится к нитрофуранам) и бензнидазол (относится к нитроимидазолам). Нифуртимокс распространяется Центром по контролю заболеваемости США. Оба препарата снижают уровень паразитемии и даже могут излечить болезнь Чагаса в острой стадии, но в хронической стадии они действуют намного слабее (Kirchhoff, 1996). И тот, и другой токсичны, но принимать их надо в течение длительного времени. В природе разные штаммы возбудителя различаются по чувствительности к этим препаратам, а в лабораторных условиях могут быть получены устойчивые штаммы. Механизмы действия нифуртимокса и бензнидазола и возникновения к ним устойчивости до конца не изучены, известно лишь, что оба препарата способствуют образованию в клетке свободных радикалов. Несмотря на молекулярные мишени Trypanosoma cruzi, пригодные для лекарственного воздействия, новые препараты для лечения болезни Чагаса разрабатываются медленно — главным образом из-за недостатка финансирования (Urbina, 1999). Вместе с тем в Бразилии, Чили и Венесуэле удалось значительно снизить заболеваемость за счет уничтожения переносчиков и улучшения жилищных условий в сельских районах (World Health Organization, 1999).
Лейшманиозы[править | править код]
Это группа заболеваний, вызываемых облигатными внутриклеточными паразитами — простейшими рода Leishmania (около 20 видов). Лейшманиозы — типичные трансмиссивные инфекции. Резервуаром ее служат представители семейства псовых и мелкие млекопитающие, а переносчиком — москиты рода Phlebotomus (около 30 видов). Лейшманиозы распространены на юге Европы и во многих природных зонах тропиков и субтропиков. В организм человека паразит попадает в виде внеклеточных жгутиковых форм (промастигот) во время кровососания. Промастиготы прикрепляются к рецепторам В макрофагов и фагоцитируются ими. Внутри фаголизосом промастиготы превращаются в амастигот, которые размножаются и после разрушения макрофага захватываются другими макрофагами. Попавшие вместе с кровью в кишечник москита амастиготы вновь превращаются в промастигот, завершая жизненный цикл возбудителя. Течение заболевания и локализация инфекции зависят от вида и подвида возбудителя, распределения зараженных макрофагов в организме и особенно от иммунитета хозяина. Выделяют четыре основные клинические формы заболевания: кожный лейшманиоз, кожно-слизистый лейшманиоз, диффузный кожный лейшманиоз и висцеральный лейшманиоз (кала-азар). В настоящее время лейшманиоз считают одной из оппортунистических инфекций у больных СПИДом (Berman, 1997).
Классификация, клиническая картина, течение, иммунитет и выбор средств лечения различных форм лейшманиоза у человека подробно рассмотрены в обзоре Herwaldt (1999b), представлены также данные по биохимии возбудителя. За исключением кожного лейшманиоза, который обычно проходит самостоятельно, все остальные клинические формы требуют лечения. Препараты пятивалентной сурьмы для парентерального применения в большинстве случаев эффективны и безопасны. Назначают их в соответствии с эмпирически подобранными схемами. Недостатками являются необходимость длительного лечения и рост устойчивости лейшманий к препаратам сурьмы.
В последнее время снова стали применять амфотерицин В и пентамидин, которые из-за высокой токсичности прежде относили к препаратам второго ряда. Предложены новые лекарственные формы и новые схемы лечения этими препаратами. Так, в 1997 г. ФДА утвердило в качестве средства лечения висцерального лейшманиоза липосомный амфотерицин В (гл. 49). Теперь при висцеральном лейшманиозе именно липидные препараты амфотерицина В рассматривают в качестве препаратов первого ряда; особенно полезными они могут оказаться при неэффективности препаратов сурьмы или их плохой переносимости в ходе длительных курсов парентерального введения (Meyerhoff, 1999; Herwaldt, 1999b). Для лечения висцерального лейшманиоза применяли также аминогликозид паромомицин в/в или в/м — в Индии в виде монотерапии, а в других странах в сочетании с препаратами пятивалентной сурьмы. Так как амастиготы лейшманий размножаются в покоящихся макрофагах, но погибают при их активации, в качестве вспомогательного средства применяют иммуномодуляторы (в том числе интерферон у п/к). Решающую роль в защите от лейшманий играет клеточный иммунитет — особенно Т-хелперы типа 1. Именно из-за нарушения клеточного иммунитета лейшманиоз плохо поддается лечению ичасторецидивируетубольныхСПИДом идругими иммунодефицитами. Препаратов для приема внутрь, которые были бы высокоэффективны прилейшманиозах, пока не существует (Herwaldt, 1999а), но имеются экспериментальные данные в пользу ряда соединений, нарушающих биосинтез липидов у лейшманий (Urbina, 1999).
Другие протозойные инфекции[править | править код]
Из множества не столь распространенных протозойных инфекций здесь рассматриваются лишь отдельные заболевания. Подробнее об этих заболеваниях и их лечении см. в соответствующих главах руководства Harrison’s Principles of Internal Medicine, 14th ed., McGraw-Hill, New York, 1998 (русск. пер. «Внутренние болезни по Тинсли Р. Харрисону», М., «Практика», 2002) и в специальном обзоре, посвященном анти паразитарным средствам (Rosenblatt, 1999).
Бабезиоз — протозойная инфекция животных, переносчиками которой служат иксодовые клещи. Так как возбудители (Babesia microcoti и Babesia divergens) проникают в эритроциты, а заболеванию сопутствуют лихорадка, гемолиз и гемоглобину-рия, на первый взгляд бабезиоз напоминает малярию. Обычно он протекает в легкой форме и не требует лечения, но при гипоспленизме и тяжелом иммунодефиците он может протекать очень тяжело и даже приводить к смерти. Для лечения бабезио-за у экспериментальных животных и ряда больных был эффективен азитромицин в сочетании с хинином или атоваквоном (гл. 40). Хлорохин при бабезиозе неэффективен.
Протозойные кишечные инфекции могут особенно тяжело протекать на фоне иммунодефицита, например у больных СПИДом. Криптоспоридиоз у таких больных лечится с трудом. Лучше поддаются лечению другие кокцидиозы, в частности изоспориаз и циклоспориаз. Так, при поносе, вызванном Isospora belli, у больных СПИДом оказался эффективен триметоприм/сульфаметоксазол. Однако может потребоваться длительная поддерживающая терапия, которая все же не исключает рецидивы. При непереносимости сульфаниламидов назначают пириметамин. Триметоприм/сульфаметоксазол эффективен также при инфекциях, вызванных Cyclospora cayatensis, которые у путешественников и больных СПИДом часто сопровождаются хроническим или рецидивирующим поносом. Лица, выезжающие в тропики, и больные иммунодефицитами нередко страдают микроспоридиозом — инфекцией, вызываемой Microsporidiaspp. При нормальном иммунитете заболевание протекает в легкой форме, но на фоне иммунодефицита часто возникает понос. Для лечения применяют антигельминт-ный препарат альбендазол (производное бензимидазола; гл. 42), эффективность которого зависит от вила микроспоридий. Иногда его применяют в сочетании с фуразолидоном. Балантидиаз (возбудитель — Balantidium coli) поражает толстую кишку. Заболевание можно спутать с амебиазом. Олнако, в отличие от аме-биаза, балантидиаз обычно поддается лечению тетрациклином.
Производные 8-гидроксихинолина[править | править код]
Синтезированы и применяются в качестве просветных амебоцидов (при носительстве) ряд галогенсодержащих производных 8-гидроксихинолина. В сочетании с метронидазол ом их применяют также для лечения кишечного амебиаза. Наиболее известны из них дийодгидроксихинолин и клиохинол (в США клиохинол выпускают только для местного применения). Производные 8-гидроксихинолина широко и часто без разбора использовались для лечения поноса. К сожалению, эти препараты — особенно при длительном лечении в дозе свыше 2 г/сут — далеко не безопасны. Самое тяжелое осложнение (в первую очередь клио-хинола) — подострая миелооптическая нейропатия. Это сходное с миелитом заболевание впервые описано в Японии, где оно приняло характер эпидемии (тысячи заболевших). В других странах отмечались лишь спорадические случаи, однако его распространенность наверняка недооценивается. Менее тяжелое проявление нейротоксичности производных 8-гидроксихинолина — полинейропатия. При лечении хронического поноса у детей высокими дозами дийодгидроксихинолина отмечались случаи атрофии зрительного нерва и необратимой слепоты. Вместе с тем дийодгидроксихинолин хуже всасывается и, возможно, поэтому считается менее опасным, чем клиохинол. В США дийодгидроксихинолин все еше продают под торговой маркой «Йодоксин». Но применять его рекомендуют в исключительных случаях, отдавая предпочтение более безопасному просветному амебоциду дилоксаниду. Более того, дийодгидроксихинолин нужно принимать в течение 20 сут, а дилоксанид — лишь 10 сут.
Дилоксанид[править | править код]
Историческая справка[править | править код]
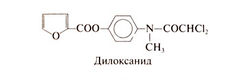
Производное дихлорацетамида дилоксанид было найдено в ходе исследования амебоцидного действия замешенных ацетанилидов. В опытах на крысах было установлено, что из многих соединений эфир дилоксанида и фурано-вой кислоты заметно активнее самого дилоксанида (Main et al., 1960). Именно эфир дилоксанида вошел в практику под названием дилоксанид; клинические испытания доказали его эффективность при остром кишечном амебиазе. В США этот препарат не выпускается. Структурная формула дилоксанида следующая:
Антипротозойное действие[править | править код]
In vitro дилоксанид оказывает прямое амебоцидное действие. Он намного активнее эметина гидрохлорида и действует в концентрации 0,01 —0,1 мкг/мл. Механизм действия не ясен.
Фармакокинетика[править | править код]
В просвете и в слизистой кишечника эфир дилоксанида гидролизуется с образованием собственно дилоксанида и фурановой кислоты, причем в кровоток поступает только дилоксанид. У экспериментальных животных за 48 ч с мочой выводятся 60—90% дилоксанида (главным образом в виде глюкуронида), причем основная часть — в первые 6 ч. С калом выводятся 4—9% дозы. Сывороточная концентрация дилоксанида достигает максимальной через час после приема, но уже через 6 ч она значительно снижается.
Применение[править | править код]
Дилоксанид в виде монотерапии действе-нен при бессимптомном выделении цист (Krogstad et al.,1978). Применяются также дийодгидроксихинолин и паромомицин (Anonymous, 1998). Монотерапия дилоксанидом при внекишечном амебиазе неэффективна, а ее результаты при остром амебном колите с кровью в кале сомнительны (Suchaket al., 1962). Поданным клинических испытаний, дилоксанидом хорошо излечиваются бессимптомное выделение цист или трофозоитов (носительство), а также стертые и легкие формы кишечного амебиаза, когда в кале не обнаруживают примеси слизи и крови (Wolfe, 1973). При внекишечном амебиазе препарат назначают либо в сочетании с тканевыми или универсальными амебоцидами, либо после них.
Дилоксанид принимают внутрь. Рекомендуемая доза для взрослых — 500 мг 3 раза в сутки в течение 10 сут. При необходимости курс можно продлить до 20 сут. Детям назначают 20 мг/кг/сут в 3 приема в течение 10 сут. Побочные эффекты. Как правило, дилоксанид хорошо переносится, а побочные эффекты незначительны. Чаще всего отмечается метеоризм, реже — тошнота, рвота, понос, зуд и крапивница (Wolfe, 1973).
Меларсопрол[править | править код]
Историческая справка[править | править код]
В 1949 г. Фридхайм установил, что комплекс меларсеноксида с димеркаптопропанолом, названный им меларсопролом, эффективен на менингоэнцефалитической стадии сонной болезни. По сравнению с другими препаратами, применявшимися в то время, меларсопрол давал гораздо меньше побочных эффектов. И сейчас еще он остается препаратом первого ряда для лечения менингоэнцефалитической стадии сонной болезни.
Строение и форма выпуска[править | править код]
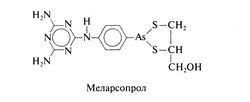
Структурная формула меларсопрола следующая:
Меларсопрол существует в виде смеси двух стереоизомеров в соотношении 3:1 (Ericsson et al., 1997). Он нерастворим в воде и выпускается в виде 3,6% раствора в пропиленгликоле для в/в введения. В США препарат можно получить только через Центр по контролю заболеваемости.
Антипротозойная активность[править | править код]
В организме из меларсопрола образуется активный метаболит меларсеноксид — органический оксид трехвалентного мышьяка (Albert, 1979). Оксиды мышьяка легко образуют обратимые связи с сульфгидрильными группами, расположенными у соседних атомов углерода (в том числе в молекулах белков), что вызывает инактивацию многих ферментов. Этот неспецифический механизм действия меларсопрола на трипаносом, по-видимому, обусловливает и повреждающее действие на ткани человеческого организма. В трипаносомах препарат активно накапливается; в этом процессе принимает участие мало изученный переносчик пуринов Р2 (Carter and Fairlamb, 1993; Barrett and Fair-lamb, 1999).
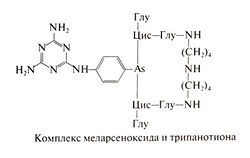
Механизм действия меларсопрола на трипаносом до конца не ясен: по-видимому, препарат обладает высокой реакционной способностью в отношении многих биологических молекул. Так, меларсопрол — мощный ингибитор пируваткиназы (Flynn and Bowman, 1969), и долгое время полагали, что его активность обусловлена подавлением гликолиза и нарушением энергетического обмена у трипаносом. Тем не менее некоторые данные указывают на второстепенную роль этого механизма (Van Schaftingen etal., 1987; EisenthalandComish-Bowden, 1998). Показано, что меларсопрол связывается с трипанотионом, который образуется из спермидина и глутатиона (Fairlamb et al., 1977). Трипанотион содержит дисульфидную связь и встречается только у простейших отряда Kinetoplastidae. Накапливаясь внутри трипаносом, восстановленный трипанотион выполняет функцию глутатиона. При взаимодействии меларсопрола с трипанотионом образуется комплекс меларсеноксида и трипанотиона. Этот комплекс служит мощным конкурентным ингибитором трипанотионредуктазы — фермента, необходимого для восстановления трипанотиона. Вместе с тем существование прямой связи между подавлением трипанотионредуктазы и гибелью паразитов пока не доказано (Barrett and Fairlamb, 1999).
Концентрации меларсопрола, вызывающие лизис чувствительных штаммов Trypanosoma brucei in vitro, составляют 0,5—10 мкмоль/л. Однако на штаммы, устойчивые к препаратам мышьяка, меларсопрол не действует даже в концентрации выше 100 мкмоль/л (Yarlett etal., 1991). Концентрация трипанотиона у устойчивых штаммов и чувствительных штаммов одинакова, но у устойчивых штаммов снижено поступление меларсопрола в клетку (Yarlett et al., 1991; Barrett and Fairlamb, 1999).
Устойчивость к меларсопролу может быть вызвана нарушением его захвата трипаносомами, в котором принимает участие выявленный у них переносчик пуринов Р2 (Carter and Fairlamb, 1993). Клонированы штаммы Trypanosoma brucei с перекрестной устойчивостью к препаратам мышьяка и пентамидину, что предполагает общий механизм захвата и накопления этих соединений (Barrett and Fairlamb, 1999).
Фармакокинетика[править | править код]
Меларсопрол назначают только в/в. В СМЖ попадает лишь небольшая часть препарата, но ее оказывается достаточно для уничтожения трипаносом в ЦНС. Меларсопрол быстро выводится, причем 70—80% препарата обнаруживается в кале (Рёрт and Milord, 1994).
Применение[править | править код]
Хотя меларсопрол действует и на гематоэн-цефалической стадии сонной болезни, из-за высокой токсичности его применяют лишь на менингоэнцефалитической стадии, при которой он остается единственным эффективным средством. При родезийской форме сонной болезни лечение начинают сразу после постановки диагноза, поскольку поражение ЦНС наступает очень быстро. Из-за побочных эффектов и быстрого выведения для профилактики трипаносомоза меларсопрол не применяют.
Устойчивость к меларсопролу зависит от подвида возбудителя. Так, при рецидиве родезийской формы, наступившем после курса лечения меларсопрол ом, эффективен повторный курс препарата. Напротив, при рецидиве гамбийской формы повторные курсы редко дают лечебный эффект. Таким больным можно назначить эфлорнитин, который эффективен только при данной форме (Рёрт and Milord, 1994).
Схемы лечения меларсопролом подбирались эмпирически более 40 лет назад, и с тех пор они почти не изменились (Рёрт and Milord, 1994). Меларсопрол вводят в/в медленно. При этом следует избегать попадания препарата на кожу и в мягкие ткани, так как он оказывает сильное раздражающее действие. Схемы лечения довольно сложны, а узкий терапевтический диапазон меларсопрола крайне затрудняет индивидуальный подбор дозы; если она будет слишком низкой, лечение может оказаться безрезультатным, а слишком высокая доза может вызвать лекарственную энцефалопатию (у 4—10% больных). Так, больным с менингоэнцефалитической стадией и при лихорадке до начала лечения меларсопролом назначают сурамин из расчета 5, 10 и 20 мг/кг/сут в/в на 1, 3 и 5-е сутки соответственно. Затем назначают меларсопрол в возрастающих дозах: 0,36,0,72 и 1,1 мг/кг/сут на 7, 8 и 9-е сутки соответственно; 1,8 мг/кг/сут на 16, 17 и 18-е сутки; 2,2, 2,9 и 3,6 мг/кг/сут на 25, 26 и 27-е сутки соответственно; и, наконец, 3,6 мг/кг/сут на 34, 35 и 36-е сутки так, чтобы к концу последнего, четвертого, курса максимальная суточная доза достигла 180 мг. При более легком течении сонной болезни курс может быть короче, но дозы будут выше: сурамин, 5 и 10 мг/кг/сут в/в на 1-е и 3-и сутки; затем три курса меларсопрола, 1,4,1,8 и 2,2 мг/кг/сут на 5, 6 и 7-е сутки; 2,5, 2,9 и 3,3 мг/кг/сут на 14,15 и 16-е сутки и 3,6 мг/кг/сут на 23,24 и 25-е сутки так, чтобы к концу третьего курса максимальная суточная доза составила 180 мг. Детям и ослабленным больным назначают меньшие дозы. В отсутствие противопоказаний за 48 ч до введения сурамина назначают глюкокортикоиды — это снижает риск лекарственной энцефалопатии. Хотя 80—90% больных излечиваются, описанные схемы сложны и трудновыполнимы. Дополнительные фармакокинетические исследования показали, что курсы лечения можно сократить, а дозы уменьшить без ущерба для лечения. Напомним, что при рецидиве гамбийской формы сонной болезни назначают эфлорнитин, тогда как рецидивы родезийской формы часто излечиваются повторным курсом меларсопрола (Рёртand Milord,1994).
Побочные эффекты[править | править код]
Меларсопрол часто дает побочные эффекты (Рёрт and Milord, 1994). Вскоре после введения препарата нередко возникает лихорадка, особенно при высоком уровне паразитемии. Но наиболее тяжело протекает поражение ЦНС. У 6% больных возникает лекарственная энцефалопатия — обычно между первым и вторым курсами меларсопрола. При родезийской форме сонной болезни она возникает чаще, чем при гамбийской. Риск энцефалопатии возрастает по мере роста цитоза и числа трипаносом в СМЖ (Рёрт et al., 1995). Из-за острого отека головного мозга возникают эпилептические припадки, быстро наступает кома. Иногда наблюдаются психические расстройства без неврологических нарушений. Лекарственная энцефалопатия может развиться на любой стадии сонной болезни и нередко приводит к смерти. Причины этого осложнения не известны. Возможно, оно не связано с токсичностью меларсопрола, а представляет собой иммунный ответ организма на антигены, поступающие в кровоток при массивной гибели трипаносом. Риск лекарственной энцефалопатии уменьшается при назначении меларсопрола в сочетании с преднизолоном. Преднизолон помогает также справиться с аллергическими реакциями, которые часто возникают во время второго и последующих курсов лечения меларсопролом. Прямым токсическим действием меларсопрола, скорее, объясняется нейропатия, возникающая у 10% больных. Нередко отмечаются повышение АД и поражение миокарда, но шок возникает редко. Часто развивается альбуминурия. Большое количество цилиндров в моче или признаки поражения печени могут потребовать снижения доз. У многих больных возникают схваткообразные боли в животе и рвота. Чтобы предупредить их появление, меларсопрол вводят медленно и натощак, больной при этом должен находиться в положении лежа. После введения препарата следует воздерживаться от приема пищи и лежать в течение нескольких часов.
Меры предосторожности и противопоказания[править | править код]
Лечение меларсопролом проводят только в больнице под наблюдением врача, чтобы в случае необходимости можно было вовремя скорректировать дозу. При выборе начальной дозы нужно учитывать данные клинического обследования — недостаточно просто рассчитать ее по весу больного. Лечение, начатое на фоне лихорадки, повышает риск лекарственной энцефалопатии. Введение меларсопрола больным проказой может спровоцировать лепрозную узловатую эритему. Не следует применять препарат во время эпидемии гриппа. У больных с дефицитом Г-6-ФД введение меларсопрола может стать причиной тяжелого гемолиза. Беременность не является противопоказанием для лечения меларсопролом.
Мепакрин[править | править код]
Мепакрин — это производное акридина, широко применявшееся во время Второй мировой войны для лечения малярии. Позже на смену ему пришли новые, более безопасные противомалярийные препараты (гл. 44), но мепакрин и сейчас остается весьма эффективным средством лечения лямблиоза — полное выздоровление наступает у 90% больных. Тем не менее в США мепакрин уже не выпускают. Фармакологические свойства мепакрина рассмотрены в 5-м и более ранних изданиях этой книги.
Метронидазол[править | править код]
Историческая справка[править | править код]
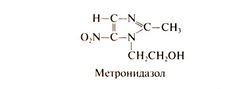
В 1953 г. Маеда и сотр. выделили из бактерий семейства Streptomycetaceae антибиотик азомицин (2-нитроимидазол), а чуть позже выяснилось, что он обладает активностью в отношении трихомонад (Ноле, 1956). Это положило начало синтезу и изучению биологической активности других производных нитроимидазола. Одно из полученных соединений — 1-(β-гидроксиэтил)-2-метил-5-нитроимидазол — известное теперь под названием метронидазол, оказалось особенно активным in vitro и in vivo в отношении анаэробных простейших Trichomonas vaginalis и Entamoeba histolytica (Cosaret al., 1961). Показано, что при приеме внутрь метронидазол уничтожает трихомонад в сперме и моче, а доля излеченных больных обоего пола весьма высока (Durel, I960). Метронидазол высокоэффективен при многих инфекциях, вызванных анаэробными гра-мотрицатсл ьными и грамположительными бактериями (см. ниже и Freeman et al., 1997), и при лямблиозе. За пределами США выпускают и другие производные 5-нитроимидазола, сходные построению и активности с метронидазолом. Среди них — ти-нидазол, секнидазол и орнидазол. Особое место в ряду 5-нитрои-мидазолов занимает бензнидазол, который эффективен при болезни Чагаса. Структурная формула метронидазола следующая:
Антипротозойная и антимикробная активность[править | править код]
Метронидазол и другие производные нитроимидазола in vitro высокоактивны в отношении многих анаэробных паразитов и бактерий. Метронидазол оказывает прямое действие на трихомонад. В анаэробных условиях чувствительные штаммы Trichomonas vaginalis погибают при концентрации метронидазола менее 0,05 мкг/мл. В присутствии даже 1% кислорода требуются большие концентрации препарата. Более высокие дозы метронидазола назначают и больным, у которых трихомоноз плохо поддается лечению. In vitro метронидазол высокоактивен в отношении Entamoeba histolytica, выращенных как отдельно, так и в смешанной культуре. In vitro в концентрации 1— 50 мкг/мл препарат уничтожает трофозоитов Giardia lambiia, по-видимому, оказывая на них прямое губительное действие. Новые возможности для синтеза 5-нитроими-дазолов открываются благодаря анализу структурно-функциональной зависимости, то есть поиску соединений, строение которых отвечает заданной антипротозойной активности (Upcroft et al., 1999). Помимо нитрогруппы в положении 5 имидазольного кольца существенное влияние на активность препаратов оказывают заместители в положении 2, которые усиливают сопряжение в кольце. Особенно сильно возрастает антипротозойная активность при введении лактамных заместителей. Напротив, появление ацильной группы в положении 2 нитроимида-зольного кольца нарушает сопряжение и снижает антипротозойную активность соединения.
Метронидазол обладает антимикробной активностью в отношении всех анаэробных кокков, анаэробных грам-отрицательных палочек (в том числе Bacteroides spp.) и спорообразующих анаэробных грамположительных палочек. Устойчивость к препарату часто проявляют неспорообразующие грамположительные палочки, а также аэробные и факультативные анаэробные бактерии.
Метронидазол показан при трихомонозе, амебиазе и лямблиозе, а также целом ряде инфекций, вызванных облигатными анаэробными бактериями (в том числе Bacteroides spp., Clostridium spp. и Helicobacter spp.). При дракункулезе препарат может облегчить удаление паразита, хотя прямого действия на Dracunculus medinensisoH не оказывает (гл. 42).
Механизм действия и устойчивость[править | править код]
Сам по себе метронидазол неактивен. Он активируется при восстановлении нитрогруппы чувствительными микроорганизмами. Избирательность его действия на анаэробных и микроаэрофильных паразитов (в частности, на лишенных митохондрий простейших Trichomonas vaginalis, Entamoeba histolytica и Giardia lambiia и некоторых анаэробных бактерий) обусловлена особенностями энергетического обмена, которыми они отличаются от аэробных организмов (Land and Johnson, 1997; Samuelson, 1999; Upcroft and Upcroft,1999). У перечисленных микроорганизмов роль переносчиков электронов играют ферредоксины — небольшие белки, содержащие атомы железа и серы и обладающие высокой восстановительной способностью. В результате переноса электрона с ферредоксина на метронидазол образуется высокоактивный свободный радикал нитро группы N0, который повреждает ДНК чувствительного микроорганизма, а возможно, и другие жизненно важные молекулы. При переносе электрона с NO на ДНК активный метаболит окисляется, превращаясь в метронидазол, готовый вновь вступить в цикл. Кислород служит акцептором электронов как с ферредоксина, так и с NO-радикала. Поэтому чем выше концентрация кислорода в среде, тем меньше образуется активного метаболита и тем быстрее он превращается в неактивный метронидазол. Электроны, необходимые для восстановления ферредоксина, образуются при декарбоксилировании пирувата под действием пируватсинтазы.
От больных выделены устойчивые к метронидазолу штаммы Trichomonas vaginalis, Giardia lambiia и ряда анаэробных бактерий. У Entamoeba histolytica устойчивости пока не отмечено. Устойчивость к 5-нитроимидазолам in vitro активно изучали на трихомонадах; данных же о Giardia lambiia и об амебах относительно HeMHoro(LandandJohnson, 1997; Samuelson, 1999; Kulda, 1999; Upcroft and Upcroft, 1999; Wassmann et al., 1999). При исследовании в аэробных условиях устойчивых штаммов Trichomonas vaginalis, выделенных от больных, выявлено два типа аномалий. С одной стороны, такие штаммы хуже связывают свободный кислород, а, как уже говорилось, повышение его концентрации замедляет образование активного метаболита и ускоряет его «бесполезный» (без повреждения макромолекул микроорганизма) переход в неактивный метронидазол (Yarlett et al., 1986). С другой стороны, у них снижены концентрации пируватферредоксиноксидоредуктазы и ферредоксина (за счет замедления транскрипции его гена) (Quon et al., 1992). Тем не менее оба белка в какой-то мере сохраняют свои функции, поэтому трихомоноз, вызванный устойчивыми штаммами, как правило, излечивается высокими дозами метронидазола или при более длительных курсах лечения (Johnson, 1993). InvitroyaMe6 и трихомонад, обработанных метронидазолом, выявлены и другие механизмы устойчивости, но реализуются ли они in vivo, не известно (Brown et al., 1999; Wassmann et al., 1999).
Фармакокинетика[править | править код]
Фармакокинетические свойства метронидазола и двух его основных метаболитов хорошо изучены (Lamp et al., 1999). Существуют препараты метронидазола для приема внутрь, в/в введения и местного применения. После приема внутрь он обычно быстро и почти полностью всасывается. После однократного приема 500 мг метронидазола для достижения сывороточной концентрации 8—13 мкг/мл требуется от 15 мин до 4 ч (на большинство чувствительных организмов метронидазол действует в концентрации 8 мкг/мл и менее). В диапазоне доз от 200 до 2000 мг сывороточная концентрация препарата линейно возрастает с увеличением дозы. При назначении 3—4 раза в сутки метронидазол накапливается в организме; его системный клиренс зависит от дозы. Т метронидазола составляет около 8 ч, а его объем распределения приближается к общему содержанию воды в организме. С белками плазмы связывается менее 20% препарата. За исключением плаценты, метронидазол хорошо проникает во все ткани и жидкости (в том числе во влагалищное отделяемое, сперму, слюну и молоко). В СМЖ также достигается терапевтическая концентрация препарата.
С использованием меченого метронидазола показано, что при приеме внутрь свыше 75% препарата выводится с мочой, причем в неизмененном виде лишь около 10%, а остальное — в виде метаболитов. Более 50% метронидазола подвергается метаболизму в печени. За счет окисления боковых цепей образуются гидроксилированный метаболит и кислота — два основных метаболита метронидазола. Гидроксилированный метаболит дольше остается в кровотоке (Т1/2 около 12 ч) и в 2 раза менее активен в отношении трихомонад, чем сам метронидазол. Обнаружены также конъюгаты метронидазола с глюкуроновой кислотой. Под действием микрофлоры кишечника образуются небольшие количества восстановленных метаболитов, в том числе возникающих при разрыве имидазольного кольца. Окрашенные производные метронидазола с неустановленной структурой могут придавать моче красновато-бурый оттенок. Ряд препаратов (фенобарбитал, преднизолон, рифампицин и, возможно, этанол) могут усиливать окисление метронидазола. Циметидин, по-видимому, подавляет метаболизм метронидазола в печени.
Применение[править | править код]
Использованию метронидазола в качестве антипротозойного средства посвящено несколько обзоров (Freeman etal., 1997; Johnson, 1993; Ravdin, 1995; Zaat et al., 1997). Трихомоноз излечивается метронидазолом у 90% больных обоего пола. Обычно достаточно однократного приема 2 г препарата внутрь. При плохой переносимости большой дозы метронидазол назначают дробно по 250 мг 3 раза в сутки или по 375 мг 2 раза в сутки в течение недели. При недостаточной эффективности препарата или при рецидиве повторный курс лечения рекомендуется начинать не ранее чем через 4—6 нед. При этом до, во время и после повторного курса следует определять количество лейкоцитов в крови.
Метронидазол может оказаться неэффективным при бактериальном вагинозе, хронической инфекции желез Скина, больших желез преддверия или желез шейки матки. Еще одна причина неэффективности — повторное заражение от полового партнера. В последнее время безрезультатное лечение все чаще связано с устойчивостью Trichomonas vaginalis к метронидазолу. В большинстве случаев помогает назначение повторного приема метронидазола (2 г внутрь) больному и его половому партнеру. Кроме лекарственных форм для приема внутрь выпускаются также гель для местного применения, содержащий 0,75% метронидазола, и влагалищные свечи, содержащие 500 или 1000 мг препарата. Их применение повышает местную концентрацию метронидазола и способствует излечению особо упорных случаев трихомоноза (Heine and McGregor, 1993).
Метронидазол — эффективный амебоцид, применяемый при всех формах амебиаза. Рекомендуемая доза составляет 500—750мг внутрь Зраза в сутки в течение 10 сут. Детям назначают 35—50 мг/кг/сут в 3 приема в течение 10 сут. Поскольку после излечения острого амебиаза метронидазолом носительство Entamoeba histolytica в большинстве случаев продолжается, рекомендуют дополнительно назначить просветный амебоцид, например дилоксанид. Несмотря на широкое применение метронидазола, устойчивых к нему штаммов Entamoeba histolytica пока не выявлено. В ряде эндемических районов распространенность амебного колита удалось значительно снизить за счет медикаментозной профилактики среди населения: в течение нескольких месяцев высокую дозу метронидазола назначали 1 раз в месяц, а затем 1 раз в 2 мес.
Хотя метронидазол эффективен для лечения лямблиоза, ФДА пока не рекомендовало применять его при этом заболевании. Излечение наступает при приеме препарата в тех же или даже более низких дозах, что и при трихомонозе. Взрослым обычно назначают по 250 мг метронидазола 3 раза в сутки в течение 5 сут или 2 г/сут в течение 3 сут, детям — 15 мг/кг/сут в 3 приема в течение 5 сут.
Метронидазол — относительно недорогой препарат для лечения целого ряда анаэробных инфекций (Freeman etal., 1997). Его применяют при тяжелых инфекциях, вызванных Bacteroides spp., Clostridium spp., Fusobacteri-um spp., Peptococcus spp., Peptostreptococcusspp., Eubac-terium spp. и Helicobacter spp. При смешанных инфекциях, вызванных аэробными и анаэробными бактериями, метронидазол назначают вместе с другими антибактериальными средствами. Метронидазол хорошо проникает в ткани, и его концентрации в костях, суставах и головном мозге достигают терапевтических. Он эффективен при анаэробных инфекциях брюшной полости, женских половых органов, кожи и ЦНС, а также при бактериальном сепсисе и инфекционном эндокардите. При необходимости метронидазол можно назначать в/в. При тяжелых анаэробных инфекциях в/в введение метронидазола начинают с насыщающей дозы 15 мг/кг, а затем вводят поддерживающую дозу 7,5 мг/кг 4 раза в сутки обычно в течение 7—10 сут. В сочетании с другими антибактериальными средствами метронидазол эффективен для профилактики смешанных бактериальных инфекций в послеоперационном периоде (Song and Glenny, 1998). В сочетании с ингибиторами Н+,К+-АТФазы его применяют для лечения гастрита и язвенной болезни, вызванных Helicobacter pylori (Hopkins and Morris, 1994; Harris, 1998; Megraud and Doermann, 1998; гл. 37). При псевдомембранозном колите метронидазолом можно заменить более дорогой ванкомицин.
Метронидазол и другие нитроимидазолы повышают радиочувствительность опухолей с низким Р02, но в клинической практике это свойство не используется. Побочные эффекты, противопоказания и лекарственные взаимодействия. Побочные эффекты метронидазола описаны, например, в обзорах Roe (1977) и Lau et al. (1992). Чаше всего отмечаются головная боль, тошнота, сухость и металлический вкус во рту, реже — рвота, понос и боль в животе. Обложенность языка, глоссит и стоматит в ходе лечения метронидазолом обычно вызваны обострением кандидоза. Нейротоксическое действие метронидазола может проявляться дурнотой, головокружением и — изредка — энцефалопатией, эпилептическими припадками, нарушением координации движений и атаксией. В этих случаях, а также при онемении конечностей и парестезии лечение прерывают. Тяжелые сенсорные нейропатии могут длиться долго и не всегда полностью проходят. На повышенную чувствительность к препарату указывают крапивница, приливы и зуд — при этом лечение также следует прервать. Отмечались болезненное и учащенное мочеиспускание, чувство тяжести внизу живота. Метронидазол может вызвать антабусную реакцию, то есть при употреблении больными спиртных напитков во время или в течение 3 сут после приема препарата могут появиться боль в животе, рвота, приливы и головная боль. Вероятность тяжелой реакции невелика, но все же на время лечения рекомендуют воздержаться от алкоголя. По той же причине метронидазол не следует принимать одновременно с дисульфирамом — могут возникнуть психические нарушения и спутанность сознания. Хотя сходные с метронидазолом соединения могут вызвать гематологические нарушения, при приеме самого метронидазола описана только нейтропения, которая проходит при отмене препарата.
Из-за возможного нейротоксического действия при заболеваниях ЦНС метронидазол назначают с осторожностью. Прием метронидазола вместе с высокими дозами лития может вызвать литиевую интоксикацию с поражением ЦНС. Препараты, подавляющие микросомальные ферменты печени (например, циметидин), могут повысить сывороточную концентрацию метронидазола. У больных, принимающих варфарин. при одновременном приеме метронидазола может увеличиться ПВ. При тяжелом поражении печени дозу метронидазола уменьшают.
У грызунов в высоких дозах и при длительном применении метронидазол оказывает канцерогенное действие, а у бактерий обнаружено мутагенное действие (Lau et al., 1992). Мутагенным действием обладают и метаболиты метронидазола, выделенные из мочи больных, принимавших препарат в терапевтических дозах. Тем не менее данных, указывающих на канцерогенное действие метронидазола у человека, не получено. Относительно тератогенного действия метронидазола у животных результаты исследований неоднозначны. Препарат применяли на всех сроках беременности без каких-либо отрицательных последствий, но все же назначать его в 1 триместре не рекомендуется.
Нифуртимокс[править | править код]
Историческая справка[править | править код]
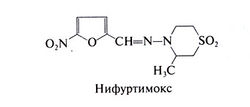
С тех пор как опыты на животных показали, что нитрофураны подавляют инфекцию, вызванную Trypanosoma cruzi, было исследовано множество сходных с ними по строению соединений. Одно из них — 3-метил-4(5'-нитрофурфурили-денамино)-тетрагидро-4Н-1,4-тиазин-1,1-диоксид — оказалось высокоэффективным для лечения острой стадии болезни Чагаса (Brener, 1979). Препарат получил название нифуртимокс. В настоящее время нифуртимокс в США больше не выпускают, и получить его можно только в Центре по контролю заболеваемости. Структурная формула нифуртимокса следующая:
Антипротозойная активность[править | править код]
Нифуртимокс действует и на трипомастигот, и на амастигот Trypanosoma cruzi. In vitro в концентрации 1 мкмоль/л он подавляет развитие амастигот (внутриклеточная стадия паразита). При длительном воздействии препарата в этой концентрации внутриклеточная стадия развития сильно затягивается. Трипомастиготы менее чувствительны к нифуртимоксу: в концентрации 10 мкмоль/л он замедляет, но не останавливает их внедрение в клетки позвоночных. Действие нифуртимокса на трипаносомы обусловлено его способностью образовывать свободный радикал N0 при частичном восстановлении нитрогруппы. При последующей потере электрона активная форма вновь превращается в нифуртимокс — при этом образуются свободные радикалы, в том числе супероксидный, гидроксильный и перекись водорода (Docampo, 1990). Фермент, катализирующий активацию нифуртимокса, пока не установлен, но, по некоторым данным, им может оказаться трипаноти-онредуктаза (Wang, 1997; Henderson et al., 1988). По-видимому, у Trypanosoma cruzi отсутствует механизм защиты от свободных радикалов (Docampo, 1990), которые вызывают перекисное окисление липидов, инактивируют ферменты, повреждают мембраны и ДНК паразита. Имеются данные, что подобным образом нифуртимокс может повреждать и клетки млекопитающих (Moreno et al., 1980).
Фармакокинетика[править | править код]
При приеме внутрь нифуртимокс хорошо всасывается, и его сывороточная концентрация достигает максимальной примерно через 3,5 ч (Paulos et al., 1989). Тем не менее из-за быстрой элиминации (Т1/2 около 3 ч) сывороточная концентрация нифуртимокса остается довольно низкой (10—20 мкмоль/л). С мочой выводится менее 0,5% принятой дозы. По-видимому, уже при первом прохождении через печень нифуртимокс превращается в метаболиты, высокие концентрации которых обнаруживаются в моче и сыворотке. Однако не известно, действуют ли эти соединения на трипаносомы.
Применение[править | править код]
Нифуртимокс применяют для лечения болезни Чагаса. Хотя препарат значительно снижает уровень паразитемии и вероятность смертельного исхода при острой стадии болезни Чагаса, на хронической стадии он почти неэффективен. Более того, нифуртимокс полностью уничтожает трипаносом лишь у половины больных, прошедших полный курс лечения. Препарат ничем не может помочь при необратимом поражении органов. Полагают, что дилатационная кардиомиопатия при хронической стадии заболевания может быть вызвана аутоиммунными нарушениями и никак не зависит от наличия трипаносом в организме, но это предположение пока не доказано (см. выше и Urbina, 1999). При острой стадии заболевания эффективность нифуртимокса в разных географических областях различна: штаммы Trypanosoma cruzi, распространенные в Аргентине, Венесуэле и на юге Бразилии, по-видимому, более чувствительны к препарату, чем те, что встречаются в центральной Бразилии. Различия в чувствительности штаммов изучались на лабораторных животных (Brener, 1979), но пока не ясно, влияютли эти различия на исход заболевания. Тем не менее лечение нифуртимоксом при острой стадии болезни Чагаса следует начинать как можно раньше. Если при работе влаборатории или при переливании крови возникает малейшая угроза заражения, к лечению приступают сразу, не дожидаясь подтверждения диагноза.
Нифуртимокс принимают внутрь. При острой стадии болезни Чагаса взрослым назначают 8—10 мг/кг/сут в 4 приема в течение 90— 120 сут. Детям в возрасте от 1 года до 10 лет назначают 15—20 мг/кг/сут, а с 11 до 16 лет — 12,5—15 мг/кг/сут по той же схеме, но в течение 90 сут. Препарат оказывает раздражающее действие на слизистую желудка, поэтому во время лечения могут отмечаться снижение аппетита и потеря веса. В таких случаях дозу следует снизить. Во время лечения не рекомендуется употреблять спиртные напитки, так как при этом побочные эффекты могут усилиться.
Побочные эффекты[править | править код]
Дети переносят нифуртимокс лучше, чем взрослые. Однако и у них возникают побочные эффекты — от аллергических реакций (сыпь, лихорадка, желтуха, поражение легких, анафилактический шок) до осложнений со стороны ЖКТ и нервной системы, которые зависят от дозы и возраста больного (Brener,1979). Нередко отмечаются тошнота и рвота, а также миалгия и слабость. Нейропатия и нарушения функции ЖКТ наиболее часты при длительном лечении. Нарушения со стороны ЖКТ могут приводить к значительной потере веса, так что препарат приходится отменять. Реже отмечаются головная боль, психические расстройства, парестезия, полинейропатия и повышенная возбудимость ЦНС. Сообщалось также о лейкопении и снижении количества сперматозоидов. Препарат может подавлять клеточный иммунитет как in vitro, так и in vivo (Lelchuk et al., 1977a, b). Так как болезнь Чагаса — очень тяжелое заболевание, а альтернативы нифуртимоксу не существует, абсолютных противопоказаний для его применения очень мало.
Пентамидин[править | править код]
Историческая справка[править | править код]
Антипротозонную активность диамидинов открыли случайно в ходе поиска сахаропонижающих средств, которые могли бы нарушать энергетический обмен у паразитов. Наиболее высокую антипротозойную активность обнаружили три соединения: стилбамидин, пентамидин и пропамидин. Благодаря относительной стабильности, умеренной токсичности и удобству введения пентамидин признали наиболее пригодным для клинического применения. Этот препарат эффективен при целом ряде протозойных инфекций (в том числе лейшманиозах), но в настоящее время его применяют в основном для профилактики и лечения пневмоцистной пневмонии и пневмоцистоза при плохой переносимости триметоприма/сульфаметоксазола. Пентамидин все еще используют (как в виде монотерапии, так и в сочетании с сурамином) при гемолимфатической стадии гамбийской формы сонной болезни (Рёрт and Milord 1994; P6pin and Khonde, 1996). В некоторых эндемических районах в Африке в качестве дешевого аналога пентамидина применяют родственный ему диминазин — при том, что этот препарат разрешен к применению только в ветеринарии. Некоторые аналоги пентамидина с успехом излечивали пневмоцистную пневмонию у крыс (Vohringer and 1993), но ни один из них пока не внедрен в клиническую практику.
Строение[править | править код]
Структурная формула пентамидина следующая:
Пентамидин выпускают в виде аэрозоля и в виде раствора для в/в введения, причем в пересчете на основание в 1,74 мг препарата содержится 1 мг пентамидина. Раствор следует готовить непосредственно перед введением.
Антипротозойная и противогрибковая активность[править | править код]
Положительно заряженные ароматические диамидины активны в отношении многих простейших, и тем не менее для этих препаратов характерна высокая избирательность действия. Так, в опытах на животных инфекции, вызванные Trypanosoma brucei rhodesiense и Trypanosoma brucei congolense, хорошо излечивались диамидинами, но инфекция, вызванная у мышей Trypanosoma cruzi, лечению не поддавалась. Эти препараты оказались также эффективными при бабезиозе, вызванном Babesia canis, у шенков и при лейшманиозе, вызванном Leishmania donovani, у хомяков. Эти данные послужили основой для применения диамидинов при сонной болезни и лейшманиозе у людей.
Диамидины обладают и противогрибковой активностью. In vitro они оказалисьактивны вотношении Blastomyces dermat it idis, и в дальнейшем клинические испытания показали эффективность этих препаратов при североамериканском бластомикозе. Впрочем, влечении этого заболевания их почти вытеснил амфотерицин В. В концентрациях, близких к терапевтическим, пентамидин убивает неразмножаюшиеся стадии Pneumocystis carinii в культуре (Piferet al., 1983). По другим данным, он оказывает скорее фунгистатическое, чем фунгицидное действие (Vohringer and Arasth, 1993).
Механизм действия и устойчивость[править | править код]
Механизм действия диамидинов не известен. У одного и того же паразита они могут проявлять целый спектр различных эффектов; в то же время механизм действия может различаться в зависимости от вида возбудителя (Sands etal., 1985; Wang, 1995; Banrttand Fairlamb, 1999). Так, в клетки Trypanosoma brucei диамидины проникают при участии высокоаффинного переносчика пуринов Р2, причем у чувствительных штаммов он работает лучше, чем у устойчивых (Damperand Patten, 1976). Этот переносчик обладает сродством к аденину и аденозину — пуринам, необходимым для размножения паразита (Barrett and Fairlamb, 1999). Он же опосредует захват трипаносомами меларсопрола и родственных ему соединений, поэтому не удивительно, что некоторые устойчивые к препаратам мышьяка штаммы Тrypanosoma brucei устойчивы и кдиамидинам (Carteret al., 1995; Barrett and Fairlamb, 1999; Ma-ser et al., 1999; de Koning and Jarvis, 1999). Устойчивость к пентамидину чаще всего обусловлена именно невозможностью его захвата клетками паразита, но не исключены и другие механизмы (Bergeret al., 1995). В миллимолярных концентрациях положительно заряженные гидрофобные диамидины могут взаимодействовать с различными отрицательно заряженными соединениями внутри клетки, в том числе с мембранными фосфолипидами, ферментами, РНК и ДНК. При этом в клетке наступает агрегация рибосом, замедляется синтез ДНК и белков, снижается активность некоторых ферментов, а сами трипаносомы, по-видимому, лишаются кинетопласта (Barrett and Fairlamb, 1999). In vitro пентамидин подавляет активность аденозилметионинде-карбоксилазы, поэтому высказывалось предположение, что он нарушает синтез полиаминов. Впрочем, этим вряд ли можно объяснить механизм действия препарата (Bitonti et al., 1986; Berger et al., 1993). Сообщалось также о подавлении активности митохондриальной ДНК-топоизомеразы И и Ca2+,Mg2+-ATФaзы у трипаносом (Barrett and Fairlamb, 1999). Диамидины связываются с ДНК на участках, где подряд идут по крайней мере четыре пары нуклеотидов аденин—тимин (Bailly et al., 1994). Под действием пентамидина ДНК кинетопластов трипаносом принимает линейную форму, что хорошо согласуется с его способностью подавлять активность ДНК-топоизомеразы II (Shapiro and Englund, 1990). Препарат подавляет также АТФ-зависимые ДНК-топоизомеразы в экстрактах Pneumocystis carinii (Dykstra and Tidwell, 1991).
Фармакокинетика[править | править код]
Фармакокинетические свойства пентамидина лучше всего изучены при инфекциях, вызванных Pneumocystis carinii, у больных СПИДом (Vohringer and Arastdh, 1993). При гамбийской форме сонной болезни данные не столь многочисленны (Pdpin and Milord, 1994; Bronner et al., 1995). При парентеральном введении пентамидин довольно хорошо всасывается, но в местах инъекций могут образовываться асептические абсцессы. После однократного в/в введения препарат удаляется из плазмы с Т1/2 от нескольких минут до нескольких часов. Затем следует более медленная стадия распределения, которую сменяет стадия элиминации, длящаяся от нескольких недель до нескольких месяцев. У разных больных сонной болезнью фармакокинетика пентамидина может сильно различаться. После однократного введения клиренс пентамидина составляет в среднем 1120 мл/мин, а объем его распределения около 25 000 л — именно поэтому T1/2 составляет в среднем около 12 сут (Bronner et al., 1995). Почками выводится всего 2—11% пентамидина (Conte, 1991; Bronner et al., 1995); не известно, подвергается ли остальная часть метаболизму или выделяется, например, с желчью. У больных пневмоцистозом, получавших пентамидин в течение 13 сут, препарат продолжал накапливаться, и стационарная концентрация не достигалась (Conte, 1991). Значительное накопление в тканях и медленная элиминация пентамидина при многократном введении могут объяснять его лечебную и профилактическую ценность при пневмоцистозе и сонной болезни (Рёрт and Milord, 1994). При многократном введении больным СПИДом пентамидин в больших количествах накапливается в печени, почках, надпочечниках и селезенке, но почти не проникает в головной мозг (Donnelly et al., 1988). При введении 4 мг/кг/сут препарата в течение 5 сут терапевтическая концентрация достигается и в легких. Более высокую концентрацию в легких обеспечивают ингаляции пентамидина. Их применяют как для лечения пневмоцистной пневмонии легкой и умеренной тяжести, так и для ее профилактики. Ингаляции позволяют уменьшить накопление пентамидина в организме и снизить побочные эффекты как у взрослых, так и у детей (Leoung et al., 1990; Hand et al., 1994). Концентрация препарата в легких зависит от размера распыляемых частиц и от индивидуальных параметров дыхания.
Применение[править | править код]
Пентамидин обычно вводят в/м или в/в медленно в течение 60 мин в дозе 4 мг/кг 1 раз в сутки. Однако при разных заболеваниях схемы лечения различны, и в некоторых случаях они четко не установлены (см. выше).
На гемолимфатической стадии сонной болезни, вызванной Trypanosoma brucei gambiense, пентамидин вводят в/м на 1,3,5,7,13 и 17-е сутки; дополнительно на 1-е и 13-е сутки вводят 20 мг/кг/сут (но не более 1 г/сут) сурамина в/в. По другой схеме вводят только пентамидин в/м 1 раз в сутки через день, всего 7 инъекций (P6pin and Milord, 1994,1996). Поскольку пентамидин не проникает в ЦНС, его не используют при родезийской форме сонной болезни, когда поражение головного мозга наступает вскоре после начала заболевания. Препарат практически бесполезен и на менингоэнцефалитической стадии гамбийской формы сонной болезни.
Пентамидин эффективен при висцеральном лейшманиозе, вызванном Leishmania donovani (препарат вводят в/м в дозе 2—4 мг/кг/сут ежедневно либо через день, всего 12—15 инъекций). Им можно заменить соединения мышьяка или липидные препараты амфогерицина В, если они плохо переносятся. Для лечения кожного лейшманиоза (возбудитель — Leishmania tropica) умеренно эффективен пентамидин в дозе 3 мг/кг/сут в/м через день, всего 4 инъекции. Однако широкого применения эта схема не находит (Berman, 1997).
В виде монотерапии или в сочетании с другими препаратами пентамидин широко применяется для профилактики и лечения инфекций, вызванных Pneumocystis carinii. В развитых странах с помощью этих препаратов удалось существенно снизить смертность от пневмоцистной пневмонии (самой частой из оппортунистических инфекций у ВИЧ-инфицированных); изменился спектр заболеваний, поражающих больных СПИДом, увеличилась средняя продолжительность их жизни.
Применение пентамидина и других средств для профилактики и лечения инфекций, вызванных Pneumocystis carinii, у взрослых ВИЧ-инфицированных суммировано в специальном обзоре (Fauci and Lane, 1998). Профилактику пневмоцистной пневмонии таким больным проводят при: 1) инфекции, вызванной Pneumocystis carinii или кандидозном стоматите в анамнезе, 2) количестве лимфоцитов CD4 менее 200 мкл-1, 3) «беспричинной» лихорадке в течение 2 нед и более. В настоящее время ингаляции пентамидина больше не рекомендуют для профилактики пневмоцистной пневмонии; их назначают лишь в тех редких случаях, когда плохо переносятся более эффективные средства для системного применения, например триметоприм/сульфаметоксазол (гл. 44). Ингаляции (300 мг пентамидина в виде 5 или 10% раствора 1 раз в месяц) проводят в течение 30—45 мин с помощью специального распылителя. Недостатки ингаляций — неэффективность при внелегочном пневмоцистозе и повышенный риск пневмоторакса.
Пентамидин — наиболее предпочтительная замена триметоприма/сульфаметоксазода (при плохой его переносимости) для лечения среднетяжелой и тяжелой пневмоцистной пневмонии и внелегочного пневмоцистоза у неослабленных взрослых ВИЧ-инфицированных. Оптимальная схема — 4 мг/кг пентамидина в/в 1 раз в сутки в течение 21 сут. В зависимости от тяжести заболевания и переносимости препарата схема может меняться. В ряде случаев столь же эффективной может оказаться и более низкая доза пентамидина (2—3 мг/кг/сут) — побочные эффекты при этом выражены намного слабее (Vohringer and Arastdh, 1993). Состояние ВИЧ-инфицированных может ухудшиться в течение первых 5 сут лечения пневмоцистной пневмонии пентамидином — по-видимому, из-за иммунного ответа на массовую гибель возбудителей. В этом случае следует как можно раньше (не позднее 72 ч от постановки диагноза) начать лечение глюкокортикоидами. Если пентамидин эффективен, к концу первой недели лечения состояние больного обычно улучшается. Доля излеченных довольно велика, хотя некоторые больные вынуждены прерывать лечение из-за побочных эффектов. У ослабленных больных со сниженным иммунитетом или злокачественными новообразованиями прогноз менее благоприятный; им могут потребоваться дополнительные курсы лечения. Безуспешность лечения, рецидивы, побочные эффекты и непереносимость чаще всего отмечаются именно у больных СПИДом, тем более что пентамидин оказывает не фунгицидное, а фунгиста-тическое действие на Pneumocystis carinii. По возможности таким больным лучше назначать триметоприм/суль-фаметоксазол.
Благодаря применению пентамидина значительно снизилась смертность при эпидемических вспышках инфекций, вызванных Pneumocystis carinii, среди ослабленных и недоношенных детей. Разработан способ ингаляционного введения пентамидина ВИЧ-инфицированным грудным детям, но эффективность такого лечения не доказана (Hand etal., 1994).
Побочные эффекты[править | править код]
В терапевтической дозе (4 мг/кг/сут) пентамидин вызывает побочные эффекты примерно у половины больных независимо от того, есть ли у них СПИД. Основные осложнения рассмотрены в ряде обзоров (Sands et al., 1985; Vohringer and Arast6h, 1993). При в/в введении пентамидина (и других диамидинов) некоторые из побочных эффектов могут представлять опасность. К ним относятся одышка, тахикардия, дурнота или обморок, головная боль и рвота. По-видимому, они связаны с резким снижением АД при слишком быстром в/в введении препарата и частично могут быть вызваны выбросом гистамина. Если медленная инфузия пентамидина невозможна, то его вводят в/м, но в месте инъекции часто возникает асептический абсцесс. Поздних нейропатий при лечении пентамидином не отмечено. Могут возникать панкреатит и гипогликемия, которая без своевременной диагностики может представлять угрозу для жизни (Sands et al., 1985). С другой стороны, пентамидин может вызвать гипергликемию и инсулинозависимый сахарный диабет. Другие побочные эффекты пентамидина — сыпь, тромбофлебит, тромбоцитопения, анемия, нейтропения, повышение активности печеночных ферментов и нефротоксичность. У 24% больных ухудшается функция почек, но после отмены препарата она восстанавливается.
Стибоглюконат натрия[править | править код]
Историческая справка[править | править код]
Препараты сурьмы уже много лет используются для лечения лейшманиозов и других протозойных инфекций. Первым из них стал препарат трехвалентной сурьмы антимонила-калия тартрат («рвотный камень»), применявшийся при кожном и висцеральном лейшманиозе. Впоследствии из-за высокой токсичности и сложности приема от него отказались в пользу соединений пятивалентной сурьмы. Производные фенилстибоновой кислоты оказались столь же эффективны, но переносились гораздо лучше, что позволило увеличить дозы и сократить сроки лечения. Затем были синтезированы соединения пятивалентной сурьмы, сходные по структуре с антимонила-калия тартратом, — сначала стибоглюконат натрия, а позднее меглумина антимонат, который предпочитают применять во франкоязычных странах. Из всех препаратов сурьмы именно эти два препарата сегодня — основные средства для лечения лейшманиозов. Более подробные сведения о средствах для лечения лейшманиозов можно найти в специальных обзорах (Steck, 1974; Berman, 1988).
Строение[править | править код]
Структурная формула стибоглюконата натрия следующая:
Помимо соединения с указанной формулой препараты стибоглюконата натрия для клинического применения содержат ряд других соединений, в том числе с более высокой молекулярной массой, строение которых не описано (Berman, 1988). В качестве консерванта к препаратам добавляют м-хлоркрезол, а доля пятивалентной сурьмы в них составляет 30—34%. В США стибоглюконат натрия выпускают в виде водного раствора, содержащего 100 мг действующего вещества в 1 мл; препарат можно заказать в Центре по контролю заболеваемости.
Антипротозойная активность и устойчивость[править | править код]
Механизм действия стибоглюконата натрия на лейшманий точно не известен. Установлено, что он нарушает энергетический обмен у амастигот Leishmania spp. (Berman, 1988), подавляя гликолиз и обмен жирных кислот — процессы, протекающие главным образом в органеллах, называемых гликосомами. Кроме того, в присутствии препарата уменьшается выработка АТФ и ГТФ. Но является ли этот механизм основным или второстепенным, не известно. Возможно, действие стибоглюконата натрия опосредовано и другими механизмами. Так, предполагают, что углеводы образуют водорастворимые комплексы с сурьмой, тем самым облегчая проникновение препарата в макрофаги, где находятся амастиготы. Затем сурьма неспецифически связывается с сульфгидри-льными группами белков лейшманий (Roberts et al., 1995). Недавние исследования подтвердили старую гипотезу о том, что относительно нетоксичные препараты пятивалентной сурьмы сами по себе неактивны; они восстанавливаются с образованием соединений трехвалентной сурьмы, которые и вызывают гибель амастигот в фаголизосомах макрофагов (Roberts et al., 1995; Sereno and Lemesre, 1997; Sereno et al., 1998). Выяснилось также, что консервант м-хлорокрезол обладает собственной антипротозойной активностью in vivo (Roberts and Rainey, 1993; Sereno etal., 1998).
Устойчивые штаммы лейшманий (как природные, так и выращенные in vitro) имеют несколько особенностей, отличающих их от чувствительных штаммов. Так, у них выше концентрация внутриклеточных тиолов, особенно трипанотиона. Кроме того, у них амплифицирован ген pgp А белка-переносчика, относящегося к семейству ABC-переносчиков. Однако этих особенностей недостаточно, чтобы объяснить, почему некоторые штаммы лейшманий устойчивы к весьма высоким дозам препаратов (Legare et al., 1997; Haimeur et al., 2000). По некоторым данным, чувствительность Leishmania donovani к препаратам пятивалентной сурьмы не зависит от макрофагов, а определяется особенностями вида и стадией развития паразита — амастиготы более чувствительны, чем промастиготы (Ephroset al., 1999).
Фармакокинетика[править | править код]
Сывороточные концентрации препаратов пятивалентной сурьмы весьма высоки (гораздо выше, чем препаратов трехвалентной сурьмы), и при однократном введении большая часть дозы выводится с мочой в течение 24 ч. Фармакокинетика стибоглюконата натрия при в/в и в/м введении почти одинакова (Pamplin etal., 1981; Chulay etal., 1988). Препарат быстро всасывается; объем его распределения составляет примерно 0,22 л/кг, а кривая элиминации имеет две фазы. Первая фаза довольно быстрая (Т1/2 около 2 ч), вторая — медленная (Т1/2 33—76 ч). По-видимому, вторая фаза отражает переход пятивалентной сурьмы в более токсичную трехвалентную, которая в виде соединений накапливается в тканях и затем медленно из них высвобождается. При введении препаратов пятивалентной сурьмы около 20% сурьмы в плазме находится в трехвалентном состоянии. Действие препарата на лейшманий сохраняется и после падения его сывороточной концентрации ниже МПК, определенной in vitro; возможно, это объясняется захватом соединений сурьмы макрофагами.
Применение[править | править код]
Использованию стибоглюконата натрия, меглумина антимоната и других препаратов для лечения лейшманиозов посвящено несколько исследований (Berman, 1988, 1997). Стибоглюконат натрия назначают в/в или в/м, доза определяется чувствительностью штаммов лейшманий к препарату в данном районе и клинической формой лейшманиоза. В настоящее время для лечения висцерального, кожно-слизистого и некоторых форм кожного лейшманиозов требуются длительные курсы в максимальных дозах — отчасти из-за растущей устойчивости лейшманий к препаратам сурьмы. Но даже высокие дозы помогают далеко не всегда. Например, при висцеральном лейшманиозе в Индии и кожно-сли-зистом лейшманиозе (везде) препараты пятивалентной сурьмы уступают по эффективности амфотерицину В.
Рекомендованная суточная доза стибоглюконата натрия выросла с 10 до 20 мг/кг (в пересчете на действующее вещество). Побочные эффекты при этом усиливаются лишь незначительно. Введение 20 мг/кг/сут стибоглюконата натрия в/м в течение 10 сут излечивает кожный лейшманиоз у 90% больных. При висцеральном лейшманиозе в Индии и кожно-слизистом лейшманиозе (везде) требуется более длительный курс лечения — 28 сут при условии хорошей переносимости. При этом выздоровление наступает у 85—90% больных висцеральным лейшманиозом и лишь у 60% — кожно-слизистым (Berman, 1997). Дети переносят стибоглюконат натрия хорошо, и им назначают ту же дозу, что и взрослым. Если препарат эффективен, то состояние больных улучшается уже через 1—2 нед лечения. При тяжелых побочных эффектах у ослабленных больных препарат можно вводить с перерывами от суток и дольше. Особенно трудно лечить ВИЧ-инфицированных: даже если сначала лечение (как препаратами пятивалентной сурьмы, так и амфотерицином В) эффективно, часто возникают рецидивы. Таким больным при рецидивах назначают препараты второго ряда, например пентамидин или паромомицин. Их же рекомендуют и в том случае, если полный курс препаратами пятивалентной сурьмы не дает эффекта (Berman, 1997).
При висцеральном, кожно-слизистом и некоторых формах кожного лейшманиоза в эндемических районах стибоглюконат натрия все чаще оказывается неэффективным (Ouellette and Papadopoulou, 1993). Во многих случаях это можно объяснить повторным заражением или индивидуальными различиями в фармакокинетике препарата и иммунитете больных; все большую роль играет устойчивость лейшманий. Многократно описаны устойчивые штаммы — как полученные в лаборатории, так и выделенные от больных (Berman et al., 1989; Grogl et al., 1992). Об эффективности стибоглюконата натрия при висцеральном лейшманиозе, вызванном Leishmania do-novani, можно судить по данным о чувствительности к нему амастигот in vitro (Lira et al., 1999). И все же при лейшманиозе стибоглюконат натрия остается препаратом первого ряда. Основные его недостатки — большая длительность лечения, необходимость парентерального введения и относительно высокая стоимость. Когда препараты пятивалентной сурьмы неэффективны (при висцеральном лейшманиозе в странах Восточной Африки и в Индии, а также при кожно-слизистом лейшманиозе), предпочтение отдают липидным препаратам амфотери-цина В.
Побочные эффекты[править | править код]
Побочное действие препаратов пятивалентной сурьмы лучше всего изучено у больных лейшманиозом без поражения внутренних органов. Как правило, высокие дозы стибоглюконата натрия неплохо переносятся. Побочные эффекты проходят с отменой препарата, а по большей части уменьшаются даже при продолжении лечения. Наиболее распространенные из них — боль в месте инъекции при в/м введении, панкреатит (почти у всех больных), повышение активности амино-трансфераз, угнетение кроветворения (анемия, нейтро-пения, тромбоцитопения), миалгия и артралгия, слабость и недомогание, головная боль, тошнота, боль в животе, сыпь. В отличие от других форм заболевания, при висцеральном лейшманиозе могут отмечаться изменения ЭКГ (уплощение и инверсия зубца Т, удлинение интервала QT) (Navinetal., 1992; Berman, 1997; Sundaretal., 1998). Сообщалось и об обратимой полинейропатии. К редким побочным эффектам препаратов сурьмы относятся гемолитическая анемия и поражение почек, а также шок и внезапная смерть.
Сурамин[править | править код]
Историческая справка[править | править код]
Сурамин был открыт в Германии в 1920 г. в ходе исследования азокрасителей — трипанового красного, трипанового синего и афридола фиолетового — способных вызывать гибель трипаносом. Сегодня этот препарат применяется главным образом для лечения сонной болезни. При болезни Чагаса он неэффективен. Хотя сурамин активен в отношении половозрелых филярий и его можно использовать при онхоцер-козе, теперь для лечения этого заболевания в основном применяют ивермектин (гл. 42). Сурамин — мощный ингибитор обратной транскриптазы ретровирусов, но при ВИЧ-инфекции он неэффективен (Cheson et al., 1987). Способность сурамина вызывать надпочечниковую недостаточность и оказывать анти-пролиферативное действие легла в основу исследований его применения (в высоких дозах) при гиперфункции коры надпочечников, раке надпочечников и некоторых других злокачественных новообразованиях (Voogd etal., 1993; Bowden etal., 1996; Frommel, 1997). Антипаразитарная и противоопухолевая активность, применение и побочные эффекты сурамина рассмотрены в обзорах Cheson et al. (1987), Voogd et al. (1993), Рёрт and Milord (1994), Barrett and Barrett (2000).
Строение и форма выпуска[править | править код]
Структурная формула сурамина следующая:
Сурамин растворим в воде, но на воздухе растворы быстро разлагаются, поэтому готовить их следует непосредственно пе-ред введением. В США сурамин распространяется только Центром по контролю заболеваемости.
Антипротозойная активность[править | править код]
Сурамин высокоэффективен как при гамбийской, так и при родезийской формах сонной болезни, но механизм его действия не известен (Voogd et al., 1993). Действие сурамина проявляется не сразу (in vitro — через 6 ч), что, по-видимому, объясняется медленным проникновением его комплекса с белком в трипаносомы путем эндоцитоза (Fairlamb and Bowman, 1977). Химическая модификация молекулы сурамина резко снижает его антипротозойную активность. In vitro сурамин обратимо взаимодействует со многими биологическими молекулами и подавляет активность ряда ферментов (как трипаносом, так и млекопитающих), но с его антипротозойной активностью это напрямую не связано (Pdpin and Milord, 1994; Wang, 1995, 1997). Многие жизненно важные молекулы трипаносом недоступны для сурамина (например, ферменты гликолиза внутри глико-сом), поскольку он не может проникнуть через мембраны путем простой диффузии (Wang, 1995). По-видимому, сурамин связывается с каким-то белком, который и переносит его через мембраны, так как после удаления двух метильных групп его активность in vivo пропадает, а in vitro сохраняется (Morty et al., 1998). После обработки трипаносом сурамином мембраны многих органелл (кроме лизосом) повреждаются, но определяется ли этим эффектом механизм действия, не известно. В какой-то степени активность сурамина может быть обусловлена ингибированием цитоплазматической сериновой олигопептидазы трипаносом (Morty et al., 1998).
На микрофилярий Onchocerca volvulus действуют несколько препаратов, но лишь сурамин — хоть и редко — применяется в лечебной практике (гл. 42). Сурамин действует и на взрослых гельминтов — даже чуть сильнее, чем на микрофилярий. Действие развивается медленно, но длится довольно долго. Механизм действия не известен (Voogd et al., 1993).
Фармакокинетика[править | править код]
При приеме внутрь сурамин не всасывается, а п/к и в/м введение вызывает местное воспаление и некроз, поэтому вводят его в/в. Фармакокинетика может сильно различаться у разных больных. Элиминация сурамина проходит в три фазы: в первые несколько часов его сывороточная концентрация снижается быстро, затем — медленнее (несколько дней) и, наконец, очень медленно, так что конечный Т1/2 составляет 90 сут. Столь длительное выведение обусловлено исключительно прочным связыванием сурамина с белками плазмы: при в/в введении обычной дозы (1 г) с белками связывается более 99,7% препарата (Рёрт and Milord, 1994). Сурамин почти не метабо-лизируется; около 80% дозы выводится почками — почечный клиренс составляет около 5 мл/ч. Хотя объем распределения сурамина у взрослых составляет около 20 л, из-за большого размера и отрицательного заряда препарат медленно проникает в клетки и в тканях его концентрация ниже, чем сывороточная. Однако при введении лабораторным животным концентрация сурамина в почках была значительно выше, чем в других органах. Возможно, именно этим объясняется альбуминурия, нередко возникающая при лечении сурамином. В СМЖ сурамин почти не проникает, так что на менингоэнцефалитической стадии сонной болезни он неэффективен. Благодаря тому что сурамин долго остается в кровотоке, его можно применять и для профилактики сонной болезни.
Применение[править | править код]
Сурамин используют для лечения и гамбийской, и родезийской форм сонной болезни, но при болезни Чагаса (возбудитель — Trypanosoma cruzi) он неэффективен. Поскольку препарат почти не проникает в головной мозг, его применяют в основном на гемолимфа-тической стадии сонной болезни, когда поражения ЦНС еще нет (Рёрт and Milord, 1994). На гемолимфатической стадии гамбийской формы заболевания сурамин более эффективен при в/в введении в сочетании с пентамиди-ном в/м. При родезийской форме, напротив, лучше назначать его в виде монотерапии. Так как на трипаносом, находящихся в крови и лимфе, сурамин действует и на менингоэнцефалитической стадии сонной болезни, то его нередко вводят в/в прежде, чем назначить меларсопрол — при этом снижается риск лекарственной энцефалопатии, часто возникающей при введении препаратов мышьяка (см. выше, «Меларсопрол»), У экспериментальных животных сурамин усиливает действие на трипаносом других антипротозойных средств, например эф-лорнитина. Однако на менингоэнцефалитической стадии родезийской формы сонной болезни назначение сурамина в сочетании с эфлорнитином оказалось неэффективным (Clerinx et al., 1998).
Сурамин вводят в/в медленно в виде 10% водного раствора. Лечение сонной болезни начинают не ранее чем через 24 ч после люмбальной пункции. Больным сонной болезнью и онхоцеркозом препарат следует вводить с осторожностью, так как у них может развиться реакция Маззотти. Для взрослых больных родезийской формой сонной болезни однократная доза обычно составляет 1 г. Сначала рекомендуется ввести пробную дозу — 200 мг в/в. При нормальной переносимости дают обычную дозу на 1, 3, 7, 14 и 21-е сутки. Детям назначают 20 мг/кг/сут в/в по той же схеме. Больным в тяжелом состоянии в первую неделю лечения назначают меньшие дозы. Для лечения гемолимфатической стадии гамбийской формы сонной болезни рекомендуют следующую схему: 20 мг/кг/сут (максимально — 1 г) сурамина в/в на 1-е и 13-е сутки и 4 мг/кг/сут пентамидина в/м на 1,3,5,13,15 и 17-е сутки. Однако даже при незначительном поражении ЦНС при гамбийской форме сонной болезни такая схема оказалась ничем не лучше монотерапии пентамидином (Рёрт and Khonde, 1994, 1996). Если после лечения сурамином возникают рецидивы, назначают меларсопрол (Рёрт and Milord, 1994).
Сурамин — эффективное средство профилактики сонной болезни. Однако лицам, выезжающим в эндемические районы лишь на короткое время и нечасто, профилактику сурамином не рекомендуют, так как риск тяжелых побочных эффектов перевешивает риск заражения (см. ниже). Для профилактики сурамин вводят в/в в дозе 1 г 1 раз в неделю в течение 5—6 нед.
Побочные эффекты[править | править код]
Сурамин вызывает целый ряд побочных эффектов; у ослабленных больных они выражены сильнее. Острая тяжелая реакция на введение сурамина (тошнота, рвота, шок, потеря сознания), к счастью, встречается редко — у 1 больного из 20 000. Чаще сразу после введения появляются недомогание, тошнота и чувство усталости. Гибель паразитов может вызвать преходящую лихорадку и аллергическую реакцию (сыпь); ослабить эти симптомы можно, если до лечения сурамином назначить глюкокортикоиды, а при сопутствующем онхоцеркозе — ивермектин (гл. 42). Самый распространенный побочный эффект сурамина — нефротоксическое действие — возникает после нескольких введений препарата и проявляется альбуминурией. Отмечаются также поздние неврологические осложнения, в том числе головная боль, металлический вкус во рту, парестезия и нейропатия. Обычно эти осложнения проходят, несмотря на продолжение лечения. При введении высоких доз сурамина (в качестве противоопухолевого средства) в течение длительного времени самое частое осложнение — нарушение свертывания крови, а самое тяжелое — тяжелая полирадикулонейропатия (Voogdetal., 1993; Bowden et al., 1996). Реже встречаются рвота, понос, стоматит, озноб, боль в животе и отеки. У 12—26% больных СПИДом на фоне лечения сурамином развивается лейкопения и, реже, агранулоцитоз, тромбоцитопения, протеинурия и повышение уровней креатинина плазмы, билирубина и активности аминотрансфераз. Все эти изменения обратимы. Кроме того, у больных СПИДом иногда возникают надпочечниковая недостаточность и вихревидная ке-ратопатия (cornea verticillata).
==== Меры предосторожности и противопоказания ==== При лечении сурамином нужно тщательно следить за состоянием больных. Лечение нельзя продолжать при непереносимости начальной дозы. При почечной недостаточности препарат применяют очень осторожно. В острой стадии заболевания умеренная альбуминурия на фоне лечения сурамином — не редкость, но длительная тяжелая альбуминурия должна насторожить и может потребовать коррекции дозы. При появлении цилиндрурии лечение следует прервать. Гиперестезия кожи на ладонях и подошвах может быть первым признаком нейропатии.
Хлорохин[править | править код]
Фармакологические свойства хлорохина описаны в статье Противомалярийные средства (препараты). Здесь рассматривается лишь применение хлорохина при амебиазе.
Уникальная особенность хлорохина состоит в том, что он оказывает прямое токсическое действие на трофозоитов Entamoeba histolytica и способен накапливаться в печени. Но при амебном абсцессе печени хлорохин применяют только в качестве препарата резерва — при неэффективности или непереносимости метронидазола. Хлорохин обычно действует быстро, а устойчивость к нему пока не выявлена. При кишечном амебиазе хлорохин гораздо менее эффективен, так как он почти полностью всасывается в тонкой кишке и его концентрация в слизистой кишечника невелика. Так как внекишечному амебиазу всегда сопутствует амебный колит, при амебном абсцессе печени помимо хлорохина назначают также какой-либо препарат, эффективный при кишечном амебиазе. При такой схеме лечения реже возникают рецидивы.
При амебном абсцессе печени взрослым обычно назначают хлорохин в дозе 1 г/сут в течение 2 сут, а затем 500 мг/сут в течение по крайней мере 2—3 нед. Поскольку препарат хорошо переносится, то при необходимости можно либо повысить дозу, либо повторить курс лечения
Эметина гидрохлорид и дегидроэметин[править | править код]
Алкалоид ипекакуаны эметина гидрохлорид применяют для лечения амебиаза с начала XX века. Дегидроэметин обладает сходными фармакологическими свойствами, но вызывает меньше побочных эффектов. Оба препарата относятся к тканевым аме-боцидам и в прошлом широко использовались для лечения тяжелого кишечного и внекишечного амебиаза, но теперь вместо них в основном применяют метронидазол, который гораздо лучше переносится. Только если метронидазол неэффективен или противопоказан, назначают эметина гидрохлорид или дегидроэметин. Фармакологические свойства этих препаратов подробно рассмотрены в 5-м и более ранних изданиях этой книги.
Эфлорнитин[править | править код]
Историческая справка[править | править код]
Эфлорнитин необратимо ингибирует орнитиндекарбоксилазу — фермент, катализирующий первую стадию биосинтеза полиаминов, от которой зависит скорость всего процесса (Metcalf et al., 1978; McCann and Pegg, 1992). Полиамины (путресцин, спермидин, а также спермин у млекопитающих) необходимы для деления и нормальной дифференцировки клеток. In vitro и у экспериментальных животных эфлорнитин подавляет рост некоторых типов опухолевых клеток, и вначале этот препарат испытывали как противоопухолевое средство (Pegg, 1988). Биосинтез полиаминов у простейших как возможная мишень антипротозойных препаратов впервые привлек внимание исследователей, когда выяснилось, что эфлорнитин эффективен при инфекциях, вызванных Trypanosoma brucei, у грызунов (Bacchi et al., 1980). С тех пор эфлорнитин с успехом применяют для лечения гамбийской формы сонной болезни. Препарат эффективен даже на менингоэнцефалитической стадии, когда не действуют препараты мышьяка (Рёрт and Milord, 1994). Напротив, при родезийской форме сонной болезни эфлорнитин бесполезен. Кроме того, он весьма дорог и малоэффективен при злокачественных новообразованиях и пневмоцистной пневмонии, поэтому не исключено, что его снимут с производства (McCann and Pegg, 1992). Впрочем, в последнее время появились новые данные об эффективности эфлорнити-на как профилактического средства у лиц с предрасположенностью к раку (Meyskens and Gerner, 1999). В США эфлорнитин в настоящее время можно получить лишь для лечения сонной болезни по специальному запросу из ВОЗ (табл. VII. 1). Структурная формула эфлорнитина следующая:
Механизм действия[править | править код]
Действие эфлорнитина на чувствительные и устойчивые штаммы Trypanosoma brucei изучали in vitro и в опытах на грызунах, выявив таким образом несколько механизмов действия препарата. С одной стороны, препарат подавляет биосинтез полиаминов и трипанотиона и нарушает метаболизм метионина; с другой - угнетает биосинтез макромолекул и деление клеток. Мелкие подвижные вытянутые формы трипаносом быстро делятся и циркулируют в кровотоке, избегая воздействия иммунной системы за счет изменения антигенной структуры (поверхностных гликопротеидов). Под действием эфлорнитина они превращаются в короткие и неделящиеся формы, которые перестают синтезировать поверхностные гликопротеиды и быстро выводятся из кровотока (Wang, 1997).
В настоящее время достигнут некоторый прогресс в понимании сложных молекулярных механизмов действия эфлорнитина на возбудителей сонной болезни и устойчивости к нему. Понятны стали и причины различного действия препарата на Trypanosoma brucei rhodesiense и Trypanosoma brucei gambiense (Wang, 1997). Эфлорнитин необратимо ингибирует орнитинде-карбоксилазу как простейших, так и млекопитающих, подавляя тем самым синтез путресцина- предшественника псшиами-нов, необходимых для деления клеток. Однако в клетках млекопитающих и у Trypanosoma brucei rhodesiense недостаток орни-тиндекарбоксилазы восполняется гораздо быстрее, чем у Тrypanosoma brucei gambiense, у которой к тому же активность этого фермента ниже, чем у Тrypanosoma brucei rhodesiense. Этим объясняется избирательность действия эфлорнитина на Trypanosoma brucei gambiense (Wang, 1997; Iten et al., 1998). В крови человека очень мало полиаминов, и трипаносомы вынуждены синтезировать их самостоятельно, а для этого нужна орнитинде-карбоксилаза. Именно поэтому мутантные штаммы Trypanosoma brucei gambiense, лишенные орнитиндекарбоксилазы, и дикие штаммы, подвергшиеся действию эфлорнитина, перестают делиться и превращаются в неподвижные и непатогенные формы, которые быстро удаляются из кровотока (Li et al., 1998). Фармакокинетика. Эфлорнитин назначают внутрь или в/в. Биодоступность при приеме внутрь составляет около 54%. Сывороточная концентрация достигает максимальной примерно через 4 ч после приема внутрь, а Т1/2 составляет около 200 мин. Препарат не связывается с белками плазмы и проникает во многие ткани и биологические жидкости, в том числе в СМЖ, что особенно важно на менингоэнцефалитической стадии сонной болезни, когда отношение концентраций эфлорнитина в СМЖ и в плазме превышает 0,9. Более 80% эфлорнитина выводится с мочой — в основном в неизмененном виде. По некоторым данным, фармакокинетические характеристики препарата могут изменяться при высоких дозах (Abeloff et al., 1984; Рёрт and Milord, 1994).
Применение[править | править код]
Опыт применения эфлорнитина для лечения гамбийской формы сонной болезни подробно рассмотрен в ряде обзоров (van Nieuwenhove, 1992; Рёрт and Milord, 1994). В основном приведены результаты лечения больных с менингоэнцефалитической стадией заболевания, многие из которых ранее прошли курс лечения препаратами мышьяка. Установлено, что оптимальная доза эфлорнитина для взрослых составляет 100 мг/кг в/в 4 раза в сутки в течение 2 нед. За исключением случаев особенно тяжелого течения болезни, состояние больных почти всегда улучшалось. Излечение наступало примерно в 60% случаев. Возможно, подобного эффекта удастся добиться и при более коротких курсах лечения. Детям младше 12 лет требовались более высокие дозы — возможно, из-за более быстрого выведения препарата, который при этом не успевал достичь нужной концентрации в СМЖ. Во избежание эпилептических припадков в начале лечения (особенно у детей, получающих более высокую дозу препарата) предложено вводить 400 мг/кг/сут в/в в первые несколько дней илишьзатем повышать дозу (Milord et al., 1993).
При приеме тех же доз внутрь эфлорнитин был менее эффективен — возможно, из-за его меньшей биодоступности. Повысить эффективность просто за счет увеличения дозы не удается из-за возникающего при этом осмотического поноса. Тем не менее при невозможности ввести препарат в/в его принимают внутрь. При приеме 100 мг/кг эфлорнитина внутрь 4 раза в сутки в течение 21—45 сут рецидивы возникали у 15% больных, тогда как при введении препарата в/в в течение 2 нед частота рецидивов составляла лишь около 5%.
При гамбийской форме сонной болезни у больных СПИДом эфлорнитин менее эффективен — возможно, потому, что на фоне иммунодефицита неделящиеся и непатогенные трипаносомы выводятся из кровотока гораздо медленнее. При родезийской форме заболевания эфлорнитин почти неэффективен даже в высокой дозе, что согласуется с данными о его относительно коротком Т1/2 и высокой активности орнитиндекарбоксилазы у Trypanosoma brucei rhodesiense. При лейшманиозах и пневмоцистной пневмонии монотерапия эфлорнитином также малоэффективна, хотя экспериментально установлена его способность подавлять синтез полиаминов у Leishmania spp. и Pneumocystis carinii.
Побочные эффекты[править | править код]
Эфлорнитин вызывает довольно много побочных эффектов (van Nieuwenhove, 1992; Рёрт and Milord, 1994). При в/в введении наиболее часто возникают анемия (48% больных), понос (39%) и лейкопения (27%). Понос возникает тем чаше, чем выше доза, и именно из-за него дозу приходится уменьшать (особенно при приеме препарата внутрь). В начале лечения у 7% больных возникают эпилептические припадки, но затем они проходят даже при дальнейшем введении препарата. Другие побочные эффекты — тромбоцитопения, алопеция, рвота, боль в животе, дурнота, лихорадка, снижение аппетита и головная боль — возникают менее чем у 10% больных. После отмены эфлорнитина большинство побочных эффектов проходят. Иногда отмечается преходящее снижение слуха —особенно после длительного лечения низкими дозами эфлорнитина внутрь, хотя проверка слуха не входит с обычную схему обследования таких больных (Pasic et al., 1997). В опытах на животных препарат нарушал развитие плода.
Эфлорнитин действует в довольно высокой дозе и требует в/в введения значительного количества жидкости. Это не всегда выполнимо в отдаленных районах; с другой стороны, у некоторых больных может возникать гиперволемия. В любом случае, при длительном лечении (более 21 сут) риск побочных эффектов может перевесить пользу.
Антибиотикотерапия протозойных инфекций[править | править код]
На эффективность при протозойных инфекциях исследовано множество антибиотиков. Некоторые из них оказались действенными, но в качестве препаратов первого ряда их по-прежнему применяют лишь изредка. Так, при балантидиазе и кишечных инфекциях, вызванных Dientamoeba fragilis, рекомендуют тетрациклин. При бабезиозе назначают клиндамицин в сочетании с хинином. Паромомицин, единственный антибиотик, оказывающий прямое амебонилное действие, активен в отношении целого ряда простейших — возбудителей протозойных инфекций (см. ниже). Для лечения амебиаза используют и другие антибиотики (некоторые тетрациклины, эритромицин), но, в отличие от паромомицина, все они оказывают непрямое действие — нарушают состав микрофлоры кишечника, которая играет важную роль в размножении возбудителя.
Паромомицин. Этот антибиотик из группы аминогликозидов был выделен из культур Streptomyces rimosus. По строению он схож с неомицином, а по спектру антимикробного действия близоккдругим аминогликозидам (гл. 46). В Европе паромомицин вводят парентерально при инфекциях, вызванных чувствительными к аминогликозидам бактериями. Помимо прямого амебоцидного действия паромомицин обладает антибактериальной активностью в отношении нормальной и патогенной микрофлоры ЖКТ. Паромомицин применяют и при других протозойных инфекциях. Так, в ряде случаев он оказался эффективным при висцеральном и кожном лейшманиозе (Berman, 1997). Кроме того, в нескольких контролируемых испытаниях изучалась эффективность паромомицина при криптоспоридиозе у больных СПИДом (Smith etal., 1998). Паромомицин испытывали как средство лечения амебиаза и лямблиоза у беременных, а также применяли для лечения инфекций, вызванных Dientamoeba fragilis. Эффективен он и при цестодозах. Структурная формула паромомицина следующая:
Для лечения кишечного амебиаза назначают 25—35 мг/кг/сут внутрь в 3 приема во время еды в течение 7 сут. Применяли и более высокие дозы — до 66 мг/кг/сут. При приеме внутрь паромомицин всасывается незначительно. Основной побочный эффект — нарушения со стороны ЖКТ (понос), но при парентеральном введении паромомицина лабораторным животным у них развивалась тяжелая почечная недостаточность. У больных, получающих паромомицин в/м или в/в (особенно при превышении рекомендованной дозы и на фоне лечения другими нефро-токсичными препаратами), могут возникать почечная недостаточность и поражение преддверно-улиткового нерва (Berman, 1997). Паромомицин эффективен, хотя и не всегда, при кишечном амебиазе, но при внекишечных формах заболевания он бесполезен (Woolfe, 1965).
Перспективы[править | править код]
На пути дальнейшего прогресса в лечении и профилактике протозойных инфекций стоят две основные трудности. Во-первых, до сих пор не существует эффективных препаратов для лечения болезни Чагаса и родезийской формы сонной болезни. Во-вторых, все чаще встречаются устойчивые штаммы возбудителей протозойных инфекций: растет устойчивость Trypanosoma brucei к меларсопролу, Leishmania spp. — к препаратам пятивалентной сурьмы, a Trichomonas vaginalis — к метронидазолу. Решению этих проблем препятствует экономическая незаинтересованность производителей и их нежелание финансировать научные исследования в этой области.
Но, даже несмотря на экономические трудности, существуют подходы, которые могут помочь справиться с указанными проблемами. Можно, например, проверить, не обладают ли антипротозойной активностью препараты, уже разрешенные для лечения других заболеваний. Такие клинические испытания позволяют обойтись без больших затрат, неизбежных при разработке новых лекарственных средств. Решение о проведении этих испытаний можно было бы принимать по результатам опытов in vitro и на животных. Об удобстве такого подхода говорят несколько примеров. Так, атоваквон, разрешенный ранее для лечения инфекций, вызванных Pneumocystis carinii, теперь применяют и для лечения тропической малярии, вызванной полирезистентными штаммами Plasmodium falciparum, и токсоплазмоза. Эфлорнитин разрабатывали как противоопухолевое средство, но он оказался эффективен и для лечения гамбийской формы сонной болезни. Милтефозин — алкилированный фосфолипид, который также вначале испытывали как противоопухолевое средство, подает надежды в качестве первого препарата для приема внутрь при висцеральном лейшманиозе (Herwaldt, 1999а). Новые препараты для клинического применения можно отыскать и среди средств, используемых при протозойных инфекциях у животных. Такие препараты обычно недороги и легко доступны. Один из них — диминазин — ароматический диамидин, применяемый для лечения трипаносомоза коров, оказался эффективен при родезийской форме сонной болезни у людей. Однако внедрению его в широкую практику опять-та-ки мешает экономическая незаинтересованность производителей.
Еще один подход — подбор комбинаций из уже известных антипротозойных препаратов. Лучше всего комбинировать препараты, дополняющие друг друга по спектрам антипротозойной активности (как поступили, например, с антагонистами фолиевой кислоты). С другой стороны, синергизм могут проявлять и препараты, действующие на различные этапы жизнедеятельности простейших. Немаловажно и сходство фармакокинетических свойств препаратов. Этот подход уже дал результаты — возросла эффективность лечения; появилась возможность избежать или отсрочить появление устойчивости. Так, для лечения тропической малярии, вызванной полирезистентными штаммами Plasmodium falciparum, разработан ряд схем, состоящих из нескольких противомалярийных препаратов.
Эффективность лечения протозойных инфекций во многом зависит от состояния иммунитета. Целый ряд инфекций (в том числе протозойных) протекают тяжелее на фоне СПИДа. Так, в Южной Европе среди больных СПИДом значительно возросла заболеваемость висцеральным лейшманиозом, который уже не поддается лечению обычными средствами (Berman, 1997). Влияние СПИДа заметнее всего при использовании антипротозойных препаратов, которые не вызывают гибели возбудителей, а задействуют иммунную систему для их уничтожения. Антипротозойные средства зачастую токсичны и еще больше подавляют иммунитет. Во избежание этого предложено назначать антипротозойные препараты на фоне иммунотерапии. Так, при системных формах лейшманиоза, когда иммунитет подавлен, с целью более эффективного разрушения возбудителей внутри клеток применяли интерферон у и вакцину БЦЖ.
Перспективный подход к лечению протозойных инфекций — направленная доставка лекарственных средств.
Пока он носит в основном экспериментальный характер и из-за высокой стоимости недоступен для широкого клинического применения. По данным исследований, связывание соединений пятивалентной сурьмы с маннаном вместо глюконата натрия, увеличивает их активность в отношении амастигот Leishmania spp. in vitro — возможно, за счет усиления захвата препарата макрофагами (Roberts etal., 1995). Появление липидных форм амфотерицина В расширило его терапевтический диапазон; теперь это препараты первого ряда при висцеральном лейшманиозе в Индии.
Однако лучшее, что может быть сделано для прогресса в лечении протозойных инфекций, — это продолжение фундаментальных и клинических исследований, направленных на изучение биологии паразитов, на основе которой будут создаваться новые и более эффективные препараты и вакцины. И хотя этот путь требует больших вложений, отказ от него может обернуться еще большими затратами.