Тепловой стресс — различия между версиями
Admin (обсуждение | вклад) |
(нет различий)
|
Текущая версия на 01:45, 14 января 2013
Содержание
Тепловой стресс у человека в условиях двигательной активности[править | править код]
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Реакция нейроэндокринной системы при выполнении физических упражнений в условиях повышенных температур (здесь свыше 35 °С) существенно отличается от таковой при термическом воздействии в состоянии покоя в сауне. И это справедливо, поскольку выделение нейротрансмиттеров и гормонов может происходить под влиянием разнообразных стимулов, а двигательная активность влияет на характер функционирования нескольких сигнальных путей, изменяя их одновременно или последовательно (Giustina; Veldhuis et al., 1998). Несмотря на то что основная масса этих изменений может быть отнесена на счет повышения тонуса симпатической нервной системы (увеличения вентиляции легких, потребления кислорода, ЧСС) или возрастания активности гипоталамо-гипофизарно-надпочечниковой и/или симпатоадреномедуллярной систем, гормональный ответ на тепловой стресс и физическую нагрузку не всегда легко интерпретировать. Например: а) двигательная активность и термические стрессоры оказывают синергический эффект на концентрацию одних гормонов в плазме (норадреналина, адреналина, кортизола), в то время как в отношении других (дофамина, соматотропного гормона) такого синергизма не наблюдается (Brenner et al., 1997); б) концентрация пролактина в плазме под влиянием теплового воздействия возрастает в состоянии покоя сильнее, чем во время двигательной активности (Kukkoncn-Harju 1 а, 1989);в) концентрация кортизола в плазме может как возрастать, так и снижаться, в зависимости от циркадного ритма (Thuma et al., 1995).
В условиях одновременного воздействия физической нагрузки и теплового стресса взаимодействие нейротрансмиттеров и нейропептидов затрудняет детальное описание процессов терморегуляции организма. Одним из показательных примеров такого поведения является соматотропный гормон. Например, секреция соматотропина регулируется под влиянием нейропептидов (галанина, тиреолиберина, нейропептида Y, кальцитов и βэндорфина), нейротрансмиттеров (ацетилхолина, норадреналина, дофамина, 5-НТ и ГАМК), метаболических субстратов (глюкозы крови, L-аргинина) и гормонов (гонадального тестостерона, эстрогенов, соматостатина и тиреоидного гормона) (Giustina; Veldhuis et al., 1998). Идентифицированы несколько изоформ соматотропного гормона, однако различия в их физиологической функции пока не установлены (Baumann, 1999). И температура, и двигательная активность (интенсивность упражнений, чередование уровня нагрузки, продолжительность периодов отдыха) могут влиять на уровень секреции СТГ. Таким образом, его секреция, вероятно, регулируется с участием нескольких путей передачи сигнала, включая разнообразные цепи обратной регуляции, непосредственно на уровне аденогипофиза и/или за счет модуляции гипоталамической секреции соматолиберина или соматостатина. Секреция СТГ имеет отношение к регуляции температуры тела, поскольку дефицит соматотропина снижает потоотделение потовыми железами кожи (Lobie et al., 1990; Borer, 2003), уменьшает теплоотдачу за счет испарения жидкости и повышает риск серьезной гипертермии во время интенсивной двигательной активностью (Hjortskov et al., 1995).
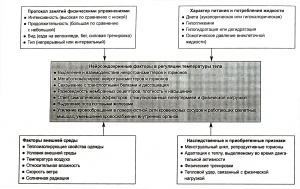
На рис. показана комплексность взаимодействия дополнительных факторов, которые могут влиять на нейроэндокринную регуляцию температуры тела человека во время воздействия теплового стресса и физической нагрузки. Центральная часть этой схемы включает секрецию и клиренс гормонов, их связывание с мембранными рецепторами и связывающими белками и диссоциацию, а также реакцию симпатических эффекторов, которые способствуют рассеянию тепла за счет потоотделения и расширения поверхностных кровеносных сосудов. Эти компоненты нейроэндокринной функции подвергаются воздействию других стимулов, в число которых входят особенности протокола занятий физическими упражнениями, сбалансированность питания, обмена веществ и жидкости, наследственные и приобретенные признаки, а также факторы окружающей среды. Несмотря на то что сегодня практически невозможно дать простого объяснения такой многофакторной проблемы, в следующем подразделе мы рассмотрим наши текущие представления о том, каким образом эти факторы влияют на гормональный ответ на тепловой стресс в сочетании с физической нагрузкой.
Протокол физических упражнений. Исследования Хоффмана указывают на возможность использования норадреналина в качестве предпочтительного гормонального показателя нагрузки на организм человека при одновременном воздействии высоких температур и физической нагрузки (Hoffman et al., 1994). Основой для такого вывода стало отсутствие изменений адреналина, тестостерона и кортизола под влиянием низкоинтенсивной двигательной активности на тредмиле при температуре 33 "С, независимо от исходного состояния гидратации организма или потребления жидкости во время физической нагрузки. Две другие группы исследователей (Mora-Rodriguez et al., 1996; Castellani et al., 1997) также пришли к выводу, что норадреналин является более чувствительным нейроэндокринным маркером, по сравнению с адреналином в условиях низкоинтенсивной двигательной активности при повышенной температуре (33 "С в обоих исследованиях; занятия на велоэргометре 150 и 90 мин с интенсивностью 65 и 50 % V02max соответственно). Выраженные изменения уровня норадреналина при отсутствии колебаний адреналина были показаны для молодых мужчин, занимавшихся в теплоизолирующей одежде (формирование некомпенсируемого теплового стресса) в течение 60 мин на велоэргометре с интенсивностью 50 % V02max при 20 "С (Nybo et al., 2002). Вместе с тем при беге на дистанцию 16,1 км с высокой интенсивностью нагрузки (80 % V02max) на открытом воздухе при температуре 30 *С были обнаружены изменения и норадреналина, и адреналина (Hartung et al., 1987), что свидетельствует о возможности влияния на характер колебаний уровня катехоламинов интенсивности нагрузки или положения тела (вертикальное по сравнению с сидячим), и за счет этого изменения терморегуляции и аккумуляции тепла в организме. В связи с этим возникает вопрос; “Как компоненты протокола занятий физическими упражнениями влияют на нейроэндокринную и терморегуляторную реакцию организма?”
Борер (Borer, 2003) и другие специалисты считают, что гипофизарная секреция АКТГ и β-эндорфина, а также выделение кортизола корой надпочечников и гормонов стресса адреналина и норадреналина мозговым слоем надпочечников возрастает при интенсивности физических нагрузок выше 80 — 90% V02max в умеренных условиях. Вместе с тем в реальности ситуация может оказаться намного сложнее. Концепция Борера явно не учитывает результатов исследований, в которых было установлено: а) отсутствие изменений АКТГ, β-эндорфина и кортизола при трех сверх-максимальиых интенсивностях нагрузки (175, 230 и 318 % V02max; продолжительность 6—46 с; двигательная активность на велоэргометре в положении сидя; 23 'С) и повышение уровня этих гормонов при нагрузке 115% V02max (Кгаешег WJ. et al., 1989); б) стабильный уровень β-эндорфина в течение первого часа занятий на велоэргометре (50 % V02max; 35 'С) и его увеличение в промежутке между 75 и 120 минутами занятия (Kelso et al., 1984); в) снижение уровня кортизола при выполнении 5 тестов максимальной анаэробной мощности, разделенных на 30 с активного восстановления (при 22 ‘С и 35 ”С) (Hoffman et al., 1997); г) увеличение уровня адреналина, норадреналина и кортизола, сопровождавшее занятие на велоэргометре продолжительностью 120 мин с интенсивностью нагрузки 40 % VO.max (22 °С), с выходом уровня норадреналина на плато в промежутке 60—120 мин (Horton T.J. et al., 1998). Две группы исследователей, проводивших эти эксперименты, пришли к выводу о том, что гормональный ответ не зависит от продолжительности и интенсивности занятий (Kraemer W.J. et al., 1989), а если и зависит, то в большей степени от продолжительности, чем от интенсивности (Hoffman et al., 1997).
Несмотря на сложность интерпретации данных приведенных исследований, их неоднозначность, вероятнее всего, обусловлена различиями в условиях проведения эксперимента. Эту точку зрения подтверждают результаты исследований Кремера (Kraemer W.J. et al., 1995), показавших, что: а) различные протоколы интенсивной силовой тренировки вызывают изменения уровня β-эндорфина и кортизола, которые отличаются по кинетике; б) критическими параметрами протокола занятий оказались длительность интервала приложения силы и продолжительность отдыха между подходами. Исследования, в которых бы предпринималась попытка разделить независимые эффекты вида упражнений (езда на велосипеде, бег, силовые упражнения), типа (непрерывная или интервальная тренировка), интенсивности и продолжительности на гормональную реакцию, практически отсутствуют. Заслуживает внимания одно исследование, в котором была предпринята попытка разделить физиологический ответ на пребывание в условиях с температурой воздуха 23 и 40 ’С от реакции на физическую нагрузку (Brenner et al., 1997). Для полного понимания механизмов нейроэндокринной регуляции температуры тела, а также влияния различных протоколов занятий двигательной активностью требуется проведение значительного количества дополнительных исследований, особенно при температурах внешней среды выше 35 *С.
Диета и гидратация организма. Поскольку изменения уровня гормонов и нейротрансмиттеров могут повлиять па процессы мобилизации или запасания биохимических субстратов, адекватность или недостаточность диеты способна повлиять на нейроэндокринную функцию. Исследования данного вопроса были направлены на анализ значения двух независимых переменных: доступности энергии и состояния гидратации организма.
Во-первых, снижение концентрации глюкозы в крови (< 3,3 мМ) во время продолжительных упражнений сопровождается усилением активации гипоталамо-гипофизарно-надпочечниковой системы, о чем свидетельствует повышение уровня АКТГ и кортизола в крови. Такой реакции, отражающей повышение физической нагрузки, можно избежать, если не допустить снижения уровня глюкозы (Tabata et al., 1991).
Во-вторых, потеря воды организмом также способна повлиять на терморегуляторную реакцию организма человека. Например, при ходьбе с низкой интенсивностью нагрузки (общей продолжительностью 140 мин, 4 интервала нагрузки по 25 мин, 28—30 % V02max) при 49 *С и 20 % относительной влажности воздуха у испытуемых при потере воды до -5 % исходной массы тела наблюдалось повышение концентрации кортизола и СТГ по сравнению с нормальной гидратацией организма (Francesconi et al., 1984). Снижение объема плазмы крови само по себе (-14,6 % по сравнению с 0 % в контрольной эксперименте) влияло на теплоотдачу во время продолжительной двигательной активности на велоэргометре и приводило к повышению ректальной температуры, сопровождавшему процесс обезвоживания (Roy et al., 2000) и усилению общей стимуляции симпатической нервной системы (т. е. увеличению уровня норадреналина в плазме при постоянной концентрации адреналина). Дегидратация, по-видимому, влияет на потоотделение через симпатическую холинергическую иннервацию и нейротрансмиттеры — ацетилхолин и норадреналин; она снижает чувствительность потовых желез к гипертермии и повышает температуру, при которой начинается потоотделение (Armstrong, Maresh, 1998). Таким образом, в условиях обезвоживания организма потоотделение в ответ на физическую нагрузку начинается гораздо позднее.
Было высказано предположение, что такие гипоталамические реакции обусловлены главным образом изменениями осмотического давления в тканях мозга или внеклеточной жидкости (Senay, 1979). Три работы, опубликованные по результатам исследований нашей лаборатории, подтверждают эту концепцию. В случае, когда здоровые мужчины занимались непрерывно на тренажере в течение 90 мин (наклон 5 %, интенсивность 36 % V02max) в камере с прогретым воздухом (33 ‘С, 56 % относительной влажности воздуха), измерения с помощью датчика точки росы показали, что локальная интенсивность выделения пота снижается параллельно с увеличением осмотического давления плазмы (от 281 до 324 мОсм-кг'1 и потерей влаги организмом (от -0,2 до -6,7 % массы тела) (Armstrong et al., 1997). В ходе этих экспериментов было обнаружено, что регидратация или восполнение запасов жидкости в организме существенно снижает уровень изменений норадреналина в плазме крови (Hoffman et al., 1994). Такая закономерность наблюдалась независимо от того, начинали участники занятие с нормальным уровнем гидратации или со сниженным. Отдельное исследование, проведенное в нашей лаборатории, установило, что восполнение запасов жидкости в организме оральным путем или с помощью внутривенного вливания 0,45 %-го раствора NaCl ослабляет изменения уровня норадреналина (т. е. активность симпатической нервной системы), АКТГ и кортизола (активность гипоталамо-гипофизарно-надпочечниковой системы) в плазме крови по сравнению с результатами независимого эксперимента, в котором при аналогичной физической нагрузке в сочетании с тепловым стрессом восполнение запасов жидкости в организме не производилось (Castellani et al., 1997). Эти результаты подтверждают концепцию, в соответствии с которой восполнение запасов жидкости в организме снижает осмотическое давление (307 мОсм-кг-1 без воды по сравнению с 293 мОсм-кг'1 с водой), это воспринимают гипоталамические нейроны, которые в свою очередь снижают стимуляцию потоотделения через симпатическую нервную систему и уровень секреции АКТГ в аденогипофизе. Эти умозаключения позволяют связать состояние гидратации организма и осмотическое давление с нейроэндокринным контролем температуры тела.
Содержание отдельных ионов также может влиять на терморегуляцию. В детальном обзоре, посвященном вопросу гипоталамической регуляции температуры тела, Майерс (Myers, 1980) сделал заключение, что гипертермии всего тела во время физической нагрузки экспериментальных животных можно избежать введением ионов кальция в гипоталамус. Это говорит о том, что отдельные ионы (кальций, натрий, калий и магний) играют роль в терморегуляторном ответе и теплоотдаче организма.
Пол и репродуктивные гормоны. После анализа многочисленных публикаций мы пришли к выводу, что о влиянии пола на нейроэндокринную регуляцию температуры тела у человека практически ничего не известно, поскольку исследований в этом направлении с анализом регулярной двигательной активности при повышенных температурах не проводилось. Было проведено всего несколько сравнительных исследований с участием лиц обоих полов, включавших занятия физическими упражнениями при умеренных температурах (22 °С) (Horton T.J. et al., 1998; Kraemer R.R. et al., 1989; Davis et al., 2000) или пребывание при высокой температуре (90 "С) в состоянии покоя (Jezova et al., 1994), результаты которых не позволяют сделать определенных выводов. Колебания уровня репродуктивных гормонов также могут создавать основу для половых различий. Например, изменение уровня соматотропного гормона в ответ на физическую нагрузку варьирует в зависимости от стадии менструального цикла (Hansen, Weeke, 1974), а оральные контрацептивы усиливают индуцированную двигательной активностью секрецию СТГ (Bernardes, Radomski, 1998). Эти эффекты могут быть обусловлены взаимодействием эстрогена на гипоталамическую регуляцию секреции СТГ. Эстроген может также влиять на радиационную и конвекционную теплоотдачу за счет увеличения биодоступности оксида азота, который является мощным вазодилятором (Chen Z. et al., 1999). Эстрадиол и прогестерон также известные модуляторы интенсивности потоотделения, подкожного кровообращения и метаболического термогенеза; изменяют внутреннюю температуру тела на протяжении менструального цикла (Kolka, 1999). И хотя рассмотренные данные не позволяют ответить однозначно на вопрос о влиянии половых отличий на терморегуляцию организма у человека, они предоставляют возможность определить направление работ и сформулировать гипотезы для подтверждения в дальнейших исследованиях.
Адаптационные изменения, связанные с акклиматизацией организма к условиям повышенных температур. В течение 5—14 дней влияния на организм разнообразных стрессовых воздействий внешней среды (жары, холода, пониженного атмосферного давления) в организме человека происходит комплекс системных, ультраструктурных и биохимических адаптационных процессов, которые в целом носят название акклиматизация (Armstrong, Maresh, 1991). Очевидно, что акклиматизация включает адаптационные изменения, затрагивающие ЦНС и нейроэндокринную систему, которые проявляются в виде снижения ректальной температуры (усиления ответных реакций периферических эффекторюв, повышающих теплоотдачу), ЧСС, концентрации натрия в поте и моче (т. е. секреция альдостерона в коре надпочечников), а также температурного порога стимуляции потоотделения (Armstrong et al., 1987; Armstrong, Maresh, 1991). Это происходит одновременно с увеличением общей интенсивности потоотделения (возбуждения симпатической холинергической иннервации) и объема плазмы (стимуляции симпатического контроля расширения сосудов через а- и бета2-адренергические рецепторы, расположенные в предкапиллярных кровеносных сосудах) (см. Horowitz, Gival, 1989).
На животной модели акклиматизации к повышенным температурам продемонстрированы модификации центральной функции нейроэндокринной системы в виде повышении уровня норадреналина и дофамина в переднем гипоталамусе (Christman, Gisolfi, 1985) в сочетании с повышением теплоотдачи на периферии. Согласно этим данным, у акклиматизированных к повышенной температуре крыс стабильно наблюдается повышенная терморегуляторная чувствительность к инъекциям в передний гипоталамус различных нейромодулирующих агентов, включая норадреналин и 5-НТ (Gordon, 1993).
Исследования ультраструктурных и метаболических адаптаций, связанных с акклиматизацией к повышенным температурам, были проведены Хоровицем (Horowitz, 1998). Во-первых, были обнаружены адаптационные изменения на уровне ЦНС в переднем гипоталамусе, включая изменение состава мембранных компонентов, которое сопровождалось периферическими изменениями плотности рецепторов, аффинности рецепторов к определенным видам молекул и концентрации Са2+ в цитозоле. Во-вторых, у лиц, участвовавших в программе акклиматизации к физической нагрузке в условиях повышенных температур, наблюдалось снижение уровня потребления кислорода (более низкое V02 при одной и той же абсолютной нагрузке) (Sawka et al., 1983). Об этом явлении до последнего времени было известно мало. Эксперименты на животных обнаружили повышение эффективности биохимических процессов (т. е. снижение уровня метаболизма) в сердечной мышце, происходящее в том же временном диапазоне, в котором наблюдалось увеличение запасов гликогена, а также повышение уровня утилизации глюкозы и гликолитического потенциала (Horowitz, 2003). Такие биохимические изменения способствуют росту энергетического потенциала сердечной мышцы, что позволяет сердцу справляться с нагрузкой, возросшей в результате совместного действия физических упражнений и повышенной температуры.
В одном из опубликованных недавно обзоров (Armstrong, Stoppani, 2002) описана развивающаяся концепция контроля со стороны ЦНС адаптаций к повторяющемуся тепловому стрессу и подчеркивается значение пластичности нервной системы, которая позволяет ей синхронизировать свои воздействия с измененными биохимическими путями. Авторы предлагают несколько возможных механизмов физиологической адаптации организма человека, в числе которых: а) контроль со стороны ЦНС за привыканием (ослабленная синаптическая передача), пороговой температурой ядра тела или схемой нервного взаимодействия; б) биохимические и ультраструктурные адаптации (изменение характеристик клеточной мембраны; изменения внутриклеточной концентрации органелл и ферментов, ограничивающих скорость процессов энергетического метаболизма); в) ответ эффекторных органов (изменение пороговой температуры стимуляции поверхностного кровообращения или потоотделения, а также размеров нервно-мышечного контакта). Поскольку многие нейробиологи считают, что хранение информации ассоциировано с определенными областями обработки информации, принимающими участие в контроле гомеостаза, можно теоретически предположить, что передний гипоталамус (интеграция терморегуляторных сигналов), мозжечок или мост (контроль ЧСС, артериальное давление, вентиляция) и ретикулярная формация (интеграция входящей нервной информации) вовлечены в процесс акклиматизации к повышенным температурам (Armstrong, Stoppani, 2002).
Адаптационные изменения механизмов гормонов терморегуляции и стресса, обнаруживаемые у животных и человека через 7 — 10 дней акклиматизации к физическим нагрузкам при температурах 35 — 49 °С. Принимая во внимание многочисленность факторов, оказывающих влияние на долговременные нейроэндокринные адаптации во время акклиматизации к повышенным температурам, основной целью табл. является уточнение направлений предстоящих исследований.
Адаптации к физическим тренировкам. Поскольку акклиматизация к физическим нагрузкам в условиях повышенных температур включает воздействие на организм регулярных физических нагрузок, логично предположить, что реакции приспособления к повышенным температурам будут в определенной степени совпадать с адаптационными изменениями, обусловленными физической тренировкой (Armstrong, Pandolf, 1988). Действительно, выполнение программы тренировки на выносливость сопровождается снижением пороговой температуры начала потоотделения, увеличением объема плазмы, увеличением объема сердечного выброса, понижением ЧСС, снижением температуры кожи ректальной температуры, а также увеличением VOmax. Такое сходство подтверждается и многочисленными сообщениями о том, что организм хорошо подготовленных спортсменов, которые занимались аэробной тренировкой исключительно при нормальных и пониженных температурах, реагирует на физическую нагрузку в условиях повышенных температур так, как если бы он был уже акклиматизирован (Armstrong, Maresh, 1991). В нескольких исследованиях была проведена оценка гормонального ответа на многонедельную программу физической тренировки в условиях нормальной и пониженной температур. В целом все эти исследования демонстрируют увеличение функциональных возможностей, которое проявляется в виде повышения уровня АКТГ, адреналина, норадреналина и эндорфина в крови (Viru, 1992). К сожалению, исследования, посвященные изучению влияния физических тренировок на нейроэндокринную регуляцию температуры тела человека в различных условиях, крайне ограничены и в настоящий момент не позволяют сделать каких-либо обобщений.
Тепловой удар и тепловое истощение, обусловленные физиологическим напряжением. Тепловое истощение, обусловленное физиологическим напряжением, выражается в неспособности продолжать занятие двигательной активностью из-за сердечно-сосудистой недостаточности. Это нарушение, имеющее отношение к гипертермии, достаточно часто встречается у военнослужащих, спортсменов и лиц гражданских специальностей и требует для полного восстановления организма от 24 до 48 ч. Оно является результатом истощения запасов жидкости и/или солей в организме (Armstrong, Anderson, 2003). Тепловой удар, медицинское состояние, требующее неотложного вмешательства врачей, может произойти в случае, когда тепловой стресс, связанный с воздействием внешней среды и интенсивным мышечным метаболизмом, превосходит возможности теплообмена организма. Сильная гипертермия может привести к значительным нарушениям функции ЦНС, а также других систем организма и даже смерти в случае, если тело пострадавшего не охладить как можно быстрее (Casa, Armstrong, 2003). По этическим соображениям, исследователь не может вызвать состояние теплового истощения, обусловленного физиологическим напряжением, у участников экспериментов, поэтому практически во всех исследованиях нейроэндокринного ответа на тепловое истощение, обусловленное физиологическим напряжением, используются данные ретроспективного анализа. Помимо стрессовой реакции симпатоадреномедуллярной и гипоталамо-гипофизарно-надпочечниковой систем на гипертермию или занятия физическими упражнениями до утомления, в патофизиологию теплового истощения вовлечены также β-эндорфин, дофамин и 5-НТ.
Перспективы дальнейших исследований[править | править код]
Нейроэндокринная регуляция температуры тела во время интенсивной двигательной активности в условиях повышенных температур подвергается влиянию многих факторов. К ним относятся взаимодействия между отдельными нейротрансмиттерами и нейропептидами, разнообразные воздействия на функцию гипоталамуса и гипофиза, периодический характер секреции (например, гормона роста) или циркадные ритмы изменений уровня отдельных гормонов (АКТГ, кортизол, СТГ, пролактин), а также механизмы обратной связи и прямого контроля (Veldhius, Yoshida, 2000). Для интерпретации таких сложных взаимодействий, несомненно, необходимы дальнейшие исследования. Учитывая несовершенство современных экспериментальных методов, дальнейшие исследования нейроэндокринного влияния на терморегуляцию во время занятий двигательной активностью о условиях повышенных температур должны развиваться по следующим направлениям:
- Определение различий между центральной (на уровне головного мозга) и периферической (на уровне изменения содержания в крови) реакцией нейроэндокринной системы.
- Изучение индивидуального воздействия предполагаемых нейротрансмиттеров и нейропептидов на различные типы нейронов преоптической области переднего гипоталамуса (а именно, тепло- и холодочув-ствительные).
- Выяснение индивидуальных эффектов на нейроэндокринный ответ различных стрессовых факторов (двигательной активности, интенсивного внешнего теплового воздействия).
- Определение специфических воздействий вида, продолжительности, интенсивности и прерывистого характера двигательной активности на нейроэндокринную реакцию.
- Выяснение направленности долговременных нейроэндокринных адаптаций, происходящих во время тепловой акклиматизации.
- Изучение влияния особенностей питания, включая потребление жидкости на нейроэндокринный ответ.
- Оценка изменений нейроэндокринной функции после теплового удара и теплового истощения, вызванного чрезмерным напряжением, направленная на выявление необратимых изменений.
Читайте также[править | править код]
- Тренировки и адаптация в условиях гор
- Тепловой баланс организма: термогенез, теплоотдача
- Аргининвазопрессин
- Тренировки в холодное время
- Тренировки в период полового созревания
Литература[править | править код]
- Adams, W.C, Fox, R.H., Fry, A.J. & MacDonald, I.C. (1975) Thermoregulation during marathon running in cool, moderate and hot environments. Journal of Applied Physiology 38, 1030-1037. Aldercreutz, H., Kuoppasalmi, K., *Kosunen, K., Pakarinen, A. & Karonen, S.L. (1976) Plasma cortisol, growth hormone and prolactin levels during exposure to intense heat. IRCS Medical Science: Endocrine System, Environmental Biology and Medicine 4, 546. *Appenzeller, O., Khogali, М., Carr, D.B. et ah (1986) Makkah hajj: heat stroke and endocrine responses. Annals of Sports Medicine 3, 30-32.
- Armstrong, L.E. & Anderson, J.M. (2003) Heat exhaustion, exercise-associated collapse, and heat syncope. In: Exertional Heat Illnesses (Armstrong, L.E., ed.). Human Kinetics, Champaign, IL: 57-90. Armstrong, L.E. & Maresh, CM. (1991) The induction and decay of heat acclimatization in trained athletes. Sports Medicine 12, 302-312.
- Armstrong, L.E. & Maresh, CM. (1998) Effects of training, environment, and host factors on the sweating response to exercise. International Journal of Sports Medicine 19, S103-S105.
- Armstrong, L.E. & Pandolf, K.B. (1988) Physical training, cardiorespiratory physical fitness and exercise-heat tolerance. In: Human Performance Physiology and Environmental Medicine at Terrestrial Extremes (Pandolf, K.B., Sawka, M.N. & Gonzalez, R.R., eds.). Benchmark Press, Indianapolis, IN: 199-226. Armstrong, L.E. & Stoppani, J. (2002) Central nervous system control of heat acclimation adaptations: an emerging paradigm. Reviews in the Neurosciences 13, 271-285.
- Armstrong, L.E. & VanHeest, J.L. (2002) The unknown mechanism of the overtraining syndrome. Sports Medicine (New Zealand) 32, 185-209.
- Armstrong, L.E., Hubbard, R.W., Jones, B.H. & Daniels, J.T. (1986) Preparing Alberto Salazar for the heat of the 1984 Olympic marathon. Physician and Sports Medicine 14, 73-81.
- Armstrong, L.E., Hubbard, R.W., DeLuca, J.P. & Christensen, E.L. (1987) Heat acclimatization during summer running in the northeastern United States. Medicine and Science in Sports and Exercise 19, 131-136.
- Armstrong, L.E., Hubbard, R.W., Szlyk, P.C, Sils, I.V. & Kraemer, W.J. (1988) Heat intolerance, heat exhaustion monitored: a case report. Aviation Space Environmental Medicine 59, 262-266.
- Armstrong, L.E., Francesconi, R.P., Kraemer, W.J. et al. (1989) Plasma cortisol, renin, and aldosterone during an intense heat acclimation program. International Journal of Sports Medicine 10(1), 38-42.
- Armstrong, L.E., Maresh, CM., Gabaree, CV. et al (1997) Thermal and circulatory responses during exercise: effects of hypohydration, dehydration, and water intake. Journal of Applied Physiology 82, 2028-2035.
- Baumann, G. (1999) Growth hormone heterogeneity in human pituitary and plasma. Hormone Research 51 (suppl. 1), 2-6.
- Bemardes, R.P. & Radomski, M.W. (1998) Growth hormone responses to continuous and intermittent exercise in females under oral contraceptive therapy. European Journal of Applied Physiology 79(1), 24-29.
- Blatteis, CM. (1998) Fever. In: Physiology and Pathophysiology of Temperature Regulation (Blatteis, CM., ed.). World Scientific, River Edge, NJ: 178-205.
- Boisvert, P., Brisson, G.R. & Peronnet, F. (1993) Effect of plasma prolactin on sweat rate and sweat composition during exercise in man. American Journal of Physiology 264, F816-F820.
- Borer. К.Т. (2003) Exercise as an emergency and a stressor. In: Exercise Endocrinology. Human Kinetics, Champaign. IL: 77-95.
- Boulant, J.A. (1996) Hypothalamic neurons controlling body temperature. In: Handbook of Physiology: Section 4. Environmental Physiology (Blatteis, CM. & Fregly, M.J., eds.). Oxford University Press, New York: 105-126.
- Boulant, J.A. & Hardy, J.D. (1974) The effect of spinal and skin temperatures on the firing rate and local thermosensitivity of preoptic neurons. Journal of Physiology 216, 1371-1374.
- Brenner, I.K.M., Zamecnik. J., Shek, P.N. & Shephard. R.J. (1997) The impact of heat exposure and repeated exercise on circulating stress hormones. European Journal of Applied Physiology 76, 445-454.
- Brezenoff, H.E. & Lomax, P. (1970) Temperature changes following microinjection of histamine into the thermoregulatory centers of the rat. Experientia 26, 51-52.
- Casa, D.J. & Armstrong, L.E. (2003) Exertional heatstroke: a medical emergency. In: Exertional Heat Illnesses (Armstrong, L.E., ed.). Human Kinetics, Champaign, IL: 29-56.
- Castellani, J.W., Maresh, CM., Armstrong, L.E. et al. (1997) Intravenous vs. oral rehydration: effects on subsequent exercise-heat stress. Journal of Applied Physiology 82(3), 799-806.
- Chen, X.-M., Hosono, Т., Yoda, Т., Fukuda, Y. & Kanosue, K. (1998) Efferent projection from the preoptic area for the control of non-shivering thermogenesis in rats. Journal of Physiology 512, 883-892.
- Chen, Z.f Yuhanna, I.S., Galcheva-Gargova, Z. et al. (1999) Estrogen receptor a mediates the nongenomic activation of endothelial nitric oxide synthase by estrogen. Journal of Clinical Investigation 103(3), 401-406.
- Christman, J.V. & Gisolfi, C.V. (1980) Effects of repeated heat exposure on hypothalamic sensitivity to norepinephrine. Journal of Applied-Physiology 49(6), 942-945.
- Christman, J.V. & Gisolfi, C.V. (1985) Heat acclimation: role of norepinephrine in the anterior hypothalamus. Journal of Applied Physiology 58(6), 1923-1928.
- Clark, W.G. (1979) Changes in body temperature after administration of amino acids, peptides, dopamine, neuroleptics and related agents. Neuroscience and Biobehavioral Reviews 3, 179-231.
- Clark, W.G. & Fregly, M.J. (1996) Evidence for roles of brain peptides in thermoregulation. In: Handbook of Physiology: Section 4, Environmental Physiology, vol. 1 (Blatteis, CM. & Fregly, M.J., eds.). Oxford University Press, New York: 139-153.
- Clark, W.G. & Upton, J.M. (1986) Changes in body temperature after administration of adrenergic and serotonergic agents and related drugs including antidepressants: II. Neuroscience and Biobehavioral Reviews 10, 153-220.
- Davis, S.N., Galassetti, P., Wasserman, D.H. & Tate, D. (2000) Effects of gender on neuroendocrine and metabolic counterregulato-ry responses to exercise in normal man. Journal of Clinical Endocrinology and Metabolism 85, 224-230.
- DeSouza, E.B. & Appel, N.M. (1991) Distribution of brain and pituitary receptors involved in mediating stress responses. In: Stress-Neurobiology and Neuroendocrinology (Brown, M.R., Koob, G.F. & Rivier, C, eds.). Marcel Dekker, New York: 91-117.
- Eguchi, N., Minami, Т., Shirafuji, N. et al. (1999) Lack of tactile pain (allodynia) in lipocalin-type prostaglandin D synthase-deficient mice. Proceedings of the National Academy of Sciences of the United States of America 96, 726-730.
- Feldberg, W. & Myers, R.D. (1963) A new concept of temperature regulation by amines in the hypothalamus. Nature (London) 200, 13-25.
- Feldberg, W. & Myers, R.D. (1964) Effects on temperature of amines injected into the cerebral ventricles. A new concept of temperature regulation. Journal of Physiology (London) 173, 226-237.
- Follenius, М., Brandenberger, G., Simeoni, M. & Reinhardt, B. (1979) Plasma aldosterone, prolactin, ACTH: relationships in man during heat exposure. Hormone and Metabolic Research 11, 180-181.
- Francesconi, R.P., Sawka, M.N. & Pandolf, K.B. (1984) Hypohydration and acclimation: effects on hormone responses to
exercise /heat stress. Aviation Space and Environmental Medicime 5S, 365-369
- Galbo. H. (1986) Autonomic neuroendocrine responses to exercise. Scandinavian Journal of Sports Science 8, 3-17
- Gibbins. I.L. & Morris. J.L. (2000) Pathway specific expression of neuropeptides and autonomic control of the vasculature. Regulatory Peptides 93(1-3). 93-107.
- Giustina, A. & Veldhuis, J.D. (1998) Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human. Endocrine Reviews 19(6). 717-797.
- Gordon. CJ. (1993) Temperature Regulation in Laboratory Rodents. Cambridge University Press. New York: 180-190.
- Guyton, A.C. & Hall, J.E. (1996) Textbook of Medical Physiology. 9th edn. W.B. Saunders Co., Philadelphia: 769-777.
- Hammel, H.T. (1965) Neurons and temperature regulation. In: Physiological Controls and Regulations (Yamamoto, W.S. & Brobeck, J.R., eds.). W.B. Saunders Co., Philadelphia: 71-97.
- Hannuksela, M.L. & Samer, E. (2001) Benefits and risks of sauna bathing. American Journal of Medicine 110(2), 118-126.
- Hansen, A.P. & Weeke, J. (1974) Fasting serum growth hormone levels and growth hormone responses to exercise during normal menstrual cycles and cycles of oral contraceptives. Scandinavian Journal of Clinical Laboratory Investigations 34(3), 199-205.
- Hartung, G.H., Myhre, L.G., Tucker, D M. & Burns, J.W. (1987) Hormone and energy substrate changes during prolonged exercise in the heat. Aviation Space Environmental Medicine 58, 24-28.
- Hasan, J., Karvonen, M.J. & Pilronen, P. (1966) Special review. Part I. Physiological effects of extreme heat as studied in the Finnish 'sauna' bath. American Journal of Physical Medicine 45(6), 296-314.
- Hjortskov, J.A., Jepsen, L.T., Nielsen, B. et al. (1995) Growth hormone deficiency and hyperthermia during exercise: a controlled study of 16 GH-deficient patients. Journal of Clinical Endocrinology and Metabolism 80(11), 3335-3340.
- Hoffman, J.R., Maresh, CM., Armstrong, L.E. et al. (1994) Effects of hydration state on plasma testosterone, cortisol and catecholamine concentrations before and during mild exercise at elevated temperature. European Journal of Applied Physiology 69. 294-300.
- Hoffman, J.R., Falk, B., Radom-Isaac, S. et al. (1997) The effect of environmental temperature on testosterone and cortisol responses to high intensity, intermittent exercise in humans. European Journal of Applied Physiology 75, 83-87.
- Horowitz, M. (1998) Do cellular heat acclimation responses modulate central thermoregulatory activity? News in Physiological Sciences 13, 218-225.
- Horowitz, M. (2003) Matching the heart to heat-induced circulatory load: heat-acclimatory responses. News in Physiological Sciences 18, 215-221.
- Horowitz, M. & Gival, N. (1989) Heat acclimation and heat stress: cardiac output distribution, plasma volume expansion and the involvement of the adrenergic pathway. In: Thermoregulatory Research and Clinical Applications (Lomax, P. & Schonbaum, E., eds.). Karger, Basel, Switzerland: 204-207.
- Horton, R.W., LeFeuvre, R.A., Rothwell, N.J. & Stock, M.J. (1988) Opposing effects of activation of central GABAA and GAB A В receptors on brown fat thermogenesis in the rat. Neuropharmacology 27, 363-366.
- Horton, T.J., Pagliasotti, M.J., Hobbs, K. & Hill, J.O. (1998) Fuel metabolism in men and women during and after long-duration exercise. Journal of Applied Physiology 85(5), 1823-1832.
- Hussi, E., Sonck, Т., Poso, H. et al. (1977) Plasma catecholamines in Finnish sauna. Annals of Clinical Research 9, 301-304.
- Jackson, H.C. & Nutt, D.J. (1991) Inhibition of baclofen-induced hypothermia in mice by the novel G ABAB antagonist CGP 35348. Neuropharmacology 30, 535-538.
- Jessen, С (1996) Interaction of body temperatures in control of thermoregulatory effector mechanisms. In: Handbook of Physiology: Section 4, Environmental Physiology, vol. 1 (Blatteis, CM. & Fregly, M.J., eds.). Oxford University Press, New York: 127-138.