Иммунитет — различия между версиями
Kron (обсуждение | вклад) (Новая страница: «== Иммунная система == Организм имеет неспецифическую (врожденную) Иммунная система|имм…») |
Ars (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| + | {{DISPLAYTITLE:Специфический и неспецифический иммунитет}} | ||
== Иммунная система == | == Иммунная система == | ||
Версия 20:41, 30 января 2015
Содержание
Иммунная система
Организм имеет неспецифическую (врожденную) иммунную защиту, которая дополняется специфической (приобретенной) иммунной защитой, что позволяет противостоять бактериям, вирусам, грибам, паразитам и чужеродным макромолекулам. Защитные функции организма действуют через антигены, т. е. вещества, стимулирующие специфическую иммунную систему, активируя антигенспецифичные Т-лимфоциты (Т-клетки) и В-лимфоциты (В-клетки). В-Лимфоциты дифференцируются в плазмоциты (плазматические клетки), которые секретируют антигенспецифичные антитела (иммуноглобулины, Ig) (В). Ig нейтрализуют и опсонизируют антигены, а также активируют систему комплемента. Такие механизмы обеспечивают специфическое распознавание соответствующего антигена и последующее его удаление неспецифическим путем. Некоторые Т- и В-клетки имеют иммунную память.
Предшественники лимфоцитов без антигенсвязывающего рецептора подвергаются препроцессингу в тимусе (Т) и костном мозге (В). Эти органы производят до 108 моноспецифичных Т- или В-клеток, каждая из которых направлена против специфичного антигена. Наивные Т- и В-клетки, которые не сталкивались еще с антигеном, циркулируют в организме (кровь → периферические лимфатические ткани → лимфа → кровь) и претерпевают клональную экспансию и селекцию после контакта со своим специфическим антигеном (обычно в лимфатической ткани). Затем лимфоциты начинают быстро делиться, производя многочисленные моноспецифичные дочерние клетки. Потомство дифференцируется в клетки плазмы (плазмоциты) или в «вооруженные» Т-клетки, которые инициируют уничтожение антигена.
Клональные делеции - это механизм уничтожения лимфоцитов с рецепторами, направленными против собственной ткани. После первого контакта с их аутоспецифичным антигеном эти лимфоциты в ранние стадии развития уничтожаются в тимусе или костном мозге. Клональные делеции приводят к центральной иммунологической толерантности. Способность иммунной системы различать эндогенные и чужеродные антигены называется распознаванием «свое-чужое». Эта способность формируется почти сразу от рождения. Все вещества, с которыми сталкивается к этому времени организм, считаются эндогенными («своими»), остальные идентифицируются как чужеродные («чужие»).
Неспособность различать эндогенные и экзогенные компоненты проявляется в виде аутоиммунных заболеваний.
При первом контакте с вирусом (например, вирусом кори) неспецифические иммунные механизмы обычно не могут предотвратить вирусную пролиферацию и развитие кори. Специфичная иммунная система со своими Т-киллерами (Б2) и Ig (сначала IgM, а затем IgG; ВЗ) реагирует медленно: происходит первичный иммунный ответ, или сенсибилизация. После активации иммунных функций патоген уничтожается, т. е. человек излечивается от кори. Вторичный иммунный ответ, или сенсибилизация: при вторичном инфицировании специфический IgG продуцируется гораздо быстрее. Вирус быстро уничтожается, и болезнь во второй раз не развивается. Такая форма защиты от инфекционных болезней называется иммунитетом. Он может быть достигнут вакцинацией при помощи специального антигена (активная иммунизация). Пассивную иммунизацию можно провести, вводя уже готовые Ig (иммунную сыворотку).
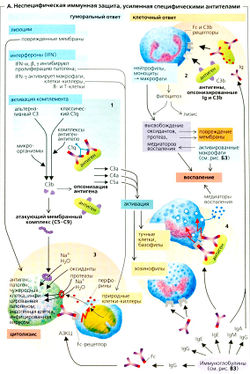
Неспецифический иммунитет
Лизоцим и факторы комплемента, присутствующие в плазме (А1), а также «естественные» клетки-киллеры (NK) и фагоциты, особенно нейтрофилы и макрофаги, которые происходят от моноцитов, мигрирующих в ткани (А2), играют важную роль в неспецифическом иммунитете. В организме циркулируют нейтрофилы, моноциты и эозинофилы. Они имеют рецепторы хемокинов (например, CXCR1 и 2 для IL-8) и прикреплены посредством различных хемокинов (например, IL-8) к тем участкам, в которые вторглись микроорганизмы (хемотаксис). Эти клетки способны мигрировать. Они закрепляются на эндотелии (маргинация) при помощи селектинов, проникают сквозь эндотелий (диапедез), поглощают и повреждают микроорганизмы с помощью лизоцима, оксидантов (например, Н2О2), кислородных радикалов (О2, ОН*, и оксида азота (N0). За этим следует расщепление (лизис) микроорганизма при помощи ферментов лизосом. Если антиген оказывается слишком большим для расщепления (паразитический червь и т. д.), этими клетками также экзоцитируются другие агенты, участвующие в неспецифическом иммунитете (например, протеазы и цитотоксические белки).
Восстанавливающие ферменты, такие как каталаза и супероксиддисмутаза, обычно поддерживают концентрацию оксидантов на низком уровне. Это состояние часто нарушается, особенно при активации макрофагов (см. ниже и БЗ), чтобы полностью использовать бактерицидный эффект оксидантов. Однако возникающее воспаление (А2,4) повреждает клетки, участвующие в неспецифической защите, а в некоторых случаях даже другие клетки.
Опсонизация (А1, 2) заключается в связывании опсонинов, например IgG или фактора комплемента С3b, со специфическими доменами антигена, тем самым усиливается фагоцитоз. Это единственный способ фагоцитировать бактерии с полисахаридной оболочкой. Фагоциты имеют рецепторы на поверхности для (антигеннезависимого) Fc-сегмента IgG, а также для С3b. Таким образом, антигенсвязанные IgG и С3b связываются с соответствующими им рецепторами, соединяя тем самым неспецифичный процесс фагоцитоза со специфической системой иммунной защиты. Углеводсвязывающие белки (лектины) плазмы - коллектины (например, маннозосвязывающий белок), которые закрепляются на клеточных стенках микробов, также действуют как неспецифические опсонины.
Каскад комплемента активируется антигенами, опсонизованными Ig (классический путь), а также неопсонофильными антигенами (альтернативный путь) (А1). Компоненты комплемента СЗа, С4а и С5а активируют базофилы и эозинофилы (А4). Компоненты комплемента С5-С9 генерируют мембранноатакующий комплекс (МАК), который перфорирует и убивает (грамотрицательные) бактерии путем цитолиза (АЗ). Этой форме защиты способствует лизоцим (=мурамидаза), фермент, разрушающий бактериальные клеточные стенки, содержащие муреин. Это происходит в гранулоцитах, плазме, лимфе и секретах.
«Естественные» клетки-киллеры (NK) - это большие гранулярные лимфоциты, специализирующиеся на неспецифической защите против вирусов, микобактерий, опухолевых клеток и т. д. Они распознают инфицированные и опухолевые клетки по «чужеродным поверхностям» и закрепляются при помощи своих Fc-рецепторов на lgG-опсонированных поверхностных антигенах (антителозависимая клеточноопосредованная цитотоксичность, АЗКЦ; АЗ). Перфорины, зкзоцитируемые «естественными» клетками-киллерами, формируют поры в стенках клеток-мишеней, таким образом способствуя их дальнейшему лизису (цитолизу). Это не только препятствует пролиферации патогена (ферментного инструмента клетки), но также превращает его (и другие внутриклеточные патогены) в объект атаки других защитных механизмов.
Различные интерфероны (IFN) стимулируют активность «естественных» клеток-киллеров: IFN-a, IFN-β и, в меньшей степени, IFN-y. IFN-a и IFN-β высвобождаются в основном лейкоцитами и фибробластами, тогда как IFN-y поступает из активированных Т-клеток и «естественных» клеток-киллеров. Инфицированные вирусом клетки поступает большое количество интерферонов, что приводит к повышенной вирусоустойчивости неинфицированных вирусом клеток. Дефенсины - это цитотоксические пептиды, высвобождаемые фагоцитами. Они могут оказывать неспецифичное цитотоксическое действие на патогены, устойчивые к «естественным» клеткам-киллерам (например, путем формирования ионных каналов в мембранах клеток-мишеней).
Макрофаги происходят от моноцитов, мигрирующих в ткани. Некоторые макрофаги свободно подвижны (свободные макрофаги), тогда как другие (фиксированные макрофаги) ограничены некоторой областью, например находятся в печеночном синусе (клетках Купфера), легочных альвеолах, серозной оболочке кишечника, синусе селезенки, лимфатических узлах, коже (клетках Лангерганса), суставной жидкости (синовиальных A-клетках), мозге (микроглии) или эндотелии (например, почечных клубочков). Система мононуклеарных фагоцитов lor англ. MPS) - это общий термин для моноцитов, циркулирующих в крови, и макрофагов, циркулирующих в тканях. Макрофаги распознают сравнительно неспецифические углеводные компоненты на поверхности бактерий и поглощают их путем фагоцитоза. Макрофаги активируются в том случае, если патогены выживают внутри фагосом (см. ниже и БЗ).
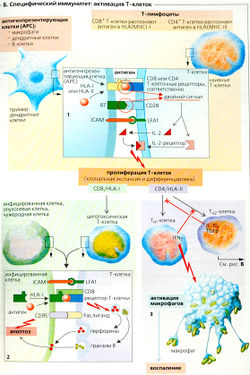
Специфический иммунитет: клеточно-опосредованный иммунный ответ
Поскольку специфический клеточноопосредованный иммунный ответ при помощи «вооруженных» эффекторных Т-клеток требует для активации несколько дней, он называется иммунным ответом замедленного типа. Он требует участия специализированных антигенпрезентирующих клеток (АРС): дендритных клеток, макрофагов и В-клеток. АРС-клетки обрабатывают и презентируют антигенные пептиды Т-клеткам, ассоциированным с МНС-1 и МНС-ll белками, передавая тем самым сигнал костимулятора, необходимый для активации наивных Т-клеток. (Гены, кодирующие эти белки, относятся к главным комплексам гистосовместимости (МНС) I (МНС-1) и II (МНС-ll) классов; HLA [человеческий лейкоцитарный антиген) - принятое обозначение МНС человека.) Инфицированные вирусом дендритные клетки (локализованные в основном в лимфатической ткани) обычно выступают в роли АРС. Такая HLA-зависимая презентация антигена (Б1) включает в себя введение антигена в участок связывания HLA. ICAM [от англ, молекула внутриклеточной адгезии) на поверхности АРС затем связывается с LFA1 (антиген 1, ассоциированный с функцией лимфоцитов) на мембране Т-клеток. Когда Т-клетки, специфические для данного антигена, образуют комплекс, связь усиливается, и двойной сигнал АРС стимулирует активацию и клональную селекцию Т-клеток (Б1).
Двойной сигнал APG состоит из: 1) распознавания антигена (HLA-зависимого антигена I или II класса) при помощи рецепторов Т-клеток и их корецепторов и 2) кости-муляторного сигнала, т. е. связывания белка 67 (на АРС) с белком CD28 на Т-клетке (Б1). Молекулы CD8 на цитотоксических Т-клетках (Тс-клетка = Т-киллерная клетка) и молекулы CD4 на хелперных Т-клетках (ТH-клетка) функционируют как корецепторы. Когда связывание антигена происходит без костимуляции (например, в печени, где нет АРС), лимфоциты инактивируются, т. е. становятся энергичными, и развивается периферическая иммунная толерантность.
Т-клетки могут получать двойной сигнал АРС от инфицированных макрофагов или В-клеток, обеспечивая связывание их рецепторов с данным антигеном (например, яда насекомого или змеи, или аллергена). Двойной сигнал АРС заставляет Т-клетки выделять интерлейкин-2 (IL-2) и связываться с соответствующим рецептором интерлейкина-2 (В1). IL-2 является реальным сигналом для клональной экспансии этих моноспецифических Т-клеток. Он действует через аутокринные и паракринные механизмы.
Применяя ингибиторы IL-2, такие как циклоспорин А, можно достичь мощной иммуносупрессии, например, при трансплантации органов.
Во время клональной экспансии Т-клетки дифференцируются на три «вооруженных» подтипа, т. е. цитотоксические Т-клетки (Тс-клетки, или Т-киллеры) и Т-хелперы типа I (ТH1-клетки) и типа II (ТH2-клетки). Эти клетки не нуждаются более в костимуляции и экспрессируют другой тип молекул адгезии (VLA-4 вместо L-селектинов), с помощью которых они теперь закрепляются на эндотелии воспаленных тканей (скорее, чем в лимфатической ткани, как делали их необученные предшественники].
Т-киллеры развиваются из наивных, содержащих CD8 (CD8+) Т-клеток после HLA-l-зависимой презентации антигена (Б2). Эндогенная презентация антигена происходит, когда белок HLA-I поглощает антиген (патоген, белок цитозоля) из цитозоля АРС, как это обычно и происходит. Вместе с рецептором Т-клетки, ассоциированным с белком CD8, Т-киллерная клетка способна распознавать HLA-I-рестриктированные антигены на инфицированных (вирусом) эндогенных клетках, на опухолевых клетках, а также на клетках трансплантированных органов. Это последовательно ведет клетку к апоптозу (программируемой смерти клетки) или некрозу. Связывание Fas-лиганда с CD95 (= Fas) приводит к тому же, что и протеаза гранзим В, которая входит в клетку через поры, образованные поглощенными (путем экзоцитоза) перфоринами (Б2).
Когда происходит HLA-ll-зависимая презентация (Б1) антигена из внутриклеточных везикул (например, поглощенные (путем фагоцитоза) бактерии или белки вирусной оболочки, т. е. экзогенная презентация антигена), наивные СD4+-Т-клетки трансформируются в незрелые Т-хелперы (7/уд), которые дифференцируются в ТH1- или Т-клетки. ТН1-клетки индуцируют воспалительный ответ и способствуют активации макрофагов при помощи IFN-y (БЗ), тогда как Тн2-клетки необходимы для активации В-клеток (В2). ТH1- или Тн2-клетки супрессируют друг друга, благодаря чему только один тип клеток из этих двух будет преобладать в клеточноопосредованном иммунном ответе (БЗ).
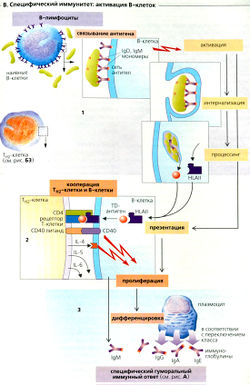
Специфический иммунитет: гуморальный иммунный ответ
Гуморальный иммунитет - это функция В-клеток (В1). Многочисленные мономеры IgD и IgM, прикрепленные к поверхности В-клеток, связывают соответствующий антиген (в растворе IgM существует в форме пентамера). Образующаяся сеть антигенсвязанных lg ведет к интернализации (поглощению) и процессингу комплекса антиген-антитело в В-клетках. Однако активация В-клеток требует второго сигнала, который может поступать прямым путем от тимуснезависимого (TI, от англ, independ) антигена (например, бактериального полисахарида) или косвенным - от Тн2-кпеток в случае тимусзависимого (TD, от англ, depend) антигена. В последнем случае В-клетки передают HLA-ll-рестриктированный TD антиген Тн2-клеткам (В2). Если С04-ассоциированный Т-клеточный рецептор (TCR) Тн2-клеток распознает антиген, то на поверхности Тн2-клеток экспрессируются лиганды CD40 (лиганды CD40 связываются с белками CD40 на поверхности В-клеток) и секретируется IL-4. Лиганд CD40 и IL-4 (далее также IL-5 и IL-6) стимулируют клональную селекцию В-клеток, секрецию IgM и их дифференцировку в плазмоциты (ВЗ). Перед дифференцировкой может произойти переключение классов lg, т. е. при помощи альтернативного сплайсинга ДНК могут быть экспрессированы разные типы тяжелых цепей lg. Таким образом, IgM превращается в IgA, IgG или IgE. Все типы lg, происходящие от данного клона В-клеток, остаются моноспецифичными к одному и тому же антигену. Плазмоциты, образованные после переключения классов, производят только один тип иммуноглобулинов.