Препараты для лечения мегалобластной анемии
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Витамин В12, фолиевая кислота и лечение мегалобластных анемий
Витамин В12 (Цианокобаламин) и фолиевая кислота — незаменимые компоненты пищи. Нехватка любого из этих витаминов нарушает синтез ДНК во всех делящихся клетках. Особенно чувствительны к их дефициту активно пролиферирующие ткани, в частности кроветворная. Мегалобластная анемия — ранний признак дефицита; при этом тяжелая анемия сочетается с макроцитозом. Сделанное более 100 лет назад описание нарушения кроветворения при этой патологии, названной пернициозной анемией, стимулировало исследования, которые привели к открытию витамина В]2 и фолиевой кислоты. Характерная картина крови по сей день используется для диагностики и оценки результатов лечения после назначения этих витаминов.
Историческая справка
Увлекательная история открытия витамина В12 и фолиевой кислоты началась более 170 лет назад. Она включает два открытия, отмеченные Нобелевскими премиями. Первые описания мегалобластной анемии были сделаны, по-видимому, Кумбом и Аддисоном в 1824 г. Уже тогда Кумб предположил, что болезнь каким-то образом связана с пищеварением, колишьв 1860 г. Остин Флинт впервые описал резкую атрофию слизистой желудка и предположил ее возможную связь с анемией. Термин «прогрессирующая пернициозная анемия» был введен Бирмером в 1872 г. Он сохранился до наших дней, хотя чаще мегалобластную анемию называют болезнью Аддисона—Бирмера.
В 1925 г. Уиппл сообщил о наличии в печени фактора, резко усиливающего кроветворение у собак с железодефицитной анемией. На основании этого наблюдения Майнот и Мэрфи (удостоенные позднее Нобелевской премии) показали, что питание сырой печенью помогает при пернициозной анемии. Через несколько лет Касл установил, что для этого необходим «внутренний фактор», секретируемый обкладочными клетками слизистой желудка, и витаминоподобный «внешний фактор», содержащийся в экстрактах сырой печени. Почти 20 лет спустя Рикс с сотр. и Смите Паркером сумели выделить витамин В12 в чистом виде. Дороти Ходжкин определила его структуру с помощью рентгеноструктурного анализа и впоследствии получила за эту работу Нобелевскую премию.
Пока предпринимались попытки выделить внешний фактор в чистом виде, Уиллз с сотр. описали у индийских женщин мак-роцитарную анемию, также поддающуюся лечению экстрактами сырой печени, но не их очищенными фракциями, эффективными при пернициозной анемии (Wills et al., 1937). Этот фактор, названный вначале фактором Уиллз, а позднее витамином М, представлял собой фолиевую кислоту. Этот термин (от латинского folium —лист) был предложен в 1941 г. Митчелломс сотр., выделившими ее из листовых овощей.
Более поздние работы показали, что выделенные из пищи витамин В12 и фолиевая кислота не проявляют коферментных свойств. Во время выделения их неустойчивые активные формы превращаются в цианокобаламин и птероилглутаминовую кислоту, которые для проявления биологической активности нуждаются в химической модификации in vivo. Хотя внутриклеточные превращения этих веществ изучены неплохо, остается еще целый ряд вопросов. Самый важный из них — это связь авитаминоза В12с неврологическими нарушениями, возникающими при этом состоянии (Chanarin et al., 1985).
Взаимосвязь витамина В12 и фолиевой кислоты
Основные метаболические процессы, в которых участвуют витамин В,2 и фолиевая кислота, показаны на рис. 54.6. Внутри клетки витамин В12 существует в виде двух активных коферментов: метилкобаламина и аденозилкобаламина (Linnell et al., 1971). Аденозилкобаламин (5'-дезоксиаденозилкобаламин) служит коферментом митохондриальной метилмалонил-КоА-мутазы, которая катализирует изомеризацию L-метилмалонил-КоА в сукцинил-КоА(Weissbach and Taylor, 1968). Эта реакция важна для углеводного и липидного обмена, но никак не связана с метаболизмом фолиевой кислоты. Напротив, метилкобаламин требуется для работы метионинсинтазы, необходимой для нормального метаболизма фолиевой кислоты (Weir and Scott, 1983). Метильные группы, отдаваемые метил-ТГФК, идут на образование метилкобаламина, служащего донором метильной группы при синтезе метионина из гомоцистеина. Это взаимодействие фолиевой кислоты с кобаламином жизненно важно для нормального синтеза пуринов и пиримидинов, а следовательно, и ДНК. Реакция, катализируемая метионинсинта-зой, отвечает за кругооборот фолатных коферментов, поддержание внутриклеточной концентрации полиглутаматов фолиевой кислоты и, через синтез метионина и его производного, S-аденозилметионина, за поддержание ряда реакций метилирования.
Так как метил-ТГФК — основное производное фолиевой кислоты, поступающее в клетку, перенос метильной группы на кобаламин жизненно важен для образования ТГФК, субстрата множества обменных процессов. Из ТГФК образуются внутриклеточные полиглутаматы фолиевой кислоты. ТГФК служит также акцептором метиленовой группы при превращении серина в глицин с образованием 5,10-метилен-ТГФК. Метиленовая группа переносится от последнего на дезокси-УМФ с образованием дезокси-ТМФ, необходимого для синтеза ДНК. В ходе этой реакции 5,10-метилен-ТГФК превращается в дигид-рофолиевую кислоту. Цикл завершается восстановлением дигидрофолиевой кислоты в ТГФК с помощью дигидрофолатредукгазы (этот этап блокируется антагонистами фолиевой кислоты, например метотрексатом; см. гл. 52). Как показано на рис. 54.6, есть еще несколько путей синтеза 5,10-метилен-ТГФК. Они важны для метаболизма формиминоглутаминовой кислоты, пуринов и пиримидинов (Weir and Scott, 1983; Chanarin et al., 1985).
При дефиците витамина Bl2 или фолиевой кислоты сниженный синтез метионина и S-аденозилметионина нарушает многие реакции метилирования, синтез белков и полиаминов. Кроме того, внутриклеточный метаболизм фолиевой кислоты смещается в сторону образования большего количества метил-ТГФК. При этом жизненно важные реакции метилирования продолжают идти ценой синтеза нуклеиновых кислот. При дефиците витамина В12 возрастает активность метилен-ТГФК-ре-дуктазы, что приводит к переходу всех внутриклеточных фолатов в метилтетрагидрофолаты. Из-за дефицита витамина В|2, который принимает и переносит метильные группы, фолаты оказываются метилированы, а прочие этапы их метаболизма, требующие ТГФК, лишаются субстрата — возникает «фолатная ловушка». Эти процессы лежат в основе мегалобластных анемий при дефиците витамина В|2 и фолиевой кислоты.
Механизмы развития неврологических нарушений при дефиците витамина В|2 изучены гораздо хуже (Reynolds, 1976; Weir and Scott, 1983). В их основе лежит повреждение миелиновой оболочки. Это наблюдение позволило предположить связь неврологических нарушений с одним из этапов метаболизма пропионата, который катализируется метилмалонил-КоА-мутазой, содержащей аденозил кобаламин. Подругам данным, причиной нарушений служат недостаточность метионинсинтазы и подавление превращения метионина в S-аденозилметионин (Scott et al., 1981).
При использовании для общей анестезии закиси азота (гл. 14) могут развиться мегалобластное кроветворение и полинейропатия, сходная с таковой при В12-дефицитной анемии (Chanarin et al., 1985). Исследования показали, что закись азота снижает активность метионинсинтазы и концентрации метионина и S-аденозилметионина. Последний нужен для реакций метилирования, которые участвуют в синтезе фосфолипидов и миелина. Существенно то, что полинейропатию, вызванную закисью азота, можно частично предотвратить с помощью метионина. Схожая полинейропатия описана у стоматологов, использующих закись азота для анестезии (Layzer, 1978).
Витамин В12
Химическая структура
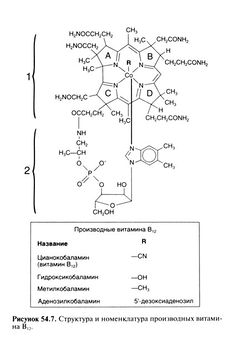
Структурная формула витамина В12 приведена на рис. 54.7 (Pratt, 1972). Его молекула состоит из трех частей: 1) плоская часть, или корриновое ядро, — кольцевая порфириноподобная структура с четырьмя восстановленными пиррольными кольцами (на рис. 54.7: A—D), связанными с центральным атомом кобальта и множеством метильных, ацетамидных и пропионамидных остатков; 2) 5,6-диметилбензимидазо-льный нуклеотид, соединенный почти под прямым углом с корриновым ядром через атом кобальта и боковую пропионатную цепь пиррольного кольца С; 3) R-группа, связанная с атомом кобальта в шестом координационном положении. R-группы наиболее важных стабильных форм витамина В12, цианокобаламина и гидроксикобаламина, а также активных коферментов, метилкобаламина и аденозилкобаламина, приведены на рис. 54.7.
Термины витамин B12 и цианокобаламин взаимозаменяемы и используются для обозначения всех кобамидов, активных у человека. В лечебных целях используют препараты, содержащие цианокобаламин и гидроксикобаламин, так как лишь они не разрушаются при хранении.
Роль в обмене веществ
Активные коферменты, метилкобаламин и аденозилкобаламин, незаменимы для роста и деления клеток. Метилкобаламин нужен для образования метионина и S-аденозилметионина из гомоцистеина. Кроме того, при дефиците витамина В12 происходит накопление метилтетрагидрофолатов, вызывая дефицит всех других форм фолиевой кислоты (см. выше, а также рис. 54.6 и 54.7). Именно этот процесс приводит к нарушениям кроветворения при авитаминозе В12 (Herbert and Zalusky, 1962). Аденозилкобаламин участвует в изомеризации Ь-метилмалонил-КоАвсукцинил-КоА(рис. 54.6). Источники. В организме человека витамин В12 не образуется. Однако некоторые микроорганизмы, живущие в почве, воде, нечистотах и кишечнике животных, способны синтезировать этот витамин. Растительные продукты, не загрязненные такими микробами, не содержат витамина В12, так что животные зависят от его выработки микроорганизмами в ЖКТ или от потребления животной пищи, содержащей этот витамин. Суточная потребность человека в витамине (3—5 мкг) удовлетворяется за счет продуктов животного происхождения. В то же время у строгих вегетарианцев дефицит витамина В12 редок. Некоторое его количество они получают с бобовыми, которые загрязняются бактериями, способными к синтезу витамина В,2; кроме того, вегетарианцы обычно обогащают пищу разнообразными витаминами и минеральными веществами.
Всасывание, распределение, потери и суточная потребность
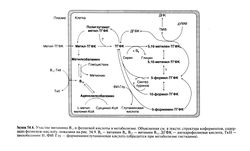
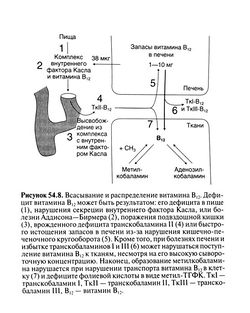
В желудке витамин В12, содержащийся в пище, высвобождается и связывается с R-белками, обнаруженными в слюне и желудочном соке. В двенадцатиперстной кишке под действием панкреатических ферментов комплекс витамина В,2 с R-белками разрушается, а витамин В12 связывается с внутренним фактором Касла. Достигнув подвздошной кишки, этот комплекс соединяется с рецепторами на клетках слизистой и активно переносится в кровоток. Для транспорта витамина В,2 в подвздошной кишке требуются достаточное количество внутреннего фактора Касла, желчь и бикарбонат натрия, поддерживающий нужное значение pH (Allen and Mehlman, 1973; Herzlichand Herbert, 1984). Дефицит витамина B12y взрослых редко возникает от его недостатка в пище; чаще он отражает нарушение того или иного этапа всасывания (рис. 54.8). Ахлоргидрия и сниженная секреция внутреннего фактора Касла обкладочными клетками из-за атрофии слизистой или после резекции желудка — частая причина дефицита витамина В|2 у взрослых. Важную роль играют также антитела к об кладочным клеткам и внутреннему фактору Касла. Всасывание может нарушаться и при болезнях поджелудочной железы (отсутствие секреции протеаз), синдроме слепой петли, гельминтозах, спру, а также локальном поражении слизистой подвздошной кишки или ее резекции.
После всасывания витамин В12 связывается в плазме с Р-глобулином транскобаламином II, который переносит его в ткани. Два других транскобаламина (I и III) плазмы, предположительно, используются для внутриклеточного хранения запасов витамина и выходят в кровь после гибели клетки (Scott et al., 1974); их концентрация зависит от скорости образования и разрушения гранулоцитов. Витамин В|2, связанный с транскобаламином 11, быстро покидает плазму и попадает главным образом в гепатоциты, где создаются его запасы. В норме у взрослых ткань печени содержит 1 10 мг витамина — 90% его общих запасов в организме. Витамин В12 хранится в виде активного кофер-мента со скоростью обмена 0,5—8 мкг/сут, в зависимости от состояния запасов (Heyssel et al., 1966). Суточная потребность в витамине В12 у взрослых составляет 2,4 мкг (табл. XIII.2).
Ежедневно вместе с желчью выделяется примерно 3 мкг кобаламинов, из которых 40—50% затем реабсорбируется. Важность этого кишечно-печеночного кругооборота доказывается тем фактом, что нарушение реабсорбции витамина в кишечнике вызывает непрерывное истощение его запасов в печени. Это объясняет, почему большие операции на желудке приводят к развитию дефицита витамина В)2 уже через 3—4 года, хотя потребность в 1—2 мкг/сут должна была бы уменьшить за это время запасы лишь на 2—3 мг.
Доставка витамина B12 в ткани напрямую зависит от запаса этого витамина в печени, а также от количества витамина, связанного с транскобаламином II (рис. 54.8). Так как измерить запасы витамина В12 в печени нелегко, на практике определяют концентрацию витамина в сыворотке. В норме эта концентрация составляет 150—660 пмоль/л (около 200—900 пг/мл); более низкий уровень обычно свидетельствует о дефиците витамина В12. Такое соответствие нарушается лишь при высоком уровне транскобаламинов I и III (например, при болезнях печени или миелопролиферативных заболеваниях). Поскольку связь с этими белками достаточно прочна, витамин В12 становится малодоступным для клеток, несмотря на его нормальный или даже повышенный уровень в сыворотке (Retief et al., 1967). Описаны по меньшей мере две семьи с наследственным дефицитом транскобаламина II (Hakami et al., 1971; Hitzig et al., 1974). У этих больных отмечалась мегалобластная анемия, несмотря на близкий к нормальному уровень витамина В12 в сыворотке. Парентеральное введение витамина В12 было эффективным при дозах, превышающих его экскрецию почками.
У детей с метилмалоновой ацидемией и гомоцистинурией были описаны нарушения внутриклеточного метаболизма витамина В12- К ним относятся неспособность клеток к транспорту или накоплению витамина из-за нарушения синтеза внутриклеточного связывающего белка, нарушения образования аде-нозилкобаламина или наследственной недостаточности метил-малонил-КоА-мутазы (Cooper, 1976).
Авитаминоз В12
Диагноз обычно ставится по характерным нарушениям кроветворения и неврологической симптоматике. Чувствительность кроветворения к дефициту витамина В|2 связана с высокой пролиферативной активностью клеток. Столь же высокая потребность в витамине присуща и другим активно делящимся клеткам (например, клеткам слизистых или эпителия шейки матки).
При дефиците витамина В12 репликация ДНК резко нарушается. Когда стволовая клетка начинает пролиферировать, нарушенная репликация хромосом не мешает созреванию цитоплазмы, но препятствует делению ядра. Это приводит к характерным морфологическим изменениям, легко выявляемым при микроскопии мазков крови и костного мозга, и гибели клеток еще в процессе дифференцировки. Последнее явление получило название неэффективного эритропоэза (Finch et al., 1956). Морфологические изменения наиболее выражены в эритрокариоцитах. Созревание эритроцитов нарушено (мегалобластный эритропоэз). Характерные морфологические изменения обнаруживаются и в эритроцитах крови, типичен макроцитоз, пойкилоцитоз. Средний эритроцитарный объем превышает 110 мкм3. При тяжелом авитаминозе В12 страдают все ростки кроветворения и развивается выраженная паниитопения.
Диагностика обычно основывается на определении сывороточных концентраций витамина В12 или метилмалоновой кислоты. Последний тест несколько более чувствителен и используется для выявления метаболического нарушения при нормальной сывороточной концентрации витамина В12. В сомнительных случаях тяжелой мегалобластной анемии проводят пробное лечение малыми дозами витамина В12. Повторные определения числа ретикулоцитов, сывороточной концентрации железа и гематокрита позволяют выявить нормализацию эритропоэза. Для уточнения причины болезни и количественной оценки всасывания витамина В12 применяют пробу Шиллинга (Schilling, 1953). Проведение этой пробы с добавлением внутреннего фактора Касла и без него позволяет отличить дефицит этого фактора от поражения подвздошной кишки.
Авитаминоз В12 может вызвать необратимое поражение нервной системы. При этом отмечаются прогрессирующий отек миелиновых волокон, демиелинизация и гибель нейронов в спинном мозге и коре головного мозга. Неврологическая симптоматика разнообразна: парестезия в ступнях и кистях; снижение вибрационной и проприоцептивной чувствительности, приводящее к неустойчивости походки; снижение сухожильных рефлексов. На поздних стадиях наблюдаются спутанность сознания, неуравновешенность, снижение памяти и даже потеря центрального зрения. Возможны бред, галлюцинации, вплоть до развития психоза. Неврологические и психические нарушения могут развиваться отдельно от гематологических, так что авитаминоз В12 всегда следует исключать у пожилых больных с деменцией и другими психическими расстройствами, даже если нет анемии (Lindenbaum et al., 1988).
Лечение витамином В12
Витамин В12 может применяться в чистом виде, а также входить в состав комбинированных препаратов (с другими витаминами и минералами). Существуют лекарственные формы как для приема внутрь, так и для инъекций. Выбор препарата определяется причиной авитаминоза. Так, препараты для приема внутрь можно использовать с профилактической целью, но при дефиците внутреннего фактора Касла или патологии подвздошной кишки их ценность невелика. Хотя небольшое количество витамина В12 всасывается путем простой диффузии, при его выраженном дефиците полагаться на прием внутрь нельзя. Поэтому для лечения авитаминоза В12 препаратом выбора остается цианокобаламин, вводимый в/м или глубоко в подкожную клетчатку.
Цианокобаламин представляет собой прозрачный водный раствор красного цвета. Препарат не предназначен для в/в введения; при в/м и п/к введении он безопасен. Изредка его применение сопровождается преходящей сыпью и анафилактическими реакциями. При наличии подобных реакций в анамнезе показано пробное внутрикожное введение препарата.
Цианокобаламин применяют в дозах 1—1000 мкг. Его метаболизм зависит от содержания транскобаламина II (см. выше). Назначение цианокобаламина в дозах свыше 100 мкг не увеличивает его запасы в организме, так как избыток препарата быстро выводится с мочой. Применять витамин В12 в дозе 1000 мкг имеет смысл при проведении пробы Шиллинга: после приема внутрь меченного радиоактивным изотопом витамина В12 вводят в/м 1000 мкг обычного немеченого витамина В12 и оценивают количество всосавшегося витамина по экскреции радиоактивного изотопа с мочой. Немеченый витамин насыщает транспортную систему и связывание витамина тканями, в результате чего 90% введенного витамина (как меченого, так и немеченого) выводится с мочой в течение следующих суток.
Поливитамины сегодня широко применяют для лечения анемий или просто в качестве пищевых добавок. Многие из них содержат цианокобаламин (до 80 мкг), некоторые — в сочетании с внутренним фактором Касла, выделенным из желудка свиней и других домашних животных. За одну единицу внутреннего фактора Касла принимается его количество, необходимое для связывания и всасывания 15 мкг цианокобаламина. В большинстве поливитаминов каждая таблетка содержит0,5 ед внутреннего фактора Касла. Хотя сочетание приема внутрь витамина В12 и внутреннего фактора Касла представляется идеальным средством при дефиците фактора, подобное лечение ненадежно. Антитела к внутреннему фактору Касла человека подавляют всасывание витамина В12. У некоторых больных со временем прием внутрь препаратов внутреннего фактора Касла становится неэффективным, что связывают с выработкой антител к свиному белку, действующих в просвете кишки (Ramsey and Herbert, 1965). Больные, получающие такое лечение, должны периодически проходить контрольные осмотры для выявления рецидивов.
Гидроксикобаламин в дозе 100 мкг в/м обладает более длительным действием, чем цианокобаламин. Однократное его введение поддерживает сывороточную концентрацию витамина В12 почти в течение 3 мес. Однако у некоторых больных концентрация витамина В12 в плазме, как и после введения цианокобаламина, падает уже в первый месяц. Более того, использование гидроксикобаламина иногда приводит к образованию антител к комплексутранскобапамин II—витамин B12(Skoubyet al., 1971).
Витамин В12 обладает незаслуженной репутацией общеукрепляющего средства, и его часто используют не по назначению. Для эффективного применения витамина требуются точная диагностика и понимание следующих принципов лечения.
- Профилактически витамин В,2 следует назначать, только если есть основания ожидать его дефицита. Показаниями к такому применению служат алиментарный дефицит у строгих вегетарианцев и нарушенное всасывание при некоторых болезнях тонкой кишки и после гастрэктомии. Если нарушения функции ЖКТ нет, может быть показан профилактический прием внутрь комплексов витаминов и минеральных веществ, включающих витамин В12. В остальных случаях назначают ежемесячные инъекции цианокобаламина.
- Относительная легкость лечения авитаминоза В12 не отменяет необходимости поиска его причины. Этот диагноз чаще всего подозревают при макроцитарной анемии или необъяснимых психических и неврологических нарушениях. Для выявления причины авитаминоза необходимо оценить содержание витамина В12 в пище, его всасывание в ЖКТ и транспорт.
- Лечение должно быть максимально специфичным. Хотя существует множество поливитаминов, их неприцельное применение при авитаминозе В,2 бывает опасным. Подобные препараты иногда содержат достаточно фолиевой кислоты, чтобы восстановить кроветворение и замаскировать дефицит витамина В12, что позднее приведет к появлению или нарастанию неврологической симптоматики.
- Хотя пробное лечение небольшими дозами витамина В12 помогает в диагностике, для пожилых больных с тяжелой анемией промедление с коррекцией анемии может стать роковым. Для быстрейшего достижения эффекта таким больным назначают одновременно витамин В12 и фолиевую кислоту, а также переливают кровь.
- Эффективность длительного лечения витамином В12 необходимо проверять каждые 6—12 мес, если нет особых показаний. При сопутствующей патологии или повышенном расходе витамина (например, при беременности) контрольные обследования следует проводить чаше.
Лечение впервые выявленного авитаминоза В12
Тактика лечения определяется тяжестью болезни. При неосложненной В12-де-фииитной анемии с небольшим или умеренным снижением уровня гемоглобина, без лейкопении и тромбоцитопении, а также без неврологической симптоматики используют монотерапию витамином В12. Лечение можно даже отсрочитьдо завершения поиска причины авитаминоза. В этой ситуации для подтверждения диагноза возможно также проведение пробного лечения небольшими дозами витамина В12 (1 —10 мкг/сут в/м).
Напротив, больным с неврологической симптоматикой, а также с глубокой лейкопенией и инфекциями или тромбоцитопенией и кровоточивостью требуется интенсивная терапия. У пожилых с тяжелой анемией (гематокрит менее 20%) часто наблюдаются тканевая гипоксия, недостаточность мозгового кровообращения и сердечная недостаточность. В этих случаях откладывать лечение до завершения диагностики нельзя. Сразу же после выявления мсгапобластного эритропоэза и взятия достаточного количества крови для последующего определения содержания витамина В12 и фолиевой кислоты вводят цианокобаламин, 100 мкг в/м, и фолиевую кислоту, 1—5 мг в/м. В течение следующих 1—2 нед назначают ежедневно цианокобаламин, 100 мкг в/м, и фолиевую кислоту, 1 —2 мг внутрь. Так как достаточный прирост объема циркулирующих эритроцитов достигается лишь через 10—20 сут, при выраженном снижении гематокрита и при знаках тканевой гипоксии требуется переливание 2—3 доз эритроцитарной массы. При сердечной недостаточности это может вы тать гиперволемию, поэтому таким больным назначают диуретики или даже делают кровопускание (в том же объеме).
Эффективность лечения витамином В12 оценивают по ряду субъективных и объективных показателей. Обычно уже в первые сутки улучшается самочувствие. Иногда резко улучшаются память и ориентация, хотя полное восстановление интеллекта может занять месяцы, а то и не произойти вовсе. Кроме того, еще до появления признаков гематологического ответа у некоторых больных уменьшаются слабость, болезненность языка и слизистой рта, улучшается аппетит.
Первый объективный признак гематологического ответа на лечение — исчезновение мегалобластов из костного мозга. После прекращения неэффективного эритропоэза концентрация железа в сыворотке резко снижается из-за активного синтеза гемоглобина. Обычно это происходит в первые 2 сут. Ретикуло-цитоз, свидетельствующий о восстановлении эритропоэза, появляется через 2—3 сут лечения и еще через 3—5 сут достигает максимума. При умеренной или тяжелой анемии ретикулоци-тарный индекс может вырасти в 3—5 раз (что соответствует относительному числу ретикулоцитов 20—40%). От способности костного мозга поддерживать интенсивный эритропоэз зависит скорость восстановления гематокрита. При сопутствующем дефиците железа, инфекциях, воспалениях и болезнях почек уровень гемоглобина может и не восстановиться. Поэтому наблюдение за ретикулоцитарным индексом нужно продолжать несколько недель. Если при гематокрите менее 35% этот индекс не остается повышенным, следует повторно исследовать концентрацию железа и фолиевой кислоты в сыворотке, а также провести поиск сопутствующей патологии, мешающей восстановлению эритропоэза.
Степень и скорость исчезновения неврологических нарушений зависит от их тяжести и длительности. Нарушения,появившиеся несколько месяцев назад, обычно проходят сравнительно быстро. Если же неврологическая симптоматика наблюдалась в течение многих месяцев или лет, то полное восстановление может и не произойти.
Поддерживающая терапия витамином В12
Однажды начатое лечение витамином В12 должно проводиться пожизненно. Следует объяснить больному и его родственникам необходимость лечения и назначить ежемесячные инъекции витамина. Введение 100 мкг цианокобаламина каждые 4 нед обеспечивает достаточное содержание витамина В|2 в крови и тканях. При тяжелой неврологической симптоматике лечение начинают с больших доз. Для достижения быстрейшего и максимально полного восстановления можно назначать препарат в дозе 100 мкг ежедневно или несколько раз в неделю в течение нескольких месяцев. Контрольный анализ крови и исследование сывороточной концентрации витамина В,2 проводят через 3—6 мес после начала лечения. Так как устойчивость к терапии может развиться в любое время, подобное обследование должно проводиться регулярно в течение всей жизни.
Другие показания к назначению витамина В12
Витамин В]2 используют также при других заболеваниях: невралгии тройничного нерва, рассеянном склерозе и других нейропатиях, различных психических расстройствах, задержке роста, истощении, а также в качестве тонизирующего средства при перегрузках или повышенной утомляемости. Тем не менее эффективность препарата при этих состояниях не доказана. Поддерживающая терапия витамином В)2 иногда помогает детям с метилмалоновой ацидемией (Cooper, 1976).
Фолиевая кислота
Химическая структура и роль в обмене веществ
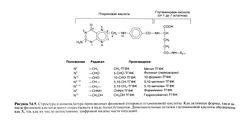
Структурная формула фолиевой (птероилглутаминовой) кислоты приведена на рис. 54.9. Ее молекула состоит из птеридинового кольца, соединенного метиленовым мостиком с парааминобензойной кислотой, которая, в свою очередь, соединена амидной связью с глутаминовой кислотой. Именно это вещество используется в терапевтических целях, но основной пищевой предшественник фолатов и активный кофермент, участвующий в обмене веществ, имеют другую структуру. После всасывания фолиевая кислота быстро восстанавливается в позициях 5, 6, 7 и 8 до ТГФК, которая затем выступает в качестве акцептора ряда одноуглеродных групп. Последние присоединяются к атомам С-5 или С-10 птеридинового кольца или соединяют собой эти атомы, образуя новое пятичленное кольцо. Самые важные формы этого кофермента показаны на рис. 54.9; ниже перечисляются их функции в клеточном метаболизме (см. также выше, «Взаимосвязь витамина В12 и фолиевой кислоты», и рис. 54.6).
Превращение гомоцистеина в метионин. В этой реакции участвует метил-ТГФК в качестве донора метильной группы и витамин В12 в качестве кофактора.
Превращение серина в глицин. В этой реакции метиленовая группа переносится от серина на ТГФК с образованием 5,10-ме-тилен-ТГФК — кофермента, необходимого для синтеза дезокси-ТМФ. Кофактором служит пиридоксальфосфат.
Синтез дезокси-ТМФ. 5,10-метилен-ТГФК служит донором метиленовой группы и восстанавливающих эквивалентов для дезокси-УМФ в лимитирующей синтез ДН К реакции образования дезокси-ТМФ.
Метаболизм гистидина. ТГФК выступает в качестве акцептора формиминовой группы в реакции превращения формими-ноглутаминовой кислоты в глутаминовую.
Синтез пуринов. Производные фолиевой кислоты участвуют в двух этапах синтеза пуринов, а именно в переносе формильной группы на глицинамидрибонуклеотид (от 5,10-метилен-ТГФК) и 5-аминоимидазол-4-карбоксамидрибонуклеотид (от 10-фор-мип-ТГФК). В этих реакциях в растущее пуриновое кольцо включаются атомы углерода соответственно в позициях 8 и 2.
Присоединение и отщепление формиата. В этой обратимой реакции участвуют ТГФК и 10-формил-ТГФК.
Суточная потребность
Источником фолиевой кислоты служат многие виды пиши, в первую очередь — свежая зелень, печень, дрожжи и некоторые фрукты. Однако при длительном приготовлении пиши до 90% фолиевой кислоты разрушается. Суточный рацион среднего американца содержит 50—500 мкг фолиевой кислоты; люди, потребляющие большое количество свежих овошей и мяса, получают до 2 мг фолиевой кислоты. Норма суточной потребности для взрослых составляет 400 мкг, однако беременным и кормяшим женщинам, больным с гемолитическими анемиями и другими пролиферативными процессами иногда требуется 500—600 мкг/сут и более (табл. XIII.2). Для профилактики дефектов нервной трубки у плода рекомендуется ежедневно получать не менее 400 мкг фолиевой кислоты (с едой или пищевыми добавками) начиная с месяца, предшествующего зачатию, до конца I триместра. Повышенное потребление фолиевой кислоты рекомендуется также больным с высокой сывороточной концентрацией гомоцистеина.
Всасывание, распределение и выведение
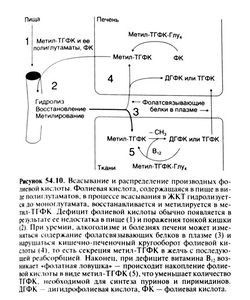
Как и в случае авитаминоза В12, для правильной диагностики и лечения дефицита фолиевой кислоты необходимо понимать механизмы всасывания и внутриклеточного метаболизма этого витамина (рис. 54.10). В пище фолиевая кислота содержится главным образом в виде восстановленных полиглутаматов (Tamura and Stokstad, 1973), поэтому для ее всасывания необходимо присутствие на мембране клеток слизистой у-глутамилгидролазы (Rosenberg, 1976). Слизистая двенадцатиперстной кишки и верхнего отдела тощей кишки содержит много дигидрофолатредуктазы, там же происходит и метил ирован ие почти всей всосавшейся восстановленной фолиевой кислоты. Так как основное всасывание идет в проксимальных отделах тонкой кишки, дефицит фолиевой кислоты нередко бывает следствием поражения тощей кишки. Так, дефицит фолиевой кислоты с мегапобластной анемией часто возникает при спру и целиакии.
После всасывания фолиевая кислота быстро переносится в ткани в виде метил-ТГФК. Ряд белков плазмы способны связывать производные фолиевой кислоты, но имеют большее сродство к неметилированным производным. Роль этих белков в метаболизме фолиевой кислоты изучена плохо. Фолатсвязывающая способность возрастает при дефиците фолиевой кислоты и некоторых болезнях (например, при уремии, злокачественных новообразован иях, алкоголизме), но пока не известно, как это влияет на транспорт и доставку витамина к тканям.
Постоянство притока метил-ТГФК поддерживается поступлением фолиевой кислоты с пищей и кишечнопеченочным кругооборотом. Печень активно восстанавливает и метилирует фолиевую кислоту, дигидрофолиевую кислоту и ТГФК, а затем секретирует метил-ТГФК в яселчь для последующей реабсорбции и доставки к тканям (Steinberg et al., 1979). В этом кругообороте ежедневно участвует не менее 200 мкг фолиевой кислоты. Важность кишечно-печеночного кругооборота следует из экспериментов на животных, в которых наблюдали быстрое снижение концентрации фолиевой кислоты в плазме после дренирования желчных протоков или введения внутрь алкоголя, блокирующего секрецию метил-ТГФК гепатоцитами (Hillman et al., 1977).
Внутри клетки метил-ТГФК служит донором метиль-ных групп для образования метилкобаламина, а также источником ТГФК и других производных фолиевой кислоты (см. выше). Запасы фолиевой кислоты хранятся в клетках в виде полиглутаматов (Baugh and Krumdieck, 1969).
Дефицит фолиевой кислоты
Это состояние часто встречается при поражениях тонкой кишки, при которых нарушается всасывание фолиевой кислоты и ее кишечно-печеночный кругооборот. При алкоголизме, с одной стороны, заметно снижается поступление фолиевой кислоты с пищей, а с другой — нарушается ее кишечно-пече-ночный кругооборот в результате токсического действия этанола на гепатоциты. Алкоголизм — вероятно, самая частая причина дефицита фолиевой кислоты и вызванного этим дефицитом мегалобластного эритропоэза. В то же время такой дефицит лучше всего поддается лечению, так как возврат к нормальному питанию оказывается достаточным для восстановления кроветворения. Болезни, протекающие с большой пролиферативной активностью клеток (например, гемолитические анемии), также могут сопровождаться дефицитом фолиевой кислоты. Ингибиторы дигидрофолатредукгазы (метотрексат, триметоприм) и препараты, нарушающие всасывание фолиевой кислоты и ее запасание в тканях (некоторые противосудорожные препараты, пероральные контрацептивы), могут снижать концентрацию фолиевой кислоты в крови и вызывать мегалобластную анемию (Stebbins, 1973; Stebbins and Bertino, 1976).
Дефицит фолиевой кислоты связывают с развитием таких дефектов нервной трубки, как позвоночная расщелина, энцефалоцеле и анэнцефалия. При этом мать не всегда страдает анемией или алкоголизмом. Недостаточное количество фолиевой кислоты в пище иногда приводит к повышению сывороточной концентрации гомоци-стеина (Green and Miller, 1999). Так как даже умеренная гомоцистеинемия повышает риск ИБС и тромбозов периферических сосудов, участие фолатов в качестве донора метильной группы в реакции превращения гомоцис-теина в метионин сейчас стало предметом пристального изучения. У гетерозигот с умеренной недостаточностью метилен-ТГФК-редуктазы и небольшим повышением концентрации гомоцистеина прием фолиевой кислоты может вызвать улучшение.
Дефицит фолиевой кислоты проявляется нарушениями кроветворения. Как и в случае витамина В12, это отражает высокую потребность в витамине, связанную с активной пролиферацией кроветворных клеток. Так как основные метаболические функции фолиевой кислоты и витамина В12 совпадают, мегалобластная анемия при обоих дефицитах выглядит одинаково. В то же время при дефиците фолиевой кислоты почти никогда не бывает неврологических нарушений. Поэтому выявление характерных нарушений вибрационной и проприоцептивной чувствительности, а также двигательных или чувствительных нарушений говорит против изолированного дефицита фолиевой кислоты.
Мегалобластная анемия при дефиците фолиевой кислоты развивается гораздо быстрее, чем при нарушении всасывания витамина В12 (например, после резекции желудка). Это означает, что запасы фолиевой кислоты в организме ограничены. В классическом исследовании Герберта у добровольца, получавшего несколько месяцев пищу с низким содержанием фолиевой кислоты, мегалобластный эритропоэз развился примерно через 10— 12 нед (Herbert, 1962). Дальнейшие исследования показали, что скорость развития мегалобластного эритропоэза зависит от индивидуальных особенностей и состава диеты (Eichner et al., 1971) и дефицит фолиевой кислоты может проявиться уже через 1—4 нед.
Лучший способ выявления дефицита фолиевой кислоты — измерение ее концентрации в сыворотке и в эритроцитах микробиологическими методами или методом конкурентного связывания. В норме сывороточная концентрация фолиевой кислоты составляет 9—45 нмоль/л (4—20 нг/мл). Эта концентрация сильно зависит от содержания фолиевой кислоты в пище и действия ингибиторов ее транспорта (например, этанола) или метаболизма. Так, при запое уже через 24—48 ч сывороточная концентрация фолиевой кислоты выходит за нижнюю границу нормы (Eichner and Hillman, 1971, 1973). После отмены алкоголя она быстро восстанавливается, хотя эритропоэз может еще оставаться мегалобластным. Подобные колебания снижают ценность определения сывороточной концентрации фолиевой кислоты. Для диагностики стойкого дефицита фолиевой кислоты можно воспользоваться измерением ее содержания в эритроцитах или определением ее запасов в лимфоцитах с помощью супрессивной пробы с дезоксиуридином (Herbert etal., 1973). Положительный результат любого из этих исследований свидетельствует о продолжительном дефиците фолиевой кислоты, ведущем к появлению популяции клеток со сниженными запасами витамина.
Фолиевая кислота выпускается в виде таблеток по 0,4, 0,8 и 1 мг, водного раствора для инъекций (5 мг/мл), а также в комбинации с другими витаминами и минеральными веществами.
Фолинат кальция (лейковорин) представляет собой кальциевую соль 5-формил-ТГФК. Его основное действие — обход метаболического блока дигидрофолатредуктазы при лечении высокими дозами метотрексата, а также потенцирование действия фторурацила при лечении рака толстой кишки (гл. 52). Фолинат кальция можно также использовать в качестве антидота таких антагонистов фолиевой кислоты, как пириметамин и триметоприм. Хотя фолинатом кальция можно восполнять и дефицит фолиевой кислоты, делать это не рекомендуется, так как он дороже и не имеет преимуществ перед фолиевой кислотой. Единственное исключение — мегалобластная анемия при наследственной недостаточности дигидрофолатредуктазы. Фолинат кальция противопоказан при авитаминозе В12 независимо от его этиологии. Как и в случае с фолиевой кислотой, применение фолината кальция позволяет быстро восстановить кроветворение, но при этом могут возникнуть или усугубиться уже существующие неврологические нарушения.
Побочные эффекты. Описаны редкие аллергические реакции на в/м введение фолиевой кислоты и фолината кальция. При наличии подобных реакций в анамнезе лечение следует проводить с осторожностью. При приеме внутрь фолиевая кислота обычно нетоксична. Даже при дозе 15 мг/сут подтвержденных сообщений о побочном действии нет. В больших дозах фолиевая кислота снижает противосудорожное действие фенобарбитала, фени-тоина и примидона, а также учащает припадки у детей с эпилепсией (Reynolds, 1968). Хотя не все исследования это подтверждают, ФДА рекомендовало ограничить содержание фолиевой кислоты в таблетках до 1 мг.
Общие принципы лечения
Терапевтическое применение фолиевой кислоты ограничивается профилактикой и лечением дефицита этого витамина. Как и в случае с витамином В12, результаты лечения зависят от правильности диагностики и понимания патогенеза дефицита у данного больного. Общие принципы лечения следующие.
- С профилактической целью фолиевую кислоту назначают только по показаниям. Обогащение пищи необходимо лишь в том случае, если потребность в витамине превышает его содержание в обычном рационе. Ежедневный прием поливитаминов, содержащих 400— 500 мкг фолиевой кислоты, широко назначают беременным (для профилактики дефектов нервной трубки) и кормящим женщинам. Родившим ранее ребенка с дефектом нервной трубки рекомендуется даже повысить дозу до 4 мг/сут (MRC Vitamin Study Research Group, 1991). Больные, находящиеся на полном парентеральном питании, должны получать фолиевую кислоту в/в, так как запасы фолатов в печени ограничены. Взрослым, страдающим болезнями, сопровождающимися высокой пролиферативной активностью клеток (например, гемолитическими анемиями), обычно нужны большие дозы фолиевой кислоты (по 1 мг 1 —2 раза в сутки). Больным с повышенным уровнем гомоцистеина также назначают фолиевую кислоту в дозе 1 мг/сут.
- Как и при авитаминозе В12, все больные с фолиеводефицитной анемией нуждаются в обследовании для поиска причины болезни. Особое внимание нужно обращать на прием лекарственных средств, употребление алкоголя, состояние ЖКТ и сведения о недавних поездках.
- Лечение всегда должно быть максимально прицельным. Поливитаминных препаратов следует избегать, если нет оснований предполагать дефицит нескольких витаминов.
- Всегда следует помнить о возможности ошибочного назначения фолиевой кислоты при авитаминозе В12. Большие дозы фолиевой кислоты могут устранить мегалоб-ластную анемию, поскольку дигидрофолатредуктаза превращает фолиевую кислоту в ТГФК, обходя «фолатную ловушку». Однако это лечение не предотвращает и не устраняет вызванные дефицитом витамина В12 неврологические нарушения, которые продолжают нарастать и могут стать необратимыми.
Лечение впервые выявленного дефицита фолиевой кислоты. Как уже говорилось в разделе, посвященном витамину В12, лечение впервые выявленной мегалобластной анемии начинается с инъекции витамина В12 и фолиевой кислоты. Поскольку лечение часто бывает необходимо начать еще до установления точной причины болезни, важно учитывать возможность сочетанного дефицита обоих витаминов, так как реакция на лечение одним витамином в этом случае будет недостаточной. Примером заболевания, при котором распространен такой сочетанный дефицит, может служить целиакия. При наличии показаний витамин В|2 (100 мкг) и фолиевую кислоту (1—5 мг) вводят в/м, после чего на 1 —2 нед в качестве поддерживающей терапии назначают фолиевую кислоту по 1—2 мг/сут внутрь. Рекомендации по лечению витамином В|2 приведены выше.
При хроническом дефиците фолиевую кислоту обычно назначают внутрь независимо от причины дефицита. Такое лечение помогает даже при доказанном нарушении всасывания фолиевой кислоты (например, при спру и целиакии). При достаточной дозе фолиевой кислоты ни недостаточность у-глутамил-гидролазы, ни патология клеток слизистой, ни продолжающееся употребление алкоголя и прием лекарственных средств не препятствуют ее пассивному всасыванию. Действие большинства ингибиторов дигидрофолатредуктазы и транспорта фолатов также легко преодолевается фармакологическими дозами витамина. Фолинат кальция — наиболее подходящая форма витамина для использования в качестве антидота метотрексата при химиотерапии. Прием фолиевой кислоты внутрь бывает неэффективным, пожалуй, лишь при тяжелом авитаминозе С. У больных цингой встречается мегалобластная анемия, несмотря на повышенное потребление фолиевой кислоты, а также нормальную или повышенную ее концентрацию в плазме и клетках крови.
Эффективность лечения, как и при лечении авитаминоза В12, оценивают по изменению характера кроветворения. В первые 48 ч после начала лечения кроветворение утрачивает мегалоб-ластный характер; с появлением нормального эритропоэза концентрация железа в сыворотке падает до нормального уровня или несколько ниже. На 2—3-и сутки число ретикулоцитов (показатель пролиферативной активности эритроидных клеток) начинает расти и на 5—7-е сутки достигает максимума. Наконец, на второй неделе начинается рост гематокрита.
Знание этих особенностей можно использовать для проведения пробного лечения. С этой целью назначают ежедневные инъекции фолиевой кислоты в дозе 50—100 мкг. Ббльшие дозы применять нежелательно, так как они могут вызвать гематологический ответ и у больных с авитаминозом B12. Прием фолиевой кислоты внутрь также не используют, так как он может не дать результата из-за нарушения всасывания в кишечнике. Пробному лечению могут помешать и другие обстоятельства. У больных спру введение фолиевой кислоты может оказаться неэффективным из-за дефицита других витаминов или железа. При алкоголизме пролиферативный ответ в костном мозге может быть затушеван сопутствующим поражением печени, воспалением или дефицитом железа. По этим причинам пробное лечение у больных с подозрением на дефицит фолиевой кислоты не пользуется популярностью.