Действие лекарств на клетки
Содержание
- 1 ДЕЙСТВИЕ ЛЕКАРСТВ НА КЛЕТКИ
- 1.1 G-белок-связанная трансдукция
- 1.2 Са2+-связанная трансдукция
- 1.3 Трансдукция, связанная с протеинкиназой С
- 1.4 Трансдукция, инициируемая ДНК-связанными рецепторами
- 1.5 Трансдукция, инициируемая рецепторами с тирозинкиназной активностью
- 1.6 Трансдукция, инициируемая РСК
- 1.7 Примеры интеграции клеточного и молекулярного механизмов
ДЕЙСТВИЕ ЛЕКАРСТВ НА КЛЕТКИ
Большинство молекулярных мишеней связано различными биохимическими механизмами с компонентами клеточного ответа (G-белки, ферменты, ионные каналы и др.). Эти реакции связывания называют трансдукцией.
G-белок-связанная трансдукция
G-белки — это молекулы, связанные непосредственно со специфической группой рецепторов или опосредованно с другими молекулярными мишенями. Активированный G-белок инициирует (или подавляет) разные каскады клеточных реакций, что в итоге изменяет функцию ионных каналов, ферментов, ДНК и других компонентов клетки, например открытие К+-канала в сердечной мышце после связывания ацетилхолина с мускариновым рецептором или увеличение активности протеин-киназы после связывания адреналина с β-адренорецептором.
G-белок состоит из трех субъединиц — а, β и у— и работает как переключатель сигналов клетки (рис. 2.25)
При активации агонистом G-белок-связанного рецептора конформационные изменения в рецепторе обусловливают активацию G-белка, что приводит к выходу гуанозиндифосфата и связыванию гуано-зинтрифосфата (ГТФ) с а-субъединицей и диссоциации этой субъединицы от гетеродимера βу. а- и βy-субъединицы активируют компоненты трансдукции. а-Субъединица гидролизует ГТФ до ГДФ, который, в свою очередь, инактивирует а-субъединицу, способствуя восстановлению ее связи с βу-комплексом и инактивации G-белка.
Стимуляция или ингибирование G-белка ведет к модуляции ферментных систем, ответственных за продукцию следующих компонентов трансдукции (иногда их называют вторичными мессенджерами):
- циклических нуклеотидов;
- диацилглицерола;
- инозитолфосфата.
Например, активация β2-адренорецептора активирует G-белок. Это, в свою очередь, активирует аденилилциклазу — фермент, катализирующий образование цАМФ. Трансдукция протекает путем активации цАМФ за счет протеинкиназы и фосфорилирования ферментов, типы которых зависят от вида ткани.
В клетках существует несколько подтипов G-белков. а-Подтип определяет главные свойства G-белка. Например, β-адренорецепторы обычно взаимодействуют с G-белками, несущими аs-субъединицы, которые активируют аденилилциклазу.
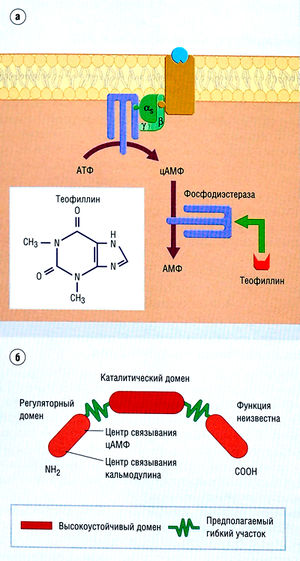
Описание к рис. 2.25 Пример трансдукции, инициированной ферментом. Ферменты фосфодиэстеразы (а) участвуют в обмене циклических нуклеотидов (например, цАМФ). Эта группа ферментов ингибируется теофиллином. Ингибирование ведет к накоплению циклических нуклеотидов в клетке (б). Следует учесть, что циклические нуклеотиды накапливаются в ответ на действие препаратов на ферменты нуклеотидциклазы, связанные с С-белком. АМФ — аденозинмонофосфат; АТФ — аденозинтрифосфат; цАМФ — циклический аденозинмонофосфат.
Са2+-связанная трансдукция
Мобилизация внутриклеточного Са2+ как вторичного мессенджера — последнее звено в цепи реакций, продуцирующих компоненты трансдукции.
Ион Са2+ вовлечен в трансдукцию в следующих процессах:
- сокращение гладких мышц;
- ускорение сокращения и расслабления кардио-миоцитов;
- секреция трансмиттеров и железистая секреция;
- выброс гормонов;
- цитотоксичность;
- активация некоторых ферментов.
Мобилизация Са2+ связана с активностью других компонентов трансдукции. Са2+ накапливается в эндоплазматическом ретикулуме гладких мышц и выходит при действии IР3 на специфический РСК, называемый IР3-рецептором.
Выброс ДАГ происходит при прямом действии фосфолипазы С (или D) на активность мембраносвязанной протеинкиназы С, которая обеспечивает фосфорилирование остатков серина и треонина и последующую активацию более 50 различных белков. Существует как минимум шесть типов протеинкиназы С, каждый из которых имеет субстратную специфичность.
Действие важных G-белков
- Gs стимулирует адеиилилциклазу и активирует Са2+-каналы
- Gi ингибирует адеиилилциклазу и активирует К+-каналы
- Gq активирует фосфолипазу С
- Go ингибирует ток Са2+
- Gt стимулирует адеиилилциклазу глаза
- Gdf стимулирует адеиилилциклазу носа
- β-, а-субъединицы активируют многие компоненты трансдукции
Трансдукция, связанная с протеинкиназой С
Протеинкиназа С является важным компонентом трансдукции в следующих реакциях:
- модуляции выброса эндокринных гормонов и нейротрансмиттеров;
- сокращения гладких мышц;
- воспаления;
- ионного транспорта;
- роста опухолей.
Трансдукция, инициируемая ДНК-связанными рецепторами
Активация ДНК-связанной трансдукции влечет изменение синтеза белка. Например, стероиды перемещают HSP90 и образуемый комплекс стероид-рецептор в ядро. В ядре комплекс стероид-рецептор может различать специфические последовательности оснований и активировать специфические гены. Этот процесс идет медленнее, чем миллисекундные ответы, наблюдаемые при других формах трансдукции. Например:
- глюкокортикостероиды увеличивают продукцию липокортина, что объясняет их противовоспалительное действие;
- минералокортикостероиды увеличивают в почках продукцию специфических молекул, вовлеченных в тубулярный транспорт ионов Na+ и К+.
Трансдукция, инициируемая рецепторами с тирозинкиназной активностью
Активация тирозинкиназных рецепторов обеспечивает аутофосфорилирование остатков тирозина, которые служат селективными центрами для разных внутриклеточных белков. Фосфорилированный рецептор действует как платформа для связывания других белков, что ведет к фосфорилированию и активации сложных реакций через каскад других протеинкиназ. Многие из образуемых реакций сходны с реакциями, инициируемыми G-белками.
Многие тирозинкиназные рецепторы несут связывающие центры для других белков, вовлеченных в сигнальную трансдукцию. Один из таких связывающих центров называют SH2. Присоединение неактивного фермента к SH2 ведет к высокоселективной активации фермента. Часто активированные ферменты вовлечены в транскрипцию генов. Ряд протеинкиназ, IР3 и Са2+ могут участвовать в промежуточных этапах трансдукции. Многие факторы роста действуют посредством этого механизма. В связи с этим интерес представляет разработка препаратов, взаимодействующих с SH2 или повторяющих активность SH2, т.к. эти препараты влияют на рост и дифференцировку клеток, поэтому возможно применение таких препаратов при злокачественных опухолях, иммунологической патологии и других заболеваниях. К протеинам, участвующим в трансдукции через тирозинкиназные рецепторы, относят небольшой G-белок ras.
Трансдукция, инициируемая РСК
Когда РСК инициирует трансдукцию, запускаются реакции вследствие изменения потенциала мембран, связанного с увеличением (или уменьшением) проницаемости к тем ионам, которые проходят через РСК. Таким образом, трансдукция начинается с изменения заряда, что ведет к деполяризации или гиперполяризации мембраны. Типичной локализацией РСК является плазматическая мембрана, но РСК также найдены в митохондриях и других внутриклеточных органеллах.
Изменение мембранного потенциала может прямо модулировать функцию ткани. В скелетных мышцах активация никотиновых РСК деполяризует мембрану концевой пластинки, а следовательно, и саркоплазматического ретикулума (после генерации потенциала в сарколемме), что приводит к выходу Са2+ в цитоплазму и сокращению мышц.
Примеры интеграции клеточного и молекулярного механизмов
Некоторые примеры интеграции молекулярного и клеточного механизмов описаны далее (рис. 2.26). Скорость трансдукции и проявление тканевого ответа определяются молекулярной мишенью (рецептором) и механизмом трансдукции. Эта скорость определяет начало тканевого ответа. Например:
- взаимодействие агониста с РСК приводит к быстрой (миллисекунды) клеточной деполяризации или гиперполяризации;
- взаимодействие агониста с G-белок-связанным рецептором может привести к одному из многих ответов, длящихся секунды;
- взаимодействие препарата непосредственно с ферментом может привести к изменениям в течение нескольких минут;
- взаимодействие препарата непосредственно с ДНК может изменить экспрессию генов и синтез нового белка в течение нескольких часов. Примеры интеграции между молекулярными и клеточными ответами показаны на рис. 2.26, 2.27, 2.28.