Молекулярное действие лекарств (молекулярные мишени)
Содержание
- 1 МОЛЕКУЛЯРНОЕ ДЕЙСТВИЕ ЛЕКАРСТВ
- 2 Связывание лекарства с рецептором
- 3 Классификация рецепторов лекарств
- 4 ДРУГИЕ МОЛЕКУЛЫ КЛЕТКИ КАК МОЛЕКУЛЯРНЫЕ МИШЕНИ ЛЕКАРСТВ
- 5 Транспортеры, симпортеры, антипортеры и насосы
- 6 Ферменты
- 7 Нуклеиновые кислоты
- 8 Структурные макромолекулы
- 9 Молекулярные мишени вне клеток
- 10 Механизмы действия лекарств на рецепторы, ионные каналы, переносчики и ферменты
- 11 Читайте также
МОЛЕКУЛЯРНОЕ ДЕЙСТВИЕ ЛЕКАРСТВ[править | править код]
Мишень — это молекула с центром связывания для лекарства. Эта молекула может содержать мембранные белки, распознающие гормоны или нейротрансмиттеры (рецепторы), а также ионные каналы, нуклеиновые кислоты, молекулы-переносчики или ферменты. Но не все лекарства действуют на рецепторы.
Большинство лекарств должны связаться с молекулярной мишенью, чтобы произвести эффект, но существуют и исключения. Уже в первых исследованиях эффектов лекарств на тканях животных в конце XIX в. стало ясно, что большинство лекарств реализуют специфическое действие в определенных тканях, т.е.:
- лекарство, которое оказывает эффект на один тип ткани, может не влиять на другой;
- лекарство может оказывать совершенно разные эффекты на разные ткани.
Например, алкалоид пилокарпин, как и нейротрансмиттер ацетилхолин, вызывает сокращение гладких мышц кишечника и тормозит частоту сердечных сокращений. С учетом этих феноменов Сэмуэль Лэнгли (1852-1925) в 1878 г., основываясь на изучении эффектов алкалоидов пилокарпина и атропина на слюноотделение, предположил, что «существуют некие рецепторные вещества... с которыми оба могут образовывать соединения». Позже, в 1905 г., изучая действие никотина и кураре на скелетные мышцы, он обнаружил, что никотин вызывает сокращения, когда действует на определенные небольшие участки мышц. Лэнгли заключил, что «рецепторная субстанция» для никотина находится в этих участках и что кураре действует путем блокады взаимодействия никотина с рецептором.
Считается, что Пауль Эрлих (1854-1915) самостоятельно разработал теорию рецепторов, наблюдая, как многие органические красители селективно окрашивают специфические компоненты клетки. В 1885 г. он предположил, что у клеток есть «боковые цепи», или «рецепторы», к которым лекарства или токсины могут присоединяться, реализуя свое действие. До сих пор Эрлих известен благодаря своей идее о «волшебной пуле» — химическом соединении, образованном для выявления селективной токсичности, например, инфекционного агента. Кроме того, Эрлих синтезировал органические производные мышьяка, которые использовали ранее при лечении сифилиса. Развивая теорию рецепторов, Эрлих был первым, кто показал, что быстрая обратимость действия алкалоидов свидетельствует о непрочных (нековалентных) химических связях между лекарством и рецепторами.
Последние достижения молекулярной биологии раскрывают природу связи лекарство-рецептор на молекулярном уровне. Сегодня под рецептором понимают специфическую молекулярную структуру, которая работает как молекулярная мишень для группы соответствующих лекарств (раньше связывающий центр не был определен отдельно от молекулярной мишени, и весь комплекс в целом рассматривали как рецептор).
Не все лекарства имеют молекулярные мишени
Для лекарств, действующих на ферменты, молекулярной мишенью является фермент. Рецептором выступает та часть фермента, которая связывается с лекарством. Для большинства лекарств молекулярными мишенями являются белки, углеводы, липиды и другие макромолекулы, на которые направлено действие препаратов. С этой позиции молекулярные мишени определены более точно, чем другие рецепторы.
Сегодня рецепторы определены и охарактеризованы с помощью методов молекулярной биологии. Действие некоторых типов лекарств легко объяснить без вовлечения молекулярных мишеней человека. К этим типам лекарств относятся антациды (буферы), которые уменьшают кислотность в желудке, формообразующие слабительные и комплексообразователи. Есть вещества, для механизма действия которых характерно отсутствие четкой химической специфичности. Основным примером являются газообразные и летучие общие анестетики, включая инертный газ ксенон. Для этих препаратов практически невозможно определить связывающий центр или одну молекулярную мишень. Тем не менее, вероятно, их фармакологические эффекты происходят из-за действия на компонент мембран (например, потенциал- или лиганд-зависимые ионные каналы). Этот компонент и является молекулярной мишенью для анестетиков.
Теория рецепторов очень важна для средств, которые действуют сходно или антагонистически гормонам, нейрогормонам, нейротрансмиттерам и аутакоидам
Лекарства (включая такие растительные алкалоиды, как никотин, кураре и атропин), которые оказывают сходные или противоположные нейротрансмиттерам эффекты, привели Лэнгли к формулировке теории рецепторов. Изучение действия этих средств первоначально сводилось к оценке их эффектов у животных и на изолированных тканях: например, на артериальное давление, частоту сердечных сокращений, секрецию или, чаще, сокращения гладких мышц кишечника, бронхов, сосудов или матки. Эти эффекты давно расценивают как побочную реакцию на взаимодействие лекарств с их рецепторами. Теория рецепторов способствовала развитию подходов, использующих эти данные для классификации лекарств по рецепторам, с которыми они взаимодействуют, и разработке новых лекарств, нацеленных на специфические рецепторы.
Классические рецепторы нейротрансмиттеров или гормонов в основном представлены крупными белками, содержащими участки, которые «распознаются» лекарствами и связываются с ними (рис. 2.1). Эти связывающие центры обычно ассоциированы с системой переноса
Стало ясно, что многие рецепторы являются белками. Они содержат как минимум один отдельный центр, с которым связываются и агонисты, и антагонисты. Когда связывается агонист, он запускает цепь трансдукции, которая либо непосредственно вызывает измеримый ответ (например, открытие канала), либо изменяет активность фермента, что в свою очередь приводит к измеримому ответу. Связь между действием агониста и трансдукцией может быть прямой или вовлекать в действие вторичные мессенджеры и каскад других белков. В общем случае трансдукцию вызывает не распознаваемый участок, а, скорее, происходящие аллостерические изменения рецепторной молекулы, обусловливающие каталитическую активность других частей белка (обычно во внутриклеточной среде). При этом другие части молекулы рецептора могут работать как мишени для других типов лекарств-ингибиторов, которые не являются конкурентными антагонистами.
Активный комплекс агонист-рецептор вызывает клеточный ответ через реакцию трансдукции
Активный комплекс агонист-рецептор инициирует трансдукцию либо локально на уровне мембраны, либо внутриклеточно. Примеры системы трансдукции приведены далее. Общепризнано, что в большинстве случаев ассоциация агониста с рецептором ведет к конформационным изменениям последнего и возникновению активного комплекса лекарство-рецептор. Это дает основу для модели, с помощью которой можно объяснить различное действие агонистов, частичных агонистов и антагонистов.
С рецептором могут связываться различные типы лекарства. Здесь связывание определяет лекарство в качестве лиганда для рецептора, а результат связывания показывает, является ли лекарство агонистом, антагонистом, частичным агонистом или обратным агонистом:
- если лиганд связывается с рецептором и вызывает молекулярный ответ (конформационное изменение рецептора) с последующим клеточным ответом, это агонист;
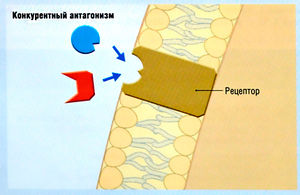
- если лиганд связывается с рецептором без индукции молекулярного ответа, ведущего к клеточному и тканевому ответу, и конкурентно блокирует доступ агониста к рецептору, этот лиганд рассматривают как конкурентный антагонист;
- если лиганд связывается с рецептором таким образом, что даже высокие концентрации не могут вызвать достаточный молекулярный ответ, лиганд называют частичным агонистом. Следовательно, максимальный тканевый ответ на действие частичного агониста будет меньше, чем на действие «полного» агониста;
- если лиганд связывается с рецептором, который в отсутствие агониста находится в активном состоянии, и делает этот рецептор неактивным, этот лиганд — обратный агонист.
Базальный уровень активности вызывает фоновый уровень трансдукции и клеточных эффектов. Когда обратный агонист связывается с активным рецептором, он инактивирует его и тем самым ингибирует базальную активность.
Тканевые ответы не обязательно прямо пропорциональны клеточным ответам, возникающим от связывания агониста с его рецептором (см. далее)
Лекарства и эндогенные вещества (гормоны и нейротрансмиттеры), которые активируют рецепторы, называют агонистами. Молекулярный ответ обусловлен активированным состоянием рецептора, который инициирует клеточный ответ.
Эндогенные агонисты есть ко многим рецепторам. Иногда эти агонисты называют первичными мессенджерами, поскольку взаимодействие с их молекулярной мишенью является первым проявлением внутриклеточных связей (аналогично другие молекулы, участвующие в развитии клеточного ответа, известны как вторичные мессенджеры).
Агонист, который полностью активирует рецептор, называют полным агонистом (см. далее в описании частичного агонизма).
В отсутствие агониста большинство рецепторов пребывают в состоянии покоя. Однако даже в этом случае рецептор может временно становиться активным, что приводит к низкоуровневому молекулярному ответу. Появление агониста изменяет равновесие в сторону активированного состояния.
Математическое соотношение между концентрацией агониста (А) и ответом определяется связыванием с рецептором (R) и ответом в результате формирования комплекса агонист-рецептор (AR), который активирует рецептор (R*). Поэтому А + R = AR =AR*. Для активации некоторых рецепторов необходима связь двух молекул агониста (А + А + R= AAR= AAR*). Для других рецепторов характерна реакция А + R + R = ARR = ARR*, т.е. присоединение агониста ведет к связыванию двух неактивных рецепторов в активированный гомодимер. Математическая основа для такого соотношения детально обсуждается далее. В книге агонисты указаны специальным значком (рис. 2.2).
В большинстве клеток максимальный клеточный ответ на действие агониста происходит только тогда, когда активирована небольшая часть рецепторов. Другими словами, рецепторов обычно намного больше, чем необходимо для достижения максимального клеточного ответа. Этот избыток рецепторов (резервные рецепторы) очень важен, поскольку он увеличивает чувствительность клетки к малым изменениям концентрации агониста (см. далее).
Частичный агонизм — это неэффективная активация рецептора
Лекарство, которое относительно неэффективно активирует рецептор, является частичным агонистом. Частичный агонист — это средство, взаимодействие которого с рецептором оказывает эффект меньше максимального либо вызывает или не вызывает молекулярный ответ (недостаточный молекулярный ответ). В любом случае максимальный клеточный ответ на действие частичного агониста меньше, чем максимальный клеточный ответ на действие полного агониста, действующего на тот же рецептор без вовлечения резервных рецепторов. Для частичных агонистов необходимо взаимодействие с большим количеством рецепторов для возникновения максимального клеточного ответа, когда нет неоккупированных рецепторов или остается их небольшое количество. Если присутствует множество резервных рецепторов, возможно, что частичный агонист вызывает максимальный клеточный ответ, хотя считается, что частичный агонист менее эффективен, чем полный, и требует большей оккупации рецепторов для возникновения максимального клеточного ответа (см. далее). Большинство клеток содержат намного больше рецепторов, необходимых для возникновения максимального клеточного ответа, поэтому частичные агонисты чаще всего способны вызвать максимальный клеточный ответ, сходный с действием полных агонистов, но для этого необходимы очень высокие дозы препаратов.
Обратный агонизм — это инициация явного клеточного ответа путем торможения спонтанной активации рецептора
Молекулярный ответ на обратный агонизм может быть:
- инактивацией активированного рецептора;
- стабилизацией рецептора в неактивной конформации.
Данная модель выглядит как R = R* и I + R* = IR, где R* — активированное состояние, I — обратный агонист.
Антагонизм — это предотвращение действия агониста
Многие лекарства связываются с рецептором, образуя комплекс лекарство-рецептор, который не вызывает клеточного ответа. Более того, оккупация рецептора антагонистом препятствует либо связыванию агониста, либо возникновению клеточного ответа при связывании агониста с рецептором. Таким образом, антагонизм может быть результатом различных молекулярных механизмов. Математическое описание эффектов различных типов антагонистов приведено далее. Кратко — антагонизм может возникать вследствие:
- связывания антагониста в том же участке рецептора, который в норме занимает агонист. Связывание антагониста препятствует оккупации центра агонистом (конкурентный антагонизм);
- связывания антагониста с участком рецептора, который в норме не оккупирует агонист (аллостерический центр), ведущего к конформационным изменениям связывающего центра агониста, что либо препятствует связыванию агониста, либо делает невозможным возникновение молекулярного ответа.
Антагонист, связывающийся с аллостерическим центром только в отсутствие агониста, называют неконкурентоспособным антагонистом. Если антагонист может связываться с аллостерическим центром даже в присутствии связанного агониста, его называют неконкурентным антагонистом. В данном случае центр часто называют лиганд-связывающим (где лигандом может быть агонист, антагонист, частичный агонист и др.).
Таблица 2.2 Шесть возможных типов антагонизма
|
Конкурентный |
Неконкурентоспособный |
Неконкурентный | |
|
Обратимый |
+ |
+ |
+ |
|
Необратимый |
+ |
+ |
+ |
Связывание антагониста может быть обратимым или необратимым. Различают как минимум шесть возможных типов антагонизма (табл. 2.2). Эффекты, проявляемые антагонистом в ответ на действие агониста, детально описаны далее. Для обозначения антагонистов будет использоваться значок, указанный на рис. 2.3.
Физиологический антагонизм отличается от фармакологического антагонизма
Часто термин «физиологический (или функциональный) антагонизм» используют некорректно. Этот термин описывает способность агониста (чаще, чем антагониста) тормозить ответ на другой агонист путем активации разных, физически разделенных рецепторов. Это может происходить, если рецепторы двух агонистов объединены одинаковыми компонентами клеточного ответа, но по-разному действуют на них, или связаны разными компонентами клеточного ответа, которые вызывают противоположные тканевые ответы. Наглядным примером служит взаимодействие между норадреналином и ацетилхолином в артериолах. Норадреналин вызывает сокращение, а ацетилхолин — расслабление. Конечно, бессмысленно описывать норадреналин как антагонист ацетилхолина, поскольку также можно ацетилхолин расценивать как антагонист к норадреналину, поэтому термины «агонист» и «антагонист» становятся взаимозаменяемы и не имеют смысла. Термин «антагонист» лучше всего подходит для описания лекарств, которые тормозят молекулярный ответ на действие агониста. Термин «функциональный антагонист» лучше не использовать.
Количественный анализ механизмов действия лекарств в основном заключается в интерпретации кривых доза-ответ
Количественный анализ действия лекарств важен при разработке новых препаратов, если цель состоит в получении:
- препаратов, селективных по рецепторам, с которыми они взаимодействуют;
- препаратов, селективных по особенности их взаимодействия только с одним подтипом рецептора.
Существует несколько фундаментальных принципов при оценке кривых связывания лекарства с рецептором и доза-ответ. К большинству препаратов, используемых в клинической практике и в эксперименте, могут быть применимы следующие принципы:
- на любой клетке в ткани находятся рецепторы; большинство клеток экспрессируют множество разных типов рецепторов;
- в присутствии препарата постоянно случайным образом создаются комплексы лекарство-рецептор благодаря столкновению движущихся молекул лекарства с неоккупированными рецепторами. Комплексы лекарство-рецептор постоянно разрушаются, освобождая таким образом рецепторы для повторного взаимодействия с лекарством;
- комплексы рецептор-агонист постоянно меняются от неактивной конформации к активной (молекулярный ответ). Последняя вызывает биофизические изменения, например открытие ионных каналов, или биохимические изменения, например активацию G-белков, что ведет к тканевому ответу;
- число рецепторов на клетке может изменяться при патологических процессах или длительном приеме лекарств.
К этим фундаментальным принципам можно добавить два полезных правила:
- субмаксимальный тканевый ответ на агонист пропорционален дозе (концентрации) агониста и числу доступных рецепторов;
- связываясь с рецепторами, антагонист уменьшает число рецепторов, доступных агонисту, независимо от дозы агониста.
Перечисленные ранее фундаментальные принципы отражают действие лекарств с точки зрения связи между эмпирическими наблюдениями и экспериментальными данными и основными химическими и физико-химическими реакциями. Количественные параметры этой теории в различных аспектах проявляются при связывании радиоактивно меченных лигандов с рецепторами в культуре ткани. Поскольку подобные эксперименты легко воспроизводимы и понятны, удобнее рассматривать связывание лекарства с рецептором до изучения кривых доза-ответ.
Связывание лекарства с рецептором[править | править код]
Рецептор можно рассматривать как структуру, которая селективно и специфически связывает лекарство. Для упрощения приведем пример селективного связывания лекарства только с одним определенным центром рецептора.
Самая простая модель обратимого связывания лекарства[править | править код]
Согласно самой простой модели обратимого связывания лекарства с рецептором, каждая молекула лекарства (D) может случайно присоединяться к молекуле рецептора (R), формируя комплекс лекарство-рецептор (DR). Этот комплекс впоследствии разрушается, высвобождая молекулу лекарства и неоккупированный рецептор. Согласно закону действия масс, скорость формирования новых DR-комплексов пропорциональна концентрации D и концентрации свободных R, т.е. [D] и [R] соответственно (концентрацию обозначают в квадратных скобках). В то же время скорость, с которой DR-комплексы разрушаются до D и R, пропорциональна концентрации DR, т.е. [DR].
В состоянии равновесия скорость образования DR-комплексов равна интенсивности их разрушения, т.е.:
KD [DR] = [D] [R], (ф. 2.1)
где KD — константа диссоциации, обычно выражаемая в молях (М). KD зависит от физических факторов, таких как температура, и химической природы взаимодействующих веществ. В данной простой модели KD представляет собой соотношение присоединения и отсоединения. Важно отметить, что сходное уравнение применимо к более сложным моделям, в которых присутствуют сложные конформации R и DR, в комплексных случаях KD зависит от значения всех постоянных, необходимых для описания системы. Тем не менее независимо от количества конформаций R и DR рецептор может рассматриваться только в двух формах — R и DR с KD [DR] = [D] [R]. Другая форма уравнения выглядит как [DR] = [D] [R]/KD.
[DR] + [R] является постоянной
Общее количество рецепторов ограничено, поэтому конечная концентрация [DR] + [R] постоянна. Ее обозначают [RJ. Следовательно:
[R] = [R] + [DR] = [R] (1 + [D]/Kd), (ф. 2.2)
если [DR] заменить на [R] [D]/Kd (см. ранее).
Объединение этого уравнения с KD [DR] = [D] [R] дает:
[DR]/[RJ = ([D]/Kd) (1 + [D]/Kd) (ф. 2.3)
при [DR]/[Rt], указывающее, что только один R в данный момент объединен с D.
Полулогарифмические графики обычно используют и для кривых концентрация-ответ, и для изучения связывания
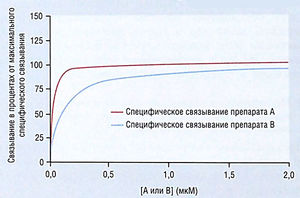
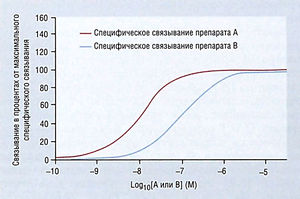
График [DR] против [D] для двух лекарств (А и В с очень разными значениями KD) приведен на рис. 2.4. На нем видно, что хотя оба графика характеризуются одинаковым начальным линейным подъемом по концентрации, который к максимуму уплощается, неудобно использовать одну и ту же ось X для обоих лекарств. На рис. 2.5 те же данные представлены как полулогарифмические, т.е. [DR] против log[D]. Графики показывают, что обе кривые в целом одинаковы и различаются только в положении относительно оси X. Такие полулогарифмические кривые используют для изучения связывания и зависимости доза-ответ.
При изучении связывания рецепторы инкубируют при различных концентрациях D, когда D мечен радиоактивным изотопом (обычно 3Н), затем их быстро фильтруют и промывают для удаления несвязанного лекарства. Последующий подсчет остаточной радиоактивности показывает, сколько лекарства осталось. Однако некоторая оставшаяся часть обусловлена простой неспецифической задержкой лекарства в порах фильтра либо между клетками или, вероятно, растворением в липидах ткани. Эффект неспецифического связывания выражается в процентах от специфического.
Описание к рис. 2.4 Линейный график специфического и неспецифического рецепторного связывания двух препаратов, А и В, где KD = 0,01 мкМ (КА) и KD = 0,1 мкМ (Кв). По оси Y: связывание (образование AR или BR), выраженное в процентах от максимального специфического связывания А и В соответственно. По оси X: концентрации А и В. Примечание: шаг на оси концентраций равный (линейный), пересечение соответствует 0,0. мкМ — микромо-лярная концентрация.
Описание к рис. 2.5 Полулогарифмический график рис. 2.4. Связывание при более высоких концентрациях А и В было изучено в таких же условиях, как на рис. 2.4, где КА = 0,01 мкМ и Кв = 0,1 мкМ. На данном рисунке ось X отображена logI0 в пределах концентраций от 10~10 до > 10-5 М, что является снижением концентрации в 100 000 раз. Пересечение осей X и Y находится в 0, -10. Аффинитет — это способность препарата связываться со своим рецептором, которую измеряют через KD. Кривизна кривой связывания показывает природу связывания. Эта простая модель имеет значение 1, поскольку одна молекула D связывается с одной молекулой R. М — молярная концентрация.
Исследования связывания дают ценную информацию о взаимодействиях между лекарством и рецептором
Предположим, что рецептор может связать молекулу лекарства (D) и лекарства (I), но не одновременно (рис. 2.6). В данном случае рецептор может существовать в трех формах:
- свободный R с концентрацией [R];
- DR с концентрацией [DR] = [R] [D]/Kd;
- IR с концентрацией [IR] = [R] [I]/Kj (где — константа диссоциации IR). Из указанного можно вывести следующее уравнение:
[RJ = [R] + [DR] + [IR], (ф. 2.4)
где [Rt] — сумма всех форм R. Сходные уравнения могут быть получены для [DR] и [IR]. Далее серия уравнений может быть выведена путем замещения.
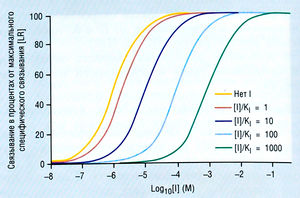
Важно, что если [D] достаточно высока, то большинство рецепторов будет связано с D (DR), несмотря на присутствие I. И наоборот, если [I] достаточно высока, большинство рецепторов будет связано с I (IR), несмотря на присутствие D. Таким образом, I конкурирует с D, a D c I. Конкуренция возникает из-за невозможности рецептора связать D и I одновременно. Конкурирование математически эквивалентно произведению константы диссоциации (1 + с), где с - концентрация конкурента, индуцирующего параллельный сдвиг кривой [DR] против log[D] (кривая доза-ответ) вправо по оси X. Сдвиг будет определяться log(l + с), где с = [I]/Kj (рис. 2.7).
Описание к рис. 2.7 Специфическое связывание препарата (L) в присутствии конкурентного антагониста (I) при различных концентрациях [l]/K| = 1, 10, 100 или 1000. Как и на рис. 2.5, это полулогарифмический график, на котором ось X выражена в 1од10. Примечание: присутствие I сдвигает кривую концентрация-связывание для L вправо параллельно. Величина сдвига зависит от [1]/К|, при которой каждое 10-кратное увеличение вызывает параллельный сдвиг на log 1,0 (= 10). Кi- константа диссоциации I; М — молярная концентрация.
На этом построен метод экспериментального определения константы диссоциации конкурирующей молекулы. При любой [I] отношение доз (dose ratio) (DR), равное значениям [D], формирующим такую же [DR] в присутствии или в отсутствии С, рассчитывают как:
DR = 1 + [I]/Ki (ф. 2.5)
Преобразовав это уравнение, получаем:
(DR - 1)/[I] =1/Кi (ф. 2.6)
Данный метод менее важен при исследовании связывания, но представляет большой интерес при оценке зависимости функциональная концентрация-ответ при взаимодействии агониста/антагониста с рецептором, когда ответ на [DR] измерен точнее, чем связывание. Добавление конкурентного антагониста I в присутствии агониста D эквивалентно уменьшению концентрации агониста на фактор (1 + [1]/Кi). Это приводит к сдвигу кривой ответ-log[агонист] вправо, который аналогичен сдвигу на рис. 2.7. Таким образом, первоначальные ответы определяются произведением доз агониста и DR, которое равно 1 + [1]/Кх.
Классификация рецепторов лекарств[править | править код]
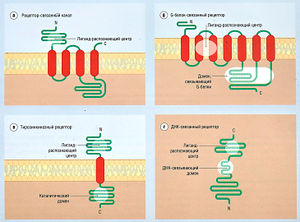
Лекарства, действующие на рецепторы, вызывают широкий спектр тканевых и системных ответов по двум причинам. Во-первых, на разных тканях находятся различные рецепторы. Во-вторых, различным типам рецепторов присуща разная структура и, соответственно, функция, поэтому клеточный ответ на активацию рецептора (трансдукция) значительно варьирует в зависимости от структуры рецептора. Выделяют четыре типа рецепторов (рис. 2.8), которые отличаются кинетическими характеристиками:
- ДНК-связанные рецепторы;
- рецепторы, обладающие тирозинкиназной активностью (тирозинкиназные рецепторы);
- рецептор-связанные каналы (РСК).
Описание к рис. 2.8 Схематическое отображение общей структуры четырех групп гормональных нейромедиаторов, (а) Рецептор-связанный канал: внеклеточный связывающий домен связан с гидрофобным a-участком белка, образующего мембранный домен. Общая структура, образующая комплекс, окружающий центральный ионный канал, может содержать до 5 субъединиц. Лучшим примером является никотиновый рецептор ацетилхолина (см. рис. 2.14). Обычно такой тип рецептора обеспечивает очень быстрое действие нейромедиатора. (б) G-белок-связанный рецептор: связывающий лекарство центр находится в a-участке, а мембранный домен связан с внутриклеточным доменом, который связан с G-белками. Это типичная структура рецептора для многих гормонов и медленно действующих систем нейромедиаторов, влияющих через G-белок-связанную систему трансдукции (например, норадреналин, действующий на сердечную мышцу). Домен, связывающий G-белки, является частью рецептора, который взаимодействует с а-субъединицей G-белка и инициирует трансдукцию после связывания агониста со связывающим доменом, (в) Рецепторы к тирозинкиназе: рецепторы к различным факторам роста и инсулину имеют внеклеточный активный центр, непосредственно связанный с внутриклеточным каталитическим доменом, который обладает либо тирозинкиназной, либо гуанилилкиназной активностью, где лиганд-связывающий центр оккупирован соответствующим агонистом. Эти рецепторы являются ферментами, (г) ДНК-связанный рецептор: активный центр связан с ДНК-связывающим доменом, как, например, рецепторы для стероидов и тиреоидных гормонов. Эти рецепторы называют ДНК-связанными рецепторами. С — С-окончание; N — N-окончание; ДНК — дезоксирибонуклеиновая кислота [Pharmacology, 3rd edn, by Rang, Dale and Ritter, Churchill Livingstone, 1995].
Тирозинкиназные рецепторы и РСК отличаются от остальных тем, что для проявления клеточного ответа они не требуют клеточной трансдукции компонентов при активации агонистом, поэтому молекула рецептора играет большую роль, чем молекулярное звено между лекарством и трансдукцией. Тирозинкиназный рецептор — в действительности мембраносвязанный фермент, который «включается» агонистом. РСК — специфический ионный канал, который структурно отличается от потенциалзависимых каналов, регулируемых лекарством или нейротрансмиттером, тем, что он присоединяется к высокоспецифическому лиганд-связывающему центру, а не к специфическому потенциал-чувствительному участку. В РСК лиганд-связывающий центр и канал являются функционально различными участками одной молекулы. РСК также называют лиганд-зависимым ионным каналом. Приведенная классификация удобна, поскольку рассматривает тирозинкиназные структуры и РСК как рецепторы.
С-белок-связанные рецепторы[править | править код]
Описание к рис. 2.9 Значки, обозначающие С-белок в неактивном и активном состояниях. а-Субъединица (as) диссоциирует при неактивном С-белке {см. рис. 2.11), но для упрощения значок активного G-белка показан как интактный с добавлением (как для активного рецептора; см. рис. 2.1). Помимо этого, показано значение G-белка для связывания рецептора в каскаде трансдукции.
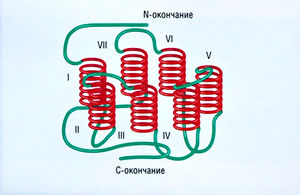
G-белки (рис. 2.9) являются компонентами трансдукции. Рецепторы, связанные с G-белками, локализованы на клеточной мембране и состоят из 7 трансмембранных спиралей (I—VII) (рис. 2.10).
В отсутствие агониста рецептор связан с G-белком, что удерживает рецептор в неактивной конформации. Сам по себе G-белок — это комплекс трех субъединиц (a, Р и у). Когда рецептор находится в состоянии покоя, три субъединицы G-белка и гуанозиндифосфат (ГДФ) прочно связаны с а-субъединицей G-белка. Связывание агониста приводит к конформационным изменениям рецептора, что, в свою очередь, вызывает конформационное изменение G-белка, ведущее к диссоциации ГДФ от a-субъединицы. Это инициирует последовательность реакций и способствует трансдукции G-белок-связанного рецептора, которая описывается далее.
Интересно, что эффекты, регулируемые G-белок-связанными рецепторами, могут со временем убывать, несмотря на присутствие агониста. Это явление называют десенсибилизацией (см. далее).
Трансдукция, связанная с циклическими нуклеотидами[править | править код]
Из компонентов трансдукции, непосредственно связанных с G-белками, наиболее распространенным в организме является аденилилциклаза. Циклический нуклеотид цАМФ синтезируется из аденозинтрифосфата (АТФ) ферментом аденилилциклазой. цАМФ обладает различными биологическими эффектами.
цАМФ оказывает действие на энергетический обмен, клеточную дифференцировку, функцию ионных каналов и сократительные белки
цАМФ фосфорилирует внутриклеточные белки (чаще ферменты) через воздействие цАМФ-зависимых протеинкиназ. Эти протеинкиназы активируют цАМФ и фосфорилируют аминокислоты серин и треонин, используя АТФ как источник фосфора (рис. 2.11).
Результат фосфорилирования состоит в:
- активации гормон-чувствительных липаз;
- инактивации гликогенсинтазы;
- активации фосфорилазкиназы и превращении неактивной фосфорилазы в активную, что приводит к ускорению липолиза, снижению синтеза и ускорению распада гликогена;
- активации Са2+-каналов L-типа и саркоплазматического ретикулума в сердечных клетках за счет фосфорилирования, что увеличивает выход кальция.
Описание к рис. 2.11 Схематическое изображение активации G-белок-связанного рецептора, (а) Многокомпонентная структура, (б) Комплекс Ру присоединяет G-белок к мембране. Связывание агониста с G-белком инициирует конформационные изменения рецептора, что в свою очередь активирует G-белок и ведет к диссоциации гетеродимера ру из a-субъединицы (оц); помимо этого, связанный гуанозинтрифосфат (ГТФ) диссоциирует из a-субъединицы, что ведет к присоединению ГТФ к белку, (в, г) Комплекс а-ГТФ взаимодействует с целевым белком (например, ферментом аденилилциклазой или ионным каналом), (д) Активность ГТФазы a-субъединицы гидролизует связанный ГТФ в гуанозиндифосфат (ГДФ), что позволяет a-субъединице заново объединяться с комплексом Ру. АТФ — аденозинтрифосфат; цАМФ — циклический аденозинмонофосфат.
Диацилглицерол- и инозитол-1,4,5-трифосфат-связанные рецепторы[править | править код]
Многие G-белки активируют диацилглицерол- и инозитол-1,4,5-трифосфатный путь. Один из G-белков, обозначаемый Gq, стимулирует активность фосфолипазы С. Этот фермент, в свою очередь, способствует продукции диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (1Р3) через гидролиз полифосфотидинозитов. Альтернативный путь включает активацию G-белками мембранной фосфолипазы А2, что ведет к образованию ДАГ и фосфатидной кислоты. Эти компоненты трансдукции обладают различными эффектами.
IР3 представлен не только инозитолфосфатом, продуцируемым фосфолипазой в клетках. Существует множество соединений, которые могут обладать различными функциями. Считается, что инозитол-1,3,4,5-тетрафосфат облегчает вход кальция в различные внутриклеточные компартменты (см. рис. 2.26).
ДНК-связанные рецепторы[править | править код]
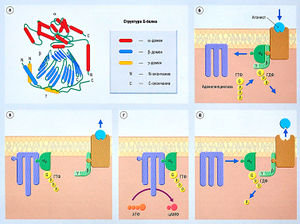
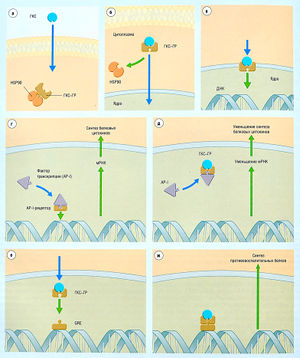
Внутриклеточные рецепторы, которые взаимодействуют с ДНК, связываются с гормонами, такими как ретиноевая кислота, кортикостероиды, тирео-идные гормоны и витамин D. Эти рецепторы состоят из ядерных белков. Таким образом, агонисты должны пройти через клеточную мембрану, чтобы достичь рецептора. Например, стероиды проникают в клетку и связываются с цитоплазматическим рецептором, который зачастую имеет прицепленную тормозящую молекулу, например белок теплового шока с массой 90 кДа (HSP90). Молекулярным ответом является изменение конформации рецептора, что ведет к диссоциации рецептора от тормозящей молекулы. Существует множество вариантов клеточных ответов на активацию ДНК-рецепторов, как показано на рис. 2.12.
Описание к рис. 2.12 Пример трансдукции ДНК-связанного рецептора. Считается, что глюкокортикостероиды (ГКС) реализуют свой эффект посредством как минимум двух механизмов, (а) ГКС пересекают клеточную мембрану и связываются рецептором в цитоплазме (здесь они связаны в неактивной форме с белком теплового шока с массой 90 кДА, HSP90). (б) Первый этап трансдукции: диссоциация комплекса глюкокортикостероида и глюкокортикостероидного рецептора (ГР) от HSP90. (в) Второй этап трансдукции: транслокация ГКС-ГР в ядро клетки, (г) В некоторых клетках синтез белков (например, провоспалительных цитокинов) может быть запущен факторами транскрипции, действующими на свои собственные рецепторы, (д) Попав в ядро, ГКС-ГР присоединяется к фактору транскрипции (например, АР-1), тем самым уменьшая количество синтезированного белка. Если этот белок — медиатор воспаления (например, цитокин), то эффектом будет уменьшение воспаления, (е) Помимо этого, ГКС-ГР может связаться с генами, реагирующими на глюкокортикостероиды (CRE, рецептор на ДНК), (ж) Связывание ГКС-ГР и CRE стимулирует синтез белков, обладающих противовоспалительным действием (например, липокорти-нов). ДНК — дезоксирибонуклеиновая кислота; мРНК — матричная рибонуклеиновая кислота.
Рецепторы, обладающие тирозинкиназной активностью (тирозинкиназные рецепторы)[править | править код]
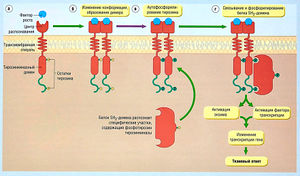
Действие агонистов на тирозинкиназные рецепторы (рис. 2.13) сопряжено с регуляцией роста, клеточной дифференцировкой и ответом на метаболические стимулы. К эндогенным агонистам относят инсулин, фактор роста эпидермиса и фактор роста тромбоцитов. Агонисты вызывают изменение конформации рецептора и действуют как тирозинкиназные ферменты, фосфорилируя остатки тирозина в широком спектре молекул внутри клетки.
Описание к рис. 2.13 Механизм трансдукции в рецепторах тирозинкиназы. (а) Связывание фактора роста с N-окончанием рецептора (6) ведет к конформационным изменениям и образованию димера. Это приводит к аутофосфорилированию остатков тирозина в домене тирозинкиназы в рецепторе (в). Специфические участки в домене тирозинкиназы, содержащие фосфотирозин, затем соединяются с 5Н2-доменом, что приводит к активации различных внутриклеточных и последующих тканевых ответов (г) [Pharmacology, 3rd edn, by Rang, Dale and Ritter, Churchill Livingstone, 1995].
Рецептор-связанные каналы[править | править код]
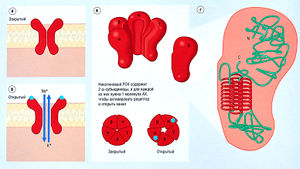
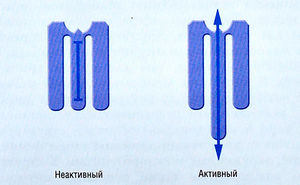
РСК состоят из субъединиц, каждая из которых имеет четыре трансмембранных домена. Эти домены образуют комплексы с различной стехиометрией (рис. 2.14). Существует несколько различных типов РСК. Каждый несет в своей структуре внеклеточный центр, связывающий лекарство. При присоединении лекарства к нему запускаются конформационные изменения других частей молекулы РСК, что приводит к открытию центральной ион-селективной поры. Ток ионов происходит только при открытой поре. Молекулярная конфигурация канала в этом случае определяет состояние канала.
Описание к рис. 2.14 Канал, регулируемый никотиновым рецептором ацетилхолина (АХ). Рецептор-связанный канал (РСК) может быть в закрытом (а) или открытом (б) состоянии, (в) Канал состоит из пяти белковых субъединиц (две а, р, у и 5), которые проникают через мембрану и окружают центральную пору. АХ связывается с а-субъединицами, и для открытия канала необходимы две молекулы АХ. (г) Полная структура одиночной 8-субъединицы. С — С-окончание; N — N-окончание.
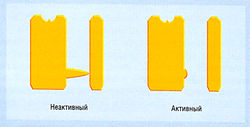
Простейшая модель состояний канала включает три варианта:
- состояние покоя (неуправляемый канал, т.е. закрытый, но открывающийся в ответ на соответствующий стимул);
- состояние активации (открытый канал);
- состояние инактивации (т.е. закрытый и неспособный к открытию канал в ответ на соответствующий стимул в отличие от канала в состоянии покоя).
Некоторые лекарства обладают молекулярным механизмом действия, который вовлекает модуляции перехода РСК из одного состояния в другое (процесс также называют «гейтинг»; см. «Потенциалзависимые каналы»).
Центр, связывающий лекарство, обычно обозначают как рецептор (который оперирует каналом). В данной книге РСК обозначен значком, отличающимся от значка для рецепторов гормонов, нейротрансмиттеров и аутакоидов (рис. 2.15). РСК для удобства обозначают как рецептор, а также канал или канал с рецепторным центром. Так, никотиновый холинергический рецептор является РСК (этот РСК содержит два центра, связывающих лекарство).
В большинстве случаев агонист РСК открывает канал, в то время как антагонист препятствует его открытию, а обратный агонист закрывает открытый канал. К РСК относят:
- никотиновые РСК (активируются ацетилхолином);
- ГАМК-РСК (активируются гамма-аминомасляной кислотой, ГАМК);
- глициновые РСК (активируются глицином);
- 5-НТ3-РСК (активируются 5-гидрокситриптами-ном);
- Р2х-РСК (активируются аденозином).
Никотиновый рецептор является частью РСК и представляет собой тетрамер с двумя ацетилхолин-связывающими центрами на наружном крае. Другие РСК во многом сходны с ним. Когда молекулы ацетилхолина связываются со связывающими центрами, конформация РСК изменяется, и открывается канальцевый компонент. Это приводит к резкому увеличению проницаемости ионов Na+ и К+ и деполяризации прилегающей клеточной мембраны. Насчитывают несколько подтипов никотиновых РСК, незначительно различающихся по составу, структуре и распределению в тканях. Все они активируются ацетилхолином, но определенные лекарства обладают селективностью к тому или иному подтипу. Некоторые лекарства (например, гексаметоний) действуют на ганглионарные никотиновые РСК больше, чем на РСК скелетных мышц, а другие — наоборот (например, d-тубокурарин).
ГАМК-РСК содержит регулируемый ГАМК Сl-канал с двумя связывающими центрами, где один центр связывает ГАМК, а другой — транквилизирующие лекарства класса бензодиазепинов (см. главу 8). Связывание агониста и антагониста приводит к сложному спектру молекулярных ответов. ГАМК-РСК обнаружены в различных областях центральной нервной системы. Активация этих РСК обычно вызывает гиперполяризацию, которая снижает нейрональную активность.
ДРУГИЕ МОЛЕКУЛЫ КЛЕТКИ КАК МОЛЕКУЛЯРНЫЕ МИШЕНИ ЛЕКАРСТВ[править | править код]
Участок молекулы, к которому присоединяется лекарство, обозначают как его рецептор. Существует много клеточных молекул, имеющих рецепторы к лекарствам, включая:
- потенциал-зависимые каналы;
- транспортеры, симпортеры, антипортеры и насосы;
- ферменты;
- нуклеиновые кислоты;
- структурные макромолекулы.
Потенциал-зависимые каналы[править | править код]
ПЗК контролируются потенциалом мембраны
Потенциал-зависимые каналы (ПЗК) и РСК имеют много общих свойств. ПЗК и РСК являются ионными каналами, но ПЗК контролируются только потенциалом, хотя данное функциональное различие не абсолютно, поскольку некоторые РСК в некоторой степени также потенциал-зависимые. Если состояние ионного канала в норме контролируется потенциалом мембраны, канал классифицируют как ПЗК. Контроль ПЗК эндогенными веществами в норме — только малая часть их функции; большинство ПЗК не имеют эндогенных модуляторов, эквивалентных ацетилхолину (например, эндогенного агониста никотиновых РСК). Однако ПЗК являются мишенями для определенных препаратов, которые изменяют состояние ПЗК либо его потенциал-зависимость (или просто вызывают блокаду канала). В данной ситуации различные части ПЗК функционируют как молекулярные мишени для экзогенных веществ. В этой книге ПЗК обозначены значком, показанным на рис. 2.16.
ПЗК формируют группу молекулярных мишеней для лекарств, поскольку структурно и функционально отличаются от РСК. ПЗК-мишень содержит один или несколько связывающих центров, сенсор потенциала и канальцевый компонент. Последний обеспечивает молекулярный ответ и управляется сенсорами потенциала и лиганд-связывающим центром. Селективность ПЗК по проводимости различных ионов определяется специфической конфигурацией белка и канальцевой поры (рис. 2.17).
Описание к рис. 2.17 Структура потенциал-зависимого канала для Са2+. (а) В покое канал закрыт, и пассаж ионов невозможен, (б) Когда канал открывается, ионы двигаются согласно градиенту концентрации, (в) Открытие канала обусловлено прежде всего переориентацией двух | а- и р-субъединиц. (г) Полная структура одной а-субъединицы. М,-М6 относятся к доменам а-субъединицы. С — С-окончание; N — 29 N-окончание.
Примером ПЗК являются кардиальные Na+-Kananbi
Кардиальные На+-каналы содержат как минимум два потенциал-зависимых канала, которые вызывают открытие и закрытие ПЗК в ответ на изменение мембранного потенциала (потенциал-зависимость):
- быстрый канал (открывается и закрывается за миллисекунды);
- медленный канал (открывается и закрывается за десятки миллисекунд).
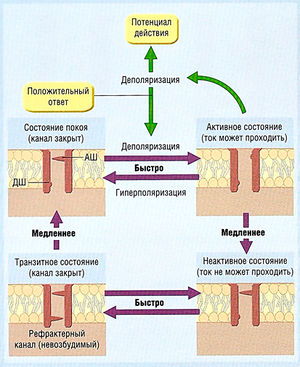
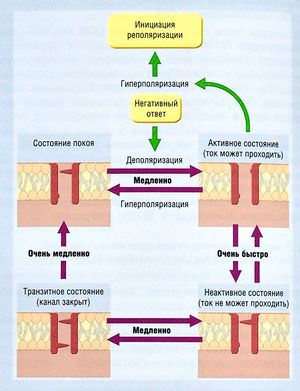
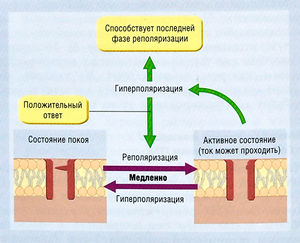
Во время диастолы, когда потенциал мембраны отрицательный, медленный канал открыт, а быстрый — закрыт. Поскольку канал может быть активирован, считают, что он находится в состоянии покоя (рис. 2.18). Но если потенциал мембраны становится более положительным, быстрый канал открывается мгновенно, и оба канала становятся открытыми. Затем медленный канал медленно закрывается в ответ на изменение потенциала мембраны. В результате, если потенциал мембраны остается положительным, медленный канал со временем закроется и будет инактивирован (не способен открыться в ответ на любой стимул). Таким образом, инактивация ПЗК зависит от времени.
Описание к рис. 2.18 Регуляция входящих токов сердца. Эта упрощенная модель имеет два шлюза: один открывается при деполяризации и закрывается при гиперполяризации, второй функционирует в обратном порядке. Переход из неактивного состояния в активное вследствие деполяризации происходит быстро по принципу положительной обратной связи. Это основа потенциала действия. Инактивация зависит от времени и ведет к медленному закрытию второго канала при положительном потенциале. Если инактивированный канал закрыт (в неактивном состоянии), клетка невозбудима. Переход способствует реполяризации. Переход от медленного потенциал-зависимого открытия неактивного канала определяет рефрактерный период (период невозбудимости в присутствии потенциала действия). АШ — активирующий шлюз; ДШ — дезактивирующий шлюз.
Инактивация играет важную роль. При реполяризации мембранного потенциала быстрый канал закрывается быстро, в то время как открытие медленного канала требует времени. В этом случае оба канала (и, следовательно, ПЗК) закрыты. Если мембрана неожиданно деполяризуется (становится более положительной), быстрый канал откроется снова, но медленный канал, который закрылся при деполяризации, снова не откроется, поскольку он открывается только при отрицательном потенциале мембраны, а не при деполяризации. Таким образом, ПЗК не откроется.
Если потенциал мембраны остается отрицательным, медленный канал снова медленно откроется (проявляя зависимость восстановления канала от времени). Последующая деполяризация не откроет медленный канал, т.к. быстрый канал откроется до того, как у медленного канала будет время снова закрыться.
Определенные лекарства могут связываться с ПЗК и изменять их поведение. Некоторые лекарства, особенно антиаритмические препараты класса I (см. главу 13), связываются с ПЗК и изменяют конформацию, фиксируя его в неактивном состоянии на все время, пока лекарство остается прикрепленным к нему.
Сродство лекарства к рецептору может зависеть от состояния ПЗК
Очевидное сродство ПЗК-контролирующих средств может зависеть от потенциала мембраны и скорости, с которой она переходит в разные состояния. В связи с этим важной является характеристика зависимости действия некоторых лекарств от потенциала и частоты. Существует два возможных объяснения такой зависимости:
- сродство и/или доступ лекарства к его рецептору определяется состоянием ПЗК.
- доступ лекарства к его рецептору определяется состоянием ПЗК.
Вероятно, модель действия многих ПЗК-контролирующих средств сводится к тому, что рецептор лекарства изменяет свою конформацию, как и ПЗК-состояние, тем самым изменяя сродство ПЗК к лекарству. Простейший пример представлен средством, которое может связаться при любом состоянии ПЗК, как описано выше и показано на рис. 2.18. Лекарство, сродство которого наибольшее при активированном состоянии ПЗК, называют блокатором активированного состояния.
Если рецептор внутриклеточный или находится внутри мембраны ПЗК, а лекарство достигает этого центра через открытый ПЗК, такое лекарство является зависимым по своему действию, т.е. требует открытого ПЗК. Хорошо растворимым в жирах средствам не требуется открытый ПЗК для контакта с рецептором, поскольку они легко проникают сквозь двойной слой липидов клеточной мембраны и реагируют с молекулярной мишенью. Следовательно, их действие менее зависимо. Распознать все возможные центры связывания в ПЗК сложно. В результате для описания действия лекарств на ПЗК используют различные термины.
Для описания лекарств, модулирующих функцию ПЗК, используют термины «ПЗК-блокатор», «агонист», «антагонист», «отрицательный модулятор». Большинство терминов (например, «блокатор Nа+-каналов» или «антагонист кальция») не отражают точного механизма действия лекарств, модулирующих функционирование каналов.
Взаимодействие лекарств с Nа+-селективными ПЗК[править | править код]
Различные типы Ка+-селективных ПЗК (Nа+-каналы) обнаружены в нейронах, миокарде и скелетных мышцах. Они немного различаются по структуре и белковому составу. Средства, ослабляющие функцию Na+-каналов, известны как блокаторы Na+-каналов. Их в определенной степени можно использовать в эксперименте для определения роли различных типов Nа+-каналов в норме и при патологии. Например, тетродотоксин (токсин, найденный в рыбе-шаре, некоторых саламандрах и одном виде осьминога) блокирует Nа+-каналы в нейронах и скелетных мышцах в концентрациях менее 10 нМ, а концентрация, необходимая для блокады Nа+-каналов миокарда, в 10-100 раз выше.
В терапии используют три типа средств, блокирующих Na+-селективные ПЗК
Тетродотоксин, лекарство класса I антиаритмических средств, и местные анестетики блокируют Nа+-каналы:
- тетродотоксин обладает молекулярной селективностью к нейрональным каналам. Это высокополярная молекула, которая не проникает через клеточную мембрану и связывается с внеклеточным центром ПЗК;
- лекарства класса I антиаритмических средств связываются с внутриклеточным рецептором; их используют для лечения некоторых форм аритмии. Существует три типа класса I антиаритмических средств (la, lb, 1с), которые характеризуются по относительному сродству и кинетике связывания и диссоциации (называемой в данном контексте отсоединением) с ПЗК в трех его состояниях;
- местные анестетики, например лидокаин и бупивакаин, обладают низкой селективностью к нейрональным Nа+-каналам, но при местном использовании преимущественно воздействуют на чувствительные нервы (см. главу 8). Некоторые местные анестетики связываются с внутриклеточным центром нейрональных Nа+-каналов, т.е. они должны проникнуть через клеточную мембрану для блокирования этого канала.
Взаимодействие лекарств с Са2+-селективными ПЗК[править | править код]
На плазменных мембранах находятся как минимум пять типов Са2+-селективных ПЗК (Са2+-каналы) (L, Т, N, Р, Q), которые открывают доступ кальция в клетку. Эти ПЗК обнаруживаются в разных типах тканей. Лучше всего охарактеризован и наиболее важным (клинически) считается L-тип (длительно действующий), локализованный в сердечной и гладких мышцах. Он открывается во время деполяризации и затем инактивируется потенциал-зависимым способом (медленней, чем Na+-селективный ПЗК). L-тип ПЗК блокируется различными лекарственными препаратами, блокаторами Са2+-каналов, известными также как антагонисты ионов Са2+.
Существует три химических класса блокаторов Са2+-каналов L-muna
Эти классы следующие:
- производные бензотиазепина (например, дилтиазем);
- фенетилалкиламины (например, верапамил);
- дигидропиридины (например, нифедипин, амлодипин).
Все блокаторы Са2+-каналов характеризуются избирательным действием на гладкие мышцы сосудов, но одни из них более избирательны, чем другие. Так, 1,4-дигидропиридины (например, нифедипин) проявляют заметную активность в отношении гладких мышц сосудов по сравнению с другими тканями с каналами L-типа (сердечная мышца). Однако небольшие дозы препарата вызывают расслабление гладких мышц сосудов (вазодилатация) без изменения сердечного выброса. Это является основанием для использования нифедипина для лечения повышенного артериального давления.
Основной причиной данной избирательности является то, что клетки гладких мышц сосудов подвержены длительному периоду деполяризации (основа для вазоконстрикции), в то время как ткань сердца деполяризуется кратковременно (только во время систолы). Длительная деполяризация поддерживает высокую долю Са2+-каналов L-типа в активированном и инактивированном состоянии по сравнению с состоянием покоя. Нифедипин относительно селективен к активированным и инактивированным каналам L-типа, поэтому относительно медленно связывается в течение деполяризации и диссоциирует (отщепляется) относительно быстро, когда ткань реполяризуется.
Верапамил (фенетилалкиламиновый блокатор ионов Са2+) имеет другие характеристики связывания с каналом L-типа: менее избирателен к сосудам, чем 1,4-дигидропиридины, и в высоких дозах может блокировать каналы L-типа как сердца, так и сосудов. В отличии от нифедипина, верапамил более важен в лечении аритмий сердца с вовлечением антриовентрикулярного узла. Это хороший пример того, как тканевая селективность обусловлена нюансами молекулярного механизма действия.
Взаимодействие лекарств с К+-селективными ПЗК[править | править код]
При открытии К+-селективных ПЗК (К+-каналы) происходит генерация тока ионов из клетки (гиперполяризация). Существует множество типов К+-каналов, которые различаются по структуре, характеристикам открывания и закрывания, сродству к лекарствам и находятся в разных органах и тканях, что потенциально важно для терапевтических средств, направленных на специфические ткани и заболевания. Идентифицировано как минимум шесть различных типов К+-каналов (со значительными структурными отличиями). Каждый из типов включает несколько подтипов (К+-каналы с незначительными структурными вариациями). Обычно одна ткань содержит несколько разных К+-каналов (например, распознано более десяти типов К+-каналов в сердце).
Номенклатура токов ионов К+, связанная с разными каналами, сложна, т.к. в большой степени определяется тканью, в которой наблюдаются эти токи. Например, в сердце происходит быстрый Са2+-независимый кратковременный ток ионов К+ наружу (называемый Itol), а в нервной ткани — ток К+ (1а), хотя каналы, ответственные за эти токи, одинаковы. Номенклатура К+-каналов основана на типе гена, структуре белка и характеристике потенциала (Кv-каналы).
'К+-каналы и связанные с ними токи варьируют в зависимости от потенциала и времени
Существуют заметные различия между разными токами ионов К+ в зависимости от потенциала и времени. Например, замедленный быстрый выпрямленный ток К+ (IКr) активируется деполяризацией, а входящий выпрямленный ток К+ (IК1) — гиперполяризацией и не проявляет времязависимой инактивации (рис. 2.19, 2.20). В сердце смешение свойств разных К+-каналов ведет к необычной форме действия потенциала миокарда.
Описание к рис. 2.19 Регуляция замедленного быстрого выпрямленного тока К+ (IКr) в сердце. В канале два прохода, таким образом, канал может быть в четырех состояниях. Деполяризация изменяет состояние покоя канала на активное, способствуя выходящему току. Это вызывает отрицательный обратный ток деполяризации, инициируя ре(гипер)поляризацию. Зависимость от времени обусловлена медленным потенциал-зависимым переходом в неактивное состояние. После полного цикла все возвращается в состояние покоя. Относительная скорость переходов состояний (кинетика) указана на рисунке.
Описание к рис. 2.20 Регуляция входящего выпрямленного тока К* (lKi) в сердце. В канале один проход, таким образом, канал может быть только в одном из двух состояний. Реполяризация вызывает активное состояние. Продолжающийся ток К+ вызывает дальнейшую деполяризацию вследствие положительной обратной связи. Инактивации не происходит потому, что нет второго прохода, который бы закрывался после реполяризации. Однако внешний ток К+ уменьшается внутриклеточным Мд2+.
Другие ПЗК[править | править код]
В научной литературе по ионным каналам основное внимание уделяется катионным каналам (Na+, Са2+, К+), но существуют и потенциал-зависимые каналы для анионов, например Сl~. Сl~-каналы обнаруживаются как в периферической нервной системе, так и в центральной. Существуют и другие ионные каналы со своими особенными характеристиками, некоторые из которых неселективны в отношении одного определенного иона. Например, канал, ответственный за funny-токи (If) в сердце, открывает ток и Na+, и К+.
Транспортеры, симпортеры, антипортеры и насосы[править | править код]
Во всех клетках постоянно регулируются внутренние концентрации ионов, а также таких молекул, как сахара, нуклеиновые кислоты и аминокислоты. Их проход через клеточные мембраны происходит за счет молекул-переносчиков, независимых от энергии (транспортеры, симпортеры и антипортеры) и зависимых от энергии насосов. Все они представлены ориентированными белками, слабо связывающимися с одним или несколькими ионами или молекулами. Связывание изменяет конформацию белка, и он переходит из состояния покоя в активированное состояние. Изменение конформации переносит субстрат через мембрану. В насосах изменение конформации превращает белок в фермент, который в норме гидролизует АТФ (зависимость активности от энергии), а гидролиз АТФ необходим для насоса, чтобы перенести субстрат. Насосы и переносчики могут быть молекулярными мишенями для определенных лекарств. В книге для обозначения энергонезависимых переносчиков использованы особые значки (рис. 2.21) и насосов (рис. 2.22).
Описание к рис. 2.21 Значки, обозначающие энергонезависимый переносчик (транспортер, симпортер, антипортер), (а) Транспортер и симпортер (характеризуются ненаправленным транспортом) в неактивном состоянии. (6) Антипортер (характеризуется двусторонним транспортом) в активированном состоянии.
Энергонезависимые транспортеры, симпортеры и антипортеры[править | править код]
Энергонезависимыми переносчиками называют транспортеры (переносят один тип иона или молекулы в одном направлении), симпортеры (переносят два и более ионов или молекул в одном направлении) или антипортеры (замещают один или несколько ионов или молекул на другие). Примером антипортера является Nа+/Са2+-обменник, который в норме вытесняет ионы Са2+ из клетки в обмен на ионы Na+ (соотношение обмена — три Na+ на один Са2+). Не существует терапевтических средств, которые прямо воздействуют на эту мишень, хотя препараты наперстянки модулируют ее активность непрямым образом.
Энергозависимые насосы[править | править код]
Энергозависимые переносчики называют насосами. Они представляют собой ферменты, которые благодаря своей локализации и ориентации в клеточной мембране обладают способностью транслоцировать ионы и другие молекулы через центральную пору за счет последовательности конформационных изменений, которые происходят при ферментном гидролизе АТФ (другие ферменты, не обладающие этими свойствами, представляют другой класс молекулярных мишеней, описываемый далее).
Na+/K+ -зависимая аденозинтрифосфатаза представляет собой мембранный насос с четко установленными характеристиками
Действие этого насоса заключается в предотвращении накопления ионов Na+ в нервных и мышечных клетках и усилении потери К+, что, наоборот, происходит вследствие открытия и закрытия ионных каналов, генерирующих электрическую активность в этих клетках. Как только начинается накопление Na+, открывается Nа+-канал (потенциал действия), Nа+/К+-зависимая аденозинтрифосфатаза (АТФаза) переносит Na+ через мембрану во внеклеточную жидкость в обмен на ионы К+ из внеклеточной жидкости. Стехиометрия этого насоса характеризуется обменом двух Na+ на три К+, следовательно, этот насос является электрогенным. Энергия поставляется за счет гидролиза АТФ. Этот насос — молекулярная мишень для препаратов наперстянки.
Ферменты[править | править код]
В организме содержится большое количество ферментов, каждый из которых является потенциальной молекулярной мишенью для лекарств.
Лекарства могут либо имитировать натуральный субстрат фермента (связывание с субстратом активного центра фермента), либо связываться с аллостерическим центром. Обычно такое молекулярное действие приводит к снижению активности фермента. Значок, обозначающий фермент, показан на рис. 2.23.
Ингибирование фермента имеет характеристики, сходные с рецепторным антагонизмом
Лекарства, которые связываются с ферментом в связывающем центре, обычно являются конкурентными ингибиторами (по аналогии с конкурентными антагонистами — лекарствами, связывающимися с рецепторами конкурентным образом). Однако другие лекарства связываются в других центрах. Это может вести к подавлению фермента через аллостерические механизмы или посредством разрыва биохимической целостности фермента, что соответствует неконкурентоспособному и неконкурентному рецепторному антагонизму (см. далее).
Ацетилхолинэстераза — пример фермента, представляющего собой мишень для лекарств
Ацетилхолинэстераза — это фермент, отвечающий за деградацию нейромедиатора ацетилхолина. Ацетилхолинэстераза имеет субстрат-связывающий центр, состоящий из двух компонентов, один из которых присоединяется к эстеразной части ацетилхолина, а другой — к заряженной анионной части. При связывании с ферментом ацетилхолин подвергается гидролитической диссоциации на компоненты молекулы — холин и ацетат. Некоторые холиновые эфиры, схожие с ацетилхолином, могут связываться с обоими компонентами связывающего центра, а другие — только с одним. Тем самым они тормозят гидролиз ацетилхолина. Это конкурентное взаимодействие может быть обратимым либо необратимым в зависимости от ингибитора.
Фосфорорганические соединения (ФОС) ковалентно связывают ацетилхолинэстеразу в эстеразной части связывающего центра, что ведет к необратимому ингибированию. Эти соединения используют в качестве нервно-паралитических газов как химическое оружие и как инсектициды (они могут быть причиной случайных отравлений). Однако до ковалентного связывания ФОС есть фаза обратимого связывания. Препараты антидоты (например, пралидоксим) могут препятствовать ковалентному связыванию на протяжении обратимой фазы за счет конкуренции. Но если ковалентное связывание произошло, то их использование неэффективно.
Многие противоопухолевые препараты снижают активность ферментов, вовлеченных в синтез белка и нуклеиновых кислот
К противоопухолевым ингибиторам ферментов относятся:
- азатиоприн, 6-меркаптопурин и 6-тиогуанин, которые блокируют синтез рибонуклеотидов из пуринов;
- 5-фторурацил и метотрексат, которые блокируют синтез дезоксирибонуклеотидов и 2-дезокситимидилата;
- цитарабин, который тормозит ДНК-полимеразу и синтез РНК;
- доксорубицин, этопозид, амсакрин и дактиномицин, которые тормозят репликацию ДНК и транскрипцию РНК.
Нуклеиновые кислоты[править | править код]
Определенные типы противоопухолевых препаратов реализуют свои эффекты путем направленного действия на нуклеиновые кислоты, ДНК и РНК. Клеточный ответ (ингибирование синтеза ДНК или РНК) происходит за счет различных молекулярных механизмов, например:
- блеомицин повреждает ДНК и препятствует ее восстановлению;
- алкилирующие вещества, такие как митомицин и цисплатин, сшивают ДНК.
Структурные макромолекулы[править | править код]
Белки (рецепторы, каналы, симпортеры и др.) являются наиболее часто встречающимися молекулярными мишенями, действующими на клеточные мембраны. Но другие препараты нацелены на структурные макромолекулы, которые не связаны с компонентами трансдукции. Таким образом, по определению эти препараты влияют на клеточную функцию непрямым способом, изменяя структуру клетки. Более того, эти рецепторы состоят из повторяющейся последовательности химических единиц, необходимой для достижения эффекта насыщения эквивалентным количеством молекул лекарства. Типичную эффективную концентрацию для препаратов, действующих на структурные макромолекулы, измеряют в миллимолях; она в 10-1000 раз выше, чем для других типов лекарств. В клеточных мембранах (либо в плазменной мембране, либо во внутриклеточных мембранах, включая такие отграничивающие органеллы, как ядро и митохондрии) основной структурный компонент представлен двойным слоем фосфолипидов, окруженных гликопротеинами. К структурным компонентам также относится цитоскелет (мишень для противоопухолевых препаратов колхицина и винбластина).
Молекулярные мишени вне клеток[править | править код]
Некоторые препараты реализуют свой терапевтический эффект без прямого взаимодействия с клетками, например:
- комплексообразователи, которые действуют, связывая ионы (Fe2+, Fе3+ и Аl3+);
- сурфактанты, которые изменяют поверхностные свойства биологических жидкостей;
- некоторые препараты для лечения заболеваний пищеварения, связывающие вещества в кишечнике и изменяющие консистенцию и время пассажа содержимого желудочно-кишечного тракта, например активированного угля;
- осмотические диуретики;
- антациды.
Бактерии, вирусы, грибы и паразиты как мишени[править | править код]
При большинстве инфекций и инвазий терапевтические препараты действуют непосредственно на соответствующий организм (бактерию, вирус, гриб или паразит). Многообразные молекулярные механизмы действия таких препаратов в целом идентичны эффектам препаратов, воздействующих на ткани человека (модуляция рецепторов, ферментов), и детально обсуждаются в главе 6.
Механизмы действия лекарств на рецепторы, ионные каналы, переносчики и ферменты[править | править код]
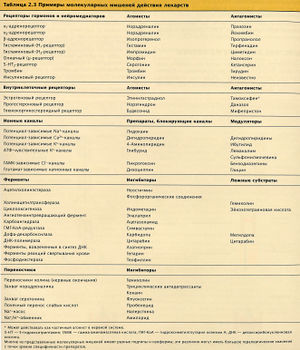
Механизмы действия лекарств на молекулярные мишени приведены на рис. 2.24. Примеры молекулярных мишеней перечислены в табл. 2.3.
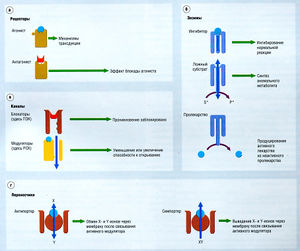
Описание к рис. 2.24 Основные молекулярные цели при действии лекарств. Действия могут быть разделены на четыре класса, (а) Агонисты могут связываться с рецептором и инициировать изменение механизмов трансдукции, что приводит к разным клеточным эффектам. Антагонисты связываются с рецептором, блокируя эффекты агонистов, (б) Лекарства могут блокировать переход веществ через каналы или присоединяться к компонентам канальцевых белков, модулируя открытие ионного канала, (в) Лекарства могут прямо взаимодействовать с ферментами посредством различных механизмов, (г) Препараты могут связываться для обмена белков (антипортеры), перемещая ионы через мембрану. Направление тока ионов соответствует направлению стрелки. Здесь транспортеры показаны в активированном состоянии, но следует учесть, что некоторые транспортеры активны в состоянии покоя и заблокированы препаратами. S* и Р* — ложные субстрат и продукт соответственно; X и Y — ионы, которые могут иметь положительный или отрицательный заряд; ПЗК — потенциалзависимый канал; РСК — рецептор-связанный канал.