Снотворные средства
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Транквилизаторы и снотворные
Самые разнообразные вещества способны угнетать ЦНС, вызывая успокоение и сонливость. Эффект транквилизаторов и снотворных первых поколении зависит от дозы: последовательно возникают заторможенность, сон, потеря сознания, общая анестезия, кома и, в итоге, ведущее к смерти угнетение дыхания и кровообращения. В настоящей статье описаны бензодиазепины, барбитураты и препараты иных химических групп (паральдегид, хлоралгидрат и др.). Ингаляционные анестетики обсуждаются в ст.Ингаляционные анестетики
Бензодиазепины лишь изредка вызывают глубокое, угрожающее жизни угнетение ЦНС. Очень высокие дозы могут вести к коме, но общая анестезия на фоне одних лишь бензодиазепинов не наступает; в отсутствие других препаратов. оказывающих тормозящее действие на ЦНС, смертельное угнетение дыхания и кровообращения также почти невозможно. Благодаря этому бензодиазепины и их новые аналоги почти вытеснили прежние средства для лечения бессонницы и тревожности.
Одни из препаратов, особенно бензодиазепины, используют во время диагностических и хирургических вмешательств и перед ними для достижения седативного эффекта и амнезии; другие, прежде всего барбитураты, применяют в высоких дозах для вводной анестезии и поддержания общей анестезии). Отдельные барбитураты и бензодиазепины назначают в качестве противосудорожных средств, некоторые из бензодиазепинов используют как миорелаксанты. Применение бензодиазепинов и других препаратов при тревожных расстройствах обсуждается в Препараты для лечения тревожных состояний.
Угнетение ЦНС вызывают также ациклические спирты, в первую очередь этанол, по действию близкий к небензодиазепиновым транквилизаторам и снотворным. Впрочем, для лечения бессонницы он подходит плохо и часто приносит больше вреда, чем пользы. Злоупотреблению этанолом и другими веществами, угнетающими ЦНС, посвящена Лекарственная зависимость.
Транквилизаторы вызывают успокоение, уменьшение возбуждения и активности (седативный эффект), снотворные же — сонливость, облегчая наступление и поддержание сна, который близок к нормальному по электроэнцефалографическим характеристикам и может быть легко прерван. Указанный эффект иногда называют гипнотическим, хотя такой сон отличается от гипноза — искусственно вызываемого состояния внушаемости.
Небензодиазепиновые транквилизаторы и снотворные вызывают дозозависимое угнетение ЦНС: последовательно развиваются успокоение и сонливость (седативный эффект), сон (снотворный эффект), утрата сознания, кома, общая анестезия и смертельное угнетение дыхания и кровообращения. Аналогичными свойствами обладают многие вещества, включая общие анестетики и ациклические спирты, в первую очередь этанол Алкоголь: вред, действие на организм. В этом непрерывном спектре действия можно выделить лишь два четко очерченных состояния: общую анестезию (состояние, при котором болевые раздражители не вызывают поведенческих и вегетативных реакций) и смерть, наступающую в результате глубокого угнетения нейронов дыхательного и сердечно-сосудистого центров. Состояния, наступающие при меньших концентрациях этих препаратов, определяются с меньшей точностью; в качестве критериев таких состояний используют нарушения когнитивных функций (включая сосредоточение внимания на внешних раздражителях) и двигательной активности (например, атаксию) либо силу раздражителя, вызывающего какой-либо рефлекс или поведенческую реакцию. Обезболивающий и противосудорожный эффекты не всегда занимают определенное место в указанной последовательности: одни препараты (например, барбитураты) вызывают их лишь в дозе, при которой возникает общая анестезия, другие (например, наркотические анальгетики, фенитоин и этосуксимид) — в таких малых дозах, при которых седативный эффект или другие признаки угнетения ЦНС минимальны.
Побочный седативный эффект оказывают многие препараты, не предназначенные для угнетения ЦНС (например, Н1-блокаторы и нейролептики). Хотя такие препараты могут усилить действие транквилизаторов и снотворных, их основной эффект обычно проявляется при концентрациях, недостаточных для заметного угнетения ЦНС. Например, на фоне одних лишь этих препаратов общая анестезия недостижима. Такое свойство присуще и бензодиазепинам: хотя в очень высоких дозах они способны вызвать кому, общая анестезия и смертельное отравление могут наступить только на фоне других веществ, угнетающих ЦНС. Еще одна особенность бензодиазепинов заключается в том, что существуют препараты, устраняющие их действие, но не оказывающие существенного эффекта в их отсутствие. Эти свойства выделяют бензодиазепины среди других транквилизаторов и снотворных, и благодаря высокой безопасности они почти вытеснили другие средства при лечении бессонницы и тревожности.
Историческая справка. С древних времен при бессоннице использовали спиртные напитки и настойки опия и различных трав. Первыми препаратами, примененными в качестве транквилизаторов, а вскоре и снотворных, стали бромиды (середина XIX века). Затем появились хлоралгидрат, паральдегид, уретан и сульфонал, вслед за ними — барбитал и фенобарбитал (в 1903 и 1912 гг.). Успех последних привел к синтезу и испытанию более 2500 барбитуратов, из которых около 50 поступили в продажу. Популярность барбитуратов была столь велика, что до 1960 г. в употребление вошел лишь десяток других транквилизаторов и снотворных.
Отделение седативных, снотворных и анестезирующих свойств фенобарбитала от противосудорожных привело к поиску веществ, более избирательно влияющих на ЦНС. В конце 1930-х начале 1940-х гг. были найдены противосудорожные средства с минимальной седативной активностью, прежде всего фенитоин и триметадион). В начале 1950-х гг. появились хлорпромазин и мепробамат и был обнаружен их приручающий эффект у животных. Эго привело к разработке все более сложных поведенческих моделей, и в результате был получен хлордиазепоксид — в 1954 г. его синтезировал Штернбах, а затем Рэндалл описал его уникальные свойства (Symposium, 1982). С 1961 г. этот препарат вошел в клиническую практику, и началась эпоха бензодиазепинов. Большинство из них были отобраны из-за высокой анксиолитической активности при ограниченном угнетении ЦНС. Впрочем, все бензодиазепины обладают более или менее выраженными седативными и снотворными свойствами, которые широко используются на практике, прежде всего при лечении бессонницы.
В 1990-х гт. выяснилось, что все бензодиазепины усиливают действие ГАМ К, основного тормозного медиатора, на ГАМКд-рецепторы — хемочувствительные хлорные каналы, состоящие их нескольких субъединиц. Бензодиазепины увеличивают вызываемый ГАМ К. ионный ток через эти каналы. В фармакологических исследованиях было выявлено разнообразие бензодиазепиновых рецепторов, а работы в области биохимии и молекулярной биологии показали, что в разных нейронах ГАМКд-рецепторы образованы разными субъединицами. Поскольку эффект бензодиазепинов и других аллостерических регуляторов проницаемости каналов, видимо, зависит от набора образующих эти каналы субъединиц, начался поиск препаратов, способных избирательно действовать на отдельные подтипы ГАМКА-рецепторов. Предполагалось, что это позволило бы получить средства с относительным преобладанием тех или иных из присущих бензодиазепинам свойств. Одним из таких препаратов стал золпидем — производное имидазопиридина. Его седативный и снотворный эффекты объясняют взаимодействием с определенными подтипами ГАМКА-рецепторов. Избирательностью в отношении некоторых подтипов ГАМКд-рецепторов обладает и производное пиразолопиримидина залеплон. Изучаются соединения и других химических классов.
Бензодиазепины
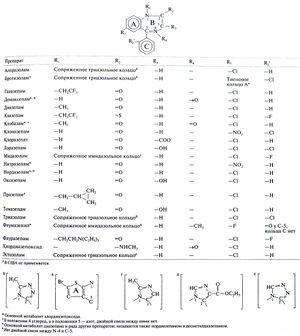
Основные эффекты всех бензодиазепинов одинаковы. В то же время выраженность тех или иных эффектов и фармакокинетические свойства у разных бензодиазепинов различны, и это часто определяет выбор препарата. Есть основания полагать, что в седативный, снотворный, миорелаксирующий, анксиолитический и противосудорожный эффекты вносят различный вклад разные механизмы действия бензодиазепинов. По последним данным, отдельные эффекты этих препаратов связаны с действием на определенные субъединицы ГАМКА-рецепторов. Мы подробно остановимся лишь на бензодиазепинах, применяемых главным образом как снотворные, но опишем также общие свойства этой группы и важные различия между отдельными препаратами (см. также гл. 19 и 21). Химические свойства. Формулы бензодиазепинов и ряда сходных веществ приведены в табл. 17.1. Термин бензодиазепин относится к бензольному кольцу (кольцо А), соединенному с семичленным диазепиновым кольцом (кольцо В). Поскольку все применяемые препараты этой группы содержат 1,4-диазепиновое кольцо В и ароматический заместитель (кольцо С) у С-5, бензодиазепинами в узком смысле слова называют 5-арил-1,4-бен-зодиазепины. Модификация бензодиазепинового ядра позволила получить вещества со сходной активностью: 1,5-бензодиазепины (клобазам) и продукты замены бензольного кольца А на гетероциклы, в частности натиофен (бротизолам). Заместители у N-1 и С-3 могут быть самыми разными; получены также бензодиазепины с триазольным или имидазольным кольцом, присоединенным к N-1 и С-2. Кетогруппа при С-5 вместо кольца С и метильная группа у N-4 — важные структурные особенности флумазенила, блокатора бензодиазепиновых рецепторов (Нае-fely, 1983).
Кроме указанных препаратов синтезировано большое количество веществ другой структуры, конкурирующих с бензодиа-зепинами и флумазенилом за участки связывания в ЦНС (Gardner et al., 1993). В молекулах этих соединений могут находиться конденсированные кольца индола и пиридина (β-карболины), а также имидазопиридиновые (золпидем), имидазопиримиди-новые, имидазохинолоновые и циклопирролоновые (зопиклон) структуры.
Фармакологические свойства
Почти все эффекты бензодиазепинов связаны с влиянием на ЦНС: в первую очередь это седативное, снотворное, противосудорожное, анксиолитическое, миорелаксирующее действие и антероградная амнезия. Лишь два эффекта, по-видимому, обусловлены действием на периферические ткани: расширение коронарных артерий (при в/в введении обычных доз некоторых бензодиазепинов) и блокада нервно-мышечного проведения (на фоне очень высоких доз).
По активности in vivo и in vitro выделяют полные агонисты (стимуляторы) бензодиазепиновых рецепторов (они оказывают выраженный эффект, занимая небольшое число рецепторов), например диазепам, и частичные агонисты (их максимальный эффект менее выражен или требует активации большего числа рецепторов). Некоторые вещества — обратные агонисты — в отсутствие стимуляторов оказывают действие, обратное таковому диазепама; описаны также частичные обратные агонисты Большинство эффектов агонистов и обратных агонистов устраняет или предотвращает флумазенил — блокатор бензодиазепиновых рецепторов, конкурирующий за них с бензодиазепинами. Сходным образом действуют и некоторые другие препараты.
ЦНС. Бензодиазепины влияют на активность всех отделов ЦНС, но одни затрагиваются в большей степени,чем другие. Эти препараты не способны вызвать такое глубокое угнетение ЦНС, как барбитураты и ингаляционные анестетики. Бензодиазепины очень близки по фармакологическим свойствам, но различаются по избирательности действия, что существенно влияет на показания к отдельным препаратам.
С увеличением дозы бензодиазепинов на смену седативному действию приходят сон и далее сопор. Нередко пишут об анестезирующем эффекте некоторых бензодиазепинов, но истинной общей анестезии не наступает, поскольку сознание обычно сохраняется и не достигается достаточного для операции расслабления мышц. Однако высокие дозы вызывают антероградную амнезию, что может создать иллюзию анестезии.
Новые данные о молекулярных основах разнообразия бензодиазепиновых рецепторов (см. ниже) привели к попыткам отделить анксиолитический эффект от седативного и снотворного. Однако эта задача оказалась непростой, так как количественно оценить тревожность и седативный эффект у человека сложно, а надежность экспериментальных моделей на животных не известна. Существование множества бензодиазепиновых рецепторов отчасти объясняет видовые различия в эффектах бензодиазепинов.
Модели тревожности у животных. В экспериментах на животных основное внимание уделяли способности бензодиазепинов повышать активность (подвижность, пищевое и питьевое поведение), подавляемую новыми или неприятными раздражителями. Для этого поведение животных, ранее вознаграждавшееся пищей или водой, периодически наказывалось ударом тока. Удар предварялся зрительным или звуковым сигналом, и животные, не получавшие бензодиазепинов, в ответ на этот сигнал почти полностью прекращали активность. Бензодиазепины устраняли различие в активности животных на фоне ударов тока и в их отсутствие, причем применяемые дозы, как правило, не влияли на активность в отсутствие ударов тока и не вызывали двигательных нарушений. В других моделях незнакомая обстановка резко снижала поисковую активность у крыс, и бензодиазепины устраняли этот эффект. Наркотические анальгетики и нейролептики не вызывают подобного растормаживания, а фенобарбитал и мепробамат делают это лишь вдозах, угнетающих спонтанную активность или ведущих к атаксии.
Различия между дозами бензодиазепинов, вызывающими двигательные нарушения и растормаживание, сильно зависят от препарата, вида животного и схемы опыта. Хотя эти различия могли способствовать продвижению на рынок некоторых бензодиазепинов в качестве избирательных транквилизаторов и снотворных средств, они не позволили предсказать седативную активность бензодиазепинов, нашедших применение в качестве анксиолитических препаратов.
Толерантность. Говоря о различии между растормаживанием и седативным и атаксическим действием бензодиазепинов, часто ссылаются на данные о толерантности у животных. Так, толерантность к угнетающему влиянию на спонтанную и вознаграждаемую активность наступает через несколько дней; растормаживающее же действие вначале нарастает, а ослабевает через 3-4 нед (File, 1985). У большинства людей, длительно принимающих бензодиазепины, сонливость исчезает в течение нескольких дней, но толерантность к ряду проявлений психомоторной заторможенности (например, при тесте реакции на движущийся объект) обычно не наблюдается. Толерантность к анксиолитическому действию остается спорной (Lader and File, 1987). Многие больные способны обходиться без существенного изменения дозы, и ее снижения и повышения, очевидно, отражают колебания эмоциональной нагрузки. Однако некоторые больные не снижают дозу по окончании стресса или постоянно наращивают ее, что, по-видимому, говорит о зависимости (Woods et al., 1987; DuPont, 1988).
Некоторые бензодиазепины снижают мышечный тонус, не влияя на двигательную активность, и могут ослаблять ригидность при центральных параличах. Однако у человека (в отличие от животных) их избирательность ограничена. Клоназепам оказывает миорелаксирующее действие в дозах, недостаточных для седативного эффекта, — в отличие от диазепама и большинства его аналогов. К миорелаксирующему и атаксическому действию бензодиазепинов развивается толерантность.
Бензодиазепины подавляют эпилептические припадки, вызванные пентетразолом и пикротоксином, но судороги, вызванные стрихнином и током высокого напряжения, предотвращаются лишь в дозах, резко нарушающих двигательную активность. У клоназепама, нитразепама и нордазепама противосудорожная активность более избирательна, чем у других препаратов. Бензодиазепины подавляют также фотогенные припадки у павианов и припадки при алкогольном абстинентном синдроме у людей. К сожалению, толерантность к противосудорожному действию ограничивает применение бензодиазепинов при эпилепсии (гл. 21).
Бензодиазепины оказывают обезболивающее действие у животных, но у человека отмечен лишь преходящий обезболивающий эффект при в/в введении этих препаратов, который в действительности может быть обусловлен амнезией. Несомненно, однако, что бензодиазепины, в отличие от барбитуратов, не вызывают гипералгезию.
Влияние на ЭЭГ и структуру сна. По действию на ЭЭГ в состоянии бодрствования бензодиазепины напоминают другие транквилизаторы и снотворные: снижается доля a-ритма, а доля быстрого низкоамплитудного ритма возрастает. К этим эффектам развивается толерантность.
Большинство бензодиазепинов ускоряют засыпание (особенно при первом использовании), уменьшают число и длительность пробуждений. Обычно сокращается I стадия (поверхностный сон), резко укорачиваются III и IV стадии (глубокий мед ленный сон). Большинство препаратов сокращают время от появления сонных веретен до начала быстрого сна (V стадии). Уменьшается и общая продолжительность быстрого сна, но возрастает число его периодов, главным образом под конец сна. Золпидем подавляет быстрый сон в меньшей мере, благодаря чему может иметь преимущество перед бензодиазепинами в качестве снотворного (Dujardin et al., 1998).
Несмотря на укорочение быстрого сна и IV стадии медленного сна, обычно бензодиазепины увеличивают общее время сна, главным образом за счет удлинения II стадии (основной составляющей медленного сна). Этот эффект тем выраженнее, чем короче был сон до назначения бензодиазепинов. Кроме того, несмотря на учащение периодов быстрого сна, снижаются частота переходов к I стадии, частота пробуждений и число движений во сне. Ночные пики концентрации СТГ, пролактина и ЛГ не меняются. При регулярном приеме бензодиазепинов на ночь их влияние на структуру сна обычно сглаживается через несколько дней. После отмены препарата возможен рикошетный эффект, особенно выраженным бывает увеличение доли и общей продолжительности быстрого сна. Впрочем, если доза была не слишком велика, больной отмечает лишь укорочение сна, но не усугубление бессонницы.
Хотя отмечены некоторые различия в действии бензодиазепинов на структуру сна, все они обычно приносят ощущение глубокого освежающего сна. Не ясно, влиянием на какой показатель структуры сна оно обусловлено. В результате преимущества отдельных препаратов в качестве снотворных определяются главным образом их фармакокинетикой, а не возможными различиями в фармакодинамике.
Механизм действия. Большинство эффектов бензодиазепинов связывают с действием на рецепторы тормозного медиатора ГАМК. Эти мембранные рецепторы подразделяют на два основных типа: ГАМКа и ГАМКв. ГАМКд-рецепторы — это хемочувствительные хлорные каналы, образованные пятью субъединицами, пронизывающими клеточную мембрану. Эти рецепторы опосредуют большую часть тормозных сигналов в ЦНС. ГАМ Кв-рецепторы сопряжены с G-белками; они состоят из единственного белка с семью трансмембранными доменами. Бензодиазепины действуют только на ГАМКд-рецепторы соединяясь с особым участком рецептора, отличным oт участка связывания ГАМК. В отличие от барбитуратов сами они не активируют рецептор и требуют присутствия ГАМК, то есть лишь модулируют ее действие. Бензодиазепины и аналоги ГАМК связываются с рецепторами в наномолярных концентрациях и действуют как аллостерические регуляторы связывания друг друга. Лиганды бензодиазепиновых рецепторов могут действовать как стимуляторы, обратные агонисты и блокаторы: первые увеличивают, а вторые уменьшают хлорный ток, возникающий в ответ на активацию ГАМКА-рецепторов. В первом случае кривая зависимости эффекта от концентрации ГАМК сдвигается влево, а во втором — вправо. Блокаторы бензодиазепиновых рецепторов устраняют оба этих эффекта, но в отсутствие стимулятора и обратного агониста не оказывают никакого эффекта. Одно из таких веществ, флумазенил, используется как антидот при передозировке бензодиазепинов. Кроме того, поведенческие и электрофизиологические эффекты бензодиазепинов могут быть ослаблены или устранены предварительным введением блокаторов ГАМКд-рецепторов (например, бикукуллина).
Данные, полученные при клонировании кДН К субъединиц ГАМКд-рецепторов, подтверждают прямое влияние бензодиазепинов на эти рецепторы (Schofield et al., 1987; Pritchett et al., 1989). При экспрессии in vitro ГАМКд-рецепторов, образованных из соответствующих субъединиц (см. ниже), выявляются участки связывания с высоким сродством к бензодиазепинами регистрируется хлорный ток, активируемый ГАМ К и усиливаемый бензодиазепинами. Такие рецепторы по свойствам близки к своим естественным аналогам в нейронах ЦНС. ГАМКд-рецептор включает 5 гомологичных субъединиц. На сегодня описано 16 вариантов субъединиц, объединенных в 7 семейств: 6 а-субъединиц, по 3 β- и у-субъединицы и по одной 5-, е-, и- и 0-субъединице. Кроме того, возможен альтернативный сплайсинг РНК некоторых из них (у2 и а6). Точный состав ГАМКд-рецепторов пока не известен, считается, что большинство из них включает а-, Щ и у-субъединицы, которые могут находиться в разных соотношениях. Разнообразие субъединиц ведет к неоднородности ГАМКд-рецепторов, что, по крайней мере отчасти, объясняет различия в фармакологических свойствах бензодиазепиновых рецепторов, выявляемые в поведенческих, биохимических и функциональных исследованиях. Изучение клонированных ГАМКд-рецепторов показало, что присоединение у-субъединицы к а- и β-субъединицам придает рецептору чувствительность к бензодиазепинам (Pritchett et al., 1989). Рецепторы из одних а- и р-субъединиц функционируют и реагируют на барбитураты, но не связывают бензодиазепины и не реагируют на них. Предполагается, что бензодиазепиновый рецептор лежит на стыке а- и р-субъединиц и обе они влияют на его свойства (McKeman et al., 1995). Так, рецепторы с а1-субъединицей отличаются по свойствам от рецепторов с а2-, а3- и аз-субъединицами (Pritchett and Seeburg, 1990), что согласуется с данными о неоднородности ГАМКд-рецепторов, полученными при изучении связывания меченых лигандов с мембранами нейронов. Рецепторы с а6-субъединицей обладают низким сродством к диазепаму, но избирательны в отношении обратного агониста RO-15-4513, который испытывался как антидот этанола (Liiddens et al., 1990). Тип у-субъединицы также влияет на свойства бензодиазепиновых рецепторов: у1-субъединица снижает сродство к бензодиазепинам (McKeman et al., 1995). Теоретически разные субъединицы могут образовывать сотни тысяч ГАМКА-рецепторов, но ввиду особенностей сборки число рецепторов ограничено (Sieghart et al., 1999).
Новые работы проливают свет на значение отдельных субъединиц ГАМКд-рецепторов для тех или иных эффектов бензодиазепинов in vivo. После замены в а1-субъединице Гис101 на аргинин диазепам утрачивает способность усиливать действие ГАМК на рецептор (Kleingoor et al., 1993). У мышей с такими субъединицами теряется седативное, амнестическое и отчасти противосудорожное действие диазепама, но сохраняются его анксиолитические, миорелаксирующие свойства и способность усиливать эффект этанола (Rudolph et al., 1999; McKeman et al.,2000). Аналогичная замена в а2-субъединице нарушает у мышей анксиолитическое действие диазепама (Low et al., 2000). Выявление связи поведенческих эффектов бензодиазепинов с теми или иными субъединицами поможет разработать препараты с меньшим числом побочных действий. Так, соединение L-838 417 усиливает действие ГАМК на рецепторы, состоящие из а2-, а3-или а5-субъединиц, но не влияет на рецепторы с а1-субъединицей; в результате оно оказывает анксиолитический эффект в отсутствие седативного (McKeman et al., 2000).
Субъединицы ГАМКд-рецепторов могут отвечать и за нормальную локализацию собранных рецепторов в синапсах. У мышей без у2-субъединицы эта локализация нарушалась, хотя происходила сборка рецепторов и их перенос на клеточную мембрану (Essrich etal., 1998). Распределение рецепторов регулирует также белок гефирин.
ГАМКрецепторы и эффекты бензодиазепинов. Высокая безопасность бензодиазепинов объясняется, по-видимому, зависимостью их эффектов от наличия ГАМК в синаптической щели: в ее отсутствие бензодиазепины не влияют на ГАМКд-рецепторы. Барбитураты в низких дозах также усиливают действие ГАМК, но в высоких напрямую активируют эти рецепторы, вызывая глубокое угнетение ЦНС (см. ниже). Растормаживающее и седативное действие бензодиазепинов может быть сопряжено с потенцирующим влиянием на ГАМКергические пути, регулирующие активность моноаминергических нейронов. Эй нейроны отвечают за общую активацию и служат важными посредниками тормозного действия страха и наказания на поведение. Миорелаксирующий и противосудорожный эффекты связывают с усилением тормозного влияния ГАМКергических нейронных контуров в различных отделах ЦНС. В большинстве исследований in vivo и in situ местное и системное введение бензодиазепинов снижало спонтанную и индуцированную электрическую активность главных (крупных) нейронов всех отделов головного и спинного мозга. Эту активность регулируют, в частности, мелкие тормозные вставочные нейроны, в основном ГАМКергические, путем прямого и возвратного торможения. Выраженность эффектов бензодиазепинов может колебаться в широких пределах в зависимости от типа тормозных нейронных контуров, источника и силы возбуждающего сигнала, а также условий эксперимента и методов оценки. Так, контуры возвратного торможения часто включают мощные тормозные синапсы на теле нейрона рядом с аксонным холмиком. Действуя на рецепторы в области этих синапсов, ГAM К (будь то выделившаяся из пресинаптических окончаний или искусственно апплицированная) повышает хлорную проницаемость; это вызывает шунтирование деполяризующих токов и затрудняет генерацию потенциала действия. Бензодиазепины существенно увеличивают период после короткой активации возвратных ГАМКергических волокон, в течение которого ни естественные, ни искусственные возбуждающие стимулы не могут вызвать потенциал действия; этот эффект устраняет блокатор ГАМКд-рецепторов бикукуллин.
В исследованиях in vitro показано, что бензодиазепины усиливают хлорный ток за счет повышения частоты вспышек открывания одиночных каналов под действием субмаксимальной концентрации ГАМК (Twyman et al., 1989). В терапевтических концентрациях они потенцируют постсинаптическое торможение, снижая тем самым реакцию на раздражение афферентных волокон. Наблюдается также удлинение спонтанных миниатюрных ТПСП. Барбитураты также усиливают хлорный ток, но за счет повышения времени пребывания одиночных каналов в открытом состоянии. Бензодиазепины смещают влево кривую зависимости эффекта (то есть хлорного тока) от концентрации
ГАМК, но не увеличивают максимальный ток. Вместе с данными работ in vivo это укладывается в гипотезу, согласно которой действие бензодиазепинов обусловлено потенцированием действия ГАМК на ГАМКд-рецепторы. Как говорилось выше, ряд экспериментальных бензодиазепинов и сходных веществ действуют как обратные агонисты бензодиазепиновых рецепторов: они уменьшают вызываемый ГАМК хлорный ток, приводя к эпилептическим припадкам и другим эффектам, обратным таковым типичных бензодиазепинов (Gardner, 1988; Gardner et al., 1993). Отдельные вещества, в первую очередь флумазенил, блокируют эффекты тех и других in vitro и in vivo, но сами не оказывают какого-либо действия. Новые данные, полученные в молекулярных исследованиях, подтвердили гипотезу о ГАМКд-рецепторах как основной мишени бензодиазепинов. Более того, разнообразие этих рецепторов позволяет объяснить многие наблюдения, казалось, противоречившие ей (De Lorey and Olsen, 1992; Doble and Martin, 1992; Sieghart, 1992; Ragan et al., 1993; Symposium, 1992). Все же некоторые эффекты бензодиазепинов сложно связать с действием на ГАМКд-рецепторы. Так, низкие концентрации бензодиазепинов вызывают торможение нейронов гиппокампа, не устраняемое бикукуллином и пикротоксином (Pole, 1988). Кроме того, эти вещества не влияют на снотворное действие бензодиазепинов у крыс, хотя его предотвращает флумазенил (Mendelson, 1992). При высоких концентрациях, используемых д ля премедикации перед общей анестезией (гл. 14) и для купирования эпилептического статуса (гл. 21), действие бензодиазепинов может иметь дополнительные механизмы. К ним относятся нарушение обратного захвата аденозина с усилением эффектов этого тормозного медиатора (Phillis and O’Regan, 1988), а также не связанные с ГАМК торможение тока Са2+, нарушение зависимого от Са2+ выброса медиаторов и блокада быстрых натриевых каналов (Macdonald and McLean, 1986).
ГАМКд-рецепторы могут быть также точкой приложения общих анестетиков, этанола, ингаляционных наркотиков и некоторых метаболитов эндогенных стероидов (Mehta and Ticku, 1999; Beckstead et al., 2000). Особый интерес среди последних представляет метаболит прогестерона прегнанолон (За-гидрокси-5а-дигидропрогестерон). Он образуется в головном мозге из стероидов, поступающих с кровью или выделяемых глией, и действует подобно барбитуратам, в том числе усиливает вызываемый ГАМК хлорный ток и способствует связыванию бензодиазепинов и стимуляторов ГАМК-рецепторов. Как и барбитураты, в высоких концентрациях прегнанолон вызывает хлорный ток и в отсутствие ГАМК. Опыты с трансфекцией клеток показали, что его действие не требует у-субъединиц ГАМКА-рецептора. Впрочем, в отличие от барбитуратов, он не ослабляет возбуждающее действие глутамата (см. ниже). Эти эффекты возникают очень быстро и, по-видимому, обусловлены действием на уровне мембранных рецепторов. Аналог прегнанолона альфаксалон ранее использовался за пределами США в качестве анестетика.
Дыхательная система. Снотворные дозы бензодиазепинов в норме не влияют на дыхание, но все же следует соблюдать особую осторожность, назначая эти препараты детям (Kriel et al., 2000) и при нарушении функции печени, например на фоне алкоголизма (Guglielminotti et al.,1999). В более высоких дозах, вводимых для премедикации перед обшей анестезией или эндоскопией, бензодиазепины несколько снижают альвеолярную вентиляцию и вызывают дыхательный ацидоз, что связано, видимо, с подавлением вентиляторной реакции на гипоксию, а не на гиперкапнию. На фоне X03JI этот эффект усиливается и могут развиться альвеолярная гипоксия и наркотическое действие С02. Бензодиазепины способны вызвать апноэ лишь в сочетании с общими анестетиками или наркотическими анальгетиками, поэтому при тяжелом отравлении показанием к ИВЛ обычно служит лишь одновременный прием других веществ, угнетающих ЦНС (чаще всего этанола).
В то же время снотворные дозы бензодиазепинов могут усугублять нарушения дыхания во сне за счет падения тонуса мышц глотки и гортани и ослабления реакции дыхательного центра на гиперкапнию (Guilleminault в Symposium, 1990b). Последнего эффекта бывает достаточно, чтобы вызвать гиповентиляцию и гипоксию при тяжелых ХОЗЛ, хотя иногда у таких больных бензодиазепины улучшают сон и его структуру. Снижая тонус мышц глотки и гортани, снотворные дозы бензодиазепинов могут усугубить влияние обструктивных апноэ во сне на альвеолярную гипоксию, легочную гипертензию и нагрузку на сердце. Многие врачи считают обструктивные апноэ во сне противопоказанием к алкоголю и любым транквилизаторам и снотворным, включая бензодиазепины; их надо назначать с осторожностью и при храпе из-за риска перевести частичную обструкцию дыхательных путей в обструктивные апноэ во сне. Кроме того, в восстановительном периоде после инфаркта миокарда эти препараты могут способствовать появлению эпизодов апноэ во время быстрого сна, сопровождаемых снижением оксигенации крови (Guilleminault в Symposium, 1990b); впрочем, влияние бензодиазепинов на выживаемость при болезнях сердца не изучалось.
Сердечно-сосудистая система. В обычных дозах и у здоровых людей бензодиазепины мало влияют на сердечнососудистую систему; их побочные эффекты при апноэ во сне и болезнях сердца описаны выше. В высоких дозах все бензодиазепины снижают АД и повышают ЧСС. В случае мидазолама это обусловлено снижением ОПСС, а в случае диазепама — уменьшением сократимости левого желудочка и работы сердца. Диазепам увеличивает коронарный кровоток, возможно, за счет накопления аденозина в интерстициальной ткани; поскольку аденозин угнетает сократимость, этот эффект может объяснять отрицательное инотропное действие диазепама. В высоких дозах мидазолам существенно снижает мозговой кровоток и экстракцию кислорода головным мозгом (Nugent et al., 1982). ЖКТ. Некоторые гастроэнтерологи считают, что бензодиазепины помогают при ряде болезней ЖКТ с психосоматическим компонентом, однако доказательств этого недостаточно. Бензодиазепины снижают риск стрессовых язв у крыс, а диазепам существенно снижает ночную желудочную секрецию у людей.
Фармакокинетика. Физико-химические свойства и фармакокинетика бензодиазепинов существенно влияют на их клиническое применение. В неионизированной форме все они достаточно липофильны, но степень их липофильности различается более чем в 50 раз в зависимости от полярности и электроотрицательности заместителей.
Все бензодиазепины почти полностью всасываются после приема внутрь (клоразепат — в виде нордазепама, или десметилдиазепама, в который он быстро превращается путем декарбоксилирования в кислой среде желудка). Некоторые препараты (празепам и флуразепам) попадают в системный кровоток лишь в виде активных метаболитов.
По длительности действия выделяют препараты: 1) сверхкороткого действия, 2) короткого действия (Т1/2 < 6 ч), к которым относятся триазолам и небензоди-азепиновые препараты золпидем (Т1/2 около 2 ч) и зопиклон (Т1/2 5—6 ч), 3) средней продолжительности действия (Т1/2 6—24 ч), к которым относятся эстазолам и темазепам, 4) длительного действия (Т1/2 > 24 ч), к которым относятся флуразепам, диазепам и квазепам.
Бензодиазепины и их активные метаболиты связываются с белками плазмы. Степень связывания существенно зависит от липофильности и колеблется от 70% для алпразолама почти до 99% для диазепама. Концентрация свободных бензодиазепинов в СМЖ примерно такая же, как в плазме. Бензодиазепины могут конкурировать за белки плазмы с другими препаратами, но клинически значимых взаимодействий не описано.
Изменение сывороточной концентрации большинства бензодиазепинов описывают двухкамерные фармакокинетические модели (гл. 1); для наиболее липофильных препаратов лучше подходят трехкамерные модели. После в/в введения (или приема внутрь для препаратов с быстрым всасыванием) бензодиазепины быстро накапливаются в головном мозге и других хорошо кровоснабжаемых органах, затем происходит перераспределение в ткани с меньшим кровоснабжением, особенно в мышечную и жировую. Чем выше липофильность препарата, тем быстрее идет этот процесс. Если препараты принимаются на ночь для нормализации сна, то скорость перераспределения может иметь большее значение для длительности действия, чем скорость метаболизма (Dettli в Symposium, 1986а). Кинетику перераспределения диазепама и других высоко липофильных препаратов усложняет кишечнопеченочный кругооборот. Бензодиазепины имеют большой объем распределения, у пожилых он часто бывает увеличен (Swift and Stevenson в Symposium, 1983). Бензодиазепины проникают через плаценту и в молоко.
Метаболизм бензодиазепинов включает 3 основных этапа. Эти этапы, а также взаимоотношения между разными бензодиазепинами и их метаболитами представлены в табл. 17.2. В метаболизме многих бензодиазепинов участвует цитохром Р450, в частности изоферменты IIIA4 и IIC9. Эритромицин, кларитромицин, ритонавир, итра-коназол, кетоконазол, нефазодон и грейпфрутовый сок ингибируют изофермент 1IIA4 и могут нарушать метаболизм таких бензодиазепинов (Dresser et al., 2000). Другие бензодиазепины, например оксазепам, сразу подвергаются конъюгации (Tanaka, 1999). Поскольку активные метаболиты некоторых бензодиазепинов разрушаются медленнее, чем исходные вещества, длительность действия таких препаратов мало связана с Т|/2 исходного соединения. Например, Т1/2 флуразепама составляет 2—3 ч, а его основного активного метаболита (N-дезалкилфлуразепама) — более 50 ч. В то же время у препаратов, которые инактивируются в первой же реакции метаболизма, не образуя активных производных (оксазепама, лоразепама, темазепама, триазолама и мидазолама), длительность действия определяется Т1/2.
У бензодиазепинов с заместителем у N-1 (или С-2) первый и самый быстрый этап метаболизма состоит в модификации или отщеплении этого заместителя. За исключением триазолама, алпразолама, эстазолама и мидазолама, содержащих дополнительное триазольное или имидазольное кольцо, на первом этапе образуются биологически активные продукты N-деалкилирования. Один из них, нордазепам — основной метаболит диазепама, клоразепата, празепама и галазепама; кроме того, он образуется из демоксепама, важного метаболита хлордиазепоксида.
На втором этапе происходит гидроксилирование по С-3, обычно при этом также получается активный метаболит (например, оксазепам из нордазепама). Модификация или отщепление заместителей при N-1 происходит гораздо быстрее, чем гидроксилирование (Т, «40—50 ч и более), поэтому гидро-ксидированных метаболитов с неизмененными заместителями почти нет. Однако существуют два важных исключения:
1) при длительном приеме диазепама накапливается небольшое количество темазепама (в табл. 17.2 не показано), 2) в случае квазепама сера у С-2 замещается кислородом с образованием 2-оксоквазепама, большая часть которого медленно гид-роксилируется по С-3 без отщепления заместителя у N-1. Впрочем, при длительном приеме квазепама его 3-гидроксилиро-ванное производное накапливается лишь в небольшом количестве из-за очень быстрой конъюгации. В то же время накапливается N-дезалкилфлуразепам, продукт дополнительного пути метаболизма квазепама, и вносит существенный вклад в действие препарата.
Третий этап метаболизма бензодиазепинов — конъюгация -гидроксилированных производных (в основном с глюкуроновой кислотой). Т1/2 этой реакции обычно составляет 6—12 ч; ее продукты неактивны. Это единственный существенный путь метаболизма оксазепама и лоразепама и основной путь темазепама, так как его превращение в оксазепам идет медленнее. Метаболизм триазолама и алпразолама начинается с гидроксилирования метильной группы у триазольного кольца (в случае алпразолама реакцию резко замедляет отсутствие хлора у кольца С). Образующиеся вещества (а-гидроксилированные производные) сохраняют активность, но почти не накапливаются из-за быстрых дальнейших превращений, прежде всего конъюгации. Триазольное кольцо эстазолама не имеет метильной группы и гидро-ксилируется лишь в небольшой степени, основной путь его метаболизма — С-30-окисление. 3-гидроксилированные производные алпразолама и триазолама также образуются в значительных количествах (в табл. 17.2 не указано). Триазольное кольцо резко ускоряет гидроксилирование этих трех препаратов по сравнению с другими бензодиазепинами. Их 3-гидроксилированные производные перед выведением быстро конъюгируются или окисляются дальше, до бензофенонов (в табл. 17.2 не указано).
Мидазолам также быстро подвергается метаболизму, в основном путем гидроксилирования метильной группы у имидазольного кольца; 3-гидроксимидазолам образуется лишь в небольшом количестве. Альфа-гидроксимидазолам достаточно активен.
Его Т1/2 составляет около 1 ч, и он выводится после конъюгации. Длительное в/в введение мидазолама ведет к накоплению этого метаболита, иногда значительному (Oldenhofet al., 1988).
Ароматические кольца бензодиазепинов (А и С) гидроксилируются лишь в небольшой степени. Существенное значение имеет восстановление NOj-группы в 7-м положении клоназепама, нитразепама и флунитразепама (Т1/2 этой реакции составляет 20—40 ч). Образующиеся амины неактивны, перед выведением они в различной степени ацетилируются.
Очевидно, бензодиазепины не вызывают существенной индукции цитохрома Р450 и при длительном лечении не ускоряют свой собственный метаболизм и метаболизм других веществ. Циметидин и пероральные контрацептивы ингибируют С-3-гидроксилирование и N- 1-деалкилирование бензодиазепинов; действие этанола, изониазида и фенитоина на эти реакции менее выражено. У пожилых и при болезнях печени они обычно нарушаются в большей степени, чем конъюгация бензодиазепинов и их метаболитов.
В идеале действие снотворного препарата должно быстро начинаться при приеме на ночь, длиться на протяжении всей ночи и прекращаться к утру. Теоретически этим требованиям в наибольшей степени соответствует триазолам, а флуразепам и квазепам, казалось бы, не годятся из-за медленной элиминации N-дезалкилфлуразепама. Однако на практике бензодиазепины короткого действия имеют ряд недостатков, включая ранние пробуждения (у некоторых больных) и больший риск рикошетного эффекта после отмены препарата (Gillin et al., 1989; Roehrs et al. в Symposium, 1990b; Roth and Roehrs, 1992). В то же время тщательный подбор дозы позволяет с успехом использовать флуразепам и другие бензодиазепины более длительного действия, чем триазолам (Vogel, 1992). Подробнее о метаболизме и фармакокинетике бензодиазепинов см. обзоры Greenblatt et al., 1983а, b, 1991, 1993; Greenblatt, 1991; Hilbert and Battista, 1991.
Побочные эффекты. В момент достижения максимальной сывороточной концентрации снотворные дозы бензодиазепинов в той или иной степени вызывают дурноту, чувство усталости, нарушение координации движений, замедление реакции, оглушенность, антероградную амнезию. Когнитивные функции страдают в меньшей степени, чем двигательные. Если препарат принимается на ночь, сохранение этих явлений после пробуждения рассматривается как побочное действие. Они могут сильно мешать вождению и другой деятельности, крайне опасно одновременное употребление алкоголя. Выраженность указанных нарушений четко зависит от дозы, но человек может их не замечать: большинство больных недооценивают, насколько их состояние далеко от нормы. Побочным действием бывает и дневная сонливость, хотя лечение и уменьшает сонливость, вызванную хронической бессонницей (Dement, 1991). Риск и выраженность побочных эффектов растут с возрастом; здесь играют роль возрастные изменения и фармакокинетики, и фармакодинамики (Meyer, 1982; Swift et al. в Symposium, 1983; Monane, 1992).
Нередко бензодиазепины вызывают слабость, головную боль, нечеткость зрения, головокружение, тошноту, рвоту, боль в эпигастрии, понос; изредка бывают артрал-гия, боль в груди, недержание мочи. Противосудорожные бензодиазепины иногда даже увеличивают частоту припадков у больных эпилепсией.
Изменения психики. Иногда бензодиазепины оказывают парадоксальное действие: например, флуразепам может вызывать кошмары, особенно в первую неделю лечения, бывают также говорливость, тревожность, раздражительность, тахикардия, потливость. На фоне различных бензодиазепинов описаны случаи амнезии, эйфории, гипомании, беспокойства и галлюцинаций. Проявлениями растормаживающего эффекта порою оказываются причудливое развязное поведение, гнев, агрессия. Описаны также случаи паранойи, депрессии, суицидальных мыслей. Риск подобных парадоксальных реакций невелик и, по-видимому, зависит от дозы. Сообщения о повышенном риске нарушений сознания и поведения привели к запрету триазолама в Великобритании, но ФДА признало его низкие дозы (0,125— 0,25 мг) безопасными и эффективными. Опрос английских семейных врачей показал, что после запрещения триазолама его замена другими снотворными не снизила число побочных эффектов (Hindmarch et al., 1993). Эти данные согласуются с результатами контролируемых испытаний, говорящих об одинаковой частоте указанных побочных эффектов на фоне разных бензодиазепинов (Jonas et al., 1992; Rothschild, 1992).
Длительный прием бензодиазепинов может вести к зависимости и злоупотреблению, но их риск ниже, чем в случае барбитуратов и наркотических анальгетиков (Ulemhuth et al., 1999). Особой формой злоупотребления можно считать и использование флунитразепама при так называемом изнасиловании на свидании (Woods and Winger, 1997). Легкая зависимость возникает у многих больных, регулярно принимающих стандартные дозы бензодиазепинов. Отмена препарата вызывает временное усиление симптомов, послуживших показанием к его назначению, таких, как бессонница и тревожность. Возможны дисфория, раздражительность, потливость, кошмары, тремор, снижение аппетита, слабость и дурнота, особенно при резкой отмене (Ре-tursson, 1994). Соответственно, отменять бензодиазепины следует постепенно. При обычной схеме лечения больные крайне редко увеличивают дозу без указаний врача, и лишь изредка наблюдается непреодолимая тяга к бензодиазепинам после их отмены. Риск злоупотребления наиболее высок при алкоголизме или наркомании в анамнезе, причем такие больные обычно используют несколько веществ. Они редко предпочитают бензодиазепины барбитуратам и даже алкоголю, но часто добавляют их для усиления действия других веществ (алкоголя и наркотических анальгетиков) или уменьшения их токсичности (например, кокаина). Длительный прием высоких доз бензодиазепинов вызывает более тяжелый абстинентный синдром, включая возбуждение, депрессию, панику, паранойю, миалгию, подергивание мышц и даже эпилептические припадки и делирий. Подробнее о бензодиазепиновой зависимости см. в обзорах Woods et al. (1992), DuPont (1988).
Несмотря на перечисленные побочные эффекты, бензодиазепины сравнительно безопасны. В отсутствие других препаратов даже очень высокие дозы редко ведут к смерти или коме. Смерть от бензодиазепинов часто бывает вызвана одновременным употреблением алкоголя. Передозировка бензодиазепинов редко вызывает тяжелые нарушения дыхания и кровообращения, но даже обычные дозы могут усугублять дыхательную недостаточность при ХОЗЛ и обструктивных апноэ во сне (см. выше).
Бывают также аллергические реакции, поражение печени и угнетение кроветворения, но риск этих явлений невелик. Они описаны для флуразепама и триазолама, но не для темазепама. Высокие дозы бензодиазепинов, введенные перед родами или во время них, могут вызвать у новорожденного гипотермию, артериальную гипотонию и легкое угнетение дыхания; если мать злоупотребляла бензодиазепинами, возможен также абстинентный синдром.
Кроме усиления эффекта других транквилизаторов и снотворных описаны лишь отдельные случаи клинически значимых фармакодинамических взаимодействий бензодиазепинов. Так, этанол не только ускоряет их всасывание, но и усиливает угнетение ЦНС. Сочетание бензодиазепинов с вальпроевой кислотой может вызывать психотические реакции. Фармакокинетические взаимодействия описаны выше.
Применение
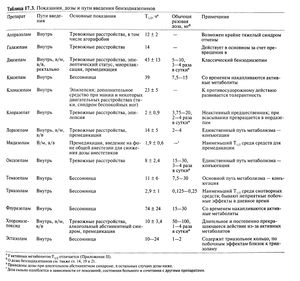
Показания, дозы и пути введения применяемых в США бензодиазепинов приведены в табл. 17.3. В этой таблице содержатся основные показания к разным бензодиазепинам, но важно отметить, что большинство препаратов взаимозаменяемы: например, диазепам можно использовать при алкогольном абстинентном синдроме, а как снотворные могут действовать большинство бензодиазепинов. В целом показания к данному препарату отражают его Т1/2 и могут не соответствовать инструкции изготовителя. В качестве противосудорожных средств применяют бензодиазепины с длинным Т1/2, для купирования эпилептического статуса нужны препараты, быстро проникающие в головной мозг. Для снотворных средств желателен короткий Т1/2, хотя это повышает риск злоупотребления и усугубляет синдром отмены после длительного использования. Для лечения тревожности требуются препараты с длинным Т 1/2, несмотря на больший риск неврологических и когнитивных нарушений из-за их накопления.
Применение бензодиазепинов при бессоннице описано ниже (см. также Symposium, 1990b; Teboul and Choui-nard, 1991; Vogel, 1992; Dement, 1992; Walsh and Engel-hardt, 1992; Maczaj, 1993). Кроме того, их используют в анестезиологии (гл. 13 и 14), при тревожности (гл. 19), эпилепсии (гл. 21) и спастичности (гл. 22).
Новые аналоги бензодиазепинов
Эта группа снотворных включает зопиклон (в США не применяется), золпидем и залеппон. Хотя по строению эти препараты далеки от бензодиазепинов, их действие связывают со стимуляцией бензодиазепиновых рецепторов. Залеплон и золпидем помогают при плохом засыпании, их можно назначать курсами по 7—10 сут. Оба препарата оказывают стойкое снотворное действие и не вызывают усиления бессонницы при резкой отмене (Mitler, 2000; Walsh et al., 2000). По эффективности они одинаковы. Т1/2 золпидема составляет около 2 ч, и его действие длится большую часть 8-часового сна, поэтому препарат назначают только на ночь. Т1/2 залеплона короче (около 1 ч), что позволяет принимать его в течение ночи, самое позднее — за 4 ч до планируемого утреннего пробуждения. Соответственно, залеплон назначают на ночь и при ночных пробуждениях. Из-за короткого Т1/2 залеплон не отличается от плацебо по длительности сна и числу пробуждений. Залеплон и золпидем неодинаковы по выраженности последействия: если принять золпидем в течение ночи, утром возможны сохранение седативного эффекта, заторможенность и антероградная амнезия, тогда как залеплон по побочным эффектам не отличается от плацебо. По риску злоупотребления эти препараты сопоставимы с бензодиазепинами.
Залеплон. Это производное пиразолопиримидина. Его структурная формула следующая:
Хотя по строению залеплон отличается от бензодиазепинов, он преимущественно связывается с бензодиазепиновыми рецепторами на ГАМКд-рецепторах, содержащих а1-субъединицы. Препарат быстро всасывается, его максимальная сывороточная концентрация достигается примерно через 1 ч. Как уже говорилось, Т1/2 залеплона также составляет около 1 ч. За счет инактивации при первом прохождении через печень его биодоступность не превышает 30%. Залеплон связывается с белками плазмы примерно на 60%, объем распределения составляет 1,4 л/кг. В его метаболизме участвуют альдегидоксидаза и, в меньшей степени, изофермент IIIA4 цитохрома Р450. Продукты окисления залеплона конъюгируются с глюкуроновой кислотой и выводятся с мочой, в неизмененном виде выделяется менее 1% препарата. Все метаболиты залеплона неактивны.
Таблица 17.3. Показания, дозы и пути введения бензодиазепинов
Залеплон назначают по 5, 10 и 20 мг. Препарат испытывался при хронической и преходящей бессоннице, причем основное внимание обращали на скорость засыпания (Dooley and Plosker, 2000). Во всех случаях залеплон ускорял засыпание по сравнению с плацебо, кроме того, не было отмечено толерантности к нему, рикошетной бессонницы и иных проявлений синдрома отмены.
Золпидем. Это еще один небензодиазепиновый транквилизатор и снотворный препарат, производное имидазопиридина. С1988 г. он применяется в Европе, с 1993 г. — в США. Его структурная формула следующая:
Золпидем стимулирует бензодиазепиновые рецепторы и в целом напоминает бензодиазепины, однако у экспериментальных животных он оказывает лишь слабое противосудорожное действие, а его достаточно сильный седативный эффект перекрывает анксиолитический в различных моделях тревожности (Langtry and Benfield, 1990). Длительное применение золпидема у грызунов не вызывает толерантности к его седативному действию и не ведет к абстинентному синдрому при отмене препарата и введении флумазенила (Perrault et al., 1992). Впрочем, у павианов наблюдались толерантность и физическая зависимость от золпидема (Griffiths etal., 1992).
В отличие от бензодиазепинов, золпидем мало влияет на структуру сна у здоровых людей. При бессоннице он ускоряет засыпание и продлевает сон в той же мере, что и бензодиазепины. Сообщалось, что эффект золпидема сохраняется до 1 нед после его отмены (Herrmann et al., 1993), однако отмечено и небольшое усиление бессонницы в первую ночь после отмены (Anonymous, 1993). Случаи толерантности и физической зависимости редки и наблюдались лишь в необычных обстоятельствах (Cavallaroetal., 1993; Morselli, 1993). Водном исследовании благоприятное действие золпидема при хронической бессоннице наблюдалось на протяжении целых 6 мес лечения в отсутствие абстинентного синдрома и синдрома рикошета после отмены препарата (Kummer et al., 1993). Тем не менее золпидем разрешен только для кратковременного лечения бессонницы. В обычных дозах (10—20 мг, 5—10 мг для пожилых) золпидем лишь изредка вызывает сонливость в дневное время и амнезию, другие побочные явления (дурнота, нарушения со стороны ЖКТ) также редки. Как и бензодиазепины, даже в очень высоких дозах золпидем не приводит ктяжелому угнетениюдыхания в отсутствие других веществ (например, алкоголя; Gamier et al.,1994). В обычных дозах препарат усугубляет гипоксию и гиперкапнию при обструктивных апноэ во сне.
Золпидем хорошо всасывается из ЖКТ. Из-за инактивации при первом прохождении через печень его биодоступность составляет около 70%; при приеме вместе с едой биодоступность ниже, так как всасывание замедляется, а печеночный кровоток возрастает. Элиминация золпидема происходит почти исключительно путем печеночного метаболизма, в основном за счет окисления метальных групп у бензольного и пиридинового колец до карбоксильных. При нормальных кровоснабжении и функции печени его Т1/2 составляет около 2 ч. При циррозе печени Т1/2 может возрастать в 2 раза и более, элиминация препарата несколько замедляется и у пожилых; в обоих случаях часто требуется снижение дозы. Золпидем почти не попадает в мочу в неизмененном виде, однако при ХПН его элиминация также замедляется, главным образом за счет увеличения объема распределения.
Флумазенил
Это блокатор бензодиазепиновых рецепторов, производное имидазобензодиазепина (табл. 17.1). Флумазенил — первый препарате такими свойствами, прошедший клинические испытания; его начали применять в 1991 г. Как говорилось выше, флумазенил имеет высокое сродство к бензодиазепиновым рецепторам и конкурирует за них со стимуляторами и с обратными агонистами (бензодиазепинами, p-карболинами и другими лигандами), блокируя электрофизиологические и поведенческие эффекты данных препаратов. В экспериментах на животных сам флумазенил оказывал лишь слабое действие, в низких дозах иногда напоминавшее эффекты обратных агонистов, а в высоких — бензодиазепинов. Собственные эффекты флумазенила у человека еще менее выражены, отмечено лишь умеренное противосудорожное действие высоких доз. Впрочем, последнее не имеет практического значения, так как в определенных условиях флумазенил сам может вызывать эпилептические припадки (см. ниже).
Флумазенил выпускается только в растворе для в/в введения. Хотя препарат быстро всасывается при приеме внутрь, из-за инактивации при первом прохождении через печень его биодоступность не превышает 25%, а в терапевтической дозе он может вызвать головную боль и дурноту (Roncari et al., 1993). Флумазенил быстро (Т1/2 около 1 ч) и почти полностью метаболизируется в печени до неактивных продуктов, поэтому его действие длится недолго — обычно 30—60 мин.
Основные показания к флумазенилу — подозрение на передозировку бензодиазепинов и устранение их седативного эффекта после обшей анестезии или диагностических и лечебных вмешательств.
Общую дозу флумазенила желательно разбить на несколько частей. Введение 1 мг препарата за 1—3 мин обычно устраняет эффект стандартных доз бензодиазепинов, при подозрении на их передозировку должна помочь общая доза 1—5 мг (ее вводят за 2—10 мин); если не помогли и 5 мг, следует думать о другой причине угнетения ЦНС. Если флумазенил подействовал, но через 20—30 мин вновь появляются симптомы угнетения ЦНС, его вводят повторно. При передозировке барбитуратов или трициклических антидепрессантов флумазенил бесполезен; более того, у таких больных он может спровоцировать эпилептические припадки (особенно на фоне трициклических антидепрессантов; Spivey, 1992). Флумазенил способен вызвать эпилептические припадки и другие проявления синдрома отмены на фоне длительного приема бензодиазепинов, когда могли развиться толерантность и зависимость от них.
Барбитураты
Долгое время в качестве транквилизаторов и снотворных широко использовались барбитураты, но сейчас их почти вытеснили более безопасные бензодиазепины.
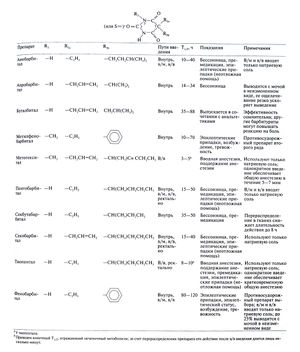
Химические свойства. Сама барбитуровая кислота (2,4,6-триоксогексагидропиримидин) не угнетает ЦНС, но алкильные и ароматические группы в 5-м положении придают барбитуратам седативные, снотворные и ряд других свойств. Строение основных барбитуратов приведено в табл. 17.4.
Кетогруппа в положении 2 придает барбитуратам кислотные свойства; за счет ее соседства с двумя электроотрицательными атомами азота барбитураты находятся преимущественно в лактамной форме (—СО—NH—), в щелочной среде они переходят в лактимную (—COH=N—) и образуют соли. Путем замены кислорода у С-2 на серу получаются тиобарбитураты, более липофильные, чем соответствующие оксибарбитураты. В целом, увеличение липофильности ускоряет элиминацию препарата и уменьшает длительность эффекта, но ускоряет его наступление и часто усиливает снотворное действие.
Фармакологические свойства
Барбитураты обратимо подавляют возбудимость всех возбудимых тканей. Наиболее чувствительна к ним ЦНС, и даже в дозах, вызывающих анестезию, барбитураты мало влияют на периферические ткани. Однако при остром отравлении барбитуратами возникают тяжелые сердечно-сосудистые и другие нарушения.
ЦНС. Барбитураты способны вызвать угнетение ЦНС любой степени — от легкой сонливости до общей анестезии. Их использование в анестезиологии обсуждается в гл. 14. Некоторые препараты, особенно с фенильной группой у С-5 (фенобарбитал и метилфенобарбитал), оказывают избирательное противосудорожное действие (гл. 20). По анксиолитической активности, особенно по ее соотношению с седативным эффектом, барбитураты уступают бензодиазепинам. Барбитураты могут вызывать эйфорию.
Кроме противосудорожного эффекта фенобарбитала и метилфенобарбитала, избирательность и терапевтический диапазон барбитуратов невелики: они не позволяют достичь того или иного эффекта без значительного угнетения ЦНС. Вплоть до потери сознания мало меняются болевая чувствительность и реакция на боль, а в низких дозах барбитураты повышают реакцию на боль. Таким образом, даже умеренная боль препятствует седативному и снотворному действию барбитуратов. У некоторых людей в определенных условиях (например, на фоне боли) вместо сонливости возникает возбуждение. Подобное парадоксальное возбуждение могут вызывать и другие препараты, угнетающие ЦНС, — очевидно, за счет подавления активности тормозных структур.
Структура сна. Барбитураты удлиняют сон и в зависимости от дозы влияют на его стадии. Подобно бензодиазепинам, они ускоряют засыпание, уменьшают число пробуждений, длительность быстрого сна и глубокого медленного сна. Через несколько дней к этим эффектам вырабатывается некоторая толерантность, а через 2 нед влияние на общую длительность сна может уменьшиться в 2 раза. Отмена барбитуратов вызывает рикошетный эффект в отношении всех описанных параметров. Толерантность. Развитие толерантности к барбитуратам обусловлено изменениями как фармакодинамики, так и фармакокинетики, причем большее значение имеет первый механизм. При длительном приеме барбитуратов в постепенно возрастающей дозе их фармакодинамика меняется в течение недель—месяцев (в зависимости от схемы), тогда как изменения фармакокинетики достигают пика не позже недели. Толерантность к анксиолитическому, седативному и снотворному эффектам возникает быстрее и в большей степени, чем к противосудорож-ному; смертельная доза увеличивается ненамного, и с развитием толерантности терапевтический диапазон сужается. Толерантность к барбитуратам сопровождается толерантностью и к другим веществам, угнетающим ЦНС, включая этанол. Злоупотребление и зависимость. Как и другие вещества, угнетающие ЦНС, барбитураты служат предметом злоупотребления, иногда возникает зависимость от них (гл. 24).
Механизм действия. Барбитураты угнетают ЦНС: на фоне их стандартных доз угнетаются преимущественно полисинаптические рефлексы, причем проведение возбуждения подавляется, а торможение обычно усиливается. Усиление торможения происходит как на постсинаптическом уровне (в клетках Беца и Пуркинье, клиновидном ядре, черной субстанции и релейных ядрах таламуса), так и на пресинаптическом (в спинном мозге) и наблюдается прежде всего в синапсах, содержащих ГАМКд-рецепторы.
Барбитураты оказывают несколько различных эффектов на возбуждающие и тормозные синапсы. Например, /-пентобарбитал в концентрации ниже 10 мкмоль/л усиливает вызываемый ГАМК хлорный ток и подавляет потенциалзависимый кальциевый ток в изолированных нейронах гиппокампа; при концентрации выше 100 мкмоль/л хлорный ток возрастает и в отсутствие ГАМК (Ffrench-Mullen et al., 1993). У фенобарбитала аналогичное действие менее выражено и достигается при значительно больших концентрациях, а активность </-пентобарби-тала вообще невелика. Таким образом, более избирательное противосудорожное действие и больший терапевтический диапазон фенобарбитала связаны с меньшей способностью вызывать глубокое угнетение ЦНС по сравнению с барбитуратами, применяемыми в анестезиологии.
Как говорилось выше, барбитураты, бензодиазепины и ГАМ К по-разному действуют на ГАМ КА-рецепторы. На это указывает ряд обстоятельств: 1) барбитураты также усиливают связывание ГАМК с ГАМКА-рецепторами (этот процесс зависит от концентрации СГ и нарушается пикротоксином), но при этом способствуют связыванию и бензодиазепинов, а не вытесняют их, 2) барбитураты усиливают вызываемый ГАМК хлорный ток за счет удлинения вспышек открывания хлорных каналов, а не путем учащения этих вспышек, как бензодиазепины, 3) для действия барбитуратов требуются а- и β-, но не у-субъединицы ГАМКА-рецептора, 4) удаление из р-субъединицы ГАМКд-рецептора тирозина и треонина, определяющих его чувствительность к стимуляторам, не препятствует усилению хлорного тока под действием барбитуратов (Amin and Weiss, 1993).
Терапевтические концентрации барбитуратов уменьшают деполяризацию, возникающую под действием глутамата (гл. 12; Macdonald and McLean, 1982), по-видимому, они действуют только на АМРА- и каинатные рецепторы (Marszalec and Narahas-hi, 1993). Барбитураты блокируют и рекомбинантные AMPA-peцепторы in vitro. В концентрациях, вызывающих общую анестезию, пентобарбитал подавляет высокочастотную импульсацию нейронов — очевидно, за счет блокады быстрых натриевых каналов; при этом активность стереоизомеров примерно одинакова (Frenkel et al., 1990). Еще более высокие концентрации снижают проницаемость потенциалзависимых калиевых каналов.
Таким образом, угнетающее действие барбитуратов на ЦНС связано со стимуляцией тормозных ГАМКд-рецепторов и с блокадой возбуждающих AMРА-рецепторов. Подробнее о механизмах действия барбитуратов см. обзор Saunders and Но (1990).
Периферическая нервная система. Барбитураты избирательно нарушают проведение в вегетативных ганглиях, ослабляя действие N-холиностимуляторов. Этот эффект отчасти объясняет падение АД при в/в введении оксибарбитуратов и тяжелом отравлении барбитуратами. В/в анестезия барбитуратами усиливает действие миорелаксантов: как деполяризующих (декаметония), так и недеполяризующих (тубокурарина). Очевидно, в концентрациях, вызывающих сон и общую анестезию, барбитураты блокируют каналы, сопряженные с N-холинорецептора-ми. Это действие, видимо, обусловлено несколькими механизмами, и стереоизомеры барбитуратов в этом отношении мало отличаются по активности (Roth et al., 1989).
Дыхательная система. Барбитураты угнетают как автоматизм дыхательного центра, так и его реакции на гипоксию и гиперкапнию. Снотворные дозы подавляют автоматизм дыхательного центра, однако примерно такой же эффект оказывает и обычный сон. Троекратное повышение дозы резко подавляет автоматизм дыхательного центра, а также реакцию на гипоксию и, в меньшей степени, на гиперкапнию. При дальнейшем увеличении дозы реакция на гиперкапнию тоже исчезает. Впрочем, разница в дозах между неглубокой общей анестезией, достаточной для хирургических манипуляций, и угрожающим жизни угнетением дыхания позволяет — с надлежащими предосторожностями — использовать для анестезии барбитураты сверхкороткого действия.
В дозах, не вызывающих тяжелого угнетения дыхания, барбитураты лишь слегка подавляют дыхательные защитные рефлексы: на фоне барбитуратной анестезии сохраняются кашель, чихание, икота и ларингоспазм. Более того, ларингоспазм — одно из основных осложнений анестезии барбитуратами. Сердечно-сосудистая система. Седативные и снотворные дозы барбитуратов не оказывают существенного влияния на кровообращение, кроме небольшого снижения АД и ЧСС, наблюдаемого и при нормальном сне. По сравнению с ингаляционными анестетиками тиопентал обычно мало влияет на сердечно-сосудистую систему, не меняя среднее АД или несколько снижая его. По-видимому, падения сердечного выброса оказывается достаточно, чтобы нивелировать увеличение ОПСС; иногда при этом возрастает ЧСС. Ганглиоблокирующее действие барбитуратов подавляет рефлекторную регуляцию кровообращения. Сильнее всего это проявляется при сердечной недостаточности и гиповолемическом шоке, когда исходно наблюдается выраженное рефлекторное сужение сосудов и увеличение ЧСС, и барбитураты могут вызвать резкое падение АД. Кроме того, они нарушают рефлекторные гемодинамические реакции на раздувание легких, поэтому при отравлении или в/в анестезии барбитуратами к ИВЛ прибегают с осторожностью—лишь когда требуется поддержать адекватную вентиляцию легких.
В/в введение тиопентала и других тиобарбитуратов после обычной премедикации часто уменьшает почечный и мозговой кровоток, резко снижая внутричерепное давление. В целом барбитураты редко вызывают аритмию, но в/в анестезия ими повышает риск желудочковых аритмий, особенно при одновременном использовании адреналина и галотана. В концентрациях, вызывающих анестезию, барбитураты оказывают прямое влияние на электрофизиологические свойства миокарда: кроме быстрых натриевых каналов они снижают проводимость по крайней мере двух типов калиевых каналов (Nattel et al., 1990; Pancrazio et al., 1993). Впрочем, сократимость миокарда напрямую угнетают лишь дозы в несколько раз больше, чем применяемые для в/в анестезии; очевидно, этот эффект вносит вклад в сердечную недостаточность при остром отравлении барбитуратами. ЖКТ. Оксибарбитураты снижают тонус гладких мышц ЖКТ и амплитуду их ритмических сокращений; это действие отчасти центральное, отчасти периферическое — в зависимости от дозы. Снотворные дозы барбитуратов существенно не замедляют опорожнение желудка. Уменьшение различных симптомов со стороны ЖКТ на фоне седативных доз барбитуратов обусловлено, по-видимому, прежде всего угнетением ЦНС.
Печень. Наиболее изучено влияние барбитуратов на микросомальные ферменты печени (гл. 1). Вначале барбитураты связываются с различными изоферментами цитохрома Р450, нарушая метаболизм других препаратов и эндогенных субстратов (например, стероидов); в свою очередь, эти вещества способны ингибировать инактивацию барбитуратов. Лекарственные взаимодействия могут возникать даже тогда, когда барбитураты и другие вещества окисляются разными изоферментами.
Длительный прием барбитуратов резко увеличивает содержание белков и липидов в гладком эндоплазматическом ретикулуме гепатоцитов, а также повышает активность глюкуро-нилтрансфераз и изоферментов цитохрома Р450. Это ускоряет метаболизм многих препаратов и эндогенных веществ, включая стероидные гормоны, холестерин, желчные кислоты, витамины К и D. Ускоряется метаболизм и самих барбитуратов, отчасти с этим связана толерантность к ним. Многие транквилизаторы и снотворные, анестетики и этанол также метаболизируютея указанными ферментами и индуцируют их, из-за чего в той или иной степени возникает перекрестная толерантность. Инактивация разных препаратов и эндогенных субстратов меняется в разной степени, но удобно считать, что при максимальной индукции цитохрома Р450 метаболизм ускоряется примерно вдвое. Наблюдается индукция и других ферментов как в митохондриях (аминолевулинатсинтаза), так и в цитоплазме (альдепадцегидрогеназа). За счет индукции аминолевулинатсинтазы барбитураты могут вызвать тяжелое обострение острой перемежающейся порфирии.
Почки. При остром отравлении барбитуратами бывает тяжелая олигурия или анурия, прежде всего как следствие резкой артериальной гипотонии.
Фармакокинетика. С седативной и со снотворной целью барбитураты обычно назначают внутрь (табл. 17.4). В применяемых дозах они всасываются быстро и, по-видимому, полностью. Натриевые соли всасываются быстрее свободных кислот, особенно при использовании растворов. Действие начинается через 10—60 мин, в зависимости от препарата и лекарственной формы, пища в желудке замедляет всасывание. При необходимости в/м инъекций используют только натриевые соли, их вводят глубоко и в крупные мышцы, чтобы избежать боли и некроза, возможного при поверхностном введении. Некоторые барбитураты можно назначать ректально. Обычно барбитураты вводят в/в лишь при эпилептическом статусе (фенобарбитал), а также для вводной анестезии и поддержания анестезии (тиопентал, метогекситал).
Барбитураты проникают во все ткани и легко проходят через плаценту. Высоко липофильные препараты, особенно анестетики, после в/в введения подвергаются перераспределению. Их переход в ткани с низким кровотоком, прежде всего мышцы и жир, снижает концентрацию препарата в крови и головном мозге. В случае тиопентала и метогекситала это вызывает пробуждение больного через 5—15 мин после введения обычной дозы.
Кроме менее липофильных фенобарбитала и апробарбитала, барбитураты почти полностью подвергаются окислению и конъюгации, после чего выводятся почками. Основной путь их инактивации — окисление заместителей у С-5; образующиеся при этом спирты, кетоновые тела, фенолы и карбоновые кислоты выделяются с мочой без изменения или в виде глюкуронидов. Иногда (например, в случае фенобарбитала) важную роль играет N-гликозилирование. Другие пути метаболизма включают N-гидроксилирование, десульфурацию тиобарбитуратов с образованием оксибарбитуратов, раскрытие барбитурового кольца, а также деалкилирование N-алкилбарбитуратов до активных метаболитов (например, ме-тилфенобарбитала до фенобарбитала). Около 25% фенобарбитала и почти весь апробарбитал выделяются с мочой в неизмененном виде, их выведение сильно ускоряют осмотический диурез и ощелачивание мочи.
У грудных детей и у пожилых метаболизм барбитуратов замедлен. Т1/2 возрастает также у беременных, отчасти из-за увеличения объема распределения. Т1/2 барбитуратов, элиминируемых путем печеночного метаболизма, повышается при хронических болезнях печени, особенно при циррозе. Длительное применение этих препаратов, в частности фенобарбитала, снижает их Т1/2 за счет индукции микросомальных ферментов (см. выше).
Как видно из табл. 17.4, ни у одного из барбитуратов, применяемых в качестве снотворных, Т1/2 не настолько короток, чтобы препарат почти полностью выводился в течение 24 ч. Впрочем, между длительностью действия и Т1/2 нет четкой связи — отчасти из-за наличия стереоизомеров, отличающихся как по активности, так и по скорости метаболизма. Так или иначе, если не снижать дозу, при длительном лечении все эти препараты накапливаются. Более того, сохранение достаточно высокой концентрации препарата в течение дня способствует развитию толерантности и злоупотреблению.
Побочные эффекты. Последействие. Сонливость после приема снотворных доз барбитуратов длится лишь несколько часов, но остаточное угнетение ЦНС иногда сохраняется и на следующий день. Даже в отсутствие явных признаков угнетения ЦНС можно выявить легкие отклонения в настроении, суждениях и тонких движениях. Так, 200 мг секобарбитала нарушают способность к вождению автомобиля и самолета на 10—22 ч. Последействие может проявляться и головокружением, тошнотой, рвотой, поносом, иногда даже явным возбуждением. Человек может проснуться в состоянии легкого опьянения, с ощущением эйфории и полный энергии, но по мере того как из-за нарушения навыков возникают затруднения в работе, появляется раздражительность.
Парадоксальное возбуждение. У некоторых людей барбитураты вызывают не угнетение ЦНС, а возбуждение; человек может казаться пьяным. Такой эффект чаще наблюдается в старческом возрасте и у тяжелых больных и более характерен для фенобарбитала и N-метилбарбитуратов. Боль. Барбитураты использовали при миалгии, невралгии и артралгии, но зачастую безуспешно, особенно на фоне неврозов и бессонницы. При наличии боли барбитураты могут вызвать беспокойство, возбуждение и даже делирий, а также усилить болевые ощущения.
Аллергия. Барбитураты чаще вызывают аллергию у больных с бронхиальной астмой, крапивницей, отеком Квинке и другими подобными расстройствами. Аллергические реакции у таких больных включают местный отек (особенно век, щек и губ) и эритему. Изредка фенобарбитал вызывает эритродермию, которая бывает смертельной: поражение кожи может сопровождаться лихорадкой, делирием и тяжелыми изменениями в печени и других паренхиматозных органах.
Лекарственные взаимодействия. Барбитураты усиливают действие других веществ, угнетающих ЦНС: чаще всего это бывает этанол, нередки взаимодействия и с Н1-бло-каторами. Угнетение ЦНС под действием барбитуратов усугубляют также изониазид, метилфенидат и ингибиторы МАО.
Барбитураты конкурентно ингибируют метаболизм ряда препаратов, но большинство их лекарственных взаимодействий вызвано индукцией микросомальных ферментов печени с ускорением инактивации многих препаратов и эндогенных веществ. Ускоряется метаболизм витаминов D и К, что нарушает минерализацию костей и снижает всасывание кальция, а также объясняет случаи коагулопатии у новорожденных, матери которых принимали фенобарбитал. Кроме того, ускоряется инактивация стероидных гормонов, что может вести к эндокринным нарушениям, а в случае пероральных контрацептивов — к нежелательной беременности. Наконец, барбитураты способствуют образованию токсичных метаболитов хлорсодержащих анестетиков и четыреххлористого углерода, усиливая перекисное окисление липидов и усугубляя перипортальный некроз гепатоцитов, вызываемый этими веществами.
Другие побочные эффекты. Барбитураты увеличивают синтез порфиринов и поэтому абсолютно противопоказаны при острой перемежающейся порфирии и вариегатной порфирии. В снотворных дозах они слабо влияют на регуляцию дыхания, но на фоне дыхательной недостаточности способны вызвать тяжелое угнетение дыхания и потому также противопоказаны. При быстром в/в введении барбитуратов еще до наступления общей анестезии может развиться шок, и тогда одни лишь признаки глубины анестезии не будут в полной мере отражать грозящую больному опасность. Возможно резкое падение АД; даже медленное в/в введение барбитуратов часто вызывает апноэ, встречаются ларингоспазм, кашель и другие нарушения со стороны органов дыхания.
Отравление
В последние годы отравление барбитуратами встречается намного реже, прежде всего из-за их менее широкого применения. Тем не менее такое отравление — неотложное состояние, в отдельных случаях приводящее к смерти. Большинство случаев связано с попытками самоубийства, но бывают и случайные отравления у детей и наркоманов. Хотя смертельная доза зависит от многих факторов, тяжелое отравление обычно вызывает 10-кратное превышение полной снотворной дозы. При сочетании с алкоголем и другими веществами, угнетающими ЦНС, смертельная доза барбитуратов ниже.
При тяжелом отравлении больной находится в коме. Быстро нарушается дыхание: оно бывает редким или частым и поверхностным. При беглом осмотре легко недооценить степень снижения МОД, тяжесть дыхательного ацидоза и гипоксии головного мозга. В дальнейшем снижается АД — преимущественно за счет действия препарата и гипоксии на сосудодвигательный центр, но имеет значение также отрицательное инотропное и ганглиоблокирующее действие барбитуратов. К смерти обычно приводят осложнения со стороны легких (отек, ателектаз, пневмония) и ОПН.
Основное значение имеет поддерживающее лечение; гемодиализ и гемосорбция требуются лишь изредка. Препараты, стимулирующие ЦНС, повышают летальность. Описанный подход в целом применим при отравлении любыми веществами, угнетающими ЦНС.
Обеспечивают проходимость дыхательных путей, достаточную вентиляцию и профилактику пневмонии; дают кислород. Поскольку барбитураты замедляют моторику ЖКТ, в первые 24 ч целесообразно промывание желудка, при этом важно не допустить аспирации желудочного содержимого. Затем дают активированный уголь и слабительное (например, сорбитол) — это ускоряет выведение менее липофильных препаратов, в частности фенобарбитала. В отсутствие ОПН, сердечной недостаточности и гиповолемии ускорить выведение апробарбитала и фенобарбитала позволяет также форсированный диурез с ощелачиванием мочи. Необходима профилактика и устранение ателектазов, при необходимости начинают ИВЛ.
При тяжелом отравлении велик риск шока. Больные часто поступают с тяжелой артериальной гипотонией или шоком, нередко бывает выражена гиповолемия. Необходимо восполнение ОЦК, для повышения АД может потребоваться дофамин. Причиной примерно шестой части смертельных исходов оказывается ОПН, вызванная шоком и гипоксией; в таких случаях проводят гемодиализ. Подробнее об отравлении барбитуратами см. обзор Gary and Tresznewsky (1983).
Применение
Значение барбитуратов как транквилизаторов и снотворных резко упало — по сравнению с бензодиазепинами их действие на ЦНС менее специфично, терапевтический диапазон уже, чаще возникает толерантность, выше риск злоупотребления и лекарственных взаимодействий. Основные показания к барбитуратам приведены в табл. 17.4. Как и в случае бензодиазепинов, при выборе препарата основную роль играет его фармакокинетика.
Хотя вместо барбитуратов в качестве средств с седативным действием обычно применяют бензодиазепины и другие препараты, фенобарбитал и секбутабарбитал до сих пор входят в комбинированные препараты с сомнительной эффективностью, назначаемые для подавления психогенного компонента при функциональных расстройствах ЖКТ и бронхиальной астме. Их включают и в комбинированные анальгетики — возможно, с обратным эффектом. Барбитураты, особенно фенобарбитал и секбутабарбитал, иногда назначают для уменьшения психостимулирующего действия эфедрина, дексамфетамина и теофиллина, однако лучше снизить дозы последних или заменить их другими препаратами. Фенобарбитал — по-прежнему широко используемое и, пожалуй, единственное эффективное средство при абстинентном синдроме после отмены транквилизаторов и снотворных (Martin etal., 1979).
Барбитураты все еще используют как средства неотложной помощи при судорогах различного происхождения — при столбняке, эклампсии, внутричерепном кровоизлиянии, эпилептическом статусе и отравлении веществами, провоцирующими судороги; впрочем, обычно в этих случаях лучше применять бензодиазепины (диазепам). Благодаря высокой противосудорожной активности чаще назначают фенобарбитал, но даже при в/в введении его концентрация в головном мозге достигает пика лишь через 15 мин. У препаратов короткого и сверхкороткого действия отношение противосудорожной активности к снотворной невелико, и к ним, как и к ингаляционным анестетикам, прибегают лишь при необходимости общей анестезии, когда другие средства не помогают. Применение барбитуратов при эпилепсии описано в гл. 21.
Барбитураты сверхкороткого действия (тиопентал, метогекситал) продолжают использовать в/в как неингаляционные анестетики (гл. 14). У детей метогекситал иногда вводят ректально — в качестве вводной анестезии и как седативное перед диагностическими исследованиями (Manuli and Davies, 1993). Препараты короткого и сверхкороткого действия изредка применяют как вспомогательные средства при анестезии в акушерстве. Согласно ряду исследований, они не вызывают существенного угнетения дыхания у доношенных детей, но у недоношенных риск выше. Поскольку оценить влияние барбитуратов на плод и новорожденного непросто, этих препаратов лучше избегать.
Барбитураты применяются и в психиатрии — для наркоанализа и наркопсихотерапии. Введение небольших доз амобарбитала в сонную артерию применялось в нейрохирургии для выявления доминантного полушария. Этот метод используется и для более углубленного нейропсихологического обследования при эпилепсии, устойчивой к противосудорожным препаратам, чтобы определить показания к хирургическому лечению (Smith and Riskin, 1991).
В дозах, вызывающих анестезию, барбитураты уменьшают отек головного мозга после операций, черепномозговой травмы и инсульта, они могут уменьшить зону некроза и повысить выживаемость; общие анестетики так не действуют. Впрочем, метод небезопасен, и не доказано, что польза от него перевешивает риск осложнений (Shapiro, 1985; Smith and Riskin, 1991).
Индукция печеночных ферментов. Барбитураты усиливают синтез глюкуронилтрансфераз и глутатионтрансфераз, и фенобарбитал с успехом применялся у новорожденных при гипербилирубинемии и билирубиновой энцефалопатии. Столь же эффективен фетарбитал — барбитурат, не угнетающий ЦНС. Фенобарбитал способен улучшить транспорт билирубина в печени при гемолитической желтухе.
Прочие транквилизаторы и снотворные
Долгие годы в качестве транквилизаторов и снотворных использовался ряд препаратов разнообразного строения, включая паральдегид (он появился еще до барбитуратов), хлоралгидрат, этхлорвинол, глутетимид, метиприлон, этинамат и мепробамат (вошел в употребление непосредственно перед бензодиазепинами). Кроме мепробамата, все они по действию близки к барбитуратам: они угнетают ЦНС и способны вызвать глубокий сон, их обезболивающий эффект минимален. По влиянию на структуру сна они также напоминают барбитураты. Терапевтический диапазон этих средств невелик; при остром отравления они вызывают угнетение дыхания и падение АД, лечение такое же, как при отравлении барбитуратами. Их длительный прием ведет к толерантности и физической зависимости, а отмена чревата тяжелым, угрожающим жизни абстинентным синдромом. Мепробамат в известной мере напоминает бензодиазепины, но чаще становится предметом злоупотребления и обладает менее избирательным анксиолитическим действием. Не удивительно, что эти препараты практически утратили свое значение.
И все же в отдельных случаях некоторые из них бывают полезны, особенно у стационарных больных.
Строение и основные свойства паральдегида, этхлорвинола, хлоралгидрата и мепробамата представлены в табл. 17.5. Сведения о глутетимиде, метиприлоне и этинамате можно почерпнуть в предыдущих изданиях этой книги.
Паральдегид
Это полимер ацетальдегида, хотя его лучше рассматривать как циклический полиэфир. Он имеет резкий запах и неприятный вкус. Паральдегид раздражает слизистую рта и желудка, парентеральное введение невозможно из-за повреждения тканей. При использовании в виде клизмы его разводят оливковым маслом.
При приеме внутрь паральдегид быстро всасывается и вызывает сон через 10—15 мин. Препарат проникает во многие ткани. На 70—80% паральдегид разрушается в печени, очевидно, путем превращения в ацетальдегид и его окисления в уксусную кислоту, которая в итоге превращается в С02 и воду. Остальная часть в основном выдыхается, придавая дыханию характерный резкий запах. Отравление паральдегидом вызывает ацидоз, геморрагический гастрит, жировую дистрофию печени, токсический гепатит и поражение почек.
Паральдегид используется при абстинентном синдроме (прежде всего алкогольном делирии у стационарных больных) и психомоторном возбуждении другой этиологии. Его применяли также у детей при судорогах, в том числе при эпилептическом статусе. Больные алкоголизмом во время лечения могут приобретать зависимость от паральдегида и впоследствии предпочитают его алкоголю, несмотря на неприятный вкус и запах.
Хлоралгидрат
Это вещество образуется при гидратации альдегидной группы трихлорацетальдегида. Раньше его использовали не только как снотворное, но и как средство с седативным действием у детей перед различными диагностическими и лечебными манипуляциями (например, в стоматологии).
Хлоралгидрат быстро восстанавливается в трихлорэтанол (СС13СН2ОН), в основном под действием алкогольдегидрогеназы в печени, и после приема внутрь в крови обнаруживается лишь небольшое количество исходного вещества. Снотворный эффект связывают прежде всего с этим метаболитом: показано, что in vitro он действует на ГАМКд-рецепторы подобно барбитуратам (Lovinger et al., 1993). Большая часть трихлорэтанола связывается с глюкуроновой кислотой и выводится почками.
Хлоралгидрат раздражает кожу и слизистые, из-за чего имеет неприятный вкус и вызывает боль в эпигастрии, тошноту и иногда рвоту; как правило, эти явления возникают при недостаточном разведении препарата и приеме натощак. Побочное действие на ЦНС включает дурноту, недомогание, атаксию и кошмары. Иногда возникает ощущение похмелья, хотя и реже, чем на фоне большинства барбитуратов и некоторых бензодиазепинов. Встречаются парадоксальные реакции в виде дезориентации, бессвязной речи и паранойи. Отравление хлоралгидратом вызывает желтуху. При длительном приеме хлоралгидрата может внезапно развиться острое отравление, угрожающее жизни, — из-за передозировки препарата или нарушения механизмов его детоксикации на фоне поражения печени; возможно также поражение почек. Внезапная отмена хлоралгидрата ведет к делирию и эпилептическим припадкам, без лечения летальность очень высока.
Этхлорвинол
Этот препарат по фармакодинамике очень близок к барбитуратам, обладая также противосудорожным и миорелаксирующим действием. При приеме внутрь он быстро всасывается. Препарат имеет большой объем распределения. Его фармакокинетику описывает двухкамерная модель; начальный Т 1/2 составляет 1—3 ч, конечный — 10—20 ч. В результате длительность действия относительно мала, и при приеме этхлорвинола на ночь больной может проснуться слишком рано. Около 90% препарата разрушается в печени. Этхлорвинол назначают короткими курсами для лечения бессонницы.
Основные побочные эффекты — мятный привкус во рту, онемение лица, дурнота, тошнота, рвота и артериальная гипотония. Нередко бывает ощущение легкого похмелья. Изредка возникают глубокий сон, мышечная слабость и обморок, не связанный с падением АД. Парадоксальные реакции колеблются от легкого стимулирующего эффекта до выраженного возбуждения и истерики. Аллергия к этхлорвинолу включает крапивницу, тромбоцитопению (редкое, но опасное для жизни осложнение) и, изредка, холестатическую желтуху. Отравление им напоминает отравление барбитуратами, но характерны более глубокое угнетение дыхания и относительная брадикардия. Этхлорвинол ускоряет печеночный метаболизм других препаратов (например, непрямых антикоагулянтов) и противопоказан при острой перемежающейся порфирии.
Мепробамат
Этот препарат, представляющий собой дикарбамат замещенного пропандиола, вошел в применение как транквилизатор в 1955 г. ФДА одобрило только это показание к нему но мепробамат широко использовался и продолжает использоваться и как снотворное. Вопрос о независимости анксиолитического эффекта мепробамата от седативного остается без ответа; его избирательное анксиолитическое действие у человека не доказано.
По фармакодинамике мепробамат во многом близок к бензодиазепинам: он также оказывает растормаживающее действие у экспериментальных животных в дозах, мало влияющих на двигательную активность, и не вызывает общую анестезию, несмотря на распространенное тормозящее действие в ЦНС. В отличие от бензодиазепинов, при отравлении он вызывает тяжелые и даже смертельные угнетение дыхания, артериальную гипотонию, шок и сердечную недостаточность. По-видимому, он оказывает некоторое обезболивающее действие при болезнях опорно-двигательного аппарата и усиливает анальгетический эффект других препаратов.
Мепробамат хорошо всасывается при приеме внутрь. Тем не менее в случае отравления в желудке могут возникать конкременты из нерастворившихся таблеток, поэтому требуется гастроскопия для их удаления. Большая часть препарата метаболизируется в печени, в основном путем окисления заместителей и конъюгации с глюкуроновой кислотой, скорость элиминации зависит от дозы. При длительном лечении Т|/2 может возрастать — несмотря на индукцию некоторых микросомальных ферментов печени.
Основные побочные эффекты седативных доз мепробамата — сонливость и атаксия, более высокие дозы резко нарушают координацию движений и способность к научению, замедляют реакцию. Подобно бензодиазепинам, мепробамат усиливает действие других веществ, угнетающих ЦНС.
Хотя клиническое значение мепробамата упало, он остается предметом злоупотребления. Мепробамат — активный метаболит центрального миорелаксанта каризопродола, также вызывающего зависимость и получившего распространение на черном рынке (Reeves et al., 1999). Наркоманы предпочитают мепробамат бензодиазепинам. Его резкая отмена вызывает абстинентный синдром, включающий тревожность, бессонницу, тремор и, нередко, галлюцинации, примерно у 10% больных возникают генерализованные эпилептические припадки; выраженность этих симптомов зависит от дозы.
Другие препараты
Этомидат — в/в анестетик, часто сочетаемый с фентанилом. Он удобен тем, что не угнетает дыхание и не снижает АД, хотя и оказывает отрицательное инотропное действие. За пределами США он применяется также как транквилизатор и снотворное средство — в блоках интенсивной терапии, при перемежающейся принудительной ИВЛ, эпидуральной анестезии и в некоторых других случаях. Поскольку препарат вводится в/в, его используют только в стационаре. Дозы, необходимые для общей анестезии, часто вызывают миоклонию, но она не возникает на фоне седативных и снотворных доз.
Таблица 17.5. Строение и свойства паральдегида, хлоралгидрата, этхлорвинола и мепробамата
Клометиазол обладает седативным, миорелаксирующим и противосудорожным действием. Он используется за пределами США при алкогольном абстинентном синдроме, а также для премедикации перед анестезией и как снотворное у пожилых, особенно в домах престарелых (Symposium, 1986b). Препарат мало угнетает дыхание и имеет широкий терапевтический диапазон, но нередки смертельные случаи из-за его взаимодействия с этанолом.
Безрецептурные средства
Согласно рекомендации ФДА, кроме ряда Н1блокаторов (доксиламина, дифенгидрамина и мепирамина), безрецептурные снотворные средства не должны включать никаких активных веществ. Несмотря на выраженное седативное побочное действие Н1блокаторов, наблюдаемое при лечении аллергических болезней, они далеко не всегда помогают при бессоннице. Очевидно, играют роль быстрое развитие толерантности, парадоксальная стимуляция ЦНС и недостаточность применяемых доз. Тем не менее иногда сохраняется выраженное угнетение ЦНС на следующий день (Т1/2 доксиламина и дифенгидрамина составляет около 9 ч).