Сокращение скелетных мышц
Содержание
Сокращение поперечно-полосатых мышц
Стимуляция мышечных волокон
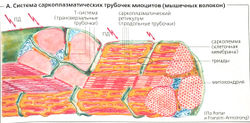
Высвобождение ацетилхолина вблизи двигательной концевой пластинки скелетной мышцы ведет к возникновению тока концевой пластинки, который распространяется электротонически и активирует быстрые потенциалзависимые Na+-каналы в сарколемме. Это ведет к возникновению потенциала действия (ПД), который проводится со скоростью 2 м/с вдоль сарколеммы всего мышечного волокна и быстро проникает в глубь волокна по Т-системе (А).
Генетические дефекты в структуре натриевых каналов замедляют их дезактивацию, что приводит к повышенной возбудимости с увеличением длительности сокращения и задержкой расслабления мышцы (миотония). Увеличение мышечной активности сопровождается массированным выходом ионов калия из волокна. Это приводит к гиперкалиемии, вследствие чего мышечный потенциал покоя достигает значений, при которых натриевые каналы более не могут быть активированы, и мышца оказывается временно парализована: семейный гилеркалиемический периодический паралич.
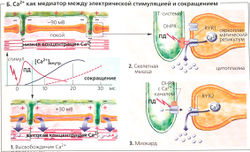
Переход от возбуждения к сокращению называется электромеханическим сопряжением (Б). В скелетной мышце этот процесс начинается с потенциала действия, возбуждающего зависимые от напряжения дигидропиридиновые рецепторы (DHPR) в сарколемме в районе триад. Эти рецепторы организованы в ряды, а напротив них в соседней мембране саркоплазматического ретикулума находятся ряды Са2+-каналов, называемых рианодиновыми рецепторами (RYR; в скелетных мышцах рианодиновый рецептор типа 1 - сокращенно RYR1). Каждый второй RYR1 ассоциирован с DHPR (Б2). RYR1 открываются, когда механически «ощущают» изменение конформации DHPR под действием потенциала действия. В миокарде каждый DHPR является частью потенциалзависимого Са2+-канала сарколеммы, который открывается в ответ на потенциал действия. Малые количества внеклеточного Са2+ входят в клетку через этот канал, приводя тем самым к открыванию миокардиального канала RYR2 (так называемый индуцирующий эффект Са2+, или «Са2+-вспышка», БЗ). Ионы Са2+, хранящиеся в СР, выходят через открытый RYR1 или RYR2 в цитоплазму, увеличивая цитоплазматическую концентрацию Са2+ до более чем 1 мкмоль/л по сравнению с концентрацией в покое —0,01 мкмоль/л (Б1). В скелетной мышце стимуляции DHPR на одном участке достаточно, чтобы запустить «дружное» открывание всей группы RYR1. Таким образом увеличивается надежность проведения импульса. Повышенная концентрация Са2+ в цитоплазме насыщает Са2+-связывающие сайты тропонина С, отменяя ингибиторный эффект тропомиозина на скольжение филаментов (Г), которое препятствует прочному (высокоаффинному) связыванию актина и миозина II.
У пациентов с генетическими дефектами RYR1 общая анестезия может приводить к массированному выбросу кальция, что вызывает сильные мышечные сокращения, сопровождающиеся стремительным и опасным для жизни повышением температуры тела: злокачественная гипертермия (=молниеносная гиперпирексия).
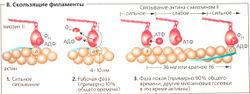
Молекулы АТФ необходимы для скольжения филаментов и, следовательно, для мышечного сокращения. Благодаря своей АТФазной активности миозиновые головки действуют как моторы (моторные белки) этого процесса. Миозиновые-ll и актиновые филаменты в саркомере организованы таким образом, что могут скользить друг по другу. Миозиновые головки соединяются с актиновыми филаментами под особым углом, образуя так называемые поперечные мостики (В1). Благодаря конформационным изменениям в районе нуклеотид-связывающего сайта миозина-ll, пространственные размеры которого увеличиваются согласованным движением участка шейки, миозиновая головка наклоняется, смещая за два последовательных «шага» тонкие филаменты в общей сложности на 4-12 нм (рабочий такт). Вторая миозиновая головка может также действует на соседний актиновый филамент, вызывая его сокращение. Затем головка отсоединяется и «напрягается», готовясь к следующему «гребку», когда свяжется с актином снова (ВЗ).
Кинезин, другой моторный белок, независимо двигается по микротрубочке посредством «шагания» двух своих головок (на 8 нм за цикл), как при перетягивании каната. В этом случае 50% цикла - «рабочее время» (коэффициент полезного действия 0,5). В скелетной мышце между двумя последовательными взаимодействиями с актином сам миозин-ll совершает «прыжок» на 36 нм (или на число нм, кратное 36, например, при быстром сокращении на 396 нм или более), чтобы достичь следующего (или 11-го) удобно расположенного актинсвязывающего сайта (ВЗ, прыжок от а к б). В то же время другие миозиновые головки, работающие на данном актиновом филаменте, должны сделать по крайней мере от 10 до 100 гребков примерно по 4 нм каждый. Коэффициент полезного действия головки миозина-ll, таким образом, от 0,1 до 0,01. Такое «разделение труда» между миозиновыми головками гарантирует, что некоторая доля миозиновых головок всегда готова совершить быстрое сокращение.
При скольжении филаментов Z-диски сближаются, и участки наложения тонких и толстых становятся шире, но их общая длина остается неизменной. Это приводит к укорачиванию 1-полосы и Н-зоны. Когда концы толстых филаментов «надвигаются» на Z-диск, происходит максимальное укорачивание мышцы и концы тонких филаментов перекрываются. Укорачивание саркомера, таким образом, происходит с обоих концов миозиновых пучков, но в противоположных направлениях.
Механизм мышечного сокращения
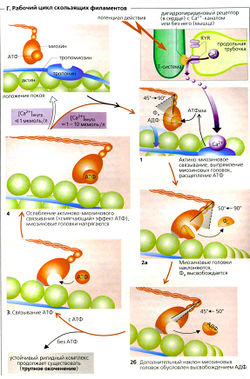
Каждая из двух головок молекул миозина-ll (М) связывает с помощью ионов Мg2+ одну молекулу АТФ в нуклеотид-связывающем сайте. Образовавшийся комплекс М-АТФ расположен под углом примерно 45° к остальной части молекулы (Г4). В этом состоянии миозин имеет очень слабое сродство к актину. Из-за воздействия повышенной концентрации Са2+ в цитоплазме на тропонин-тропомиозиновый комплекс актин (А) активирует миозиновую АТФазу, что приводит к гидролизу АТФ (АДФ + Фн) и образованию комплекса актин-миозин-АДФ-Фн (Г1). После этого головки миозина-ll вновь выпрямляются -результат этого конформационного изменения состоит в том, что константа ассоциации актина с миозином увеличивается на четыре порядка (В1, Г1). Фн (неорганический фосфат) отделяется от комплекса, что вызывает отклонение головки миозина на 40° (Г2а). Это приводит к тому, что актиновые и миозиновые филаменты скользят друг относительно друга (первая фаза рабочего такта). Последующее высвобождение АДФ вызывает вторую фазу сокращения, которая однозначно завершается финальным положением головок миозина (Г2б). Сохраняющийся актино-миозиновый комплекс (ригидный комплекс) устойчив и может быть превращен в присутствии АТФ в новый комплекс, где миозиновые головки слабо связаны с АТФ [«смягчающий» эффект АТФ] Г4). Большая подвижность покоящейся мышцы важна для таких процессов, как сердечное наполнение или расслабление мышцы-разгибателя во время быстрого сгибательного движения. Если в цитоплазме сохраняется концентрация Са2+ >10-6 моль/л, циклы И и Г4 начинаются заново. Это в основном зависит от того, поступит ли следующий потенциал действия. Чтобы обеспечить плавность сокращения, только часть миозиновых головок, которые тянут миозиновый филамент, «заняты делом» единовременно (низкий коэффициент полезного действия).
Ионы Са2+, высвобождаемые из саркоплазматического ретикулума (СР), постоянно закачиваются назад за счет активного транспорта при помощи Са2+-АТФазы, также называемой SERCA . Таким образом, если RYR-опосредованное высвобождение Са2+ из саркоплазматического ретикулума прерывается, то концентрация Са2+ в цитоплазме падает ниже 10-6 моль/л и скольжение филаментов прекращается (состояние покоя, Г, верхний левый угол).
Парвальбумин, белок, присутствующий в цитоплазме быстрых мышечных волокон (F-волокон), ускоряет расслабление мышц после короткой фазы мышечного сокращения посредством связывания Са2+ из цитоплазмы в обмен на Мg2+. Сродство парвальбумина к Са2+ выше, чем у тропонина, но ниже, чем у Са2+-АТФазы саркоплазматического ретикулума. Таким образом, парвальбумин действует как «медленный» Са2+-буфер.
Ход цикла скольжения филаментов, как он описан выше, в основном относится к изотоническому сокращению, т. е. к сокращению, в ходе которого происходит укорочение мышцы. В ходе строго изометрического сокращения, когда напряжение мышцы увеличивается, но длина мышцы остается неизменной, отклонение миозиновых головок и взаимное скольжение филаментов не может произойти. Вместо этого при изометрическом сокращении усилие достигается путем деформации миозиновых головок (ГЗ).
Мышечные волокна мертвого тела не производят АТФ. Это означает, что после смерти Са2+ больше не закачивается обратно в СР и запасы АТФ, необходимые для того, чтобы разрушить стабильный комплекс актин-миозин, скоро истощаются. Это приводит к окоченению мертвого тела (трупное окоченение), которое проходит только после разложения актина и миозина в мышечном волокне.
Механика скелетной мышцы
Потенциалы действия, генерируемые в мышечном волокне, увеличивают внутриклеточную концентрацию Са2+, [Са2+]внугр, инициируя сокращение (скелетная мышца; миокард). В скелетных мышцах регуляция силы сокращения достигается участием разного числа двигательных единиц и изменением частоты потенциала действия. Однократный стимул, если он выше порогового уровня, всегда ведет к максимальному высвобождению Са2+ и, таким образом, к максимально интенсивному однократному сокращению (реакция «все или ничего»). Тем не менее такой однократный стимул не индуцирует максимального укорочения мышечного волокна, поскольку он слишком короткий для поддержания скользящих филаментов в движении до достижения финальной позиции. Укорочение мышцы продолжается только в том случае, если второй стимул поступит до того, как мышца полностью расслабится после первого стимула. Такое повторение стимула ведет к нарастающей механической суммации, или суперпозиции, отдельных сокращений (А). Если частота стимуляции становится настолько высокой, что мышца уже не может расслабиться между стимулами, то наступает длительное максимальное сокращение двигательных единиц, или тетанус (А). Это происходит, например, при 20 Гц в медленно сокращающихся мышцах, и при 60-100 Гц в быстро сокращающихся мышцах. Мышечная сила во время тетануса может быть в четыре раза больше, чем при однократном сокращении. Концентрация Са2+ несколько уменьшается между суммирующимися стимулами, а при тетанусе остается высокой.
Окоченение, как и контрактура, характеризуются стойким укорачиванием мышц. Это состояние нужно отличать от тетануса. Контрактура вызывается не потенциалом действия, а стойкой локальной деполяризацией, например, вследствие увеличенной внутриклеточной концентрации К+ (К+-контрактура) или индуцированного высвобождения Са2+, например, в ответ на кофеин. Сокращение так называемых изотонических волокон (особых волокон внешних мышц глаза и мышечных веретен; с. 326) также одна из форм контрактуры. Изотонические волокна не отвечают на стимулы по закону «все или ничего», а сокращаются пропорционально величине деполяризации. Степень сокращения изотонических волокон регулируется изменением концентрации Са2+ в цитоплазме (не потенциалом действия!).
И напротив, общий мышечный тонус (рефлекторный тонус), или устойчивое напряжение скелетной мышцы в покое, относится к развитию нормального потенциала действия в отдельной двигательной единице. Единичные сокращения не могут быть зарегистрированы, поскольку двигательные единицы работают асинхронно. Например, лозные мышцы (поддерживающие осанку) при видимом покое находятся в непроизвольном напряжении. Тонус покоящейся мышцы регулируется рефлексами и увеличивается при повышении внимания.
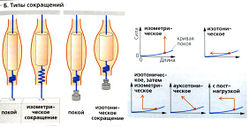
Типы сокращений
Существуют разные типы мышечных сокращений. При изометрическом сокращении мышечная сила (напряжение) изменяется, а длина мышцы остается постоянной. (В сердечной мышце этот тип представлен изоволюметрическим (изообъемным) сокращением, ведь длина мышцы определяет объем предсердия и желудочков.) При изотоническом сокращении длина мышцы меняется под действием постоянной мышечной силы. (В сердечной мышце этот тип представлен изобарным сокращением (при постоянном давлении) - мышечная сила определяет давление в предсердии или в желудочке.) При ауксотоническом сокращении мышечная длина и сила изменяются одновременно. Изотоническое или ауксотоническое сокращение, которое формируется на основе изометрического, называется сокращением с постнагрузкой.
Растяжимость мышцы
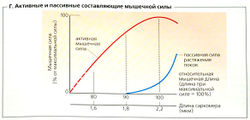
Покоящаяся мышца, содержащая АТФ, может быть растянута, как будто она резиновая. Сила, необходимая для начала расслабления мышцы (Г, Д, сила покоя), очень мала, но увеличивается экспотенциально в случае эластичной мышцы (см. кривую покоя, Г). Мышечное сопротивление растяжению, которое удерживает скользящие филаменты в саркомере от разделения, в какой-то степени зависит от фасций (фиброзной ткани). Основной фактор, однако, это гигантская нитевидная эластичная молекула, называемая титином (или коннектином; длиной 1000 нм, массой от 3 до 3,7 МДа), которая включена в саркомер (6 молекул титина на миозиновый филамент). В районе полосы А каждого саркомера титин расположен около миозинового филамента и помогает удерживать его в центре саркомера. Молекулы титина в районе полосы I гибкие и функционируют в качестве «эластичных тяжей», которые противодействуют пассивному сокращению мышцы и влияют на скорость ее укорачивания.
Растяжимость молекулы титина (титин может вытягиваться до примерно десятикратного размера по сравнению с первоначальной длиной в скелетной мышце и немного меньше в сердечной мышце) определяется частым повторением последовательности PEVK (пролин-глутамат-валин-лизин). При очень сильном растяжении мышцы, которое представлено самым крутым участком кривой покоя (Г), также разворачиваются элементы глобулярной цепи, называемые доменами иммуноглобулина С2. Чем быстрее сокращается мышца, тем более неожиданным и резким будет действие этого «поглотителя шока».
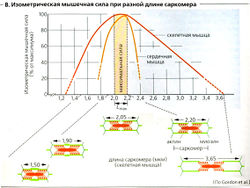
Длина (L) и сила (F), или «напряжение», мышцы тесно взаимосвязаны (В, Д). Общая сила мышцы является суммой ее активной силы и ее напряжения в покое, как было описано выше. Поскольку активная сила определяется величиной всех потенциальных актино-миозиновых взаимодействий, она варьирует в соответствии с начальной длиной саркомера (В, Г). Скелетная мышца может развить максимальную активную (изометрическую) силу (F0) от своей длины покоя (Lmax; длина саркомера примерно от 2 до 2,2 мкм; В). Когда саркомеры укорачиваются, (L < Lmax), часть тонких филаментов перекрывается - развиваемая сила меньше Fq (В). При L —0,7 /тах (длина саркомера 1,65 мкм) толстые филаменты контактируют с Z-диском - F еще меньше. Кроме того, способность предварительно растянутой мышцы [L > развивать силу ограничена, поскольку ограничено количество потенциально доступных актино-миозиновых мостиков (В). При растяжении до 130% или более величины Lmax сила растяжения в покое становится основной составляющей общей мышечной силы (Д).
Кривая «длина-сила» соответствует сердечной диаграмме «давление-объем», где длине соответствует объем наполнения желудочка, а силе -давление в желудочке. Концентрация Са2+ в цитоплазме может влиять на соотношение давление/объем из-за изменения сократимости.
Другие важные функциональные различия между сердечной и скелетной мышцами перечислены ниже.
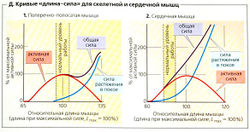
Поскольку скелетная мышца, по сравнению с сердечной, более эластична, пассивная сила растяжения сердечной мышцы в покое больше, чем таковая скелетной мышцы (Д1, 2)
В норме скелетная мышца функционирует в области плато кривой «длина-сила», тогда как сердечная мышца в норме работает на восходящем участке (ниже Lmax) кривой (которая не имеет плато) (В, Д1, 2). Следовательно, желудочек отвечает на увеличение диастолического наполнения увеличением развиваемой силы (механизм Франка-Старлинга). В сердечной мышце растяжение также воздействует на чувствительность тропонина к Са2+, что дает более крутую кривую (Д2).
Потенциал действия в сердечной мышце гораздо продолжительнее, чем в скелетной мышце, потому что gK< понижается со временем, а gCа увеличивается за 200-500 мс после быстрой инактивации Na+-каналов. Это вызывает медленный приток Са2+, в результате чего потенциал действия достигает плато. Таким образом, период рефрактерности не заканчивается почти до конца сокращения. Следовательно, тетанус в сердечной мышце невозможен.
В отличие от скелетной мышцы, в сердечной мышце нет двигательных единиц. Вместо этого стимул распространяется по всем волокнам предсердий, а потом желудочков, вызывая сокращение по принципу «все или ничего» обоих предсердий и желудочков.
В сердечной мышце, но не в скелетных, продолжительность потенциала действия может менять силу сокращения, которая контролируется варьированием притока Са2+ в клетку.
Чем больше сила (нагрузка), тем ниже скорость изотонического сокращения (см. диаграмму «скорость-сила», E1). Максимальная сила с небольшим количеством тепла - в отсутствие укорочения. Максимальная скорость (примерно 7 м/с в бицепсах) и много тепла - в отсутствие нагрузки. Сокращения с незначительной нагрузкой, таким образом, могут быть совершены гораздо быстрее, чем с тяжелой нагрузкой (Е2). Общее количество энергии, потребляемое для работы и теплообмена, больше при изотоническом сокращении, чем при изометрическом. Мощность мышцы - это произведение силы на скорость укорочения: Н • м • с-1 = Вт (Е1, закрашенные области диаграммы).
Энергетическое обеспечение мышечного сокращения
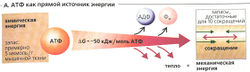
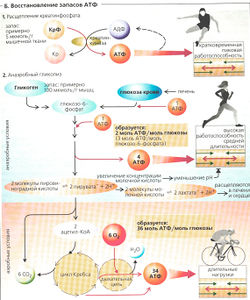
Аденозинтрифосфат (АТФ) - прямой источник химической энергии для мышечного сокращения (А). Однако мышечная клетка содержит лишь ограниченное количество АТФ, например его может быть достаточно для преодоления спринтером около 10-20 м. Следовательно, потраченный АТФ должен постоянно возобновляться, чтобы поддерживать внутриклеточную концентрацию АТФ на постоянном уровне, даже когда он требуется в больших количествах. Существуют три основных пути восстановления запасов АТФ (Б).
1. Дефосфорилирование креатинфосфата.
2. Анаэробный гликолиз.
3. Аэробное окисление глюкозы и жирных кислот.
Пути 2 и 3 относительно медленные; так что именно креатинфосфат (КрФ) должен обеспечивать необходимую химическую энергию для быстрого восстановления запасов АТФ. АДФ, образующийся из АТФ, немедленно превращается митохондриальной креатинкиназой в АТФ и креатин (Кр) (Б1). Запас креатинфосфата в мышце достаточен для кратковременных интенсивных нагрузок длительностью 10-20 с (например, в организме спринтера на 100-метровой дистанции).
Анаэробный гликолиз начинается позже, чем дефосфорилирование креатинфосфата (самое большее через 30 с). При анаэробном гликолизе мышечный гликоген превращается через глюкозоб-фосфат в молочную кислоту (лактат + Н+), образуя в результате по 3 молекулы АТФ на каждый остаток глюкозы (Б2). Во время небольшой физической нагрузки лактат расщепляется в сердце и печени, при этом используются ионы Н+. Приблизительно на 1 мин позже этого малопродуктивного механизма регенерации АТФ начинается аэробное окисление глюкозы и жирных кислот. Если во время интенсивных упражнений аэробное окисление не производит достаточного количества АТФ, анаэробный гликолиз продолжается.
В этом случае глюкоза должна импортироваться из печени, где она образуется посредством гликогенолиза и глюконеогенеза. При этом образуется только две молекулы АТФ на каждую молекулу глюкозы, поскольку одна молекула АТФ необходима для фосфорилирования самой глюкозы по положению 6.
Аэробное восстановление запасов АТФ из глюкозы (около 32 молекул АТФ на остаток глюкозы) или из жирных кислот требуется в случае продолжительных нагрузок (БЗ). Минутный сердечный выброс = сердечный ритм х ударный объем сердца) и общая легочная вентиляция при этом должны быть увеличены, чтобы удовлетворять возросшим потребностям метаболизма в мышце; затем сердечный ритм становится постоянным. Несколько минут, которые проходят до того, как достигается это стационарное состояние, преодолеваются за счет анаэробного производства энергии, увеличенного поглощения O2 из крови и использования небольших резервов О2 в мышце (О2, связанного с миоглобином). Промежуток времени между двумя фазами часто воспринимается как «низшая точка» физической нагрузки.
Сродство к О2 у миоглобина выше, чем у гемоглобина, но ниже, чем у ферментов дыхательной цепи. Таким образом, миоглобин обычно насыщен Од и может передать кислород митохондриям при временной недостаточной поставке кислорода артериями.
Функциональные резервы сердца у тренированных спортсменов оцениваются в 370 Вт (~ 0,5 л. с.), и в основном это зависит от скорости, с которой поступает О2, а также от того, как быстро происходит аэробное окисление. Если резервы превышены, стационарное состояние не может быть достигнуто - сердечный ритм постоянно растет. Мышцы могут временно компенсировать дефицит энергии (см. выше), но метаболизм лактата не может успевать за устойчиво высокой скоростью анаэробного восстановления запасов АТФ. Вследствие этого развивается лактацидоз, т. е. появляется избыток лактата и ионов Н+. Если субъект превышает свои резервы сердца примерно на 60%, что почти эквивалентно максимальному потреблению кислорода, то концентрация лактата в плазме резко повышается, достигая так называемого анаэробного порога 4 ммоль/л. С этого момента значительное увеличение исполняемой физической работы невозможно. Системное понижение pH приводит к увеличению ингибирования химических реакций, необходимых для мышечного сокращения. Это ведет к дефициту АТФ, быстрой мышечной утомляемости и, в конце концов, к остановке мышечной работы.
Метаболизм креатинфосфата и анаэробный гликолиз позволяют организму совершать в 3 раза больше мышечной работы, чем это возможно при аэробном восстановлении запасов АТФ, хотя только в течение примерно 40 с. Однако эти процессы приводят к дефициту 02 который должен быть компенсирован в течение постнагрузочного восстановительного периода (кислородный долг). Организм «оплачивает» этот долг путем восстановления своих резервов энергии и разрушением избытка лактата в печени и сердце. После интенсивной нагрузки кислородный долг гораздо больше (до 20 л) по сравнению с тем дефицитом кислорода, который возникает по другим причинам.