Поперечно-полосатые мышцы
Содержание
Поперечно-полосатые скелетные мышцы
Источник: «Спортивная диагностика»
Автор: профессор В.П. Губа, 2016 год
Автор: Claudia Koch-Remmele
Строение поперечно-полосатых скелетных мышц
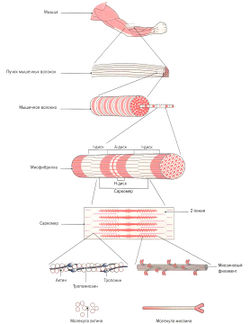
Скелетная мышца состоит из многочисленных пучков мышечных волокон (фасцикул), видимых невооруженным глазом. Один пучок мышечных волокон состоит приблизительно из 10-20 параллельно расположенных мышечных волокон. Каждое мышечное волокно, в свою очередь, содержит 1000-2000 миофибрилл (Silbernagl, Despopoulos, 1983; Klee, 2003). Каждая миофибрилла образована несколькими тысячами последовательно расположенных саркомеров (Linde), 2006), которые являются сократительными элементами мышечного волокна (рис. 1.1).
Поперечно-полосатое мышечное волокно представляет собой мельчайшую самостоятельную структурную единицу скелетной мышцы. Это одиночная цилиндрическая клетка, длина которой может достигать от нескольких миллиметров до 30 см (Cabri, 1999). Наиболее длинными мышечными волокнами в организме человека обладает портняжная мышца (m. sartorius), один из сгибателей бедра. Толщина мышечного волокна зависит от клеточного питания (трофики) и нагрузки на мышцу и варьирует от 10 до 100 мкм. Например, мышцы бедра имеют очень толстые мышечные волокна, тогда как мышцы глазного яблока состоят из тонких волокон (Cabri, 1999). Толщина мышечных волокон в мышце относительно постоянна. Таким образом, брюшко мышцы формируется не из-за утолщения волокон в центре мышцы, а из-за неравной длины мышечных волокон, накладывающихся друг на друга, что образует веретенообразную форму мышцы. Мышечное волокно имеет несколько сотен ядер, объединенных одной клеточной мембраной (сарколеммой) и расположенных в цитоплазме (саркоплазме). В саркоплазме мышечных волокон находятся сократительные миофибриллы, саркоплазматический ретикулум (разновидность эндоплазматического ретикулума), митохондрии (саркосомы), лизосомы, капельки жира и гранулы гликогена. Помимо этого, в саркоплазме растворены молекулы креатинфосфата, аминокислоты, гликолитические ферменты, гликоген и другие вещества. Большую часть саркоплазмы занимают миофибриллы. Они тянутся от одного конца волокна к другому и имеют толщину около 1-2 мкм (Cabri, 1999). При изучении под электронным микроскопом видно, что каждая мио-фибрилла состоит из двух белковых миофиламентов (см. рис. 1.1).
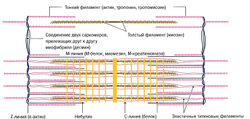
- Актиновые миофиламенты — имеют в поперечнике около 5-8 нм (Tillmann, 1998; Klee, 2003). Вокруг актина дополнительно закручены нити тропомиозина, а на равных интервалах (примерно каждые 40 нм) прикрепляются молекулы тро-понина (Silbernagl, Despopoulos, 1983). Тропонин (Тп) состоит из трех субъединиц: Tn-С (образует связь с Са2+), Тп-Т (соединяет тропонин с тропомиозином) и Тп-I (блокирует образование мосто-видных связей между миозином и актином в состоянии покоя). При соединении субъединицы Тп-С с ионами кальция это тормозящее действие прекращается и актиновые филаменты прикрепляются к Z-линии.
- Миозиновые филаменты — расположены между филаментами актина. Миозиновые филаменты образованы из пучка плотно соединенных молекул миозина (около 150-360) и составляют 1,6 мкм в длину и 10-14 мкм в толщину. Молекулы миозина имеют двойные головки, прикрепляющиеся с помощью шейки к шарнирному участку (тяжелый меромиозин). Шейка молекулы обеспечивает ее подвижность и переходит в длинную хвостовую нить (легкий меромиозин). Благодаря шарнирным участкам миозин может образовывать обратимые связи с актином и вызывать взаимное скольжение нитей актина и миозина относительно друг друга.
Отрезок между Z-линиями называется саркомером. Микроскопически саркомер состоит из чередующихся светлых и темных полосок и линий, обусловленных упорядоченным расположением толстых нитей актина и тонких нитей миозина. Благодаря различному преломлению света актиновыми и миозиновыми филаментами формируется характерная поперечная исчерченность мышечного волокна. Актиновые филаменты в меньшей степени преломляют свет (изотропные) и выглядят как светлые линии, в то время как сильно преломляющие свет миозиновые филаменты (анизотропные) выглядят темными полосками под микроскопом. Отрезок между двумя соседними саркомерами, содержащий только нити актина, называется I-диском (см. рис. 1.1). В середине I-диска видна темная линия — Z-линия — граница саркомера. Между двумя I-дисками расположен A-диск, состоящий как из миозина, так и из актина. В середине A-диска в состоянии расслабления виден еще один светлый промежуток — Н-диск, — содержащий только миозин. При сокращении нити актина сдвигаются к центру миозинового филамента и Н-диск исчезает. Длина саркомера в состоянии покоя, по данным литературы, варьирует и составляет от 2,0 (Trombitas et al., 1998) до 2,2 мкм (Klee, 2003).
Помимо актина и миозина в мышечном волокне содержатся и другие белки (рис. 1.2). В отличие от вышеперечисленных белков они не относятся к сократительным. Их функцией является поддержание структурной организации внутренних компонентов мышечного волокна, благодаря чему достигается стабилизация волокна во всех плоскостях и его внутренние компоненты могут выдерживать внешние и внутренние нагрузки как в продольном, так и в поперечном направлении. Эти белки образуют следующие третичные филаменты (Maruyama et al., 1984; Street, 1983).
- Небулиновые филаменты — состоят из белка небулина и расположены параллельно тонким актиновым нитям. Небулиновые филаменты прикрепляются к Z-линиям и стабилизируют актиновые филаменты и контролируют расположение молекул актина (Cabri, 1999).
- Титиновые филаменты (коннектиновые филаменты) — состоят из одной молекулы белка титина. Данные филаменты длиной 1 нм в натянутой мышце занимают половину саркомера, соединяя М-линию и Z-линию (Maruyama et al., 1984). Титиновые филаменты расположены параллельно нитям миозина и прикрепляются к их свободным концам. Миозиновый комплекс, соединяясь с 3-6 титиновыми филаментами, образует функциональную единицу (Klee, 2003). Ее функцией является удерживание миозиновых филаментов при сокращении в центре саркомера. Между Z-линией и концами нитей миозина они образуют высокоэластичную PEVK-область [образуемую пролином (Pro или Р), глутаминовой кислотой (Glu или Е), валином (Val или V) и лизином (Lys или К); Linke et al., 1996]. Благодаря наличию этого эластичного участка саркомер может восстанавливать свою изначальную длину (длину в покое) после растяжения за счет притягивания миозиновых филаментов к Z-линиям. Это позволяет восстановить оптимальное взаиморасположение актиновых и миозиновых нитей. Таким образом, титиновые филаменты ответственны за остаточное напряжение мышц при их расслаблении (тонус мышцы) (Wiemann et al., 1998) (см. разд. 3.6.7).
- Промежуточные филаменты — расположены перпендикулярно направлению сократительных филаментов. а-Актин спиралеобразно окружает Z-линию и участвует в стабилизации актиновых филаментов. Белок десмин прикрепляется к сарколемме и соединяет друг с другом соседние миофибриллы, стабилизируя таким образом мышечное волокно в поперечном направлении (Street, 1993; Wang, 1984). Это позволяет сохранить структуру А- и I-дисков и поперечную исчерченность мышечных волокон.
- Поперечно расположенные М-белки, миомезин и М-креатинкиназы (М-КК) образуют в центре Н-диска так называемую М-линию. Миомезин при этом играет функцию якоря для титина, М-КК обеспечивает образование АТФ, а М-белок соединяет друг с другом и удерживает миозиновые филаменты.
- С-белки образуют С-линии. Продольно расположенные филаменты из С-белка стабилизируют миозиновые нити в саркомере.
- Короткие филаментные и глобулярные белки — расположены в сарколемме (а- и β-интегрин), в саркоплазматической мембране (дистрофии, талин, винкулин) и вне сарколеммы (ламинин и фибронектин), контактируя с оболочкой сократительных волокон.
![]() Запомните: Саркомер состоит из тонких актиновых и толстых миозиновых филаментов, а также несократительных «третичных филаментов». Несколько тысяч последовательно расположенных саркомеров образуют миофибриллу. Большое количество рядом расположенных миофибрилл, в свою очередь, формирует мышечное волокно. Параллельно расположенные мышечные волокна образуют пучок мышечных волокон (фасцикулу), из которых состоит анатомически определяемая мышца.
Запомните: Саркомер состоит из тонких актиновых и толстых миозиновых филаментов, а также несократительных «третичных филаментов». Несколько тысяч последовательно расположенных саркомеров образуют миофибриллу. Большое количество рядом расположенных миофибрилл, в свою очередь, формирует мышечное волокно. Параллельно расположенные мышечные волокна образуют пучок мышечных волокон (фасцикулу), из которых состоит анатомически определяемая мышца.
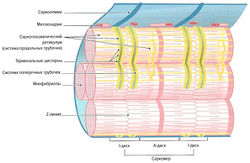
Миофибриллы окружены эндоплазматическим ретикулумом, который в мышцах называется саркоплазматическим ретикулумом. Он представляет собой систему продольно расположенных плоских разветвленных трубочек, соединенных между собой (L-система, продольная система) и отграниченных от сарколеммы и межклеточного пространства (рис. 1.3).
Около Z-линий на протяжении всей миофибриллы саркоплазматический ретикулум образует мешковидные расширения (терминальные цистерны). Эта органелла играет роль резервуара ионов кальция и ответственна за их накопление и обратный захват. К саркоплазматическому ретикулуму также можно отнести поперечную систему (Т-система, Т-трубочки). Под поперечными трубочками понимают систему вертикально расположенных выпячиваний сарколеммы, соединяющих ее с экстрацеллюлярным пространством. Данные выпячивания диаметром около 50 нм располагаются по бокам от Z-линий (Forssmann, 1985). Они выполняют роль ионных каналов, которые открываются и закрываются в зависимости от потенциала действия. Кроме этого, они обусловливают быстрое проведение потенциала действия от поверхности клеточной мембраны к центру клетки и одновременное сокращение всех миофибрилл внутри одного мышечного волокна. В определенных местах поперечные трубочки располагаются между двумя L-цистернами продольной системы, образуя так называемую триаду. За счет накопления мембранного потенциала в щелевидных контактах (T-L-соединение) происходит распространение возбуждения по L-системе всей мышечной клетки, что вызывает высвобождение ионов кальция.
Другими важными компонентами саркоплазмы являются митохондрии, в мышечных волокнах называемые саркосомами. Количество саркосом варьирует в зависимости от типа мышечных волокон. Саркосомы находятся между миофибриллами или непосредственно под сарколлемой (см. рис. 1.3). В центре волокна саркосомы расположены либо циркулярно вокруг Z-линии, либо между миофибриллами. Между миофиблиллами в виде «ожерелий» находятся маленькие гранулы гликогена. Их также в больших количествах обнаруживают около клеточного ядра. Часто около митохондрий в саркоплазме видны липиды в виде маленьких капель. Количество липидов в мышечном волокне зависит от его типа.
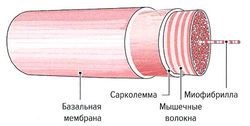
Сократительные элементы мышечных волокон и все компоненты саркоплазмы окружены клеточной мембраной (сарколеммой). Сарколемма представляет собой эластичную способную к возбуждению мембрану, функцией которой является открытие и закрытие ионных каналов в ответ на возбуждающие стимулы и их дальнейшая передача по Т-системе. Сарколемма, в свою очередь, окружена базальной мембраной, которая отделяет мышечные волокна от соединительной ткани мышцы (рис. 1.4).
Помимо сократительных элементов скелетные мышцы состоят из соединительной ткани, окружающей мышцы и содержащей кровеносные сосуды и нервы.
Соединительная ткань поперечно-полосатых мышц
Соединительная ткань является важным компонентом скелетных мышц и образует вместе с мышечными волокнами функциональную единицу мышцы. Помимо соединительной ткани брюшка мышц к ней относят и соединительную ткань мышечно-сухожильных соединений, сухожилий и костно-сухожильных соединений. Основными компонентами соединительной ткани мышц являются фибробласты и межклеточный матрикс. Межклеточный матрикс состоит из коллагеновых и эластических волокон (причем эластические волокна представлены в небольшом количестве), основного вещества (протеогликаны и глюкозаминогликаны), неколлагеновых соединительных и структурных белков и воды. Соединительная ткань под микроскопом имеет вид белой хрупкой паутинообразной сети (van den Berg, 1999). Тем не менее именно благодаря большому количеству соединительной ткани достигается большая стабильность мышечных волокон и хорошая механическая защита — как при сокращении (утолщение брюшка мышцы), так и при растяжении. Соединительная ткань обеспечивает хорошую смещаемость волокон и пучков волокон относительно друг друга во время цикла сокращений, а также самой мышцы относительно окружающих тканей. Кроме того, она уменьшает потерю силы за счет снижения трения. Соединительная ткань передает силу сокращения мышечных волокон через сухожилия к костям и делает возможными движения в суставах или стабилизацию позы. Соединительнотканная прослойка, прикрепляющаяся непосредственно к базальной мембране волокон и разделяющая их, называется эндомизием. Группы волокон разделяются более плотными перегородками, перимизием, и образуют пучки мышечных волокон (фасцикулы). Эпимизий представляет собой слой рыхлой соединительной ткани, соединяющий пучки волокон и окружающий каждую анатомически выделяемую мышцу. Соединительнотканные слои соединяются между собой и богаты нервами, кровеносными и лимфатическими сосудами. Соединительная ткань мышечного брюшка и базальная мембрана волокон также плотно соединяются друг с другом: с помощью ретикулярных волокон, а также поперечными мостовидными нитями (перекрестные волокна) между слоями. Соединение тканей обеспечивается неколлагеновыми связывающими белками (винкулин, талин, а-актин, интегрин, витронектин, ламинин, тенасцин и фибронектин) в мембранах (базальная мембрана, сарколемма) (van den Berg, 1999). К эпимизию прилегает фасция мышцы (собственная фасция), придающая мышце ее анатомическую форму и отграничивающая ее от прилегающих тканей. Часто между эпимизием и фасцией может находиться жировая ткань, играющая роль прокладки и хранилища энергетических ресурсов. К собственной фасции мышцы, в свою очередь, прилегают мышечные фасции, которые объединяют на конечностях группы мышц (например, мышцы-разгибатели плеча).
![]() Запомните: Отдельные мышечные волокна разделяются соединительнотканными перегородками — эндомизием. Перимизий окружает пучки мышечных волокон (фасцикулы), а эпимизий окружает анатомически выделяемую мышцу. Поверх эпимизия расположена собственная фасция мышцы. Группы мышц объединяются общими мышечными фасциями в единые функциональные группы (например, мышечная фасция мышц-сгибателей плеча).
Запомните: Отдельные мышечные волокна разделяются соединительнотканными перегородками — эндомизием. Перимизий окружает пучки мышечных волокон (фасцикулы), а эпимизий окружает анатомически выделяемую мышцу. Поверх эпимизия расположена собственная фасция мышцы. Группы мышц объединяются общими мышечными фасциями в единые функциональные группы (например, мышечная фасция мышц-сгибателей плеча).
Типы мышечных волокон
В зависимости от выполняемой функции мышца может состоять из различных типов мышечных волокон. Из-за своей способности сокращаться и расслабляться за доли секунды экстрафузальные волокна также называют быстросокращающимися волокнами (англ, twitch-fibers). В зависимости от специфической структуры (изоформ) ферментов и белков в миофибриллах, например наличия тяжелых миозиновых цепей (МНС — myosin heavy chain), и их распределения в мышечных волокнах выделяют несколько типов мышечных волокон. По морфологическим, биохимическим и физиологическим особенностям выделяют два типа экстрафузальных мышечных волокон:
- волокна I типа (МНС-I), или медленные волокна;
- волокна II типа (МНС-Н), или быстрые волокна.
Волокна I типа (МНС-I), или медленные (окислительные) волокна, — тонкие мышечные волокна диаметром 50 мкм, характеризующиеся относительно медленными сокращениями (с частотой 20-30 Гц). При этом они развивают небольшую силу и медленно утомляются. Волокна I типа хорошо кровоснабжаются и в отличие от волокон II типа имеют большее количество миоглобина, что придает им характерный красный цвет (красные волокна). Они также отличаются наличием многочисленных крупных митохондрий, содержащих ферменты окислительного фосфорилирования. Хотя в медленных волокнах больше миозина, чем в быстрых мышечных волокнах, они содержат меньше фермента АТФазы и медленнее сокращаются. Иннервация обеспечивается малыми а-мотонейронами спинного мозга. Благодаря низкой скорости сокращения они больше приспособлены к длительным нагрузкам, что, например, очень важно для поддержания позы.
Волокна II типа (МНС-II), или быстрые волокна, — толще, чем мышечные волокна I типа, и достигают в диаметре 80-100 мкм. Они отличаются быстрыми сокращениями (частота 50-100 Гц), развивают большую силу и быстрее утомляются. Эти волокна хуже кровоснабжаются и имеют меньше митохондрий, липидов и миоглобина. В литературе они описываются как белые волокна. В отличие от медленных волокон, быстрые волокна содержат в основном ферменты анаэробного окисления и больше миофибрилл. Эти миофибриллы отличаются меньшим содержанием миозина, который, однако, сокращается быстрее и лучше метаболизирует аденозинтрифосфат (АТФ). Кроме того, в этих волокнах лучше выражен саркоплазматический ретикулум. Благодаря высокой скорости сокращения и быстрой утомляемости эти волокна способны на кратковременную работу. Иннервация осуществляется большими а-мотонейронами спинного мозга. По данным литературы, волокна II типа разделяют на три группы (Forssman, 1985).
- Волокна IIа типа — быстрые волокна, средней толщины. Более выносливы, чем волокна IIЬ типа, но утомляются быстрее, чем волокна I типа. Способны к выраженному сокращению, при этом развивают среднюю силу. Источниками энергии являются как окислительные, так анаэробные механизмы (быстрые окислительные волокна).
- Волокна IIЬ типа(волокна IIх типа) — крупные, быстро сокращающиеся и быстро утомляющиеся волокна. Активируются при кратковременных нагрузках и развивают большую силу. Получают энергию через процессы анаэробного окисления, источником энергии является гликоген (быстрые гликолитические волокна). В этих волокнах обнаруживают большое количество гликогена и мало митохондрий. Поскольку скорость сокращения самых быстрых мышечных волокон несколько выше, чем скорость сокращений волокон IIЬ типа, самые быстрые волокна называются в литературе волокнами IIх типа (Friedman, 2007).
- Волокна IIс типа — эти волокна не похожи на волокна ни I, ни II типа. Они проявляют как окислительную, так и гликолитическую активность и представлены лишь в небольшом количестве (около 1 %). В зависимости от типа тренировок они могут переходить в волокна I или II типа (Seidenspinner, 2005).
Медленные и быстрые мышечные волокна представлены в любой мышце организма человека, различаются лишь их соотношения. Так, в мышцах, для функции которых необходимы кратковременные сильные сокращения, больше быстрых волокон (фазные мышцы), а в мышцах опоры и поддержания позы (постуральные, или тонические, мышцы) больше медленных волокон. Мышечные волокна в пределах одной моторной единицы всегда относятся к одному типу. Считается, что процентное соотношение быстрых и медленных волокон генетически детерминировано и, как правило, сопоставимо (около 40-50 % волокон I типа и около 50-60 % волокон II типа у нетренированных лиц; Seidenspinner, 2005). Конечно, возможны генетически обусловленные исключения, например у прирожденного стайера содержание волокон I типа может достигать 90 %, а у прирожденного спринтера может быть до 90 % волокон II типа (Hollmann, Hettinber, 1990; Weineck, 2003). В научной литературе описано, что при интенсивных тренировках на выносливость возможна трансформация белых волокон II типа в красные волокна I типа. Также возможна трансформация внутри II типа из волокон IIЬ (IIх) в На (Tillmann, 1998). Переход красных волокон I типа в белые волокна II типа описан только в небольшом количестве исследований (Kadi et al., 2005; Liu et al., 2003). Это можно объяснить тем, что скорость сокращения мышц трудно поддается тренировке (Seidenspinner, 2005).
|
Обзор важнейших мышечных волокон и их физиологических особенностей | |||
|
Тип мышечных волокон |
I |
IIа |
IIb (IIх) |
|
Цвет |
Красный |
Красный |
Белый |
|
Содержание гемоглобина |
++ |
+/- |
- |
|
Утомляемость |
- |
От — до +/- |
+ |
|
Обмен веществ |
Окислительный |
Окислительный и гликолитический |
Гликолитический |
|
Активность миозин-АТФазы |
- |
От +/- до + |
+ |
|
Активность лактатдегидрогеназы (ЛДГ) |
- |
От +/- до + |
+ |
|
Скорость сокращений |
- |
+ |
++ |
ПРИМЕЧАНИЕ : ++ — очень высокий; + — высокий; +/--средний;--низкий.