Состав и функции крови
Содержание
Состав и функции крови[править | править код]
Объем крови у взрослого человека соответствует его массе тела (без жировой ткани) и составляет при массе тела 70 кг примерно 4-4,5 л у женщин (♀) и 4,5-5 л у мужчин (табл.). Функции крови включают в себя транспорт различных молекул (О2, СО2, питательные вещества, метаболиты, витамины, электролиты и т. д.), поддержание (регуляцию) температуры тела и передачу сигналов (гормонов), а также буферные свойства и иммунную защиту. Кровь состоит из жидкости (плазмы) и форменных элементов (см. табл.). Красные кровяные клетки (эритроциты) транспортируют О2 и играют важную роль в регуляции pH. Белые кровяные клетки (лейкоциты) можно подразделить на нейтрофильные, эозинофильные и базофильные гранулоциты, моноциты и лимфоциты. Нейтрофилы играют важную роль в неспецифической иммунной защите, тогда как моноциты и лимфоциты участвуют в специфическом иммунном ответе. Кровяные пластинки (тромбоциты) необходимы для гемостаза. Гематокрит (Hct) - это часть объема крови, приходящаяся на долю эритроцитов (отношение объема красных кровяных клеток ко всему объему крови) (В и табл.). Плазма - это жидкая часть крови, в которой растворены электролиты, питательные вещества, метаболиты, витамины, гормоны, газы и белки.
Белки плазмы (см. табл.) участвуют в гуморальной иммунной защите и определяют онкотическое давление, которое позволяет поддерживать объем крови на постоянном уровне. Благодаря связыванию с белками крови (плазмы крови) нерастворимые в воде компоненты могут транспортироваться кровью, а многие вещества (например, гем) могут быть защищены от распада и от выведения через почки. Связывание небольших молекул с белками плазмы уменьшает коллоидо-осмотическое (онкотическое) давление. Многие белки плазмы участвуют в свертывании крови и в фибринолизе. Сыворотка образуется при отделении фибриногена от плазмы путем свертывания крови.
Таблица
Объем крови, л/масса тела (m, кг)
♂ 0,041 • m (кг) + 1,53; ♀ 0,047 • m (кг) + 0,86
Гематокрит (Hct; объем эритроцитов/объем крови):
♂ 0,40-0,54 ♀ 0,37-0,47
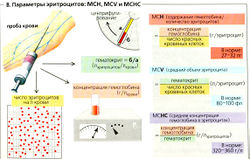
Эритроциты (1012/л крови = 10 6 /мкл крови):
♂ 4,6-5,9 ♀ 4,2-5,4
Гемоглобин (г/л крови):
♂ 140-180 ♀ 120-160
МСН - среднее содержание гемоглобина в эритроците;
MCV - средний объем эритроцита;
МСНС - средняя концентрация гемоглобина в эритроците (В).
Лейкоциты (109/л крови = 103/мкл крови);
3-11 (64% гранулоцитов, 31% лимфоцитов, 6% моноцитов)
Тромбоциты (109/л крови = 103/мкл крови):
♂170-360 ♀ 180-400
Белки плазмы (г/л сыворотки):
66-85 (включая 55-64% альбумина)
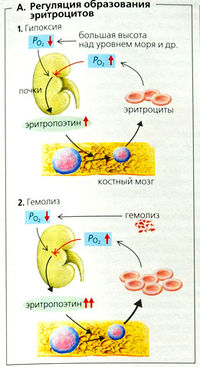
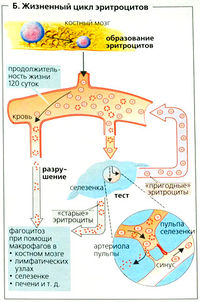
Эритропоэз (кроветворение) происходит в красном костном мозге плоских костей у взрослого и в селезенке и печени у плода. Кроветворная ткань содержит плюрипотентные стволовые клетки, которые под действием кроветворных ростовых факторов (см. ниже) развиваются в миелоидные, эритроидные и лимфоидные клетки-предшественники. Поскольку плюрипотентные стволовые клетки являются самовоспроизводящимися, они существуют на всем протяжении жизни. При дифференцировке лимфоциты, происходящие от лимфоидных клеток-предшественников, вначале претерпевают специфическую дифференцировку (в тимусе или костном мозге), а потом оформляются в селезенке и лимфатических узлах, а также в костном мозге. Все другие клетки-предшественники образуются в ходе миелоцитопозза, т. е. процессы пролиферации, созревания и высвобождения в кровоток происходит в костном мозге. В миелопоззе участвуют два гормона - эритропоэтин и тромбопоэтин. Тромбопоэтин (образующийся в основном в печени) способствует созреванию и развитию мегакариоцитов, от которых отделяются тромбоциты. Ряд других ростовых факторов с паракринным действием влияет на формирование клеток крови в костном мозге.
Эритропоэтин способствует пролиферации красных кровяных клеток и их созреванию. Он секретируется печенью плода, а в постнатальный период главным образом почками (примерно 90%). В ответ на дефицит кислорода (например, из-за большой высоты над уровнем моря, гемолиза и т. д.; А) секреция эритропоэтина возрастает, образуется больше красных кровяных клеток, и фракция ретикулоцитов (молодых эритроцитов) в крови возрастает. Продолжительность жизни красных кровяных клеток составляет примерно 120 суток. Красные кровяные клетки регулярно выходят из артериол в пульпе селезенки и проходят через небольшие поры, чтобы попасть в синус селезенки (Б), где старые кровяные клетки отсортировываются и разрушаются (гемолиз). Макрофаги в селезенке, печени, костном мозге и т. д. поглощают и разрушают клеточные фрагменты. Гем, железосодержащая группа гемоглобина (НЬ), высвобождаемая в результате гемолиза, распадается до билирубина, а железо используется повторно (рециркулируется).
Метаболизм железа и эритропоэз[править | править код]
Примерно 2/3 общего железа в организме (примерно 2 г у женщин и 5 г у мужчин) связано с гемоглобином (Нb). Около 1/4 существует в виде запасов железа (ферритин, гемосидерин), а остальное -функциональное железо (миоглобин, железосодержащие ферменты). Потери железа организмом составляют примерно 1 мг/сут у мужчин и 2 мг/сут у женщин (из-за менструации, во время родов и беременности). Всасывание (абсорбция) железа происходит в основном в двенадцатиперстной кишке и варьирует в зависимости от потребностей. У здоровых людей всасывается от 3 до 15% общего железа, поступающего с пищей, но при дефиците железа в организме эффективность всасывания может возрастать до 25% (А1). Поэтому рекомендуется ежедневное потребление железа в количестве не менее 10-20 мг в день (женщины > дети > мужчины).
Всасывание железа (А2). Fe(ll), поступающее с пищей (гемоглобин и миоглобин в основном из мяса и рыбы), эффективно поглощается в виде комплекса гем-Fe(II) с помощью белка-транспортера НСР1 (heme carrier protein 1). В клетках слизистой оболочки Fe3+ высвобождается с помощью гем-оксигеназы и восстанавливается до Fe2+, которое транспортируется через клеточную мембрану мобилферрином (Fe-транспортер между трансферрином и гемоглобином). Трехвалентное железо либо остается в слизистой оболочке в виде комплекса ферритин-Fe(Ill) и возвращается в просвет кишечника при обновлении клеток, либо поступает в кровоток. Негемовое железо может поглощаться только в виде Fe2+. Таким образом, негемовое Fe(lll) сначала должно быть восстановлено до Fe2+ железоредуктазой (ЖР; А2) и аскорбатом на поверхности слизистой оболочки кишечника (А2). Fe2+, вероятно, поглощается путем вторичного активного транспорта посредством Fе2+-Н+-симпорта (переносчик DCT1 - транспортер двухвалентных катионов Fe2+; DMT1 - транспортер двухвалентных металлов - конкурентов Mn2+, Со2+, Cd2+ и т. д.). В связи с этим важную роль играет низкий pH химуса, поскольку это (а) увеличивает градиент Н+, который проводит Fe2+ в клетку посредством DCT1, и (б) высвобождает из комплексов железо, полученное с пищей. Поглощение железа в кровотоке регулируется двумя механизмами.
- При дефиците железа фермент аконитаза (регулирующий уровень железа) связывается в цитоплазме с комплексом ферритин-иРНК, ингибируя тем самым трансляцию ферритина в слизистой. В результате в кровоток может поступать повышенное количество Fe(ll).
- Fla базолатеральной стороне клеток Fe2+ окисляется до Fe3+ с помощью белка гефестина (=мембраносвязанный гомолог ферроксидазы церулоплазмина).
Fe3+ покидает клетку с помощью ферропортина-1 (=IREG1). Его плотность на мембране клеток слизистой (как и на мембранах гепатоцитов и макрофагов) убывает под действием гепсидина. Секреция этого гормона печени снижается при дефиците железа. Как следствие, плотность IREG1 возрастает и Fe3+ попадает в кровь. Затем он связывается с апотрансферрином, белком, отвечающим за транспорт железа в плазме (А2,3). Трансферрин (=апотрансферрин + 2Fe(IID) поглощается в ходе эндоцитоза в эритробластах и клетках печени, плаценты и т. д. при помощи трансферриновых рецепторов. Как только железо высвобождается в клетках-мишенях, апотрансферрин снова становится доступен для поглощения железа из кишечника и макрофагов (см. ниже).
Хранение и рециркуляция железа (АЗ). Ферритин- одна из главных форм, в виде которой железо хранится в организме; он находится в основном в слизистой оболочке кишечника, печени, костном мозге, красных кровяных клетках и плазме. Ферритин имеет места связывания для примерно 4500 ионов Fe3+ и обеспечивает быстрый доступ к запасам этого иона (примерно 600 мг), тогда как мобилизация иона из гемосидерина протекает гораздо медленнее. Комплексы Hb-Fe и гем-Fe, высвобождающиеся из плохо сформированных эритробластов (так называемый неэффективный эритропоэз) и красных кровяных клеток после их гемолиза, связываются с гаптоглобином и гемопексином. Затем они поглощаются макрофагами в костном мозге или в печени и селезенке соответственно, что приводит к 97%-ной рециркуляции железа (АЗ).
Дефицит железа ингибирует синтез гемоглобина, что приводит к гипохромной микроцитарной анемии, при которой МСН < 26 пг; MCV < 70 фл; Нb < 110 г/л. Основными причинами этого могут быть:
1. потеря крови (наиболее часто); 0,5 мг железа теряется с каждым мл крови;
2. недостаточное поглощение (абсорбция) железа;
3. увеличение потребности в железе во время роста, беременности, кормления грудью и т. д.;
4. сниженная рецикляция железа (из-за хронической инфекции). Медиаторы воспаления, такие как IL6, увеличивают секрецию гепсидина. Поэтому плотность IREG1 в макрофагах также падает и Fe остается там. Перегрузка железом (например, вызванная дефектами системы гепсидина и IREG1) чаще всего повреждает печень, поджелудочную железу и миокард (гемохроматоз). Если поставки железа обходят кишечный тракт (при инъекциях), емкость трансферрина может быть превышена и образующееся свободное железо может вызвать отравление.
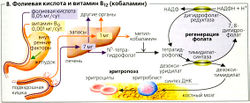
Витамин В12 (кобаламин) и фолиевая кислота также необходимы для эритропоэза (Б). Дефицит этих веществ ведет к гиперхромной анемии (уменьшение числа эритроцитов, повышение МСН). Основными причинами являются недостаток внутреннего фактора (необходимого для ресорбции кобаламина) и плохое всасывание фолиевой кислоты из-за абсорбции маната или крайне несбалансированной диеты. Поскольку в организме обычно есть значительные запасы железа, сниженное всасывание кобаламина не ведет к симптомам дефицита в течение многих лет, тогда как при дефиците фолиевой кислоты симптомы развиваются в течение нескольких месяцев.
Реологические свойства крови[править | править код]
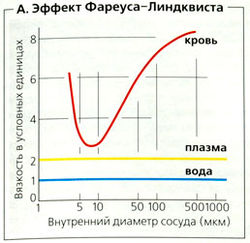
Вязкость (η) крови выше, чем вязкость плазмы, из-за содержания в ней эритроцитов (число эритроцитов/л крови). Вязкость (η) = 1 /текучесть = напряжение сдвига (τ)/скорость сдвига (у) [Па • с]. Вязкость крови возрастает с увеличением гематокрита и уменьшением скорости кровотока. В эритроцитах отсутствуют основные органеллы и, как следствие, они легко деформируются. По причине низкой вязкости их содержимого, текучей похожей на пленку мембраны и высокого соотношения поверхность/объем кровь ведет себя скорее как эмульсия, чем как суспензия клеток, особенно если она быстро течет. В мелких артериях (диаметром около 20 мкм) вязкость циркулирующей крови (ηкрови) составляет примерно 4 уел. ед. Это в 2 раза выше, чем вязкость плазмы (для плазмы η = 2 уел. ед.; для воды η = 1 уел. ед. = 0,7 мПа • с при 37 °С).
Эритроциты легко деформируются, в норме они не имеют затруднений при прохождении через капилляры или поры в сосудах селезенки, хотя их диаметр (< 5 мкм) меньше, чем диаметр свободных подвижных эритроцитов (7 мкм). Несмотря на то что при замедлении скорости потока в мелких сосудах вязкость крови увеличивается, это частично компенсируется (ηкрoви ↓) тем, что красные кровяные клетки выстраиваются в цепочку друг за другом по центру небольшого сосуда (диаметром < 300 мкм). Этот феномен известен как эффект Фареуса-Линдквиста (А). Вязкость крови лишь немногим выше вязкости плазмы в артериолах (диаметр ~ 7 мкм), но заметно возрастает в капиллярах (диаметр ~ 4 мкм).
Критическое увеличение вязкости крови может произойти, если (а) кровоток становится слишком вялым и/или (б) текучесть красных кровяных клеток снижается из-за высокого осмотического давления (приводящего к зазубренности эритроцитов), наличия клеточных включений, дефиците гемоглобина (например, при серповидноклеточной анемии), изменений в клеточной мембране (например, в старых эритроцитах) и т. д. При таких условиях эритроциты претерпевают агрегацию [образуется столбик эритроцитов), резко увеличивая вязкость крови (до 1000 уел. ед.). Это может быстро привести к остановке кровотока в малых сосудах.
Плазма, распределение ионов[править | править код]
Плазму получают, предотвращая свертывание крови и удаляя форменные элементы путем центрифугирования. Высокомолекулярные белки (Б), наряду с ионами и незаряженными веществами с низкой молекулярной массой, растворены в плазме.
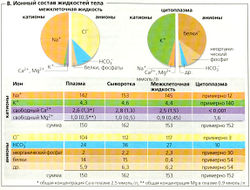
Общая концентрация этих частиц создает осмотическое давление крови, так называемая осмоляльность плазмы равна 290 мОсм/кг Н2О. Наиболее распространенным катионом в плазме является Na+, а наиболее распространенными анионами - Сl и НСО3. Хотя белки плазмы несут некоторый суммарный отрицательный заряд (В), обусловленное ими осмотическое давление меньше, поскольку в данном случае определяющим фактором служит количество частиц, а не заряд ионов.
Доля белков, способных покинуть кровеносные сосуды, мала и в разных органах варьирует. Капилляры печени, например, гораздо более проницаемы для белков, чем капилляры мозга. Состав интерстициальной Iмежклеточной) жидкости из-за этого значительно отличается от состава плазмы, особенно по белковому компоненту (В). Состав цитоплазмы совсем иной; здесь основным катионом является К+, а основные анионы - фосфаты, белки и другие органические анионы (В), содержание которых колеблется в зависимости от типа клеток.
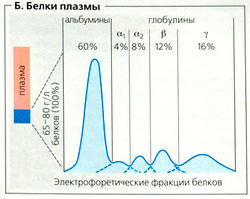
На альбумин приходится 60% всех белков плазмы (35-40 г/л; Б). Альбумин служит транспортным средством для многих веществ крови. Белки крови являются основной причиной коллоидно-осмотического давления, или иначе, онкотического давления; они также обеспечивают белковый резерв при дефиците белка. а1,a2 и β-Глобулины в основном служат для транспортировки липидов (аполипопротеины), гемоглобина (гаптоглобин), железа (апотрансферрин), кортизола (транскортин) и кобал-амина (транскобаламин). Большинство факторов коагуляции (фибринолиза) в плазме также являются белками. Большинство иммуноглобулинов плазмы [lg, Г) относится к группе у-глобулинов и служат защитными белками (антителами). IgG, наиболее распространенный иммуноглобулин (7-15 г/л), может пересекать плацентарный барьер (транспорт от матери к плоду, Г). Любой иммуноглобулин состоит из двух группоспецифичных тяжелых белковых цепей (IgG: у-цепь; IgA: a-цепь; IgM: μ-цепь; IgD: δ-цепь; IgE: е-цепь) и двух легких белковых цепей (X- или Х-цепь), соединенных дисульфидными связями с формированием характерной Y-образной структуры.
Группы крови[править | править код]
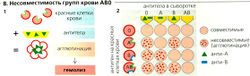
Группа крови человека определяется типом антигена (определенные гликолипиды), присутствующего на поверхности красных кровяных клеток. В системе АВО антигенами являются А и В (В). В крови группы А присутствуют антиген А (на эритроцитах) и анти-В антитела (в сыворотке): в крови группы В присутствуют антиген В и антитела анти-А, в крови группы АВ отсутствуют антитела и присутствуют антигены А и В, а в крови группы 0 нет антигена и присутствуют антитела анти-А и анти-В.
При переливании крови важно соответствие групп крови донора и реципиента, чтобы эритроциты донора, например группы А, не контактировали с соответствующими антителами реципиента (в нашем примере анти-А). Если перелить донорскую кровь неподходящего типа, то произойдет агглютинация (перекрестное сшивание посредством IgM) и гемолиз (разрыв) донорских эритроцитов (В1). Таким образом, группы крови донора и реципиента должны быть совместимы и определяться до процедуры переливания (В2).
Поскольку антитела АВ0 относятся к классу IgM, они обычно не проходят через плацентарный барьер.
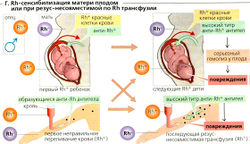
В системе Rh антитела к резус-антигенам (С, D, Е) на эритроцитах не развиваются, если не произошло предварительной сенсибилизации. D, безусловно, является наиболее аллергенным. Человек является Rh-положительным (Rh+), если на поверхности эритроцитов его крови присутствует D (большинство людей), и Rh-отрицательным (Rh-), если D отсутствует. Анти-D антитела принадлежат к классу IgG иммуноглобулинов, которые способны преодолевать плацентарный барьер.
У человека с отрицательным резус-фактором могут образовываться анти-Rh + (= анти-D) антитела после сенсибилизации, например из-за переливания не соответствующей крови или у Rh-отрицательной беременной женщины с Rh-положительным плодом. Последствием контакта с несоответствующей группой крови является тяжелая реакция образования антиген-антитела, характеризующаяся внутрисосудистой агглютинацией и гемолизом (Г).
Гемостаз[править | править код]
Система гемостаза останавливает кровотечение. Для остановки кровотечения взаимодействуют тромбоциты (кровяные пластинки) и факторы коагуляции (или свертывания) в плазме и на стенках сосудов. Поврежденный сосуд сжимается (вазоконстрикция), высвобождая эндотелин, и тромбоциты агрегируют в участке прокола (привлекаются дополнительные тромбоциты), чтобы «запаять» дырку при помощи «пробки» из тромбоцитов. Время, которое требуется для этого (примерно 2-4 мин), называется временем кровотечения. Вслед за этим система коагуляции «строит» фибриновую сеть. Благодаря ковалентным перекрестным сшивкам фибриновая сеть превращается в фибриновый сгусток, или тромб, который впоследствии стягивается, укрепляя тем самым запаянное место. В дальнейшем восстановление проходимости сосуда может быть достигнуто путем фибринолиза.
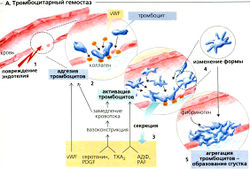
Тромбоциты (170-400 * 103/мкл крови; время полужизни —10 суток) - это маленькие безъядерные тельца, которые отщепляются от мегакариоцитов в костном мозге. При повреждении эндотелия тромбоциты прикрепляются к субэндотелиальным коллагеновым волокнам (А1) с участием фактора фон Виллебранда (vWF), который образуется эндотелиальными клетками и циркулирует в плазме в комплексе с фактором VIII. Гликопротеиновый комплекс GP 1b/1Х на тромбоцитах является рецептором для vWF. Такая адгезия активирует тромбоциты (А2). Они начинают высвобождать вещества (АЗ), некоторые из них способствуют адгезии тромбоцитов (vWF); другие вещества, такие как серотонин, тромбоцитарный фактор роста (PDGF) и тромбоксан Ag (ТХА2), вызывают сужение кровеносных сосудов (вазоконстрикцию). Вазоконстрикция и сгустки тромбоцитов замедляют кровоток. Медиаторы, высвобождаемые тромбоцитами, увеличивают активацию тромбоцитов и привлекают новые тромбоциты: АДФ, ТХА2, тромбоцитактивирую-щий фактор (PAF). Форма активированных тромбоцитов существенно изменяется (А4). Дисковидные тромбоциты становятся сферическими и образуют псевдоподии, которые переплетаются с псевдоподиями других тромбоцитов. Такая агрегация тромбоцитов (А5) далее усиливается тромбином и стабилизируется при помощи GP llb/llia. После того как тромбоциты изменяют форму, GP IIЬ/IIIа на поверхности тромбоцитов экспрессируется, что ведет к связыванию с фибриногеном и агрегации тромбоцитов. GP llb/llla также увеличивает способность к адгезии тромбоцитов, что облегчает их прилипание к эндотелиальному фибронектину.
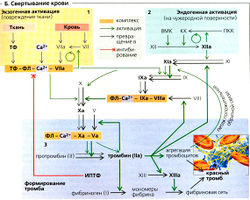
В процесс свертывания крови вовлечено несколько факторов коагуляции, которые все, кроме Са2+,являются белками, образующимися в печени (Б и см. табл.). Факторы, отмеченные в таблице буквой «К» (наряду с белком С и белком S, см. ниже), синтезируются вместе с витамином К, важным кофактором посттрансляционного у-карбоксилирования глутаматных остатков этих факторов. Такие у-карбоксиглутаматные группы являются хелатирующими лигандами Са2+. Они требуются для Са2+-опосредованного ком-плексообразования факторов на поверхности фосфолипидного слоя (ФЛ), в основном на мембране тромбоцитов (тромбоцитарный фактор 3). Витамин К окисляется в этой реакции и должен быть снова восстановлен эпоксид-редуктазой печени (рециркуляция витамина К). Ионы Са2+ требуются на нескольких стадиях процесса свертывания крови (Б). При добавлении к образцам крови in vitro цитрат, оксалат и ЗД-ТА связывают ионы Са2+, таким образом предотвращая процесс свертывания крови. Эти процессы играют важную роль при проведении разных анализов крови. Активация свертывания крови (Б). Большинство факторов коагуляции обычно неактивны и представляют собой проферменты. Их активация требует целого каскада реакций (добавление буквы «а» к названию фактора означает «активированный»). Таким образом, даже малое количество триггерного фактора ведет к быстрому свертыванию крови. Триггер может быть эндогенным (внутри сосуда) или экзогенным. В случае экзогенной (экстраваскулярной) активации, сопровождающей повреждение кровяного русла (Б, наверху слева), тканевой фактор (ТФ - наружный тромбопластин, трансмембранный белок) формирует комплекс с VIla и Са2+, уже содержащимися в крови,на фосфолипидной (ФЛ) стороне мембраны. Данный комплекс активирует VII, IX и X, что в свою очередь ведет к образованию небольшого количества тромбина (реакция инициации, Б, тонкие стрелки). Этого количества тромбина достаточно для активации V, VIII, XI, IX и X (Б, жирные стрелки); затем по механизму положительной обратной связи высвобождается тромбин в количестве, достаточном для образования сгустка (см. ниже). Эффекты комплекса ТФ-ФЛ-Са2+VIIа теперь ингибируются TFPI [от англ. ингибитор пути тканевого фактора) (Б, слева). «Эндогенная» активация (Б, справа вверху) начинается при контактной активации XII. Так как у больных с наследственным дефектом XII геморрагический диатез не наблюдается, в настоящее время считается, что этот тип активации имеет место лишь в случаях наличия внешней (в лабораторном эксперименте) или внутренней (при наличии сосудистого протеза) чужеродных поверхностей.
Таблица Время полужизни (ч)
|
1 |
Фибриноген |
96 |
|
llK |
Протромбин |
72 |
|
III |
Тканевой тромбопластин | |
|
IV |
Ионизированный кальций (Са2+) | |
|
V |
Проакселерин |
20 |
|
VIIK |
Проконвертин |
5 |
|
VIII |
Антигемофильный фактор А |
12 |
|
IXK |
Антигемофильный фактор В; тромбопластиновый компонент плазмы (РТС) кристмас-фактор |
24 |
|
Хк |
Фактор Стюарта-Пауэра |
30 |
|
XI |
Предшественник плазматического тромбопластина (РТА) |
48 |
|
XII |
Фактор Хейгемана |
50 |
|
XIII |
Фибринстабилизирующий фактор (FSF) |
250 |
|
- |
Прекалликреин (РКК), фактор Флетчера | |
|
- |
Высокомолекулярный кининоген (НМК); фактор Фитцжеральда |
Образование фибрина (БЗ). Ха и Va образуют дополнительный комплекс с ФЛ и Са2+. Этот комплекс активирует протромбин (II), превращая его в тромбин (IIа). В ходе этого процесса Са2+ связывается с фосфолипидами и N-концевой участок протромбина отделяется. Высвобождающийся тромбин активирует не только V, VIII, IX, X и XI (см. выше), но и фибриноген с образованием фибрина, как и фибринстабилизирующий фактор (XIII). Мономерный фибрин преобразуется из растворимой формы (фибринаs) в нерастворимый фибрин (фибринi), стабилизируясь при помощи ХIIIа. Фактор ХIIIа - это трансамидаза, которая соединяет боковые цепи фибриновых нитей посредством ковалентных связей. Тромбин также содействует агрегации тромбоцитов, приводящей к образованию очень стойкого барьера (красный тромб) из агрегированных тромбоцитов (белый тромб) и фибриновой сети.
Фибринолиз и тромбопротекция[править | править код]
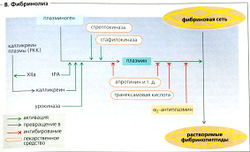
Для предотвращения избыточного свертывания крови, окклюзии (непроходимости) главных кровеносных сосудов [тромбоза), а также их закупорки (эмболии) из-за миграции тромба сразу после начала восстановления сосуда фибрин; снова превращается в растворимую форму (фибринs; фибринолиз), а ингибиторные факторы активируются.
Фибринолиз опосредуется плазмином (В). Разнообразные факторы в крови (калликреин плазмы, фактор ХIIа), в тканях (тканевой активатор плазминогена, tPA, на эндотелиальных клетках и т. д.) и в моче (урокиназа) активируют плазминоген, который переходит в плазмин. 6 терапии для активации плазминогена используются стрептокиназа, урокиназа и tPA. Это необходимо для растворения свежего тромба, например, в коронарной артерии.
Фибрин расщепляется на фибринопептиды, которые ингибируют образование тромбина и полимеризацию фибрина, таким образом предотвращая дальнейшее формирование сгустка. а2-Антиплазмин - это эндогенный ингибитор фибринолиза. Транексамовая кислота применяется в терапии с той же целью.
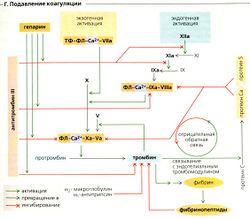
Тромбопротекция. Антитромбин III (серпин) является самым важным тромбопротекторным белком плазмы (Г). Он инактивирует протеазную активность тромбина и факторов IXa, Ха, ХIа и ХIIа путем образования с ними комплексов. Этот процесс усиливается гепарином и гепариноподобными эндотелиальными глюкозамингликанами. Гепарин в норме образуется в тучных клетках и гранулоцитах, а в терапевтических целях вводится синтетический гепарин.
Связывание тромбина с эндотелиальным тромбомодулином обеспечивает дальнейшую тромбопротекцию. Только в этой форме тромбин имеет эффект антикоагулянта (Г, отрицательная обратная связь). Тромбомодулин активирует белок С к Са, который после связывания с белком S дезактивирует факторы коагуляции Va и Villa. Синтез белков С и S зависит от витамина К. Другие белки плазмы, ингибирующие тромбин, - это а2-макроглобулин и агантитрипсин (Г). Эндотелиальные клетки секретируют тканевый ингибитор тромбопластина, вещество, ингибирующее экзогенную активацию коагуляции, и простациклин (= простагландин I2), который ингибирует адгезию тромбоцитов к здоровому эндотелию.
Антикоагулянты вводятся для тромбопротекция у пациентов с риском свертывания крови. Введенный гепарин обладает немедленным действием. Перорально производные кумарина (фенпрокумон, варфарин, аценокумарол) являются антагонистами витамина К, действующими через ингибирование эпоксидредуктазы печени, что необходимо для рециркуляция витамина D. Таким образом, эти лекарства не дают эффекта до тех пор, пока сывороточная концентрация факторов коагуляции, зависящих от витамина К, не снижается. Ингибиторы циклооксигеназы, такие как аспирин (ацетилсалициловая кислота), ингибируют агрегацию тромбоцитов путем блокирования синтеза тромбоксана А2 (ТХА2).
Геморрагический диатез может быть вызван следующими причинами: (а) врожденным дефицитом некоторых факторов коагуляции; недостаток факторов VIII или IX, например, ведет к гемофилии А или В соответственно; (б) приобретенным дефицитом факторов коагуляции; основные причины - повреждение печени или дефицит витамина К, вызванный нарушением синтезирующей витамин К кишечной микрофлоры или кишечной абсорбции маната; (в) повышенным расходом факторов коагуляции по причине синдрома диссеминированного внутрисосудистого свертывания, (г) дефицитом тромбоцитов (тромбоцитопенией) или дефектом тромбоцитов (тромбоцитопатией); (д) некоторыми сосудистыми заболеваниями; (е) чрезмерным фибринолизом.
Читайте также[править | править код]
- Кроветворная система
- Средства, влияющие на кроветворение
- Гемостаз
- Гемостатики (коагулянты, ингибиторы фибринолиза)
- Средства, уменьшающие проницаемость сосудов
- Противосвертывающая система крови
- Антикоагулянты прямого действия
- Антикоагулянты непрямого действия
- Средства, влияющие на фибринолиз
- Средства, влияющие на агрегацию тромбоцитов