Физиология органов пищеварения
Содержание
- 1 Желудочно-кишечный тракт: общие сведения, иммунная защита, кровоснабжение
- 2 Взаимосвязь нервной и эндокринной систем
- 3 Слюна
- 4 Глотание
- 5 Рвотный рефлекс
- 6 Строение и моторика желудка
- 7 Желудочный сок
- 8 Функции тонкого кишечника
- 9 Поджелудочная железа
- 10 Желчь
- 11 Выделительная функция печени
- 12 Переваривание липидов
- 13 Распределение и хранение липидов
- 14 Триацилглицериды (ТГ)
- 15 Холестерин (СНО)
- 16 Переваривание и всасывание углеводов и белков
- 17 Всасывание витаминов
- 18 Всасывание воды и минеральных веществ
- 19 Толстый кишечник
Желудочно-кишечный тракт: общие сведения, иммунная защита, кровоснабжение
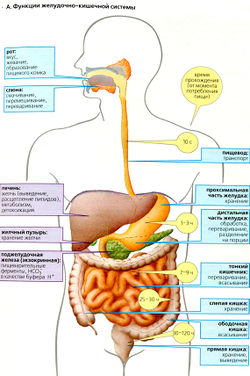
Пища покрывает потребности организма в энергии и питательных веществах. Для усвоения она должна быть проглочена, подвергнута обработке и расщеплена (переварена), после чего вещества всасываются в кишечнике. Трехслойная мускулатура желудочно-кишечного тракта обеспечивает перемешивание и транспорт содержимого кишечника. Время прохождения по разным сегментам желудочно-кишечного тракта варьирует и в основном зависит от состава пищи (среднее время прохождения см. А).
Твердая пища при пережевывании смешивается со слюной и смачивается ею. Слюна содержит иммунокомпетентные вещества (см. ниже) и ферменты. Пищевод быстро транспортирует пищевой комок в желудок. Нижний сфинктер пищевода открывается только кратковременно, только для прохода пищи. Проксимальная часть желудка в основном служит пищевым резервуаром. Тонус этой части желудка определяет ту скорость, с которой пища проходит в дистальную часть желудка, где подлежит дальнейшей обработке (образование химуса, пищевой кашицы) и где частично перевариваются белки. Дистальная часть желудка (включая привратник) также отвечает за доставку химуса порциями в тонкий кишечник. Желудок секретирует также внутренний фактор.
В тонком кишечнике ферменты поджелудочной железы и слизистой оболочки тонкого кишечника расщепляют питательные вещества на компоненты, которые далее могут всасываться. НСО3 в соке поджелудочной железы нейтрализует кислый химус. Желчные соли в составе желчи необходимы для расщепления жиров. Продукты расщепления (моносахариды, аминокислоты, дипептиды, моноглицериды и свободные жирные кислоты), наряду с водой и витаминами, всасываются в тонком кишечнике.
Побочные продукты (например, билирубин) с желчью, секретируемой печенью, попадают в фекалии и выделяются из организма. Печень также имеет множество других метаболических функций. Она служит, например, обязательной передаточной «станцией» метаболизма и распределения веществ, реабсорбируемых из кишечника, синтезирует белки плазмы крови (включая альбумин, глобулины, факторы свертывания крови, аполипопротеины и т. д.), и там же происходит детоксикация чужеродных веществ путем их биотрансформации и продуктов метаболизма (например, аммония) перед их выделением.
Толстый кишечник является последним отделом, где происходит всасывание воды и ионов. Он населен бактериями и содержит участок хранения фекалий (прямая кишка).
Иммунная защита. Большая внутренняя поверхность желудочно-кишечного тракта (примерно 100 м2) требует очень эффективной системы иммунной защиты. Слюна содержит муцин, иммуноглобулин A (IgA) и лизоцим, которые предотвращают проникновение патогенов. Желудочный сок имеет бактери-цидный эффект. Пейеровы бляшки обеспечивают желудочно-кишечный тракт иммунокомпетентной лимфатической тканью. М-клетки (специальные мембранные клетки) слизистой оболочки эпителия позволяют антигену войти в пейеровы бляшки. Вместе с макрофагами пейеровы бляшки могут вызывать иммунный ответ путем секреции IgA. IgA транспортируется в просвет кишечника путем трансцитоза. В эпителии IgA связывается с секреторным компонентом, защищая его от пищеварительных ферментов. Слизистая эпителия содержит также внутриэпителиальные лимфоциты (ВЗЛ), которые функционируют как Т-киллерные клетки. Медиаторы осуществляют взаимосвязь между ВЗЛ и соседними энтероцита-ми. Макрофаги синусоидных капилляров печени (купферовы клетки) являются дополнительным бастионом иммунной защиты. Физиологические колонии кишечной флоры в толстом кишечнике препятствуют распространению патогенов. IgA грудного молока защищает слизистую желудочно-кишечного тракта новорожденных.
Кровоток в желудке, кишечнике, печени, поджелудочной железе и селезенке (примерно 30% минутного сердечного объема) обеспечивается тремя основными ответвлениями брюшной аорты. Кишечный кровоток регулируется локальными рефлексами, автономной нервной системой и гормонами. Более того, он является ауторегуляторным, т. е. в основном независим от изменений давления в большом круге кровообращения. Кровоток в кишечнике резко возрастает после еды (ацетилхолин, вазоактивный кишечный (интестинальный) пептид (ВИП) и т. д. функционируют как медиаторы расширения сосудов) и падает во время физической активности (медиаторы: норадреналин и т. д.). Венозная кровь несет вещества, реабсорбируемые из кишечного тракта, и входит в печень через воротную (полую) вену. Некоторые компоненты реабсорбированных жиров усваиваются кишечной лимфой, которая транспортирует их в большой круг кровообращения в обход печени.
Взаимосвязь нервной и эндокринной систем
Эндокринные и паракринные гормоны и нейромедиаторы контролируют моторику, секрецию, перфузию и пролиферацию клеток желудочно-кишечного тракта. Рефлексы мезентерического (брыжеечного) и подслизистого сплетений, а также внешняя иннервация модулируют активность нервной системы кишечника (НСК).
Локальные рефлексы запускаются рецепторами растяжения в стенках пищевода, желудка и кишечника или при помощи хеморецепторов слизистой оболочки эпителия и запускают сокращение или релаксацию соседних гладкомышечных волокон. Перистальтические рефлексы распространяются далее к анальным (примерно 20-30 мм) участкам. Они частично модулируются промежуточными нейронами и помогают продвигать содержимое кишечника (перистальтика ЖКТ).
Внешняя иннервация желудочно-кишечного тракта осуществляется парасимпатической нервной системой (от нижней части пищевода до прямой кишки) и симпатической нервной системой. Иннервация также обеспечивается висцеральными афферентными волокнами (симпатических или парасимпатических нервов), по которым поступают афферентные импульсы центральных рефлексов.
Функции НСК в основном независимы от внешней иннервации, однако внешняя иннервация имеет некоторые преимущества: (а) быстрая передача сигнала между сравнительно удаленными частями желудочно-кишечного тракта посредством брюшных ганглиев (короткие висцеральные афферентные волокна) или ЦНС (длинные висцеральные афферентные волокна); (б) функции желудочно-кишечного тракта подчиненные по отношению к всему организму; (в) функции желудочно-кишечного тракта контролируются мозгом, так что организм может о них оповещаться (например, в случае появления желудочных болей).
Нейромедиаторы. Норадреналин (НА) высвобождается адренергическими постганглионарными нейронами, а ацетилхолин (АН) - пре- и постганглионарными (кишечными) волокнами. ВИП (вазоактивный интестинальный пептид) опосредует релаксацию круговых и сосудистых мышц желудочно-кишечного тракта. Мет- и лейэнкефалины интенсифицируют сокращение сфинктера привратника, илеоцекального (подвздошно-слепокишечного) и нижнего пищеводного сфинктеров путем связывания с опиоидными рецепторами. ГВП (гастринвысвобождающий пептид) вызывает высвобождение гастрина. Кальцитонин-гензависимый пептид стимулирует высвобождение соматостатина (СС).
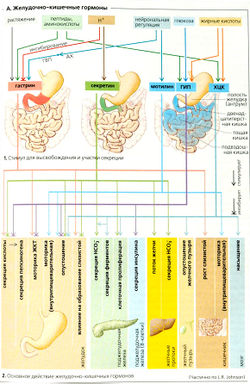
Все эндокринные гормоны, действующие в желудочно-кишечном тракте, являются пептидами, синтезируемыми эндокринными клетками слизистой оболочки, (а) Гастрин и холецистокинин (ХЦК) и (б) секретин и ГИЛ структурно сходны, то же относится к глюкагону и ВИП. Следовательно, высокая концентрация гормонов одного и того же семейства имеет очень похожие эффекты.
Гастрин существует в виде длинной (G34 состоит из 34 аминокислот) и короткой (G17 - из 17 аминокислот) форм. G17 составляет до 90% от всего антрального гастрина. Гастрин секретируется в антруме и двенадцатиперстной кишке. Его высвобождение (А1) при помощи гастринвысвобождающего пептида (ГВП) подлежит нейрональному контролю. Гастрин также высвобождается в ответ на растяжение стенок желудка и наличие фрагментов белка в желудке. Его секреция ингибируется, когда pH в просвете желудка/двенадцатиперстной кишки снижается ниже 3,5 (А1). Основными эффектами гастрина являются секреция кислоты и рост слизистой оболочки кишечника (А2).
Холецистокинин, ХЦК (33 аминокислоты) синтезируется слизистой оболочкой на всем протяжении тонкого кишечника. Длинноцепочечные жирные кислоты, аминокислоты и олигопептиды в просвете кишечника стимулируют высвобождение ХЦК (А1). Это вызывает сокращение желчного пузыря и ингибирует опустошение желудка. В поджелудочной железе он стимулирует синтез ферментов и секрецию НСО3 (через секретин, см. ниже) (А2).
Секретин (27 аминокислот) в основном вырабатывается в двенадцатиперстной кишке. Его высвобождение стимулируется кислым химусом (А1). Секретин ингибирует секрецию кислоты и формирование слизистой желудка и стимулирует секрецию НСО3 (потенцируемую ХЦК), секрецию поджелудочной железы и выработку печенью желчи (А2).
ГИП (глюкозозависимый инсулинотропный пептид, 42 аминокислоты; раньше он назывался кишечным ингибиторным полипептидом, или энтерогастроном) синтезируется в двенадцатиперстной и тощей кишке и высвобождается под действием фрагментов белков, жиров и углеводов (например, глюкозы) (А1). ГИП ингибирует секрецию кислот (А2) и стимулирует высвобождение инсулина (поэтому при пероральном введении глюкозы высвобождается больше инсулина, чем при внутривенном).
Мотилин (22 аминокислоты) высвобождается нейронами в тонком кишечнике и регулирует моторику ЖКТ (А1, 2).
Паракринные медиаторы. Гистамин, соматостатин и простагландин являются основными паракринными медиаторами в желудочно-кишечном тракте.
Слюна
Функции слюны следуют из ее состава. Муцин служит для смачивания пищи, облегчая проглатывание и поддерживая ротовую полость во влажном состоянии для облегчения жевательных и речевых движений. Слюна растворяет компоненты пищи, что является предпосылкой для стимуляции вкусовых сосочков и облегчает оральную и зубную гигиену. Слюна имеет низкую концентрацию NaCl и является гипотоничной, что делает ее подходящей для промывания вкусовых рецепторов (NaCI) во время еды. Младенцы нуждаются в слюне для смыкания губ при сосании. Слюна также содержит а-амилазу, которая начинает переваривание крахмала во рту, а также иммуноглобулин А и лизоцим, являющиеся частью системы иммунной защиты. Высокая концентрация НСО3 в слюне создает pH ~7, что оптимально для катализируемого а-амилазой переваривания пищи. Проглоченная слюна также важна для нейтрализации кислых желудочных соков, забрасываемых в пищевод. Секреция перед рвотой больших количеств слюны также предотвращает повреждение кислотой эмали зубов. Секреция слюны очень зависит от содержания воды в организме. Низкое содержание воды приводит к сниженной секреции слюны - горло и рот становятся сухими, пробуждая, таким образом, чувство жажды. Это важный механизм поддержания баланса жидкости в организме.
Скорость секреции
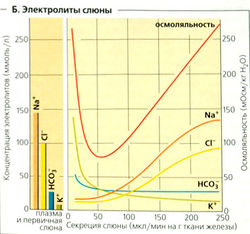
Скорость секреции слюны варьирует от 0,1 до 4 мл/мин (10-250 мкл/мин на грамм слюнных желез) в зависимости от степени стимуляции (Б). Общая секреция слюны составляет 0,5—1,5 л в сутки. При 0,5 мл/мин 95% слюны секретируется околоушной железой (серозная слюна) и подчелюстной железой (богатая муцином слюна). Остальная слюна происходит из подъязычной железы и желез слизистой оболочки щеки.
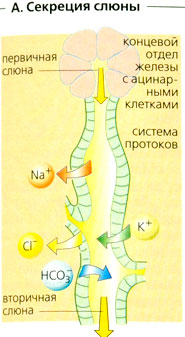
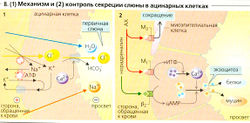
Секреция слюны происходит в два этапа: ацинии (концевые отделы железы) производят первичную слюну (А, В), которая имеет электролитный состав, аналогичный плазме крови (Б). Секреция первичной слюны в ацинарных клетках является результатом трансцеллюлярного транспорта CL: CI активно поглощается из крови в клетки (при помощи вторичного активного транспорта) с помощью ко-транспортера Na+-K+-2CI и высвобождается в просвет (вместе с НСО3) через анионные каналы, что приводит к образованию люмен-отрицательного эпителиального потенциала (ЛОЭП), который проводит Na+ в просвет (парацеллюлярно). Пассивно следует также вода (осмотический эффект). Первичная слюна модифицируется в экскреторных протоках, что дает вторичную слюну. При прохождении слюны через экскреторные протоки реабсорбируются Na+ и Сl-, а К+ и (карбоангидразозависимый) НСО3 секретируются в просвет. Слюна становится гипотоничной (гораздо ниже 100 мОсм/кг Н0О; Б), поскольку реабсорбция Na+ и Сl- больше секреции К+ и НСО3 и протоки относительно непроницаемы для воды (Б). Если уровень секреции возрастает до гораздо более высокого, чем 100 мкл/мин • г), эти процессы запаздывают, и состав вторичной слюны становится сходным с составом первичной (Б).
Стимуляция слюноотделения
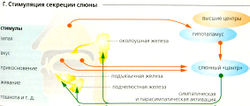
Рефлекторная стимуляция секреции слюны происходит в больших слюнных железах (Г). К стимулам слюноотделения относятся запахи и вкус пищи, жевание и тошнота. Условные рефлексы также играют роль. Например, обычный стук тарелок при приготовлении пищи может вызвать слюноотделение. Сон и обезвоживание ингибируют секрецию слюны. Выделение слюны стимулируется симпатической и парасимпатической нервной системой (В2).
- Норадреналин запускает секрецию очень вязкой слюны с высокой концентрацией муцина при помощи β2-адренорецепторов и цАМФ. ВИПтакже увеличивает концентрацию цАМФ в ацинарных клетках.
- Ацетилхолин: (а) При помощи М-холинорецепторов и ИТФ ацетилхолин стимулирует увеличение цитозольной концентрации Са2+ в ацинарных клетках. Таким образом, увеличивается проводимость анионных каналов просвета, что приводит к синтезу жидкой слюны и увеличивает экзоцитоз слюнных ферментов;(б) при помощи М3-холинергических рецепторов ацетилхолин опосредует сокращение миозпителиальных клеток вокруг ациния, что приводит к опустошению ациния; (в) ацетилхолин увеличивает синтез калликреина, который расщепляет брадикинин из кининогена плазмы крови. Брадикинин и ВИП расширяют сосуды слюнных желез. Это необходимо, поскольку максимальная секреция слюны сильно превосходит кровоток в покое.
Глотание
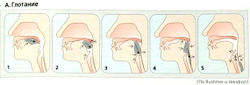
Верхняя треть стенки пищевода состоит из поперечно-полосатых мышц, а остальная часть - из гладких мышц. При глотании язык проталкивает пищевой комок в горло (А1). Носоглотка рефлекторно блокируется (А2), дыхание ингибируется, голосовые связки закрываются, надгортанник закрывает трахею (АЗ) и в это время открывается верхний сфинктер пищевода (А4). Перистальтические волны проталкивают пищевой комок в желудок (А5, Б1, 2) Если пищевой комок застревает, растяжение поврежденного участка запускает вторичные перистальтические волны.
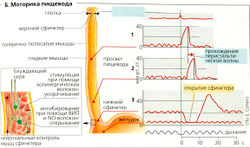
Нижний сфинктер пищевода открывается в начале глотания благодаря вазовагальному рефлексу (рецептивная релаксация), опосредованному ВИП-и NO-высвобождающими нейронами (БЗ). В остальное время нижний сфинктер остается закрытым, чтобы предотвратить рефлюкс агрессивных кишечных соков, содержащих пепсин и HCI.
Моторика пищевода обычно измеряется путем определения давления в его просвете, например, во время перистальтических волн (Б1, 2). Давление покоя в нижнем сфинктере обычно составляет 20-25 мм рт. ст. Во время рецептивной релаксации давление в пищеводе снижается, чтобы соответствовать низкому давлению в проксимальной части желудка (БЗ), указывая на открывание сфинктера.
При ахалазии рецептивной релаксации не происходит и пища накапливается в пищеводе.
Давление в нижнем пищеводном сфинктере снижается под действием ВИП, ССК, NO, GIP, секретина и прогестерона и возрастает под действием ацетилхолина, гастрина и мотилина. Увеличенное брюшное давление (внешнее давление) также увеличивает давление в сфинктере, поскольку часть нижнего пищеводного сфинктера расположена в брюшной полости.
Нейтрализация pH. pH остаточного желудочного сока, сохранившегося после очистки объема, все еще низкий, но постепенно увеличивается во время каждого акта глотания. Другими словами, проглоченная слюна нейтрализует остаточный желудочный сок.
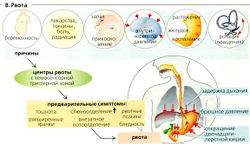
Рвотный рефлекс
Рвотный рефлекс играет роль защитного рефлекса, но также является важным клиническим симптомом таких явлений, как внутричерепное кровотечение и опухоли. Процессу рвоты предшествует тошнота, увеличенное слюноотделение и рвотные позывы (В). Центр рвоты расположен в продолговатом мозге внутри ретикулярной формации. В основном он контролируется хеморецепторами зоны пострема, расположенными на дне четвертого желудочка, этот участок называется хеморецепторной триггерной зоной (ХТЗ). Гематоэнцефалический барьер в этом участке не столь непроницаем, как в самом заднем поле ромбовидной ямки.
ХТЗ активируется никотином, другими токсинами, а также дофаминовыми агонистами наподобие апоморфина (используется как рвотное средство). Клетки в районе ХТЗ имеют рецепторы для медиаторов, ответственных за их нейрональный контроль. Рвотный центр также может быть активирован независимо от ХТЗ, например, при аномальной стимуляции органов равновесия (кинезия, морская болезнь), слишком большом растяжении желудка или кишечника, запоздалом очищении желудка и воспалении брюшных органов. Тошнота и рвота часто появляются в первом триместре беременности (утром) и могут развиваться в рвоту у беременных, ведущую к связанным с рвотой расстройствам (см. ниже).
Желудочно-пищеводный рефлюкс. Периодический заброс желудочного сока в пищевод происходит достаточно часто. Рефлюкс может случиться при глотании (если нижний пищеводный сфинктер открылся на пару секунд) из-за неожиданного давления на полный желудок или из-за краткого открытия сфинктера (продолжительностью до 30 с - это часть рефлекса отрыжки). Желудочный рефлюкс сильно понижает pH в дистальном отделе пищевода.
Для предотвращения повреждения слизистой оболочки пищевода после желудочно-пищеводного рефлюкса работают защитные механизмы:
Очистка объема, т. е. быстрый возврат заброшенной жидкости в желудок посредством пищеводного перистальтического рефлекса. Рефлюкс объемом в 15 мл, например, находится в пищеводе 246 около 5-10 с (только небольшой объем остается более долгое время).
При рвоте диафрагма остается в позиции вдоха, брюшные мышцы быстро сокращаются, производя большое давление на желудок. Одновременное сокращение двенадцатиперстной кишки блокирует путь в кишечник; нижний пищеводный сфинктер расслабляется, что приводит к выдавливанию содержимого желудка через пищевод.
Осложнения хронической рвоты сводятся к снижению потребления пищи (недоеданию) и связанной с этим потере желудочного сока, проглоченной слюны, жидкостей и кишечных секретов. Кроме гиповолемии, из-за потери желудочного сока развивается нереспираторный алкалоз (10-100 ммоль Н+/л желудочного сока). Это сопровождается гипокалиемией из-за потерь К+ с рвотными массами (питательные вещества, слюна, желудочный сок) и мочой (связанный с гиповолемией гиперальдостеронизм).
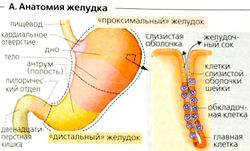
Строение и моторика желудка
Строение
Кардиальный отдел (кольцевое отверстие) соединяет пищевод с дном желудка (верхняя часть), которое переходит в тело и следующий за ним антрум желудка. Нижнее отверстие желудка (привратник) соединяет его с двенадцатиперстной кишкой (А). Размер желудка зависит от степени наполнения, однако его растяжение в основном ограничивается проксимальной частью желудка (А, Б). Стенки желудка имеют внешний слой продольных мышечных клеток (только у изгибов; регулируют длину желудка), слой мощных круговых мышц и внутренний слой косых мышечных волокон. Слизистая оболочка трубчатых желез дна и тела желудка содержит главные клетки (ГК) и обкпадочные клетки (ОК) (А), которые синтезируют компоненты желудочного сока. Слизистая оболочка желудка также содержит эндокринные клетки (синтезирующие гастрин в антруме и т. д.) и клетки слизистой оболочки шейки (КСШ).
Функциональная анатомия
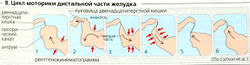
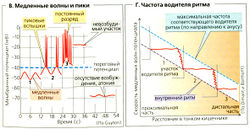
Желудок может быть подразделен на проксимальную и дистальную части (А). Вазовагальный рефлекс, запускаемый глотанием пищевого комка, вызывает открывание нижнего пищеводного сфинктераи кратковременное расширение проксимальной части желудка [рецептивная релаксация). Это продолжается после попадания пищи в желудок (вазовагальный аккомодационный рефлекс). В результате внутреннее давление почти не возрастает, несмотря на увеличение наполнения. Тоническое сокращение проксимальной части желудка, которая в основном служит резервуаром, медленно продвигает содержимое желудка в дистальную часть. Вблизи ее верхней границы (средняя треть тела желудка) находится зона водителя ритма (см. ниже), из которой распространяются перистальтические волны сокращения, в основном благодаря локальной стимуляции стенок желудка (в ответ на рефлекторную стимуляцию и гастрин; Г1). Волны перистальтики являются наиболее сильными в атриуме и распространяются в привратник. Химус продвигается к привратнику (В5, Б, 1), затем сжимается (В2, 3), а после закрытия привратника частично возвращается назад (ВЗ, 4). Таким образом, пища подвергается обработке, т. е. измельчается, смешивается с желудочным соком и переваривается, жиры при этом эмульгируются.
Дистальная часть желудка содержит клетки водителя ритма [интерстициальные клетки), мембранный потенциал которых колеблется каждые 20 с, производя характерные медленные волны. Скорость (0,5-4 см/с) и амплитуда (0,5-4 мВ) увеличиваются с их распространением к привратнику. Будет ли и как часто за этими волнами следовать сокращение, зависит от суммы всех нейрональных и гормональных воздействий. Гастрин увеличивает частоту ответа и скорость водителя ритма. Другие гормоны, такие как ГИП, прямо ингибируют эту моторику, тогда как другие (соматостатин, СС) делают это косвенно путем ингибирования высвобождения ГВП (Г1).
Опорожнение желудка. Твердая пища остается в желудке до тех пор, пока не будет разбита на мелкие частицы (диаметром <1 мм) и суспендирована до химуса. Затем химус проходит в двенадцатиперстную кишку. Время, необходимое для того, чтобы 50% проглоченного объема покинуло желудок, варьирует от 10-20 мин для воды и 1-4 ч для твердой пищи (углеводы < белки < жиры). Опорожнение желудка в основном зависит от тонуса проксимальной части желудка и привратника. Мотилин стимулирует опорожнение желудка (тонус проксимальной части желудка возрастает, привратник расширяется), тогда как снижение pH (осмоляльности химуса) или увеличение количества длинноцепочечных свободных жирных кислот и ароматических аминокислот ингибирует опорожнение желудка. Хемо-чувствительные энтероциты или клетки ворсинок слизистой оболочки тонкого кишечника, внутрижелудочные рефлексы и некоторые гормоны (ССК, ГИП, секретин и гастрин) опосредуют эту регуляторную активность (Г2). Привратник обычно слегка открыт во время этого процесса (свободный поток «готового» химуса). Он сокращается только 1) в конце «антральной систолы» (см. выше) с целью удержания твердой пищи и 2) при сокращении двенадцатиперстной кишки с целью предотвращения оттока вредных желчных солей. Если такой рефлекс имеет место, поступление аминокислот, в норме не присутствующих в желудке, вызывает рефлекторное закрывание привратника (Г2).
Неперевариваемые вещества (кости, волокна, чужеродные тела) не покидают желудок в течение фазы переваривания. Особые волны сокращения, называемые моторными мигрирующими комплексами (ММК), проходят через желудок и тонкий кишечник примерно каждые 1,5 часа во время последующего межпищеварительного периода, что определяется внутренними «биологическими часами». Эти перистальтические волны транспортируют неперевариваемые вещества из желудка и бактерии из тонкого кишечника в толстый кишечник. Эта «очистительная фаза» контролируется мотилином.
Желудочный сок
Трубчатые железы дна и тела желудка секретируют 3-4 л желудочного сока каждые сутки. Пепсиногены и липазы высвобождаются главными клетками, a HCI и внутренний фактор - париетальными (обкладочными) клетками. Муцин и НСО3 высвобождаются клетками слизистой оболочки шейки и другими клетками слизистой оболочки желудка.
Пепсины действуют при переваривании белков как эндопептидазы. Они отщепляются от пепсиногенов, экзоцитированных из главных клеток железистого и желудочного просвета при pH < 6. Ацетил-холин (АХ), локально высвобождаемый в ответ на Н+ (и, таким образом, косвенно, в ответ на гастрин), является главным активатором этой реакции.
Кислотность желудочного сока. pH желудочного сока падает примерно до 0,8 во время пика секреции HCI. Проглоченная пища нейтрализует pH до 1,8-4, что является оптимальным для большинства пепсинов и желудочных липаз. Низкий pH способствует денатурации белков пищи и имеет бактерицидный эффект.
Секреция HCI
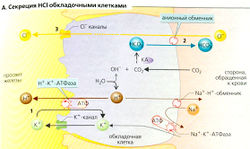
Н+-К+-АТФаза в мембране просвета обкладочных клеток проводит ионы Н+ в железистый просвет в обмен на К+ (первичный активный транспорт; А1), таким образом увеличивая концентрацию Н+ в просвете примерно в 107 раз. При этом К+ поступает назад в люмен через К+-каналы люмена. На каждый секретируемый ион Н+ один ион НСО3 покидает клетку со стороны крови и обменивается на ион CI- при помощи анионного антипортера (А2). (Ионы НСО3 образуются в реакции СО3 + ОН-, катализируемой карбоангидразой, КА). Это приводит к внутриклеточной аккумуляции ионов CI-, которые диффундируют из клетки в просвет через Сl--каналы (АЗ). Таким образом, на каждый секретируемый ион Н+ достигает просвета один ион CI-.
Активация обкладочных клеток (см. далее) ведет к открыванию канальцев, тянущихся глубоко в клетку из просвета железы (Б). Канальцы оснащены микроворсинками, которые сильно увеличивают поверхность просвета, густо покрытую молекулами мембраносвязанной Н+-К+-АТФазы. Это позволяет увеличить секрецию ионов Н+ от 2 ммоль/ч в покое до более чем 20 ммоль/ч во время процесса пищеварения.
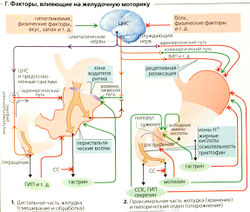
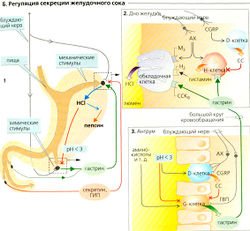
Желудочная секреция кислоты стимулируется нейрональными, локальными желудочными и кишечными факторами (Б). Потребление пищи ведет к рефлекторной секреции желудочного сока, однако дефицит глюкозы также может стимулировать этот рефлекс в мозге. Зрительный, вкусовой и обонятельный нервы являются афферентными проводниками этого частично условного рефлекса, а эфферентные стимулы проводятся блуждающим нервом. Ацетилхолин непосредственно активирует обкладочные клетки дна желудка (посредством М3-холинорецепторов, Б2). ГВП (гастринвысвобождающий пептид), высвобождаемый нейронами, стимулирует секрецию гастрина из G-клеток антрума (БЗ). Гастрин, высвобождаемый в большой круг кровообращения, в свою очередь, активирует обкладочные клетки через ССКв-рецепторы (= гастриновые рецепторы). Железы дна желудка содержат Н-клетки (гистаминовые) или ECL-клетки (знтерохромаффиноподобные клетки), которые активируются гастрином через ССКв-рецепторы, а также ацетилхолином и β3-адреномиметиками (Б2). Клетки высвобождают гистамин, который оказывает паракринный эффект на соседние обкладочные клетки (Н2-рецептор). Локальные желудочные и кишечные факторы также влияют на секрецию желудочного сока, поскольку химус в антруме и двенадцатиперстной кишке стимулирует секрецию гастрина (Б1).
Факторы, ингибирующие секрецию желудочного сока: (а) pH < 3,0 в просвете антрума ингибирует G-клетки (отрицательная обратная связь, Б1, 3) и активирует антральные D-клетки, секретирующие СС, который имеет, в свою очередь, паракринный эффект. СС ингибирует Н-клетки дна желудка, а также G-клетки антрума (Б2, 3); (б) CGRP высвобождается нейронами и активирует D-клетки антрума и дна желудка (Б2, 3);(в) секретин и ГИП, высвобождаемые в тонком кишечнике, имеют противоположный эффект на секрецию желудочного сока (Б1). Это приводит состав химуса, поступающего из желудка, в соответствие с нуждами тонкого кишечника.
Защита слизистой оболочки желудка от деструктивного воздействия желудочного сока в основном обеспечивается: (а) слизистой и (б) секрецией НСО§ нижерасположенными клетками слизистой оболочки желудка. НСО3 диффундирует через слизистую и нейтрализует кислоту, попавшую туда из просвета. Простагландины ПГ-Е2 и ПГ-l2 стимулируют секрецию НСО3.
Противовоспалительные лекарства, ингибирующие циклооксигеназу 1 и, следовательно, синтез простагландина, ослабляют защиту слизистой и могут привести к развитию язвы.
Функции тонкого кишечника
Основной функцией тонкого кишечника (ТК) является окончательное переваривание пищи и всасывание продуктов расщепления, а также воды, электролитов и витаминов.
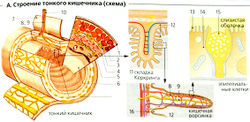
Строение. Тонкий кишечник человека имеет длину примерно 2 м. Он начинается от привратника как двенадцатиперстная кишка, продолжается тощей и заканчивается подвздошной кишкой, которая соединяется с толстым кишечником. Стенки ТК (снаружи вовнутрь) состоят из внешней серозной оболочки (А1), слоя продольных мышечных волокон (А2), мышечно-кишечного сплетения (ауербахово сплетение, АЗ), слоя круговых мышечных клеток (А4), подслизистого сплетения (мейсснерово сплетение; А5) и слизистого слоя (слизистой оболочки, А6), которые покрыты эпителиальными клетками (А13-15). ТК обеспечен кровеносными сосудами (A8), лимфатическими сосудами (А9) и нервами (А10) посредством мезентерия (А7). Поверхность контакта эпителиально-полостной области примерно в 300-1600 раз больше (> 100 м2), чем поверхность гладкой цилиндрической трубки, по причине наличия складок Керкринга (А11), кишечных ворсинок (А12) и микроворсинок, или щеточной каймы (А13).
Ультраструктура и функции. Бокаловидные клетки (А15) раскиданы между энтероцитами, осуществляющими ресорбцию (А14). Слизь, секретируемая бокаловидными клетками, действует как защитная оболочка и лубрикант (смазка). Кишечные железы (либеркюновы железы) (А1В), расположенные в основании ворсинок, содержат: (а) недифференцированные и митотические клетки, которые дифференцируют в клетки ворсинок (см. ниже); (б) клетки слизистой; (в) эндокринные и паракринные клетки, которые получают информацию от хемосенсорных клеток о составе химуса; (г) иммунные клетки. Триггеры в составе химуса запускают секрецию эндокринных гормонов и паракринных медиаторов. Трубчато-альвеолярные железы двенадцатиперстной кишки (бруннеровы железы), расположенные в глубине кишечной стенки (подслизистая оболочка), секретируют жидкость, богатую НСО3 и содержащую урогастрон (человеческий эпидермальный ростовой фактор), важный стимулятор пролиферации эпителиальных клеток.
Обновление клеток. Концы ворсинок постоянно замещаются новыми клетками из либеркюновых желез. Таким образом, весь эпителий тонкого кишечника обновляется каждые 3-6 суток. Отмершие клетки разрушаются в просвете, высвобождая ферменты, запасенное железо и т. д.
Кишечная моторика автономно регулируется кишечной нервной системой, но также подвержена гормональной регуляции и внешней иннервации. Локальные маятникообразные движения (продольных мышц) и сегментация (сокращение/релаксация циркулярных мышечных волокон) гладкой мускулатуры служат перемешиванию содержимого кишечника и приводят последний в контакт со слизистой оболочкой. Процесс усиливается за счет движения кишечных ворсинок. Рефлекторные перистальтические волны (30-130 см/мин) проталкивают содержимое кишечника в направлении прямой кишки со скоростью примерно 1 см/мин. Эти волны особенно сильны во время внутрипищеварительного периода.
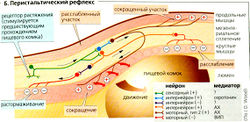
Перистальтический рефлекс. Растяжение кишечной стенки во время прохождения пищевого комка (Б) запускает рефлекс, сокращающий просвет за пищевым комком и расширяющийся перед ним. Контролируемые вставочными нейронами (мотонейроны холинергического типа II) с продолжительным возбуждением одновременно активируют циркулярные мышечные волокна за пищевым комком и продольную мускулатуру перед ним. В то же время циркулярные мышечные волокна перед пищевым комком блокируются (аккомодация), а аналогичные волокна за комком деблокируются (Б).
Водители ритма. Кишечник также содержит интерстициальные клетки водителя ритма (клетки Кахаля). Мембранный потенциал этих клеток меняется между 10 и 20 мВ каждые 3-15 мин, образуя медленные волны (В1). Их амплитуда может возрастать (менее отрицательный потенциал) или падать в ответ на нейрональный, эндокринный или паракринный стимулы. Серии потенциалов действия (всплеск пиков) возникают в тот момент, когда мембранный потенциал возрастает выше некоторого порогового значения (примерно -40 мВ) (В2). Когда впадина волны также возрастает выше порогового потенциала, происходит мышечный спазм (ВЗ).
Импульсное проведение. Вспышки пиков проводятся в миоциты через щелевой контакт. Вслед за этим миоциты ритмически сокращаются с той же частотой (или медленнее). По прохождении некоторой дистанции проведение импульса в направлении ануса ухудшается (Г, зона водителя ритма), так что более дистальные клетки (с более низким внутренним ритмом) должны принять на себя функцию водителя ритма. Следовательно, перистальтические волны тонкого кишечника продвигаются только в направлении ануса.
Поджелудочная железа
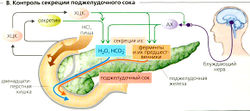
Экзокринная часть поджелудочной железы секрети-рует в двенадцатиперстную кишку 1-2 л поджелудочного сока в сутки. Панкреатический сок содержит бикарбонат (НСО3), который нейтрализует (до pH 7-8) богатый HCI химус, поступающий из желудка, и по большей части неактивные предшественники пищеварительных ферментов, расщепляющих в тонком кишечнике белки, жиры, углеводы и другие вещества.
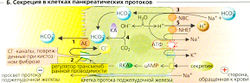
Секреция поджелудочной железы сходна со слюнной в том, что также протекает в два этапа. (1) В ацинусе секретируется CI- путем вторичного активного транспорта, за которым следует пассивный транспорт Na+ и воды. Состав электролитов в этом первичном секрете соответствует таковому в плазме крови (А1, 2). Первичный секрет поджелудочной железы также содержит пищеварительные ферменты и другие белки (экзоцитоз). (2) Ионы НСО3 добавляются к первичному секрету (в обмен на Сl во вставочных и внутри-дольковых протоках; Na+ и вода следуют за ними пассивно. В результате концентрация НСО3 в панкреатическом соке возрастает до более чем 100 ммоль/л, тогда как концентрация CI- падает (АЗ). В отличие от слюны в панкреатическом соке осмоляльность и концентрация Na+ и К+ остается постоянной (А1, 2). Большая часть панкреатического сока секретируется из протоков во время фазы переваривания (АЗ).
НСO3 секретируется через мембраны в просвет протоков при помощи анионного обменника, который одновременно реабсорбирует из просвета Сl- (Б1). Сl- возвращается в просвет по CL-каналам, которые открываются при помощи секретина более часто, с тем чтобы количество секретируемого НСО3 не превышало доступного количества Cl (Б2).
При кистозном фиброзе (муковисцидозе) ухудшение работы канала регулятора трансмембранной проводимости ведет к серьезным нарушениям функции поджелудочной железы.
НСО3, вовлеченный в процесс, продуцируется в реакции СО2 + ОН-, катализируемой карбоангидразой (КА). На каждый секретируемый анион НСО3 клетку (со стороны крови) покидает один ион Н+ при помощи Ма+-Н+-обменника (БЗ).
Секреция поджелудочного сока в ацинусах контролируется холинергическим (относящимся к блуждающему нерву) и гормональным механизмами (ХЦК). Стимуляция блуждающего нерва, по всей видимости, увеличивается при помощи ХЦКA-рецепторов в холинергических волокнах ацинуса (А2, 3, Б, В). В обоих случаях происходит увеличение внутриклеточной концентрации Са2+, [Ca2+]j, что стимулирует секрецию Сl- и (про)ферментов. Трипсин в просвете тонкого кишечника дезактивирует высвобождение ХЦК по механизму обратной связи (Г). Секретин увеличивает секрецию НСО3 и воды канальцами. ХЦК и ацетилхолин усиливают этот эффект путем увеличения концентрации Са2+ в цитозоле. Секретин и ХЦК также влияют на панкреатические ферменты. Гормоны также стимулируют рост.
Употребление в пищу соевых бобов в больших количествах ингибирует трипсин и в результате ХЦК секретируется также в перерывах между приемами пищи, что ведет к увеличению риска развития рака поджелудочной железы.
Панкреатические ферменты (ферменты поджелудочной железы) необходимы для переваривания. Они имеют оптимум pH примерно 7-8. Недостаточная секреция (например, при кистозном фиброзе) приводит к неадекватной нейтрализации химуса и, следовательно, к ослабленному пищеварению.
Протеолиз катализируется протеазами, которые секретируются в неактивной форме, т. е. в виде проферментов: трипсиногена 1-3, химотрипсиногенов А и В, проэластазы 1 и 2 и прокарбоксипептидаз А1, А2, В1 и В2. Они не активируются до тех пор, пока не достигнут кишечника, где энтеропептидаза сначала превращает трипсиноген в трипсин (Г), который, в свою очередь, превращает неактивный химотрипсиноген в активный химотрипсин. Трипсин активирует также другие панкреатические проферменты, включая проэластазы и прокарбоксипептидазы. Трипсин, химотрипсин и эластазы являются эндопротеазами, т. е. они разрушают некоторые пептидные связи в пептидной цепи.
Патологическая активация проферментов в теле поджелудочной железы заставляет этот орган переваривать самого себя (острый панкреатический некроз).
Катаболизм углеводов, а -Амилаза секретируется в активной форме и расщепляет крахмал и гликоген до мальтозы, мальтотриозы и а-декстрина. Эти продукты перевариваются далее ферментами кишечного эпителия.
Липолиз. Панкреатическая липаза является наиболее важным ферментом липолиза. Она секретируется в активной форме и расщепляет триацилглицерин до 2-моноацилглицерина и свободных жирных кислот. Активность панкреатической липазы зависит от присутствия колипаз, производимых в секрете поджелудочной железы из проколипаз (с помощью трипсина). Соли желчных кислот также необходимы для переваривания жиров.
Другие важные панкреатические ферменты включают (про)фосфолипазу А2, РНКазы, ДНКазы и карбоксилэстеразы.
Желчь
Компоненты желчи
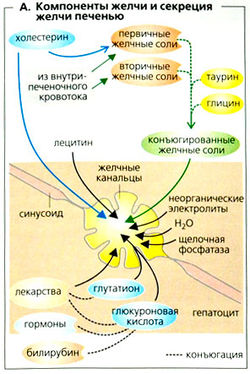
Желчь содержит электролиты, соли желчных кислот, холестерин, лецитин (фосфатидилхолин), диглюкуронид билирубина, стероидные гормоны, лекарства и т. д. (А). Соли желчных кислот необходимы для переваривания жиров. Большинство других компонентов желчи веделяется с фекалиями (экскреторная функция печени).
Образование желчи
Гепатоциты секретируют примерно 0,7 л желчи в желчных канальцах (А) -тонких канальцах, образованных клеточными мембранами близлежащих гепатоцитов. Пазушные (синусоидные) и канальцевые мембраны гепатоцитов содержат многочисленные переносчики, которые абсорбируют соответственно компоненты желчи из крови и секретируют их в протоки.
Соли желчных кислот (ЖС)
Печень синтезирует холаты и хенодезоксихолаты (первичные желчные соли) из холестерина. Кишечные бактерии преобразуют некоторые из них во вторичные желчные соли, такие как дезоксихолат и литохолат. Желчные соли образуют в печени конъюгаты с таурином или глицином и в этой форме секретируются в желчь (А). Эта конъюгация необходима для мицеллообразования в желчи и в кишечнике.
Переносчики желчных солей в печени
Конъюгированные желчные кислоты в синусоидной крови активно поглощаются NTCP (Na+-таурохолат-котранспортирующий полипептид; вторичный активный транспорт) и транспортируются против высокого градиента концентрации в канальцы (первичный активный транспорт) при помощи АТФ-зависимого переносчика HBSEP (экспортирующий насос для желчных солей у человека), также называемого сВАТ (канальцевый транспортер желчных кислот).
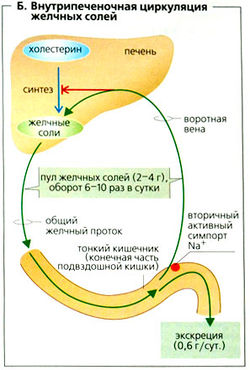
Внутрипеченочная циркуляция желчных солей
Неконъюгированные желчные кислоты немедленно реабсорбируются из желчных протоков. Конъюгированные желчные соли входят в двенадцатиперстную кишку и реабсорбируются из терминальной части подвздошной кишки при помощи Na+-симпорт-переносчика ISBT (подвздошный котранспортер натриевых солей желчных кислот) и после использования для переваривания жиров циркулируют назад в печень (энтерогепатическая циркуляция; В). Общий запас желчи (2-4 г) рециркулирует примерно 6-10 раз в сутки, в зависимости от содержания жиров в пище. Для всасывания жиров требуется примерно 20-30 г желчных кислот ежедневно.
Желчеобразование
Кишечно-печеночная (энтерогепатическая) циркуляция повышает концентрацию желчных кислот в воротной вене во время переваривания. Это (а) ингибирует синтез желчных кислот в печени (холестерин-7а-гидроксилаза; отрицательная обратная связь; Б) и (б) стимулирует секрецию желчных кислот в желчных канальцах. Последнее обстоятельство увеличивает выделение желчи при осмосе воды, т. е. вызывает зависимое от желчных кислот желчеобразование (В). Существует также независимое от желчных кислот желчеобразование. Оно вызывается секрецией в канальцы других компонентов желчи, а также секрецией в желчные протоки НСО3 (в обмен на Сl-) и Н2О (В). Второй механизм желчеобразования стимулируется блуждающим нервом и секретином.
Желчный пузырь
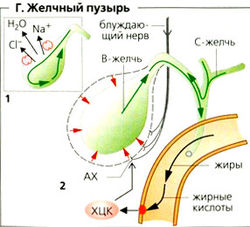
Когда сфинктер Одди между общим желчным протоком и двенадцатиперстной кишкой закрыт, печеночная желчь (С-желчь) отводится в желчный пузырь, где она концентрируется (1:10) и хранится (Г). Эпителий желчного пузыря реабсорбирует Na+, Cl- и воду (И) из хранящейся желчи, таким образом сильно увеличивая концентрацию специфических компонентов желчи (солей желчных кислот, диглюкуронида билирубина, холестерина, фосфатидилхолина и т. д.). Если желчь используется для переваривания жиров (или если перистальтические волны происходят в межпищеварительную фазу), желчный пузырь сокращается, и его компоненты смешиваются порциями с химусом в двенадцатиперстной кишке (Г2).
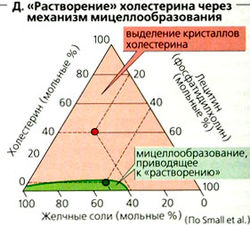
Холестерин в желчи транспортируется в виде мицелл, образованных путем агрегации холестерина с лектином и желчными солями. Изменение пропорции между этими тремя веществами в пользу холестерина (Д) ведет к преципитации (осаждению) кристаллов холестерина, ответственных за образование в желчном пузыре высококонцентрированной желчи IВ-желчи) и желчных камней. Красные и зеленые точки на рис. Д показывают эффект двух различных пропорций между этими веществами.
Сокращение желчного пузыря запускается ХЦК, который связывается с ХЦКA-рецепторами и нервным сплетением в стенке желчного пузыря, которое иннервируется преганглионарными парасимпатическими волокнами блуждающего нерва (Г2). CGRP и вещество Р, высвобождаемое сенсорными волокнами, по всей видимости, косвенно стимулирует мышцы стенок желчного пузыря путем увеличения высвобождения ацетилхолина. Симпатическая нервная система ингибирует сокращения желчного пузыря посредством a2-адренорецепторов в холинергических терминалях волокон. Жирные кислоты и продукты расщепления белков, а также яичный желток и MgS04 эффективно стимулируют секрецию ХЦК и тем самым выступают в качестве желчегонных средств.
Выделительная функция печени
Билирубин
Печень обезвреживает и выводит многие, в основном липофильные, вещества, которые или образуются в результате метаболизма (например, билирубин и стероидные гормоны), или поступают из желудочно-кишечного тракта (например, антибиотик хлорамфеникол). Однако для этих веществ требуется предварительная биотрансформация. На первом этапе биотрансформации к гидрофобным веществам энзиматически (например, при помощи монооксигеназ) присоединяются реакционноспособные группы ОН, NH2 или СООН. На втором этапе эти вещества конъюгируют с глюкуроновой кислотой, ацетатом, глутатионом, глицином, сульфатами и т. д. После этого конъюгаты становятся растворимыми в воде и могут либо далее обрабатываться в почках и выводиться с мочой, либо секретироваться клетками печени в желчь и выводиться с фекалиями. Глутатионовые конъюгаты, например, подвергаются дальнейшей обработке в почках и выводятся с мочой в виде меркаптомочевой кислоты.
Переносчики
Мембрана канальцевых гепатоцитов содержит различные переносчики, большинство из которых АТФ-зависимы. Основные из них: MDR1 (белок множественной лекарственной устойчивости I типа), специфичный для относительно гидрофобных, в основном катионных метаболитов; MDR3 специфичен для фосфатидилхолина; сМОАТ (канальцевый мультиспецифический транспортер органических анионов = белок множественной лекарственной устойчивости II типа MRP2) - для конъюгатов (с глутатионом, глюкуроновой кислотой или сульфатом) и многих других органических анионов.
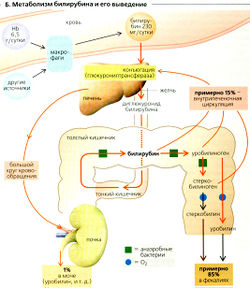
Источники билирубина и конъюгация
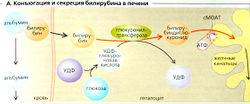
Примерно 85% всего билирубина происходит от гемоглобина эритроцитов, а остальной продуцируется другими гемовыми белками, например цитохромом (А и Б). При деградации гемоглобин расщепляется на компоненты - глобулин и железо. Промежуточный биливердин и конечный продукт билирубин -желтый желчный пигмент - образуются из порфириновых остатков. 1 г гемоглобина дает 35 мг билирубина. Свободный неконъюгированный билирубин [«непрямой» билирубин) слаборастворим в воде, но хорошо растворяется в липидной фракции и при этом токсичен. Поэтому, попадая в кровь, он образует комплекс с альбумином (2 моля билирубина; 1 моль альбумина), но не тогда, когда абсорбируется гепатоцитами (А). Билирубин конъюгирует (при катализе глюкуронилтрансферазой) с двумя молекулами УДФ-глюкуроната (синтезируемого из глюкозы, АТФ и УДФ) в клетках печени, образуя глюкуронид билирубина («прямой» билирубин).
Это вещество растворяется в воде, секретируется в желчные протоки по механизму первичного активного транспорта (сМОАТ, см. ранее).
Экскреция билирубина
С желчью выводится 200-250 мг билирубина в сутки. Примерно 90% общего количества выводится с фекалиями. В кишечнике бактерии расщепляют билирубин до бесцветного вещества, стеркобилиногена (Б). Он частично окисляется до стеркобилина - вещество коричневого цвета, окрашивает испражнения. Примерно 10% всего диглюкуронида билирубина деконъюги-руется кишечными бактериями и возвращается в печень в липофильной форме (частично как стеркобилиноген) посредством энтерогепатической циркуляции. Небольшое количество (примерно 1 %) попадает в большой круг кровообращения и выводится почками как уробилиноген = стеркобилиноген (см. далее) (Б). Скорость почечной экскреции увеличивается при повреждениях печени.
Желтуха
Концентрация билирубина в плазме крови в норме не превышает 17 мкмоль/л (10 мг/л). Концентрации, более высокие, чем 30 мкмоль/л (18 мг/л), ведут к желтоватому окрашиванию глазных склер и кожи - симптомы желтухи. Типы желтухи:
1. Прегепатическая желтуха. При образовании избыточного количества билирубина, например из-за повышенного гемолиза, печень не может более справляться с нагрузкой иначе, чем повышая концентрацию билирубина в плазме крови. Следовательно, у таких пациентов в основном повышен неконъюгированный [непрямой] билирубин.
2. Гепатическая желтуха. Основными причинами являются: (а) повреждение клеток печени токсинами [бледной поганки) или инфекцией [вирусная желтуха), что приводит к нарушениям транспорта билирубина или его конъюгации; (б) дефицит или отсутствие системы глюкуронилтрансферазы у новорожденных; (в) ингибирование глюкуронилтрансферазы, например, стероидами; (г) нарушенная секреция билирубина в желчные протоки из-за врожденного дефекта (синдром Дубина-Джонсона) или по другим причинам (лекарства, стероидные гормоны).
3. Постгепатическая желтуха. Нарушение тока желчи происходит из-за непроходимости (например, камень или опухоль) в желчном протоке, что обычно сопровождается повышенной концентрацией в сыворотке конъюгированного (прямого) билирубина и щелочной фосфатазы - оба этих вещества являются нормальными компонентами желчи.
Типы желтухи 2а, 2г и 3 сопровождаются повышенной концентрацией конъюгированного билирубина в моче - моча коричневатого цвета. При желтухе типа 3 испражнения становятся серыми из-за недостатка билирубина в кишечнике и результирующего отсутствия стеркобилина.
Переваривание липидов
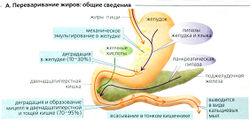
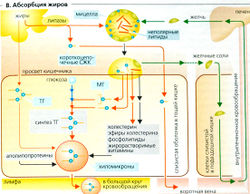
Среднее потребление липидов (масло животное и растительное, маргарин, молоко, мясо, сосиски, яйца, орехи и т. д.) составляет примерно 60-100 г в сутки, но существуют большие индивидуальные вариации (10-250 г в сутки). Большинство жиров в пище (90%) - это нейтральные жиры, или триацилглицериды (триглицериды). Остальные жиры -это фосфолипиды, эфиры холестерина и жирорастворимые витамины (витамин A, D, Е и К). Более 95% липидов обычно всасываются в тонком кишечнике.
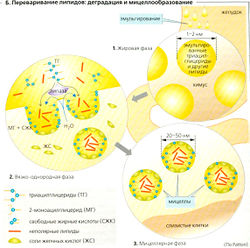
Переваривание липидов (А). Липиды плохо растворяются в воде, и поэтому для их переваривания в водной среде желудочно-кишечного тракта и для последующего всасывания и транспорта в плазму крови требуются специальные механизмы. Хотя недеградированные триацилглице-риды могут всасываться в небольших количествах, жиры пищи должны быть гидролизованы ферментами перед тем, как они смогут эффективно всосаться. Для оптимальной ферментативной активности требуется предварительная механическая эмульгация жиров (в основном в дистальной части желудка), поскольку липидные капли в эмульсии (1-2 мкм; Б1) имеют гораздо большую (относительную к массе жиров) поверхность для работы липаз.
Липазы - ферменты, растворяющие жиры, вырабатываются железами языка, дна желудка (главные клетки и слизистые клетки шейки) и поджелудочной железы (А). Примерно 10-30% пищевых жиров гидролизуется в желудке, а остальные 70-90% расщепляется в двенадцатиперстной кишке и верхней части тощей кишки. Липазы из языка и желудка имеют кислый оптимум pH, а липазы поджелудочной железы - pH 7-8. Липазы становятся активными в области контакта жира (масла) с водой (Б). Панкреатическая липаза (триацилглицеролгидролаза) проявляет липолитическую активность (максимальная скорость липолиза 140 г жира/мин) в присутствии колипаз и Са2+. Проколипазы из сока поджелудочной железы, будучи активированы трипсином, образуют липазы. В большинстве случаев панкреатические липазы расщепляют триацилглицериды (ТГ) по первой и третьей сложноэфирной связи. Этот процесс требует присутствия воды и приводит к образованию свободных жирных кислот (СЖК) и 2-моно-ацилглицерида.
При этом вокруг фермента формируется вязко-однородная фаза с водной и гидрофобной зонами (Б2). Избыток Са2+ или дефицит моноацилглицерида приводит к превращению жирных кислот в кальциевые мыла, которые потом выводятся.
Фосфолипаза А2 (образуется из профосфолипазы Аз панкреатического сока при активации трипсином) расщепляет вторую сложноэфирную связь фосфолипидов (в основном фосфатидилхолина = лектина), содержащихся в мицеллах. Для этой реакции требуется присутствие желчных солей и Са2+.
Неспецифичная карбоксилэстераза (= неспецифичная липаза = гидролаза эфиров холестерина) из панкреатического секрета воздействует на эфиры холестерина в мицеллах, а также на все три эфирные связи ТГ и эфирные связи витаминов A, D, Е.
Эта липаза также присутствует в женском грудном молоке (но не в коровьем), и поэтому вскормленные грудью младенцы получают пищеварительные ферменты, требующиеся для расщепления молочного жира вместе с молоком матери. Поскольку ферменты чувствительны к теплу, пастеризация грудного молока значительно уменьшает способность младенцев переваривать молочные жиры.
2-Моноацилглицериды, длинноцепочечные свободные жирные кислоты и другие липиды агрегируют с желчными кислотами и спонтанно формируют мицеллы в тонком кишечнике (БЗ). (Поскольку короткоцепочечные жирные кислоты более полярны, они могут всасываться непосредственно и не нуждаются в желчных кислотах или мицеллах.) Диаметр мицелл составляет всего 20-50 нм, отношение поверхность/объем у них примерно в 50 раз больше, чем у липидных капель в эмульсии. Они облегчают плотный контакт между продуктами расщепления жиров и стенкой тонкого кишечника и, следовательно, важны для всасывания липидов. Полярный конец участвующих в процессе веществ (в основном конъюгированных желчных кислот, 2-моноацилглицерида и фосфолипидов) обращен в водную среду, а неполярная - внутрь мицелл. Полностью неполярные липиды (например, эфиры холестерина, жирорастворимые витамины и липофильные яды) находятся внутри мицелл. Таким образом, неполярные липиды во время всех этих процессов остаются в липофильном окружении до тех пор, пока не достигают липофильной щеточной каймы (микроворсинок) мембран эпителия. Там они абсорбируются клетками слизистой путем либо растворения в мембране, либо пассивного транспорта (например, в случае свободных жирных кислот при помощи переносчиков). Хотя всасывание жиров завершается к тому моменту, когда химус достигает конца тощей кишки, желчные кислоты, высвобождающиеся из мицелл, абсорбируются только в конце подвздошной кишки и затем рециркулируют (внутрипеченочная циркуляции).
Распределение и хранение липидов
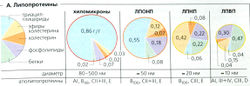
Липиды в крови транспортируются в виде липопротеинов, ЛП (А), представляющих собой агрегаты молекул (микроэмульсии) с центральной частью из сильногидрофобных липидов, таких как триацилглицерид (ТГ) и сложные эфиры холестерина (СНО-эфиры), окруженных слоем амфипатических липидов (фосфолипиды, холестерин). Липопротеины содержат также некоторые типы белков, называемых аполипопротеинами. Липопротеины различны по размеру молекул, плотности, липидному составу, а также участкам синтеза и составу аполипопротеинов. Аполипопротеины (Аро) функционируют в качестве структурных элементов липопротеинов (например, АроАII и АроВ48), лигандов рецепторов липопротеинов (АроВ100, АроЕ и т. д.) на мембране клеток-мишеней липопротеинов и активаторов ферментов (например, ApoAI и АроСII).
Хиломикроны транспортируют липиды (в основном триацилглицериды, ТГ) из кишечника на периферию (при помощи кишечной лимфы и большого круга кровообращения; Г), где их АроСII активируют эндотелиальную липазу липопротеинов (ЛЯП), которая отщепляет свободные жирные кислоты (СЖК) от ТГ. В основном СЖК абсорбируется миоцитами и жировыми клетками (Г). При помощи АроЕ хиломикронные остатки доставляют остальные триацилглицериды, холестерин и сложные эфиры холестерина в гепатоциты при помощи рецептор-опосредованного эндоцитоза (Б, Г).
Холестерин и ТГ, импортируемые из кишечника, а также синтезированные в печени, экспортируются как фракция ЛПОНП (липопротеины очень низкой плотности) из печени на периферию, где они при помощи АроСII также активируют ЛПСП, приводя к высвобождению СЖК (Г). Это приводит к потерям АроСН и экспозиции АроЕ. Остатки ЛПОНП или ЛПСП (липиды средней, или промежуточной плотности) остаются. Примерно 50% ЛПСП возвращается в печень (в основном в связанном виде - с АроЕ на рецепторах ЛПНП; см. далее), где ЛПСП репроцессируются и экспортируются из печени в виде ЛПОНП (Б).
Другие 50% ЛПСП превращаются в ЛПНП (липопротеины низкой плотности) после контакта с липазой печени (что приводит к потерям АроЕ и экспозиции АроВ100). Две трети ЛПНП доставляют холестерин и эфиры холестерина в печень, а другая треть - во внепеченочные ткани (Б). Связывание АроВ100 с рецепторами ЛПНП необходимо для обоих процессов.
Липопротеины высокой плотности (ЛПВП) обменивают некоторые апопротеины на хиломикроны и ЛПОНП и абсорбируют излишний холестерин из внепеченочных клеток и крови (Б). Вместе с АроА1 они активируют плазматические лецитин-холестеролацилтрансферазы (ЛХАТ), которые ответственны за частичную этерификацию холестерина. ЛПВП также доставляют холестерин и его эфиры в печень и железы, продуцирующие стероидные гормоны и имеющие рецепторы ЛПВП (яичники, семенники, кора надпочечников).
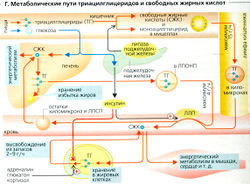
Триацилглицериды (ТГ)
Триацилглицерины, поступающие с пищей, расщепляются на свободные жирные кислоты (СЖК) и 2-моноацилглицерид (МГ) в желудочно-кишечном тракте (В). Поскольку короткоцепочечные свободные жирные кислоты растворимы в воде, они могут быть абсорбированы и транспортированы в печень по воротной вене. Длинноцепочечные жирные кислоты и 2-моноацилглицерин нерастворимы в воде. Они в клетках слизистой оболочки вновь превращаются в ТГ (В). (СЖК, необходимые для синтеза ТГ, переносятся СЖК-связывающими белками от клеточной мембраны к участкам синтеза, т. е. к гладкому эндоплазматическому ретикулуму.) Поскольку ТГ нерастворимы в воде, вслед за этим они включаются в хиломикроны, которые, в свою очередь, экзоцитируются во внеклеточную жидкость, затем проходят в кишечную лимфу (снова проходя через печень), откуда, в итоге, попадают в большой круг кровообращения (В, Г). (Плазма крови становится мутной примерно через 20-30 мин после принятия жирной пищи из-за присутствия в ней хило-микронов.) Печень также синтезирует ТГ, забирая необходимые СЖК из плазмы или синтезируя их из глюкозы. ТГ с ЛПОНП (см. ранее) после этого сек-ретируются в плазму (Г).
Поскольку экспортная емкость этого механизма ограничена, избыток СЖК или глюкозы (Г) может привести к аккумуляции ТГ в печени (жирная печень).
Свободные жирные кислоты (СЖК) представляют собой высокоэнергетические субстраты, используемые для энергетического метаболизма. Жирные кислоты, циркулирующие в крови, существуют в основном в форме ТГ (в составе липопротеинов), а СЖК плазмы образуют комплексы с альбумином. Жирные кислоты удаляются из ТГ хиломикронов и ЛПОНП липазой липопротеинов (ЛЛП) на стороне просвета эндотелия капилляров многих органов (в основном в жировой ткани и мышцах) (Г). АроСН на поверхности ТГ и ЛПОНП активируют ЛЛП. Инсулин, секретируемый после еды, индуцирует ЛЛП (Г), что способствует быстрой деградации реабсорбированых пищевых ТГ. ЛЛП также активируются гепарином (из эндотелиальной ткани, из тучных клеток и т. д.), что позволяет удалить хиломикроны из мутной плазмы; и поэтому он также называется фактором просветления плазмы. СЖК в составе комплексов с альбумином в плазме в основном транспортируются в мишени (Г).
- В сердечную мышцу, скелетную мышцу, почки и другие органы, где они окисляются до СО2 и Н2О в митохондриях (β-окисление) и используются как источник энергии.
- В жировые клетки (Г), которые либо хранят СЖК, либо используют их для синтеза ТГ. При возрастании энергетических потребностей либо снижении поставки СЖК в жировых клетках они отщепляются из триацилглицеридов (липолиз) и транспортируются в те участки, где необходимы (Г). Липолиз стимулируется адреналином, глюкагоном и кортизолом и ингибируется инсулином.
- В печень, где СЖК окисляются или используются для синтеза ТГ.
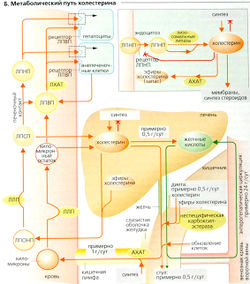
Холестерин (СНО)
Сложные эфиры холестерина (СНО-эфиры), как и триацилглицериды (ТГ), представляют собой неполярные молекулы. В водной среде организма они могут транспортироваться лишь в составе липопротеинов (или связанными с белками) и могут быть использованы в обмене веществ только после превращения в холестерин, который более полярен (Б). СНО-эфиры служат запасными веществами и в некоторых случаях как транспортная форма СНО. СНО-эфиры присутствуют во всех липопротеинах, но наиболее распространены в ЛПНП (42%) (А).
Холестерин - важный компонент клеточной мембраны. Более того, он предшественник желчных солей (Б), витамина D и стероидных гормонов. В сутки примерно 0,6 г холестерина теряется с фекалиями (в виде копростерина) и выводится через кожу. Количество желчных кислот, теряемых за сутки, составляет около 0,5 г. Эти потери (без учета потребления холестерина с пищей) должны компенсироваться путем постоянного ресинтеза холестерина в желудочно-кишечном тракте и печени (Б). Холестерин, поступающий с пищей, частично усваивается сам по себе, а частично - в этерифицированной форме (Б, справа внизу). До того как он реабсорбируется, эфиры холестерина расщепляются неспецифической панкреатической карбоксилэстеразой до холестерина, который всасывается в верхней части тонкого кишечника (Б, внизу). Клетки слизистой желудка содержат ацил-КоА-холестеринацилтрансферазу (АХАТ) - фермент, реэтерифицирующий всасываемый холестерин, так что и холестерин, и его эфиры могут быть интегрированы в хил омикроны (А). Холестерин и его эфиры СНО в остатках хиломикронов (см. ранее) транспортируются в печень, где ли-зосомальные кислые липазы снова расщепляют эфиры до холестерина. Этот холестерин, а также холестерин из других источников (ЛПНП, ЛПВП) покидают печень (Б) различными способами: 1) путем экскреции в желчь; 2) путем превращения в желчные соли, которые также потом поступают в желчь; 3) путем включения в ЛПОНП — липопротеины печени, экспортирующие липиды в другие ткани. Под действием ЛЛП (см. далее) ЛПОНП преобразуются в ЛПСП и позже в ЛПНП (Б, слева). ЛПНП транспортируют холестерин и его эфиры в клетки с рецепторами ЛПНП (печеночные и внепеченочные клетки; Б, вверху). Плотность рецепторов на поверхности клеток колеблется в соответствии с потребностями в холестерине. Как и печеночные клетки (см. выше), внепеченочные клетки поглощают ЛПНП посредством рецептор-опосредованного эндоцитоза, и лизосомальные кислые липазы переводят эфиры холестерина в холестерин (Б, справа вверху). Затем клетки могут встраивать холестерин в клеточные мембраны или использовать его для синтеза стероидов. Избыток холестерина вызывает (а) ингибирование синтеза холестерина в клетках (З-НМG-СоА-редуктаза) и (б) активацию АХАТ - фермента, зтерифицирующего и запасающего холестерин в форме его эфиров (см. ранее).
Гиперлипопротеинемия
Избыток липидов в крови может отражать увеличение уровня триацилглицеридов и/или холестерина (> 2,0-2,2 г/л сыворотки, этот показатель обнаруживается у примерно каждого пятого жителя западных стран). В наиболее серьезной форме семейная гиперлипопротеинемия (генетический дефект) вызывает увеличенную концентрацию холестерина в крови с самого рождения, что может привести к инфаркту миокарда в юношеском возрасте. Болезнь вызывается генетическим дефектом высокоаффинных рецепторов ЛПНП. Уровень холестерина в сыворотке повышается, поскольку клетки поглощают небольшие количества богатых холестерином липопротеинов низкой плотности (ЛПНП). Внепеченочные ткани синтезируют большие количества холестерина, поскольку З-НМG-СоА-редуктаза не может ингибировать синтез холестерина по причине пониженного всасывания ЛПНП. В результате все больше ЛПНП связывается с низкоаффинными рецепторами, опосредующими всасывание и запасание холестерина в макрофагах, кожных покровах и кровеносных сосудах. Таким образом, гиперхолестеринемия увеличивает риск атеросклероза и коронарной болезни сердца.
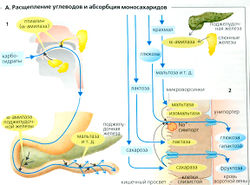
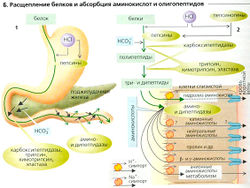
Переваривание и всасывание углеводов и белков
Углеводы обеспечивают от половины до двух третей всех энергетических резервов организма. По крайней мере, половина углеводов пищи состоит из полисахаридов крахмала (амилоза и амилопектин), другие важные углеводы - тростниковый сахар (сахароза) и молочный сахар (лактоза). Переваривание углеводов начинается во рту (А1). а-Амилаза слюны (птиалин) в средах с нейтральным pH расщепляет крахмал на олигосахариды [мальтозу, мальтотриозу, a-концевой декстрин). Этот пищеварительный процесс продолжается в проксимальной части желудка, но прерывается в дистальной части желудка, когда пища смешивается с кислыми пищеварительными соками. Панкреатическая а-амилаза, имеющая оптимум при pH 8, смешивается с химусом в двенадцатиперстной кишке. Таким образом, переваривание полисахаридов продолжается до финальной стадии образования олигосахаридов (как уже упомянуто выше). Углеводы могут всасываться только как олигосахариды. Следовательно, ферменты мальтаза и изомальтаза в микроворсинках мембраны энтероцитов просвета кишечника расщепляют мальтозу, мальтотриозу и а -концевой декстрин до конечного продукта - глюкозы. Как и в почечных канальцах, глюкоза сначала активно транспортируется переносчиком SGLT1 (Na+-симпортером) в клетки слизистой оболочки желудка (А2), а потом пассивно диффундирует при помощи GLUT2, глюкозного унипортера (облегченная диффузия), попадая в воротную циркуляцию. Гидролиз сахарозы, лактозы и трегалозы катализируется другими ферментами микроворсинок - лактазой, сахаразой и трегалазой. Кроме глюкозы эти реакции высвобождают галактозу (из лактозы), которая абсорбируется теми же переносчиками, что и глюкоза; и фруктозу, которая пересекает мембрану энтероцитов при помощи пассивного унипортера: GLUT5 в мембране просвета и GLUT2 в базолатеральной мембране (А2).
Дефицит лактазы
Лактоза не может быть расщеплена и абсорбирована, если в организме нет достаточного количества лактазы. Дефицит лактазы ведет к диарее, поскольку 1) вода осмотически удерживается в просвете кишечника и 2) кишечные бактерии превращают лактозу в токсичные вещества.
Переваривание белков начинается в желудке (Б1). HCI в желудке денатурирует белки и превращает три пепсиногена в восемь различных пепсинов. При рМ 2-5 эти эндопептидазы расщепляют белки в тех участках, где в пептидную цепь включены тирозин и фенилаланин. Пепсины инактивируются в тонком кишечнике (pH 7-8). Панкреатический сок также содержит проферменты других пептидаз, которые активируются в двенадцатиперстной кишке. Эндопептидазы трипсин, химотрипсин и эластаза гидролизуют белковые молекулы до коротких пептидов. Карбоксипептидазы А и В (из поджелудочной железы) наряду с дипептидазой и аминопептидазой (ферментами микроворсинок) расщепляют пептидную связь в белках, превращая их в трипептиды, дипептиды и (в основном) аминокислоты. Эти продукты расщепления всасываются в двенадцатиперстной и тощей кишке.
Аминокислоты транспортируются набором различных переносчиков (Б2), сходных с теми, которые обнаружены в почках. Нейтральные (не несущие суммарного заряда) и анионные («кислые») L-аминокислоты транспортируются Na+-симпортера-ми (вторичный активный транспорт; с. 34) из просвета кишечника в клетки слизистой, из которых они пассивно диффундируют вместе с переносчиками в кровь. Катионные («основные») L-аминокислоты, такие как L-аргинин+, 1-лизин+ и 1-орнитин+, частично поглощаются энтероцитами при помощи Na+-не-зависимых механизмов, поскольку движущей силой их транспорта является мембранный потенциал. Анионные аминокислоты, такие как L-глутамаГ и L-ac-партат-, которые по большей части расщепляются в клетках слизистой, также имеют свои собственные (Na+- и К+-независимые) системы переносчиков. Нейтральные аминокислоты используют несколько различных транспортеров.
Дисфункция всасывания аминокислот может быть врожденной и затрагивать разные группы аминокислот. Эти расстройства часто связаны с дефектами почечных канальцев (почечная аминоацидурия, например цистинурия).
Дипептиды и трипептиды могут абсорбироваться как интактные молекулы при помощи симпорт-переносчиков (PepT1). Переносчик работает благодаря градиенту Н+ (Б2), что, в свою очередь, генерируется секрецией Н+ (третичный активный H-пептидный симпорт). Аминокислоты обычно гораздо быстрее абсорбируются в виде дипептидов и трипептидов, чем в виде свободных аминокислот. Входя в клетку, они гидролизуются до свободных аминокислот.
Всасывание витаминов
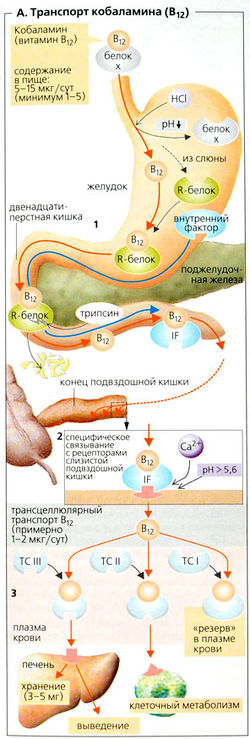
Высшие животные не могут синтезировать кобаламин (витамин В12), они должны получать этот кофермент из пищи. Животные продукты (печень,почки, рыба, яйца, молоко) являются его основными источниками.
Биохимия кобаламина. Водный, или ОН-кобаламин, является предшественником двух активных форм, метил- и аденозилкобаламина. Метилкобаламин необходим для образования метионина из гомоцистеина; кобаламин переносит метильную группу, необходимую для этого типа N5-метилтетрагидрофолата (см. далее), на гомоцистеин. Некоторые ферменты, например метилмалонил-СоА-мутаза, нуждаются в аденозилкобаламине для разрыва и образования углерод-углеродных связей.
Кобаламины - это сравнительно большие гидрофильные молекулы, которые требуются транспортным белкам (А). Во время прохождения через желудочно-кишечный тракт, плазму крови и другие компар-тменты кобаламин связывается с (1) внутренним фактором (IF), который секретируется обкладочными клетками желудка; (2) транскобаламином II (ТС II) в плазме крови; (3) R-белками в плазме крови (ТС I) и гранулоцитах (ТС III), слюне, желчи, молоке и т. д. Кислота желудка высвобождает кобаламин из белков пищи. В большинстве случаев кобаламин связывается с R-белками в слюне или (при высоком pH) с IF (А1). R-белки перевариваются в двенадцатиперстной кишке под действием трипсина, что приводит к высвобождению кобаламина, который затем соединяется с (устойчивым к трипсину) внутренним фактором (IF). В концевой части подвздошной кишки слизистая оболочка имеет высокоспецифичные рецепторы для комплекса кобаламин-IF. ТС II связывается с этими рецепторами и абсорбируется путем рецептор-опосредованного эндоцитоза, при условии, что pH > 5,6, и при доступности ионов Ca2+ (А2). Плотность рецепторов, а поэтому и скорость всасывания увеличиваются во время беременности. Кобаламин связывается с TCI, II и III в плазме крови (АЗ). ТС II в основном распределяет кобаламин во все клетки, претерпевающие деление (рецепторы ТС II, эндоцитоз). ТС III (из гранулоцитов) транспортирует избыток кобаламина и нежелательные производные кобаламина в печень (рецепторы ТС III), где они либо хранятся, либо выводятся в составе желчи. Время полужизни ТС I, который служит кратковременным депо кобаламина в плазме крови около 10 суток.
Вегетарианская диета или нарушения всасывания кобаламина могут привести к серьезным симптомам дефицита, например пернициозной анемии (= дефицит В-12-фолата) и повреждению спинного мозга (фуникулярный миелоз). Требуются годы для развития этих симптомов, поскольку организм имеет резерв, в 1000 раз превышающий ежедневные потребности (1 мкг).
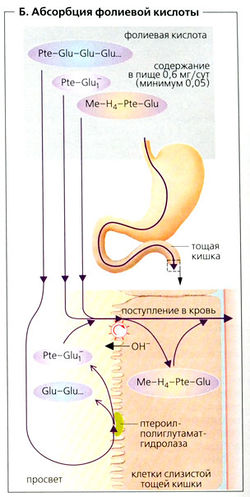
Фолиевая кислота/фолат (= птероилглютаминовая кислота). N5, N10-метилентетрагидрофолат, метаболически активная форма фолиевой кислоты (ежедневная потребность составляет 0,1-0,2 мг), требуется для синтеза ДНК (образование дезокситимидилата из дезоксиуридилата). Фолиевая кислота из пищи обычно содержит до семи глутаминовых остатков (у-связанная пептидная цепь: Pte-Glu7) вместо птероилглютаминовой кислоты [Pte-Glu1). Поскольку только Pte-Glu1 может абсорбироваться из просвета проксимальной части двенадцатиперстной кишки (Б), полиглутаминовая цепь фолиевой кислоты должна быть укорочена перед всасыванием. Это осуществляется ферментом птероилглютамат-гидролазой, локализованной в мембране просвета энтероцитов. Абсорбция Pte-Glu-1 (в обмен на 0Н~) осуществляется специфическим активным транспортером. В клетках слизистой Pte-Glu1 распадается с образованием N5-метилтетрагидрофолата (5ме-Н4-фолата) и других метаболитов. Если эти метаболиты уже присутствуют в проглоченной пище, то они всасываются из просвета кишечника при помощи упомянутого выше механизма. (Такой же механизм действия цитостатического лекарственного препарата метотрексата (подавляющего деление клеток).) Метилкобаламин требуется для превращения 5-Ме-H4-фолата в тетрагидрофолат (см. ранее). Организм имеет в виде запасов около 7 мг фолиевой кислоты, что достаточно на несколько месяцев (ср. дефицит фолиевой кислоты).
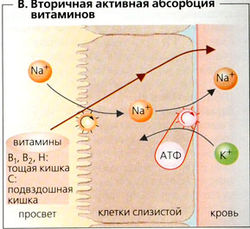
Другие водорастворимые витамины, а именно В1 (тиамин), В2 (рибофлавин), С (аскорбиновая кислота) и Н (биотин, ниацин (= никотиновая кислота)), абсорбируются при помощи Na+-симпорт-переносчиков (В). Витамин С всасывается из подвздошной кишки, тогда как витамины B1, B2 и Н — из двенадцатиперстной. Витамины группы B6 (пиридоксаль, пиридоксин, пиридоксамин), вероятнее всего, абсорбируются пассивно.
Жирорастворимые витамины А (ретинол), D3 (холекальциферол), Е (токоферол), K1 (филлохнон) и K2 (менахинон) для всасывания должны быть включены в мицеллы (см. переваривание липидов). Механизм всасывания еще неизвестен, хотя и установлено, что имеет место частичное насыщение и процесс является энергозависимым. Жирорастворимые витамины для транспорта в плазму крови включаются в хиломикроны и ЛПОНП.
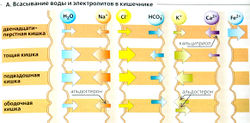
Всасывание воды и минеральных веществ
В среднем потребление воды (в виде напитков и пищи) составляет примерно 1,5 л в сутки. Дополнительно 7 л жидкости секретирует желудочно-кишечный тракт (слюна, желудочный сок, желчь, панкреатический сок и кишечные секреты), а с фекалиями выводится только 0,1 л. Следовательно, при пищеварении должно всасываться по крайней мере 8,4 л воды в сутки. Всасывание воды происходит в основном в двенадцатиперстной и подвздошной кишке и только очень небольшие количества в прямой кишке (А). Вода проходит через кишечный эпителий при помощи осмоса. Когда в кишечнике происходит всасывание растворенных веществ (Na+, Cl- и т. д.), вода следует за ними (Б). (Стул содержит лишь незначительные количества Na+, Cl и воды.) И напротив, секреция веществ в просвет или переваривание неабсорбируемых веществ ведет к притоку воды в просвет кишечника. Таким образом, слабовсасываемые вещества ведут себя как слабительные (например, сульфаты, сорбитол, полиэтиленгликоль).
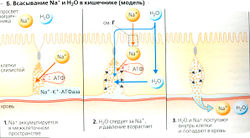
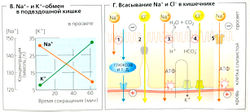
Всасывание воды в основном стимулируется абсорбцией Na+, Сl- и органических веществ (Б). Концентрация Na+ и Сl- в просвете постепенно понижается от двенадцатиперстной кишки к прямой. Если взять Na+, то его концентрация в двенадцатиперстной кишке составляет примерно 145 ммоль/л, в подвздошной -125 ммоль/л и только 40 ммоль/л - в прямой (В). Na+ абсорбируется по различным механизмам, но во всех перечисленных отделах кишечника (Б, Г) в основном с помощью Na+-K+-ATФaзы базолатеральной мембраны.
- Симпорт Na+ и органических веществ: Na+ пассивно входит в клетки двенадцатиперстной и тощей кишки при помощи симпорт-переносчиков, которые активно котранспортируют глюкозу, аминокислоты, фосфаты и другие вещества (вторичный активный транспорт, Г1). Поскольку это электрогенный транспортный механизм, проведение Сl- из просвета наружу осуществляет люмен-отрицательный трансэпителиальный потенциал (ЛОТП) (Г2).
- Параллельный транспорт Na+ и Сl-. Ионы Na+ в просвете подвздошной кишки обмениваются на ионы Н+ (ГЗ), тогда как ионы Сl- обмениваются на ионы НСО3 (Г4). Ионы Н+ соединяются с ионами НСО3 с образованием H2O и СО2, которые диффундируют из просвета кишечника. По такому электронейтральному транспортному механизму, обусловленному осмосом, абсорбируется большая часть Na+, Сl- и Н2О.
- Диффузия Na+. В основном Na+ в прямой кишке абсорбируется через люменальные Na+-каналы (Г5). Этот транспорт Na+ является электрогенным и альдостерон-зависимым. Связанный с ним люмен-отрицательный трансзпителиальный потенциал (ЛОТП, см. ранее) либо ведет к секреции К+, либо проводит ионы Сl- из просвета кишечника (Г2).
Механизм секреции ионов Сl- в эпителиальных клетках (в основном в либеркюновых криптах) аналогичен таковому в ацинии слюнных желез. Приток Сl- в просвет кишечника и связанный с ним отток Na+ и воды стимулируется при помощи цАМФ и регулируется нейронами и гормонами, такими как ВИП (вазоактивный интестинальный пептид) и простагландины. Физиологическое значение этой формы секреции Н2О может состоять в разбавлении вязкого химуса или в обеспечении рециркуляции воды (крипты → просвет → ворсинки → крипты) для обеспечения абсорбции плохо растворимых веществ.
Холерный токсин ингибирует ГТФазу Gs-белков, таким образом поддерживая максимальную концентрацию цАМФ и, следовательно, заметное увеличение секреции Cl. В ответ большие количества воды и Na+ секретируются в просвет кишечника, и это может вести к сильной диарее (до 1 л в час).
Дополнительно к HCO3 из панкреатического сока, НСО3 также секретируется в просвет тонкого и толстого кишечника (А). Ионы К+ секретируются (аль-достеронзависимый механизм) клетками крипт толстой кишки (концентрация К+ в просвете составляет примерно 90 ммоль/л!) и реабсорбируются при помощи Н+-К+ насоса поверхности эпителия (сходно с механизмом в желудке). Соотношение секреция/абсорбция К+ (альдостеронзависимые процессы) определяет количество выводимого К+ (А). Диарея приводит к потерям К+ и НСО3 (гипокалиемия и метаболический ацидоз).
Ca2+. Со стулом выводится треть потребляемого с пищей Са2+. Са2+ всасывается в верхней части тонкого кишечника (А) при помощи внутриклеточного кальцийсвязывающего белка (СаВР). Кальцитриол увеличивает синтез СаВР, таким образом увеличивая абсорбцию Са2+. Дефицит витамина D или веществ, которые образуют нерастворимые в воде комплексы с Са2+ (фитин, оксалат, жирные кислоты), снижает всасывание Са2+. Мg2+ абсорбируется по похожим механизмам, а железо (Fe) -по другому.
Толстый кишечник
Желудочно-кишечный тракт заканчивается толстым кишечником (слепая кишка и толстая кишка, примерно 1,3 м в длину) и прямой кишкой. Слизистая оболочка толстого кишечника имеет специфические ямки (крипты), большая часть которых выстлана бокаловидными клетками, образующими слизь. Некоторые поверхностные клетки имеют мембрану со щеточной каймой (микроворсинками) и реабсорбируют ионы и воду.
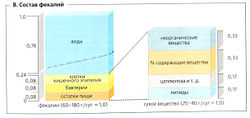
Толстый кишечник выполняет две основные функции: (1) служит в качестве резервуара содержимого кишечника (слепая кишка, нисходящая часть толстой кишки и прямая кишка); (2) там всасываются вода и электролиты, тем самым примерно 500-1500 мл химуса, достигающего толстого кишечника, может сократиться до 100-200 мл. Толстый кишечник не жизненно важный орган; следовательно, большие участки толстого кишечника могут быть удалены, например при лечении рака.
Вода, попадающая в прямую кишку при клизме, реабсорбируется. Ректально доставляемые лекарства (суппозитории) также диффундируют через кишечную стенку в кровоток. Вещества, вводимые этим путем, обходят печень, а также избегают воздействия кислоты желудка и пищеварительных ферментов.
Моторика
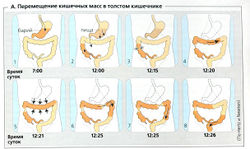
Выделяют разнообразные локальные перемешивающие движения толстого кишечника, например сильные сокращения (гаустрация) его сегментов, связанные с формированием карманов, а также антероградные или ретроградные перистальтические волны (водитель ритма, расположенный в поперечной ободочной кишке). Таким образом, содержимое ободочной (толстой) кишки может попасть в слепую кишку. Движение каловых масс происходит 2-3 раза в течение дня (А). Стимул возникает с поступлением новых порций пищи и вызывает желудочно-толстокишечный рефлекс и секрецию желудочно-кишечных гормонов.
Передвижение каловых масс можно наблюдать при помощи рентгеноскопии после введения бариевой взвеси. Как показано на диаграмме (А1-8). А1: бариевая взвесь вводится в 7 ч утра. А2: полдень: бариевая взвесь видна в последней петле подвздошной кишки и в слепой кишке. Прием пищи в обед стимулирует очищение подвздошной кишки. АЗ: через примерно 5 мин вершина бариевой взвеси сдавливается. А4: вскоре после этого бариевая взвесь продвигается в поперечную ободочную кишку. А5: гаустрация разделяет бариевую массу в поперечной ободочной кишке, перемешивая ее содержимое. А6-8: через несколько минут (все еще во время еды) поперечная ободочная кишка резко сокращается, отделяя порцию содержимого кишечника, и быстро проталкивает ее в сигмовидную ободочную кишку.
Кишечные бактерии
Желудочно-кишечный тракт стерилен при рождении, но позже, в первые несколько недель жизни, заселяется перорально введенными бактериями. Толстый кишечник здорового взрослого человека содержит 1011—1012 бактерий/мл (содержимого), подвздошная кишка — 106 на мл. Низкий pH внутри желудка важен как барьер против патогенов. Следовательно, в верхней части тонкого кишечника бактерии практически отсутствуют (0-104). Кишечные бактерии увеличивают активность кишечной иммунной системы («физиологическое воспаление»), а их метаболическая активность очень полезна для хозяина (человека). Бактерии синтезируют витамин К и превращают неперевариваемые вещества (например, целлюлозу) или частично перевариваемые сахариды (например, лактозу) в абсорбируемые короткоцепочечные жирные кислоты и газы (метан, Н2, СО2).
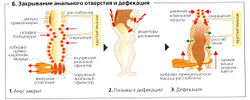
Анус в норме закрыт
Закрытие ануса регулируется поперечной ректальной складкой (складкой Кольрауша), лобково-прямокишечной мышцей, внутренним (непроизвольным) и наружным (произвольным) анальными сфинктерами и венозным сплетением. Оба сфинктера сокращаются тонически, внутренний сфинктер (гладкая мускулатура) - самопроизвольно или после стимуляции симпатическими нейронами (L1, L2) через а-адренорецепторы, а наружный (поперечно-полосатая мускулатура) -после стимуляции срамного нерва.
Дефекация
Заполнение верхней части прямой кишки (ампулы прямой кишки) содержимым кишечника стимулирует ректальные рецепторы растяжения (Б2), вызывая рефлекс расслабления внутреннего сфинктера (аккомодация нейронов посредством ВИП), сокращение наружного сфинктера и позыв к дефекации. Если принято (обычно сознательное) решение произвести дефекацию, прямая кишка укорачивается, лобково-прямокишечная и внешняя мышца сфинктера ануса расслабляются и опосредованное спинальным (S2-S4) парасимпатическим рефлексом сокращение круговых мышц нисходящего колена толстой кишки, сигмовидной ободочной кишки и прямой кишки выталкивает фекалии из организма с помощью увеличения брюшного давления (Б). Нормальная частота эвакуации колеблется от 3 раз в сутки до 3 раз в неделю, в зависимости от содержания в пище неперевариваемых волокон (например, целлюлозы, лигнина). Частый водянистый стул (диарея) и редкий стул (запор) ведут к разнообразным нарушениям.
Стул (фекалии; В). Средний взрослый человек выделяет 60-180 г фекалий в сутки. Примерно четвертую часть составляет сухая масса, а примерно треть - бактерии толстого кишечника.