Кислотно-щелочной баланс
Содержание
- 1 Кислотно-основный гомеостаз
- 2 pH, рН-буферы.Кислотно-основный баланс
- 3 Буферная система бикарбонат - диоксид углерода
- 4 Ацидоз и алкалоз
- 5 Нереспираторные (метаболические) кислотно-основные патологии
- 6 Респираторные (дыхательные) кислотно-основные патологии
- 7 Оценка кислотно-основного статуса
- 8 Почки и кислотно-основный баланс
- 9 Читайте также
Кислотно-основный гомеостаз[править | править код]
pH, рН-буферы.Кислотно-основный баланс[править | править код]
Значение pH (водородный показатель) служит для оценки активности (эффективной концентрации) ионов водорода Н+ в растворе (активность Н+ = fH • [Н+], квадратные скобки означают концентрацию).
pH = -lg (fH • [Н+]). [6.1]
У здоровых людей pH крови в среднем составляет 7,4 (область нормальных значений), что соответствует активности ионов Н+ примерно в 40 нмоль/л. Поддержание в организме постоянного pH жизненно важно. Большие отклонения от нормы могут оказывать нежелательное влияние на метаболизм, проницаемость мембраны, распределение электролитов. Значения pH крови ниже 7,0 и выше 7,8 являются летальными.
За поддержание постоянного pH в организме отвечают различные pH-буферы. Одним из важных буферов крови и других жидкостей организма является бикарбонатная буферная система (HCO3/СO2):
СO2 + H2O ⇄ HCO3- + Н+. [6.2]
Значение рКа определяет соотношение между концентрациями буферного основания и буферной кислоты (в уравнении [6.2] [HCO3] и [СO2] соответственно) при заданном значении pH [уравнениеХендерсона-Хассельбаха А).
Основная функция бикарбонатной буферной системы крови - нейтрализация ионов Н+. Эта буферная система играет особо важную роль, поскольку концентрации обоих буферных компонентов можно регулировать независимо друг от друга; [СO2] - путем дыхания, [HCO3] - в печени и в почках (А). Таким образом, это открытая буферная система.
Гэмоглобин красных кровяных клеток (320 г НЬ/л эритроцитарной массы) - вторая важная буферная система крови, которая также называется небикарбонатной.
НbН ⇄ Hb + Н+ [6.3]
Оху-НЬН ⇄ Оху-Hb- + Н+. [6.4]
Анион оксигемоглобина (Oxy-Hb) способен присоединить меньше ионов Н+, чем дезоксигенированный Hb(более слабая кислота). Таким образом, в легких при окислении гемоглобина до оксигемоглобина высвобождаются ионы Н+. Равновесие реакции [6.2] сдвигается влево, что способствует высвобождению СO2 из бикарбоната. При этом, в свою очередь, увеличивается удаление СO2 легкими.
Другие небикарбоиатные буферы крови включают белки плазмы и неорганический фосфат (Н2РО4 ⇄ Н+ + НРO24), а также органические фосфаты (в красных кровяных клетках). Внутриклеточные органические и неорганические вещества в различных тканях также функционируют как буферы.
Буферная система характеризуется буферной емкостью (моль • л-1 • [ΔрН]-1); это количество ионов Н+ или ОН-, которое надо добавить в расчете на единицу объема, чтобы изменить pH раствора на одну единицу. Буферную емкость можно найти из кривой титрования. Буферная емкость зависит: (а) от концентрации буфера и (б) от pH. Чем дальше pH раствора от рКа буферной кислоты, тем меньше буферная емкость. Буферная емкость крови составляет —75 ммоль • л-1 • [ΔрН]-1 при pH 7,4 и постоянном PCO2. Поскольку буферная емкость зависит от PCO2, для оценки буферной емкости крови в клинической медицине обычно используется концентрация буферных оснований крови (норма —48 мэкв/л). Концентрация буферных оснований - это сумма концентраций всех компонентов буфера, которые связывают ионы водорода, т. е. HCO3, Hb~, Oxy-Htf, дифосфоглицерат-анионы, анионные белки плазмы, НРО4- и т. д.
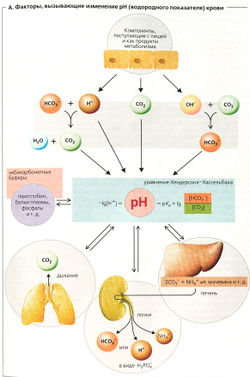
Изменения pH крови обусловлены главным образом следующими факторами (А).
- Поступление ионов Н+: из пищи (например, из уксуса) или как продуктов метаболизма; они могут также удаляться из крови (например, почками).
- Поступление ионов ОН~ из пищи, содержащей соли слабых кислот, особенно при вегетарианской диете.
- Изменение концентрации СO2: из-за нарушений метаболизма или выведения СO2 через легкие. Уменьшение [СO2] ведет к увеличению pH (А: [СO2] находится в знаменателе).
- HCO3. может удаляться прямо из крови через почки или кишечник (при диарее). Увеличение или уменьшение [HCO3] ведет к изменению pH (А: [HCO3] в числителе).
Буферная система бикарбонат - диоксид углерода[править | править код]
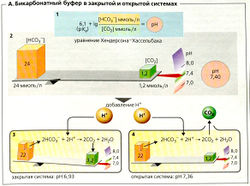
pH в любом буферном растворе определяется соотношением концентраций компонентов буфера и рКа. Согласно уравнению Хендерсона-Хассельбаха, pH раствора бикарбонатного буфера определяется отношением концентраций бикарбоната и растворенного углекислого газа ([HCO3~]/[СO2]) СА1). Если [HCO3] = 24 ммоль/л, а [СO2] = 1,2 ммоль/л, то [HCO3]/[СO2] = 24/1,2 = 20. Ig 20 = 1,3, а рКд = 6,1. Подставив эти значения в уравнение (А2), получим pH = 7,4. Если [HCO3] уменьшится до 10, а [СO2] до 0,5 ммоль/л, то отношение концентраций [НС0з]/[СO2] не изменится, и pH останется постоянным.
При добавлении к буферному раствору ионы Н+ соединяются с буферным основанием (HCO3 в данном случае), что приводит к образованию буферной кислоты (HCO3 + Н+ -* СO2 + H2O). В закрытой системе, из которой не может быть удален СO2 (АЗ), количество образовавшейся буферной кислоты (СO2) эквивалентно количеству буферного основания (HCO3). Обращение направления реакции происходит при добавлении гидроксид-ионов: СO2 + ОН-⇄ HCO3. После добавления 2 ммоль/л ионов Н+ исходное отношение [HCO3]/[СO2] = 24/1,2 (А2) меняется на 22/3,2, что приводит к уменьшению pH до 6,93 (АЗ). Таким образом, в закрытой системе при pH 7,4 буферная емкость НС0з/СO2, рKa, = 6,1, очень низкая.
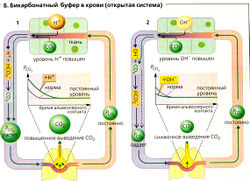
Если, однако, дополнительно образовавшийся СO2 выводится из системы (открытая система; А4), при добавлении Н+ (2 ммоль/л) изменится только [HCO3], а отношение [НС0з1/[СO2] (24/1,2) и pH (7,36) при этом лишь немного отличается от закрытой системы. В организме бикарбонатный буфер действует как открытая система, в которой парциальное давление (PCO2) и, следовательно, концентрация углекислого газа в плазме ([СO2] = а * PCO2) регулируется при дыхании (Б). Через легкие обычно удаляется столько СO2, сколько его образуется в результате метаболизма (15 000-20 000 ммоль/сут), а альвеолярное давление PCO2 остается постоянным. Поскольку при каждом дыхательном цикле РСO2 в плазме крови приводится к альвеолярному PCO2- артериальное PCO2 (PaCO2) также остается постоянным. Увеличение концентрации Н+ на периферии ведет к увеличению PCO2 венозной крови (HCO3 + Н+ ⇄ СO2 + H2O) (Б1). Легкие удаляют дополнительный СO2 так быстро, что артериальное давление PCO2 остается практически неизменным, несмотря на поступление дополнительного количества ионов Н+ (открытая система).
Следующий пример демонстрирует, что повышенное выведение СО; через легкие дает небольшой эффект. Двукратное увеличение количества ионов Н+, образующихся в организме за день (обычно 60 ммоль/сут), приведет к дополнительному образованию 60 ммоль СO2 (без учета небикарбонатных буферов). Это соответствует только 0,3% от нормального ежедневного удаления СO2.
Повышенный приток ионов ОН- на периферию имеет примерно такой же эффект. Поскольку СO2 + ОН" -» HCO3, концентрация бикарбоната [HCO3] возрастает, PCO2 в венозной крови становится меньше нормы. Так как скорость удаления СO2 также снижена, артериальное давление PCO2 (в приведенном примере) не меняется (Б2).
При pH 7,4 открытая буферная система HCO3/СO2 обеспечивает около 2/3 буферной емкости крови, когда PCO2 остается постоянным - на уровне 5,33 кПа. Остальную буферную емкость создают внутриклеточные небикарбонатные буферы.
Поскольку небикарбонатные буферы (НББ) действуют в закрытых системах, общая концентрация их компонентов ([основание] + [кислота]) остается постоянной даже после нейтрализации, однако в ответ на изменения концентрации гемоглобина она изменяется (гемоглобин - главный компонент НББ). При нереспираторных (метаболических) кислотно-основных нарушениях небикарбонатные буферы дополняют карбонатную буферную систему НС0з/СO2, а если патология не связана с дыхательной системой, то эффективно работают только НББ.
Ацидоз и алкалоз[править | править код]
Основная цель кислотно-основной регуляции - поддержание в норме pH крови и, таким образом, всего организма. Референтные (в норме) показатели кислотно-основного гомеостаза в плазме (артериализо-ванной капиллярной крови) указаны в таблице 2 и [HCO3]).
Референтные (в норме) кислотно-основные показатели плазмы крови
|
женщины |
мужчины | |
|
[Н+] (нмоль/л) |
39,8 ± 1,4 |
40,7 ±1,4 |
|
pH |
7,40 ± 0,015 |
7,39 ±0,015 |
|
РСO2, (кПа) |
5,07 ± 0,3 |
5,47 ± 0,3 |
|
[мм рт. ст.) |
38,9 ± 2,3 |
41,0 ±2,3 |
|
[HCO3] (ммол/л) |
24,0 ± 2,5 |
24,0 ±2,5 |
Кислотно-основный гомеостаз осуществляет сохранение баланса в нескольких процессах:
- (Приток извне или образование ионов Н+) -(приток или образование ионов HCO3) = = (выведение ионов Н+) - (выведение ионов HCO3) = 60 ммоль/сут (зависит от диеты).
- (Образование ионов CO2) = (выведение СO2) = 15 000-20 000 ммоль/сут.
Основными факторами, влияющими на первое равновесие, являются образование ионов Н+ (HCI, H2SO4, молочная кислота, Н3РО4 и т. д.) и их адекватное выведение почками. Вегетарианская диета может привести к значительному притоку ионов HCO3 (метаболизм: СO2 + ОН-⇄ HCO3). Чтобы компенсировать дополнительный приток извне, HCO3 выводится с мочой (следовательно, моча у вегетарианцев имеет тенденцию к защелачиванию).
Нарушения кислотно-основного баланса. Алкалоз наступает в том случае, если pH крови увеличивается выше нормы (см. таблицу), а ацидоз - при падении pH крови ниже наименьшего допустимого значения. Респираторные (дыхательные) кислотно-основные патологии наступают из-за первичных изменений PCO2, тогда как нереспираторные (метаболические)-из-за изменений [HCO3]. Кислотно-основные патологии могут быть частично или почти полностью компенсированы.
Нереспираторные (метаболические) кислотно-основные патологии[править | править код]
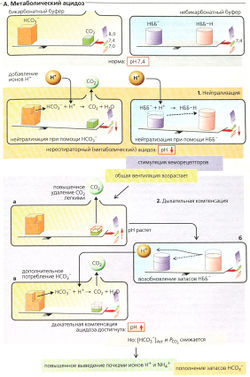
Нереслираторный ацидоз в основном вызывается: (1) почечной недостаточностью или дефектом секреции Н+ в почечных канальцах, что приводит к нарушению нормального выведения ионов Н+ (почечный ацидоз), (2) гиперкалиемией; (3) увеличенным образованием β-гидроксимасляной и ацетоуксусной кислот (сахарный диабет, голодание); (4) повышенным анаэробным превращением глюкозы в молочную кислоту (лактат + Н+), т. е. интенсивной физической нагрузкой или гипоксией; (5) усиленным метаболическим образованием HCI и H2SO4 в случае потребления пищи, богатой белками', (6) потерей HCO3 за счет почечной экскреции (проксимальный почечно-канальцевый ацидоз, использование ингибиторов карбоангидразы) или при диарее.
Нейтрализация (А1) избытка ионов Н+ происходит на первых стадиях нереспираторного ацидоза (потеря одного аниона HCO3 приводит к прибавлению одного иона Н+). Две трети буферной емкости обеспечивается за счет HCO3, остальное (V3) - за счет небикарбонатной буферной системы (НББ~), причем СO2, образующийся из HCO3, удаляется из организма через легкие (открытая система). Понижаются стандартный бикарбонат [HCO3]St, фактическая концентрация [HCO3]Act и концентрация буферных оснований (БО), возникает «дефицит оснований», т. е. отрицательный избыток оснований (BE, от англ, base excess).
Дыхательная компенсация нереспираторного ацидоза (А2) происходит на второй стадии. Общая вентиляция в ответ на уменьшение pH (через центральные хемосенсоры) снижает альвеолярное и артериальное давление PCO2 [гипервентиляция, А2а). Это не только помогает вернуть отношение [HCO3]/[СO2] к норме (20:1), но и превращает НББ-Н обратно в НББ- (через увеличение pH) (А2б). Дальнейший процесс также требует HCO3 и, следовательно, дальнейшего компенсационного удаления СO2 через легкие (А2в). Если причина ацидоза сохраняется, то дыхательная компенсация в итоге становится недостаточной и происходит увеличение почечной экскреции ионов Н+, при условии ацидоза непочечного происхождения (см. выше, причина 1).
Нереспираторный (метаболический) алкалоз вызывается: (1) введением оснований (например, при инфузии HCO3): (2) увеличением распада органических анионов (например, лактат, а-кетоглутарат2-); (3) потерей ионов Н+ из-за рвоты или гипокалиемии; (4) уменьшением объема жидкости. Нейтрализация при метаболическом алкалозе аналогична таковой при нереспираторном ацидозе (увеличение [НС0з]St, положительный избыток оснований; BE - международный показатель; от англ, base excess). Однако емкость дыхательной компенсации посредством гиповентиляции ограничена из-за возникающего дефицита О2.
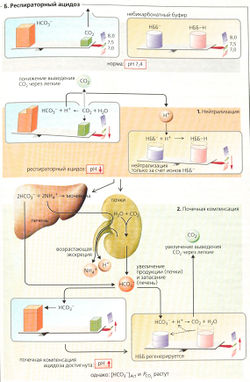
Респираторные (дыхательные) кислотно-основные патологии[править | править код]
Респираторный (дыхательный) алкалоз (Б) происходит в том случае, когда легкие удаляют больше СO2, чем образуется при метаболизме - гипервентиляция, что приводит к снижению РСO2 в плазме крови (гипокапния). И соответственно респираторный ацидоз происходит в том случае (Б), если удаляется меньше СОг, чем образуется, - гиповентиляция, что приводит к увеличению PCO2 в плазме (гиперкапния). Бикарбонатные и небикарбонатные (НББ-) буферные основания вместе компенсируют увеличение pH при метаболическом (нереспираторном) ацидозе, однако при респираторном алкалозе эти две буферные системы ведут себя различно (Б1). Система HCO3/СO2 в данном случае неэффективна, поскольку изменение РСO2 - причина, а не результат дыхательного алкалоза.
Респираторный (дыхательный) ацидоз может происходить при повреждении легочной ткани (например, при туберкулезе), при ухудшении альвеолярного газообмена (например, при отеке легких), при параличе дыхательных мышц (например, при полиомиелите), дыхательной недостаточности (например, при передозировке наркотиков), при недостаточной подвижности грудной клетки (например, в результате сильного искривления позвоночника), а также при других патологиях. В результате происходит увеличение концентрации СO2 в плазме ([СO2] = а • PCO2) и увеличение продукции HCO3 и Н+ (Б1, слева). Ионы Н+ связываются основаниями некарбонатных буферов (НББ- + Н+ ⇄ НББ-Н; Б1, справа), в то время как фактическая концентрация [HCO3]Act увеличивается. В отличие от нереспираторного ацидоза при респираторном ацидозе HCO3]St не изменяется (по крайней мере, в начале, так как этот показатель определен для нормы PCO2 и [БО] сохраняется неизменной, потому что снижение [НББ] эквивалентно увеличению [HCO3]Act;. Поскольку относительное увеличение [HCO3]Act гораздо ниже, чем рост [СO2], отношение [HCO3]/[СO2] и pH ниже, чем в норме (ацидоз).
Если повышенное давление PCO2 поддерживается, происходит почечная компенсация (Б2) дыхательных нарушений. После латентного периода в 1-2 дня почки также начинают выводить избыточное количество ионов Н+ в составе титруемых кислот и NH4+. Каждый выведенный ион NH4+ приводит к связыванию одного иона HCO3 в печени, а каждый выведенный ион Н+ приводит к высвобождению канальцевыми клетками одного иона HCO3 в кровь. Этот процесс продолжается до тех пор, пока pH не достигнет нормы,
несмотря на увеличение PCO2. Часть ионов HCO3 используется для связывания Н+, высвобождаемых в реакции НББ-Н ⇄НББ- + Н+ (Б2, справа). По причине сравнительно длительного латентного периода почечной компенсации уменьшение pH более выражено при остром дыхательном ацидозе, чем при хроническом. При хронической форме ацидоза [HCO3] может возрастать примерно на 1 ммоль на каждые 1,34 кПа (10 мм рт. ст.) увеличения PCO2.
Респираторный (дыхательный) алкалоз обычно вызывается гипервентиляцией из-за тревоги (беспокойства) или в условиях высокогорья (дефицит кислородной вентиляции), что приводит к уменьшению PCO2 в плазме крови. Это ведет к небольшому снижению [HCO3 ]Act, поскольку некоторые ионы HCO3- превращаются в СO2 (HCO3 + Н+ ⇄ СO2 + Н2О); необходимые для этой реакции ионы HCO3 нейтрализуются ионами Н+ из НББ (нейтрализация: НББ-Н ⇄ НББ- + Н+). Это также является причиной для дополнительного снижения [HCO3-] при дыхательной компенсации нереспираторного ацидоза. Для адекватной нормализации pH (компенсации) требуется дальнейшее снижение [HCO3]Act. Это достигается при уменьшении выведения ионов Н+ почечными канальцами. В результате почки выводят повышенное количество ионов HCO3 (почечная компенсация).
При остром респираторном ацидозе или алкалозе СO2 диффундирует из крови в спинномозговую жидкость (СМЖ) быстрее, чем HCO3 и Н+. Низкая концентрация НББ при этом вызывает довольно сильные флуктуации значений pH спинномозговой жидкости, обеспечивая адекватную стимуляцию центральных хемосенсоров.
Оценка кислотно-основного статуса[править | править код]
По уравнению Хендерсона-Хассельбаха для бикар-бонатной буферной системы (НС0з/СO2)
pH = р Ка + Iд[HCO3]/[СO2]. [6.5]
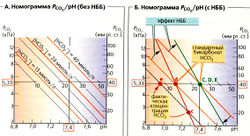
Поскольку [СO2] = а • PCO2, уравнение [6.5] содержит две константы (рKа и а) и три переменные (pH, [HCO3] и PCO2). При 37 °С плазмы крови рКa = 6,1 и а = 0,225 ммоль * л-1 • кПа-1. Когда одна из переменных не изменяется (например, [HCO3]), две другие (например, PCO2 и pH) взаимозависимы. На графике это прямая, если по оси X отложить pH, а по оси Y - lg PCO2 (A-В).
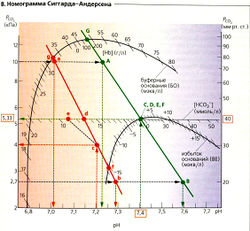
Если в бикарбонатном буфере (в отсутствие других буферов) изменяется PCO2, то pH меняется, но [HCO3] остается постоянной (А, жирная линия). Можно также нанести на график линии для различных концентраций HCO3, все они параллельны друг другу (А, Б, оранжевые прерывистые линии). На рис. A-В использованы шкалы, при которых линии концентраций бикарбоната пересекают оси координат под углом в 45°. Номограмма Сиггарда-Андерсена (В) использует не линии, а точки пересечения линий [HCO3] с линией РСO2 в норме (5,33 кПа = 40 мм рт. ст.).
Кровь содержит не только буфер НС0з/СO2, но также небикарбонатный буфер, НББ). Благодаря этому изменения PCO2 не затрагивают pH в той степени, как в растворе, содержащем только бикарбонатный буфер. Следовательно, в номограмме PCO2/pH наклон круче, чем 45° (Б, зеленая и красная линии). Отсюда при изменении pH фактическая концентрация бикарбоната в крови [HCO3]Act меняется в том же направлении, что и PCO2. Поэтому при анализе крови определяют и [HCO3]Act, и стандартный бикарбонат [HCO3]St. По определению, [HCO3]St представляет собой [HCO3] при PCO2 в норме (5,33 кПа = 40 мм рт. ст.). Следовательно, [HCO3]st позволяет оценить концентрацию [HCO3], которая не зависит от изменения PCO2.
Концентрации [HCO3]Act, и [HCO3']St, находят путем измерения в крови PCO2 и pH на анализаторе газов. На номограмме Сиггарда-Андерсена [HCO3]St определяется в точках пересечения линии [HCO3] (Б, оранжевые линии) и линии PCO2/pH (Б и В, зеленая и красная линии) при PCO2 в норме 5,33 (Б и В, точки D и d). [HCO3]Act определяют из пересечения линии [HCO3] с линией PCO2/рН на уровне фактически измеряемого давления PCO2. Поскольку PCO2 в норме и измеряемая величина коррелируют, обычно [HCO3]Act [HCO3]st. Если PCO2 отклоняется от нормы (Б, В, точка с), то [HCO3]Act соответствует точке е на линии HCO3 (Б, В, прерывистая линия 45°), на которой расположена фактически измеряемое давление PCO2 (Б, В, точка с).
Измерения и pH крови. При использовании метода калибровки (метода Аструпа) снимается три показания pH: (1) в образце цельной крови;(2) в равновесном образце с высоким PCO2 (например, 10 кПа = 75 мм рт. ст.; В: точки А и а), (3) в равновесном образце с низким PCO2 (2,7 кПа = = 20 мм рт. ст.; В: точки В и b). PCO2 в исходном образце крови затем можно определить из линий A-В и а—Ь, используя значение pH, полученное в измерении 1. В норме (В, прописные буквы, зеленый цвет) [HCO3]Act = [НС0з-]St = 24 ммоль/л (В, точки Е и D).
На примере 2 (В, строчные буквы, красный цвет) показаны кислотно-основные нарушения: pH слишком низкий (7,2) и [HCO3]St (В, точка d) уменьшилась до 13 ммоль/л (метаболический ацидоз). Произошла частичная компенсация с уменьшением PCO2 до 4 кПа, что привело к снижению [HCO3]Act до 11 ммоль/л (В, точка е).
Общее содержание буферных оснований (БО) и избыток оснований (BE) также можно определить из номограммы Сиггарда-Андерсена (В). Избыток оснований (точки F и f) равен разности между измеренной суммарной концентрацией буферных оснований (точки G и д) и нормой буферных оснований (точка G). Точка G зависит от концентрации гемоглобина в крови (В, [Нb/БО). Подобно [HCO3]St, отклонение БО от нормы (0 ± 2,5 мэкв/л) применяется при диагностике первичных нереспираторных кислотно-основных патологий.
Зависимость PCO2/рН образца крови (В) может быть определена, если известны: (1) PCO2, (2) pH, (3) концентрация гемоглобина.
Почки и кислотно-основный баланс[править | править код]
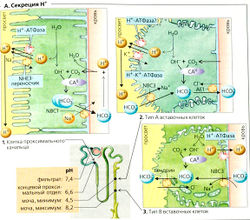
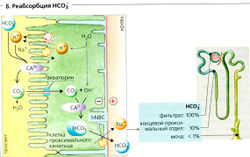
Основные функции почечной экскреции Н+ (А):
- реабсорбция отфильтрованного бикарбоната (Б),
- экскреция ионов Н+, измеряемая как титруемая кислотность (В];
- неионный транспорт NH^, т. е. в форме NH3 (Г1, 2).
1. Очень большие количества ионов Н+ секретируются в просвет проксимальных канальцев (А1) при помощи: (а) первичного активного транспорта посредством Н+-АТФазы\ (б) при помощи вторичного активного транспорта посредством злектронейтрального Na+-H+-антипортера (переносчика NHE3). pH в просвете снижается от 7,4 (фильтрат) до примерно 6,6. На каждый секре-тируемый ион Н+ один ион ОН- остается внутри клетки; ион ОН- реагирует с СОз - образуется HCO3 (что ускоряется карбоангидразой-ll, см. ниже). Ион HCO3 покидает клетку и переходит в кровь, где связывает один ион Н+. Таким образом, каждый ион Н+, декретируемый в просвет (и экскретируемый), способствует удалению из организма одного иона Н+, за исключением тех случаев, когда секреция иона Н+ сопровождается секрецией NH3 (см. ниже).
2. В соединительных канальцах и собирательной трубочке (А2) вставочные клетки типа А декретируют ионы Н+ при помощи Н+-К+-АТФазы и Н+-АТФазы, что вызывает падение pH в просвете до 4,5. Остаточный 0Н~ в клетке реагирует с СОд с образованием HCO3, который высвобождается на базолатеральной мембране через анионные транспортеры АЕ1 (= SLC 4 AD (А2). При метаболическом алкалозе вставочные клетки типа В могут декретировать HCO3 через пендрин (SLC 26 А4) (АЗ).
Карбоангидраза (КА) играет важную роль во всех случаях, когда ионы Н+ выходят с одной стороны клетки и/или ионы HCO3 выходят с другой стороны, например, в клетках почечных канальцев, которые содержат КА" в цитоплазме и KAIV на наружной стороне люминальной мембраны (А, Б, Г), как в желудке, тонком кишечнике, протоке поджелудочной железы и эритроцитах, и т. д. КА катализирует реакцию
H2O + СO2 ⇆ Н+ + HCO3 .
Угольная кислота (Н2СО3) часто считается промежуточным продуктом этой реакции, но с КА, вероятно, соединяется ОН" (а не H2O). Поэтому, реакции Н2О ⇆ ОН" + Н+ и ОН" + СОз HCO3 лежат в основе вышеупомянутой суммарной реакции.
Реабсорбция HCO3
Количество HCO3, фильтруемое каждый день, в 40 раз больше количества, присутствующего в крови. Следовательно, для поддержания кислотно-основного баланса ион HCO3 должен быть реабсорбирован. Ионы Н+, секретируемые в просвет проксимальных извитых канальцев, реагируют примерно с 90% фильтруемого HCO3 с образованием СO2 и H2O (Б). KAIV, закрепленная на мембране, катализирует эту реакцию. СОд диффундирует в клетку, возможно, с помощью аквапорина 1 (Б). КА" катализирует превращение СO2 + Н2О в Н+ + HCO3 внутри клетки (Б). Ионы Н+ снова декретируются, тогда как ионы HCO3 выходят через базолатеральную мембрану клетки посредством электрогенного переносчика (NBC1 = NBCel = SSCL4 А4, см. Б) - 1 Na+ в котранспорте с 3 HCO3 (и/или 1 HCO3 + 1СО3-?). Таким образом, HCO3 транспортируется из просвета через мембрану в форме СO2 (движущая сила: A/fod и выходит из клетки через базолатеральную мембрану как HCO3 (движущаяся сила - мембранный потенциал).
Гипокалиемия ведет к снижению мембранного потенциала (уравнение Нернста) и, таким образом, к увеличению базолатерального транспорта HCO3. Это приводит к увеличению секреции Н+ и, следовательно, к гипокалиемическому алкалозу.
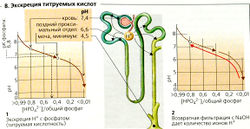
Выведение мочевой кислоты. Если потребление белков с пищей составляет 70 г в сутки , то после расщепления аминокислот ежедневно в организм поступает 190 ммоль Н+. HCI (из аргинина, лизина и гистидина), H2SO4 (из метионина и цистина), Н3РО4 и молочная кислота - вот главные источники ионов Н+. Это нелетучие кислоты, которые, в отличие от СO2, не удаляются при дыхании. Поскольку для распада органических анионов (глутамата, аспартата, лактата и т. д.) используется около 130 ммоль Н+ в сутки, общая продукция Н+ составляет около 60 (40-80) ммоль/сут. Хотя ионы и нейтрализуются в месте их образования, для регенерации буферных свойств они должны выводиться.
В экстремальных случаях pH мочи может возрастать примерно до 8 (высокий уровень экскреции HCO3) или падать до 4,5 (максимальная концентрация Н+ составляет 0,03 ммоль/л). При ежедневной экскреции около 1,5 л мочи почки выводят <1% производимых ионов Н+ в свободной форме.
Титруемые кислоты (80% фосфата, 20% мочевой кислоты, лимонная кислота и т. д.) составляют значительную фракцию (10-30 ммоль/л) выводимых Н+ (В1). Это количество ионов Н+ можно определить путем титрования мочи щелочью NaOH до pH плазмы (7,4) (В2). Примерно 80% фосфата (рКа = 6,8) в крови существует в форме НР04, тогда как в кислой моче почти весь фосфат присутствует как Н2РО4, т. е. секретируемые ионы Н+ нейтрализуются i фильтруемыми ионами НРО4. Нереабсорбированный фосфат (5-20% фильтруемого количества), следовательно, связывает ионы Н+, причем примерно половина находится в проксимальных канальцах (pH 7.4 → 6.6). а остальные - в собирательной трубочке (pH 6,6 → 4.5) (В1). При ацидозе мобилизуется из костей и экскретируется повышенное количество фосфата. Результирующее увеличение выведения Н+ превосходит усиление образования NH4+, связанное с ацидозом (см. ниже).
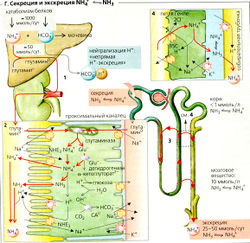
Экскреция ионов аммония (NH4 ⇆ NH3 + Н+) составляет примерно 25-50 ммоль/сут при среднестатистической диете и эквивалентна расходу Н+. Таким образом, NH4+ является непрямой формой выведения Н+ (Г). NH4+ не является титруемой формой кислоты. В отличие от НРО4 + Н+⇆ Н2РО4, реакция NH3 + Н+ ⇆NH4+ не действует как буфер из-за высокого значения рКа ~ 9,2. Однако на каждый экскретируемый почками ион NH4+ один ион HCO3 запасается печенью. Это эквивалентно одному расходуемому иону Н+, поскольку один запасаемый ион HCO3 может связать один ион Н+ (и как следствие осуществить «непрямое» выведение Н+). При среднем потреблении белка с пищей метаболизм аминокислот приводит к образованию примерно эквимолярных количеств ионов HCO3 и NН4+ (примерно 700-1000 ммоль/сут). Печень утилизирует примерно 95% этих двух веществ, образуя мочевину (И): 2HCO3- + 2NH4+ ⇆ H2N-C-NH2 + С02 + ЗH2O О [7.131
Таким образом, на каждый ион NН4+, поступающий из печени в почки, потребляется и выводится с мочой один ион HCO3. Перед экспортом NH4+ в почки печень включает его в глутамат, что приводит к образованию глутамина, и только небольшая часть достигает почек в виде свободного NH4+. Высокие концентрации NH4+ NH3 токсичны.
В почках глугемин входит в клетки проксимальных канальцев при помощи Na+-симпорта и расщепляется митохондриальной глутаминазой, образуя NH4+ и глутамат (Glu). Glu далее превращается глутаматдегидрогеназой в а-кетоглуторат с образованием второго иона NH4+ (Г2). NH4+ может достигнуть просвета канальцев двумя путями: (1) он диссоциирует внутри клетки с образованием NH3 и Н+, позволяя NH3 диффундировать (не по ионному механизму) в просвет, где он вновь соединяется с отдельно секретируемыми ионами Н+; (2) переносчик NHE3 секретирует NH4+ (вместо Н+). Как только ион NH4+ поступает в тонкий сегмент восходящего колена петли Генле (Г4), переносчик BSC реабсорбиру-ет NH4+ (вместо К+), так что тот остается в мозговом веществе почек. Рециркуляция ионов NH4+ через петлю Генле приводит к образованию очень высокой концентрации NH4+ ⇆ NH3 + Н+ в направлении почечных сосочков (ГЗ). Тогда как ионы Н+ активно закачиваются в просвет собирательной трубочки и, возможно, NH3-транспортерами (гликопротеины RhB и RhC) (Я2, Г4), молекулы NH3 поступают сюда путем неионной диффузии (Г4). Градиент NH3, необходимый для осуществления этой диффузии, образуется благодаря тому, что очень низкое значение pH просвета (около 4,5) ведет к гораздо меньшей концентрации NH3 в просвете, чем в мозговом межклеточном пространстве, где pH выше примерно на две единицы, и концентрация NH3, следовательно, тоже выше, чем в просвете, примерно в 100 раз.
Нарушения кислотно-основного метаболизма. Когда развивается хронический нереспираторный ацидоз непочечной природы, экскреция возрастает по сравнению с нормальным уровнем в течение 1-2 дней примерно в 3 раза благодаря параллельному увеличению образования глутамина печенью (за счет мочевины) и активности почечной глутаминазы. Нереспираторный алкалоз только снижает почечную продукцию NH4+ и секрецию Н+. Это происходит вместе с увеличением фильтруемого HCO3 (повышенная концентрация в плазме), приводя к быстрому увеличению экскреции HCO3 и вслед за этим к осмотическому диурезу. Для компенсации респираторных нарушений важно, что повышенный (или пониженный) уровень Род, приводит к увеличенной (или уменьшенной) секреции Н+ и, следовательно, увеличенной (или уменьшенной] резорбции HCO3. Рецепторы CO2 и HCO3 на базолатеральной поверхности клетки регулируют этот процесс.
Почки также могут быть первичной причиной кислотноосновных нарушений (почечный ацидоз), при этом дефект может быть или генерализованным, или изолированным. При генерализованном дефекте, как например при почечной недостаточности, ацидоз развивается из-за снижения экскреции ионов Н+. При изолированном дефекте с нарушением проксимальной секреции ионов Н+ большие количества фильтруемого HCO3 не реабсорбируются, что ведет к проксимальному почечному канальцевому ацидозу. Когда ослабление выделения ионов Н+ почками происходит в собирательной трубочке (например, при нарушении функции гена АЕ1), моча больше не может закисляться (pH > Б, несмотря на ацидоз), и экскреция титруемых кислот и NH4+ закономерно ухудшается (дистальный почечный канальцевый ацидоз).