Физиология мышечного сокращения
Стимуляция мышечных волокон[править | править код]
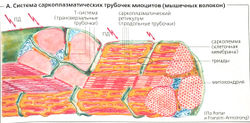
Высвобождение ацетилхолина вблизи двигательной концевой пластинки скелетной мышцы ведет к возникновению тока концевой пластинки, который распространяется электротонически и активирует быстрые потенциалзависимые Na+-каналы в сарколемме. Это ведет к возникновению потенциала действия (ПД), который проводится со скоростью 2 м/с вдоль сарколеммы всего мышечного волокна и быстро проникает в глубь волокна по Т-системе (А).
Генетические дефекты в структуре натриевых каналов замедляют их дезактивацию, что приводит к повышенной возбудимости с увеличением длительности сокращения и задержкой расслабления скелетной мышцы (миотония). Увеличение мышечной активности сопровождается массированным выходом ионов калия из волокна. Это приводит к гиперкалиемии, вследствие чего мышечный потенциал покоя достигает значений, при которых натриевые каналы более не могут быть активированы, и мышца оказывается временно парализована: семейный гиперкалиемический периодический паралич.
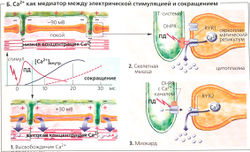
Переход от возбуждения к сокращению поперечно-полосатой мышцы называется электромеханическим сопряжением (Б). В скелетной мышце этот процесс начинается с потенциала действия, возбуждающего зависимые от напряжения дигидропиридиновые рецепторы (DHPR) в сарколемме в районе триад. Эти рецепторы организованы в ряды, а напротив них в соседней мембране саркоплазматического ретикулума находятся ряды Са2+-каналов, называемых рианодиновыми рецепторами (RYR; в скелетных мышцах рианодиновый рецептор типа 1 - сокращенно RYR1). Каждый второй RYR1 ассоциирован с DHPR (Б2). RYR1 открываются, когда механически «ощущают» изменение конформации DHPR под действием потенциала действия. В миокарде каждый DHPR является частью потенциалзависимого Са2+-канала сарколеммы, который открывается в ответ на потенциал действия. Малые количества внеклеточного Са2+ входят в клетку через этот канал, приводя тем самым к открыванию миокардиального канала RYR2 (так называемый индуцирующий эффект Са2+, или «Са2+-вспышка», БЗ). Ионы Са2+, хранящиеся в СР, выходят через открытый RYR1 или RYR2 в цитоплазму, увеличивая цитоплазматическую концентрацию Са2+ до более чем 1 мкмоль/л по сравнению с концентрацией в покое —0,01 мкмоль/л (Б1). В скелетной мышце стимуляции DHPR на одном участке достаточно, чтобы запустить «дружное» открывание всей группы RYR1. Таким образом увеличивается надежность проведения импульса. Повышенная концентрация Са2+ в цитоплазме насыщает Са2+-связывающие сайты тропонина С, отменяя ингибиторный эффект тропомиозина на скольжение филаментов (Г), которое препятствует прочному (высокоаффинному) связыванию актина и миозина II.
У пациентов с генетическими дефектами RYR1 общая анестезия может приводить к массированному выбросу кальция, что вызывает сильные мышечные сокращения, сопровождающиеся стремительным и опасным для жизни повышением температуры тела: злокачественная гипертермия (=молниеносная гиперпирексия).
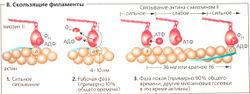
Молекулы АТФ необходимы для скольжения филаментов и, следовательно, для мышечного сокращения. Благодаря своей АТФазной активности миозиновые головки действуют как моторы (моторные белки) этого процесса. Миозиновые-ll и актиновые филаменты в саркомере организованы таким образом, что могут скользить друг по другу. Миозиновые головки соединяются с актиновыми филаментами под особым углом, образуя так называемые поперечные мостики (В1). Благодаря конформационным изменениям в районе нуклеотид-связывающего сайта миозина-ll, пространственные размеры которого увеличиваются согласованным движением участка шейки, миозиновая головка наклоняется, смещая за два последовательных «шага» тонкие филаменты в общей сложности на 4-12 нм (рабочий такт). Вторая миозиновая головка может также действует на соседний актиновый филамент, вызывая его сокращение. Затем головка отсоединяется и «напрягается», готовясь к следующему «гребку», когда свяжется с актином снова (ВЗ).
Кинезин, другой моторный белок, независимо двигается по микротрубочке посредством «шагания» двух своих головок (на 8 нм за цикл), как при перетягивании каната. В этом случае 50% цикла - «рабочее время» (коэффициент полезного действия 0,5). В скелетной мышце между двумя последовательными взаимодействиями с актином сам миозин-ll совершает «прыжок» на 36 нм (или на число нм, кратное 36, например, при быстром сокращении на 396 нм или более), чтобы достичь следующего (или 11-го) удобно расположенного актинсвязывающего сайта (ВЗ, прыжок от а к б). В то же время другие миозиновые головки, работающие на данном актиновом филаменте, должны сделать по крайней мере от 10 до 100 гребков примерно по 4 нм каждый. Коэффициент полезного действия головки миозина-ll, таким образом, от 0,1 до 0,01. Такое «разделение труда» между миозиновыми головками гарантирует, что некоторая доля миозиновых головок всегда готова совершить быстрое сокращение.
При скольжении филаментов Z-диски сближаются, и участки наложения тонких и толстых становятся шире, но их общая длина остается неизменной. Это приводит к укорачиванию 1-полосы и Н-зоны. Когда концы толстых филаментов «надвигаются» на Z-диск, происходит максимальное укорачивание мышцы и концы тонких филаментов перекрываются. Укорачивание саркомера, таким образом, происходит с обоих концов миозиновых пучков, но в противоположных направлениях.
Механизм мышечного сокращения[править | править код]
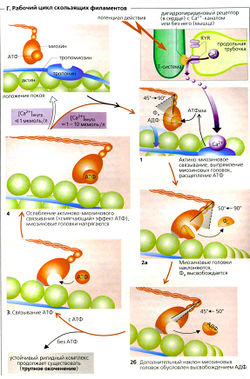
Каждая из двух головок молекул миозина-ll (М) связывает с помощью ионов Мg2+ одну молекулу АТФ в нуклеотид-связывающем сайте. Образовавшийся комплекс М-АТФ расположен под углом примерно 45° к остальной части молекулы (Г4). В этом состоянии миозин имеет очень слабое сродство к актину. Из-за воздействия повышенной концентрации Са2+ в цитоплазме на тропонин-тропомиозиновый комплекс актин (А) активирует миозиновую АТФазу, что приводит к гидролизу АТФ (АДФ + Фн) и образованию комплекса актин-миозин-АДФ-Фн (Г1). После этого головки миозина-ll вновь выпрямляются -результат этого конформационного изменения состоит в том, что константа ассоциации актина с миозином увеличивается на четыре порядка (В1, Г1). Фн (неорганический фосфат) отделяется от комплекса, что вызывает отклонение головки миозина на 40° (Г2а). Это приводит к тому, что актиновые и миозиновые филаменты скользят друг относительно друга (первая фаза рабочего такта). Последующее высвобождение АДФ вызывает вторую фазу сокращения скелетных мышц, которая однозначно завершается финальным положением головок миозина (Г2б). Сохраняющийся актино-миозиновый комплекс (ригидный комплекс) устойчив и может быть превращен в присутствии АТФ в новый комплекс, где миозиновые головки слабо связаны с АТФ [«смягчающий» эффект АТФ] Г4). Большая подвижность покоящейся мышцы важна для таких процессов, как сердечное наполнение или расслабление мышцы-разгибателя во время быстрого сгибательного движения. Если в цитоплазме сохраняется концентрация Са2+ >10-6 моль/л, циклы И и Г4 начинаются заново. Это в основном зависит от того, поступит ли следующий потенциал действия. Чтобы обеспечить плавность сокращения, только часть миозиновых головок, которые тянут миозиновый филамент, «заняты делом» единовременно (низкий коэффициент полезного действия).
Ионы Са2+, высвобождаемые из саркоплазматического ретикулума (СР), постоянно закачиваются назад за счет активного транспорта при помощи Са2+-АТФазы, также называемой SERCA . Таким образом, если RYR-опосредованное высвобождение Са2+ из саркоплазматического ретикулума прерывается, то концентрация Са2+ в цитоплазме падает ниже 10-6 моль/л и скольжение филаментов прекращается (состояние покоя, Г, верхний левый угол).
Парвальбумин, белок, присутствующий в цитоплазме быстрых мышечных волокон (F-волокон), ускоряет расслабление мышц после короткой фазы мышечного сокращения посредством связывания Са2+ из цитоплазмы в обмен на Мg2+. Сродство парвальбумина к Са2+ выше, чем у тропонина, но ниже, чем у Са2+-АТФазы саркоплазматического ретикулума. Таким образом, парвальбумин действует как «медленный» Са2+-буфер.
Ход цикла скольжения филаментов, как он описан выше, в основном относится к изотоническому сокращению, т. е. к сокращению, в ходе которого происходит укорочение скелетной мышцы. В ходе строго изометрического сокращения, когда напряжение мышцы увеличивается, но длина мышцы остается неизменной, отклонение миозиновых головок и взаимное скольжение филаментов не может произойти. Вместо этого при изометрическом сокращении усилие достигается путем деформации миозиновых головок (ГЗ).
Мышечные волокна мертвого тела не производят АТФ. Это означает, что после смерти Са2+ больше не закачивается обратно в СР и запасы АТФ, необходимые для того, чтобы разрушить стабильный комплекс актин-миозин, скоро истощаются. Это приводит к окоченению мертвого тела (трупное окоченение), которое проходит только после разложения актина и миозина в мышечном волокне.