Фармакокинетические параметры
Фармакокинетические параметры[править | править код]
Многие фармакогенетические закономерности находят свое объяснение с позиций фармакокинетики — важной области фармакологических исследований, которая описывает процессы всасывания, распределения, метаболизма и элиминации (экскреции) введенного в организм лекарственного препарата. Ниже изложены основные фармакокинетические параметры, которые используются для разработки лекарств и рационализации их применения.
Больные, страдающие хроническими заболеваниями, например диабетом и эпилепсией, должны принимать лекарства каждый день на протяжении всей жизни. Однако некоторые нуждаются лишь в одной дозе препарата для снятия головной боли.
Способ, которым пользуется человек для приема лекарственного средства, называется режимом дозирования. Как длительность лекарственной терапии, так и режим дозирования зависят от целей терапии (лечение, облегчение течения заболевания, профилактика заболевания, а в практике спортивной подготовки — повышение общей и специальной спортивной работоспособности, ускорение процессов восстановления организма после тяжелых физических и психоэмоциональных нагрузок). Поскольку практически все препараты обладают побочными эффектами, рационализация фармакотерапии достигается при выборе оптимального соотношения лечебного и побочных действий препарата.
Однако прежде всего необходимо правильно выбрать лекарственное средство. Решение принимают на основе точного диагноза заболевания, знания клинического состояния больного и глубокого понимания как патогенетических механизмов, так и механизмов действия препарата. Далее следует определить дозу, режим дозирования и длительность приема. При этом необходимо учитывать терапевтическую широту, или различия между эффективной и токсической дозой. Частота приема определяется временем, в течение которого происходит существенное снижение эффекта после однократного приема препарата. Длительность лечения определяется временем достижения терапевтического действия без выраженных побочных эффектов, в некоторых случаях возникают и фармакоэкономические проблемы. Для каждого больного эти вопросы должны рассматриваться в комплексе.
В недалеком прошлом основой их решения был метод проб и ошибок, при котором дозу, схему дозирования и способ введения выбирали эмпирически, исходя из изменения состояния больного. Однако в ряде случаев выбранные режимы приводили к токсическим проявлениям или были неэффективны. Неясно было, например, почему тетрациклин должен назначаться каждые 6—8 ч, а дигоксин — один раз в сутки; почему морфин более эффективен при внутримышечном введении, чем при пероральном, и др.
Чтобы преодолеть ограничения эмпирического подхода и ответить на возникшие вопросы, необходимо разобраться в событиях, которые следуют после приема препарата. Исследования in vitro и in vivo показывают, что эффективность и токсичность — это функция концентрации лекарственного вещества в биожидкости в месте его действия. Из этого следует, что цель фармакотерапии может быть достигнута поддержанием адекватной концентрации лекарственного средства в месте действия в течение всего периода лечения. Однако крайне редко бывает, что лекарственное средство сразу оказывается в области мишени. Например, для приема внутрь назначаются препараты, действующие на головной мозг, сердце, нервно-мышечный синапс и др., что требует их транспорта к месту действия. При этом лекарственное вещество распределяется во всех других тканях, включая те органы, особенно печень и почки, которые выводят его из организма.
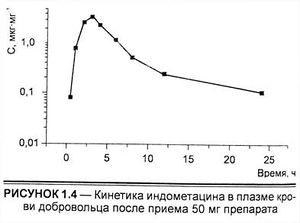
На рисунке представлены явления, имеющие место после приема препарата внутрь. Вначале скорость его поступления в организм превышает скорость элиминации, при этом концентрации в крови и других тканях возрастают, часто превышая уровень, необходимый для проявления терапевтического действия, и иногда вызывая токсические эффекты. Затем скорость элиминации лекарственного вещества становится выше скорости всасывания, поэтому концентрации препарата как в крови, так и тканях снижаются, уменьшаются проявления его действия. Таким образом, для рационализации применения препарата необходимо иметь представление о кинетике процессов всасывания, распределения и элиминации, т. е. фармакокинетике. Применение фармакокинетических параметров к управлению фармакотерапевтическим процессом является предметом клинической фармакокинетики.
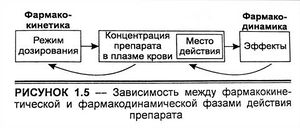
Состояние больного после приема препарата можно разделить на две фазы: фармакокинетическую, в которой доза, лекарственная форма, частота приема и способ введения связываются с зависимостью концентрация лекарственного вещества — время, и фармакодинамическая фаза, где концентрация лекарственного препарата в месте действия связывается с амплитудой вызванного эффекта.
Выделение этих двух фаз способствует разработке режима дозирования. Во-первых, можно провести разграничение между фармакокинетическими и фармакодинамическими причинами необычной реакции на препарат. Во-вторых, основные фармакокинетические параметры используются для всех лекарственных веществ; информация, полученная о фармакокинетике одного препарата, может быть прогностичной для фармакокинетики другого, имеющего сходный путь биотрансформации. В-третьих, понимание фармакокинетики лекарственного средства позволяет выбрать способ его применения, отработать индивидуальный режим дозирования с предсказуемыми последствиями.
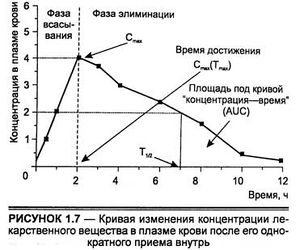
Таким образом, основной принцип клинической фармакокинетики заключается в том, что величины как желаемого, так и токсического эффекта являются функциями концентрации лекарственного вещества в месте(ах) его действия. В соответствии с этим терапевтическая недостаточность возникает, когда концентрация препарата либо слишком низкая, что не позволяет проявиться эффекту, либо слишком высокая, что вызывает токсические осложнения. Между этими границами концентраций лежит область, обусловливающая успех терапии. Эта область может рассматриваться как "терапевтическое окно". Очень редко можно непосредственно измерить концентрацию препарата в месте его действия, обычно содержание введенного вещества и/или его метаболитов измеряется в доступных биосубстратах — в плазме, сыворотке крови. Оптимальным для дозирования может считаться режим, обеспечивающий концентрацию лекарственного вещества в плазме крови в пределах "терапевтического окна". Поэтому чаше всего лекарства назначаются в дискретные интервалы времени для поддержания баланса с процессом выведения.
Развитие фармакокинетических исследований во второй половине XX в. имело большое значение для фармацевтической промышленности. Например, если обнаружено, что активное лекарственное средство недостаточно всасывается, хотя предназначено для перорального применения, то можно выбрать соединение с меньшей активностью, но лучше проникающее в организм. Подобное решение можно принять на этапе доклинических исследований, поскольку основные процессы фармакокинетики для млекопитающих сходны и могут быть экстраполированы от животных на человека. Такое же заключение можно сделать в отношении фармакокинетических экспериментов на животных, направленных на отбор рекомендуемых человеку доз препарата.
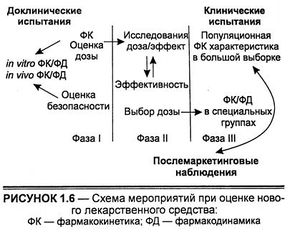
Фармакокинетические исследования в процессе первой фазы клинических испытаний, обычно проводимых на здоровых добровольцах, дают возможность оценить различные лекарственные формы и режимы их дозирования. Фармакокинетический контроль на второй фазе клинических исследований обеспечивает на малой выборке больных объективную оценку эффективности и безопасности, позволяет дать рекомендации по рациональному применению препарата на третьей фазе клинических испытаний. В необходимых случаях фармакокинетические исследования продолжают после разрешения медицинского применения в целях улучшения фармакотерапевтического профиля. Последовательность мероприятий по разработке лекарственного средства и его оценке представлена на схеме.
Фармакокинетические исследования необходимы и для решения фундаментальной проблемы фармакотерапии — индивидуальной чувствительности. К причинам различий в эффектах лекарств относят возраст, пол, массу тела пациента, тип и степень тяжести заболевания, дополнительно принимаемые больным препараты, вредные привычки и другие средовые факторы, влияющие на фармакокинетические механизмы, контролируемые в свою очередь индивидуальным набором генов.
В результате у одних больных стандартный режим дозирования окажется оптимальным, у других — неэффективным, у третьих — токсическим.
Назначение одновременно нескольких лекарств больному может также привести к проблемам, поскольку их взаимодействие в организме способно вызвать изменения в фармакокинетике отдельных препаратов.
Таким образом, необходимость использования фармакокинетических параметров в разработке и применении лекарственных средств не вызывает сомнений.
Для описания фармакокинетического профиля лекарственного вещества используется ряд параметров, необходимых для выбора режима дозирования.