Костно-мышечная система
Категория:
«Фармакология».
Содержание
- 1 Физиология костно-мышечной системы
- 2 ПАТОФИЗИОЛОГИЯ И ЗАБОЛЕВАНИЯ КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ
- 3 Остеопороз
- 4 Остеомаляция и рахит
- 5 Болезнь Педжета
- 6 Остеоартрит
- 7 Ревматоидный артрит
- 8 Подагра и другие виды кристаллического артрита
- 9 Системная красная волчанка
- 10 Серонегативные спондилоартропатии
- 11 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ
- 12 Лекарственные средства для лечения остеопороза
- 13 Лекарственные средства для лечения остеомаляции
- 14 Лекарственные средства для лечения болезни Педжета
- 15 Лекарственные средства для лечения остеоартрита
- 16 Лекарственные средства для лечения острого кристаллического артрита
- 17 Лекарственные средства для лечения системной красной волчанки
- 18 Лекарственные средства для лечения серонегативного артрита
- 19 Костно-мышечные инфекции
- 20 Литература
Физиология костно-мышечной системы[править | править код]
Костно-мышечная система защищает жизненно важные органы и отвечает за движения тела. Подвижность костно-мышечной системы зависит от взаимодействия между скелетными мышцами, приводящими в движение прикрепленные к ним кости в области суставов. Суставы соединяют две или более костей и создают скользящие поверхности, по которым могут двигаться кости. Мышечную функцию контролируют произвольные и непроизвольные импульсы, идущие из двигательной области коры головного мозга в ЦНС. Спинномозговые рефлексы регулируют мышечный тонус на том уровне, где из спинного мозга выходят нервные окончания.
Скелет состоит из различных костей и суставов, которые обеспечивают максимальную подвижность при сохранении равновесия.
Существует два типа костей:
- кортикальная компактная кость (80%) — плотная кость, оказывающая сопротивление вращательным силам, является главным компонентом трубчатых костей;
- губчатая кость (20%) оказывает сопротивление сжимающим силам и расположена на конце трубчатых костей. Позвоночник в основном состоит из губчатых костей.
Существует два типа суставов:
- синовиальный (истинный) сустав (например, коленный) позволяет совершать экстенсивные движения. Его стабильность поддерживают связки и мышцы, которые через него проходят;
- сустав, состоящий из волокнистого хряща (например, крестцово-подвздошный), обладает стабильностью, но ограничивает движения скелета.
ПАТОФИЗИОЛОГИЯ И ЗАБОЛЕВАНИЯ КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ[править | править код]
Остеопороз[править | править код]
Остеопороз — истончение нормальной кости с возрастом. Это заболевание также может развиться в молодом возрасте из-за нарушения функции яичников, возникшего естественным или хирургическим путем, из-за лекарств (например, глюкокортикостероидов) либо быть следствием образа жизни (курение, алкоголь). Остеопороз часто выявляют у женщин и приводит к переломам предплечья, тазобедренного сустава и позвоночника. Возросшее число заболевших и умерших из-за остеопороза в Европе и Северной Америке отражает растущее число стареющего населения.
Заболевания костей
- Могут вызывать переломы и боль
- Остеопороз характеризуется изменением в количестве костной ткани
- Остеомаляция характеризуется нехваткой минералов
- Болезнь Педжета характеризуется образованием аномальных костей
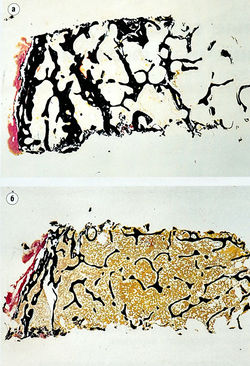
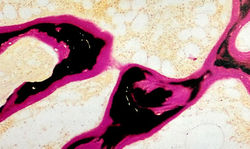
Рис. 15.1 Остеопороз. (а) Микроснимок биоптата подвздошной кости, помещенного в смолу. Видны нормальные кортикальные и губчатые кости, обработанные методом серебрения, при котором кость, содержащая кальций, чернеет, (б) Микроснимок кости больного остеопорозом. При сравнении с микроснимком (а), который показывает костную массу здорового пациента того же возраста, видно, что кортикальная зона уже, а губчатая тоньше и отличается меньшей массой (предоставлено Alan Stevens, Jim Lowe).
Лучший способ установить риск перелома — определить плотность костей
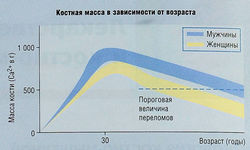
При остеопорозе качество кости остается нормальным, но количество костной ткани уменьшается (рис. 15.1). Баланс между образованием (функция остеобластов) и резорбцией кости (функция остеокластов) влияет на увеличение или уменьшение массы костной ткани с течением времени. Массу костной ткани определяют совокупным эффектом этих одновременно идущих процессов. Она увеличивается от рождения до 30 лет у мужчин и у женщин (рис. 15.2), а затем медленно уменьшается, причем у женщин в период менопаузы это уменьшение происходит быстрее.
Как образование, так и резорбцию костной ткани можно установить с помощью гистоморфологического анализа биопсии костей или определить напрямую, используя маркеры образования и резорбции костей. Обычно отслеживают концентрацию Са2+ в сыворотке и гормон, регулирующий Са2+.
Остеомаляция и рахит[править | править код]
Остеомаляция — сравнительно редкое состояние костей, при котором в матрице новой кости уменьшается минерализация (рис. 15.3). У детей такая нехватка кальция может привести к нарушениям роста, деформациям и рахиту. Взрослые страдают от боли, проксимальной миопатии или переломов с незначительными повреждениями.
Рис. 15.3 Остеомаляция. Микроснимок отростка подвздошной кости, помещенного в акриловую смолу без предварительной декальцификации, взятый у пациента с остеомаляцией. Хорошо виден широкий участок лишенного минералов остеоида (красный цвет) и центральный участок кости, насыщенный минералами (черный цвет). Этот макет выполнен с помощью техники серебрения Kossa (предоставлено Alan Stevens, Jim Lowe).
Остеомаляция (размягчение костей) в основном возникает из-за недостатка витамина D. К биохимическим показателям относят нехватку кальция, вторичное увеличение концентрации паратиреоидного гормона и низкую концентрацию в плазме 25-гидроксивитамина D3. Также встречаются и другие, менее распространенные наследственные типы остеомаляции.
Основной источник витамина D — кожа, где он образуется благодаря фотохимической реакции. Витамин D также содержится в пище, особенно в молоке. Люди, не имеющие возможности загорать из-за климата, а также нуждающиеся в долгосрочном уходе в старости и не выходящие из-за этого на улицу, подвержены риску дефицита витамина D.
Болезнь Педжета[править | править код]
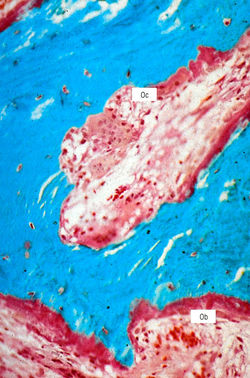
Рис. 15.4 Болезнь Педжета. Микроснимок фрагмента кости, помещенного в смолу, взят у пациента с активной болезнью Педжета. Наблюдается неконтролируемое рассасывание остеокластов (Ос) кости, а остеобласты (ОЬ) пытаются заполнить возникающие пустоты (предоставлено Alan Stevens, Jim Lowe).
Болезнь Педжета — состояние костей, при котором наблюдаются боль, скелетные деформации, неврологические осложнения или переломы. Это заболевание встречается в различных странах: оно распространено в Центральной Европе, Великобритании и Северной Ирландии, Австралии, Новой Зеландии и США, реже — в Африке, на Среднем и Дальнем Востоке и в Скандинавии.
При этой патологии присутствуют чрезмерная резорбция и образование костей (рис. 15.4). Заболевание проходит три фазы: остеолитическую, остеобластическую и бессимптомную. У одного пациента в одно и то же время могут наблюдаться все три фазы. Включения различных тел на гистопатологии позволяют сделать выводы о возможных вирусных причинах этой болезни.
Остеоартрит[править | править код]
Остеоартрит — самое распространенное заболевание суставов. Оно характеризуется утратой соединительных хрящей, деформацией и гипертрофией костей, склерозом субхрящевой кости и костной кистой. Возможные причины остеоартрита:
- чрезмерная нагрузка на суставы;
- наличие анормального хряща или кости.
Самый характерный признак остеоартрита — прогрессирующая утрата хряща. Ранние биохимические изменения при остеоартрите включают: (1) уменьшение содержания в хряще гликозаминогликана (с низким содержанием хондроитинсульфата, кератана сульфата и гиалуроновой кислоты); (2) увеличение количества энзимов, которые разрушают хрящ (металлопротеиназы матрикса); (3) увеличение содержания воды в суставе. Возросшая активность энзимов-металлопротеиназ частично отвечает за разрушение протеогликана и коллагена. В начале хондроциты стимулируются для увеличения числа хондролитов, а также синтезируют цитокины, например интерлейкин-1 и фактор некроза опухоли а. Естественно образующиеся протеины подавляют катаболические энзимы. Эти патофизиологические изменения вызывают локальную боль, которая сначала проходит, если снять с сустава нагрузку, но затем возвращается при малейшей нагрузке или движении. Характерная для воспалительного артрита неподвижность суставов минимальна и быстро проходит.
Ревматоидный артрит[править | править код]
Ревматоидный артрит — хроническое воспалительное заболевание, которое приводит к боли, опуханию и разрушению суставов. Им болеет 1% всего взрослого населения Земли. Развитие болезни приводит к разрушению суставов, деформации и значительной утрате трудоспособности.
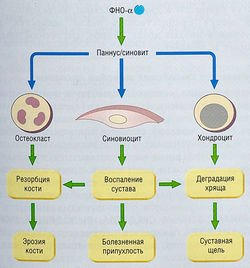
Ревматоидный артрит — это хроническое воспаление синовиальной оболочки, которая выстилает сустав. Синовиальная оболочка воспалена, в поверхностном слое скапливаются полиморфноядерные лейкоциты, а под синовиальным слоем и глубоко в синовиальных тканях — одноядерные клетки (CD4+ Т-лимфоциты и плазмоциты). В дальнейшем наступает массивная синовиальная гипертрофия, которая сопровождается инвазией воспалительными и фибробластоподобными клетками. Сосудисто-волокнистая ткань (паннус) поражает и разрушает кость и хрящ. Медиаторы воспаления способствуют воспалению синовиальной оболочки, разрушению хряща и эрозии кости. В ревматоидном суставе образуются провоспалительные цитокины, включая ФНО-0С, IL-1, гранулоцитарно-макрофагальные колониестимулирующие факторы, IL-6 и другие хемокины. Кроме того, присутствуют противовоспалительные цитокины IL-4 и IL-10, которые могут подавлять воспалительные состояния. ФНО-a оказывает прямое воздействие на синовит, остеокласты и хондроциты. Знание этой особенности позволило разработать специальную биологическую терапию, которая учитывает действие этих цитокинов (см. далее).
Ревматоидный артрит имеет отношение к множеству клинических синдромов, не связанных с соединительной тканью, включая васкулит, подкожные узлы, интерстициальный пневмосклероз, перикардит, повторяющийся мононеврит (васкулит периферических нервов), синдром Шегрена (воспаление слюнных и слезных желез), синдром Фелти (спленомегалия и лейкопения) и воспаления глаз.
Подагра и другие виды кристаллического артрита[править | править код]
Подагра — это общее заболевание, которое характеризуется отложением в тканях кристаллов солей мочевой кислоты
Подагра поражает преимущественно мужчин в возрасте 30-40 лет, но также встречается и у женщин в постклимактерическом периоде. Клинические проявления включают воспалительный артрит (острая подагра), хронические воспаления хряща и околосуставных тканей, камни мочевой кислоты в почках (мочекаменная болезнь) и реже — подагрическую нефропатию. Гиперурикемия встречается часто, но обычно ее не лечат, если только она не связана с симптомами и признаками.
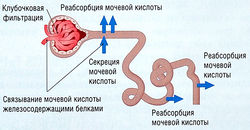
Образование и выделение мочевой кислоты обычно направлено на то, чтобы держать уровень ее концентрации в тканях ниже той отметки, при которой она преобразуется в кристаллические формы (рис. 15.5, 15.6). На синтез мочевой кислоты и ее выделение через почки могут оказывать влияние генетические факторы и окружающая среда. Гиперурикемия связана с ожирением, сахарным диабетом, гипертензией и почечной недостаточностью и с применением тиазидиновых диуретиков и салицилатов в малых дозах.
Избыточное образование мочевой кислоты встречается у 10% больных подагрой. Оно может быть связано с наследственной нехваткой энзимов или пролиферативными нарушениями спинного мозга. Уменьшенное выделение мочевой кислоты через почки связано с остальными 90% случаев подагры. Уменьшенное выделение уратов через почки обусловлено хронической почечной недостаточностью, свинцовой нефропатией, кетоацидозом, гипотиреозом и несахарным диабетом.
Отложение пирофосфата дигидрата кальция и гидроокислов апатита[править | править код]
Отложения пирофосфата дигидрата кальция ассоциируется со множеством состояний и может привести к острому воспалению (псевдоподагра) и дегенерации суставов. Псевдоподагра — относительно распространенное заболевание, клинические проявления которого сходны с проявлениями острой подагры. Характерное острое воспаление обусловлено ответом нейтрофилов, реагирующих на кристаллы пирофосфата кальция. Терапию воспаления тканей проводят теми же препаратами, что и подагры. Отложение гидроокислов апатита может привести к острому воспалению сустава, околосуставных тканей и подкожным отложениям. Оно часто связано с остеоартритом, но роль кристаллов апатита в его патогенезе неясна.
Системная красная волчанка[править | править код]
Системная красная волчанка — аутоиммунное заболевание, которое поражает приблизительно 1 человека из 1000 и преобладает в основном у молодых женщин. Заболеваемость и смертность снижена во многих странах благодаря ранней диагностике и лечению. Вероятность осложнений, связанных с этим заболеванием, выше у социально необеспеченных слоев населения, а случаи заболевания чаще встречаются у лиц африканского, испанского и азиатского происхождения. СКВ характеризуется множеством клинических проявлений, включая кожные и костно-мышечные. Почечные, легочные, серозные, неврологические и психиатрические нарушения, а также ретикулоэндотелиальные патологии встречаются реже, но они потенциально более опасны. К патологическим явлениям относят воспаления, аномалии и отложения иммунных комплексов.
К иммуннологическим нарушениям относят появление антител к разнообразным собственным тканям. Часто встречаются антинуклеарные антитела, которые воздействуют на клеточные ядра. Вклад антинуклеарных антител в клиническую картину неясен, поскольку они вырабатываются при отсутствии заболевания, к тому же целевой антиген в ядрах, как правило, защищен от связывания антителами. Иммунные нарушения вызывают гиперактивность В-клеток в ответ на свои и чужеродные антитела. Триггерным механизмом может послужить реакция на инородные тела, например вирусы.
Читайте также: Лечение красной волчанки
Серонегативные спондилоартропатии[править | править код]
Серонегативные спондилоартропатии — группа артритов воспалительного характера. Они обладают общими клиническими признаками и в той или иной степени связаны с геном HLA-B27. Характерным заболеванием у этой группы является сакроилеит, также к этой группе относятся анкилозный спондилит, псориатический артрит, реактивный артрит, а также артрит, связанный с воспалительными заболеваниями кишечника.
Патологическая грануляционная ткань разрушает сустав, состоящий из волокнистой хрящевой ткани, и постепенно приводит к окостенению и возможному обездвиживанию. Сходный с ревматоидным артритом воспалительный процесс может начаться в периферических синовиальных суставах, характерным признаком будет также энтезит (воспаление мышечных включений в кость). К другим признакам относят воспаления глаз, кожи и иногда заболевания сердца.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ[править | править код]
Лекарственные средства для лечения остеопороза[править | править код]
При лечении остеопороза в постклимактерический период используют заместительную гормональную терапию, кальцитонин, бисфосфонаты, селективные модуляторы эстрогеновых рецепторов, кальций и витамин D.
Заместительная гормональная терапия[править | править код]
Заместительная гормональная терапия эстрогенами в постклимактерическом периоде подавляет воздействие остеокластов на резорбцию костей. Это замедляет утрату костной массы и влияет на ее количество в первые годы после прекращения функции яичников. Эстрогены можно принимать перорально, вводить с помощью инъекций или трансдермально, поскольку они и их сложные эфиры легко проникают через кожу, клеточные мембраны и желудочно-кишечный тракт. Различные способы введения эстрогенов обусловливают разную фармакокинетику и свойства. Эстрогены для перорального применения (например, конъюгированный конский эстроген, сульфат эстрона и микронизированный эстрадиол-20β) наиболее широко применяют для лечения постклимактерического остеопороза.
Эстрогены циркулируют в крови вместе с половыми гормонами, связывая глобулин и альбумин. Подобно другим стероидным гормонам, эстрогены действуют в клеточных ядрах. Эстрогены пассивно проникают через клеточную мембрану и соединяются с ядерными рецепторами эстрогенов, находящихся в восприимчивых к эстрогену тканях. Вслед за активацией рецепторы эстрогена соединяются со специфическими последовательностями ДНК, что приводит к транскрипции смежных генов. Существует по крайней мере два типа рецепторов эстрогена: а и β. Известно, что эстроген соединяется с а-рецепторами и образует эстороген-рецепторный комплекс, который вступает в соединение с реагирующим на эстроген элементом. В репродуктивных тканях, включая молочные железы и матку, находятся а-рецепторы. В нерепродуктивных тканях, включая кости, печень и сердечнососудистую систему, преобладают β-рецепторы. Это частично объясняет, почему эстроген и подобные ему вещества по-разному действуют в различных тканях.
Решение о назначении заместительной терапии эстрогенами и привыкание к ней пациента зависит не только от воздействия на кости, но и от других клинических эффектов
Заместительная гормональная терапия эстрогеном облегчает вазомоторные синдромы, если терапию назначают в первые несколько лет менопаузы. Обычно лечение может быть умеренным, но иногда необходима длительная терапия. ЗГТ снижает утрату костной массы и повышает плотность костей. Кроме того, эстроген воздействует на метаболизм липопротеинов, приводя к снижению концентраций липопротеинов низкой плотности и увеличению концентраций липопротеинов высокой плотности, таким образом защищая пациентов от сердечно-сосудистых заболеваний. Некоторые клинические исследования показали уменьшение количества инфарктов миокарда, снижение показателей смертности от сердечнососудистых заболеваний и общей смертности среди женщин в постклимактерическом периоде на ЗГТ эстрогенами. Однако четырехлетние наблюдения женщин, страдавших от заболеваний сердца в период менопаузы, показали возросшее число сердечно-сосудистых событий в первый год применения ЗГТ, хотя последние исследования выявили тенденцию к их уменьшению. Эстроген, вводимый трансдермально, обычно контролирует постклимактерические симптомы и остеопороз, но оказывает меньший эффект на липопротеины.
Всем пациентам, проходящим ЗГТ и не подвергавшимся гистерэктомии, необходимо также назначать прогестерон, поскольку это уменьшит значительно возросший риск рака матки, связанный с воздействием эстрогена. Эстрогены некупированного действия можно назначать только пациентам, перенесшим гистерэктомию и поэтому не имеющим риска возникновения эндометриальной гиперплазии. Назначение цикличной терапии прогестероном обычно приводит к более продолжительным менструациям, но длительность кровотечения можно уменьшить, снизив дозу или постоянно применяя прогестерон. Такой режим терапии прогестероном подавляет эндометриальную пролиферацию и снижает риск рака матки, но может вызывать обильные кровотечения. Имеются доказательства того, что прогестерон снижает благоприятное воздействие эстрогенов на показатели липопротеинов. Прогестерон можно вводить перорально, трансдермально и с помощью инъекций. К обычным оральным прогестеронам относят медроксипрогестерон, норетиндрон и микронизированный прогестерон.
Кальцитонин[править | править код]
Кальцитонин — 32-аминокислотный пептид, который напрямую подавляет остеокласты и может замедлить потерю костной массы. Он воздействует на рецепторы кальцитонина, имеющиеся на многих клетках, но его действие направлено главным образом на остеокласты. Между рецепторами остеокластов и паратиреоидными рецепторами остеобластов не существует гомологии. Рецепторы кальцитонина, расположенные на поверхности клеток, связаны с аденилилциклазой таким образом, что их активация увеличивает внутриклеточную концентрацию цАМФ, оказывая подавляющее воздействие на остеокласты. Кальцитонин также может воздействовать на остеобласты, но механизм этого эффекта не вполне ясен. Оральное введение кальцитонина неэффективно, т.к. он разрушается в ЖКТ под воздействием аминопептидазы и протеаз.
Кальцитонин, вводимый парентерально, хорошо усваивается, но этот способ введения используют редко. Обычно кальцитонин вводят интраназально. Несмотря на плохое всасывание и низкий пик концентрации в плазме, этот способ наиболее практичен. Усредненные контрольные данные по применению кальцитонина назально показали, что за 2 года плотность костей увеличивалась на 1-2%. Другое исследование подтвердило уменьшение переломов позвонков после применения назального кальцитонина в дозе 200 МЕ/сут, но не 400 МЕ/сут. Инъекции больших доз кальцитонина (50-100 МЕ/сут) оказывают обезболивающее действие, и их назначают пациентам с сильной болью после недавнего компрессионного перелома позвоночника.
Кальцитонин интраназально или подкожно применяют для оказания лечебного воздействия на кости без соматических побочных эффектов. Обычно используют кальцитонин, получаемый из лосося или угря, поскольку он эффективнее, чем человеческий. К незначительным побочным эффектам относят приливы и желудочно-кишечные симптомы (тошнота, рвота или диарея). Однако возможно появление нейтрализующих антител, подавляющих действие кальцитонина.
Бисфосфонаты[править | править код]
Бисфосфонаты являются аналогами пирофосфата, у которых вместо атома углерода — атом кислорода. Эта Р-С-Р структура позволяет иметь много радикалов, изменяющих боковые цепи на атоме углерода, что приводит к значительным физикохимическим, биологическим и терапевтическим различиям, поэтому каждый фосфонат необходимо рассматривать отдельно.
Бисфосфонаты имеют сильное сходство с фосфатом кальция и воздействуют исключительно на обызвествленные ткани, где подавляют резорбцию костей, но механизм этого эффекта неясен. В отличие от кальцитонина, который оказывает немедленный эффект на резорбцию, бисфосфонатам нужно около 48 час на ее подавление.
Различные бисфосфонаты обладают разной антирезорбтивной активностью. Активность этидроната, клодроната, тилудроната, памидроната, алендроната и ризедроната составляет 1, 10, 10, 100, 1000 и 5000 соответственно.
Абсорбция введенных перорально бисфосфонатов в лучшем случае составляет 1-10% принятой дозы. Их нельзя принимать с молочными продуктами, пищей или одновременно с Са2+, поскольку это подавляет их абсорбцию на 90%.
Результаты нескольких крупномасштабных многолетних исследований остеопороза показали, что по меньшей мере три бисфосфоната (этидронат, алендронат и ризедронат) увеличивают плотность костей на 4-9% в течение 3 лет применения и уменьшают переломы позвоночника приблизительно на 50%. Длительное применение этидроната может привести к остеомаляции, чего можно избежать, если прекратить прием через 2 нед на период от нескольких недель до 3 мес. Биопсия костей, которую проводили в течение 7 лет после циклического применения этидроната, не выявила дефекты минерализации. Такие бисфосфонаты, как алендронат и ризедронат, не оказывают подобного эффекта, поэтому их можно применять длительное время.
Ежедневное применение 10 мг алендроната или 5 мг ризедроната привело к значительному улучшению плотности костей во время 3-летних наблюдений плацебо-контролируемой терапии. Количество единичных переломов позвонков снизилось на 50%, а множественных — на 90%.
Другие исследования выявили, что удобнее принимать бисфосфонаты, подобные алендронату, перорально большими дозами (35-70 мг) 1 раз в неделю, чем принимать их ежедневно за 30-120 мин до еды.
Самые распространенные побочные эффекты — желудочно-кишечные (изжога, тошнота, боль в желудке). По данным эндоскопии верхних отделов ЖКТ, язву желудка выявляли у 4-14% больных, а эрозию пищевода — еще реже. Рекомендуется принимать эти лекарства с водой и не ложиться на спину в течение 30 мин.
Бисфосфонаты медленно выводятся из костей и могут годами оказывать воздействие на костные ткани. Считается, что возможен неопределенный кумулятивный эффект через 10-20 лет, поэтому большинство экспертов не рекомендуют назначение бисфосфонатов молодым людям.
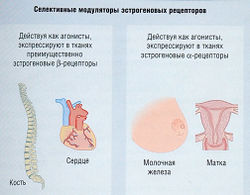
Селективные модуляторы эстрогеновых рецепторов[править | править код]
Селективные модуляторы эстрогеновых рецепторов (СМЭР) — это лекарственные средства, которые оказывают специфический эффект на различные ткани, сходный с влиянием эстрогенов на кости и сердечно-сосудистую систему, но не на другие ткани, например на молочную железу или матку (рис. 15.7). СМЭР избирательно воздействуют на а-рецепторы эстрогена и выступают в качестве конкурентных ингибиторов в тканях с а-рецепторами. СМЭР также могут образовывать соединения с β-рецепторами эстрогена и оказывать такое же воздействие в тех тканях, где преобладают эти рецепторы (см. рис. 15.7). СМЭР тамоксифен препятствуют вторичному раку молочной железы благодаря действию, направленному против эстрогенов. Тамоксифен также защищает от остеопороза и сердечно-сосудистых заболеваний, но повышает вероятность рака матки. Ралоксифен, производное бензотиофена, также относится к группе СМЭР. Комплекс ралоксифена с эстрогеновыми рецепторами соединяется с особой областью ДНК, которая отличается от реагирующих на эстрогены элементов, встречая противодействие в одних тканях и содействие в других. Трехлетние клинические исследования показали увеличение плотности костного вещества в бедренной кости на 2-3% и в поясничном отделе позвоночника на 3-4% благодаря ежедневному приему 60 мг ралоксифена. Статистика показала, что число новых переломов позвонков уменьшилось на 50%. Повышение риска рака матки и улучшение показателей липопротеинов подтверждения не получили. Эти исследования также выявили значительное снижение риска рака молочной железы у пациентов, принимавших ралоксифен, по сравнению с принимавшими плацебо.
Побочные эффекты СМЭР, как и у эстрогенов, включают рост риска венозной эмболии. Кроме того, у женщин отмечаются приливы и судороги.
Другие лекарственные средства[править | править код]
Препараты кальция оказывают незначительное благотворное воздействие на сохранение костной ткани, но препараты, содержащие диетический или лекарственный Са2+, — недорогие и надежные. Их необходимо назначать всем пациентам для сохранения костной ткани. В период менопаузы рекомендуется принимать 1500 мг Са2+ ежедневно.
Аналоги витамина D усиливают всасывание Са2+ из желудочно-кишечного тракта и могут оказывать воздействие на наращивание и рассасывание костной ткани, но необходимо определить их эффективность в уменьшении риска переломов.
Тиболон — это синтетический С19 стероид, обладающий слабо выраженными гормональными свойствами. Исследования на животных показали, что воздействие тиболона в 50 раз слабее этинилэстрадиола, в 8 раз слабее норетистерона и намного слабее андрогена. Тиболон не оказывает стимулирующего воздействия на матку, а ежедневная доза в 2,5 мг ослабляет вазомоторные постклимактерические симптомы. Ежедневный прием тиболона в количестве 1,25 мг и 2,5 мг оказывает благоприятный эффект на биохимические маркеры резорбции костей (С-телопептиды в моче) и на образование костей (остеокальцин в сыворотке). Краткосрочные исследования показали увеличение в позвоночнике основного костного вещества и предотвращение его рассасывания в предплечье у женщин в постклимактерическом периоде. Однако для подтверждения данных о предотвращении переломов необходимы долгосрочные исследования.
Аналоги паратиреоидного гормона, например терипаратид в курсовых дозах, также эффективны в лечении остеопороза при подкожном введении. Они стимулируют остеобласты и таким образом увеличивают образование костной ткани. Учитывая, что эти препараты можно вводить внутривенно, их можно эффективно применять для увеличения костной ткани у женщин в первые годы менопаузы.
Лекарственные средства для лечения остеомаляции[править | править код]
Для предотвращения и лечения остеомаляции применяют витамин D. Возникшую в результате нехватки этого витамина остеомаляцию можно с успехом устранить с помощью витамина D, 25-гидроксивитамина D3, 1а-гидроксивитамина D3 или 1,25-дигидроксивитамина D3. Пациентам, страдающим остеомаляцией, полезно бывать на солнце. В США, где молочные продукты обогащают витамином D, остеомаляция встречается крайне редко.
Лекарственные средства для лечения болезни Педжета[править | править код]
Для лечения болезни Педжета применяют анальгетики, кальцитонин и бисфосфонаты.
ПРОСТЫЕ АНАЛЬГЕТИКИ И НПВС. Простые анальгетики и НПВС (аспирин, ацетаминофен) часто применяют для облегчения боли при болезни Педжета, но эти препараты не купируют долгосрочные жалобы.
КАЛЬЦИТОНИН. Кальцитонин подавляет резорбцию и может уменьшить боль с помощью различных механизмов. Морской кальцитонин (полученный из лосося или угря) более эффективен, чем человеческий, но может стимулировать появление антител, которые будут препятствовать терапии. Для достижения необходимого уровня концентрации в крови, что позволяет уменьшить боль в костях, рекомендуется вводить подкожно большие дозы кальцитонина (50-100 МЕ/сут), но это обычно приводит к побочным эффектам, включая приливы и желудочно-кишечные расстройства.
БИСФОСФОНАТЫ. Биофосфонаты являются главными лекарственными средствами для лечения болезни Педжета. Они уменьшают образование как пораженных, так и здоровых костей. Крупномасштабные исследования показали, что алендронат и ризедронат эффективно снижают активность пораженных костей. Применяемые дозы обычно выше, чем ежедневные дозы для терапии остеопороза. Желудочно-кишечная непереносимость — главный побочный эффект, который наблюдают при лечении болезни Педжета большими дозами этих препаратов.
Тем пациентам, которые не переносят алендронат и ризедронат из-за побочных эффектов, связанных с ЖКТ, необходимо назначить памидронат внутривенно в течение нескольких часов. Тилудроновая кислота — это лекарственное средство для лечения гипокальциемии, которое применяют и для терапии болезни Педжета.
Лекарственные средства для лечения остеоартрита[править | править код]
Для лечения остеоартрита применяют анальгетики и НПВС.
АНАЛЬГЕТИКИ. Анальгетики, особенно ацетаминофен, облегчают боль при остеоартрите и являются средствами первого выбора. Данные крупномасштабных клинических исследований показывают, что эффективность анальгетиков в лечении остеоартрита так же высока, как и у НПВС. При острых приступах боли на короткое время можно назначать наркотические анальгетики.
НПВС. Нестероидные противовоспалительные средства часто применяют для облегчения боли у пациентов с остеоартритом. Они эффективны и помогают уменьшить воспаление, но не оказывают влияния на вызвавший его процесс. НПВС подавляют циклооксигеназу — энзим, который преобразует арахидоновую кислоту в простагландины (рис. 15.8-15.11; см. главу 9).
НПВС имеют побочные эффекты, связанные с ЖКТ. Наиболее распространенные из них — тошнота, рвота, диспепсия, боль в животе и диарея. Реже встречаются язва желудка и желудочно-кишечное кровотечение, но они имеют большее клиническое значение. К традиционным НПВС относят ибупрофен, напроксен, кетопрофен, флурбипрофен, индометацин, кеторолак, набуметон, оксапроцин, пироксикам, сулиндак и толметин (табл. 15.1).
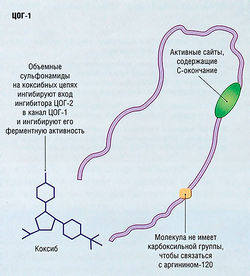
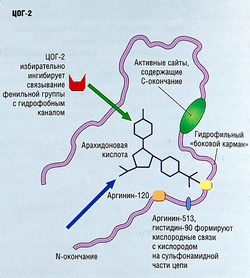
Существуют два типа энзимов циклооксигеназы, которые преобразуют арахидоновую кислоту в простагландины. Изоформа ЦОГ-1 производит класс простагландинов, которые важны для нормальных физиологических функций, включая защиту слизистых оболочек ЖКТ, регуляцию функции тромбоцитов и клеток почек. Изоформа ЦОГ-2 выполняет важную функцию в производстве простагландинов, участвующих в нормальной работе почек. Энзимы ЦОГ-2 активируются при патологии и вызывают боль и воспаление.
Энзимы ЦОГ-1 и ЦОГ-2 сходны по строению, но из-за разницы в количестве аминокислот при разработке препаратов (коксибов) предпочтение отдают энзимам, обладающим избирательностью к изоформе ЦОГ-2 (см. рис. 15.8-15.10).
Целекоксиб и рофекоксиб — два ингибитора ЦОГ-2, обладающие высокой степенью избирательности (см. рис. 15.11). Крупномасштабные исследования выявили, что эти два препарата так же эффективно уменьшают боль, как и традиционные НПВС (ибупрофен, напроксен и диклофенак), с заметным снижением побочных эффектов, связанных с ЖКТ, например язвы желудка. К побочным эффектам относят незначительные проблемы с ЖКТ, но коксибы также повышают риск инфаркта миокарда. По этой причине компания, производящая рофекоксиб, добровольно изъяла его из клинической практики, а другие коксибы рекомендует назначать с осторожностью.
Таблица 15.1 Нестероидные противовоспалительные средства
|
Максимальная рекомендуемая доза (мг/сут) |
Приблизительный период полувыведения (час) | |
|
Нестероидные противовоспалительные средства | ||
|
Диклофенак |
150 |
1-2 |
|
Этодолак |
1200 |
5-10 |
|
Фенопрофен |
2400 |
2 |
|
Ибупрофен |
3200 |
2 |
|
Индометацин |
150 |
2 |
|
Кетопрофен |
300 |
5 (?) |
|
Кеторолак |
40 |
5 |
|
Мелоксикам |
15 |
1-3 |
|
Набуметон |
2000 |
22 |
|
Напроксен |
1500 |
15 |
|
Оксапроцин |
1800 |
24-48 |
|
Пироксикам |
20 |
30-60 |
|
Сулиндак |
400 |
7-15 |
|
Толметин |
1800 |
7 |
|
Коксибы | ||
|
Целекоксиб Рофекоксиб |
400 50 |
10 15-20 |
Побочные эффекты традиционных НПВС
- ЖКТ: раздражение желудка, пептическая язва, кровотечения, прободение
- Почки: уменьшение почечного кровотока, снижение очищения креатинина, повышенное кровяное давление, интерстициальный нефрит или нефротический синдром (редко)
- ЦНС: головные боли, спутанность сознания, шум в ушах, асептический менингит (редко)
- Кроветворная система: кровотечения, снижение функции тромбоцитов (необратимый эффект, если в течение 10-12 сут принимать аспирин)
Лечение остеоартрита
- Механические устройства для облегчения нагрузки на сустав
- Анальгетики
- Противовоспалительные лекарства
- Хирургическое вмешательство
Лекарственные средства для лечения ревматоидного артрита[править | править код]
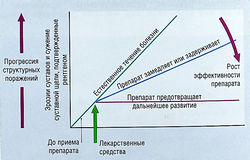
Лекарства, которые используют для лечения ревматоидного артрита, можно классифицировать на основе их терапевтического эффекта, по симптоматическому или противовоспалительному действию, сравнивая их способность вызывать ремиссию и останавливать развитие болезни и связанное с ней разрушение костей. Лечение пациентов с ревматоидным артритом основывается на понимании биологии, истории возникновения этого заболевания в сочетании с результатами клинических исследований. Разрушение суставов нередко происходит вскоре после начала заболевания. Это обусловливает необходимость применения мощных препаратов, обладающих способностью влиять на развитие ревматоидного артрита, с самого начала заболевания (рис. 15.12). Ацетаминофен, аспирин, НПВС и коксибы назначают для облегчения симптоматических проявлений, но не для предотвращения разрушения суставов. Кроме того, для подавления раздражения в воспаленном суставе применяют глюкокортикостероиды. С другой стороны, есть большая группа лекарств, которые называют базовыми противоревматическими препаратами, поскольку они подавляют развитие болезни. К ним относят противомалярийные препараты, метотрексат, препараты золота, D-пеницилламин, сульфасалазин, азатиоприн, циклоспорин, лефлуномид, этанерцепт и инфликсимаб. В последнее время начальную терапию ревматоидного артрита проводят мощными БПРП.
АСПИРИН. Аспирин — очень эффективное и недорогое противовоспалительное средство. Отличается от других НПВС, поскольку является ингибитором циклооксигеназы необратимого действия и ацетилирует активную форму энзима циклооксигеназы. Ранее салицилаты применяли для лечения ревматоидного артрита (их продолжают применять из-за низкой стоимости). Покрытый специальной оболочкой аспирин в ЖКТ усваивается лучше, чем обычный. Как правило, аспирин принимают 3-4 раза в день, обычно с едой, чтобы уменьшить побочное действие на желудок. Всасывание обычно полное и быстрое; если аспирин покрыт оболочкой, то немного медленней. Аспирин преобразуется в активный метаболит с долгим периодом полувыведения. В сравнительно невысоких дозах выведение аспирина можно описать как типичную кинетику первого уровня. В высоких дозах салицилаты демонстрируют кинетику нулевого порядка с постоянным количеством действующего вещества, которое преобразуется за единицу времени (см. главу 4). Клинически это важно, поскольку при желании можно принимать высокие дозы аспирина 2 раза в день. Однако высокие дозы аспирина могут вызывать длительную токсичность. Максимальная концентрация должна составлять 200-300 мг/мл, уровень в сыворотке измерять не нужно, поскольку побочные эффекты (желудочно-кишечные нарушения, шум в ушах и глухота) ограничивают дозы.
НПВС. НПВС в течение последних 20 лет являются главным средством лечения ревматоидного артрита, но, подобно салицилатам, они не оказывают влияния на развитие болезни. Выбор конкретного препарата зависит от опыта врача, знания точной дозы и схемы приема. Если симптомы не контролируются, врач должен осторожно увеличивать дозу до максимально рекомендуемой (см. табл. 15.1). Если в течение 2 нед применение лекарства не дает результатов, необходимо назначить альтернативный препарат из этой группы. Можно испробовать различные НПВС до получения оптимального контроля над симптомами.
Одновременное применение второго препарата из группы НПВС или салицилатов не рекомендуется, поскольку возрастает риск побочных эффектов, связанных с ЖКТ. Терапевт должен уведомить пациента о таком риске, поскольку во многих лекарственных средствах, отпускаемых без рецепта, содержатся салицилаты и НПВС, а пациенты принимают их без консультации с врачом.
ПРИМЕНЕНИЕ КОКСИБОВ. Применение коксибов (ингибиторов ЦОГ-2 избирательного действия) для уменьшения боли и отека при воспалительном артрите заметно возросло, но наличие у применяющих их пациентов сердечно-сосудистых заболеваний обусловливает осторожное применение этих препаратов.
НИЗКИЕ ДОЗЫ ГЛЮКОКОРТИКОСТЕРОНДОВ. Низкие дозы глюкокортикостероидов, например преднизолона, в виде мазей очень эффективны и вызывают меньше соматических побочных эффектов, и применяют их в случае поражения одного или двух суставов. Основной риск — занесение в сустав инфекции, а возможный — ускорение разрушения хряща в пораженном суставе.
Если НПВС или низкие дозы глюкокортикостероидов не помогают при ревматоидном артрите в активной стадии, необходимо назначить БПРП К БПРП относят противомалярийные препараты, сульфасалазин, азатиоприн, циклоспорин, лефлуномид, этанерцепт, инфликсимаб. Сильный активный артрит обычно лечат одним или несколькими препаратами этой группы в дополнение к НПВС и/или с низкими дозами глюкокортикостероидов. Эти лекарства можно применять для легких, средних и тяжелых форм артрита. Противомалярийные препараты назначают для легких случаев, а в паре с другим препаратом — для средних и тяжелых форм. Лечение средних и тяжелых форм артрита обычно начинают с метотрексата. Сульфасалазин может заменить метотрексат, если он вызывает побочные эффекты. Разработка препарата лефлуноми-да привела к снижению применения золота, азатиоприна, пенициламина и циклоспорина. Новые биологические агенты, этанерцепт и инфликсимаб (см. далее), которые подавляют действие ФНО-а, применяют все чаще, если лечение менее дорогими препаратами не дает результатов либо ограничено побочными эффектами или важно быстро остановить развитие болезни.
ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА. Гидроксихлорохин и хлорохин — противомалярийные средства, которые применяют, если необходимо вызвать ремиссию или уменьшить воспаление при ревматоидном артрите. Из всех БПРП противомалярийные средства считаются самыми слабыми, но они обладают наименьшей токсичностью. Для определения эффективной дозы необходимо применять их в течение 6 мес. В зависимости от назначенной дозы необходимо контролировать в течение 6-12 мес цветовое и периферическое зрение.
Противовоспалительный механизм действия хлороина и гидроксихлорохина неясен. Имеются сведения, что они нарушают функцию лейкоцитов. Препараты могут подавлять производство IL-1 макрофагами, лимфопролиферативную реакцию и цитотоксическую реакцию Т-лимфоцитов. При использовании в высоких дозах (что редко) они также оказывают подавляющий эффект на синтез ДНК.
СУЛЬФАСАЛАЗИН. Сульфасалазин часто используют как базисное средство лечения ревматоидного артрита в Великобритании; в США этот препарат не столь популярен. Его считают таким же эффективным, как и соли золота, и у него меньше побочных эффектов. Сульфасалазин представляет собой комбинацию 5-аминосалициловой кислоты, ковалентно соединенной с сульфапиридином. Он плохо всасывается при пероральном введении, но расщепляется на активные компоненты бактериями толстой кишки.
Сульфапиридин постепенно выводится с мочой. Механизм действия неясен, но имеются признаки того, что он снижает активность NK-клеток и влияет на другие функции лейкоцитов. К сильным побочным эффектам, вызванным сульфапиридином,относят острый гемолиз у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы и редко — агранулоцитоз. Высыпания наблюдаются у 20-40% пациентов. Возможны также тошнота, лихорадка и артралгия.
СОЛИ ЗОЛОТА. Соли золота для внутримышечных инъекций в США являются базисным средством лечения ревматоидного артрита. К побочным эффектам относят: дерматит, протеинурию и снижение функции красного костного мозга. Перед каждой инъекцией необходимо делать общий анализ крови и анализ мочи. Препараты золота для перорального введения, например ауранофин, доступны уже несколько лет, но они менее эффективны, чем препараты для инъекций. Также существуют два препарата для парентерального введения: тиомалат-натрий золота и ауротиоглюкоза.
Соли золота усваиваются ретикулоэндотелиальными клетками (например, в красном костном мозге, лимфоузлах, печени и селезенке). В этих тканях они ослабляют функцию макрофагов и активность цитокинов. Другие возможные механизмы: замедление синтеза простагландина, влияние на активацию комплемента, перекрестное сшивание коллагена и ослабление функции лизосомов.
ПЕНИЦИЛЛАМИН. Пеницилламин для перорального введения является хелатом тяжелых металлов. Пеницилламин используют для лечения ревматоидного артрита. Эффективность препарата сопоставима с солями золота для инъекций. Препарат хорошо всасывается при пероральном приеме (40-70%), несмотря на то что пища снижает его абсорбцию, перерабатывается в печени и выводится с мочой и экскрементами.
Пеницилламин подавляет антитела к IgM и оказывает другое воздействие на иммунные комплексы, однако механизм воздействия на ревматоидный артрит остается невыясненным.
Побочные эффекты пеницилламина
- Кожные: макулопапулезная сыпь, крапивница, пемфигоид, красная волчанка, миозит
- Гематологические (фатальные реакции происходят редко): тромбоцитопения, лейкопения, агранулоцитоз, апластическая анемия
- Почечные: обратимая протеинурия
- Необычные побочные эффекты: острый пневмонит, миастения беременных (при длительном лечении)
- Менее серьезные эффекты: тошнота, другие желудочно-кишечные проявления, временная аносмия
МЕТОТРЕКСАТ. Метотрексат — антагонист фолиевой кислоты, который эффективен в терапии ревматоидного артрита при пероральном или парентеральном введении в дозе 5-25 мг/нед. Метотрексат снижает число воспалительных клеток в синовиальной оболочке, что препятствует эрозии и разрушению сустава. Есть опасение, что метотрексат связан с повреждением печени, если кумулятивная доза составляет 1,5 г. У пациентов с определенными сопутствующими заболеваниями, например цирроз печени, ожирение или сахарный диабет, повышенный риск повреждения печени может привести к отказу от приема этого лекарства. Рекомендуется ежемесячно проводить общий анализ крови, анализ печеночных энзимов и определять концентрацию альбумина в сыворотке. Если концентрация ферментов печени неуклонно растет или в сыворотке присутствует белок, следует снизить дозу метотрексата и провести необходимые анализы для определения причин цирроза печени. Для раннего выявления фиброза или цирроза, из-за которых прием метотрексата следует прекратить на длительный срок, необходима биопсия печени. Другие побочные эффекты: тошнота, язва ротовой полости, потеря волос, острая пневмония (1-2%) и супрессия красного костного мозга.
АЗАТИОПРИН. Азатиоприн — аналог активного пурина для перорального введения. Он цитотокси-чен по отношению к воспалительным клеткам (см. главы 7, 9). Чтобы лечение было эффективным, оно должно длиться 3-6 мес. Поскольку азатиоприн может вызвать серьезные побочные эффекты, включая супрессию красного костного мозга и токсичность для печени, лечение следует проводить под наблюдением врача.
ЛЕФЛУНОМИД. Лефлуномид представляет собой изоксазол иммуномодулирующего агента, который подавляет дигидрооротат-дегидрогеназу, — фермент, важный для синтеза пиримидина. Лефлуномид оказывает антипролиферативный и противовоспалительный эффекты, подавляет синтез уридина. После перорального введения лефлуномид усваивается до активных метаболитов, которые выполняют терапевтическое действие. Лефлуномид можно назначать перорально по 100 мг/сут в течение 3 сут для быстрого достижения устойчивых концентраций. Поддерживающие дозы позволяют достичь такой концентрации в течение 2 мес. Активное вещество препарата связывается с альбумином (> 99%) у здоровых людей. Активные метаболиты выводятся через систему желчных протоков и мочеполовую систему.
Масштабные клинические испытания показали, что лефлуномид эффективно уменьшает отек суставов и болезненность на протяжении 12 мес. Ученые сравнили лефлуномид с плацебо, метотрексатом и сульфасалазином, и результат был очевиден к концу 1 мес, а стабилизация клинического результата была достигнута к концу 6 мес. Лефлуномид показал такие же клинические эффекты, как метотрексат или сульфасалазин.
Повышение энзимов печени — главное проявление токсичности лефлуномида. Увеличение транс-аминаз (АлАТ и АсАТ) обычно не превышает двухкратного значения и быстро возвращается в норму при снижении дозы. При 2-3-кратном увеличении необходимо снижение дозы. Если наблюдается постоянное увеличение трансаминаз больше чем в 3 раза, а прием лефлуномида прервать нельзя, показана биопсия печени. При одновременном приеме лефлуномида с метотрексатом возможны токсические реакции, связанные с печенью. Женщинам следует использовать надежные методы контрацепции, поскольку эксперименты на животных показали вероятность гибели плода или тяжелые пороки развития. Если необходимо вывести это лекарство из организма, применяют холестирамин 3 раза в день в течение нескольких дней. Он оказывает наибольшее воздействие на лефлуномид, циркулирующий в кишечнике и печени.
ЦИКЛОСПОРИН. Лимфоциты играют важную роль при ревматоидном артрите, существуют подтверждения того, что иммунноподавляющий препарат циклоспорин эффективен и может контролировать хроническое воспаление околосуставных тканей у некоторых пациентов.
ЭТАНЕРЦЕПТ. Этанерцепт — полученный генетическим путем сложный белок, состоящий из двух идентичных цепей рекомбинантной формы человеческого рецептора ФНО-a с мономером Р 75, смешанного с Fс-областью человеческого иммуноглобулина. Этот белок связывает и инактивирует ФНО-а, оказывающий непосредственное воздействие на околосуставные ткани, остеокласты и хондроциты, и подавляет его активность (рис. 15.13). Этанерцепт во много раз эффективней в связывании ФНО, чем природные ФНО-а-рецепторы. Таким образом, изоляция ФНО-a с помощью этанерцепта подавляет клеточный лизис.
Этанерцепт назначают подкожно 2 раза в неделю. Средний период полувыведения составляет 115 час (в пределах 98-300). Этот препарат можно безопасно применять в сочетании с салицилатами, НПВС, анальгетиками, глюкокортикостероидами и метотрексатом, но о воздействии этанерцепта на печень и почки известно мало.
Клинические испытания, которые проводили в соответствии с критериями American College of Rheumatology, показали, что этанерцепт уменьшает боль суставов и отеки на период более 12 мес. Исследования, в которых его сравнивали с метотрексатом, показали схожее воздействие на суставы, но у пациентов, которых лечили этанерцептом, в течение 2 лет наблюдается меньшее разрушение суставов.
Серьезные аллергические побочные эффекты отмечались только у 2% больных, применявших этанерцепт, однако реакции в месте инъекции наблюдались у 37%, включая эритему, зуд, боль и отеки. Эти побочные эффекты не считаются тяжелыми, и применение этанерцепта из-за них не отменяют. Клинические исследования выявили, что у 4% больных, которым назначали этанерцепт, наблюдались серьезные побочные эффекты. Среди пациентов, принимавших плацебо, это число составило 5%. Однако лечение больных с развивающейся инфекцией следует проводить под наблюдением врача, и при наличии серьезной инфекции или сепсиса необходимо хотя бы на время прекратить прием этанерцепта.
ИНФЛИКСИМАБ. Инфликсимаб представляет собой химерные анти-ФНО-а моноклональные антитела IgGl5 которые связывают растворимый цитокин ФНО-a, а также мембраносвязанный ФНО-a, что приводит к утрате функциональности ФНО-а. Этот синтетический продукт получают из клеток человека и мыши. Клинические исследования показали, что период полувыведения составляет 8-12 сут, примерно в течение 50 сут инфликсимаб может циркулировать в организме. Лечение состоит из первоначальной внутривенной дозы и поддерживающих доз каждые несколько недель (4-8 нед). По результатам исследования инфликсимаб в сочетании с низкими дозами метотрексата значительно снижает развитие ревматоидного артрита в первые 2 года терапии. На рентгеновских снимках видно, что при лечении низкими дозами инфликсимаба разрушение сустава происходит медленно, а при высоких дозах — прекращается.
Клинические исследования 50 ООО пациентов, которые применяли инфликсимаб для лечения ревматоидного артрита, подтверждают безопасность препарата. У 5% пациентов наблюдалась гиперчувствительность вскоре после инъекций. К другим побочным реакциям относят гипотензию, крапивницу и одышку. Незначительные побочные реакции можно контролировать, снизив скорость инъекций и проведя предварительное лечение антагонистами Н1рецепторов. Иногда у пациентов, принимавших инфликсимаб, наблюдались серьезные инфекции. Терапия больных с инфекцией должна проводиться под наблюдением врача, а в случае серьезной инфекции или сепсиса прием препарата следует прекратить. Недавно было обнаружено, что инфликсимаб может реактивировать скрытые туберкулезные инфекции. У некоторых пациентов вырабатываются антитела против этого препарата, называемые человеческими антихимерными антителами. Их присутствие связано с высокой скоростью реакции на инъекцию. Одновременное применение метотрексата или азатиоприна снижает число таких антител, поэтому рекомендуют назначать инфликсимаб в комплексе с метотрексатом перорально 1 раз в неделю.
Адалимумаб представляет собой моноклональные антитела к IgG1 (анти-ФНО-а). Его можно назначать подкожно (40 мг), кроме того, у него относительно долгий период полувыведения.
АНАКИНРА. Анакинра — рекомбинантная форма антагониста рецепторов IL-1. Применение этого белка приводит к тому, что биопсия околосуставных тканей показывает заметное уменьшение числа макрофагов и лимфоцитов. Анакинру вводят подкожно в дозе не более 150 мг/сут. Анализ больших международных клинических исследований показал, что анакинра эффективно уменьшает боль и отеки суставов при ревматоидном артрите в качестве монотерапии и в сочетании с метотрексатом. Подобно этанерцепту и инфликсимабу, анакинра заметно сокращает разрушения суставов, что видно на рентгеновских снимках. Серьезные побочные эффекты наблюдают редко. Реакции в местах инъекции встречаются часто (~ 40%) при высоких дневных дозах (150 мг/сут), но только у 5% больных это приводит к отмене препарата.
Лекарственные средства для лечения острого кристаллического артрита[править | править код]
При остром кристаллическом артрите применяют НПВС, колхицин и глюкокортикостероиды.
НПВС. Противовоспалительные средства обычно назначают при первых признаках острого кристаллического артрита и применяют до исчезновения воспаления.Хорошую эффективность показал препарат Нимесил (нимесулид-аналог). Наиболее часто назначают индометацин 3 раза в день в дозе 50 мг/сут. Через 10-14 сут дозу постепенно снижают. Другие НПВС также могут быть эффективны (например диклофенак, кетопрофен, толметин, напроксен, целекоксиб и рофекоксиб), хотя в клинических исследованиях не сравнивали эффективность данных препаратов при остром кристаллическом артрите.
КОЛХИЦИН. Колхицин эффективен при лечении острого подагрического и других видов кристаллического артрита. Препарат проникает в воспалительные клетки и входит в систему микротрубочек, где оказывает прямое ингибирующее воздействие, и воспалительные клетки утрачивают свою активность. Колхицин разрушает структуру тубулина, что замедляет способность воспалительных клеток перемещаться к месту инфекции (хемотаксис) и уменьшает фагоцитоз. Максимальную дозу — 6 мг/сут (10 таблеток) превышать нельзя, и в течение следующих 7 сут колхицин применять не рекомендуется. Внутривенно колхицин вводят редко.
При высоких дозах побочными эффектами могут быть тошнота, рвота, диарея у 80% больных. Колхицин также связывают с подавлением красного костного мозга, почечной недостаточностью, ДВС-синдромом, гипокальциемией, судорогами и смертью. Иногда длительное применение связывают с нервно-мышечными расстройствами, напоминающими полимиозит. Токсичность колхицина связана с почечными нарушениями. Передозировка колхицина может привести к летальному исходу, частично из-за разрушения эпителиальных клеток ЖКТ, которые обычно пополняются.
ГЛЮКОКОРТИКОСТЕРОИДЫ. Глюкокортикостероиды можно эффективно применять при остром кристаллическом артрите, если пациент не переносит НПВС и колхицин или их назначение противопоказано. Например, преднизолон назначают перорально или внутривенно, можно использовать мази, содержащие глюкокортикостероиды (если поражено не более двух суставов). Иногда применяют внутримышечные инъекции адренокортикотропного гормона (адренокортикотропина), который также стимулирует работу надпочечников в дополнение к глюкокортикостероидам, но о преимуществах такого метода лечения по сравнению с применением только глюкокортикостерондов данных нет.
Повторные приступы подагры можно предотвратить, если регулировать концентрацию мочевой кислоты в сыворотке
Первоначальные методы лечения подагры включают контроль за массой тела и артериальным давлением, диету с низким содержанием пуринов (сократить прием красного мяса и морепродуктов), а также исключение лекарственных средств, которые могут привести к гиперурикемии. Выведению уратов могут препятствовать такие лекарства, как аспирин в низких дозах, этанол, диуретики, циклоспорин и этамбутол.
Повышение выведения мочевой кислоты[править | править код]
Концентрацию мочевой кислоты в крови можно уменьшить, если усилить ее выведение (используя препараты, выводящие мочевую кислоту) или снизить синтез мочевой кислоты (применяя ингибиторы ксантиноксидазы). Перед использованием препаратов, выводящих мочевую кислоту, необходимо определить степень содержания мочевой кислоты в моче. Если увеличить выделение мочевой кислоты у тех пациентов, у кого она вырабатывается в избытке, это приведет к образованию камней.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЫВОДЯЩИЕ МОЧЕВУЮ КИСЛОТУ. Лекарственные средства, выводящие мочевую кислоту, назначают пациентам в следующих ситуациях:
- сниженное выведение мочевой кислоты через почки (т.е. она не вырабатывается в избытке);
- отсутствие камней в почках или почечной недостаточности, поскольку из-за увеличения выведения мочевой кислоты через почки повышается риск осложнения почечнокаменной болезни;
- проявление реакции на ингибитор ксантиноксидазы.
Средства, выводящие мочевую кислоту, например пробенецид или сульфинпиразон, блокируют повторное всасывание мочевой кислоты, отфильтрованной и выведенной из почечных трубочек, что способствует повышенному выведению мочевой кислоты и последующему снижению ее концентрации в плазме (см. рис. 15.6). Пробенецид блокирует трубочное всасывание органических анионов мочевой кислоты и снижает уровень уратов в сыворотке. Высыпания на коже и нарушения со стороны ЖКТ — наиболее частые побочные эффекты. Сульфинпиразон относят к той же группе препаратов, что и фенилбутазон, он блокирует всасывание в почечных трубочках. Наиболее частые побочные эффекты связаны с ЖКТ, например тошнота и обострение язвенной болезни. Нарушения гомеостаза, включая апластическую анемию, происходят редко.
Подавление синтеза мочевой кислоты[править | править код]
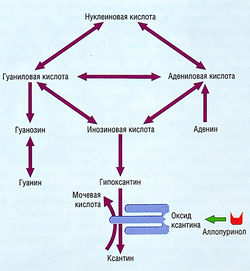
АЛЛОПУРИНОЛ. Аллопуринол — ингибитор ксантиноксидазы, избирательно соединяется с энзимом, который контролирует два последних этапа в метаболизме пуринов (аденина и гуанина) в мочевую кислоту.
Аллопуринол назначают пациентам, у которых:
- избыточно вырабатывается мочевая кислота;
- установлена почечнокаменная болезнь.
Аллопуринол часто используют как средство, выводящее мочевую кислоту, из-за легкости его применения. Типичная доза составляет 300 мг/сут перорально, но ее можно увеличивать до 600-800 мг/сут. Дозу снижают, если понизилась гломерулярная фильтрация, а если выведение креатинина меньше 10-20 мл/мин (0,20-0,33 мл/сек), то дневная доза не должна превышать 200 мг/сут.
Побочные эффекты аллопуринола не связаны с дозой; незначительные побочные эффекты — головная боль, диспепсия и диарея. Зудящая сыпь появляется у 5% пациентов, очень редко наблюдают синдром гиперчувствительности к аллопуринолу. Данный синдром протекает с лихорадкой, почечной недостаточностью и токсическим кожным некролизом, который может угрожать жизни, что препятствует дальнейшему приему препарата.
Аллопуринол хорошо всасывается, и до 80% препарата биологически доступно в течение 2-6 час. Препарат окисляется ксантиноксидазой до оксипуринола. Оксипуринол, как и аллопуринол, подавляет ксантиноксидазу, таким образом снижая превращение гипоксантина и ксантина до мочевой кислоты. Преимущество состоит в том, что предшественники мочевой кислоты хорошо растворяются и выводятся с мочой (см. рис. 15.5).
Аллопуринол взаимодействует с другими препаратами. Например, данный ингибитор подавляет:
- метаболизм других аналогов пурина (азатиоприна и 6-меркаптопурина), поэтому при назначении аллопуринола необходимо снижать дозы этих лекарств до 25-50%;
- инактивацию печенью других лекарств, включая антикоагулянты. При назначении аллопуринола необходимо следить за уровнем протромбина. Дозы пероральных антикоагулянтов необходимо уточнять.
Лекарственные средства для лечения системной красной волчанки[править | править код]
Лечение системной красной волчанки проводят противовоспалительными и иммуносупрессивными препаратами.
ГЛЮКОКОРТИКОСТЕРОИДЫ. Симптомы и признаки острого воспаления кожи и суставов при СКВ хорошо контролируют глюкокортикостероиды. Варианты терапии:
- местные препараты против кожных высыпаний;
- терапия низкими дозами, если болезнь имеет умеренную степень;
- высокие дозы перорально или внутривенно, если болезнь угрожает жизни пациента.
Механизм действия глюкокортикостероидов в лечении СКВ неясен. Они напрямую воздействуют на клетки красного костного мозга, что приводит к рассредоточению циркулирующих нейтрофилов (нейтрофилии) и в то же время к лейкопении с уменьшением числа циркулирующих эозинофилов. Большие дозы глюкокортикостероидов подавляют выработку цитокинов и их эффект, а также фосфолипазу А2, которая контролирует выработку простагландинов и лейкотриенов.
Дозы глюкокортикостерондов подбирают с таким расчетом, чтобы снизить риск побочных эффектов и в то же время обеспечить количество активного вещества, способного подавить воспалительную реакцию. Преднизон или преднизолон в таблетках по 5 мг предпочитают другим долгодействующим препаратам типа дексаметазона и рекомендуют принимать утром 1 раз в день. Удобная форма препаратов позволяет точно регулировать дозу. Побочные эффекты глюкокортикостерондов: истончение кожи и гематомы, ожирение, мышечная слабость, гипертензия, непереносимость глюкозы и остеопороз.
ПРОТИВОМАЛЯРИЙНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА. Противомалярийные лекарственные средства особенно эффективны для лечения кожных поражений и воспалительного артрита у пациентов с СКВ. Эти препараты позволяют улучшить клиническую картину, однако после прекращения приема заболевание может возобновиться. К противомалярийным средствам относят гидроксихлорохин, хинакрин и хлорохин. Первые два препарата применяют во многих странах. Хлорохин имеет меньшую стоимость, но он менее изучен. Относительная безопасность противомалярийных препаратов делает их привлекательными для первоначальной терапии. Распространенные побочные эффекты включают неспецифические симптомы, кожные высыпания и жалобы, связанные с ЖКТ.
Реакции со стороны ЦНС происходят реже. Токсическое действие на сетчатку глаза — наиболее серьезная проблема, но при приеме препаратов в низких дозах такой побочный эффект наблюдают редко. Перед назначением противомалярийных препаратов у пациентов следует проверить зрительные поля и цветовое зрение, а затем повторять осмотр каждые 6 мес.
АЗАТИОПРИН. Азатиоприн широко применяют при лечении различных проявлений системной красной волчанки, включая поражение почек, чтобы уменьшить потребность в глюкокортикостероидах. Азатиоприн уменьшает воспаление при волчаночном нефрите и улучшает функцию почек. Однако он может вызвать побочные эффекты, включая супрессию красного костного мозга. Наблюдалась также гепатотоксичность, которая обычно прекращается, если прекратить прием препарата. Повышает ли азатиоприн риск злокачественных образований, особенно в кроветворной системе, или лимфосеточных новообразований, неизвестно.
АЛКИЛИРУЮЩИЕ АГЕНТЫ. Алкилирующие агенты — самое эффективное средство (после глюкокортикостероидов) для лечения угрожающей жизни системной красной волчанки (табл. 15.2). Они подавляют активацию и деление клеток и препятствуют делению воспалительных клеток, например Т-лимфоцитов. Однако из-за механизма действия эти препараты (например, циклофосфамиды) оказывают значительные побочные эффекты.
Циклофосфамид назначают одновременно с большими дозами глюкокортикостероидов для лечения угрожающей жизни системной красной волчанки или в тех случаях, когда глюкокортикостероиды или азатиоприн неэффективны. По мере улучшения клинической картины дозу стероидов следует снижать. Циклофосфамид является самым эффективным средством лечения диффузного волчаночного нефрита.
Лекарственные средства для лечения серонегативного артрита[править | править код]
НПВС — наиболее подходящие средства для лечения серонегативных патологий межпозвонковых суставов.
Как правило, сначала рекомендуют самые эффективные НПВС: индометацин, диклофенак, напроксен, толметин, целекоксиб и рофекоксиб. Другие НПВС также могут оказать полезное действие, если перечисленные ранее препараты не дали результатов или имеют побочные эффекты. Несмотря на то что различные клинические исследования показывают преимущества одних препаратов над другими, НПВС необходимо выбирать на основе клинического опыта и умения подбирать дозы.
ГЛЮКОКОРТИКОСТЕРОИДЫ. Глюкокортикостероиды не оказывают долгосрочного эффекта на серонегативные патологии межпозвоночных суставов, но в малых дозах помогают контролировать симптомы. Сульфасалазин, который часто применяют для лечения ревматоидного артрита, может контролировать периферийный артрит при этом заболевании. Все лекарства, которые используют при ревматоидном артрите, подходят для лечения псориати-ческого артрита.
Некоторые широко применяемые препараты оказывают побочные эффекты на костно-мышечную систему
Аспирин в малых дозах (менее 2 г/сут) может повысить уровень мочевой кислоты в сыворотке, препятствуя выделению мочевой кислоты в почечных трубочках. Такие дозы аспирина обычно применяют для предотвращения инфаркта миокарда и инсульта. План лечения должен включать переход на сульфинпиразон и применение аллопуринола, если приступы сильные или частые.
Гидралазин ранее часто применяли для лечения гипертензии, данный препарат может помочь некоторым пациентам с застойной сердечной недостаточностью. У 50% больных, принимавших гидралазин длительное время, в крови обнаруживают антинуклеарные антитела. У пациентов с медленным ацетилированием или у тех, кто принимает относительно высокие дозы, вероятно развитие синдрома, подобного системной красной волчанке: высыпания, атралгия и лихорадка. С появлением такого синдрома необходимо немедленно прекратить прием препарата. Обычно симптомы прекращаются, но могут понадобиться глюкокортикостероиды, иначе симптомы будут сохраняться продолжительное время.
Глюкокортикостероиды в основном применяют для лечения костно-мышечных и иных иммунологических нарушений. Возможны остеопороз и стероидная миопатия. Механизм остеопороза, вызванного глюкокортикостероидами, полифакторный и включает прямое подавление остеобластов, увеличение выделения кальция с мочой и снижение абсорбции кальция из ЖКТ. Превентивные меры — уменьшение доз и продолжительности применения глюкокортикостероидов, пополнение запасов кальция и витамина D, занятия в тренажерном зале и проведение лекарственной терапии остеопороза. Лучшими изученными средствами от возникшего в результате применения глюкокортикостерондов остеопороза являются алендронат и ризедронат (см. ранее).
Глюкокортикостероиды могут вызывать мышечную атрофию и слабость. При возникновении этого осложнения общую функцию можно улучшить с помощью упражнений, но для долгосрочного эффекта необходимо снизить дозу.
Статины — синтетические средства, снижающие уровень липидов в крови. Статины могут быть связаны с мышечной болью и миозитом. Клинические исследования показали увеличение креатинин-фосфокиназы у 5% пациентов. У пациентов редко развивается острая миопатия с сильной проксимальной мышечной слабостью и значительным увеличением креатининфосфаткиназы. Риск мио-патии возрастает при одновременном применении фибрата и других препаратов, направленных на снижение липидов, включая ниацин. Пациентов, которым впервые назначено лечение статинами, необходимо информировать о таком риске, и они должны незамедлительно сообщать о мышечной боли неясного происхождения, чувствительности или слабости. Обычно симптомы прекращаются с отменой препарата.
Костно-мышечные инфекции[править | править код]
Септический артрит[править | править код]
Септический артрит характеризуется лихорадкой, болью, отеками и ограничением подвижности. У лиц, ведущих активную половую жизнь, высока вероятность его возникновения из-за Neisseria gonorrhoeae. В других случаях это заболевание вызывают грамположительные микроорганизмы (табл. 15.3). К важным факторам носительства относят:
- лежащее в основе заболевание суставов (ревматоидный артрит, остеоартрит);
- хронические заболевания (сахарный диабет, хроническая почечная недостаточность);
- злоупотребление алкоголем;
- применение лекарств (глюкокортикостероиды, цитотоксины, внутривенные инъекции);
- другие инфекции (урологические, кожные);
- большинство инфекций поражают один сустав, но в 20% случаев — несколько суставов.
Раннее эффективное лечение важно для предотвращения мышечной контрактуры и, что еще важнее, разрушения суставов. Если есть подозрение на инфекцию, необходимо срочно взять на анализ жидкость из сустава. Для лечения необходимо использовать подходящий антибиотик и провести эффективное дренирование (например, артроско-пию, артротомию или откачать жидкость с помощью шприца). Первоначальный выбор нужно основывать на возрасте пациента, его заболеваниях и на красителе Грама. Схему лечения можно назначить через 24-48 час, когда будет готов результат посева, а позднее ее можно модифицировать, когда станет ясна эффективность выбранного препарата. Возможны следующие схемы лечения антибиотиками:
- метицилин или клоксацилин внутривенно с аминогликозидами внутривенно или без них;
- меропенем внутривенно;
- цефтриакзон внутривенно.
Антибиотики для парентерального введения создают превосходные концентрации в синовивиальном слое и внутри хрящей, не требуя введения в сустав.
Продолжительность лечения зависит от клинических проявлений, дренирования и состояния больного. Инфекцию стрептококками можно вылечить внутривенными инъекциями в течение 2 нед, но затем на протяжении 2-4 нед необходимо принимать перорально большие дозы антибиотиков. Инфекция стафилококками требует более длительного лечения. Убедительные клинические исследования, которые позволили бы сравнить короткий период лечения антибиотиками внутривенно с продолжительным (т.е. в течение 2-6 нед), не проводили.
Таблица 15.3 Микроорганизмы, вызывающие септический артрит
|
Негонококковые |
Грамположительные (65-85%) Грамотрицательные (10-1 596) Смешанные аэробные и анаэробные (5%) Микобактерии и грибы (< 5%) |
|
Neisseria gonorrhoeae |
Остеомиелит[править | править код]
Бактерии могут проникать в кости из-за травмы, операции или в результате инфекции мягких тканей и крови. Возникший из-за этого остеомиелит может проявляться остро, подостро или хронически болью в костях, лихорадкой и лейкоцитозом. У пациентов с серповидно-клеточной анемией риск остеомиелита в 100 раз выше. На рентгеновских снимках можно увидеть разрушение костного вещества из-за отслоения надкостницы. Может образоваться абсцесс или свищ. Исследование костей с помощью рентгена или ультразвука — самое важное первичное обследование для определения остеомиелита у взрослых и детей. Диагноз часто устанавливают поздно, поэтому важно вовремя делать снимки.
Лечение включает:
- наложение шины для предотвращения переломов;
- хирургическое дренирование;
- антибиотики внутривенно.
Инфекции протезированных суставов[править | править код]
Инфекции протезированных суставов происходят часто, но их трудно диагностировать и лечить. Каждый год в США выполняют более 100 ООО операций по полной замене бедра, и одной из клинических проблем является риск бактериальной инфекции протеза. Такая инфекция может возникнуть в течение года после операции или позднее из-за бактериемии. Прооперированный сустав изолируют от ранних послеоперационных инфекций (Staphylococcus epidermidis, S. aureus, анаэробных бактерий). Поздние инфекции возникают из-за стафилококков, стрептококков и грамотрицательных микроорганизмов. Ученые озабочены участившимися случаями резистентности S. aureus к воздействию метициллина.
Все бактериологически подтвержденные инфекции необходимо лечить большими дозами антибиотиков, вводимых внутривенно, соответствующей хирургической обработкой раны и реимплантацией
Применение одних только антибиотиков внутривенно в больших дозах в течении 6 нед обеспечивает низкий процент излечения (менее 20%). Если добавить антибиотики в вяжущее вещество во время ревизионного хирургического вмешательства, это оказывает хороший терепевтический эффект. Результаты улучшаются еще больше, если сделать операцию двухступенчатой, установив временный протез на срок от 6 нед до нескольких месяцев, а затем установить постоянный протез.
Считается, что инфекцию можно предотвратить, если незадолго до операции провести короткий профилактический курс лечения антибиотиками и продолжать его в течение 24-72 час после операции. Кроме того, антибиотики применяют эмпирически в течение первых 3-6 мес после операции по замене сустава, чтобы избежать инфицирования протеза во время стоматологических вмешательств и гинекологических или урологических манипуляций, но эта тема нуждается в дальнейшем изучении.
Литература[править | править код]
- Bermas BL. Oral contraceptives in systemic lupus erythematosus — a tough pill to swallow? N Engl J Med 2005; 353:2602-2604.
- Bone HG, Hosking D, Devogelaer J-P, et al. The alendronate phase III osteoporosis treatment study group. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med 2004; 350:1 189-1 199.
- Drazen JM. COX-2 Inhibitors — a lesson in unexpected problems. N Engl J Med 2005; 352:1 1 31-1 1 32
- Geusens P, Reid D. Newer drug treatments: their effects on fracture prevention. Best Practice & Research Clinical Rheumatology 2005; 19: 983-989
- Heaney RP, Recker RR. Combination and sequential therapy for osteoporosis. N Engl J Med 2005; 353: 624-625.
- O’Dell JR. Drug therapy: therapeutic strategies for rheumatoid arthritis. N EnglJ Med 2004; 350: 2591-2602.
- Olsen NJ. Tailoring arthritis therapy in the wake of the NSAID crisis. N Engl J Med 2005; 352: 2578-2580.
- Olsen NJ, Stein CM. Drug therapy: new drugs for rheumatoid arthritis. N Engl J Med 2004; 350: 2167-2179.
- Papapoulos SE. Who will benefit from antiresorptive treatment (bisphosphonates)? Best Practice & Research Clinical Rheumatology 2005, 1 9: 965-973.
- Rhen T, Cidlowski JA. Mechanisms of disease: antiinflammatory action of glucocorticoids — new mechanisms for old drugs. N Engl J Med 2005; 353: 1711-1 723.
- Sambrook P. Who will benefit from treatment with selective estrogen receptor modulators (SERMs)? Best Practice & Research Clinical Rheumatology 2005; 19: 975-981.
- Thatayatikom A, White AJ. Rituximab: A promising therapy in systemic lupus erythematosus. Autoimmunity Reviews 2006; 5: 18-24.
- Tolar J, Teitelbaum SL, Orchard P. J. Mechanisms of Disease: Osteopetrosis. N EnglJ Med 2004; 351: 2839-2849.
- Walsh JP, Ward LC, Stewart GO, et al. A randomized clinical trial comparing oral alendronate and intravenous pamidronate for the treatment of Paget’s disease of bone. Bone 2004; 7: 747-754.