Побочные действия новых лекарственных средств
Содержание
- 1 Обнаружение нежелательных эффектов лекарств
- 2 Читайте также
- 3 Литература
Обнаружение нежелательных эффектов лекарств[править | править код]
Нежелательные эффекты лекарств часто схожи с обычными заболеваниями. Тяжелые эффекты обычно поражают:
- системы с быстрым делением клеток (кожа, система кроветворения, слизистая кишечника);
- органы детоксикации и/или выведения лекарств (печень и почки).
Типичными примерами тяжелых нежелательных эффектов являются токсический некроз эпидермиса, апластическая анемия, колит, гепатит и нефрит.
Диагностирование этих эффектов, особенно редких, может быть затруднено, и врач всегда должен решать, вызван ли этот эффект новым препаратом. Но поскольку врач общей практики на протяжении всей своей карьеры может не сталкиваться, например, с апластической анемией, определение нежелательных эффектов требует бдительности и со стороны пациента, и со стороны лиц, вовлеченных в лечение, в том числе фармацевта и других медицинских работников.
Нежелательные эффекты легче обнаружить, если они тяжелые, отличаются от заболевания или возникают сразу после начала лечения
Анафилаксия может возникать через несколько минут после инъекции пенициллина и проявляется отеком тканей, брохоспазмом и коллапсом, т.е. является явным нежелательным эффектом препарата. Гораздо сложнее заметить нежелательные эффекты, возникающие после длительного периода лечения и имеющие скрытое начало. Еще сложнее обнаружить нежелательные эффекты, появляющиеся после окончания лечения препаратом. Примером отсроченного нежелательного эффекта являются злокачественные заболевания, возникающие у 15% пациентов, получавших в детстве циклофосфамид по поводу лимфомы.
Трудно заметить нежелательные эффекты, сходные с обычными заболеваниями, особенно если они напоминают относительно безопасные заболевания. Признаки фокомелии четко выражены, если они представлены задержкой роста или отсутствием конечностей, и чрезвычайно редки; поэтому грамотные клиницисты быстро связывают фокомелию с приемом талидомида. Напротив, повышенный риск развития спинального дизрафизма у детей, рожденных от женщин, принимавших противоэпилептическое средство вальпроат натрия во время беременности, может быть обнаружен только в ходе тщательно спланированных клинических наблюдений, поскольку спинальный дизрафизм не является частым осложнением.
Если латентный период специфического нежелательного эффекта хорошо известен, его легче обнаружить
В решении о связи нежелательного эффекта с лекарственной терапией нужно учитывать латентный период. Некоторые нежелательные эффекты появляются только после определенного латентного периода, другие нет, но очевидно, что нежелательные эффекты, появившиеся до лечения, лекарством не вызваны. Нежелательные эффекты могут иметь специфические латентные периоды:
- сразу после приема (анафилаксия на пенициллин, выраженная вазодилатация, гипотензия после инъекции ванкомицина — синдром «красного человека»);
- через несколько дней после приема (заболевания крови, вызванные змеиными анатоксинами, выделенными из лошадиной сыворотки; ампициллиновая сыпь у больных инфекционным мононуклеозом);
- после длительного лечения (ятрогенный синдром Кушинга после лечения пероральными глюкокортикостероидами в течение нескольких недель или месяцев);
- после прекращения лечения (синдром отмены бензодиазепинов или ингибиторов обратного захвата серотонина);
- в последующих поколениях (талидомидовая фокомелия, ретиноидная эмбриопатия).
Некоторые нежелательные эффекты, такие как анафилаксия или аплазия костного мозга, присущи только определенным препаратам.
Если после прекращения лечения эффект исчезает и при возобновлении возникает вновь, скорее всего, лекарство является причиной обратимой нежелательной реакции.
Лекарство вызывает нежелательный эффект, если:
- Хорошо заметно, что нежелательный эффект возникает одновременно с приемом лекарства
- Эффект известен как нежелательный у группы препаратов, и подозреваемое лекарственное средство принадлежит к этому классу (например, кашель — нежелательный эффект ингибиторов ангиотензинпревращающего фермента)
Алфавитная классификация помогает запомнить разные типы нежелательных эффектов лекарств
Типы нежелательных эффектов перечислены в табл. 3.3. Реакции типа А (дозозависимые) легко предсказуемы из-за известных фармакологических эффектов препарата, а риск возникновения реакции зависит от дозы. Многие реакции, например
Таблица З.В Алфавитная классификация типов нежелательных эффектов лекарств запор от опиатных анальгетиков или головная боль от антиангинальных средств группы нитратов, являются скорее неудобством, чем опасностью.
Нежелательные эффекты типа В (независимые от дозы) менее предсказуемы и часто тяжелые. Примерами служат анафилаксия, которая может привести к фатальному коллапсу, почечная и печеночная недостаточность, супрессия костного мозга. Наиболее важные реакции типа В перечислены в табл. 3.4.
Некоторые пациенты более чувствительны к нежелательным эффектам лекарств
|
Тип |
Вид эффекта |
Определение |
Примеры эффекта/лекарство |
|
А |
Дозозависимые эффекты |
Нежелательные эффекты, связанные с фармакологическим действием лекарств и дозой. Они редко бывают фатальными и относительно часты |
Гипогликемия/инъекции инсулина Брадикардия/бета-блокаторы Геморрагия/антикоагулянты |
|
В |
Независимые от дозы эффекты |
Нежелательные эффекты, возникающие непредсказуемо и часто с высокой степенью заболеваемости и смертности |
Анафилаксия/пенициллин Острый некроз печени/галотан Супрессия костного мозга/хлорамфеникол |
|
С |
Постоянные эффекты |
Нежелательные эффекты, возникающие при длительном лечении |
Ятрогенный синдром Кушинга/преднизолон Дисфункция толстой кишки/ фенотиазиновые транквилизаторы Дисфункция толстой кишки/ слабительные |
|
D |
Отсроченные эффекты |
Нежелательные эффекты, возникающие после лечения либо у детей пациентов, либо у самих пациентов через годы после лечения |
Вторичный рак/алкилирующие средства от болезни Ходжкина Краниофациальная мальформация у детей, матери/изотретиноин Светлоклеточная карцинома влагалища у дочерей женщин/диэтилстильбэстрол во время беременности |
|
Е |
Эффекты после лечения |
Нежелательные эффекты, возникающие после прекращения лечения, особенно если прием препарата остановлен внезапно (так называемый синдром отмены) |
Нестабильная стенокардия/после внезапной отмены β-адреноблокаторов Недостаточность коры надпочечников/ после отмены глюкокортикостероидов (преднизолон) Судороги/после отмены противосудорожных средств (фенобарбитал или фенитоин) |
Польза от любой лекарственной терапии должна всегда сопоставляться с возможным риском причинения вреда. Наиболее подвержены нежелательным эффектам плод, больные хроническими заболеваниями и пациенты с генетическими аномалиями, а также лица, уже принимающие лекарственные средства, и пожилые пациенты.
Женщины в период беременности[править | править код]
При лечении беременных (или женщин с предполагаемой беременностью) необходимо принимать во внимание здоровье и матери, и плода. Безусловно, необходимо избегать тератогенных лекарственных средств, т.е. вызывающих пороки развития плода. Однако целесообразно рассматривать все средства как потенциально тератогенные, поэтому беременным не следует назначать никакие препараты, за исключением следующих ситуаций:
- если у беременной есть жизненная необходимость в этом лекарственном средстве и его расценивают как безопасное для плода;
- если беременная тяжело больна, то применение препарата оправданно, даже если это может нанести вред плоду.
Сопутствующие заболевания[править | править код]
Сопутствующая патология, например заболевания печени и почек, может усилить и ускорить нежелательный эффект лекарства. Из-за этих состояний лекарство может находиться в организме в большей концентрации или в течение большего периода времени. Вследствие замедленного метаболизма или экскреции больные более подвержены нежелательным эффектам типа А (усиленный фармакологический ответ на стандартную дозу). Нежелательные эффекты некоторых лекарств более часты у больных с органной недостаточностью. Например, калий-сберегающий диуретик амилорид чаще вызывает гиперкалиемию у лиц с нарушением почек, т.к. К+ выводится через почки, следовательно, их способность выводить К+ снижена. У больных с патологией печени антикоагулянтный эффект варфарина может быть сильно завышен из-за замедленного метаболизма варфарина и вследствие нарушения синтеза факторов свертывания в печени.
Сопутствующая патология может предрасполагать к нежелательным эффектам и по другим причинам. Например, более вероятна дыхательная недостаточность от приема транквилизаторов, таких как диазепам, у больных с хронической обструктивной болезнью легких (ХОБЛ), поскольку ток воздуха уже снижен.
Таблица 3.4 Наиболее важные реакции типа В (независимые от дозы)
|
Нежелательный эффект |
Лекарства, вызывающие его |
|
Анафилаксия |
Пенициллины и другие антибактериальные средства Чужеродные белки (стрептокиназа или лошадиная противозмеиная сыворотка) Йодное контрастное вещество для рентгенографии |
|
Анафилактоидные реакции (неиммунные реакции, похожие на анафилаксию, но возникающие без первого контакта) |
Ингибиторы ангиотензинпревращающего фермента (ангионевротический отек) N-ацетилцистеин внутривенно (крапивница и анафилаксия) Растворитель полиэтоксилированного касторового масла |
|
Патология печени (острый гепатонекроз) |
Галогенированные газы для наркоза, такие как хлороформ, галотан и энфлуран Хлорпромазин, оральные контрацептивы и флоксациллин (внутрипеченочный холестаз) Миноциклин (хронический активный гепатит) |
|
Патология почек |
Нестероидные противовоспалительные средства (острый интерстициальный нефрит) Амфотерицин (острый тубулярный некроз) Ингибиторы ангиотензинпревращающего фермента (поражение сосудов почек) |
|
Патология костного мозга |
Антитиреоидные средства карбимазол, метимазол и пропилтиоурацил Антибактериальные средства (хлорамфеникол и котримоксазол) Противоревматические средства (соли золота и пеницилламин) |
Генетически обусловленные дефекты ферментов[править | править код]
В организме находится много ферментов, метаболизирующих лекарства. Генетически обусловленные дефекты этих ферментов могут сделать обычно безвредную лекарственную терапию рискованной и даже фатальной. Примером служат различные формы дефицита глюкозо-6-фосфатдегидрогеназы (G6PD), который связан с рецессивным геном Х-хромосомы, поэтому встречается только у мужчин. Такие оксиданты, как аспирин, примахин и дапсон, могут вызывать тяжелый гемолиз у людей с подобным дефицитом, чаще у выходцев из Средиземноморья, Африки и Юго-Восточной Азии.
Взаимодействие лекарств[править | править код]
Взаимодействие лекарств является важной проблемой. Оно может быть классифицировано как:
- фармацевтическое взаимодействие, при котором происходит химическое или физическое взаимодействие между несколькими лекарствами до их проникновения в организм;
- фармакокинетическое взаимодействие, при котором один препарат изменяет концентрацию другого, влияя на всасывание, метаболизм, распределение и выведение;
- фармакодинамическое взаимодействие, при котором совместное действие двух препаратов отличается от действия каждого из них, введенного отдельно.
Фармацевтическое взаимодействие[править | править код]
К фармацевтическим взаимодействиям относят, например, химическое хелатирование Fe2+ тетрациклинами с образованием сульфата железа и тетрациклина, менее эффективного при таком введении. Это связано с тем, что в присутствии одного вещества уменьшается доступная для абсорбции концентрация другого. Другим примером служит осаждение гидроксида кальция, образующегося из глюконата кальция, если он введен внутривенно в растворе бикарбоната натрия.
Фармакокинетическое взаимодействие[править | править код]
На практике самыми важными и потенциально опасными из всех лекарственных взаимодействий являются фармакокинетические. К ним относят взаимодействия между веществами, метаболизируемыми ферментными системами цитохрома Р-450 (CYP) (комбинация оксидаз) и лекарствами, ингибирующими их. Например, антикоагулянт варфарин, теофиллин (используют в лечении астмы) и циклоспорин (препарат, предотвращающий отторжение трансплантата) метаболизируются цитохромом Р-450. Эти лекарства имеют низкий терапевтический индекс (соотношение между терапевтической и токсической концентрациями), поэтому небольшие изменения метаболизма могут вызывать тяжелые нежелательные эффекты типа А. К лекарствам, ингибирующим цитохром Р-450, относятся антибактериальные средства эритромицин, котримоксазол и ципрофлоксацин, антимикотические средства кетоконазол и флуконазол и антагонист Н2-рецепторов циметидин.
Небольшое количество лекарственных средств могут индуцировать продукцию ферментов цитохрома Р-450 и, как следствие, уменьшать концентрацию лекарства, метаболизируемого ферментными системами. Индукторами ферментов являются антиконвульсанты фенобарбитал и карбамазепин и противотуберкулезное средство рифампицин. Женщины, принимающие оральные контрацептивы одновременно с этими средствами, должны принимать большие дозы контрацептивов, чем обычно, иначе повышенный метаболизм контрацептивов приведет к возможности возникновения беременности.
Почечная экскреция лекарства может быть изменена в присутствии другого лекарства: например, почечная экскреция лития снижается тиазидными диуретиками.
Фармакодинамическое взаимодействие[править | править код]
Антихолинергические средства и леводопу используют для лечения болезни Паркинсона, когда один препарат снижает холинергическую активность, а другой увеличивает дофаминергическую активность. Оба эффекта улучшают двигательную активность, но оба могут вызвать галлюцинации и делирий.
Фармаконадзор[править | править код]
Поскольку в фазах I—III обычно участвует небольшое число пациентов, мониторинг по обнаружению редких нежелательных эффектов продолжается после одобрения препарата. Этот процесс называют фармаконадзором.
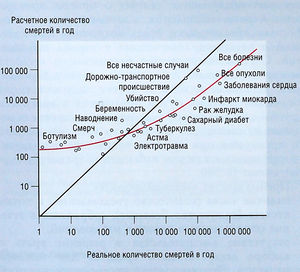
Обычно люди не в силах адекватно оценить риск: новые опасности расценивают как более рискованные, а повседневные и известные опасности недооценивают. На рис. 3.2 показана связь между «принимаемым риском» и «истинным риском» на анализе 41 причины смерти. «Принимаемый риск»
определяет поведение людей и может проявляться в том, что они говорят («экспрессивный риск») или что они делают («открытый риск»). Пациенты часто боятся принимать лекарственные препараты (особенно после обсуждения в газетах тяжелого случая нежелательного эффекта), но с удовольствием продолжают курить, хотя у курящих лиц риск развития смертельных заболеваний составляет около 0,5 (50%). Риски, принимаемые врачами, заметно отличаются от «истинных рисков», оцененных в хорошо спланированных наблюдениях. (Интересно сравнить это с ситуацией, как люди оценивают соотношение цены и качества путешествий на машине. Мы радостно принимаем реальный риск смерти и травмы за удобное передвижение.)
Фармакоэпидемиология изучает применение и эффекты лекарств на больших популяциях. В фармакоэпидемиологии используют методы эпидемиологии и затрагивают все аспекты соотношения пользы и риска в популяции для конкретных лекарств. Фармаконадзор является разделом фармакоэпидемиологии, который ограничивается эпидемиологическими исследованиями реакций, связанных с лекарствами, и их нежелательных эффектов. Под реакцией понимают замечания пациентов, зарегистрированные в течение периода мониторинга. Они могут быть связаны с основным заболеванием, сопутствующим заболеванием или инфекцией, нежелательными эффектами на лекарственное средство, активностью других принимаемых препаратов или взаимодействием лекарств. Реакция — это любое явление, отмечаемое пациентом, которое не считается адекватным терапевтическим ответом и связано с лекарством. Нежелательный эффект препарата потенциально вреден для пациента.
Виды исследований фармаконадзора:
- разработка гипотезы (определение новых нежелательных эффектов недавно введенных лекарств);
- разработка и оценка гипотезы;
- оценка гипотезы (доказательство любых подозрений по поводу использования конкретного лекарства).
Методы фармаконадзора
- Разработка гипотезы: доклад о спонтанных нежелательных эффектах лекарств («желтая форма» в Великобритании)
- Разработка и оценка гипотезы: мониторинг показаний («зеленая форма» в Великобритании)
- Оценка гипотезы: изучение частных случаев, когортные исследования, рандомизированные контролируемые клинические исследования
Разработка гипотезы[править | править код]
Часто в клинической практике после приема лекарства пациенту становится хуже, и врач подозревает наличие нежелательного эффекта на препарат. В соответствии с правилами медицинский работник, подозревающий наличие нежелательной реакции, должен уведомить Центральное агентство о своем подозрении. Подобные уведомления способствуют фиксированию новых нежелательных эффектов лекарств.
Описание к рис. 3.2 Отношение между «принимаемым риском» и «истинным риском» для 41 причины смерти. Если принимаемая и истинная частота совпадают, данные выглядят как прямая линия. Точки и кривые между ними отражают средний ответ [Kahneman D, Slovic Р and Tversky A (eds). Judgment Under Uncertainty: Heuristics and Biases. Cambridge, Cambridge: University Press; 1982].
Такая система впервые была введена в Великобритании в 1964 г. в виде «желтой формы». Похожая система информирования о нежелательных эффектах лекарств была учреждена в США под эгидой FDA (рис. 3.3). Подобные системы созданы в Европе и в наиболее развитых странах и построены на добровольном информировании врачами и другими медицинскими работниками о любых реакциях, которые они считают нежелательными эффектами препаратов.
Основные достоинства этих схем:
- касаются всех лекарственных препаратов в течение всего времени их применения;
- являются самым доступным методом выявления редких нежелательных эффектов.
Недостатки этих схем:
- не отражают истинное количество нежелательных эффектов, поскольку система является добровольной;
- существуют предубеждения из-за интереса средств массовой информации (СМИ) к определенному лекарству;
- отражают только количественные данные (количество уведомлений о каждой подозрительной реакции) без учета того, сколько человек в действительности принимали препарат.
Тем не менее роль этих схем неоценима, важно добиться, чтобы врачи всегда заполняли уведомительные карты.
Уведомления о побочных эффектах помогают определить многие неописанные нежелательные эффекты, что может привести к исключению некоторых препаратов из оборота. Примеры препаратов, изъятых с рынка Великобритании после 1972 г. вследствие нежелательных эффектов, обнаруженных по системе «желтой формы», приведены в табл. 3.5, изъятых с рынка США — в табл. 3.6.
Разработка и оценка гипотезы[править | править код]
Мониторинг нежелательных эффектов, связанных с назначениями лекарственных препаратов, представляет собой процесс по разработке и оценке гипотез
В Великобритании мониторинг назначений (МН) является важным методом, который обеспечивает преимущество Национальной службы здравоохранения и задает точку отсчета, которая отсутствует в других системах. Рецепты, выписанные врачами общей практики, направляются в Центральное агентство назначений, в котором собираются официальные копии всех назначений недавно введенных препаратов, находящихся под наблюдением Службы по изучению безопасности лекарств. Затем отдел через 6 или 12 мес после назначения направляет врачу общей практики, сделавшему это назначение, специальную анкету — так называемую «зеленую форму» (рис. 3.4). Такая процедура обеспечивает поступление данных о приеме препаратов в период наблюдения, а заполненные «зеленые формы» обеспечивают отдел подробной информацией о реакциях, отмеченных в период наблюдений. Служба по изучению безопасности лекарств может отслеживать последствия лечения беременных, летальные исходы и другие заслуживающие внимания реакции путем обращения к врачу или другим специалистам, имеющим отношение к лечению пациента. До настоящего времени изучено 76 препаратов при среднем количестве пациентов, участвующих в каждом наблюдении (размер когорты), около 10 500.
Преимущества «зеленой формы»:
- наличие числа (количество уведомлений) и точки отсчета (количество больных), собранных в течение определенного периода наблюдений;
- отсутствие вмешательства в решение врача о выборе лекарственного средства для каждого пациента. Это уменьшает постороннее влияние, которое затем затрудняет интерпретацию результатов.
Недостатком МН является то, что возвращаются лишь 50-70% заполненных форм. В настоящее время предпринимаются попытки создать МН в других странах.
Таблица 3.5 Препараты, зарегистрированные после 1972 г. и изъятые из оборота в Великобритании из-за токсичности
|
Препарат |
Назначение |
Причина |
|
Алосетрон |
Лечение синдрома раздраженного кишечника |
Ишемический колит |
|
Фенилпропаноламин |
Деконгестант |
Геморрагический шок |
|
Троглитазон |
Пероральное противодиабетическое средство |
Гепатотоксичность |
|
Цизаприд |
Улучшение моторики кишечника |
Аритмия |
|
Грепафлоксацин |
Антибактериальное средство |
Тяжелые сердечно-сосудистые осложнения |
|
Ротавирусная вакцина |
Профилактика ротавирусной диареи |
Кишечная непроходимость |
|
Астемизол |
Гистаминоблокатор |
Аритмия |
|
Бромфенак натрия |
Нестероидное противовоспалительное средство |
Тяжелая печеночная недостаточность |
|
Мибефрадил |
Антигипертензивное, антиангинальное средство |
Нежелательные лекарственные взаимодействия |
|
Терфенадин |
Гистаминоблокатор |
Аритмия |
|
Фенфлурамин, дексфенфлурамин |
Лечение ожирения |
Недостаточность клапанов сердца |
|
Хлормезанон |
Седативное средство |
Токсический эпидермальный некроз |
|
Рофекоксиб |
Анальгетик |
Сердечно-сосудистые осложнения |
|
Церивастатин |
Гиполипидемическое средство |
Рабдомиолиз |
Таблица 3.6 Лицензированные лекарственные препараты, изъятые из оборота в США в 1996-2004 гг.
|
Препарат |
Терапевтический класс |
Нежелательные эффекты |
Тип реакции |
|
Аклофенак |
НПВС |
Анафилаксия |
В |
|
Полидексид |
Гиполипидемический |
Загрязненность |
- |
|
Номифензин |
Антидепрессант |
Гемолитическая анемия |
В |
|
Фенклофенак |
НПВС |
Эпидермальный некроз |
в |
|
Фепразон |
НПВС |
Нефротоксичность, токсичность для ЖКТ |
А |
|
Беноксапрофен |
НПВС |
Фотосенсибилизация, гепатотоксичность |
А |
|
Зомепирак |
НПВС |
Анафилаксия |
В |
|
Индопрофен |
НПВС |
Токсичность для ЖКТ |
А |
|
Зимелдин |
Антидепрессант |
Синдром Гийена-Барре |
В |
|
Супрофен |
НПВС |
Нефротоксичность |
А |
|
Теродилин |
Лечение энуреза |
Желудочковая тахикардия |
В |
|
Триазолам |
Снотворное |
Психические реакции |
А |
|
Темафлоксацин |
Антибиотик |
Мультиорганная токсичность |
В |
|
Центоксин |
Антибиотик |
Увеличение смертности |
В |
|
Ремоксиприд |
Нейролептик |
Апластическая анемия |
В |
|
Флозехинан |
Лечение сердечной недостаточности |
Увеличение смертности |
В |
|
Метипранолол |
Антиглаукомный |
Передний увеит |
В |
|
Перечень показывает, что лекарства могут быть причиной серьезных нежелательных эффектов, и отражает важность фармаконадзора. ЖКТ — желудочно-кишечный тракт; НПВС — нестероидное противовоспалительное средство. | |||
Оценка гипотезы[править | править код]
Работы по оценке гипотез начинают после того, как полученные данные привели к новой гипотезе относительно лекарства и его нежелательных эффектов. Используемые методы включают контроль частных случаев и когортные исследования. Метод контроля частных случаев обычно выбирается тогда, когда обнаружено лишь не сколько случаев нежелательных эффектов и сбор обширной когорты случаев невозможен. Но некоторые фармакоэпидемиологи считают когортную технику более точной. В этом контексте под когортой понимают группу пациентов с одинаковыми демографическими или статистическими характеристиками.
Сравнительное исследование частных случаев у здоровых индивидуумов
Хотя технически изучение частных случаев сложно, его успешно используют правительственные структуры и многие академические подразделения. Окончательные результаты сравнивают или соотносят риски лечения с контролем. Абсолютный риск может быть определен только в очень специфических условиях. Большое внимание уделяют точной диагностике и сбору данных, чтобы минимизировать или даже исключить субъективизм, а также не учитывать крайние результаты. Безусловно, небольшое увеличение риска развития часто встречающейся серьезной патологии, например рака молочной железы, имеет большее значение для общественного здоровья, чем значительное увеличение риска таких редких состояний, как первичный рак печени.
В когортных исследованиях наблюдают большую группу пациентов в течение времени, достаточного для получения адекватных результатов
В сравнительные когортные исследования включают контрольную группу. И опять основной проблемой является субъективизм, но этот метод, несмотря на дороговизну и длительность, позволяет определить и абсолютный, и относительный риск.
Рандомизированные контролируемые исследования исключают субъективизм
В рандомизированных контролируемых исследованиях больных делят на 2 группы в случайном порядке. Одна группа получает препарат, другая — нет, затем результаты сравнивают. Этот метод исключает субъективизм, поэтому он важен для фармакоэпидемиологии, поскольку в данном случае наиболее тяжелые нежелательные эффекты относительно редки. К сожалению, крупномасштабные рандомизированные контролируемые исследования трудноосуществимы и затратны.
Оценка стоимости и пользы лечения
Врач и, если возможно, пациент должны оценивать:
- потенциальную пользу от лечения;
- риск нежелательных эффектов у данного пациента;
- возможные затраты при возникновении нежелательных эффектов;
- стоимость лечения.
Обычно под пользой от лечения понимают пользу для конкретного больного, например отсутствие боли. Однако при некоторых обстоятельствах преимущества оценивают для всего общества. Например, вакцины снижают заболеваемость в обществе. Затраты оплачиваются:
- человеком, у которого проявились нежелательные эффекты;
- обществом, если правительство и страховые компании оплачивают дорогостоящие препараты.
Рекомбинантные ферменты для лечения редкого наследуемого дефекта β-глюкозидазы, являющегося причиной болезни Гоше, стоят около $100 ООО в год на одного больного. Липид-нормализующие препараты, которые достоверно снижают риск смерти от ишемической болезни сердца у лиц с умеренной ги-перхолестеринемией без инфаркта миокарда, стоят около $300 000 на одну сохраненную жизнь. Таким образом, решение о расходовании этих средств должно быть принято только в случае, когда польза для данного пациента гарантирована.
Фармакоэкономика и научно обоснованная медицина
Все чаще одобрение нового лекарства не гарантирует его принятие органами, осуществляющими оплату препаратов, — правительственными органами здравоохранения и организациями управления здравоохранения. Этим структурам требуется подтверждение, что новое лечение имеет преимущество по сравнению с существующими схемами или имеет меньшую стоимость. Для этого эти организации используют научно обоснованную доказательную медицину, согласно которой ценность каждого лекарственного препарата определена самыми строгими научными методами. Подтверждением, являющимся «золотым стандартом», служат результаты рандомизированных контролируемых исследований, метаанализ и сборники отчетов, предоставляемые, например, Кохрейновским сотрудничеством.
Читайте также[править | править код]
Литература[править | править код]
- Davies DM, Ferner RE, de Glanville H (eds). Davies’s Textbook of Adverse Drug Reactions, 5th edn. London: Chapman and Hall; 1998. [A textbook of adverse reactions arranged by disease.]
- Descotes J. Immunotoxicology: role in the safety assessment of drugs. Drug Saf2005; 28: 127-136.
- Dukes MNG, Aronson JK (eds). Meyler’s Side Effects of Drugs, 14th edn. Amsterdam: Elsevier; 2000. [A textbook of adverse reactions arranged by drugs.]
- Gogerty JH. Preclinical research evaluation. In: Guarino RA (ed.) New Drug Approval Processes. New York: Marcel Dekker; 1987, pp. 25-54. [A thoughtful discussion of issues in preclinical research as it bears on clinical drug development.]
- Gough S. Post-marketing surveillance: a UK/European perspective. Curr Med Res Opin 2005; 21: 565-570.
- Cregson N, Sparrowhawk K, MauskopfJ, PaulJ. Pricing medicines: theory and practice, challenges and opportunities. Nat Rev Drug DiscovJ 2005; 4: 121-130.
- Gunawan B, Kaplowitz N. Clinical perspectives on xenobiotic-induced hepatotoxicity. Drug Metab Rev 2004; 36: 301-312.
- Haas JF. A problem-oriented approach to safety issues in drug development and beyond. Drug Saf 2004; 27: 555-567.
- Japan Pharmaceutical Reference, 3rd edn. Japan Medical Products International; 1993, pp. 14-34. [A description in detail of the requirements for approval for drugs in Japan.]
- Mamelok RD. Drug discovery and development. In: Car-ruthers SG, Hoffman BB, Melman KL, Nielenberg DF (eds). Clinical Pharmacology, 4th edn. New York: McGraw-Hill; 2000, pp. 1289-1305. [A more detailed discussion of issues in demonstrating a drug’s safety and efficacy.]
- Miller P. Role of pharmacoeconomic analysis in R&D decision making: when, where, how? Pharmacoeconomics 2005; 23: 1-12.
- Walgren JL, Mitchell MD, Thompson DC. Role of metabolism in drug-induced idiosyncratic hepatotoxicity. Crit Rev Toxicol 2005; 35: 325-361.
- Wienkers LC, Heath TG. Predicting in vivo drug interactions from in vitro drug discovery data. Nat Rev Drug Discov 2005; 4: 825-833.
- Wilkinson GR. Drug metabolism and variability among patients in drug response. N Engl J Med 2005; 352: 2211-2221.