Кроветворная система — различия между версиями
Django (обсуждение | вклад) (→Физиология кроветворной системы) |
Dormiz (обсуждение | вклад) |
||
| Строка 9: | Строка 9: | ||
*тромбоциты со свертывающими белками плазмы образуют тромбы, обеспечивая сокращение кровопотери из поврежденных кровеносных сосудов, и принимают участие в воспалительной реакции. | *тромбоциты со свертывающими белками плазмы образуют тромбы, обеспечивая сокращение кровопотери из поврежденных кровеносных сосудов, и принимают участие в воспалительной реакции. | ||
| + | [[Image:Ph_10_1.jpg|250px|thumb|right|Рис. 10.1]] | ||
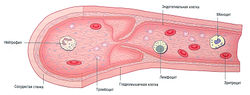
| + | ''Рис. 10.1 Кровеносные сосуды (вены) и клетки крови. Стенки кровеносных сосудов окружены гладкомышечными клетками и выстланы изнутри эндотелиальными клетками, которые обеспечивают нетромбообразующую поверхность для беспрепятственного кровотока. Белые клетки крови (нейтрофилы, моноциты и лимфоциты) взаимодействуют с клетками кровеносных сосудов для защиты организма от микробной инвазии. Красные клетки крови (эритроциты) несут кислород для насыщения им органов. Тромбоциты образуют тромбы при кровотечениях из сосудов.'' | ||
'''Все клетки крови являются производными от гемопоэтических стволовых клеток''' | '''Все клетки крови являются производными от гемопоэтических стволовых клеток''' | ||
| Строка 17: | Строка 19: | ||
Гемопоэтические стволовые клетки дают начало кроветворным (родоначальным) клеткам. В отличие от стволовых эти клетки обладают меньшим потенциалом к самовоспроизведению и более склонны к дифференцировке в специфичный тип клеток. С каждым новым поколением потомство родоначальных клеток дифференцируется во все более зрелые клетки с еще большим ограничением времени жизни, становясь все более приближенным к узкой группе потомства. В конечном итоге процесс дифференцировки завершается образованием зрелых клеток, которые больше не имеют способности к делению и дают начало красным клеткам крови, лейкоцитам и тромбоцитам (рис. 10.2). | Гемопоэтические стволовые клетки дают начало кроветворным (родоначальным) клеткам. В отличие от стволовых эти клетки обладают меньшим потенциалом к самовоспроизведению и более склонны к дифференцировке в специфичный тип клеток. С каждым новым поколением потомство родоначальных клеток дифференцируется во все более зрелые клетки с еще большим ограничением времени жизни, становясь все более приближенным к узкой группе потомства. В конечном итоге процесс дифференцировки завершается образованием зрелых клеток, которые больше не имеют способности к делению и дают начало красным клеткам крови, лейкоцитам и тромбоцитам (рис. 10.2). | ||
| − | + | [[Image:Ph_10_2.jpg|250px|thumb|right|Рис. 10.2]] | |
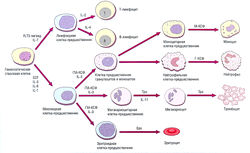
| − | Рис. 10. | + | ''Рис. 10.2 Гемопоэз и гемопоэтические факторы роста. Гемопоэтические стволовые клетки имеют высокий потенциал к регенерации, но каждое следующее поколение делящихся клеток имеет наследственно-специфические характеристики и уменьшенную пролиферативную способность. Факторы роста, включая Еро, Г-КСФ, ГМ-КСФ, IL, М-КСФ, SCF и Тро, необходимы для регуляции каждого этапа гемопоэза. Еро — эритропоэтин; FLT3 — C-FMS-подобная тирозинкиназа; IL — интерлейкин; SCF — фактор роста стволовых клеток; Тро — тромбопоэтин; Г-КСФ — гранулоцитарный колониестимулирующий фактор; ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор; М-КСФ — макрофагальный колониестимулирующий фактор.'' |
| − | |||
| − | Рис. 10.2 Гемопоэз и гемопоэтические факторы роста. Гемопоэтические стволовые клетки имеют высокий потенциал к регенерации, но каждое следующее поколение делящихся клеток имеет наследственно-специфические характеристики и уменьшенную | ||
Процесс созревания контролируется кроветворными факторами роста и цитокинами, которые активируют соответствующий рецептор фактора роста или цитокина, что ведет к дифференцировке и пролиферации. Многие из этих факторов были очищены и клонированы, а некоторые получены средствами рекомбинантной технологии и используются для клеточной терапии различных заболеваний. | Процесс созревания контролируется кроветворными факторами роста и цитокинами, которые активируют соответствующий рецептор фактора роста или цитокина, что ведет к дифференцировке и пролиферации. Многие из этих факторов были очищены и клонированы, а некоторые получены средствами рекомбинантной технологии и используются для клеточной терапии различных заболеваний. | ||
| Строка 26: | Строка 26: | ||
'''Нормальная концентрация гемоглобина и гематокрита (среднее значение ± среднее отклонение)''' | '''Нормальная концентрация гемоглобина и гематокрита (среднее значение ± среднее отклонение)''' | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td rowspan="2"> | <tr><td rowspan="2"> | ||
<p></p></td><td colspan="2"> | <p></p></td><td colspan="2"> | ||
| − | <p>Гемоглобин</p></td><td> | + | <p>'''Гемоглобин'''</p></td><td> |
| − | <p>Гематокрит</p></td></tr> | + | <p>'''Гематокрит'''</p></td></tr> |
<tr><td> | <tr><td> | ||
<p>г/дл</p></td><td> | <p>г/дл</p></td><td> | ||
| Строка 56: | Строка 56: | ||
== ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КРОВИ == | == ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КРОВИ == | ||
| − | Здесь описаны препараты, которые являются предпочтительными при лечении трех патологических процессов — анемии, тромбоза и кровотечения: | + | Здесь описаны препараты, которые являются предпочтительными при лечении трех патологических процессов — [[Анемия и спорт|анемии]], тромбоза и кровотечения: |
*анемия — это нарушение циркуляции гемоглобина, происходящее в результате снижения кислородтранспортной емкости эритроцитов; | *анемия — это нарушение циркуляции гемоглобина, происходящее в результате снижения кислородтранспортной емкости эритроцитов; | ||
| Строка 66: | Строка 66: | ||
Таблица 10.1 '''Средства, используемые для лечения нарушений в системе кровообращения''' | Таблица 10.1 '''Средства, используемые для лечения нарушений в системе кровообращения''' | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td> | <tr><td> | ||
<p>Средства при анемии</p></td><td> | <p>Средства при анемии</p></td><td> | ||
| − | <p>Железо</p> | + | <p>[[Железо]]</p> |
<p>Дефероксамин </p> | <p>Дефероксамин </p> | ||
| − | <p>Витамин | + | <p>Витамин В<sub>12</sub> </p> |
| − | <p>Фолат</p></td></tr> | + | <p>[[Фолиевая кислота|Фолат]]</p></td></tr> |
<tr><td> | <tr><td> | ||
<p>Гемопоэтические факторы роста</p></td><td> | <p>Гемопоэтические факторы роста</p></td><td> | ||
| Строка 85: | Строка 85: | ||
<p>Антагонисты гликопротеиновых рецепторов llb/llla (абциксимаб, эптифибатид, тирофибан) Дипиридамол</p></td></tr> | <p>Антагонисты гликопротеиновых рецепторов llb/llla (абциксимаб, эптифибатид, тирофибан) Дипиридамол</p></td></tr> | ||
<tr><td> | <tr><td> | ||
| − | <p>Антикоагулянты</p></td><td> | + | <p>[[Антикоагулянты прямого действия|Антикоагулянты]]</p></td><td> |
<p>Ингибитор синтеза факторов коагуляции (варфарин)</p> | <p>Ингибитор синтеза факторов коагуляции (варфарин)</p> | ||
| − | <p>Непрямые ингибиторы тромбина (гепарин, низкомолекулярные гепарины — эноксапарин) </p> | + | <p>Непрямые ингибиторы тромбина ([[гепарин]], низкомолекулярные гепарины — эноксапарин) </p> |
<p>Прямые ингибиторы тромбина (гирудин, лепирудин)</p></td></tr> | <p>Прямые ингибиторы тромбина (гирудин, лепирудин)</p></td></tr> | ||
<tr><td> | <tr><td> | ||
| − | <p>Тромболитические средства</p></td><td> | + | <p>[[Тромболитики|Тромболитические средства]]</p></td><td> |
<p>Стрептокиназа</p> | <p>Стрептокиназа</p> | ||
<p>Активатор плазминоген-стрептокиназного комплекса </p> | <p>Активатор плазминоген-стрептокиназного комплекса </p> | ||
| Строка 128: | Строка 128: | ||
Таблица 10.2 '''Виды и причины анемии''' | Таблица 10.2 '''Виды и причины анемии''' | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td colspan="2"> | <tr><td colspan="2"> | ||
<p>Гипопролиферативная</p></td></tr> | <p>Гипопролиферативная</p></td></tr> | ||
| Строка 134: | Строка 134: | ||
<p>Микроцитарная</p> | <p>Микроцитарная</p> | ||
<p>анемия</p></td><td> | <p>анемия</p></td><td> | ||
| − | <p>Дефицит железа</p></td></tr> | + | <p>[[Дефицит железа]]</p></td></tr> |
<tr><td> | <tr><td> | ||
<p>Хронические заболевания</p></td></tr> | <p>Хронические заболевания</p></td></tr> | ||
| Строка 182: | Строка 182: | ||
Железо необходимо для формирования сложной молекулы гема — кислородтранспортного компонента гемоглобина. Когда старые красные клетки крови разрушаются, все их железо сохраняется для новых красных клеток. Небольшое количество железа для красных клеток крови поступает с пищей. Пищевое (экзогенное) железо абсорбируется преимущественно в двенадцатиперстной кишке и проксимальном отделе тощей кишки частично как гем и его составные части посредством рецепторов поверхности клеток кишечного эпителия. Железо гема быстро абсорбируется и высвобождается из кольца порфирина с помощью гемоксигеназы в клетке. Негемовая абсорбция железа очень вариабельна, и многие продукты, такие как чай, яичный желток и отруби, мешают абсорбции железа. Избыточное железо запасается в клетке в качестве ферритинового комплекса. | Железо необходимо для формирования сложной молекулы гема — кислородтранспортного компонента гемоглобина. Когда старые красные клетки крови разрушаются, все их железо сохраняется для новых красных клеток. Небольшое количество железа для красных клеток крови поступает с пищей. Пищевое (экзогенное) железо абсорбируется преимущественно в двенадцатиперстной кишке и проксимальном отделе тощей кишки частично как гем и его составные части посредством рецепторов поверхности клеток кишечного эпителия. Железо гема быстро абсорбируется и высвобождается из кольца порфирина с помощью гемоксигеназы в клетке. Негемовая абсорбция железа очень вариабельна, и многие продукты, такие как чай, яичный желток и отруби, мешают абсорбции железа. Избыточное железо запасается в клетке в качестве ферритинового комплекса. | ||
| + | [[Image:Ph_10_3.jpg|250px|thumb|right|Рис. 10.3]] | ||
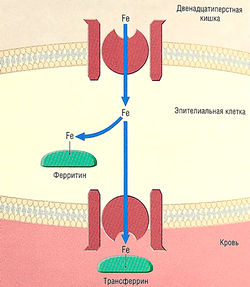
| + | ''Рис. 10.3 Абсорбция железа гастроинтестинальными эпителиальными клетками. Железо (Fe) абсорбируется через поверхностные клеточные рецепторы на эпителиальных клетках. Часть железа проходит через клетку и связывается в крови с трансферрином. Избыток железа запасается в виде ферритина.'' | ||
Железо, связанное с трансферрином, транспортируется в плазме. Железо-трансферриновые комплексы связываются с трансферриновыми рецепторами — мембранными гликопротеинами, эти рецепторы находятся на мембране зрелых эритроидных клеток. Что в результате ведет к поглощению с последующим высвобождением железа внутри клетки. Свободный трансферрин и трансферриновые рецепторы возвращаются на клеточную мембрану (рис. 10.3). | Железо, связанное с трансферрином, транспортируется в плазме. Железо-трансферриновые комплексы связываются с трансферриновыми рецепторами — мембранными гликопротеинами, эти рецепторы находятся на мембране зрелых эритроидных клеток. Что в результате ведет к поглощению с последующим высвобождением железа внутри клетки. Свободный трансферрин и трансферриновые рецепторы возвращаются на клеточную мембрану (рис. 10.3). | ||
| Строка 197: | Строка 199: | ||
[[Препараты для лечения железодефицитной анемии|Лечение железодефицитной анемии]] заключается в коррекции перечисленных далее причин и железокомпенсирующей терапии. Пероральное назначение сульфата железа являются стандартным лечением. Железо лучше абсорбируется, если его принимают на голодный желудок, муцин связывается с неорганическим железом и улучшает его абсорбцию, которая, кроме того, может ухудшаться антацидными препаратами или манипуляциями, усиливающими продукцию соляной кислоты желудка. Лекарственные препараты сульфата железа обычно содержат 60 мг элементарного железа. Только 10-20% принятого внутрь железа абсорбируется организмом пациента с недостатком железа, т.к. биодоступность относительно низкая. Обычная доза составляет 150-200 мг/сут элементарного железа, разделенного на три или четыре приема. Быстрый рост числа ретикулоцитов подтверждает диагноз железодефицитной анемии. Концентрация гемоглобина у пациентов, оптимально получающих 180 мг/сут элементарного железа, увеличивается примерно на 1 г/дл в неделю (массовая концентрация 10 г/л в неделю, массовая доля 0,62 ммол/л в неделю). Лечение должно продолжаться в течение 6 мес после нормализации уровня гемоглобина, для того чтобы пополнить запасы железа в организме. | [[Препараты для лечения железодефицитной анемии|Лечение железодефицитной анемии]] заключается в коррекции перечисленных далее причин и железокомпенсирующей терапии. Пероральное назначение сульфата железа являются стандартным лечением. Железо лучше абсорбируется, если его принимают на голодный желудок, муцин связывается с неорганическим железом и улучшает его абсорбцию, которая, кроме того, может ухудшаться антацидными препаратами или манипуляциями, усиливающими продукцию соляной кислоты желудка. Лекарственные препараты сульфата железа обычно содержат 60 мг элементарного железа. Только 10-20% принятого внутрь железа абсорбируется организмом пациента с недостатком железа, т.к. биодоступность относительно низкая. Обычная доза составляет 150-200 мг/сут элементарного железа, разделенного на три или четыре приема. Быстрый рост числа ретикулоцитов подтверждает диагноз железодефицитной анемии. Концентрация гемоглобина у пациентов, оптимально получающих 180 мг/сут элементарного железа, увеличивается примерно на 1 г/дл в неделю (массовая концентрация 10 г/л в неделю, массовая доля 0,62 ммол/л в неделю). Лечение должно продолжаться в течение 6 мес после нормализации уровня гемоглобина, для того чтобы пополнить запасы железа в организме. | ||
| − | + | Наиболее частый побочный эффект лечения препаратами железа — это раздражение пищеварительного тракта, иногда причиняющее беспокойство. Врачи должны разъяснять пациентам особенности лечения и приема препаратов. Уменьшение дневной дозы или прием препаратов железа вместе с приемом пищи значительно уменьшает вызванный железом лечебный эффект. Полисахарид-железный комплекс меньше раздражает пищеварительную систему, но является более дорогим. Препараты железа для парентерального введения также доступны, но показаны только пациентам с железодефицитной анемией, не переносящим или неспособным абсорбировать железо в таблетках, или пациентам с хроническими кровотечениями, а также пациентам, потребности в железе которых не могут быть удовлетворены только энтеральным приемом препаратов железа. Внутримышечное введение болезненно и может вызвать изменение цвета кожи в месте инъекции. В качестве альтернативы можно медленно внутривенно ввести декстран железа, но такой способ требует особого контроля, т.к. высока вероятность анафилактоидных реакций. | |
| − | + | '''Читайте также''': [[Препараты для лечения железодефицитной анемии]] | |
=== Дефероксамин и передозировка железом === | === Дефероксамин и передозировка железом === | ||
| Строка 218: | Строка 220: | ||
=== Витамин В12, фолат и макроцитарные анемии === | === Витамин В12, фолат и макроцитарные анемии === | ||
| − | + | [[Image:Ph_10_4.jpg|250px|thumb|right|Рис. 10.4]] | |
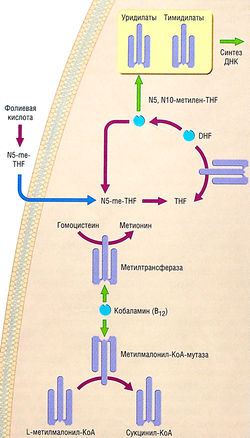
Макроцитарные анемии могут быть мегалобластными, вызванными биохимическим дефектом синтеза ДНК, и немегалобластными, обычно связанными с патологическим повреждением мембранных липидов красных клеток крови. Наиболее частыми факторами, вызывающими мегалобластную, являются недостаток витамина В12 (кобаламин), фолата, миелодисплазия и прием препаратов, угнетающих синтез ДНК. Кобаламин и фолат являются незаменимыми кофакторами ферментативной реакции, необходимой для синтеза ДНК (рис. 10.4). Взаимозависимость кобаламина и метилфолата может объяснить, почему появляются схожие морфологические изменения, когда имеется недостаток кобаламина или фолата. Однако, в отличие от недостатка фолата, недостаток витамина В12 вызывает также и неврологическую недостаточность. Парестезия является самым ранним симптомом, за которым следует потеря чувства вибрации, атаксия, деменция и кома. | Макроцитарные анемии могут быть мегалобластными, вызванными биохимическим дефектом синтеза ДНК, и немегалобластными, обычно связанными с патологическим повреждением мембранных липидов красных клеток крови. Наиболее частыми факторами, вызывающими мегалобластную, являются недостаток витамина В12 (кобаламин), фолата, миелодисплазия и прием препаратов, угнетающих синтез ДНК. Кобаламин и фолат являются незаменимыми кофакторами ферментативной реакции, необходимой для синтеза ДНК (рис. 10.4). Взаимозависимость кобаламина и метилфолата может объяснить, почему появляются схожие морфологические изменения, когда имеется недостаток кобаламина или фолата. Однако, в отличие от недостатка фолата, недостаток витамина В12 вызывает также и неврологическую недостаточность. Парестезия является самым ранним симптомом, за которым следует потеря чувства вибрации, атаксия, деменция и кома. | ||
| + | ''Рис. 10.4 Роль фолатов и витамина В12 в синтезе дезоксирибонуклеиновой кислоты (ДНК). Соединения фолиевой кислоты являются донорами углерода при синтезе диокситимидина из ди-оксиуридина. Кобаламин — кофактор для гомоцистеинметионин-метилтрансферазы, которая переносит метильную группу от метилтетрагидрофолата к гомоцистеину, образуя метионин. Кобаламин также требуется для метилмалонил-КоА-мутазы, которая переводит метилмалонил-КоА в сукцинил-КоА. Метотрексат ингибирует синтез ДНК путем ингибирования дигидрофолатредуктазы, которая переводит дигидрофолат в тетрагидрофолат. DHF — дигидрофолат; N5-me-THF — NS-метилтетрагидрофолиевая кислота; THF — тетрагидрофолат; КоА — коэнзим А.'' | ||
==== Недостаток витамина В12 ==== | ==== Недостаток витамина В12 ==== | ||
| − | + | [[Image:Ph_10_5.jpg|250px|thumb|right|Рис. 10.5]] | |
[[Цианокобаламин|Витамин В12 (кобаламин)]] является сложной молекулой, состоящей из центрального атома кобальта, связанного с четырьмя пиррольными кольцами, связанными с нуклеотидом. Человек получает витамин В12 из животного белка. Ежедневная потребность составляет 0,6-1,2 мкг, а период полувыведения витамина В12 (хранящегося в печени) составляет около 1 года, с содержанием в организме 3-5 мг. Нормальная ежедневная потеря очень мала; следовательно, перед тем, как клинические проявления станут заметны, может пройти более 2 лет. | [[Цианокобаламин|Витамин В12 (кобаламин)]] является сложной молекулой, состоящей из центрального атома кобальта, связанного с четырьмя пиррольными кольцами, связанными с нуклеотидом. Человек получает витамин В12 из животного белка. Ежедневная потребность составляет 0,6-1,2 мкг, а период полувыведения витамина В12 (хранящегося в печени) составляет около 1 года, с содержанием в организме 3-5 мг. Нормальная ежедневная потеря очень мала; следовательно, перед тем, как клинические проявления станут заметны, может пройти более 2 лет. | ||
'''Наиболее распространенной причиной недостатка В12 является пернициозная анемия''' | '''Наиболее распространенной причиной недостатка В12 является пернициозная анемия''' | ||
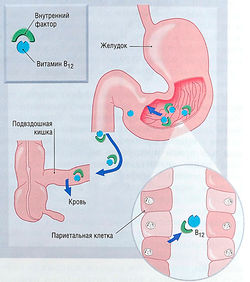
| − | Витамин В12 абсорбируется из желудочно-кишечного тракта с помощью внутреннего фактора, выделяемого париетальными клетками желудка, после чего комплекс внутреннего фактора и кобаламина абсорбируется рецепторами на поверхности клеток слизистой оболочки подвздошной кишки (рис. 10.5 | + | Витамин В12 абсорбируется из желудочно-кишечного тракта с помощью внутреннего фактора, выделяемого париетальными клетками желудка, после чего комплекс внутреннего фактора и кобаламина абсорбируется рецепторами на поверхности клеток слизистой оболочки подвздошной кишки (рис. 10.5). Поскольку витамин В12 широко распространен в животной пище, пищевой недостаток — нечастая причина дефицита витамина В12, за исключением строгих [[Вегетарианская диета|вегетарианцев]] (например, у веганов). Грудные дети вега нов подвержены риску дефицита витамина В12. Наиболее распространенная форма дефицита витамина В12 — пернициозная анемия (нарушение желудочной секреции с атрофией париетальных клеток желудка и нарушением секреции внутреннего фактора). Предполагается, что пернициозная анемия является аутоиммунным процессом, поскольку у многих пациентов обнаружены антитела к париетальным клеткам и внутреннему фактору. Кроме того, дефицит витамина В12 наблюдается у пациентов с частичной или полной резекцией желудка, синдромом мальабсорбции, воспалительными заболеваниями кишечника или резекцией тонкой кишки. |
| − | + | ''Рис. 10.5 Абсорбция витамина В12- Интестинальная абсорбция витамина В12 требует внутренних факторов, которые находятся в париетальных клетках полости рта и связываются в дистальном отделе подвздошной кишки с рецепторами на поверхности клеток.'' | |
| − | |||
| − | Рис. 10.5 Абсорбция витамина | ||
Для постановки диагноза дефицита витамина В12 необходимо провести измерение уровней сывороточного витамина В12, хотя некоторые пациенты с дефицитом имеют нормальный уровень этого витамина. Дефицит витамина В12 приводит к повышению концентрации метилмалоновой кислоты в сыворотке и моче, что является чувствительным показателем дефицита витамина В12. Для определения причинно-следственной связи дефицита витамина В12 и пернициозной анемии проводят двухэтапный тест (тест Шиллинга), сначала только с одним меченым радиоизотопом витамина В12, а затем с меченым радиоизотопом витамина В12 и внутренним фактором. | Для постановки диагноза дефицита витамина В12 необходимо провести измерение уровней сывороточного витамина В12, хотя некоторые пациенты с дефицитом имеют нормальный уровень этого витамина. Дефицит витамина В12 приводит к повышению концентрации метилмалоновой кислоты в сыворотке и моче, что является чувствительным показателем дефицита витамина В12. Для определения причинно-следственной связи дефицита витамина В12 и пернициозной анемии проводят двухэтапный тест (тест Шиллинга), сначала только с одним меченым радиоизотопом витамина В12, а затем с меченым радиоизотопом витамина В12 и внутренним фактором. | ||
| Строка 241: | Строка 242: | ||
=== Дефицит фолиевой кислоты === | === Дефицит фолиевой кислоты === | ||
| − | Фолат (фолиевая кислота) принадлежит к семейству витаминов группы В и содержится в большинстве свежих продуктов, но быстро разрушается при нагревании | + | [[Фолиевая кислота|Фолат (фолиевая кислота)]] принадлежит к семейству витаминов группы В и содержится в большинстве свежих продуктов, но быстро разрушается при нагревании. Фолиевая кислота широко представлена в природе в виде связанной с одной или несколькими молекулами глутаминовой кислоты. Естественно, существующий фолат должен быть отделен от моно- и диглутаматов посредством конъюгаз, имеющихся в желудке, перед тем, как он будет эффективно абсорбирован в проксимальном отделе тонкой кишки. Фолат транспортируется в печень, где запасается и трансформируется в 5-метилтетрагидрофолат — форму, способную проникать в клетки тканей. В клетке 5-метилтетрагидрофолат трансформируется в метаболически активную форму — тетрагидрофолат, посредством витамин-В12-зависимой метилтрансферазы. Дневная норма потребления фолата примерно 100 мкг, с тканевым запасом приблизительно 10 мг. Неадекватный прием фолата, следовательно, ведет к мегалобластной анемии быстрее, чем дефицит витамина В12. |
'''Опасность использования фолиевой кислоты''' | '''Опасность использования фолиевой кислоты''' | ||
| Строка 277: | Строка 278: | ||
Эти факторы были быстро внедрены в клинику для повседневного и экспериментального использования. В настоящее время эритропоэтин, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и интерлейкин-11 были одобрены для использования FDA США, а многие другие, включая тромбопротеин, находятся на финальной стадии разработки. | Эти факторы были быстро внедрены в клинику для повседневного и экспериментального использования. В настоящее время эритропоэтин, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и интерлейкин-11 были одобрены для использования FDA США, а многие другие, включая тромбопротеин, находятся на финальной стадии разработки. | ||
| + | '''Читайте также''': [[Ростовые кроветворные факторы]] | ||
=== Эритропоэтин === | === Эритропоэтин === | ||
[[Эритропоэтин: допинг-контроль, тесты|Эритропоэтин]] — физиологический гормон, необходимый гемопоэтический фактор роста, регулирующий пролиферацию красных клеток крови и дифференцировку в костном мозге. Природный эритропоэтин был впервые изолирован и выделен из мочи пациентов с анемией. Рекомбинантная форма человеческого эритропоэтина — это 165-аминокислотный гликопротеин с молекулярной массой в 34-39 кДа. Период полувыведения в плазме после внутривенного введения составляет примерно 8 час. Печень является главным органом, разрушающим эритропоэтин. | [[Эритропоэтин: допинг-контроль, тесты|Эритропоэтин]] — физиологический гормон, необходимый гемопоэтический фактор роста, регулирующий пролиферацию красных клеток крови и дифференцировку в костном мозге. Природный эритропоэтин был впервые изолирован и выделен из мочи пациентов с анемией. Рекомбинантная форма человеческого эритропоэтина — это 165-аминокислотный гликопротеин с молекулярной массой в 34-39 кДа. Период полувыведения в плазме после внутривенного введения составляет примерно 8 час. Печень является главным органом, разрушающим эритропоэтин. | ||
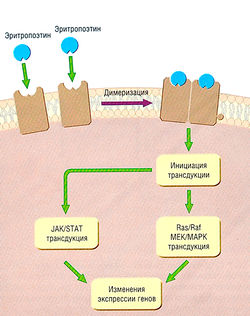
| + | [[Image:Ph_10_6.jpg|250px|thumb|right|Рис. 10.6]] | ||
| + | ''Рис. 10.6 Передача сигнала с цитокиновых рецепторов типа I. Стимуляция цитокиновых рецепторов типа I, в данном случае рецепторов эритропоэтина, на гемопоэтические клетки-предшественники индуцирует димериэацию рецепторов, которые стимулируют триггерную активацию сигналов тирозинкиназы JAK/STAT и Ras/MAPK, что ведет к транскрипции генов, отвечающих за рост и дифференцировку.'' | ||
| − | + | Эритропоэтин продуцируется в ответ на гипоксию тканей печени зародыша и почки взрослого. Гемопротеиновые рецепторы (сенсоры в перитубулярных клетках почек, которые чувствительны к тканевому кислороду) регулируют синтез и последующее высвобождение эритропоэтина (рис. 10.7). Эритропоэтин быстро высвобождается в кровь. В костном мозге эритропоэтин соединяется с эритропоэтиновыми рецепторами на эритроидных клетках-предшественниках, активирует JAK/STAT и другие сигнальные пути тирозиновой протеинкиназы и таким образом стимулирует клеточную пролиферацию и дифференцировку в красные клетки крови (см. ранее и рис. 10.6). | |
| − | |||
| − | Эритропоэтин продуцируется в ответ на гипоксию тканей печени зародыша и почки взрослого. Гемопротеиновые рецепторы (сенсоры в | ||
Эритропоэтин используют при анемии вследствие почечной недостаточности, злокачественных новообразований и хронических воспалений. Анемия вследствие почечной недостаточности — результат потери эритропоэтина. Рекомбинантный человеческий эритропоэтин является стандартом лечения анемии при хронической почечной недостаточности, и подкожное или внутривенное введение эритропоэтина 150 ЕД/кг 3 раза в неделю корректирует анемию в 80% случаев. Ответ ретикулоцитов на эритропоэтин начинается через 3 дня после начала лечения, а значительное увеличение гематокрита проявляется через 1 нед. Максимальный эффект достигается через 4-8 нед. Эритропоэтин используют также для лечения анемий, вызванных первичным поражением костного мозга и вторичных анемий, ассоциированных с воспалением, СПИДом и раком. Эритропоэтин также является эффективным средством для лечения зидовудин-индуцированной анемии у пациентов с ВИЧ и у онкологических больных, получающих химиотерапию. | Эритропоэтин используют при анемии вследствие почечной недостаточности, злокачественных новообразований и хронических воспалений. Анемия вследствие почечной недостаточности — результат потери эритропоэтина. Рекомбинантный человеческий эритропоэтин является стандартом лечения анемии при хронической почечной недостаточности, и подкожное или внутривенное введение эритропоэтина 150 ЕД/кг 3 раза в неделю корректирует анемию в 80% случаев. Ответ ретикулоцитов на эритропоэтин начинается через 3 дня после начала лечения, а значительное увеличение гематокрита проявляется через 1 нед. Максимальный эффект достигается через 4-8 нед. Эритропоэтин используют также для лечения анемий, вызванных первичным поражением костного мозга и вторичных анемий, ассоциированных с воспалением, СПИДом и раком. Эритропоэтин также является эффективным средством для лечения зидовудин-индуцированной анемии у пациентов с ВИЧ и у онкологических больных, получающих химиотерапию. | ||
| Строка 291: | Строка 293: | ||
Международный олимпийский комитет запрещает применение эритропоэтина спортсменами по причине способности этого вещества повышать число красных клеток крови, доставку кислорода к тканям и, следовательно, влиять на результаты соревнований. Кроме того, такая практика может быть опасной. | Международный олимпийский комитет запрещает применение эритропоэтина спортсменами по причине способности этого вещества повышать число красных клеток крови, доставку кислорода к тканям и, следовательно, влиять на результаты соревнований. Кроме того, такая практика может быть опасной. | ||
| − | Дробепоэтин а является | + | Дробепоэтин а является гипергликозилированным аналогом эритропоэтина, который стимулирует эритропоэз по такому же механизму, что и эндогенный эритропоэтин. |
=== Миелоидный фактор роста и нейтропения === | === Миелоидный фактор роста и нейтропения === | ||
| Строка 302: | Строка 304: | ||
Гранулой, и тарный колониестимулирующий фактор и гранулоцитарно-макрофагальный колониестимулирующий фактор Г-КСФ и ГМ-КСФ являются широко используемыми средствами клеточной терапии. Они были впервые выделены из линий человеческих клеток, и сейчас их производят с помощью рекомбинантной технологии. Г-КСФ и ГМ-КСФ стимулируют дифференцировку и пролиферацию разнообразных миелоидных клеток-предшественников посредством активации их специфических рецепторов в клеточной мембране этих клеток. Как и эритропоэтиновые рецепторы, рецепторы Г-КСФ и ГМ-КСФ относят к семейству цитокиновых рецепторов типа I, которые используют JAK/STAT и другие сигнальные пути тирозиновых протеинкиназ, чтобы преобразовывать клеточные ответы. | Гранулой, и тарный колониестимулирующий фактор и гранулоцитарно-макрофагальный колониестимулирующий фактор Г-КСФ и ГМ-КСФ являются широко используемыми средствами клеточной терапии. Они были впервые выделены из линий человеческих клеток, и сейчас их производят с помощью рекомбинантной технологии. Г-КСФ и ГМ-КСФ стимулируют дифференцировку и пролиферацию разнообразных миелоидных клеток-предшественников посредством активации их специфических рецепторов в клеточной мембране этих клеток. Как и эритропоэтиновые рецепторы, рецепторы Г-КСФ и ГМ-КСФ относят к семейству цитокиновых рецепторов типа I, которые используют JAK/STAT и другие сигнальные пути тирозиновых протеинкиназ, чтобы преобразовывать клеточные ответы. | ||
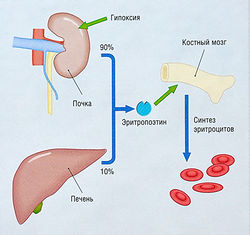
| − | + | [[Image:Ph_10_7.jpg|250px|thumb|right|Рис. 10.7]] | |
| − | Рис. 10.7 Стимуляция синтеза эритропоэтина при гипоксии. Низкое парциальное давление кислорода в крови, поступающей в перитубулярные клетки почек, индуцирует образование этими клетками эритропоэтина. Эритропоэтин стимулирует образование эритроцитов в костном мозге. Печень также продуцирует небольшое количество эритропоэтина, который определяется у больных, не имеющих одной почки. | + | ''Рис. 10.7 Стимуляция синтеза эритропоэтина при гипоксии. Низкое парциальное давление кислорода в крови, поступающей в перитубулярные клетки почек, индуцирует образование этими клетками эритропоэтина. Эритропоэтин стимулирует образование эритроцитов в костном мозге. Печень также продуцирует небольшое количество эритропоэтина, который определяется у больных, не имеющих одной почки.'' |
Таблица 10.3 '''Причины нейтропении''' | Таблица 10.3 '''Причины нейтропении''' | ||
| − | *Миелосупрессивная химиотерапия | + | *Миелосупрессивная [[химиотерапия]] |
*Анальгетики и противовоспалительные препараты | *Анальгетики и противовоспалительные препараты | ||
| − | *Антимикробные средства: сульфонамиды, полусинтетические пенициллины, хлорамфеникол, цефалоспорины | + | *Антимикробные средства: [[Сульфаниламиды, триметоприм/сульфаметоксазол|сульфонамиды]], полусинтетические [[пенициллины]], хлорамфеникол, [[цефалоспорины]] |
*Антипсихотические препараты | *Антипсихотические препараты | ||
| Строка 319: | Строка 321: | ||
*Антагонисты Н2-рецепторов | *Антагонисты Н2-рецепторов | ||
| − | *Аутоиммунные нарушения: системная красная волчанка, ревматоидный артрит *Злокачественные новообразования | + | *Аутоиммунные нарушения: [[Лечение красной волчанки|системная красная волчанка]], [[Лечение ревматоидного артрита|ревматоидный артрит]] |
| + | |||
| + | *[[Лечение злокачественных опухолей|Злокачественные новообразования]] | ||
*Вирусы: иммунодефицита человека, Эпштейна-Барр | *Вирусы: иммунодефицита человека, Эпштейна-Барр | ||
| − | *Туберкулез | + | *[[Противотуберкулезные средства (антимикобактериальные)|Туберкулез]] |
Несмотря на то что специфическая физиологическая роль Г-КСФ и ГМ-КСФ в регуляции нормального миелопоэза до сих пор до конца не ясна, оба фактора эффективно стимулируют продукцию нейтрофилов, когда назначены экзогенно. Г-КСФ и ГМ-КСФ также стимулируют функциональную чувствительность зрелых нейтрофилов к медиаторам воспаления и укрепляют нейтрофил-зависимые защитные механизмы посредством улучшения функции нейтрофилов. Г-КСФ работает только на гемопоэтических клетках, которые станут нейтрофилами, т.е. этот фактор более специфичен, чем ГМ-КСФ. Последний также стимулирует развитие макрофагов. Когда Г-КСФ и ГМ-КСФ вводят внутривенно или подкожно, количество нейтрофилов обычно возрастает через 24 час. Когда поступление препарата заканчивается, количество нейтрофилов снижается на 50% через 24 час и возвращается к начальному количеству через 1-7 дней. Ответная реакция снижена у пациентов, активно подвергавшихся лучевой или химиотерапии, поскольку количество клеток-предшественников у них снижено. | Несмотря на то что специфическая физиологическая роль Г-КСФ и ГМ-КСФ в регуляции нормального миелопоэза до сих пор до конца не ясна, оба фактора эффективно стимулируют продукцию нейтрофилов, когда назначены экзогенно. Г-КСФ и ГМ-КСФ также стимулируют функциональную чувствительность зрелых нейтрофилов к медиаторам воспаления и укрепляют нейтрофил-зависимые защитные механизмы посредством улучшения функции нейтрофилов. Г-КСФ работает только на гемопоэтических клетках, которые станут нейтрофилами, т.е. этот фактор более специфичен, чем ГМ-КСФ. Последний также стимулирует развитие макрофагов. Когда Г-КСФ и ГМ-КСФ вводят внутривенно или подкожно, количество нейтрофилов обычно возрастает через 24 час. Когда поступление препарата заканчивается, количество нейтрофилов снижается на 50% через 24 час и возвращается к начальному количеству через 1-7 дней. Ответная реакция снижена у пациентов, активно подвергавшихся лучевой или химиотерапии, поскольку количество клеток-предшественников у них снижено. | ||
| Строка 364: | Строка 368: | ||
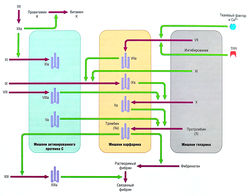
В норме тромбоциты не взаимодействуют с эндотелием сосудов. Тем не менее, когда клетки эндотелия повреждены, тромбоциты прикрепляются к месту повреждения посредством адгезии гликопротеиновых рецепторов тромбоцитов к субэндотелиальному коллагену. Адгезированные тромбоциты подвергаются активации и дегрануляции, высвобождая несколько веществ, таких как тромбоксан А2, аденозиндифосфат (АДФ), [[адреналин]] и [[серотонин]]. Эти вещества активируют и привлекают дополнительные тромбоциты к образованию тромбоцитарного тромба. Активированные тромбоциты предоставляют фосфолипидную контактную поверхность для поддержки конгломерата фактора Ха, активированного комплекса (включающего I фактор 1Ха, тромбоцит-связанный фактор VIlla и кальций) и протромбиназного комплекса (включающего фактор Ха, тромбоцит-связанный фактор Va и кальций), которые совместно усиливают образование тромбина. Образованный тромбин активирует дополнительные тромбоциты и запускает каскад коагуляции (см. далее). | В норме тромбоциты не взаимодействуют с эндотелием сосудов. Тем не менее, когда клетки эндотелия повреждены, тромбоциты прикрепляются к месту повреждения посредством адгезии гликопротеиновых рецепторов тромбоцитов к субэндотелиальному коллагену. Адгезированные тромбоциты подвергаются активации и дегрануляции, высвобождая несколько веществ, таких как тромбоксан А2, аденозиндифосфат (АДФ), [[адреналин]] и [[серотонин]]. Эти вещества активируют и привлекают дополнительные тромбоциты к образованию тромбоцитарного тромба. Активированные тромбоциты предоставляют фосфолипидную контактную поверхность для поддержки конгломерата фактора Ха, активированного комплекса (включающего I фактор 1Ха, тромбоцит-связанный фактор VIlla и кальций) и протромбиназного комплекса (включающего фактор Ха, тромбоцит-связанный фактор Va и кальций), которые совместно усиливают образование тромбина. Образованный тромбин активирует дополнительные тромбоциты и запускает каскад коагуляции (см. далее). | ||
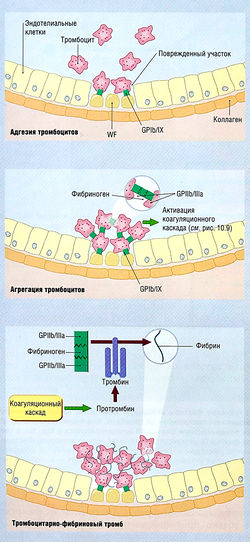
| − | + | [[Image:Ph_10_8.jpg|250px|thumb|right|Рис. 10.8]] | |
Активация тромбоцитов агонистами, такими как АДФ и тромбоксан А2, особенно тромбином, ведет к конформационной активации гликопротеи-нового рецептора Ilb/IIIa на их поверхности. Активированные гликопротеиновые рецепторы Ilb/IIIa обеспечивают функциональное связывание частей фибриногена и других адгезивных молекул, таких как фактор Виллебранда (WF) и фибронектин. Связывание бивалентной молекулы фибриногена с гликопротеиновыми рецепторами Ilb/IIIa на поверхностях соседних тромбоцитов формирует тромбоцитарные агрегаты. Таким образом, активация гликопротеинового рецептора Ilb/IIIa является конечным путем агрегации тромбоцитов согласно агонистическому типу. | Активация тромбоцитов агонистами, такими как АДФ и тромбоксан А2, особенно тромбином, ведет к конформационной активации гликопротеи-нового рецептора Ilb/IIIa на их поверхности. Активированные гликопротеиновые рецепторы Ilb/IIIa обеспечивают функциональное связывание частей фибриногена и других адгезивных молекул, таких как фактор Виллебранда (WF) и фибронектин. Связывание бивалентной молекулы фибриногена с гликопротеиновыми рецепторами Ilb/IIIa на поверхностях соседних тромбоцитов формирует тромбоцитарные агрегаты. Таким образом, активация гликопротеинового рецептора Ilb/IIIa является конечным путем агрегации тромбоцитов согласно агонистическому типу. | ||
| Строка 371: | Строка 375: | ||
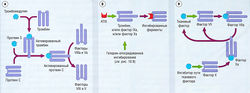
В добавление к тромбину, образованному вследствие активации и агрегации тромбоцитов, комплекс тканевый фактор — фактор Vila играет ключевую роль в инициации коагуляционного каскада и образовании тромбина. Тканевый фактор является собственным мембранным гликопротеином клеток, контактирующих с кровью. Он становится доступен только после образования протеаз или повреждения клетки организма. После повреждения сосуда тканевый фактор функционирует как кофактор или рецептор, который в присутствии ионов Са2+ связывается с фактором VII и активирует его до VIla. Этот комплекс активирует фактор X до Ха, который способствует появлению тромбина (Па) из протромбина (II). Тромбин затем расщепляет фибриноген до фибрина, который стабилизирует временный тромбоцитарный сгусток в постоянный (рис. 10.8). Тканевый фактор VIla активирует фактор X косвенно, через активацию фактора IX до IХа. Продолжительная активация фактора X требует комплекса из факторов 1Ха и VIlla (рис. 10.9). Это объясняет тот факт, что дефицит антигемофильных факторов VIII и IX приводит к расстройствам при кровотечении. Другой патогенез образования тромбина из протромбина — так называемая внутренняя система, которая запускается активацией фактора XII вследствие его контакта со свободными поверхностями (см. рис. 10.9). | В добавление к тромбину, образованному вследствие активации и агрегации тромбоцитов, комплекс тканевый фактор — фактор Vila играет ключевую роль в инициации коагуляционного каскада и образовании тромбина. Тканевый фактор является собственным мембранным гликопротеином клеток, контактирующих с кровью. Он становится доступен только после образования протеаз или повреждения клетки организма. После повреждения сосуда тканевый фактор функционирует как кофактор или рецептор, который в присутствии ионов Са2+ связывается с фактором VII и активирует его до VIla. Этот комплекс активирует фактор X до Ха, который способствует появлению тромбина (Па) из протромбина (II). Тромбин затем расщепляет фибриноген до фибрина, который стабилизирует временный тромбоцитарный сгусток в постоянный (рис. 10.8). Тканевый фактор VIla активирует фактор X косвенно, через активацию фактора IX до IХа. Продолжительная активация фактора X требует комплекса из факторов 1Ха и VIlla (рис. 10.9). Это объясняет тот факт, что дефицит антигемофильных факторов VIII и IX приводит к расстройствам при кровотечении. Другой патогенез образования тромбина из протромбина — так называемая внутренняя система, которая запускается активацией фактора XII вследствие его контакта со свободными поверхностями (см. рис. 10.9). | ||
| − | + | ''Рис. 10.8 Роль тромбоцитов в гемостазе. Существуют 3 этапа формирования тромбоцитарно-фибринового тромба. Первый этап — адгезия тромбоцитов: повреждение эндотелиальных клеток приводит к обнажению подлежащего коллагенового матрикса. Тромбоциты адгезируются на поврежденном коллагене после того, как коллагеновый фактор Виллебранда (WF) связывается с гликопротеиновыми рецепторами Ib/IX (GPIb/IX) тромбоцитов. Второй этап, агрегация тромбоцитов, — это активация тромбоцитов местными факторами, такими как тромбоксан А2, тромбин и коллаген. Они привлекают другие тромбоциты, которые агрегируют с гликопротеиновыми рецепторами Ilb/IIIa (GPIIb/llla) тромбоцитов. Третий этап — это соединение тромбоцитарного тромба с тромбоцитами, обеспечивающими фосфолипидную поверхность для каскада реакций активации коагуляции, чтобы активировать тромбин, который расщепляет фибриноген, с образованием фибрина для ретракции начального тромба.'' | |
| + | [[Image:Ph_10_9.jpg|250px|thumb|right|Рис. 10.9]] | ||
| + | ''Рис. 10.9 Каскад реакций коагуляции. Инициация коагуляции через тканевые факторы активирует фактор VII, который активирует факторы IX и X. Фактор IX переводит фактор X в фактор Ха. Фактор Ха расщепляет протромбин до тромбина, последний расщепляет фибриноген до фибрина. При взаимодействии с отрицательно заряженными поверхностями фактор XII аутоактивируется в ХИа, тот, в свою очередь, переводит субстрат прекалликреин в калликреин, и в результате фактор IX активирует внутренний путь коагуляции. Факторы в сером прямоугольнике — это гепарин-зависимые факторы (мишени гепарина). Факторы в желтом прямоугольнике являются витамин-К-зависимыми (мишени варфарина). Факторы в зеленом прямоугольнике — мишени активированного протеина С. TFPI — ингибитор пути тканевого фактора.'' | ||
| − | + | Кроме превращения фибрина, тромбин активирует фактор XIII, который стабилизирует и перекрещивает молекулы в нерастворимом сгустке фибрина (см. рис. 10.9). Тромбин активирует другие факторы свертывания, усиливая их образование, что вовлекает в тромб больше тромбоцитов и усиливает их агрегацию. Тромбин также является причиной миграции лейкоцитов, регулирует сосудистыи тонус, является сильным активатором миграции и пролиферации гладкомышечных клеток. Центральная роль тромбина в гемостазе и тромбогенезе может стать мишенью для блокирования его активности или предотвращения его образования в терапевтических целях. | |
'''Гемостаз тесно связан со специфическими ингибиторами факторов свертывания''' | '''Гемостаз тесно связан со специфическими ингибиторами факторов свертывания''' | ||
| Строка 382: | Строка 388: | ||
Важными членами семейства серпинов являются антитромбин III, протеины С и S. Антитромбин III — главный ингибитор тромбина, факторов Ха и 1Ха. Гепарин как кофактор антитромбина III увеличивает активацию тромбина и фактора Ха. Протеины С и S — основные ингибиторы факторов Va и Villa. Тромбин активирует протеин С связыванием тромбомодулина, который активирует протеин С на поверхности эндотелиальных клеток. Физиологическое соотношение антитромбина III, протеинов С и S важно при оценке риска тромбоза вен у людей с недостаточностью естественных антикоагулянтов (рис. 10.10). | Важными членами семейства серпинов являются антитромбин III, протеины С и S. Антитромбин III — главный ингибитор тромбина, факторов Ха и 1Ха. Гепарин как кофактор антитромбина III увеличивает активацию тромбина и фактора Ха. Протеины С и S — основные ингибиторы факторов Va и Villa. Тромбин активирует протеин С связыванием тромбомодулина, который активирует протеин С на поверхности эндотелиальных клеток. Физиологическое соотношение антитромбина III, протеинов С и S важно при оценке риска тромбоза вен у людей с недостаточностью естественных антикоагулянтов (рис. 10.10). | ||
| + | [[Image:Ph_10_10.jpg|250px|thumb|right|Рис. 10.10]] | ||
| + | ''Рис. 10.10 Эндогенные антикоагулянты. Существуют В физиологические антикоагуляционные системы, (а) Тромбомодулин, простимулированный тромбином, активирует протеин С, который со своим кофактором, белком S, ингибирует кофакторы Va и Villa в каскаде реакций коагуляции, (б) Антитромбин III (ATIII), простимулированный гепарином, ингибирует тромбин, фактор Ха и фактор 1Ха. (в) Ингибитор пути тканевого фактора ингибирует тканевый фактор, который является ключевым активатором коагуляционного каскада.'' | ||
а2-Макроглобулин выступает в роли ингибитора протеаз, таких как плазмин. | а2-Макроглобулин выступает в роли ингибитора протеаз, таких как плазмин. | ||
| Строка 387: | Строка 395: | ||
'''Активность фибринолитической системы регуляции гемостаза''' | '''Активность фибринолитической системы регуляции гемостаза''' | ||
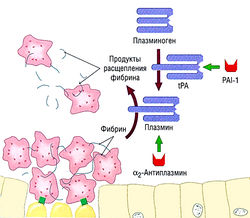
| − | Кроме физиологических антикоагулянтов, фибринолитическая система плазмы является основным эндогенным механизмом, который защищает от тромбообразования путем лизиса фибриновых тромбов. Система состоит из плазминогена, плазмина и их соответствующих ингибиторов. Фибринолиз в основном регулируется ферментами тканевого активатора плазминогена. Циркулирующий tPA находится в неактивном состоянии. Внедрившись в сгусток фибрина, он превращает фибрин-связанный плазминоген в плазмин, который разрушает фибриновый тромб. Плазминоген и плазмин регулируются различными ингибиторами, включая ингибиторы активации плазминогена 1, 2 и 3 и а-2-антиплазмин (рис. 10.11 | + | Кроме физиологических антикоагулянтов, фибринолитическая система плазмы является основным эндогенным механизмом, который защищает от тромбообразования путем лизиса фибриновых тромбов. Система состоит из плазминогена, плазмина и их соответствующих ингибиторов. Фибринолиз в основном регулируется ферментами тканевого активатора плазминогена. Циркулирующий tPA находится в неактивном состоянии. Внедрившись в сгусток фибрина, он превращает фибрин-связанный плазминоген в плазмин, который разрушает фибриновый тромб. Плазминоген и плазмин регулируются различными ингибиторами, включая ингибиторы активации плазминогена 1, 2 и 3 и а-2-антиплазмин (рис. 10.11). |
| − | + | [[Image:Ph_10_11.jpg|250px|thumb|right|Рис. 10.11]] | |
| + | ''Рис. 10.11 Фибринолитическая система. Тканевый активатор плазминогена (tPA), связанного фибрином, переводит его в плазмин, который расщепляет фибрин. Физиологическими ингибиторами являются ингибитор активатора плазминогена (PAI-1) и а2-антиплазмин.'' | ||
== Тромбоз == | == Тромбоз == | ||
| Строка 396: | Строка 405: | ||
*венозной окклюзии, вызывающей тромбоз глубоких вен и легочную эмболию. | *венозной окклюзии, вызывающей тромбоз глубоких вен и легочную эмболию. | ||
| − | |||
| − | |||
Тромбоз с летальным исходом связан с образованием тромбов в местах повреждения сосудистой стенки артерий или вен вследствие стаза или гиперфункции системы коагуляции. Тромбы могут также заполнять камеры сердца, располагаться на поврежденных сердечных клапанах или появляться вследствие синдрома диссеминированного свертывания. | Тромбоз с летальным исходом связан с образованием тромбов в местах повреждения сосудистой стенки артерий или вен вследствие стаза или гиперфункции системы коагуляции. Тромбы могут также заполнять камеры сердца, располагаться на поврежденных сердечных клапанах или появляться вследствие синдрома диссеминированного свертывания. | ||
| Строка 408: | Строка 415: | ||
При тромбозе вен сосудистая стенка часто остается неповрежденной. Стаз играет доминирующую роль и стимулирует накопление агрегатов тромбоцитов и возникновение нитей фибрина в области замедленного тока крови. Гиперкоагуляция также является важным предрасполагающим фактором. Наиболее изученные и типичные гиперкоагуляционные состояния связаны с наследственной недостаточностью натуральных антикоагулянтов антитромбина III, протеинов С и S. Недавнее открытие относительно часто встречающейся наследственной мутации фактора Va (Лейдена), который более устойчив к инактивации посредством активированного протеина С, существенно увеличило количество пациентов с диагностируемыми гиперкоагуляционными состояниями. | При тромбозе вен сосудистая стенка часто остается неповрежденной. Стаз играет доминирующую роль и стимулирует накопление агрегатов тромбоцитов и возникновение нитей фибрина в области замедленного тока крови. Гиперкоагуляция также является важным предрасполагающим фактором. Наиболее изученные и типичные гиперкоагуляционные состояния связаны с наследственной недостаточностью натуральных антикоагулянтов антитромбина III, протеинов С и S. Недавнее открытие относительно часто встречающейся наследственной мутации фактора Va (Лейдена), который более устойчив к инактивации посредством активированного протеина С, существенно увеличило количество пациентов с диагностируемыми гиперкоагуляционными состояниями. | ||
| − | |||
| − | |||
| − | |||
| − | |||
'''Пожизненная антикоагуляция''' | '''Пожизненная антикоагуляция''' | ||
| Строка 418: | Строка 421: | ||
=== Антитромботическая терапия === | === Антитромботическая терапия === | ||
| − | + | [[Image:Ph_10_12.jpg|250px|thumb|right|Рис. 10.12]] | |
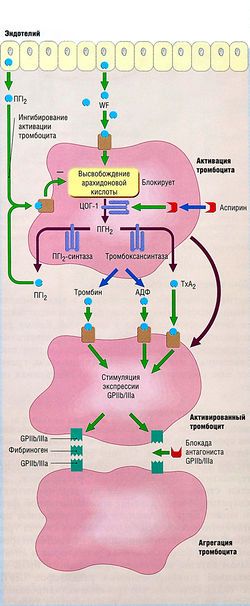
Существует три основных класса антитромботических средств для артериальных и венозных тромботических расстройств. С того времени, как стала известна ключевая роль тромбоцитов в патогенезе артериальных тромботических расстройств, эти клетки стали мишенью для антитромботических препаратов. Ингибирование тромбоцитарной функции может быть достигнуто ингибированием простагландинсинтазы (чтобы уменьшить синтез тромбоксана A2), ингибированием тромбоцитарной мембраны G-белок-связанных рецепторов и антагонизмом адгезии рецептора тромбоцитов Ib/IX или агрегацией гликопротеиновых рецепторов Ilb/IIIa (рис. 10.12). Известно, что тромбин-активированный фибрин является главным компонентом тромба и что тромбин является самым сильным активатором тромбоцитов, поэтому стратегии антикоагуляции сфокусировались на ингибировании активности тромбина или предотвращении его генерации. Для этого используют непрямые ингибиторы тромбина (оральный кумарин и его дериваты) и прямые ингибиторы (гепарин или низкомолекулярный гепарин, аргатробан, гирудин и его дериваты). Третья группа антитромботических препаратов — тромболитические агенты, которые более активно растворяют тромбы, чем прекращение тромботического процесса антитромбоцитарными агентами или ингибиторами тромбина. | Существует три основных класса антитромботических средств для артериальных и венозных тромботических расстройств. С того времени, как стала известна ключевая роль тромбоцитов в патогенезе артериальных тромботических расстройств, эти клетки стали мишенью для антитромботических препаратов. Ингибирование тромбоцитарной функции может быть достигнуто ингибированием простагландинсинтазы (чтобы уменьшить синтез тромбоксана A2), ингибированием тромбоцитарной мембраны G-белок-связанных рецепторов и антагонизмом адгезии рецептора тромбоцитов Ib/IX или агрегацией гликопротеиновых рецепторов Ilb/IIIa (рис. 10.12). Известно, что тромбин-активированный фибрин является главным компонентом тромба и что тромбин является самым сильным активатором тромбоцитов, поэтому стратегии антикоагуляции сфокусировались на ингибировании активности тромбина или предотвращении его генерации. Для этого используют непрямые ингибиторы тромбина (оральный кумарин и его дериваты) и прямые ингибиторы (гепарин или низкомолекулярный гепарин, аргатробан, гирудин и его дериваты). Третья группа антитромботических препаратов — тромболитические агенты, которые более активно растворяют тромбы, чем прекращение тромботического процесса антитромбоцитарными агентами или ингибиторами тромбина. | ||
| − | Рис. 10.12 Действие антитромбоцитарных агентов на активацию и агрегацию тромбоцитов. После повреждения сосудов тромбоциты связываются со стенкой сосудов, при этом они активируются, дегранулируются и активируют и привлекают к себе другие тромбоциты. Тромбоцитарные активаторы вызывают изменение конформации тромбоцитарных гликопротеиновых рецепторов Ilb/IIIa (GPIIb/llla), что в итоге стимулирует агрегацию тромбоцитов. Аспирин, антагонисты рецепторов аденозиндифос-фата (АДФ) и антагонисты гликопротеиновых рецепторов Ilb/IIIa блокируют процесс на различных уровнях. ТхА2 — тромбоксан А2; WF — фактор Виллебранда; ПГН2 — простагландин Н2; ПГ12 — простагландин 12; ЦОГ-1 — циклооксигеназа типа I. | + | ''Рис. 10.12 Действие антитромбоцитарных агентов на активацию и агрегацию тромбоцитов. После повреждения сосудов тромбоциты связываются со стенкой сосудов, при этом они активируются, дегранулируются и активируют и привлекают к себе другие тромбоциты. Тромбоцитарные активаторы вызывают изменение конформации тромбоцитарных гликопротеиновых рецепторов Ilb/IIIa (GPIIb/llla), что в итоге стимулирует агрегацию тромбоцитов. Аспирин, антагонисты рецепторов аденозиндифос-фата (АДФ) и антагонисты гликопротеиновых рецепторов Ilb/IIIa блокируют процесс на различных уровнях. ТхА2 — тромбоксан А2; WF — фактор Виллебранда; ПГН2 — простагландин Н2; ПГ12 — простагландин 12; ЦОГ-1 — циклооксигеназа типа I.'' |
=== Ингибирование продукции тромбоксана А2: аспирин === | === Ингибирование продукции тромбоксана А2: аспирин === | ||
| Строка 441: | Строка 444: | ||
=== Обратимые ингибиторы ЦОГ: НПВС === | === Обратимые ингибиторы ЦОГ: НПВС === | ||
| − | НПВС широко используют при различных воспалительных заболеваниях, т.к. препараты ингибируют ЦОГ тромбоцитов и подавляют тромбоксан А2-зависимую агрегацию тромбоцитов (см. главу 15). В отличие от аспирина, некоторые НПВС конкурентно и обратимо ингибируют ЦОГ тромбоцитов. В типичной противовоспалительной дозе НПВС на 70-85% ингибируют ЦОГ, но этого недостаточно, чтобы развился значительный антитромбоцитарный эффект. Некоторые НПВС, включая индобуфен, сульфинпиразон и трифлузал, тестировались в клинических условиях для оценки возможности их применения при различных тромботических состояниях. Например, индобуфен, неселективный ингибитор ЦОГ-1, оказывает терапевтический эффект, подобный эффекту аспирина. При приеме в дозе 200 мг 2 раза в день индобуфен ингибирует сывороточный тромбоксан А2 более чем на 95%. Клинические испытания показывают, что индобуфен эффективен так же, как и аспирин, при предотвращении коронарной окклюзии. Однако ни один из этих ингибиторов ЦОГ, кроме аспирина, в США не используют, т.к. они не имеют весомого преимущества по сравнению с ним. Селективные ингибиторы ЦОГ-2 как противовоспалительные препараты с меньшим вредным воздействием на ЖКТ пришлось изъять, поскольку они увеличивали риск возникновения сердечных приступов | + | НПВС широко используют при различных воспалительных заболеваниях, т.к. препараты ингибируют ЦОГ тромбоцитов и подавляют тромбоксан А2-зависимую агрегацию тромбоцитов (см. главу 15). В отличие от аспирина, некоторые НПВС конкурентно и обратимо ингибируют ЦОГ тромбоцитов. В типичной противовоспалительной дозе НПВС на 70-85% ингибируют ЦОГ, но этого недостаточно, чтобы развился значительный антитромбоцитарный эффект. Некоторые НПВС, включая индобуфен, сульфинпиразон и трифлузал, тестировались в клинических условиях для оценки возможности их применения при различных тромботических состояниях. Например, индобуфен, неселективный ингибитор ЦОГ-1, оказывает терапевтический эффект, подобный эффекту аспирина. При приеме в дозе 200 мг 2 раза в день индобуфен ингибирует сывороточный тромбоксан А2 более чем на 95%. Клинические испытания показывают, что индобуфен эффективен так же, как и аспирин, при предотвращении коронарной окклюзии. Однако ни один из этих ингибиторов ЦОГ, кроме аспирина, в США не используют, т.к. они не имеют весомого преимущества по сравнению с ним. Селективные ингибиторы ЦОГ-2 как противовоспалительные препараты с меньшим вредным воздействием на ЖКТ пришлось изъять, поскольку они увеличивали риск возникновения сердечных приступов — в основном через подавление ПГ12 синтеза. |
=== Антагонисты АДФ-рецепторов: тиклопидин, клопидогрел === | === Антагонисты АДФ-рецепторов: тиклопидин, клопидогрел === | ||
| Строка 486: | Строка 489: | ||
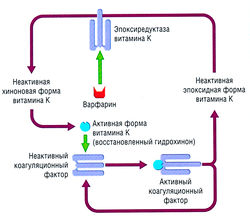
Открытие антикоагуляционных эффектов кумарина в 1940 г. привело к созданию синтетических дериватов, например варфарина. Он является широко распространенным антикоагулянтом, который действует на витамин-К-зависимый синтез факторов свертывания II, VII, IX, X и кофакторов (протеинов С и S) в печени. Посттрансляционное ферментативное карбоксилирование остатков глутаминовой кислоты в этих факторах коагуляции в у-карбоксиглутаминовую кислоту требует витамина К как кофактора. Присутствие ионов кальция, остатков у-карбоксиглутамила позволяет факторам свертывания претерпевать конформационные изменения, необходимые для их биологической активации. Варфарин ингибирует эпоксиредуктазу витамина К, что приводит к уменьшению его синтеза и уменьшению у-карбоксилирования (рис. 10.13), таким образом, косвенно влияя на функцию факторов свертывания. Антикоагулянтный эффект варфарина проявляется только после исчезновения существующих у-карбоксилированных факторов. | Открытие антикоагуляционных эффектов кумарина в 1940 г. привело к созданию синтетических дериватов, например варфарина. Он является широко распространенным антикоагулянтом, который действует на витамин-К-зависимый синтез факторов свертывания II, VII, IX, X и кофакторов (протеинов С и S) в печени. Посттрансляционное ферментативное карбоксилирование остатков глутаминовой кислоты в этих факторах коагуляции в у-карбоксиглутаминовую кислоту требует витамина К как кофактора. Присутствие ионов кальция, остатков у-карбоксиглутамила позволяет факторам свертывания претерпевать конформационные изменения, необходимые для их биологической активации. Варфарин ингибирует эпоксиредуктазу витамина К, что приводит к уменьшению его синтеза и уменьшению у-карбоксилирования (рис. 10.13), таким образом, косвенно влияя на функцию факторов свертывания. Антикоагулянтный эффект варфарина проявляется только после исчезновения существующих у-карбоксилированных факторов. | ||
| − | + | [[Image:Ph_10_13.jpg|250px|thumb|right|Рис. 10.13]] | |
| − | Рис. 10.13 Витамин-К-зависимый синтез факторов свертывания крови. Варфарин ингибирует образование редуцированной формы витамина К, который требуется для у-карбоксилирования глутаминовой кислоты в факторах II, VII, IX, X и протеинов С и S. | + | ''Рис. 10.13 Витамин-К-зависимый синтез факторов свертывания крови. Варфарин ингибирует образование редуцированной формы витамина К, который требуется для у-карбоксилирования глутаминовой кислоты в факторах II, VII, IX, X и протеинов С и S.'' |
Протромбин (фактор II) имеет наибольший период полувыведения, равный 60 час. Тем не менее для максимального антитромботического эффекта с использованием варфарина требуется ежедневное назначение в течение 5 сут. Этот способ рационален при лечении тромбоцитарных расстройств в сочетании с гепарином, даже если международное нормализованное отношение (МНО) достигает терапевтического уровня до истечения 5 сут. Варфарин эффективен для: | Протромбин (фактор II) имеет наибольший период полувыведения, равный 60 час. Тем не менее для максимального антитромботического эффекта с использованием варфарина требуется ежедневное назначение в течение 5 сут. Этот способ рационален при лечении тромбоцитарных расстройств в сочетании с гепарином, даже если международное нормализованное отношение (МНО) достигает терапевтического уровня до истечения 5 сут. Варфарин эффективен для: | ||
| Строка 517: | Строка 520: | ||
Многие клинические состояния и влияние других препаратов потенцируют снижение антикоагуляционного эффекта варфарина (табл. 10.5). Колебание уровня витамина К в диете может оказаться важным фактором для пациентов, проходящих долговременный курс лечения варфарином. | Многие клинические состояния и влияние других препаратов потенцируют снижение антикоагуляционного эффекта варфарина (табл. 10.5). Колебание уровня витамина К в диете может оказаться важным фактором для пациентов, проходящих долговременный курс лечения варфарином. | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td colspan="2"> | <tr><td colspan="2"> | ||
<p>Таблица 10.5 Препараты и условия взаимодействия с варфарином</p></td></tr> | <p>Таблица 10.5 Препараты и условия взаимодействия с варфарином</p></td></tr> | ||
| Строка 593: | Строка 596: | ||
=== Непрямое ингибирование активности тромбина: стандартный гепарин и низкомолекулярные гепарины === | === Непрямое ингибирование активности тромбина: стандартный гепарин и низкомолекулярные гепарины === | ||
| − | + | [[Image:Ph_10_14.jpg|250px|thumb|right|Рис. 10.14]] | |
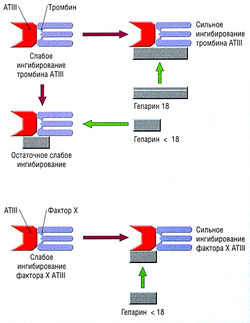
[[Гепарин]] представляет собой гликозаминогликановые цепи чередующихся остатков D-глюкозамина и уроновой кислоты. Стандартный нефракционированный гепарин (НФГ) — гетерогенный препарат с молекулярной массой от 5000 до 30 000 кДа. Антикоагуляционная активность гепарина различна, т.к. длина молекулярной цепи влияет на его активность и клиренс. Молекулы большей молекулярной массы восстанавливают циркуляцию быстрее. Тем не менее некоторые НМГ более активны в отношении фактора Ха, чем в отношении тромбина. | [[Гепарин]] представляет собой гликозаминогликановые цепи чередующихся остатков D-глюкозамина и уроновой кислоты. Стандартный нефракционированный гепарин (НФГ) — гетерогенный препарат с молекулярной массой от 5000 до 30 000 кДа. Антикоагуляционная активность гепарина различна, т.к. длина молекулярной цепи влияет на его активность и клиренс. Молекулы большей молекулярной массы восстанавливают циркуляцию быстрее. Тем не менее некоторые НМГ более активны в отношении фактора Ха, чем в отношении тромбина. | ||
Главный антикоагуляционный эффект гепарина обусловлен связыванием с антитромбином III, в результате чего изменяется конформация антитромбина III и ускоряется ингибирование тромбина, факторов Ха и 1Ха. Антитромбин III — это a-глобулин, который ингибирует сериновые протеазы, включая несколько факторов тромбообразования, связывая остатки серина с реакционным центром факторов свертывания, что приводит к их инактивации. Гепарин в качестве каталитического агента участвует в ускорении инактивации тромбина антитромбином III, действуя как матрица, к которой присоединяются оба элемента, чтобы сформировать третичный комплекс. Однако инактивация антитромбином III фактора Ха не требует образования этого комплекса. НМГ, содержащие менее 18 полисахаридных цепей, не могут служить матрицей для инактивации тромбина антитромбином III, но сохраняют способность инактивировать фактор Ха (рис. 10.14). Но ингибирование тромбообразования гепарином не является полным, т.к. оно не способно инактивировать фактор активации тромбоцитов и фибрин-связанный тромбин, которые сохраняют ферментативную активность. Это, по крайней мере, частично предрасполагает к устойчивости артериального тромбообразования, несмотря на применение гепарина. | Главный антикоагуляционный эффект гепарина обусловлен связыванием с антитромбином III, в результате чего изменяется конформация антитромбина III и ускоряется ингибирование тромбина, факторов Ха и 1Ха. Антитромбин III — это a-глобулин, который ингибирует сериновые протеазы, включая несколько факторов тромбообразования, связывая остатки серина с реакционным центром факторов свертывания, что приводит к их инактивации. Гепарин в качестве каталитического агента участвует в ускорении инактивации тромбина антитромбином III, действуя как матрица, к которой присоединяются оба элемента, чтобы сформировать третичный комплекс. Однако инактивация антитромбином III фактора Ха не требует образования этого комплекса. НМГ, содержащие менее 18 полисахаридных цепей, не могут служить матрицей для инактивации тромбина антитромбином III, но сохраняют способность инактивировать фактор Ха (рис. 10.14). Но ингибирование тромбообразования гепарином не является полным, т.к. оно не способно инактивировать фактор активации тромбоцитов и фибрин-связанный тромбин, которые сохраняют ферментативную активность. Это, по крайней мере, частично предрасполагает к устойчивости артериального тромбообразования, несмотря на применение гепарина. | ||
| − | Рис. 10.14 Антикоагуляционный механизм гепарина. Связывание гепарина с антитромбином III (ATIII) значительно облегчает ингибирование тромбина. Однако при этом требуются молекулы гепарина с полисахаридными остатками более 18. Ингибирование 321 фактора Ха не зависит от размера гепариновых молекул. | + | ''Рис. 10.14 Антикоагуляционный механизм гепарина. Связывание гепарина с антитромбином III (ATIII) значительно облегчает ингибирование тромбина. Однако при этом требуются молекулы гепарина с полисахаридными остатками более 18. Ингибирование 321 фактора Ха не зависит от размера гепариновых молекул.'' |
Гепарин плохо всасывается в полости рта, назначается обычно подкожно или внутривенно, чаще внутривенно в виде сыворотки, способствующей быстрой антикоагуляции и сохранению этого состояния благодаря последующим инфузиям. Подкожные введения 2 или 3 раза в день в равной степени эффективны. Однако, если требуется немедленная антикоагуляция, внутривенное введение предпочтительнее, т.к. под кожей гепарин задерживается на 1-2 час. Применение гепарина требует постоянного лабораторного контроля. Дозу гепарина необходимо титровать, чтобы достичь уровня активированного частичного тромбопластинового времени в 1,5-2,5 раза больше нормального. | Гепарин плохо всасывается в полости рта, назначается обычно подкожно или внутривенно, чаще внутривенно в виде сыворотки, способствующей быстрой антикоагуляции и сохранению этого состояния благодаря последующим инфузиям. Подкожные введения 2 или 3 раза в день в равной степени эффективны. Однако, если требуется немедленная антикоагуляция, внутривенное введение предпочтительнее, т.к. под кожей гепарин задерживается на 1-2 час. Применение гепарина требует постоянного лабораторного контроля. Дозу гепарина необходимо титровать, чтобы достичь уровня активированного частичного тромбопластинового времени в 1,5-2,5 раза больше нормального. | ||
| Строка 673: | Строка 676: | ||
=== Тромболитические средства === | === Тромболитические средства === | ||
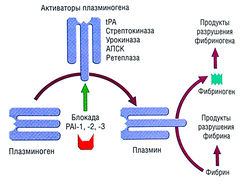
| − | + | [[Image:Ph_10_15.jpg|250px|thumb|right|Рис. 10.15]] | |
В отличие от антикоагуляционной терапии, [[Тромболитики|тромболитические средства]] активно растворяют тромбы за счет сериновых протеаз, ускоряющих процесс превращения плазминогена в плазмин и гидролиза фибриногена и фибрина, что приводит к растворению тромбов (рис. 10.15). Следовательно, только некоторые тромбоэмболические расстройства лечатся тромболитическими средствами. Однако тромболитические средства могут локально повышать концентрацию тромбина при растворении тромба, приводя к усилению агрегации тромбоцитов и тромбозу. Предотвратить это может комбинированная терапия антитромбоцитарными препаратами, такими как аспирин, или антикоагулянтом гепарином. | В отличие от антикоагуляционной терапии, [[Тромболитики|тромболитические средства]] активно растворяют тромбы за счет сериновых протеаз, ускоряющих процесс превращения плазминогена в плазмин и гидролиза фибриногена и фибрина, что приводит к растворению тромбов (рис. 10.15). Следовательно, только некоторые тромбоэмболические расстройства лечатся тромболитическими средствами. Однако тромболитические средства могут локально повышать концентрацию тромбина при растворении тромба, приводя к усилению агрегации тромбоцитов и тромбозу. Предотвратить это может комбинированная терапия антитромбоцитарными препаратами, такими как аспирин, или антикоагулянтом гепарином. | ||
| Строка 680: | Строка 683: | ||
Геморрагии — основной побочный эффект тромболитиков, т.к. они не могут отличить фибрин в тромбе от фибрина гемостатической губки. Тромболитики противопоказаны пациентам с острыми перикардитами, внутренним кровотечением, заживающими ранами и метастазами рака. Одно из осложнений тромболитической терапии при остром инфаркте миокарда — коронарная реокклюзия. | Геморрагии — основной побочный эффект тромболитиков, т.к. они не могут отличить фибрин в тромбе от фибрина гемостатической губки. Тромболитики противопоказаны пациентам с острыми перикардитами, внутренним кровотечением, заживающими ранами и метастазами рака. Одно из осложнений тромболитической терапии при остром инфаркте миокарда — коронарная реокклюзия. | ||
| − | Рис. 10.15 Фибринолитическая система и механизмы действия тромболитических средств. Активаторы плазминогена, используемые в качестве тромболитических агентов, стимулируют переход плазминогена в плазмин, что разрушает фибрин. Показано действие физиологических ингибиторов. PAI-1, -2, -3 — ингибитор активатора плазминогена 1, 2, 3; tPA — тканевый активатор плазминогена; АПСК активатор плазминоген-стрептокиназного комплекса. | + | ''Рис. 10.15 Фибринолитическая система и механизмы действия тромболитических средств. Активаторы плазминогена, используемые в качестве тромболитических агентов, стимулируют переход плазминогена в плазмин, что разрушает фибрин. Показано действие физиологических ингибиторов. PAI-1, -2, -3 — ингибитор активатора плазминогена 1, 2, 3; tPA — тканевый активатор плазминогена; АПСК активатор плазминоген-стрептокиназного комплекса.'' |
В настоящее время в США используют 5 тромболитических средств. Их действие, как прямое, так и непрямое, основано на усилении генерации плазмина из плазминогена (фармакологические и фармакокинетические свойства перечислены в табл. 10.6): | В настоящее время в США используют 5 тромболитических средств. Их действие, как прямое, так и непрямое, основано на усилении генерации плазмина из плазминогена (фармакологические и фармакокинетические свойства перечислены в табл. 10.6): | ||
| Строка 694: | Строка 697: | ||
*ретеплаза — модифицированный рекомбинантный тканевый активатор плазминогена, созданный, чтобы улучшить терапевтические свойства tPA без увеличения риска кровотечений. Это средство в сочетании с алтеплазой приводит к увеличению реперфузии. | *ретеплаза — модифицированный рекомбинантный тканевый активатор плазминогена, созданный, чтобы улучшить терапевтические свойства tPA без увеличения риска кровотечений. Это средство в сочетании с алтеплазой приводит к увеличению реперфузии. | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td colspan="6"> | <tr><td colspan="6"> | ||
<p>Таблица 10.6 Фармакологические и фармакокинетические свойства тромболитиков</p></td></tr> | <p>Таблица 10.6 Фармакологические и фармакокинетические свойства тромболитиков</p></td></tr> | ||
| Строка 835: | Строка 838: | ||
*приобретенные дефекты факторов свертывания включают заболевания печени, недостаточность | *приобретенные дефекты факторов свертывания включают заболевания печени, недостаточность | ||
| − | Таблица 10.8 Заболевания, приводящие к кровотечениям | + | Таблица 10.8 '''Заболевания, приводящие к кровотечениям''' |
*Наследственные | *Наследственные | ||
| Строка 867: | Строка 870: | ||
=== Витамин К === | === Витамин К === | ||
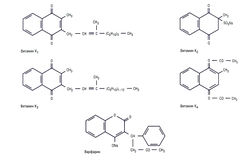
| − | + | [[Image:Ph_10_16.jpg|250px|thumb|right|Рис. 10.16 Химическая структура витамина К и его антагониста варфарина.]] | |
[[Витамин К]] является эссенциальным кофактором синтеза протромбина в печени факторов свертывания II, VII, IX и X, протеинов С и S. Синтез этих факторов требует адекватного поступления витамина К с пищей. Его недостаток или присутствие таких его ингибиторов, как варфарин, приводит к образованию у-некарбоксилированного протромбина, который активируется фактором X только на 1-2% от нормы (см. рис. 10.13). | [[Витамин К]] является эссенциальным кофактором синтеза протромбина в печени факторов свертывания II, VII, IX и X, протеинов С и S. Синтез этих факторов требует адекватного поступления витамина К с пищей. Его недостаток или присутствие таких его ингибиторов, как варфарин, приводит к образованию у-некарбоксилированного протромбина, который активируется фактором X только на 1-2% от нормы (см. рис. 10.13). | ||
| − | |||
| − | |||
Этот витамин нужен для обратимости процесса коагуляции и кровотечения, вызванных варфарином. Недостаточность витамина К можно также наблюдать у пациентов с обструкцией желчных путей и заболеваниями печени, а также после длительного лечения пероральными антибиотиками, в результате чего происходит подавление синтеза витамина К кишечной микрофлорой. | Этот витамин нужен для обратимости процесса коагуляции и кровотечения, вызванных варфарином. Недостаточность витамина К можно также наблюдать у пациентов с обструкцией желчных путей и заболеваниями печени, а также после длительного лечения пероральными антибиотиками, в результате чего происходит подавление синтеза витамина К кишечной микрофлорой. | ||
| − | <table | + | <table border="1" style="border-collapse:collapse;" cellpadding="3"> |
<tr><td> | <tr><td> | ||
<p>Название продукта</p></td><td> | <p>Название продукта</p></td><td> | ||
Версия 00:44, 21 октября 2014
Категория:
«Фармакология».
Содержание
- 1 Физиология кроветворной системы
- 2 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КРОВИ
- 3 АНЕМИЯ И ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЕЕ ЛЕЧЕНИЯ
- 4 Гемопоэтические факторы роста
- 5 НАРУШЕНИЯ ГЕМОСТАЗА И АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ
- 6 Тромбоз
- 6.1 Антитромботическая терапия
- 6.2 Ингибирование продукции тромбоксана А2: аспирин
- 6.3 Обратимые ингибиторы ЦОГ: НПВС
- 6.4 Антагонисты АДФ-рецепторов: тиклопидин, клопидогрел
- 6.5 Ингибирование агрегации тромбоцитов: антагонисты гликопротеиновых рецепторов Ilb/IIIa
- 6.6 Ингибирование факторов образования тромба: варфарин
- 6.7 Непрямое ингибирование активности тромбина: стандартный гепарин и низкомолекулярные гепарины
- 6.8 Низкомолекулярный гепарин: эноксапарин
- 6.9 Прямое ингибирование активности тромбина: гирудин (лепирудин)
- 6.10 Тромболитические средства
- 6.11 Новые антитромботические стратегии и лекарственные средства
- 7 ИНСУЛЬТ
- 8 КРОВОТЕЧЕНИЯ
- 9 Литература
Физиология кроветворной системы
Кровь — это взвесь клеток в плазме, являющейся водным раствором белков и солей. Клетки крови представлены красными клетками крови (эритроциты), белыми клетками крови (лейкоциты) и тромбоцитами (рис. 10.1):
- эритроциты не имеют ядра, содержат гемоглобин и переносят кислород из легких во все ткани, где он обменивается на двуокись углерода;
- лейкоциты (нейтрофилы, моноциты, лимфоциты, эозинофилы и др.) защищают организм от микроорганизмов;
- тромбоциты со свертывающими белками плазмы образуют тромбы, обеспечивая сокращение кровопотери из поврежденных кровеносных сосудов, и принимают участие в воспалительной реакции.
Рис. 10.1 Кровеносные сосуды (вены) и клетки крови. Стенки кровеносных сосудов окружены гладкомышечными клетками и выстланы изнутри эндотелиальными клетками, которые обеспечивают нетромбообразующую поверхность для беспрепятственного кровотока. Белые клетки крови (нейтрофилы, моноциты и лимфоциты) взаимодействуют с клетками кровеносных сосудов для защиты организма от микробной инвазии. Красные клетки крови (эритроциты) несут кислород для насыщения им органов. Тромбоциты образуют тромбы при кровотечениях из сосудов.
Все клетки крови являются производными от гемопоэтических стволовых клеток
Все клетки крови (за исключением периода ранней эмбриональной жизни) берут начало в костном мозге. Костный мозг обеспечивает кроветворную микросреду для поддержания процесса гемопоэза, кроветворного самообновления и дифференцировки. Кроветворные стволовые клетки являются самовоспроизводящимися и существуют в очень небольшом количестве в костном мозге и крови. Каждая стволовая клетка имеет большой потенциал самовоспроизведения. Гемопоэтические стволовые клетки являются покоящимися, и только небольшая их фракция постоянно пролиферирует и дифференцируется, чтобы заменить погибшие клетки крови.
Кроветворные факторы роста и цитокины контролируют гемопоэз
Гемопоэтические стволовые клетки дают начало кроветворным (родоначальным) клеткам. В отличие от стволовых эти клетки обладают меньшим потенциалом к самовоспроизведению и более склонны к дифференцировке в специфичный тип клеток. С каждым новым поколением потомство родоначальных клеток дифференцируется во все более зрелые клетки с еще большим ограничением времени жизни, становясь все более приближенным к узкой группе потомства. В конечном итоге процесс дифференцировки завершается образованием зрелых клеток, которые больше не имеют способности к делению и дают начало красным клеткам крови, лейкоцитам и тромбоцитам (рис. 10.2).
Рис. 10.2 Гемопоэз и гемопоэтические факторы роста. Гемопоэтические стволовые клетки имеют высокий потенциал к регенерации, но каждое следующее поколение делящихся клеток имеет наследственно-специфические характеристики и уменьшенную пролиферативную способность. Факторы роста, включая Еро, Г-КСФ, ГМ-КСФ, IL, М-КСФ, SCF и Тро, необходимы для регуляции каждого этапа гемопоэза. Еро — эритропоэтин; FLT3 — C-FMS-подобная тирозинкиназа; IL — интерлейкин; SCF — фактор роста стволовых клеток; Тро — тромбопоэтин; Г-КСФ — гранулоцитарный колониестимулирующий фактор; ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор; М-КСФ — макрофагальный колониестимулирующий фактор.
Процесс созревания контролируется кроветворными факторами роста и цитокинами, которые активируют соответствующий рецептор фактора роста или цитокина, что ведет к дифференцировке и пролиферации. Многие из этих факторов были очищены и клонированы, а некоторые получены средствами рекомбинантной технологии и используются для клеточной терапии различных заболеваний.
Нормальная концентрация гемоглобина и гематокрита (среднее значение ± среднее отклонение)
|
Гемоглобин |
Гематокрит | ||
|
г/дл |
ммоль/л |
% | |
|
Ребенок |
12,5 ± 1,5 |
(7,37 ± 0,93) |
38 ± 4 |
|
Взрослый мужчина |
15,4 ± 1,8 |
(9,56 ±1,12) |
44 ± 5 |
|
Взрослая женщина |
13,5 ± 2,0 |
(8,38 ± 1,24) |
38 ± 5 |
|
Гематокрит в III триместре беременности может быть снижен на 30% | |||
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗАБОЛЕВАНИЯХ КРОВИ
Здесь описаны препараты, которые являются предпочтительными при лечении трех патологических процессов — анемии, тромбоза и кровотечения:
- анемия — это нарушение циркуляции гемоглобина, происходящее в результате снижения кислородтранспортной емкости эритроцитов;
- тромбоз — это процесс формирования нежелательных тромбов в кровеносных сосудах, которые могут заблокировать доставку кислорода к органам или возврат крови к сердцу;
- кровотечение — это результат несостоятельности системы гемостаза, выражающийся в неспособности формировать тромбы и останавливать кровотечение из поврежденных сосудов. Препараты, используемые для лечения этих заболеваний, представлены в табл. 10.1. Некоторые гемопоэтические факторы роста, которые стали стандартными для гематологических и негематологических расстройств, также рассматриваются здесь.
Таблица 10.1 Средства, используемые для лечения нарушений в системе кровообращения
|
Средства при анемии |
Дефероксамин Витамин В12 |
|
Гемопоэтические факторы роста |
Эритропоэтин Гранулоцитарный колониестимулирующий фактор Гранулоцитарно-макрофагальный колониестимулирующий фактор Опрелвекин (интерлейкин-11) Тромбопоэтин |
|
Антитромбоцитарные агенты |
Необратимые ингибиторы ЦОГ (аспирин) Обратимые ингибиторы ЦОГ (некоторые НПВС) Антагонисты АДФ (тиклопидин, клопидогрел) Антагонисты гликопротеиновых рецепторов llb/llla (абциксимаб, эптифибатид, тирофибан) Дипиридамол |
|
Ингибитор синтеза факторов коагуляции (варфарин) Непрямые ингибиторы тромбина (гепарин, низкомолекулярные гепарины — эноксапарин) Прямые ингибиторы тромбина (гирудин, лепирудин) | |
|
Стрептокиназа Активатор плазминоген-стрептокиназного комплекса Урокиназа Тканевый активатор плазминогена Ретеплаза | |
|
Прокоагулянты |
Концентрированные факторы коагуляции Десмопрессин Витамин К Аминокапроновая кислота Апротинин Местные гемостатики (тромбин, коллаген, абсорбирующий желатин, окисленная целлюлоза) |
АНЕМИЯ И ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЕЕ ЛЕЧЕНИЯ
Анемия — снижение эритроцитарной массы со значением гематокрита менее 40% (37% у женщин) или гемоглобина ниже нормы более чем на 2 стандартных отклонения. Анемия проявляется бледностью, дыхательной недостаточностью и слабостью (не связанной с основной этиологией), эти признаки являются результатом пониженного уровня гемоглобина, приводящего к недостатку кислорода.
По способности костного мозга продуцировать эритроциты и количеству молодых форм красных клеток крови (ретикулоцитов) причины анемии могут быть разделены на две категории:
- низкий уровень ретикулоцитов (гипопролиферативная анемия), когда костный мозг производит недостаточное количество красных клеток крови;
- высокий уровень ретикулоцитов (гиперпролиферативная, или гемолитическая, анемия) — результат повышенного периферического распада красных клеток крови, несмотря на повышенную продукцию.
Гипопролиферативные анемии классифицируют, основываясь на размере красных клеток крови:
- микроцитарная анемия (маленькие красные клетки крови);
- нормоцитарная анемия (красные клетки крови нормального размера);
- макроцитарная анемия (большие красные клетки крови).
В табл. 10.2 представлена этиология анемий согласно перечисленным критериям.
Таблица 10.2 Виды и причины анемии
|
Гипопролиферативная | |
|
Микроцитарная анемия | |
|
Хронические заболевания | |
|
Избыток сидеробластов в костном мозге | |
|
Нормоцитарная анемия |
Хронические заболевания |
|
Эндокринные | |
|
Недостаточное функционирование костного мозга | |
|
Макроцитарная анемия |
Дефицит витамина В12 |
|
Дефицит фолиевой кислоты | |
|
Миелодиспластический синдром | |
|
Гиперпролиферативная | |
|
Гемолитическая анемия |
Гемоглобинопатии |
|
Аутоиммунные | |
|
Мембранопатии | |
|
Лекарственные | |
|
Метаболические нарушения | |
|
Дефицит глюкозо-6-фосфат-дегидрогеназы Инфекции | |
Железо и железодефицитная анемия
Недостаток железа — наиболее частая причина возникновения анемии во всем мире
Несмотря на то, что недостаток железа может встречаться у детей и подростков в период их быстрой фазы роста, железодефицитная анемия считается в основном результатом хронического кровотечения. У женщин это обычно связано с потерей крови во время менструации и беременности; в постклимактерическом периоде у мужчин и женщин железодефицитная анемия связана с патологической потерей крови, причины заболевания следует немедленно установить.
Две трети железа содержится в гемоглобине
Железо необходимо для формирования сложной молекулы гема — кислородтранспортного компонента гемоглобина. Когда старые красные клетки крови разрушаются, все их железо сохраняется для новых красных клеток. Небольшое количество железа для красных клеток крови поступает с пищей. Пищевое (экзогенное) железо абсорбируется преимущественно в двенадцатиперстной кишке и проксимальном отделе тощей кишки частично как гем и его составные части посредством рецепторов поверхности клеток кишечного эпителия. Железо гема быстро абсорбируется и высвобождается из кольца порфирина с помощью гемоксигеназы в клетке. Негемовая абсорбция железа очень вариабельна, и многие продукты, такие как чай, яичный желток и отруби, мешают абсорбции железа. Избыточное железо запасается в клетке в качестве ферритинового комплекса.
Рис. 10.3 Абсорбция железа гастроинтестинальными эпителиальными клетками. Железо (Fe) абсорбируется через поверхностные клеточные рецепторы на эпителиальных клетках. Часть железа проходит через клетку и связывается в крови с трансферрином. Избыток железа запасается в виде ферритина.
Железо, связанное с трансферрином, транспортируется в плазме. Железо-трансферриновые комплексы связываются с трансферриновыми рецепторами — мембранными гликопротеинами, эти рецепторы находятся на мембране зрелых эритроидных клеток. Что в результате ведет к поглощению с последующим высвобождением железа внутри клетки. Свободный трансферрин и трансферриновые рецепторы возвращаются на клеточную мембрану (рис. 10.3).
Физиологическая дневная потеря железа составляет примерно:
- 1 мг/сут у мужчин и женщин вне периода менструации;
- 2-3 мг/сут у женщин в период менструации;
- 500-1000 мг с каждой беременностью.
Сбор анамнеза и осмотр больного дают неполную информацию о состоянии пациента с железодефицитной анемией, но точный диагноз недостаточности железа зависит от одного или более специфических лабораторных тестов. Информация об уровне сывороточного ферритина может быть полезна для оценки запасов железа в организме, поскольку содержание ферритина связано с железодефицитной анемией в том случае, если нет конкурентного процесса, который аномально повышает его количество в крови, например инфекции или заболевания печени. К железодефицитной анемии приводит низкий уровень сывороточного железа и высокий показатель железосвязывающей емкости, т.е. соотношение данных параметров является показателем общей железосвязывающей емкости и характеризуется низким уровнем железа в организме. Микроцитоз является поздним симптомом. Самый чувствительный и специфичный тест в диагностике недостатка железа — исследование костного мозга путем его окрашивания для определения запасов железа, хотя в большинстве клинических случаев эта процедура не всегда нужна.
Лечение железодефицитной анемии заключается в коррекции перечисленных далее причин и железокомпенсирующей терапии. Пероральное назначение сульфата железа являются стандартным лечением. Железо лучше абсорбируется, если его принимают на голодный желудок, муцин связывается с неорганическим железом и улучшает его абсорбцию, которая, кроме того, может ухудшаться антацидными препаратами или манипуляциями, усиливающими продукцию соляной кислоты желудка. Лекарственные препараты сульфата железа обычно содержат 60 мг элементарного железа. Только 10-20% принятого внутрь железа абсорбируется организмом пациента с недостатком железа, т.к. биодоступность относительно низкая. Обычная доза составляет 150-200 мг/сут элементарного железа, разделенного на три или четыре приема. Быстрый рост числа ретикулоцитов подтверждает диагноз железодефицитной анемии. Концентрация гемоглобина у пациентов, оптимально получающих 180 мг/сут элементарного железа, увеличивается примерно на 1 г/дл в неделю (массовая концентрация 10 г/л в неделю, массовая доля 0,62 ммол/л в неделю). Лечение должно продолжаться в течение 6 мес после нормализации уровня гемоглобина, для того чтобы пополнить запасы железа в организме.
Наиболее частый побочный эффект лечения препаратами железа — это раздражение пищеварительного тракта, иногда причиняющее беспокойство. Врачи должны разъяснять пациентам особенности лечения и приема препаратов. Уменьшение дневной дозы или прием препаратов железа вместе с приемом пищи значительно уменьшает вызванный железом лечебный эффект. Полисахарид-железный комплекс меньше раздражает пищеварительную систему, но является более дорогим. Препараты железа для парентерального введения также доступны, но показаны только пациентам с железодефицитной анемией, не переносящим или неспособным абсорбировать железо в таблетках, или пациентам с хроническими кровотечениями, а также пациентам, потребности в железе которых не могут быть удовлетворены только энтеральным приемом препаратов железа. Внутримышечное введение болезненно и может вызвать изменение цвета кожи в месте инъекции. В качестве альтернативы можно медленно внутривенно ввести декстран железа, но такой способ требует особого контроля, т.к. высока вероятность анафилактоидных реакций.
Читайте также: Препараты для лечения железодефицитной анемии
Дефероксамин и передозировка железом
Избыток железа может повлечь за собой острое или хроническое отравление (передозировка железом). Острое отравление железом обычно наблюдается у маленьких детей, которые употребляют таблетки, содержащие железо, предназначенные для педиатрической поддержки, а также у взрослых членов семьи и их детей при пренатальной витаминной поддержке или при лечения анемии. Таблетки, содержащие железо, чрезвычайно привлекательны для маленьких детей, т.к. они похожи на леденцы. Острое отравление железом является частой причиной смерти детей до 6 лет. Хроническая передозировка железом, с другой стороны, является частой в сочетании с врожденным гемохроматозом. Это расстройство вызвано чрезмерной абсорбцией железа и переливанием крови в течение длительного периода времени при отсутствии кровотечения. Например, передозировка железом является основной причиной смерти больных талассемией в развитых странах,
Опасность пероральных препаратов железа поскольку организм не может существенно увеличить элиминацию железа.
- Прием пероральных препаратов железа ведет к появлению черного стула, что может быть расценено как желудочно-кишечное кровотечение!
Отравление железом может быть коррозивным или клеточным. Железо является крайне коррозивным веществом для слизистой оболочки желудочно-кишечного тракта. Такой коррозивный эффект может проявляться как гематемезис или диарея. У пациентов может наблюдаться гиповолемия, что связано с потерей крови и жидкости. Абсорбция чрезмерного количества экзогенного железа может вести к системному отравлению железом с нарушением окислительного фосфорилирования и митохондриальной дисфункцией, приводящей к гибели клеток. Наиболее поражаемым органом является печень. Также могут быть поражены другие органы: сердце, почки, легкие и кроветворная система. После приема большого количества элементарного железа (> 20 мг/кг) у пациентов обычно проявляются признаки желудочно-кишечного отравления. Когда прием железа превышает 40 мг/кг, пациенты обычно переносят острую интоксикацию. Прием более 60 мг/кг может привести к смерти.
Передозировка железом может быть предотвращена и излечена посредством хелатной добавки, связывается с железом и способствует его выведению. Единственной хелатной добавкой, используемой в клинике, является дефероксамин В тригидроксаминовая кислота, выделенная из бактерий Streptomyces pilosus с избирательностью к трехвалентному железу. Препарат вводится подкожно или внутривенно, чтобы связывать железо в случаях острой и хронической передозировки железом.
Дефероксамин подкожно назначают в дозе 20-50 мг/кг в течение 8-10 час, от 3 до 5 раз в неделю. Применение дефероксамина необходимо продолжать до тех пор, пока уровень ферритина не станет ниже 1000 нг/мл. Аскорбиновая кислота (витамин С) в дозе 100 мг повышает экскрецию железа, ее назначают в комбинации с дефероксамином. При остром гемосидерозе дефероксамин назначают внутривенно в дозе 100 мг/кг в течение 12 час. Желательно поддерживать уровень ферритина ниже 2000 нг/мл; если ферритин выше 4000 нг/мл, необходимо введение дефероксамина в высоких дозах.
Самые частые побочные эффекты дефероксамина — звон в ушах и кратковременная обратимая потеря слуха независимо от дозы. Менее типично ухудшение сумеречного зрения. Внутривенное введение более 15 мг/кг/час может вызвать гипотензию и даже шок. Нередки аллергические реакции, включая анафилаксию. К дефероксамину можно добавить гидрокортизон, чтобы снизить риск этих реакций. Разбавленный дефероксамин может уменьшить раздражение при назначении. Чрезмерное связывание железа вызывает нарушение роста у детей и дефицит минералов.
Витамин В12, фолат и макроцитарные анемии
Макроцитарные анемии могут быть мегалобластными, вызванными биохимическим дефектом синтеза ДНК, и немегалобластными, обычно связанными с патологическим повреждением мембранных липидов красных клеток крови. Наиболее частыми факторами, вызывающими мегалобластную, являются недостаток витамина В12 (кобаламин), фолата, миелодисплазия и прием препаратов, угнетающих синтез ДНК. Кобаламин и фолат являются незаменимыми кофакторами ферментативной реакции, необходимой для синтеза ДНК (рис. 10.4). Взаимозависимость кобаламина и метилфолата может объяснить, почему появляются схожие морфологические изменения, когда имеется недостаток кобаламина или фолата. Однако, в отличие от недостатка фолата, недостаток витамина В12 вызывает также и неврологическую недостаточность. Парестезия является самым ранним симптомом, за которым следует потеря чувства вибрации, атаксия, деменция и кома.
Рис. 10.4 Роль фолатов и витамина В12 в синтезе дезоксирибонуклеиновой кислоты (ДНК). Соединения фолиевой кислоты являются донорами углерода при синтезе диокситимидина из ди-оксиуридина. Кобаламин — кофактор для гомоцистеинметионин-метилтрансферазы, которая переносит метильную группу от метилтетрагидрофолата к гомоцистеину, образуя метионин. Кобаламин также требуется для метилмалонил-КоА-мутазы, которая переводит метилмалонил-КоА в сукцинил-КоА. Метотрексат ингибирует синтез ДНК путем ингибирования дигидрофолатредуктазы, которая переводит дигидрофолат в тетрагидрофолат. DHF — дигидрофолат; N5-me-THF — NS-метилтетрагидрофолиевая кислота; THF — тетрагидрофолат; КоА — коэнзим А.
Недостаток витамина В12
Витамин В12 (кобаламин) является сложной молекулой, состоящей из центрального атома кобальта, связанного с четырьмя пиррольными кольцами, связанными с нуклеотидом. Человек получает витамин В12 из животного белка. Ежедневная потребность составляет 0,6-1,2 мкг, а период полувыведения витамина В12 (хранящегося в печени) составляет около 1 года, с содержанием в организме 3-5 мг. Нормальная ежедневная потеря очень мала; следовательно, перед тем, как клинические проявления станут заметны, может пройти более 2 лет.
Наиболее распространенной причиной недостатка В12 является пернициозная анемия
Витамин В12 абсорбируется из желудочно-кишечного тракта с помощью внутреннего фактора, выделяемого париетальными клетками желудка, после чего комплекс внутреннего фактора и кобаламина абсорбируется рецепторами на поверхности клеток слизистой оболочки подвздошной кишки (рис. 10.5). Поскольку витамин В12 широко распространен в животной пище, пищевой недостаток — нечастая причина дефицита витамина В12, за исключением строгих вегетарианцев (например, у веганов). Грудные дети вега нов подвержены риску дефицита витамина В12. Наиболее распространенная форма дефицита витамина В12 — пернициозная анемия (нарушение желудочной секреции с атрофией париетальных клеток желудка и нарушением секреции внутреннего фактора). Предполагается, что пернициозная анемия является аутоиммунным процессом, поскольку у многих пациентов обнаружены антитела к париетальным клеткам и внутреннему фактору. Кроме того, дефицит витамина В12 наблюдается у пациентов с частичной или полной резекцией желудка, синдромом мальабсорбции, воспалительными заболеваниями кишечника или резекцией тонкой кишки.
Рис. 10.5 Абсорбция витамина В12- Интестинальная абсорбция витамина В12 требует внутренних факторов, которые находятся в париетальных клетках полости рта и связываются в дистальном отделе подвздошной кишки с рецепторами на поверхности клеток.
Для постановки диагноза дефицита витамина В12 необходимо провести измерение уровней сывороточного витамина В12, хотя некоторые пациенты с дефицитом имеют нормальный уровень этого витамина. Дефицит витамина В12 приводит к повышению концентрации метилмалоновой кислоты в сыворотке и моче, что является чувствительным показателем дефицита витамина В12. Для определения причинно-следственной связи дефицита витамина В12 и пернициозной анемии проводят двухэтапный тест (тест Шиллинга), сначала только с одним меченым радиоизотопом витамина В12, а затем с меченым радиоизотопом витамина В12 и внутренним фактором.
Лечение дефицита витамина В12 следует начинать с назначения препаратов витамина В12 парентерально: цианокобаламина или гидроксикобаламина. Рекомендованная начальная доза составляет 0,1-1 мг/сут внутримышечно в течение 1-2 нед. Поддерживающей дозой является ежемесячная инъекция 1 мг цианокобаламина в течение всей жизни. Пероральный прием 1 мг витамина В12 5 раз в неделю является сопоставимо эффективным. Несмотря на недостаток внутреннего фактора, абсорбция посредством пассивной диффузии может удовлетворять дневную потребность величиной в 2-5 мкг. Аппликации витамина В12 интраназально в форме геля являются оправданными как добавление к диете, но не как лечение пернициозной анемии, хотя это равным образом повышает сывороточный уровень витамина В12. Сывороточная концентрация К+ может упасть после лечения витамином В12 вследствие повышенного использования внутриклеточного К* для поддержания синтеза новых клеток.
Мегалобластная анемия как результат дефицита витамина В12 может быть результатом назначения больших доз фолата. Наоборот, избыточные дозы витамина В12 могут превратить мегалобластную анемию в дефицит фолата. Важно помнить, что неврологические нарушения, вызванные дефицитом витамина B12, необратимы посредством использования фолата. Следовательно, необходим точный диагноз типа дефицита.
Дефицит фолиевой кислоты
Фолат (фолиевая кислота) принадлежит к семейству витаминов группы В и содержится в большинстве свежих продуктов, но быстро разрушается при нагревании. Фолиевая кислота широко представлена в природе в виде связанной с одной или несколькими молекулами глутаминовой кислоты. Естественно, существующий фолат должен быть отделен от моно- и диглутаматов посредством конъюгаз, имеющихся в желудке, перед тем, как он будет эффективно абсорбирован в проксимальном отделе тонкой кишки. Фолат транспортируется в печень, где запасается и трансформируется в 5-метилтетрагидрофолат — форму, способную проникать в клетки тканей. В клетке 5-метилтетрагидрофолат трансформируется в метаболически активную форму — тетрагидрофолат, посредством витамин-В12-зависимой метилтрансферазы. Дневная норма потребления фолата примерно 100 мкг, с тканевым запасом приблизительно 10 мг. Неадекватный прием фолата, следовательно, ведет к мегалобластной анемии быстрее, чем дефицит витамина В12.
Опасность использования фолиевой кислоты
- Большие дозы фолиевой кислоты могут повернуть вспять течение мегалобластной анемии, вызванной дефицитом витамина В12, но неврологические нарушения вследствие этого дефицита будут необратимыми
Неадекватный прием препарата является самой распространенной причиной дефицита фолата
Во время беременности потребность в фолате заметно возрастает. Дефицит фолата в раннем периоде беременности приводит к врожденным дефектам нервной трубки у зародыша. Восполнение фолата рекомендовано всем беременным женщинам, или тем, кто планирует беременность, поскольку существует повышенная потребность в фолате в первые дни после зачатия. Алкоголизм является частой причиной фолат-дефицитной анемии вследствие уменьшенного потребления фолата и сниженной его абсорбции. Поскольку концентрация фолата в желчи в несколько раз больше, чем в плазме, дефицит желчи будет снижать концентрацию фолата в плазме. Пациенты с долговременным дренажем желчи также должны получать фолат. Люди, принимающие фенитоин и подобные антиконвульсанты, склонны к сниженной абсорбции фолата, но они редко болеют мегалобластной анемией. Антифолатные препараты, такие как метотрексат, активно используют для лечения гематологических и воспалительных заболеваний. Метотрексат конкурирует с дигидрофолатом за фермент дигидрофолатредуктазу и даже в относительно небольших дозах используется в лечении ревматоидного артрита; при этом доказан макроцитоз красных клеток крови (см. рис. 10.4).
Анамнез, осмотр и обнаружение макроцитоза позволяют врачу диагностировать дефицит фолата. Несмотря на то что недостаток фолата и витамина В12 вызывают похожие морфологические изменения в красных клетках крови, характерные неврологические изменения наблюдаются только в случаях мегалобластной анемии, вызванной дефицитом витамина В12. Для постановки диагноза дефицита фолата необходимо измерение уровня сывороточного фолата или уровня фолата красных клеток крови; последний имеет большее диагностическое значение.
Дефицит фолата требует ежедневного приема 1-5 мг фолата перорально. Инъекционная форма также допустима. Поскольку дефицит витамина В12 может вызывать сопутствующий дефицит фолата, перед лечением важно убедиться в том, что пациент не имеет дефицита витамина В12. Фолат может корректировать мегалобластную анемию, вызванную дефицитом витамина В12, но не сможет скорректировать неврологические поражения. Беспорядочное использование фолата может, следовательно, маскировать симптомы дефицита витамина В12 и вести к необратимым неврологическим поражениям.
Фолиевая кислота может предотвратить атеросклероз
Концентрация сывороточного гомоцистеина обратно пропорционально коррелирует с уровнем сывороточного фолата. Доказано, что повышенный уровень сывороточного гомоцистеина является независимым фактором риска атеросклероза. Следовательно, для профилактики атеротромбоза полезно проводить гомоцистеин-снижающую терапию фолиевой кислотой.
Гидроксимочевина и серповидно-клеточная анемия
Серповидно-клеточная анемия является частой гемоглобинопатией в основном у представителей негроидной расы. Пятьдесят лет назад Лайнус Поллинг и его коллеги открыли, что серповидноклеточная анемия вызывается белковой молекулой, кодируемой определенным геном. Точный механизм был выяснен позднее: точечная мутация в (3-цепи гена гемоглобина S приводит к замене валина на глутамат в шестом аминокислотном положении. Это повреждение заметно снижает растворимость окисленного гемоглобина S, что приводит к полимеризации окисленного гемоглобина S и деформации красных клеток крови (образованию серповидных форм) и гемолизу. Пациенты с серповидно-клеточной анемией гомозиготны по дефективному гену и имеют гемоглобин S, но не имеют гемоглобина А. В отличие от этого, люди с характерной серповидностью клеток являются гетерозиготными по дефективному гену и имеют оба вида гемоглобина. Серповидность клеток (примерно у 1 из 10 представителей негроидной расы) обычно ничем не проявляется, но физическая активность на большой высоте, авиаперелеты и анестезия для таких людей потенциально опасны.
Клинические проявления, вытекающие из эпизодического образования серповидных форм, сводятся к микрососудистой окклюзии. Появляются болезненные приступы, когда ригидные и деформированные серповидные клетки взаимодействуют с тромбоцитами, эндотелием и факторами свертывания, вызывая нарушение микроциркуляции. Пациенты с серповидно-клеточной анемией страдают от тяжелой гемолитической анемии, которая начинается с первых недель жизни, когда гемоглобин S заменяет гемоглобин F, и длится всю жизнь. Среднее время жизни эритроцитов у этих больных составляет всего 17 дней вместо 120 в норме; таким образом, эти пациенты очень чувствительны к кратковременному угнетению функции костного мозга, вызванному разнообразными инфекциями, которые могут приводить к апластическому кризису. Повторяющиеся эпизоды ишемического некроза приводят к прогрессирующему повреждению органов.
Лечение серповидно-клеточной анемии в прошлом было в основном поддерживающим, с использованием внутривенных вливаний жидкостей, кислородотерапии, анальгетиков для облегчения боли и переливанием крови.
Гидроксимочевина (ГМ) — это ингибитор рибонуклеотид-редуктазной системы, которая катализирует лимитирующую скорость реакции в заново реализующемся биосинтезе пуриновых и пиримидиновых дезоксирибонуклеотидов. В настоящее время ГМ используют для лечения хронической миелогенной лейкемии и истинной полицитемии (см. главу 6). Последние клинические исследования демонстрируют, что ГМ увеличивает популяцию ретикулоцитов, содержащих гемоглобин F, и стимулирует небольшой рост уровня гемоглобина F. ГМ ослабляет болезненные приступы у тяжелобольных взрослых и у детей с серповидно-клеточной анемией. Тем не менее лечение не всегда эффективно, и у большинства пациентов приступы не ослабляются. Еще больше клинических исследований необходимо, чтобы определить, способна ли ГМ предотвращать хронические поражения органов. Хотя ГМ широко используют в лечении разнообразных гематологических заболеваний и она относительно хорошо переносится, использование цитотоксических препаратов при незлокачественных состояниях ставит вопрос о долговременной безопасности. Клинические исследования показали, что использование ГМ в максимально допустимых дозах в течение 1 года приводит к положительным гематологическим изменениям, включая повышенную концентрацию гемоглобина с мягкой, кратковременной и обратимой интоксикацией у детей с серповидноклеточной анемией. Дозу ГМ следует повышать медленно до уровня, при которой проявится значительная цитопения. Рекомендованная максимальная доза составляет 10-20 мг/кг/сут.
Гемопоэтические факторы роста
Гемопоэтические факторы роста являются членами семейства цитокинов типа I
Известно более 30 гемопоэтических факторов роста и цитокинов, которые вовлечены в регуляцию дифференцировки и пролиферации клеток крови. Они включают факторы, непосредственно регулирующие специфические линии клеток, факторы, регулирующие размножение специфических линий клеток, и факторы, опосредованно регулирующие гемопоэз путем включения экспрессии генов гемопоэтических факторов роста или цитокинов. Структура гемопоэтических факторов роста и цитокинов вариабельна, но рецепторы большинства этих факторов относятся к семейству цитокиновых рецепторов типа I. Как группа цитокиновые рецепторы типа I состоят обычно из рецепторной субъединицы и ассоциированной преобразовательной субъединицы. Три преобразовательные единицы, имеющиеся у разнообразных представителей этого рецепторного семейства, называют гликопротеином 130 (GP130), субъединица β (βс) и субъединица у (ус). В отличие от семейства рецепторов тирозинкиназы, ни один из цитокиновых рецепторов типа I не имеет внутреннего домена тирозинкиназы. Вместо этого рецепторы обычно формируют гомо-или гетеродимеры посредством соединения родственных факторов роста или цитокинов. Лиганд-индуцируемая димеризация рецепторов запускает активацию JAK/STAT тирозинкиназных сигнальных путей, которые служат связующим звеном в дифференцировке и пролиферации факторов роста или цитокинов (рис. 10.6; см. также главу 3). Кроме того, сигнальные пути Ras/MAPK и фосфатидилинозитол-3-киназы также могут быть использованы этими рецепторами, чтобы служить связующим звеном в стимуляции гемопоэтических факторов роста.
Эти факторы были быстро внедрены в клинику для повседневного и экспериментального использования. В настоящее время эритропоэтин, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и интерлейкин-11 были одобрены для использования FDA США, а многие другие, включая тромбопротеин, находятся на финальной стадии разработки.
Читайте также: Ростовые кроветворные факторы
Эритропоэтин
Эритропоэтин — физиологический гормон, необходимый гемопоэтический фактор роста, регулирующий пролиферацию красных клеток крови и дифференцировку в костном мозге. Природный эритропоэтин был впервые изолирован и выделен из мочи пациентов с анемией. Рекомбинантная форма человеческого эритропоэтина — это 165-аминокислотный гликопротеин с молекулярной массой в 34-39 кДа. Период полувыведения в плазме после внутривенного введения составляет примерно 8 час. Печень является главным органом, разрушающим эритропоэтин.
Рис. 10.6 Передача сигнала с цитокиновых рецепторов типа I. Стимуляция цитокиновых рецепторов типа I, в данном случае рецепторов эритропоэтина, на гемопоэтические клетки-предшественники индуцирует димериэацию рецепторов, которые стимулируют триггерную активацию сигналов тирозинкиназы JAK/STAT и Ras/MAPK, что ведет к транскрипции генов, отвечающих за рост и дифференцировку.
Эритропоэтин продуцируется в ответ на гипоксию тканей печени зародыша и почки взрослого. Гемопротеиновые рецепторы (сенсоры в перитубулярных клетках почек, которые чувствительны к тканевому кислороду) регулируют синтез и последующее высвобождение эритропоэтина (рис. 10.7). Эритропоэтин быстро высвобождается в кровь. В костном мозге эритропоэтин соединяется с эритропоэтиновыми рецепторами на эритроидных клетках-предшественниках, активирует JAK/STAT и другие сигнальные пути тирозиновой протеинкиназы и таким образом стимулирует клеточную пролиферацию и дифференцировку в красные клетки крови (см. ранее и рис. 10.6).
Эритропоэтин используют при анемии вследствие почечной недостаточности, злокачественных новообразований и хронических воспалений. Анемия вследствие почечной недостаточности — результат потери эритропоэтина. Рекомбинантный человеческий эритропоэтин является стандартом лечения анемии при хронической почечной недостаточности, и подкожное или внутривенное введение эритропоэтина 150 ЕД/кг 3 раза в неделю корректирует анемию в 80% случаев. Ответ ретикулоцитов на эритропоэтин начинается через 3 дня после начала лечения, а значительное увеличение гематокрита проявляется через 1 нед. Максимальный эффект достигается через 4-8 нед. Эритропоэтин используют также для лечения анемий, вызванных первичным поражением костного мозга и вторичных анемий, ассоциированных с воспалением, СПИДом и раком. Эритропоэтин также является эффективным средством для лечения зидовудин-индуцированной анемии у пациентов с ВИЧ и у онкологических больных, получающих химиотерапию.
Осложнения лечения эритропоэтином включают гипертензию и тромбоз, который может проявляться, если показатели гематокрита возрастают слишком быстро. Приступы отмечались у пациентов с подобными эпизодами в анамнезе. Запасы железа у больных с анемией вследствие почечной недостаточности обычно быстро истощаются в процессе лечения эритропоэтином, что связано с эритропоэзом. Поскольку бывает трудно ограничиться пероральным восполнением железа вследствие того, что продолжительная потеря железа связана с потерей крови, может быть необходимо лечение с парентеральным введением препаратов железа.
Международный олимпийский комитет запрещает применение эритропоэтина спортсменами по причине способности этого вещества повышать число красных клеток крови, доставку кислорода к тканям и, следовательно, влиять на результаты соревнований. Кроме того, такая практика может быть опасной.
Дробепоэтин а является гипергликозилированным аналогом эритропоэтина, который стимулирует эритропоэз по такому же механизму, что и эндогенный эритропоэтин.
Миелоидный фактор роста и нейтропения
Нейтрофилы являются главными защитными клетками против бактериальной и грибковой инфекции. Их продолжительная персистенция и пополнение в тканях являются необходимыми для поддержания асептического статуса. В отличие от других клеток крови, предшественники нейтрофилов проводят большую часть своей жизни (15 дней) в костном мозге. Нормальный гранулопоэз поддерживает клетки в крови и тканевых компартментах, которые быстро обновляются. Нейтрофилы в крови и ткани, следовательно, чувствительны к быстрому угнетению, если резервный пул костного мозга подвергается опасности.
Лекарства являются наиболее частой причиной нейтропении
Самая распространенная причина возникновения нейтропении — миелосупрессия, индуцированная противоопухолевой химиотерапией, хотя многие часто назначаемые препараты также могут вызывать нейтропению. Другими причинами могут быть врожденные, аутоиммунные и инфекционные нарушения (табл. 10.3). Пролиферация и созревание миелоидных клеток-предшественников частично регулируются специфическими гемопоэтическими факторами роста, называемыми колониестимулирующими факторами.
Гранулой, и тарный колониестимулирующий фактор и гранулоцитарно-макрофагальный колониестимулирующий фактор Г-КСФ и ГМ-КСФ являются широко используемыми средствами клеточной терапии. Они были впервые выделены из линий человеческих клеток, и сейчас их производят с помощью рекомбинантной технологии. Г-КСФ и ГМ-КСФ стимулируют дифференцировку и пролиферацию разнообразных миелоидных клеток-предшественников посредством активации их специфических рецепторов в клеточной мембране этих клеток. Как и эритропоэтиновые рецепторы, рецепторы Г-КСФ и ГМ-КСФ относят к семейству цитокиновых рецепторов типа I, которые используют JAK/STAT и другие сигнальные пути тирозиновых протеинкиназ, чтобы преобразовывать клеточные ответы.
Рис. 10.7 Стимуляция синтеза эритропоэтина при гипоксии. Низкое парциальное давление кислорода в крови, поступающей в перитубулярные клетки почек, индуцирует образование этими клетками эритропоэтина. Эритропоэтин стимулирует образование эритроцитов в костном мозге. Печень также продуцирует небольшое количество эритропоэтина, который определяется у больных, не имеющих одной почки.
Таблица 10.3 Причины нейтропении
- Миелосупрессивная химиотерапия
- Анальгетики и противовоспалительные препараты
- Антимикробные средства: сульфонамиды, полусинтетические пенициллины, хлорамфеникол, цефалоспорины
- Антипсихотические препараты
- Противоэпилептические средства
- Антагонисты Н2-рецепторов
- Аутоиммунные нарушения: системная красная волчанка, ревматоидный артрит
- Вирусы: иммунодефицита человека, Эпштейна-Барр
Несмотря на то что специфическая физиологическая роль Г-КСФ и ГМ-КСФ в регуляции нормального миелопоэза до сих пор до конца не ясна, оба фактора эффективно стимулируют продукцию нейтрофилов, когда назначены экзогенно. Г-КСФ и ГМ-КСФ также стимулируют функциональную чувствительность зрелых нейтрофилов к медиаторам воспаления и укрепляют нейтрофил-зависимые защитные механизмы посредством улучшения функции нейтрофилов. Г-КСФ работает только на гемопоэтических клетках, которые станут нейтрофилами, т.е. этот фактор более специфичен, чем ГМ-КСФ. Последний также стимулирует развитие макрофагов. Когда Г-КСФ и ГМ-КСФ вводят внутривенно или подкожно, количество нейтрофилов обычно возрастает через 24 час. Когда поступление препарата заканчивается, количество нейтрофилов снижается на 50% через 24 час и возвращается к начальному количеству через 1-7 дней. Ответная реакция снижена у пациентов, активно подвергавшихся лучевой или химиотерапии, поскольку количество клеток-предшественников у них снижено.
Лечение Г-КСФ переносится лучше, чем лечение ГМ-КСФ. Несмотря на то что назначение обоих препаратов может вызвать боль в костях, ГМ-КСФ может также вызывать синдром недостаточности легочных капилляров с отеком легких и сердечной недостаточностью. Лечение ГМ-КСФ, в отличие от Г-КСФ, может также вызывать конституциональные симптомы, включая лихорадку, головную боль и недомогание.
Пегфилграстим является ковалентным конъюгатом рекомбинантного метионила Г-КСФ и моно-метоксиполиэтиленгликоля. Он работает так же, как и другие КСФ, активируя пролиферацию, дифференцировку и контроль разнообразных гемопоэтических клеток, но имеет преимущество — очень долгий период полувыведения в плазме (15-80 час). Препарат используют для лечения вызванного химиотерапией угнетения костного мозга, в основном для коррекции нейтропении. Главными побочными эффектами такой терапии являются тошнота, утомляемость, нейтропеническая лихорадка и общая слабость.
Мегакариоцитарный фактор роста и тромбоцитопения
Тромбоцитопения — это состояние, характеризующееся снижением числа тромбоцитов, циркулирующих в крови, до уровня менее 150 000/мм3. Тромбоциты играют ключевую роль в нескольких механизмах гемостаза, включая свертываемость крови, заживление ран, а также в хранении и высвобождении цитокинов. Пациенты при тяжелой тромбоцитопении имеют тенденцию к кровотечениям. Этиология тромбоцитопении сложная. Она может быть связана со следующими механизмами:
- сниженной продукцией костного мозга (например, у пациентов с апластической анемией);
- повышенным уровнем деструкции тромбоцитов в селезенке (например, у пациентов с портальной гипертензией или болезнью Гаучера);
- ускоренной деструкцией тромбоцитов в периферической крови;
- простым разведением у пациентов, подвергнувшихся массивной замене красных клеток крови или заместительной трансфузии;
- как побочный эффект использования многих часто применяемых препаратов.
Опрелвекин (интерлейкин-11)
Опрелвекин, рекомбинантная форма интерлейкина-11, является первым фактором роста, одобренным в США для использования в качестве вторичной профилактики тромбоцитопении у онкологических больных, получающих цитотоксическую терапию. Лечение опрелвекином предотвращает тяжелую тромбоцитопению и снижает необходимость трансфузии тромбоцитов, следующей за миелосупрессивной химиотерапией. Опрелвекин стимулирует продукцию мегакариоцитов и тромбоцитов посредством активации IL-11 рецепторов на клетках-предшественниках тромбоцитов. IL-11 рецепторы принадлежат к семейству цитокиновых рецепторов типа I (см. рис. 10.6) и используют JAK/STAT пути тирозинкиназы, чтобы осуществлять регуляцию пролиферации и дифференцировки тромбоцитов. Кроме того, опрелвекин обладает негемопоэтическими свойствами. Он улучшает заживление желудочно-кишечных повреждений, индуцирует синтез белка, ингибирует синтез жира, продукцию провоспалительных цитокинов, увеличивает продукцию остеокластов и стимулирует нейрогенез. После введения опрелвекин достигает пикового уровня в плазме в течение 3 час и имеет период полувыведения около 7 час. Биодоступность опрелвекина при подкожном введении более чем 80%. Было показано, что клиренс опрелвекина снижается с возрастом. Клиренс опрелвекина у новорожденных и детей на 20-60% больше, чем у подростков и взрослых. У экспериментальных животных опрелвекин элиминируется почками. Тем не менее очень небольшое количество интактного опрелвекина выделяется с мочой, что говорит о его метаболизировании до экскреции.
Наиболее частым побочным эффектом опрелвекина является задержка натрия в почках. Последующее изменение объема циркулирующей крови может привести к сердечно-сосудистым нарушениям (например, изменение артериального давления, аритмия, отеки) и может объяснить связь между использованием этого препарата и умеренным снижением концентрации гемоглобина. Эти побочные эффекты могут быть предотвращены сопутствующим использованием диуретиков, таких как фуросемид, который успешно используют для остановки падения гематокрита, связанного назначением опрелвекина.
Тромбопоэтин
Тромбоциты формируются в костном мозге путем отделения от больших многоядерных клеток, называемых мегакариоцитами, которые, подобно другим гемопоэтическим клеткам, являются производными гемопоэтических стволовых клеток. Тромбопоэтин является основным фактором роста, регулирующим образование тромбоцитов. Это гликопротеин с молекулярной массой 65-85 кДа, представленный во многих клетках, но в большей степени в гепатоцитах. Тромбопоэтин стимулирует образование тромбоцитов в костном мозге посредством активации с-тр1-рецепторов на клетках-предшественниках или тромбоцитах. Тромбопоэтин обладает «склеивающим» эффектом в отношении тромбоцитов (он потенцирует коллаген-индуцированную агрегацию тромбоцитов), c-mpl-рецепторы используют сигнальные пути JAK/STAT, Ras/MAPK и фосфатидилинозитол-3-киназы, чтобы способствовать пролиферации клеток-предшественников мегакариоцитов и их созревание в мегакариоциты. Тромбопоэтин был впервые обнаружен в человеческой моче, а его рекомбинантная форма (PEG-rHuMGDF) получена экспрессией в человеческих клетках. Тромбопоэтин используют в терапии первичной и вторичной тромбоцитопении.
НАРУШЕНИЯ ГЕМОСТАЗА И АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ
Гемостаз
Нормальный гемостаз представляет собой тонкий баланс между свертывающей, противосвертывающей и фибринолитической системами в кровеносных сосудах. Повреждение сосудистой стенки запускает сложный ряд событий, вовлекающих тромбоциты, эндотелиальные клетки и свертывающие белки, который приводит к образованию тромбоцитарно-фибринового сгустка. В то же время физиологические антикоагулянты и фибринолитические системы активируются продуктами коагуляционного каскада, чтобы предотвратить избыточное тромбообразование (т.е. тромбоз).
Тромбоциты играют решающую роль в гемостазе
В норме тромбоциты не взаимодействуют с эндотелием сосудов. Тем не менее, когда клетки эндотелия повреждены, тромбоциты прикрепляются к месту повреждения посредством адгезии гликопротеиновых рецепторов тромбоцитов к субэндотелиальному коллагену. Адгезированные тромбоциты подвергаются активации и дегрануляции, высвобождая несколько веществ, таких как тромбоксан А2, аденозиндифосфат (АДФ), адреналин и серотонин. Эти вещества активируют и привлекают дополнительные тромбоциты к образованию тромбоцитарного тромба. Активированные тромбоциты предоставляют фосфолипидную контактную поверхность для поддержки конгломерата фактора Ха, активированного комплекса (включающего I фактор 1Ха, тромбоцит-связанный фактор VIlla и кальций) и протромбиназного комплекса (включающего фактор Ха, тромбоцит-связанный фактор Va и кальций), которые совместно усиливают образование тромбина. Образованный тромбин активирует дополнительные тромбоциты и запускает каскад коагуляции (см. далее).
Активация тромбоцитов агонистами, такими как АДФ и тромбоксан А2, особенно тромбином, ведет к конформационной активации гликопротеи-нового рецептора Ilb/IIIa на их поверхности. Активированные гликопротеиновые рецепторы Ilb/IIIa обеспечивают функциональное связывание частей фибриногена и других адгезивных молекул, таких как фактор Виллебранда (WF) и фибронектин. Связывание бивалентной молекулы фибриногена с гликопротеиновыми рецепторами Ilb/IIIa на поверхностях соседних тромбоцитов формирует тромбоцитарные агрегаты. Таким образом, активация гликопротеинового рецептора Ilb/IIIa является конечным путем агрегации тромбоцитов согласно агонистическому типу.
Тромбоцитарный сгусток укрепляется фибрином, образованным в результате активации коагуляционного механизма, в котором ключевую роль играет тромбин
В добавление к тромбину, образованному вследствие активации и агрегации тромбоцитов, комплекс тканевый фактор — фактор Vila играет ключевую роль в инициации коагуляционного каскада и образовании тромбина. Тканевый фактор является собственным мембранным гликопротеином клеток, контактирующих с кровью. Он становится доступен только после образования протеаз или повреждения клетки организма. После повреждения сосуда тканевый фактор функционирует как кофактор или рецептор, который в присутствии ионов Са2+ связывается с фактором VII и активирует его до VIla. Этот комплекс активирует фактор X до Ха, который способствует появлению тромбина (Па) из протромбина (II). Тромбин затем расщепляет фибриноген до фибрина, который стабилизирует временный тромбоцитарный сгусток в постоянный (рис. 10.8). Тканевый фактор VIla активирует фактор X косвенно, через активацию фактора IX до IХа. Продолжительная активация фактора X требует комплекса из факторов 1Ха и VIlla (рис. 10.9). Это объясняет тот факт, что дефицит антигемофильных факторов VIII и IX приводит к расстройствам при кровотечении. Другой патогенез образования тромбина из протромбина — так называемая внутренняя система, которая запускается активацией фактора XII вследствие его контакта со свободными поверхностями (см. рис. 10.9).
Рис. 10.8 Роль тромбоцитов в гемостазе. Существуют 3 этапа формирования тромбоцитарно-фибринового тромба. Первый этап — адгезия тромбоцитов: повреждение эндотелиальных клеток приводит к обнажению подлежащего коллагенового матрикса. Тромбоциты адгезируются на поврежденном коллагене после того, как коллагеновый фактор Виллебранда (WF) связывается с гликопротеиновыми рецепторами Ib/IX (GPIb/IX) тромбоцитов. Второй этап, агрегация тромбоцитов, — это активация тромбоцитов местными факторами, такими как тромбоксан А2, тромбин и коллаген. Они привлекают другие тромбоциты, которые агрегируют с гликопротеиновыми рецепторами Ilb/IIIa (GPIIb/llla) тромбоцитов. Третий этап — это соединение тромбоцитарного тромба с тромбоцитами, обеспечивающими фосфолипидную поверхность для каскада реакций активации коагуляции, чтобы активировать тромбин, который расщепляет фибриноген, с образованием фибрина для ретракции начального тромба.
Рис. 10.9 Каскад реакций коагуляции. Инициация коагуляции через тканевые факторы активирует фактор VII, который активирует факторы IX и X. Фактор IX переводит фактор X в фактор Ха. Фактор Ха расщепляет протромбин до тромбина, последний расщепляет фибриноген до фибрина. При взаимодействии с отрицательно заряженными поверхностями фактор XII аутоактивируется в ХИа, тот, в свою очередь, переводит субстрат прекалликреин в калликреин, и в результате фактор IX активирует внутренний путь коагуляции. Факторы в сером прямоугольнике — это гепарин-зависимые факторы (мишени гепарина). Факторы в желтом прямоугольнике являются витамин-К-зависимыми (мишени варфарина). Факторы в зеленом прямоугольнике — мишени активированного протеина С. TFPI — ингибитор пути тканевого фактора.
Кроме превращения фибрина, тромбин активирует фактор XIII, который стабилизирует и перекрещивает молекулы в нерастворимом сгустке фибрина (см. рис. 10.9). Тромбин активирует другие факторы свертывания, усиливая их образование, что вовлекает в тромб больше тромбоцитов и усиливает их агрегацию. Тромбин также является причиной миграции лейкоцитов, регулирует сосудистыи тонус, является сильным активатором миграции и пролиферации гладкомышечных клеток. Центральная роль тромбина в гемостазе и тромбогенезе может стать мишенью для блокирования его активности или предотвращения его образования в терапевтических целях.
Гемостаз тесно связан со специфическими ингибиторами факторов свертывания
Существует три группы физиологических ингибиторов гемостаза в плазме, которые классифицируют в соответствии с механизмами ингибирования. К этим ингибиторам относятся кинины (ингибиторы панкреатического трипсина), серпины (ингибиторы сериновых протеаз) и a2-макроглобулины. Они лимитируют гемостаз и защищают от тромбообразования.
Патогенетический ингибитор тканевого фактора является членом семейства кининов. Сначала он связывает активный фактор Ха, а затем инактивирует тканевый фактор формированием четвертичного комплекса. Назначение гепарина приводит к высвобождению эндотелин-ассоциированного ингибитора тканевого фактора в циркулирующей крови.
Важными членами семейства серпинов являются антитромбин III, протеины С и S. Антитромбин III — главный ингибитор тромбина, факторов Ха и 1Ха. Гепарин как кофактор антитромбина III увеличивает активацию тромбина и фактора Ха. Протеины С и S — основные ингибиторы факторов Va и Villa. Тромбин активирует протеин С связыванием тромбомодулина, который активирует протеин С на поверхности эндотелиальных клеток. Физиологическое соотношение антитромбина III, протеинов С и S важно при оценке риска тромбоза вен у людей с недостаточностью естественных антикоагулянтов (рис. 10.10).
Рис. 10.10 Эндогенные антикоагулянты. Существуют В физиологические антикоагуляционные системы, (а) Тромбомодулин, простимулированный тромбином, активирует протеин С, который со своим кофактором, белком S, ингибирует кофакторы Va и Villa в каскаде реакций коагуляции, (б) Антитромбин III (ATIII), простимулированный гепарином, ингибирует тромбин, фактор Ха и фактор 1Ха. (в) Ингибитор пути тканевого фактора ингибирует тканевый фактор, который является ключевым активатором коагуляционного каскада.
а2-Макроглобулин выступает в роли ингибитора протеаз, таких как плазмин.
Активность фибринолитической системы регуляции гемостаза
Кроме физиологических антикоагулянтов, фибринолитическая система плазмы является основным эндогенным механизмом, который защищает от тромбообразования путем лизиса фибриновых тромбов. Система состоит из плазминогена, плазмина и их соответствующих ингибиторов. Фибринолиз в основном регулируется ферментами тканевого активатора плазминогена. Циркулирующий tPA находится в неактивном состоянии. Внедрившись в сгусток фибрина, он превращает фибрин-связанный плазминоген в плазмин, который разрушает фибриновый тромб. Плазминоген и плазмин регулируются различными ингибиторами, включая ингибиторы активации плазминогена 1, 2 и 3 и а-2-антиплазмин (рис. 10.11).
Рис. 10.11 Фибринолитическая система. Тканевый активатор плазминогена (tPA), связанного фибрином, переводит его в плазмин, который расщепляет фибрин. Физиологическими ингибиторами являются ингибитор активатора плазминогена (PAI-1) и а2-антиплазмин.
Тромбоз
Тромбоз как основная причина смерти или потер трудоспособности является результатом:
- артериальной окклюзии, приводящей к инфаркту миокарда, инсульту или периферической ишемии;
- венозной окклюзии, вызывающей тромбоз глубоких вен и легочную эмболию.
Тромбоз с летальным исходом связан с образованием тромбов в местах повреждения сосудистой стенки артерий или вен вследствие стаза или гиперфункции системы коагуляции. Тромбы могут также заполнять камеры сердца, располагаться на поврежденных сердечных клапанах или появляться вследствие синдрома диссеминированного свертывания.
Повреждение эндотелия — основная причина тромбоза артериальных сосудов
В артериальном русле с высокой скоростью кровотока тромбогенез определяется эндотелиальным повреждением. Артериальные тромбы формируются только пристеночно при определенной патологии сосудов (например, атеросклероз или травма при баллонной ангиопластике либо аутоиммунные васкулиты). Артериальные тромбозы часто связаны с увеличением концентрации гомоцистеина в плазме, что, возможно, является следствием его токсического воздействия на эндотелиальные клетки и повреждением артериальной стенки.
Стаз и гиперкоагуляция — основные причины тромбоза венозных сосудов
При тромбозе вен сосудистая стенка часто остается неповрежденной. Стаз играет доминирующую роль и стимулирует накопление агрегатов тромбоцитов и возникновение нитей фибрина в области замедленного тока крови. Гиперкоагуляция также является важным предрасполагающим фактором. Наиболее изученные и типичные гиперкоагуляционные состояния связаны с наследственной недостаточностью натуральных антикоагулянтов антитромбина III, протеинов С и S. Недавнее открытие относительно часто встречающейся наследственной мутации фактора Va (Лейдена), который более устойчив к инактивации посредством активированного протеина С, существенно увеличило количество пациентов с диагностируемыми гиперкоагуляционными состояниями.
Пожизненная антикоагуляция
Многим пациентам с патологией в виде гиперкоагуляции необходима пожизненная антикоагуляция, если они имеют тромбоз в анамнезе. Кроме того, гиперкоагуляция может быть важным механизмом в патогенезе тромботического диатеза и при таких заболеваниях, как нефротический синдром, травма, ожог или диссеминированная злокачественная опухоль.
Антитромботическая терапия
Существует три основных класса антитромботических средств для артериальных и венозных тромботических расстройств. С того времени, как стала известна ключевая роль тромбоцитов в патогенезе артериальных тромботических расстройств, эти клетки стали мишенью для антитромботических препаратов. Ингибирование тромбоцитарной функции может быть достигнуто ингибированием простагландинсинтазы (чтобы уменьшить синтез тромбоксана A2), ингибированием тромбоцитарной мембраны G-белок-связанных рецепторов и антагонизмом адгезии рецептора тромбоцитов Ib/IX или агрегацией гликопротеиновых рецепторов Ilb/IIIa (рис. 10.12). Известно, что тромбин-активированный фибрин является главным компонентом тромба и что тромбин является самым сильным активатором тромбоцитов, поэтому стратегии антикоагуляции сфокусировались на ингибировании активности тромбина или предотвращении его генерации. Для этого используют непрямые ингибиторы тромбина (оральный кумарин и его дериваты) и прямые ингибиторы (гепарин или низкомолекулярный гепарин, аргатробан, гирудин и его дериваты). Третья группа антитромботических препаратов — тромболитические агенты, которые более активно растворяют тромбы, чем прекращение тромботического процесса антитромбоцитарными агентами или ингибиторами тромбина.
Рис. 10.12 Действие антитромбоцитарных агентов на активацию и агрегацию тромбоцитов. После повреждения сосудов тромбоциты связываются со стенкой сосудов, при этом они активируются, дегранулируются и активируют и привлекают к себе другие тромбоциты. Тромбоцитарные активаторы вызывают изменение конформации тромбоцитарных гликопротеиновых рецепторов Ilb/IIIa (GPIIb/llla), что в итоге стимулирует агрегацию тромбоцитов. Аспирин, антагонисты рецепторов аденозиндифос-фата (АДФ) и антагонисты гликопротеиновых рецепторов Ilb/IIIa блокируют процесс на различных уровнях. ТхА2 — тромбоксан А2; WF — фактор Виллебранда; ПГН2 — простагландин Н2; ПГ12 — простагландин 12; ЦОГ-1 — циклооксигеназа типа I.
Ингибирование продукции тромбоксана А2: аспирин
В надежде помочь своему отцу, который страдал от артрита и неблагоприятных эффектов от лечения салицилатом натрия, немецкий химик Феликс Хоффман из компании Farbenfabriken Friedrich Bayer впервые начал синтезировать дериваты салициловой кислоты в надежде сохранить ее противовоспалительные свойства, уменьшив вредное воздействие на желудок. Эфир ацетата и салициловой кислоты (ацетилсалициловая кислота) был синтезирован в 1897 г., а в 1899 г. компания Bayer начала массовую продажу этого препарата под названием «аспирин». Спустя столетие аспирин стал наиболее часто употребляемым препаратом в мире, в основном благодаря его способности действовать и как противовоспалительный, и как анальгетический препарат. Однако за последние годы он стал также «золотым стандартом» антитромбоцитарных препаратов, используемых для предотвращения и лечения артериальных тромботических расстройств, таких как стенокардия, инфаркт миокарда и ишемическая болезнь. Аспирин имеет наилучшее сочетание отношения польза-риск и цена-качество при острых коронарных синдромах.
Аспирин предотвращает трансформацию арахидоновой кислоты в простагландин Н2 и, следовательно, уменьшает продукцию тромбоксана А2 ацетилирования остатка серина в ферменте простагландин Н2-синтаза, необратимо инактивируя его (см. рис. 10.12). Из мастоцитов мышей выделено 2 изоформы циклооксигеназы: ЦОГ-1 и ЦОГ-2. ЦОГ-1 входит в структуру большинства видов клеток, а ЦОГ-2 — индуцибельный фермент, который увеличивает выраженность таких клинических проявлений, как воспаление и инфекция. Человеческие тромбоциты экспрессируют только ЦОГ-1. Аспирин — относительно селективный ингибитор ЦОГ-1, с приблизительным ингибированием в 200 раз больше ЦОГ-1, чем ЦОГ-2. Это определяет рациональность использования малых доз аспирина как антитромбоцитарного средства в сравнении с его использованием как противовоспалительного препарата (угнетение ЦОГ-2). Ингибирование ЦОГ-1 и уменьшение синтеза тромбоксана А2 приводит к подавлению агрегации тромбоцитов на период их жизни (7-10 сут) с того момента, как ЦОГ-1 необратимо ацетилируется аспирином и не ресинтезируется тромбоцитами, т.к. у них нет ядра. Однако АДФ, эпинефрин и тромбин все еще могут активировать тромбоциты. Аспирин также блокирует синтез ингибитора тромбоцитов ПГ12 эндотелиальных клеток, но этот эффект лимитируется низкими дозами аспирина и коротким периодом действия в сравнении с синтезом тромбоксана А2 в тромбоцитах. Действие аспирина на функцию тромбоцитов проявляется удлинением времени кровотечения у пациентов, которые его принимают.
Аспирин быстро всасывается из ЖКТ, частично гидролизуется до салицилата при первом прохождении через печень и распространяется по большинству тканей организма. После перорального приема аспирин появляется в сыворотке через 5-30 мин, пик его концентрации наблюдается в течение часа. Эти свойства аспирина описаны более подробно в главе 15. Для того чтобы достичь терапевтического уровня в крови быстро, особенно у пациентов с острым инфарктом миокарда, рекомендуется жевать таблетки аспирина, чтобы ускорить всасывание в ротовой полости. Гемостаз возвращается в норму приблизительно через 36 час после последней дозы, предположительно являясь сроком, когда новые тромбоциты высвобождаются из костного мозга.
Аспирин является краеугольным камнем в терапии нестабильной стенокардии и инфаркта миокарда без зубца Q. Он может уменьшить летальные исходы или площадь инфаркта. Также аспирин служит основой в терапии острого инфаркта миокарда в сочетании с другими способами лечения как на короткий, так и на продолжительный период. Это сокращает случаи повторного инфаркта у 30% пациентов осложнения после инфаркта, инсульт или смерть вследствие этих причин — у 25%. Более того, аспирин, как обнаружилось, является почти таким же эффективным, как и стрептокиназа, в сокращении смертности при остром инфаркте миокарда. Даже такие низкие дозы аспирина, как 80 мг/сут и меньше, могут давать положительный эффект во вторичной профилактике инфаркта и в уменьшении смертности при пост-миокардиальных инфарктах. Аспирин также применяют для предотвращения приступов транзитной ишемии и уменьшения риска инсульта, в том числе его назначают при растущем риске артериального тромбоза, например, у пациентов с коронарной катетеризацией, баллонной ангиопластикой и последующей сосудистой хирургией. Аспирин используют и в сочетании с другими антитромбоцитарными агентами (например, антагонистами АДФ) или антикоагулянтами (гепарином или варфарином). У 10-15% пациентов обнаружена слабая реакция на аспирин, которая развивается в резистентность к данному препарату. Пациенты с устойчивостью к аспирину могут быть уязвимы к повторным приступам сосудистых расстройств.
Аспирин в дозе 325 мг для разжевывания при остром коронарном синдроме используют для быстрого достижения терапевтического уровня в крови, последующие дозы (160-325 мг/сут) следует принимать в течение госпитализации. Теоретически полное ингибирование ЦОГ-1 в тромбоцитах может быть сохранено и при приеме более низких доз (80 мг/сут).
Раздражение ЖКТ является неблагоприятным эффектом аспирина. Шум в ушах и токсичность по отношению к нервной системе отсутствуют при приеме низких доз, используемых в антитромботической терапии. Аспирин, как и другие НПВС, дозозависимо увеличивает риск желудочного кровотечения (см. главу 15) и повышает риск внутримозгового кровоизлияния. В профилактической терапии очень важно определить отношение польза-риск при употреблении аспирина, особенно у пациентов с низким риском сердечно-сосудистых заболеваний. У некоторых пациентов может развиться серьезный бронхоспазм в ответ на аспирин (см. главу 15). Таким пациентам помимо антитромбоцитарных обязательно должны быть назначены альтернативные препараты.
- Аспирин, как правило, не используют во время приступа или применяют намного позднее. Своевременное назначение аспирина может спасти много жизней!
Обратимые ингибиторы ЦОГ: НПВС
НПВС широко используют при различных воспалительных заболеваниях, т.к. препараты ингибируют ЦОГ тромбоцитов и подавляют тромбоксан А2-зависимую агрегацию тромбоцитов (см. главу 15). В отличие от аспирина, некоторые НПВС конкурентно и обратимо ингибируют ЦОГ тромбоцитов. В типичной противовоспалительной дозе НПВС на 70-85% ингибируют ЦОГ, но этого недостаточно, чтобы развился значительный антитромбоцитарный эффект. Некоторые НПВС, включая индобуфен, сульфинпиразон и трифлузал, тестировались в клинических условиях для оценки возможности их применения при различных тромботических состояниях. Например, индобуфен, неселективный ингибитор ЦОГ-1, оказывает терапевтический эффект, подобный эффекту аспирина. При приеме в дозе 200 мг 2 раза в день индобуфен ингибирует сывороточный тромбоксан А2 более чем на 95%. Клинические испытания показывают, что индобуфен эффективен так же, как и аспирин, при предотвращении коронарной окклюзии. Однако ни один из этих ингибиторов ЦОГ, кроме аспирина, в США не используют, т.к. они не имеют весомого преимущества по сравнению с ним. Селективные ингибиторы ЦОГ-2 как противовоспалительные препараты с меньшим вредным воздействием на ЖКТ пришлось изъять, поскольку они увеличивали риск возникновения сердечных приступов — в основном через подавление ПГ12 синтеза.
Антагонисты АДФ-рецепторов: тиклопидин, клопидогрел
Антагонисты АДФ-рецепторов — более современные антитромбоцитарные препараты, которые блокируют АДФ-активированную агрегацию тромбоцитов без воздействия на ЦОГ (см. рис. 10.12). Эти препараты ингибируют связывание фибриногена с гликопротеиновыми рецепторами Ilb/IIIa. Кроме того, тиклопидин участвует в связывании WF с тромбоцитарной мембраной гликопротеиновых рецепторов lb. Тем не менее происходит угнетение адгезии и агрегации тромбоцитов, при этом эффект угнетения агрегации необратим. Антагонисты АДФ-рецепторов оказывают синергетические эффекты при совместном использовании с аспирином или антагонистами гликопротеиновых рецепторов Ilb/IIIa.
Тиклопидин и его аналог клопидогрел являются дериватами тенопуридиновой кислоты и легко растворимы в воде. Тиклопидин быстро и хорошо всасывается в ЖКТ. Пик его концентрации в плазме крови достигается через 2 час после приема одной пероральной дозы в 250 мг, но стойкого эффекта ингибирования можно добиться только при регулярном его применении в течение 4 дней. Стабильные концентрации достигаются через 14-21 день. Период полувыведения тиклопилина составляет 24-36 час после однократного приема и до 96 час после 14 дней курсового приема. Оба препарата активируются в печени и оказывают антитромботический эффект. Тиклопидин экстенсивно метаболизируется и выводится в основном почками. Нарушения в работе почек значительно повышают концентрацию препарата в плазме крови.
Тиклопидин используют для предотвращения повторных инсультов и приступов ишемии, связанных с тромбозом. Клинические испытания показали, что тиклопидин более эффективен, чем аспирин. Тиклопидин также применяют при нестабильной стенокардии и остром коронарном синдроме. Тиклопидин на 46% снижает риск их появления по сравнению с терапией аспирином. Комбинация тиклопидина и аспирина помогает предотвратить тромбозы стента при коронарных вмешательствах. Тиклопидин лучше, чем аспирин, в сочетании с пероральным антикоагулянтом варфарином предотвращает острый тромбоз стента, инфаркт и повторные приступы. Рекомендуемая доза тиклопидина для первого употребления составляет 500 мг перорально, затем по 250 мг 2 раза в день. Ударную (стартовую) дозу назначают за 3 дня до процедур, потому что максимальный эффект тиклопидина достигается через 4 дня. Если пациенту выполняют аортокоронарное стентирование, доза тиклопидина составляет по 250 мг 2 раза в день в течение 2-4 нед в комбинации с аспирином. Тиклопидин неэффективен, если нужен быстрый антитромбо-цитарный эффект, потому что его антитромбоци-тарный эффект появляется только в первые 2 нед приема. Другим редким, но очень серьезным побочным эффектом может стать тромбоцитопеническая пурпура.
Кровотечение может появиться при использовании любого из этих препаратов. Риск кровотечения из ЖКТ может снизиться при использовании тиклопидина и клопидогрела вместо аспирина. В хирургии употребление антагонистов АДФ-рецепторов прекращают за неделю до операции. Редкие побочные эффекты, такие как нейтропения и агранулоцитоз, ограничивают использование тиклопидина у пациентов, которые не переносят аспирин.
Особенности приема антагонистов АДФ-рецепторов
- Для предупреждения нейтропении через 10 дней после начала приема тиклопидина необходимо выполнить анализ крови!
Клопидогрел имеет механизм действия и клинические эффекты, подобные тиклопидину, но отличается минимальным угнетением костного мозга. Рекомендуемая стартовая доза — 200 мг перорально, затем — 75 мг/сут. Такой режим дает стабильное угнетение агрегации тромбоцитов после 3-4 дней лечения. Наиболее частые побочные эффекты: расстройства ЖКТ, кровотечения, сыпь и диарея.
Ингибирование агрегации тромбоцитов: антагонисты гликопротеиновых рецепторов Ilb/IIIa
После стимуляции агрегации тромбоцитов интегрирующие гликопротеиновые рецепторы Ilb/IIIa (GPIIb/IIIa) функционируют как конечное звено патогенеза и, следовательно, играют ключевую роль в тромбоцитарных взаимодействиях и формировании тромба (см. рис. 10.12). Рецепторы GPIIb/IIIa относятся к классу интегративных рецепторов, состоящих из субъединиц a (ocIIb, GPIIb) и Р ((З3, GPIIIa), которые формируют нековалентную связь гетеродимера. Рецептор GPIIIa содержит участок связывания для последовательности трипептида аргинин-глицин-аспарагиновой кислоты (RGD), прикрепления фибриногена, WF, фибронектина и витронектина. Рецептор GPIIb состоит из 4 повторяющихся сегментов, которые связывают ионы кальция и выполняют рецепторную функцию. Нарушение обоих субъединиц приводит к тромбастении Гланцманна — состоянию, при котором не происходит агрегация тромбоцитов. Рецепторы GPIIb/IIIa являются специфичными для тромбоцитов.
Антагонисты рецепторов GPIIb/IIIa блокируют индуцированное связывание фибриногена и других адгезивных факторов. Адгезия и агрегация тромбоцитов ингибируются необратимо. Антагонистов рецепторов GPIIb/IIIa делят на три категории: (1) моноклональные антитела к рецепторам (абциксимаб); (2) содержащие RGD или лизин-глицин-аспарагиновую кислоту (KGD) пептидные антагонисты природного или синтетического происхождения, которые конкурируют с фибриногеном за эти рецепторы (эптифибатид); (3) короткоцепочечные синтетические молекулы (тирофибан). Эти антагонисты рецепторов GPIIb/IIIa являются моноклональными антителами абциксимаба, синтетического пептида эптифибатида и непептидной молекулы тирофибана.
АБЦИКСИМАБ. Абциксимаб — это мышино-человеческие антитела, состоящие из фаб-фрагментов пептидогликановых моноклональных антител к рецепторам GPIIb/IIIa, связанных с фрагментами иммуноглобулина человека. Антитела препятствуют агрегации, блокируя фибриноген, связываясь с рецепторами GPIIb/IIIa. Ингибирование антителами агрегации тромбоцитов приводит к уменьшению образования — тромбина. Антитромбоцитарный эффект антител дозозависимый. Существует связь между процентным соотношением блокируемых рецепторов и ингибированием агрегации тромбоцитов.
Для достижения эффекта более 90% рецепторов должны быть заблокированы. При вторичном применении антител их концентрации в плазме быстро уменьшаются, т.к. тромбоциты связываются с гликопротеиновыми рецепторами Ilb/IIIa. Период их полувыведения в плазме составляет 10-30 мин, но фармакодинамический период полувыведения равен 3 сут.
В клинике антитела являются вспомогательными средствами при чрескожной транслюминальной коронарной ангиопластике и при остром коронарном синдроме. Эти антитела в сочетании с гепарином или аспирином уменьшают риск возникновения ишемии у пациентов с нестабильной стенокардией и инфарктом миокарда без зубца Q. Рекомендуемая доза — 250 мкг/кг, последующие инфузии — 10 мкг/кг/час. После этого функция тромбоцитов медленно возвращается в норму, а антитромбоцитарный эффект персистирует в течение 24-48 час.
Главный побочный эффект антител — кровотечение, особенно при одновременном применении других средств из этой группы. Также антитела могут вызвать тромбоцитопению, которая легко купируется переливанием тромбоцитов и является обратимой после прекращения терапии. Моноклональные антитела также могут быть иммуногенными.
ЭПТИФИБАТИД. Эптифибатид был открыт при исследовании компонентов змеиного яда. Этот протеин состоит из 73 аминокислот, содержит KGD в последовательности, похожей на RGD-последовательность в других GPIIb/Ша-связывающих компонентах. Протеин такого рода был синтезирован искусственно и является дисульфид-связанным циклическим гептапептидом. Применение эптифибатида сходно с применением антител. Рекомендованная доза — 0,2-1,5 мкг/кг/мин для внутривенных инфузий. Период полувыведения 50-60 мин, функция тромбоцитов нормализуется через 2-4 час после инфузии.
ТИРОФИБАН. Тирофибан является непептидным дериватом тирозина, который селективно ингибирует гликопротеиновые рецепторы Ilb/IIIa с минимальным влиянием на avβз-витронектиновые рецепторы. Период полувыведения в плазме 3 час, можно использовать перорально. Агрегация тромбоцитов ингибируется дозозависимо. Рекомендуемая доза в виде сыворотки — 5-10 мкг/мл. Для внутривенных инфузий последующие дозы от 0,05 до 0,1 мкг/мл/мин в течение 16-24 час.
ПЕРОРАЛЬНЫЕ АНТАГОНИСТЫ ГЛИКОПРОТЕИНОВЫХ РЕЦЕПТОРОВ Ilb/IIIa. Всего было синтезировано около 10 антагонистов рецепторов GPIIb/IIIa. Эти препараты назначают в основном пациентам с хроническими заболеваниями, т.к. клиническая эффективность препаратов до сих пор не установлена; возможен риск сердечно-сосудистых заболеваний.
ДИПИРИДАЛЛОЛ. Дипиридамол — это вазодилата-тор, механизм действия которого связан с регуляцией внутриклеточных уровней цАМФ за счет ингибирования фосфодиэстеразы. Дипиридамол оказывает также антиагрегационный эффект, т.к. ингибирует синтез тромбоксана А2 и потенцирует эффект ПГЕ2, уменьшая адгезию тромбоцитов. Дипиридамол также блокирует выброс аденозина в эритроцитах и увеличивает уровень аденозина в плазме, что приводит к сосудорасширяющему и антитромбоцитарно-му эффектам. Клиническая эффективность дипиридамола, даже в сочетании с аспирином, является предметом дискуссии. Монотерапия дипиридамолом в дозе 400 мг/сут или сочетание этого препарата с аспирином уменьшает риск развития сердечного приступа (16 и 37% соответственно). Кроме того, дипиридамол в комбинации с варфарином эффективно предупреждает сердечную эмболию.
АНАГРЕЛИД. Увеличение количества тромбоцитов в связи с такими миелопролиферативными заболеваниями, как естественный тромбоцитоз, впоследствии может привести к тромбозу (по сравнению с относительно доброкачественными реактивными тромбоцитозами). Традиционное лечение этих расстройств заключается в использовании неспецифических химиотерапевтических агентов. Анагрелид, как и квинозолин, является высокоселективным препаратом, отрицательно действует на мегакарио-циты и таким образом уменьшает количество тромбоцитов. В долговременном исследовании анагрелида не было обнаружено лейкемогенного эффекта, поэтому при тромбоцитемии препарат является препаратом выбора.
Ингибирование факторов образования тромба: варфарин
Открытие антикоагуляционных эффектов кумарина в 1940 г. привело к созданию синтетических дериватов, например варфарина. Он является широко распространенным антикоагулянтом, который действует на витамин-К-зависимый синтез факторов свертывания II, VII, IX, X и кофакторов (протеинов С и S) в печени. Посттрансляционное ферментативное карбоксилирование остатков глутаминовой кислоты в этих факторах коагуляции в у-карбоксиглутаминовую кислоту требует витамина К как кофактора. Присутствие ионов кальция, остатков у-карбоксиглутамила позволяет факторам свертывания претерпевать конформационные изменения, необходимые для их биологической активации. Варфарин ингибирует эпоксиредуктазу витамина К, что приводит к уменьшению его синтеза и уменьшению у-карбоксилирования (рис. 10.13), таким образом, косвенно влияя на функцию факторов свертывания. Антикоагулянтный эффект варфарина проявляется только после исчезновения существующих у-карбоксилированных факторов.
Рис. 10.13 Витамин-К-зависимый синтез факторов свертывания крови. Варфарин ингибирует образование редуцированной формы витамина К, который требуется для у-карбоксилирования глутаминовой кислоты в факторах II, VII, IX, X и протеинов С и S.
Протромбин (фактор II) имеет наибольший период полувыведения, равный 60 час. Тем не менее для максимального антитромботического эффекта с использованием варфарина требуется ежедневное назначение в течение 5 сут. Этот способ рационален при лечении тромбоцитарных расстройств в сочетании с гепарином, даже если международное нормализованное отношение (МНО) достигает терапевтического уровня до истечения 5 сут. Варфарин эффективен для:
- предотвращения и лечения тромбоэмболии вен и легочной эмболии (см. главу 13);
- предотвращения сердечных приступов, вызванных тромбозом и эмболией, а также повторного инфаркта у пациентов сразу после острого инфаркта миокарда.
Пациентам со склерозом сердечных клапанов необходимо назначение антикоагулянтов. Комбинированная терапия варфарином и низкими дозами аспирина более эффективна, чем лечение одним варфарином. Большинство пациентов с фибрилляцией предсердий должны пожизненно принимать варфарин (табл. 10.4).
Лечение варфарином начинают с малых доз (5-10 мг/сут) в течение недели, что позволяет увеличить протромбиновое время, которое должно сохраняться в пределах 20-25% от нормальной активности при долговременном приеме варфарина. В современных исследованиях используют стандартный коагуляционный тест для определения протромбинового времени, названный международным нормализованным отношением. При терапии с использованием варфарина возможно достижение одного из двух обычных целевых уровней МНО — среднего (2,0-3,0) и высокого (2,5-3,5). Высокий уровень МНО увеличивает риск кровотечений, а более низкий уровень (2-2,5) говорит об эффективности предотвращения и лечения большинства венозных и артериальных тромботических осложнений.
Таблица 10.4 Показания для применения комбинированной терапии оральными антикоагулянтами и варфарином
- Механические протезы сердечных клапанов
- Фибрилляция предсердий
- Лечение венозной тромбоэмболии
- Постинфарктное состояние
- Предотвращение венозной тромбоэмболии
- Эпизодическая системная эмболия
Варфарин хорошо всасывается из полости рта и характеризуется отличной биодоступностью, активно связывается с протеинами плазмы крови (на 99% с альбумином), обладает небольшим объемом распределения и длительным периодом полувыведения (30-40 час) и выделяется с мочой в измененном состоянии. Препарат метаболизируется в печени за счет микросомального окисления цитохромами Cs и As, и только неактивные метаболиты появляются в моче и фекалиях.
Многие клинические состояния и влияние других препаратов потенцируют снижение антикоагуляционного эффекта варфарина (табл. 10.5). Колебание уровня витамина К в диете может оказаться важным фактором для пациентов, проходящих долговременный курс лечения варфарином.
|
Таблица 10.5 Препараты и условия взаимодействия с варфарином | |
|
Препараты |
Активность варфарина |
|
Антибиотики |
+ |
|
Амиодарон |
+ |
|
Циметидин |
+ |
|
Клофибрат |
+ |
|
Флуконазол |
+ |
|
Метронидазол |
+ |
|
Фенитоин |
+ |
|
Барбитураты |
- |
|
Карбамазепин |
- |
|
Гризеофульвин |
- |
|
Нафциллин |
- |
|
Рифампицин |
- |
|
Сукральфат |
- |
|
Возраст |
+ |
|
Болезни печени |
+ |
|
Застойная сердечная недостаточность |
+ |
|
Гипертиреоз |
+ |
|
Гипотиреоз |
- |
|
Нефротический синдром |
- |
Главный побочный эффект варфарина — кровотечение, риск его появления связан с интенсивностью лечения и сопутствующим употреблением антитромбоцитарных препаратов, таких как аспирин. Риск кровотечения уменьшается при снижении МНО с 3,0-4,5 до 2,0-3,0. Наиболее серьезный побочный эффект — некроз кожных покровов, вызванный обширным тромбозом микроциркулятор-ного русла подкожной жировой клетчатки. Очевидно, этот феномен связан с недостаточностью протеинов С и S. Тенденция к тромбообразованию может быть временным прокоагулянтным состоянием в течение начального периода лечения варфарином, которое объясняется тем, что данные протеины имеют более короткий период полувыведения, чем протромбин. Падение уровней протеинов С и S появляется до снижения уровня протромбина. Можно избежать некроза кожи, используя терапевтические дозы гепарина в начальном периоде лечения варфарином.
Варфарин попадает в плаценту и обладает тератогенным действием, поэтому противопоказан во время беременности. Лечение стандартными или низкомолекулярными гепаринами (НМГ) обеспечивает сохранность плода во время беременности.
Антикоагуляционные эффекты варфарина могут быть частично обратимы низкими дозами витамина К, который способствует появлению резистентности к варфарину, особенно в больших дозах. Свежая замороженная плазма или концентрированный протромбиновый комплекс могут вызвать обратное действие варфарина, если таковое потребуется при сильном, продолжительном кровотечении.
- Для достижения эффекта терапию варфарином проводят по меньшей мере 4-5 дней, даже если МНО достигает терапевтического уровня через 1-2 дня
- Варфарин обладает тератогенным эффектом и может стать причиной патологии нервной системы плода или кровотечения. Беременные, склонные к тромбозам, должны получать лечение стандартным или низкомолекулярным гепарином
Непрямое ингибирование активности тромбина: стандартный гепарин и низкомолекулярные гепарины
Гепарин представляет собой гликозаминогликановые цепи чередующихся остатков D-глюкозамина и уроновой кислоты. Стандартный нефракционированный гепарин (НФГ) — гетерогенный препарат с молекулярной массой от 5000 до 30 000 кДа. Антикоагуляционная активность гепарина различна, т.к. длина молекулярной цепи влияет на его активность и клиренс. Молекулы большей молекулярной массы восстанавливают циркуляцию быстрее. Тем не менее некоторые НМГ более активны в отношении фактора Ха, чем в отношении тромбина.
Главный антикоагуляционный эффект гепарина обусловлен связыванием с антитромбином III, в результате чего изменяется конформация антитромбина III и ускоряется ингибирование тромбина, факторов Ха и 1Ха. Антитромбин III — это a-глобулин, который ингибирует сериновые протеазы, включая несколько факторов тромбообразования, связывая остатки серина с реакционным центром факторов свертывания, что приводит к их инактивации. Гепарин в качестве каталитического агента участвует в ускорении инактивации тромбина антитромбином III, действуя как матрица, к которой присоединяются оба элемента, чтобы сформировать третичный комплекс. Однако инактивация антитромбином III фактора Ха не требует образования этого комплекса. НМГ, содержащие менее 18 полисахаридных цепей, не могут служить матрицей для инактивации тромбина антитромбином III, но сохраняют способность инактивировать фактор Ха (рис. 10.14). Но ингибирование тромбообразования гепарином не является полным, т.к. оно не способно инактивировать фактор активации тромбоцитов и фибрин-связанный тромбин, которые сохраняют ферментативную активность. Это, по крайней мере, частично предрасполагает к устойчивости артериального тромбообразования, несмотря на применение гепарина.
Рис. 10.14 Антикоагуляционный механизм гепарина. Связывание гепарина с антитромбином III (ATIII) значительно облегчает ингибирование тромбина. Однако при этом требуются молекулы гепарина с полисахаридными остатками более 18. Ингибирование 321 фактора Ха не зависит от размера гепариновых молекул.
Гепарин плохо всасывается в полости рта, назначается обычно подкожно или внутривенно, чаще внутривенно в виде сыворотки, способствующей быстрой антикоагуляции и сохранению этого состояния благодаря последующим инфузиям. Подкожные введения 2 или 3 раза в день в равной степени эффективны. Однако, если требуется немедленная антикоагуляция, внутривенное введение предпочтительнее, т.к. под кожей гепарин задерживается на 1-2 час. Применение гепарина требует постоянного лабораторного контроля. Дозу гепарина необходимо титровать, чтобы достичь уровня активированного частичного тромбопластинового времени в 1,5-2,5 раза больше нормального.
Гепарин крайне сложно высвобождается и связывается эндотелиальными клетками и различными белками плазмы, такими как липопротеин, фибронектин, 4-й тромбоцитарный фактор и фактор Виллебранда. Эти взаимодействия предрасполагают к снижению биодоступности при низких его концентрациях и ограничивают взаимодействие гепарина с антитромбином III. Более того, изменение уровней гепарин-связанных единиц в плазме у пациентов с тромботическими расстройствами приводит к непредсказуемым антикоагуляционным реакциям и требует иногда очень высоких доз гепарина.
Фармакокинетические свойства гепарина сложны. Он прикрепляется к рецепторам макрофагов, клеткам тканей ретикулоэндотелиальной системы, после чего быстро деградирует. Гепарин имеет более длинный период полувыведения у пациентов с серьезными заболеваниями печени. Однако такой механизм сатурации дает кинетику нулевого порядка. Гепарин также медленно утилизируется почками, особенно при первом прохождении. В результате период полувыведения гепарина зависит от его дозы. При внутривенном введении гепарина в дозе 25 ЕД/кг период полувыведения равен 30 мин, но он увеличивается до 60 мин при 100 ЕД/кг и до 150 мин при 400 ЕД/кг.
Гепарин эффективен в случаях:
- предотвращения тромбоза вен;
- лечения тромбоэмболии глубоких вен и легочной эмболии (см. главу 14);
- раннего лечения нестабильной стенокардии и острого инфаркта миокарда;
- предотвращения тромбообразования при катетеризации сосудов;
- антикоагуляционного экстракорпорального лечения, кардиохирургических вмешательств, гемодиализа;
- лечения артериального тромбоза при остром инфаркте миокарда в сочетании с антитромбоцитарными агентами.
Терапевтический спектр применения гепарина достаточно узок, а кровотечение является основным осложнением. Естественно, кровотечения появляются чаще при увеличении дозы гепарина. С того момента, как стали получать гепарин животного происхождения (свиной и крупного рогатого скота), он становится причиной гиперсенсибилизации, проявляющейся лихорадкой, ознобом и даже анафилактическим шоком. Не очень частым, но серьезным осложнением является гепарин-индуцированная тромбоцитопения. Количество тромбоцитов у пациентов, принимающих гепарин, нужно постоянно контролировать, чтобы при подозрении на тромбоцитопению отказаться от его использования, поскольку возможны протромботические расстройства. Долговременная гепариновая терапия также может вызвать остеопороз и повышение уровня некоторых ферментов в печени.
Гепарин противопоказан пациентам, которые: (1) обладают гиперчувствительностью к нему; (2) имеют нарушения свертываемости крови; (3) страдают гипертензией или почечно/печеночными заболеваниями и алкоголизмом; (4) перенесли операцию на головном мозге или глазах.
Гепарин-индуцированное кровотечение можно быстро остановить назначением 1 мг протамина на 100 ЕД гепарина. Протамин, специфический антагонист гепарина, связывается с ним, образуя стабильный комплекс, который теряет антикоагуляционную активность. Следует избегать передозировки протамина, т.к. он тоже является антикоагулянтом. Протамин нейтрализует НМГ не до конца.
Побочные эффекты гепарина
- Кровотечение
- Тромбоцитопения
- Парадоксальный тромбоз
- Остеопороз
- Гиперчувствительность
Низкомолекулярный гепарин: эноксапарин
Нефракционированный гепарин обычно получают из слизистой кишечника или бычьего легкого. В результате этой экстракции полисахариды деградируют в гетерогенную смесь с молекулярной массой от 300 до 30 000 кДа. Все нефракционированные гепарины должны быть стандартизированы.
НМГ получают путем фракционирования, химического гидролиза, деполимеризации. Коммерческие препараты имеют среднюю молекулярную массу 5000 кДа, т.е. от 1000 до 10 000 кДа. Следует заметить, что НМГ, продуцированные различными способами, имеют индивидуальные фармакокинетические и фармакодинамические характеристики и не всегда бывают взаимозаменяемы. По механизму действия антикоагуляционные эффекты НМГ отличаются от эффектов обычного гепарина, потому что:
- соотношение антитромбина к антифактору Ха уменьшается с 1 : 1 до 1 : 4;
- фармакокинетические свойства имеют заметную межвидовую вариабельность по крайней мере в отношении связывания с протеинами;
- снижается взаимодействие с тромбоцитами по сравнению с гепарином.
НМГ имеют некоторые преимущества перед гепарином. При подкожном введении НМГ достигает максимального уровня в плазме через 2-3 час, а период полувыведения составляет около 4 час (т.е. в 2 раза больше, чем у стандартного гепарина). При таком введении биодоступность НМГ составляет 90%, а гепарина — 20%. НМГ имеют более предсказуемый ответ на введение, что говорит об отсутствии необходимости постоянного мониторинга. НМГ эффективны так же, как и обычный гепарин, при предотвращении и лечении тромбоза вен, но гораздо реже могут давать осложнения в виде кровотечения.
Эноксапарин натрия был первым НМГ, одобренным в США для предотвращения тромбоза глубоких вен после операций на бедре. Более того, эноксапарин был одобрен как средство для ежедневного стационарного или амбулаторного применения. Эноксапарин сравнивался со стандартным гепарином при лечении острой коронарной недостаточности, включая нестабильную стенокардию и острый инфаркт миокарда. Исследования показали, что эноксапарин эффективнее гепарина при остром инфаркте миокарда. Дозировка эноксапарина при лечении тромбоза глубоких вен или легочной эмболии составляет 30 мг подкожно 2 раза в день в течение 6 сут или больше в зависимости от клинической ситуации. Побочные эффекты: кровотечения, тромбоцитопения и местное раздражение.
Период полувыведения в сыворотке крови другого НМГ (ревипарина) составляет 3,3 час.
Прямое ингибирование активности тромбина: гирудин (лепирудин)
Тромбогенные эффекты тромбина играют центральную роль в мультифакторном патогенезе тромботических расстройств. Инактивация этого фермента или прекращение его образования может ингибировать тромбин-индуцированный тромбоз.
Гирудин — протеин (7 кДа), состоящий из 65 аминокислот. Этот протеин выделяют из слюнных желез медицинской пиявки, он является специфическим антагонистом тромбина. Рекомбинантный аналог гирудина, лепирудин, выделенный из дрожжевых клеток, также разрешен к применению. Лепирудин и его аналоги являются сильными прямыми ингибиторами тромбина. В отличие от гепарина (которому требуется антитромбин III для ингибирования тромбина), лепирудин сразу действует на тромбин. Теоретически прямое ингибирование тромбина безопаснее, т.к. оно не влияет на функцию тромбоцитов. Более того, оно не вызывает тромбоцитопению.
Лепирудин используют при тромботических осложнениях, связанных с гепарин-индуцированной тромбоцитопенией типа II. Она встречается редко и похожа на побочную аллергическую реакцию гепарина, вызывается комплексным иммунным механизмом и характеризуется быстрым и сильным снижением количества тромбоцитов. Это происходит вследствие секвестрации тромбоцитов в сосудистом русле и приводит к увеличению риска возникновения тромбоэмболических осложнений, результатом которых может стать частичная нетрудоспособность, ампутация и даже смерть. Лепирудин позволяет пациентам с гепарин-индуцированной тромбоцитопенией типа II продолжать антитромботическую терапию для профилактики тромбоэмболических осложнений. Лепирудин уменьшает смертность от острого инфаркта миокарда и необходимость операции на сердце у пациентов с нестабильной стенокардией. Рекомендуемая доза при гепарин-индуцированной тромбоцитопении II — 0,4 мг/кг/час для медленного внутривенного введения (при массе тела до 110 кг). При продолжительной внутривенной терапии (2-10 сут) доза — 0,15 мг/кг/час (при массе тела до 110 кг). Период полувыведения лепирудина равен 1 час, т.к. он быстро гидролизуется. Неизмененный препарат и его фрагменты выводятся с мочой, но кумулируются при почечной недостаточности.
Главный побочный эффект лепирудина — кровотечение, которое может обостриться из-за сопутствующей антитромботической терапии. Другие побочные эффекты связаны с изменениями функции печени и кожными реакциями. Постоянное лечение этим препаратом может привести к выработке антител — тромбинового комплекса, который может усилить антитромботический эффект лепирудина.
Бивалирудин — синтетический пептид, состоящий из 20 аминокислотных остатков, который напрямую ингибирует тромбин, специфически связываясь и с катионным, и с анионным центрами свободного и связанного тромбина. Препарат имеет очень короткий период полувыведения и небольшое количество побочных эффектов, таких как боли в спине, тошнота, гипотензия и головные боли.
Ксимелагатран — еще один прямой ингибитор тромбина, являющийся пролекарством мелагатрана. Ксимелагатран легко преобразуется в биологически активный мелагатран в результате гидролиза этил-эфирной связи и восстановления гидроксиамидинового компонента. Затем мелагатран связывается с аргинином тромбина, вызывая обратимое ингибирование, которое проявляется сразу после введения. Период полувыведения в сыворотке —3-5 час, основные побочные эффекты — кровотечение и увеличение активности печеночных ферментов (7% больных).
Аргатробан — прямой ингибитор тромбина, обратимо связывающийся с активным центром тромбина, но не нуждающийся в кофакторе антитромбина III для своего эффекта. Препарат оказывает антикоагуляционное действие ингибированием тромбин-индуцированных реакций, включая образование фибрина, активацию факторов свертывания V, VIII и XIII, протеина С и агрегацию тромбоцитов.
Аргатробан высокоселективен к тромбину с константой ингибирования (Ki) 0,04 мкг/мл. В терапевтических концентрациях он оказывает слабый эффект на сериновые протеазы.
Аргатробан угнетает действие как свободного, так и связанного тромбина. Пациентам, постоянно получающим аргатробан, препарат вводят внутривенно в виде болюса (100 мкг/кг) и далее в дозе 3 мкг/кг/мин при приступе острой ишемии, что обеспечивает безопасную антикоагуляцию в случае острой коронарной недостаточности без риска возникновения кровотечения. Препарат на 54% связывается с протеинами сыворотки крови. Метаболизируется в печени. Единственное заболевание, при котором назначение аргатробана одобрено в США, — гепарин-индуцированная тромбоцитопения, а также иммунные осложнения при гепариновой терапии. Тогда как начальное лечение гепарин-индуцированной тромбоцитопении сводится к тому, чтобы прекратить применение гепарина, пациентам может потребоваться назначение антикоагулянта для предупреждения тромбоэмболии. Рекомендуемая начальная доза аргатробана для взрослых со здоровой печенью — 2 мкг/кг/мин, вводимая продолжительной внутривенной инфузией. Серьезный побочный эффект — кровотечения, которые развиваются в 5% случаев.
Тромболитические средства
В отличие от антикоагуляционной терапии, тромболитические средства активно растворяют тромбы за счет сериновых протеаз, ускоряющих процесс превращения плазминогена в плазмин и гидролиза фибриногена и фибрина, что приводит к растворению тромбов (рис. 10.15). Следовательно, только некоторые тромбоэмболические расстройства лечатся тромболитическими средствами. Однако тромболитические средства могут локально повышать концентрацию тромбина при растворении тромба, приводя к усилению агрегации тромбоцитов и тромбозу. Предотвратить это может комбинированная терапия антитромбоцитарными препаратами, такими как аспирин, или антикоагулянтом гепарином.
Использование тромболитических агентов для растворения тромбов является стандартной терапией при остром инфаркте миокарда. Тромболитики полезны также в начальной стадии лечения острой периферической сосудистой окклюзии, тромбоза глубоких вен и массивной легочной эмболии. Некоторые пациенты с приступами острой ишемии могут получать рекомбинантный тканевый активатор плазминогена в течение 3 час после появления первых симптомов заболевания.
Геморрагии — основной побочный эффект тромболитиков, т.к. они не могут отличить фибрин в тромбе от фибрина гемостатической губки. Тромболитики противопоказаны пациентам с острыми перикардитами, внутренним кровотечением, заживающими ранами и метастазами рака. Одно из осложнений тромболитической терапии при остром инфаркте миокарда — коронарная реокклюзия.
Рис. 10.15 Фибринолитическая система и механизмы действия тромболитических средств. Активаторы плазминогена, используемые в качестве тромболитических агентов, стимулируют переход плазминогена в плазмин, что разрушает фибрин. Показано действие физиологических ингибиторов. PAI-1, -2, -3 — ингибитор активатора плазминогена 1, 2, 3; tPA — тканевый активатор плазминогена; АПСК активатор плазминоген-стрептокиназного комплекса.
В настоящее время в США используют 5 тромболитических средств. Их действие, как прямое, так и непрямое, основано на усилении генерации плазмина из плазминогена (фармакологические и фармакокинетические свойства перечислены в табл. 10.6):
- стрептокиназа выделяется бета-гемолитическими стрептококками группы А и очень антигенна. Она не имеет собственной ферментативной активности. После внутривенной инфузии она образует комплекс с плазминогеном в пропорции 1 : 1, что и активирует превращение плазминогена в плазмин. Этот комплекс растворяет сгустки фибрина, фибриноген и факторы свертывания V и VII;
- активатор плазминоген-стрептокиназного комплекса (АПСК) является предшественником молекулы плазминогена. Он также не имеет ферментативной активности, пока не деацетилизируется. Комплекс имеет в 4 раза больший период полувыведения, чем стрептокиназа; его применяют в виде сыворотки внутривенно. Обладает высокой антигенностью;
- урокиназа получена из клеток почек плода. Она напрямую воздействует на процесс превращения плазминогена в плазмин, отщепляя аргинино-валиновую связь в плазминогене, прямо расщепляя фибрин и фибриноген, при этом не вызывая антигенной стимуляции;
- алтеплаза — рекомбинантный тканевый активатор плазминогена, связывающийся с фибрином сильнее, чем со свободным плазминогеном в сыворотке. Теоретически этот фермент должен уменьшать активность фибринолиза и сокращать риск кровотечения. Однако клинически он также увеличивает литическое состояние системы и тенденцию к кровотечениям;
- ретеплаза — модифицированный рекомбинантный тканевый активатор плазминогена, созданный, чтобы улучшить терапевтические свойства tPA без увеличения риска кровотечений. Это средство в сочетании с алтеплазой приводит к увеличению реперфузии.
|
Таблица 10.6 Фармакологические и фармакокинетические свойства тромболитиков | |||||
|
Препараты |
Стрептоки наза |
АПСК |
Урокиназа |
Рекомбинантный tPA |
Ретеплаза |
|
Источник получения |
Стрептококки |
Мастоциты |
Стрептококки |
Мастоциты |
Мастоциты |
|
Молекулярная масса (кДа) |
47 |
131 |
32-54 |
70 |
55 |
|
Период полувыведения (мин) |
12-18 |
40-60 |
15-20 |
2-6 |
2-4 |
|
Фибринспецифичность |
1 + |
1 + |
2+ |
3+ |
3+ |
|
Доза (внутривенно болюсно в минуту) |
1,5 ME (30-60) |
30 мг (5) |
3 ME (45-90) |
1 5 мг болюс, затем 50 мг/30 мин, затем 35 мг/30 мин |
10 мг болюс, затем 10 мг болюс (30) |
|
Время достижения пика концентрации после инъекции (мин) |
60 или менее |
2-5 |
5-15 |
180 или менее |
30 или менее |
|
Биодоступность через 90 мин (%) |
53-65 |
55-65 |
66 |
81-88 |
86-90 |
|
Сохраненные жизни на 100 применений |
2,5 |
2,5 |
2,5 |
3,5 |
Не оценивалось |
|
Необходимость в немедленном введении гепарина |
Нет |
Нет |
Нет |
Да |
Нет |
|
Антигенная реакция |
Да |
Да |
Нет |
Нет |
Нет |
|
Внутричерепные кровоизлияния (%) |
0,4 |
0,6 |
0,4 |
0,6 |
Не оценивалось |
|
Гипотензия |
Да |
Да |
Нет |
Нет |
Нет |
|
Относительная стоимость одной дозы ($ США) |
300 |
1200 |
2200 |
2300 |
2500 |
|
tPA — тканевый активатор плазминогена; АПСК — активатор плазминоген-стрептокиназного комплекса; ME— миллионов единиц. | |||||
Новые антитромботические стратегии и лекарственные средства
Ограничения использования аспирина и гепарина привели к появлению новых антитромботических средств, в том числе ингибиторов тромбоксана А2 (в т.ч. антагонистов АДФ), антагонистов рецепторов адгезии тромбоцитов (в т.ч. антагонистов GPIb/IX) и ингибиторов образования или активности тромбина. Новые антитромботические стратегии сфокусированы на создании сильных специфических ингибиторов функции тромбоцитов и цепей ферментативных реакций коагуляции. Показания к назначению новых антитромботических средств в настоящее время устанавливаются в процессе ведения определенных заболеваний (табл. 10.7). Они включают препараты, ингибирующие адгезию и агрегацию тромбоцитов; препараты, блокирующие образование и активность тромбина; препараты, усиливающие естественную антикоагуляционную активность или эндогенный фибринолиз.
ИНСУЛЬТ
Инсульт является основной причиной смерти в западных странах, а также важнейшим заболеванием, приводящим к потере трудоспособности на долгие годы. Подходы к лечению инсультов меняются еще с того времени, как стало возможно вмешательство и восполнение неврологических дефицитов у большинства пациентов, которые начинали курс активного лечения сразу после появления первых симптомов. Именно поэтому инсульт необходимо рассматривать в том же контексте, что и острый инфаркт миокарда, чтобы достичь соответствующего эффекта в отделениях экстренной медицинской помощи.
Первоначальный диагноз инсульта чаще всего клинический. Отличие между геморрагическим и ишемическим инсультом должно быть установлено быстро, т.к. лечение по устранению этих процессов различается. Компьютерную томографию и МРТ считают лучшими способами постановки правильного диагноза, даже если клинические проявления кажутся явными. Ишемический инсульт обычно связан с окклюзией артериального мозгового кровотока. Дефицит кислорода при ишемическом инсульте проявляется ранними нарушениями неврологических функций. На этой стадии они обратимы, если мозговое кровообращение удается восстановить. Промежуток времени, соответствующий этому процессу, пока точно не установлен. Но при длительном отсутствии лечения нарушения будут необратимы, в результате произойдет гибель нервных клеток. Тромболитическая терапия подходит многим пациентам с ишемическим инсультом,но противопоказана пациентам с геморрагическим инсультом.
Таблица 10.7 Новые антитромботические стратегии и лекарственные средства
Тромболитическая терапия острого инсульта
Различные клинические исследования продемонстрировали, что тромболитическая терапия уменьшает неврологические нарушения и нетрудоспособность в течение 3-6 мес. Хотя тромболитическая терапия с использованием стрептокиназы и уроки-назы может вызвать внутричерепное кровоизлияние, польза от ее применения превышает этот риск. Более того, у пациентов, начавших лечение уже через 3 час после инсульта, риск развития внутричерепного кровоизлияния меньше. Эти исследования также показали, что неотложная помощь при ишемическом инсульте очень важна. Применение тканевого активатора плазминогена у пациентов с сопутствующими заболеваниями, такими как сахарный диабет и артериальная гипертензия, противопоказано пациентам, принимающим антикоагулянты, имеющим повышенную склонность к тромбообразованию или сниженное общее количество тромбоцитов.
Небольшая польза может быть получена при назначении аспирина на ранних стадиях острого инсульта. Потенциальная польза от применения антикоагулянтов при остром инсульте не установлена. К сожалению, экспериментальные нейропро-тективные средства не показали ожидаемых эффектов в клинических испытаниях.
Профилактика инсульта
Установлено, что аспирин играет важную роль в предотвращении инсульта, особенно у пациентов с приступами транзиторной ишемии или атеросклерозом каротидной зоны. Антикоагуляционная терапия варфарином является наиболее полезной, особенно у пациентов с фибрилляцией предсердий.
КРОВОТЕЧЕНИЯ
Дефект в каком-либо из компонентов механизма нормального гемостаза может привести к кровотечению. Такие дефекты могут быть приобретенными или наследственными и обычно разделены на
4 группы: сосудистые, тромбоцитарные, коагулопатические и фибринолитические (табл. 10.8):
- сосудистые дефекты — приобретенные и наследственные структурные аномалии сосудистой стенки;
- тромбоцитарные дефекты — приобретенные и наследственные аномалии количества или качества тромбоцитов;
- болезнь Виллебранда — наиболее частая наследственная коагулопатия. У больных обычно наблюдаются аномальные кровоподтеки и кровотечения на слизистых оболочках, эпистаксис и мелена, тогда как для гемофилии более характерны кровотечения из мягких тканей и спонтанные гемартрозы;
- приобретенные дефекты факторов свертывания включают заболевания печени, недостаточность
Таблица 10.8 Заболевания, приводящие к кровотечениям
- Наследственные
- Гемофилия А (дефицит фактора VIII)
- Гемофилия В (дефицит фактора IX)
- Болезнь Виллебранда
- Нарушения функции тромбоцитов (тромбастения Гланцманна)
- Приобретенные
- Дефицит витамина К
- Болезни печени
- ДВС-синдром
- Тромбоцитопения (иммунная, инфекционная, селезеночная секвестрация)
- Дисфункция тромбоцитов (уремия) витамина К, увеличение фибринолиза и тромбоцитарные расстройства.
Концентраты факторов свертывания
Для профилактики и терапии у больных гемофилией типа А применяют концентраты фактора свертывания VIII с разными степенями чистоты. С 1985 г. все концентраты фактора VIII использовали для лечения с подавляющими вирус процедурами, поэтому риск передачи вируса СПИДа и гепатита С существенно снизился. Сейчас также доступен рекомбинант фактора VIII, полученный методом генной инженерии из мастоцитов (табл. 10.9). Использование с 1991 г. хорошо очищенного концентрата фактора IX в сочетании с подавляющими вирус процедурами способствовало значительному улучшению лечения гемофилии А и В типов. Существуют концентраты, такие как мороктоког-а (рекомбинантный фактор VIII) и нонаког-а (рекомбинантный фактор IX), которые используют для лечения гемофилии А и гемофилии В соответственно. Побочные эффекты терапии: головная боль, озноб, лихорадка и аллергические реакции.
Образование аллоантител, которые ингибируют факторы VIII или IX, может стать серьезной проблемой при лечении гемофилии. Пациенты с высоким уровнем ингибитора фактора VIII могут лечиться его фрагментами, если антитела не очень сильно реагируют с ними. Другие возможности предполагают использование концентрата фактора IX или рекомбинанта концентрата фактора VIla. Рекомбинант, активирующий фактор VII, также используют как сильное гемостатическое средство.
Таблица 10.9 Концентраты фактора свертывания VIII
Десмопрессин
Инфузия десмопрессина (1-деамино-8-D-аргинин-вазопрессина) — синтетический аналог вазопрессина, приводящий к высвобождению фактора Виллебранда и фактора VIII из участков депонирования (например, тельца Вейбел-Палада в эндотелиальных клетках).
Десмопрессин используют при средней степени дефицита (> 5%) фактора VIII в основном с профилактической целью, перед небольшими хирургическими вмешательствами. Десмопрессин не применяют при острой гемофилии А, потому что при ней не накапливается фактор VIII. Десмопрессин также используют для предотвращения и лечения кровотечений у пациентов с болезнью Виллебранда. Фактор Виллебранда нужен, чтобы стимулировать образование тромбоцитарных сгустков, а также для активации фактора VIII. Пациенты с различными видами болезни Виллебранда могут реагировать на лечение десмопрессином. Пациентам с тяжелым дефицитом фактора Виллебранда необходима трансфузия концентрата фактора VIII средней чистоты. Рекомбинант фактора VIII этим больным не подходит. Десмопрессин следует использовать при предотвращении кровотечений у больных с почечной недостаточностью. Уремия может стать причиной комплексных аномалий гемостаза, проявляющихся частично в увеличении времени кровотечения. Внутривенная трансфузия десмопрессина может нормализовать длительность кровотечения и изменить динамику его развития.
Десмопрессин можно использовать в качестве спрея для носа, для внутривенного и подкожного введения. Действие на организм десмопрессина различно и может уменьшаться после приема нескольких доз в результате истощения фактора VIII. К побочным эффектам десмопрессина относят приливы, головные боли, повышение артериального давления и задержка жидкости.
Витамин К
Витамин К является эссенциальным кофактором синтеза протромбина в печени факторов свертывания II, VII, IX и X, протеинов С и S. Синтез этих факторов требует адекватного поступления витамина К с пищей. Его недостаток или присутствие таких его ингибиторов, как варфарин, приводит к образованию у-некарбоксилированного протромбина, который активируется фактором X только на 1-2% от нормы (см. рис. 10.13).
Этот витамин нужен для обратимости процесса коагуляции и кровотечения, вызванных варфарином. Недостаточность витамина К можно также наблюдать у пациентов с обструкцией желчных путей и заболеваниями печени, а также после длительного лечения пероральными антибиотиками, в результате чего происходит подавление синтеза витамина К кишечной микрофлорой.
|
Название продукта |
Степень чистоты |
|
Рекомбинант |
Рекомбинантный |
|
Моноклэйт-Р |
Высокая |
|
Коэйт-НР |
Средняя |
|
Хумэйт-Р |
Средняя |
|
Хиэйт-С |
Свиной |
Натуральный витамин К, находящийся в зеленых листовых овощах — это витамин Kj (фитонадион). Витамин К2 (менахинон) синтезируется бактериями кишечника. Витамины и К2 являются жирорастворимыми, поэтому для их всасывания в ЖКТ необходимы желчные кислоты. Синтетические витамины К3 (менадиона натрия бисульфит) и К4 (менадиона диацетат) являются водорастворимыми, поэтому их применяют в инъекциях. Однако витамины К3 и К4 редко используют в клинике, т.к. они терапевтически неэффективны (рис. 10.16).
Основная польза витамина К состоит в предотвращении гипопротромбинемии новорожденных. Уровни витамина К у новорожденных могут быть крайне низкими и увеличиваться при неадекватном питании в первые дни жизни. Концентрации факторов свертывания II, VII, IX и X у новорожденных составляют приблизительно 20-50% уровня этих факторов в плазме взрослых, дети постарше имеют даже более низкие концентрации. Количество витамина К предотвращает гипопротромбинемию, понижая концентрации витамин-К-зависимых факторов свертывания, хотя у взрослых такого эффекта не наблюдают. Врачи обычно рекомендуют небольшие дозы витамина К новорожденным в профилактических целях. Излишки витамина могут провоцировать гемолитические анемии, гипербилиру-бинемии и желтухи новорожденных. Новорожденные и дети постарше с врожденной недостаточностью глюкозо-6-фосфат-дегидрогеназы в эритроцитах являются частично чувствительными к витаминам К, включая К1, К2 и K4. K1 — препарат выбора для новорожденных. Он может быть назначен как перорально, так и парентерально. Хотя К3 и К4 не требуют присутствия желчи в ЖКТ, они могут провоцировать интоксикацию у новорожденных и противопоказаны даже в течение последнего триместра беременности. Альтернативой может быть профилактическое назначение витамина K1 матери незадолго до родов.
Аминокапроновая кислота
Аминокапроновая кислота (АКК) действует как гемостатическое средство, ингибируя фибринолитическую систему. Она взаимодействует с лизин-связанными участками на плазминогене, блокируя его связывание с фибрином и таким образом ингибируя превращение плазминогена в плазмин. Используются пероральный и парентеральный пути введения, применяют для остановки кровотечений различного генеза и местоположения, хотя чаще — при кровотечениях мочеполовой системы.
Рекомендованная суточная доза АКК — 6 г в 4 приема при стартовой дозе в 5 г. Внутривенно вводится в течение 30-60 мин. Она быстро всасывается из полости рта и выводится почками. Период полувыведения АКК равен приблизительно 2 час.
Побочные эффекты АКК включают внутрисосудистый тромбоз вследствие ингибирования активатора плазминогена, гипотензию, мышечную слабость, диарею. Антитромболитические агенты могут усиливать тромботический компонент и не должны использоваться.
Апротинин
Апротинин — протеин с массой 6,5 кДа, получаемый из бычьего легкого. Он функционирует как ингибитор нескольких сериновых протеаз, включая тканевый и плазменный калликреины, которые образуют обратимые ферментативно-ингибирующие комплексы. Ингибирование апротинином калликреина приводит к уменьшению образования активированного фактора XII (см. рис. 10.9). Следовательно, апротинин ингибирует инициацию как коагуляции, так и фибринолиза, что связано со взаимодействием клеток крови с инородной поверхностью. Апротинин назначают внутривенно. Его ферментативная активность измеряется в единицах инактивации калликреина (ЕИК). Чтобы ингибировать плазмин, требуется его концентрация в плазме в пределах 125 ЕИК/мл, а чтобы ингибировать калликреин, нужно 300-500 ЕИК/мл.
Апротинин используют в хирургии сердца, особенно при пересадке коронарной артерии, когда контакт крови с искусственными поверхностями в экстракорпоральном оксигенаторе ведет к гиперпротеолитическому и гиперфибринолитическому состоянию вследствие ферментной и механической травмы тромбоцитов. Использование апротинина может уменьшить кровопотери при этих процедурах на 50%.
Наибольший вред, который приносит апротинин, — это реакция гиперчувствительности. Поэтому перед применением полной терапевтической дозы необходимо проведение теста небольшой дозой. К тому же лечение апротинином может вызвать тромбоз вен и артерий. В недавних клинических исследованиях наблюдалось меньшее преобладание инфарктов среди больных, проходивших лечение апротинином.
Местные абсорбирующие гемостатики
Цель использования местных гемостатиков — предотвратить и остановить кровотечение из кровеносных сосудов или слабо кровоточащих ран. Идеальный местный гемостатик должен быстро абсорбироваться, не оказывать раздражающего воздействия и оказывать гемостатический эффект независимо от механизмов тромбообразования. Многие местные гемостатики отвечают этим требованиям, и их используют, накладывая на рану. Наиболее широко используемые местные гемостатики включают тромбин, микронизированный коллаген, абсорбирующую желатиновую кровоостанавливающую губку и окисленную целлюлозу.
ТРОМБИН. Тромбин, выделенный из бычьей сыворотки, используют местно для контроля капиллярного кровотечения в хирургических процедурах и для уменьшения периода кровотечения в местах подкожной инъекции гепарина. Одна порция тромбина представляет собой 1 мл стандартного раствора фибрина, который свертывается в течение 15 сек. Тромбин также можно использовать при местных кровотечениях в полостях носа и рта у больных с болезнью Виллебранда. Однако тромбин никогда не используют для системных инъекций из-за высокого риска генерализованного тромбоза.
МИКРОФИБРИЛЛЯРНЫЙ КОЛЛАГЕНОВЫЙ ГЕМОСТАТИК. Микрофибриллярный коллагеновый гемостатик (выделяют из бычьего коллагена) действует за счет хемотаксиса и активации тромбоцитов, активируя формирование тромба, способен к абсорбции и готовится как сухой, стерильный, фиброзный и безводный продукт. Было обнаружено, что микрофибриллярный коллаген эффективен в качестве местного гемостатика для медленно кровоточащих поверхностей большой площади. Используют в процессе хирургического вмешательства для контролирования капиллярного кровотечения и как дополнительный гемостатик. Он вызывает постоянный клеточный воспалительный ответ и может препятствовать заживлению раны.
АБСОРБИРУЮЩИЙ ЖЕЛАТИН. Абсорбирующий желатин — это простой протеиновый комплекс, изготовленный из животного желатина (не антиген). Существует 3 формы желатина для различных клинических целей, включая абсорбирующую желатиновую губку, абсорбирующую желатиновую пленку и абсорбирующую желатиновую пудру. Желатиновую губку изготавливают как стерильный, абсорбирующий, безводный, основанный на желатине препарат. Используют для контроля капиллярной кровопотери и остановки открытых кровотечений. При имплантации в ткань желатиновая губка абсорбируется полностью в течение 3-5 нед без образования шрама. Когда данную форму желатина используют при ранениях на коже или назальном, ректальном или вагинальном кровотечении, происходит ее полное разжижение в течение 2-5 сут. При лечении гастроинтестинальных кровотечений применяют 1-10 мг желатиновой пудры для проглатывания.
ОКИСЛЕННАЯ ЦЕЛЛЮЛОЗА. Это специфическая лекарственная форма хирургической марли или хлопка, которая способствует тромбообразованию путем физического воздействия и активации нормального механизма тромбообразования. Используют для контролирования капиллярного, венозного и небольшого артериального кровотечения, когда лигатурный и другие методы неактуальны и неэффективны. Также целлюлозу применяют в челюстно-лицевой хирургии. Окисленную целлюлозу не сочетают вместе с тромбином, поскольку ее низкий уровень pH препятствует активации тромбина. Окисленная целлюлоза нетоксична и относительно безвредна, но в ней присутствуют некоторые элементы, препятствующие заживлению раны, а фагоцитоз мешает восстановлению. Более того, окисленную целлюлозу не применяют в качестве постоянного имплантата при переломах из-за препятствия регенерации кости или возможного образования кисты. Используют как стерильные хлопковые тампоны, прокладки или полоски.
Литература
- Colman RW, Hirsh J, Marder VJ, Salzman EW (eds). Hemostasis and Thrombosis: Basic Principles and Clinical Practice, 4th edn. Philadelphia: JB Lippincott; 2000. [An excellent textbook covering all aspects of hemostasis from molecular mechanism to clinical application.]
- Gresle P, Fuster V, Page CP, Vermylen J (eds). The platelet in Health and Disease. Cambridge: Cambridge University Press; 2002. [A comprehensive overview of platelet biology and antiplatelet drugs.]
- Handin RJ, Lux SE, Stossel TP. Blood: principles and practice of haematology. Philadelphia, Pa.: Lippincott Williams & Wilkins 200B.
- Hirsh J, Dalen J, Anderson DR, Poller L, Bussey H, Ansell J, Deykin D. Oral anticoagulants: mechanisms of action, clinical effectiveness, and optimal therapeutic range. Chest 2001; 119: 8S-21S.
- Hirsh J, Warkentin ТЕ, Shaughnessy SG, Anand SS, Halperin JL, Raschke R, Granger C, Ohman EM, Dalen JE. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest 2001; 119: 64S-94S. [The full pharmacology of heparin and heparin-like drugs in the treatment of coagulant pathologies.]
- Patrono C, Coller B, Dalen JE, FitzGerald GA, Fuster V, Gent M, Hirsh J, Roth G. Platelet-active drugs: the relationships among dose, effectiveness, and side effects. Chest 2001; 119: 39S-63S. [The pharmacology of antiplatelet drugs.]
- Provan A, and Gribben J. Molecular haematology. Malden, Mass: Blackwell Pub., 2005. [The molecular biology of drugs used for their effects on coagulation.]
- Provan A. Oxford handbook of clinical haematology. Oxford; New York: Oxford University Press, 2004. [One of the standard textbooks on haematology and the use of drugs for treating haematological conditions.]