Серотонин
Содержание
Серотонин[править | править код]
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Серотонин — биогенный амин, образующийся из аминокислоты триптофана путем ее гидроксилирования и декарбоксилирования. Значительное количество серотонина содержится в энтерохромаффинных клетках кишечника, ЦНС, преимущественно в гипоталамусе и среднем мозге, тромбоцитах, меньшее количество — в лаброцитах, тучных клетках, надпочечниках. Серотонин оказывает влияние на нервную деятельность, вызывает сокращение гладкой мускулатуры кишечника, матки, бронхов, а также сужение сосудов. В основе реакции организма на серотонин лежат центральные, миотропные, ганглионарные, рефлекторные эффекты.[1][2]
Образование. Серотонин (5-гидрокси-триптамин, 5-НТ) синтезируется в энтерохромаффинных клетках эпителия кишечника из L-триптофана. Серотонин образуется также в нервных клетках мезентериального сплетения и в ЦНС, где играет роль медиатора. Тромбоциты не синтезируют серотонин, однако захватывают его и накапливают.
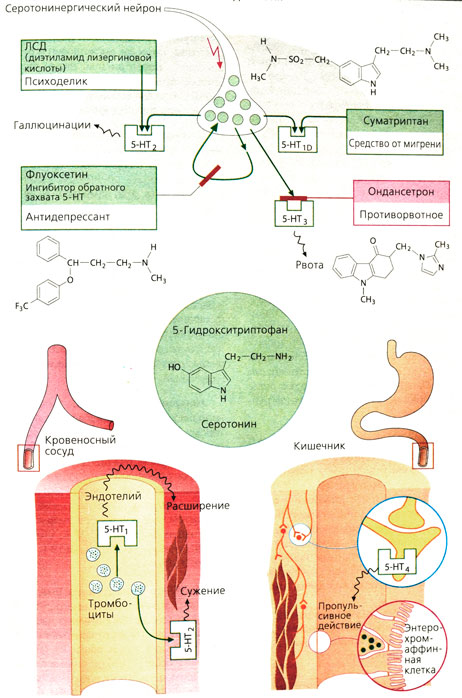
Серотониновые рецепторы. Существует несколько типов рецепторов. С фармакологической точки зрения важное значение имеют рецепторы 5-HT1 и 5-НТ2, а также 5-НТ3 и 5-НТ4. Как правило, рецепторы действуют через G-белок. Рецептор 5-НТ3 представляет собой неселекгивный катионный канал.
Действие серотонина. Сердечно-сосудистая система. Влияние серотонина на сердечно-сосудистую систему является комплексным, так как серотонин оказывает действие (иногда противоположно направленное) во многих участках через разные типы рецепторов. Через 5-НТ2-рецепторы, расположенные в гладких мышцах стенок сосудов, серотонин вызывает сужение сосудов. В то же время непрямое действие серотонина может приводить к расширению сосудов и снижению АД: через 5-НТ1А-рецепторы он блокирует симпатические нейроны ствола мозга и периферии, что приводит к снижению симпатического тонуса; активация 5-HT1 рецепторов в сосудистом эндотелии приводит к выбросу вазодилататоров (простациклин, NO). Серотонин, высвобождающийся из тромбоцитов, играет роль в процессах тромбообразования, гемостаза и в патогенезе гипертонии у беременных.
Суматриптан (средство против мигрени) является агонистом 5-НТ1D и 5-НТ1В-рецепторов. Сужение краниальных сосудов, обусловленное блокадой выброса нейропептидов, приводит к так называемому «нейрогенному воспалению» или же к прямому сосудистому кризу. При этом может возникать чувство стеснения в груди, связанное со спазмом коронарных артерий. Другими «триптанами» являются наратриптан, золмитриптан и ризатриптан.
Желудочно-кишечный тракт. Серотонин, образованный в мезентериальном сплетении или энтерохромаффинных клетках, стимулирует перистальтику и секрецию кишечника посредством влияния на 5-НТ4-рецепторы.
Попытки фармакологического воздействия на моторику кишечника через серотониновые рецепторы пока оказывались малоэффективными. Цизаприд, агонист 5-НТ4, однако, может повышать пропульсивную моторику кишечника. Данный побочный эффект блокируется атропином, что свидетельствует о повышении концентрации ацетилхолина под воздействием цизаприда. Препарат оказывает множество побочных эффектов. Он инактивируется по механизму с участием СУРЗА4, что приводит к различным непредвиденным взаимодействиям с другими веществами. Цизаприд вызывает нарушения (в том числе тяжелые) сердечного ритма (сокращение QT-интервалов), поэтому препарат не нашел применения.
Центральная нервная система. Серотониновые рецепторы играют важную роль в различных функциях ЦНС.
Флуоксетин является антидепрессантом, блокирующим обратный захват серотонина. Он значительно повышает мотивацию, а также понижает аппетит.
Сибутрамин, блокатор обратного нейронального захвата серотонина и норадреналина; применяется как средство лечения ожирения.
Ондансетрон обладает выраженным противорвотным эффектом при рвоте, вызванной применением цитостатиков. Он является антагонистом 5-НТ3-рецепторов. Аналогами ондансетрона являются трописетрон и гранисетрон.
ЛСД и другие психоделики (психотомиметики), такие как мескалин и псилоцибин, вызывают галлюцинации, расстройства сознания, страх, возможно, из-за активации 5-НТ-рецепторов.
Эффекты серотонина[править | править код]
Изменение гена серотонина как способ лечения ожирения[править | править код]
Авторами научной работы, в ходе которой был обнаружен ключевой ген ожирения - разновидность серотонина, стали сотрудники Университета Макмастера. Общеизвестно, что серотонин является «гормоном радости», его выработка мозгом способствует эмоциональной стабильности и хорошему настроению. Но, как поясняют канадские исследователи, серотонин, отвечающий за приятные эмоции, относится к первому типу данного соединения.
«Он разделяется на два типа: по месту действия и по форме синтеза. Первый тип вырабатывается в головном мозге и влияет на разные эмоции», - пояснили биологи.
Ко второму типу, относится периферический серотонин – эта субстанция регулирует активность бурой жировой ткани, от которой зависит развитие тучности.
Бурый жир содержит компоненты, которые способствуют снижению сахара в крови, а также сжиганию калорий и переработки их в энергию. На теле человека есть определенные зоны, где располагается бурый жир – и чем активнее его клетки, тем стройнее фигура у человека. Канадские исследователи пришли к заключению, что подавляя серотонин второго типа, можно значительно повысить метаболическую активность клеток бурой жировой ткани. Она, в свою очередь, заставит тело «сжигать» белый жир – причем, это будет происходить независимо от того, насколько калорийную пищу употребляет человек.[3]
Читайте также[править | править код]
- Серотониновые рецепторы
- Стимуляторы серотониновых рецепторов
- Блокаторы серотониновых рецепторов
- Гормоны голода и насыщения
Серотониновые рецепторы[править | править код]
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Эффекты серотонина чрезвычайно разнообразны. Это вещество служит медиатором в ЦНС, влияет на сократимость гладких мышц сосудов и ЖКТ, участвует в сосудисто-тромбоцитарном гемостазе. Методами молекулярного клонирования было выявлено неожиданно большое количество серотониновых рецепторов, которые на основании структуры и функции можно разделить на 4 типа. 5-НТ1-, 5-НТ2- и 5-НТ4-рецепторы сопряжены с G-белками и через эти белки и соответствующие системы вторых посредников влияют на функции различных ферментов и на элек-трофизиологические свойства эффекторных клеток. Напротив, 5-НТ3-рецепторы связаны с ионными каналами. Здесь мы рассмотрим стимуляторы и блокаторы серотониновых рецепторов. Новейшие препараты этих групп, избирательно действующие на отдельные подтипы серотониновых рецепторов, были получены в работах с использованием рекомбинантных рецепторов. Мы остановимся также на экспериментальных моделях, которые применяют для исследования средств, влияющих на сложные психические функции и их нарушения — навязчивости, агрессивное поведение, тревожность, депрессию, цикл сон—бодрствование и прочие. Современные избирательные стимуляторы отдельных подтипов серотониновых рецепторов уже с успехом применяются при мигрени и тревожности, а избирательные блокаторы — при ряде желудочно-кишечных нарушений. На физиологические эффекты серотонина можно влиять также с помощью средств, действующих на серотонинергическую передачу. Так, ингибиторы обратного захвата серотонина оказались эффективными препаратами для лечения депрессии и тревожности.
Несмотря на то что роль серотонина во многих физиологических и патологических процессах не вызывает сомнения, точки его приложения и механизмы действия изучены плохо. Возможно, такая ситуация отчасти обусловлена многообразием серотониновых рецепторов. Эти рецепторы, выявленные вначале фармакологическими методами, сегодня получены путем клонирования кДНК. Рекомбинантные серотониновые рецепторы используют для изучения молекулярных механизмов действия серотонина, а также для поиска средств, избирательно влияющих на отдельные подтипы этих рецепторов. Круг клинического применения подобных средств становится все шире и шире.
Историческая справка[править | править код]
В 1930-х гг. Эрспамер начал изучать локализацию энтерохромаффиных клеток с помощью красителей на производные индола. Самая высокая концентрация таких производных была выявлена в слизистой ЖКТ; далее шли тромбоциты и некоторые отделы ЦНС (Erspamer, 1966). Спустя некоторое время Пейдж и сотр., работавшие в Кливлендской клинике, впервые выделили сосудосуживающее вещество, высвобождаемое из тромбоцитов в процессе остановки кровотечения, и расшифровали его структуру (Rapport et al., 1948). Это вещество, названное Пейджем серотонином (Page, 1976), оказалось тем самым производным индола, которое исследовал Эрспамер. Описание путей синтеза и распада серотонина (Uden-friend, 1959) и его вазопрессорных свойств (Sjoerdsma, 1959) позволило выдвинуть гипотезу, согласно которой проявления так называемого карциноидного синдрома у больных с опухолями из энтерохромаффиных клеток обусловлены повышенной выработкой этого вещества. Действительно, у таких больных суточная экскреция с мочой серотонина и его метаболитов может достигать сотен миллиграммов. Некоторые симптомы этого заболевания в какой-то степени указывают на механизмы действия серотонина. Так, у больных может развиваться психоз, сходный с возникающим при приеме ЛСД. Учитывая же, что в животных и растительных тканях обнаружены сходные с трипта-мином вещества с галлюциногенным действием, можно предположить, что подобные вещества образуются и вызывают психотическую симптоматику у больных с карциноидным синдромом. Предположение о медиаторной функции серотонина в головном мозге млекопитающих было высказано в середине 1950-х гг. (Brodie and Shore, 1957).
Первые данные о молекулярных механизмах действия серотонина были получены в опытах на печеночной двуустке Fasciola hepatica (Mansour, 1979). Под действием серотонина у нее резко возрастала подвижность и концентрация цАМФ; и тот, и другой эффекты блокировались ЛСД. Повышение подвижности было обусловлено цАМФ-зависимым фосфорилированием фосфофруктокиназы — лимитирующего фермента гликолиза. Однако серотониновые рецепторы, опосредующие эти эффекты у печеночной двуустки, видимо, иные, чем сопряженные с аденилатциклазой серотониновые рецепторы млекопитающих. У последних столь подробных данных о механизмах действия серотонина пока получить не удалось.
Серотонин появился у растений и животных уже на ранних этапах эволюции, и именно этим, возможно, объясняется обилие серотониновых рецепторов (Peroutka and Howell, 1994). Клонирование этих рецепторов показало, что некоторые препараты, ранее считавшиеся избирательными по отношению к отдельным их подтипам, на самом деле обладают высоким сродством по отношению к нескольким подтипам (табл. 11.1). Подробнее об истории изучения и эффектах серотонина см. статью Sjoerdsma and Palfreyman (1990).
Химические свойства серотонина[править | править код]
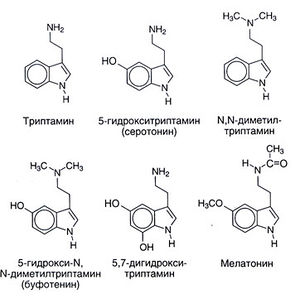
Источники. Химическое строение серотонина и некоторых близких к нему соединений приведено на рис. 11.1. Серотонин широко распространен в растительном и животном мире: он найден у позвоночных, оболочников, моллюсков, членистоногих, кишечнополостных, во фруктах и в орехах. Он обнаруживается также в ядах — в крапиве, у ос и скорпионов. Многочисленные синтетические или природные близкие к серотонину вещества также в той или иной степени обладают центральными и периферическими физиологическими эффектами. Многие N- или О-метилированные индоламины (например, N,N-диметилтриптамин) являются галлюциногенами. Поскольку они могут вырабатываться в организме, их долго считали возможными виновниками по крайней мере некоторых проявлений психозов. Мелатонин (5-метокси-N-ацетилтриптамин) образуется из серотонина путем N-ацетилирования с последующим О-метилированием (рис. 11.2). Это вещество служит главным индоламином шишковидного тела, где его синтез регулируется внешними факторами (в частности, уровнем освещенности). Мелатонин вызывает депигментацию меланоцитов кожи и подавляет функцию яичников. Возможно, он играет определенную роль в биоритмах и поэтому может оказаться полезным при синдроме смены часовых поясов.
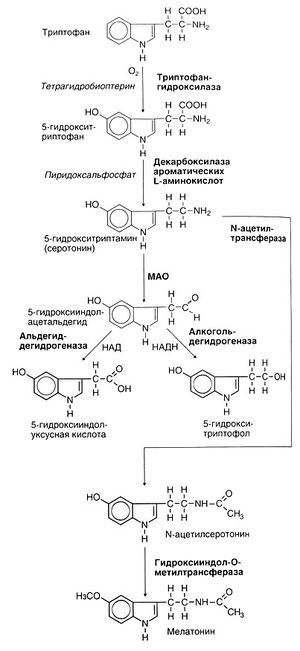
Синтез и катаболизм. Серотонин образуется из незаменимой аминокислоты триптофана в 2 этапа (рис. 11.2). На первом этапе под действием триптофангидроксилазы образуется 5-гидрокситриптофан, это лимитирующая реакция синтеза серотонина. Триптофангидроксилаза представляет собой оксидазу со смешанными функциями. В катализируемой ею реакции принимает участие молекулярный кислород, а в качестве кофермента — тетрагидробиоптерин. Активность триптофангидроксилазы, как и тирозингидроксилазы, регулируется путем фосфорилирования, однако триптофангидроксилаза не ингибируется конечным продуктом по механизму отрицательной обратной связи. В головном мозге триптофангидроксилаза не насыщена субстратом, и поэтому скорость синтеза серотонина зависит от концентрации триптофана. Последний поступает в клетки головного мозга путем активного захвата с помощью переносчика, отвечающего за транспорт нескольких нейтральных и разветвленных аминокислот. В связи с этим содержание триптофана в мозге зависит не только от его концентрации в плазме, но и от концентрации других аминокислот, конкурирующих с триптофаном за переносчик.
Декарбоксилирование 5-гидрокситриптофана приводит к образованию серотонина. Долгий спор о том, являются ли декарбоксилазы 5-гидрокситриптофана и ДОФА разными или одним и тем же ферментом, разрешился методами клонирования кДНК — оказалось, что один и тот же генный продукт отвечает за декарбоксилирование обоих субстратов. Теперь этот фермент называется декарбоксилазой ароматических L-аминокислот. Он чрезвычайно широко распространен и действует на многие субстраты. 5-гидрокситриптофан декарбоксилируется очень быстро и в мозге почти не обнаруживается. В связи с этим попытки повлиять на концентрацию в мозге серотонина путем изменения концентрации 5-гидрокситриптофана обречены на неудачу.
Основной путь катаболизма серотонина — превращение в 5-гидроксииндолуксусную кислоту, также протекающее в 2 этапа (рис. 11.2). Сначала под действием МАО образуется 5-гидро-ксииндолацетальдегид, который затем переходит в 5-гидрокси-индолуксусную кислоту под действием широко распространенного в организме фермента альдегиддегидрогеназы (незначительное количество 5-гидроксииндолацетальдегида превращается в спирт — 5-гидрокситриптофол). 5-гидроксииндолуксусная кислота активно выводится из головного мозга; этот процесс подавляется неспецифическим ингибитором трансэпителиального переноса пробенецидом. Поскольку в нервных клетках на долю 5-гидроксииндолуксусной кислоты приходится почти 100% всех метаболитов серотонина, скорость кругооборота серотонина в головном мозге оценивают по повышению уровня 5-гидроксииндолуксусной кислоты после введения пробенецида. Образующаяся в мозге и других органах 5-гидроксииндолуксусная кислота, а также небольшие количества 5-гидрокситриптофола и глюкуронидов выводятся с мочой. В норме суточная экскреция 5-гидроксииндолуксусной кислоты у взрослого составляет 2—10 мг. Более высокие значения — надежный признак карциноидного синдрома. Резко повышенный синтез серотонина при этом заболевании требует больших количеств пиридиновых нуклеотидов и триптофана, и поэтому признаки дефицита никотиновой кислоты и триптофана не редкость у таких больных. Этанол вызывает повышение содержания НАДН, и в результате 5-гидроксииндолацетальдегид переходит с окислительного пути катаболизма на восстановительный (рис. 11.2).
Это несколько повышает экскрецию 5-гидрокситриптофола и соответственно снижает экскрецию 5-гидроксииндолуксусной кислоты.
Существуют два изофермента МАО — МАО А и МАО В. Сначала их разделяли на основании сродства к субстратам и чувствительности к ингибиторам; в настоящее время оба изофермента клонированы, причем свойства клонированных и естественных форм оказались одинаковыми (Shih, 1991; см. также гл. 10). МАО А обладает преимущественным сродством к серотонину и норадреналину, а ее избирательным ингибитором является клоргилин. МАО В в большей степени действует на β-фенил-этиламин и бензиламин; избирательный ингибитор МАО В — селегилин. Сродство обоих изоферментов к дофамину и триптамину одинаково. В нервных клетках содержатся и МАО А, и МАО В — преимущественно на наружной мембране митохондрий. Основным изоферментом тромбоцитов, в которых также содержится серотонин в высокой концентрации, служит МАО В.
Предполагалось, что существуют и другие пути катаболизма серотонина, например сульфатирование и О- или N-метилирование. Последний путь, в частности, мог бы приводить к образованию эндогенного психотропного вещества — 5-гидрокси-N,N-диметилтриптамина (буфотенина, рис. 11.1). Однако другие метилированные индоламины (N,N-диметилтриптамин, 5-метокси-N,N-диметилтриптамин) обладают гораздо более выраженными галлюциногенными свойствами, и их роль в патогенезе психозов вероятнее.
Инактивация серотонина осуществляется не только путем ферментативного распада, но и посредством обратного захвата. За этот захват отвечает Nа+-зависимый переносчик, расположенный на наружной поверхности пресинаптической мембраны серотонинергического окончания (обеспечивает удаление серотонина из синаптической щели) и наружной поверхности мембраны тромбоцитов (извлекает серотонин из крови). У тромбоцитов это единственный путь пополнения запасов серотонина, так как ферментов синтеза этого вещества в них нет. Переносчик серотонина, как и другие переносчики моноаминов, клонирован (гл. 12).
Точки приложения серотонина[править | править код]
На долю периферических тканей приходится большая часть всего содержания серотонина в организме, хотя он служит также медиатором в ЦНС. Наиболее высока его концентрация в энтерохромаффинных клетках и тромбоцитах. Серотонин играет важнейшую роль в регуляции моторики ЖКТ.
Энтерохромаффинные клетки. Эти клетки располагаются в слизистой ЖКТ. Особенно их много в двенадцатиперстной кишке. В энтерохромаффинных клетках синтезируется из триптофана и накапливается серотонин, а также содержатся другие биологически активные вещества, например вещество Р и кинины. Существует некий уровень базальной секреции серотонина в ЖКТ. Эта секреция усиливается при механическом растяжении (например, при поступлении пищи или гипертонического раствора) и при раздражении двигательных волокон блуждающих нервов. Возможно, стимулирующее действие серотонина на моторику ЖКТ опосредовано также его влиянием на нейроны межмышечного сплетения (Gershon, 1991; см. также гл. 38). Резко повышенная секреция серотонина и других биологически активных веществ при карциноидном синдроме сопровождается соответствующими желудочно-кишечными, сердечнососудистыми и нервными нарушениями. Кроме того, повышенный синтез серотонина может привести к дефициту никотиновой кислоты и триптофана.
Тромбоциты. От остальных форменных элементов крови тромбоциты отличаются, в частности, способностью захватывать, хранить и высвобождать серотонин. Синтез серотонина в тромбоцитах не происходит. Серотонин захватывается тромбоцитами из крови и поступает для хранения в секреторные электроноплотные гранулы посредством активного транспорта. Эти процессы во многом сходны с захватом и запасанием норадреналина в симпатических окончаниях (гл. 6 и 12). Через мембрану тромбоцитов серотонин переносится с помощью Nа+-зависимого транспорта, а в гранулы — путем вторичного активного транспорта с использованием в качестве источника энергии электрохимического градиента для Н+, создаваемого Н+-АТФазой. При этом концентрация серотонина в гранулах достигает 0.6 моль/л — это в 1000 раз выще, чем в цитоплазме тромбоцитов. Скорость На+-зависимого захвата серотонина тромбоцитами _ чувствительный показатель активности ингибиторов захвата серотонина.
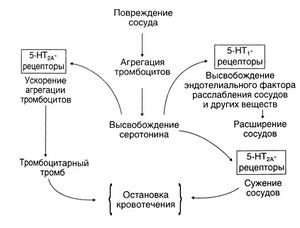
Главная функция тромбоцитов — гемостаз: они закрывают бреши в поврежденном эндотелии. С другой стороны, целость эндотелия играет важнейшую роль в функционировании тромбоцитов (Furchgott and Vanhoutte, 1989). Эндотелий постоянно контактирует с тромбоцитами, так как из-за действующих в текущей крови сил сдвига они смещаются к периферии сосудов (Gibbons and Dzau, 1994). Сосудосуживающему действию серотонина и тромбоксана А2 противостоит эндотелиальный фактор расслабления сосудов (N0 и, возможно, некоторые другие вещества) (Furchgott and Vanhoutte, 1989; рис. 11.4). Для адгезии и агрегации тромбоцитов имеет решающее значение состояние эндотелия (Hawiger, 1992; Ware and Heistad, Л993). Когда тромбоциты соприкасаются с поврежденным эндотелием, они выделяют вещества, вызывающие их адгезию и высвобождение серотонина. К таким веществам относятся АДФ и тромбоксан А2 (гл. 26 и 55). Связывание серотонина с 5-НТ2А-рецепторами оказывает слабое проагрегантное действие, резко усиливающееся в присутствии коллагена. Если дефект сосудистой стенки достигает гладкомышечных слоев, то серотонин оказывает прямой сосудосуживающий эффект, служащий одним из механизмов гемостаза. Этот эффект усиливается под действием выделяющихся в области повреждения биологически активных веществ — тромбоксана А2, кининов, вазоактивных пептидов. Образованию тромбов при атеросклерозе способствует разрушение эндотелия и, как следствие, отсутствие эндотелиального фактора расслабления сосудов. В этих условиях процессы, ведущие к тромбообразованию, протекают бесконтрольно, по типу порочного круга. Определенную роль в них играет и серотонин. Сходная картина может наблюдаться при других болезнях сосудов, например синдроме Рейно и вазоспастической стенокардии.
Описание к рис. 11.4. Функции серотонина тромбоцитов. Высвобождение серотонина из тромбоцитов запускается их адгезией и агрегацией. В свою очередь, серотонин вызывает 1) активацию б-НТ^-рецепторов тромбоцитов и, врезультате, изменение формы и ускорение агрегации последних, 2) активацию 5-НТ,-по-добных рецепторов эндотелия с выделением эндотелиального фактора расслабления сосудов, 3) активацию S-HT^-peuenTO-ров гладких мышц сосудов и сужение последних. Все эти процессы протекают во взаимодействии со многими другими биологически активными веществами и в конечном счете приводят к остановке кровотечения.
Сердечно-сосудистая система. Типичная реакция кровеносных сосудов на серотонин — сужение. Особенно чувствительны к нему сосуды органов ЖКТ, почек, легких и головного мозга. Серотонин вызывает также сокращение гладких мышц бронхов. Его эффекты на сердце разнообразны, что объясняется активацией разных подтипов серотониновых рецепторов, изменением тонуса вегетативных нервов и рефлекторными реакциями (Saxena and Villalon, 1990). Так, прямое положительное хронотропное и инотропное действие серотонина на сердце может быть замаскировано эффектами возбуждения волокон, идущих от барорецепторов и хеморецепторов. Влияние серотонина на афферентные окончания блуждающих нервов вызывает рефлекс Бецольда—Яриша, проявляющийся резкой бради-кардией и падением АД. Иногда артериолы под действием серотонина не сужаются, а, напротив, расширяются в результате выделения эндотелиального фактора расслабления сосудов и простагландинов, а также подавления высвобождения норадреналина из симпатических окончаний. С другой стороны, сам по себе серотонин усиливает сосудосуживающее действие норадреналина, ангиотензина 11 и гистамина. Это способствует еще более эффективному гемостатическому действию серотонина (Gershon, 1991).
ЖКТ. Видимо, основным источником и хранилищем серотонина в организме служат энтерохромаффинные клетки слизистой ЖКТ. Выделяемый этими клетками серотонин поступает через воротную вену в печень, где метаболизируется под действием МАО A (Gillis, 1985). Какое-то количество серотонина минует печеночный метаболизм, но быстро захватывается эндотелием легочных капилляров и также подвергается действию МАО. Серотонин, выделяющийся в стенку органов ЖКТ при их механическом растяжении или возбуждении блуждающих нервов, участвует в местной регуляции этих органов. Под влиянием серотонина моторика желудка и кишечника может как усиливаться, так и тормозиться (Dhasmana et al., 1993), так как в ЖКТ имеются по меньшей мере 6 подтипов серотониновых рецепторов (табл. 11.2). Стимулирующий эффект серотонина обусловлен его действием на окончания нервов, подходящих к продольным и циркулярным мышечным слоям (5-НТ4-рецепторы), на интрамуральные нейроны (5-HTj- и 5-НТ|Р-рецепторы) и непосредственно на гладкие мышцы (5-НТ^-рецепторы в кишечнике и 5-НТ2В-рецепторы в дне желудка). В пищеводе серотонин действует на 5-НТ4-рецепторы, что у разных видов животных может сопровождаться как сокращением, так и расслаблением гладких мышц. 5-НТ3-рецепторы (в изобилии присутствующие на окончаниях чувствительных волокон блуждающих и других нервов, а также на энтерохромаффинных клетках) играют ключевую роль в рвотном рефлексе (Grunberg and Hesketh,1993). В межмышечном сплетении обнаружены серотонинергические окончания. Высвобождение серотонина в кишечнике вызывают ацетилхолин, раздражение симпатических нервов, повышение внутрикишечного давления и снижение pH (Gershon, 1991). Выделяющийся при этом серотонин, в свою очередь, запускает перистальтическое сокращение.
ЦНС. Серотонин влияет на многие функции ЦНС, в том числе сон, познавательную деятельность, восприятие, управление движениями, терморегуляцию, болевую чувствительность, аппетит, половое поведение и эндокринную регуляцию. В головном мозге обнаружены все клонированные серотониновые рецепторы, причем часто в одном и том же отделе присутствуют несколько таких рецепторов. Более того, хотя экспрессия серото-ниновых рецепторов в отдельных нейронах изучена недостаточно, можно полагать, что на одном и том же нейроне могут располагаться несколько подтипов этих рецепторов, причем их активация может сопровождаться как синергичными, так и антагонистическими эффектами. Это может быть причиной необычайного разнообразия влияний серотонина на мозговые функции.
Основная область сосредоточения тел серотонинергических нейронов в ЦНС — это ядра шва ствола мозга. Отростки этих нейронов идут ко всем отделам головного и спинного мозга (гл. 12). Серотонин выделяется не только в пресинаптических окончаниях, но и в так называемых варикозных расширениях аксонов, где четко выраженных синапсов нет (Descarries et al., 1990). В этих случаях он действует сразу на многие прилежащие структуры. Такая особенность выделения и действия серотонина согласуется с распространенной точкой зрения о том, что серотонин — это не только медиатор, но и нейромодулятор (гл. 12).
В окончаниях серотонинергических нейронов имеются все компоненты, необходимые для синтеза серотонина из триптофана (рис. 11.2). Образовавшийся серотонин быстро поступает в синаптические пузырьки, где на него не может подействовать МАО. После высвобождения в синаптическую щель серотонин снова захватывается нервным окончанием с помощью Na -зависимого переносчика. Этот обратный захват служит эффективным способом инактивации медиатора. Те же молекулы серотонина, которые не поступают обратно в нервное окончание, разрушаются расположенной в постсинаптических нейронах и соседних клетках МАО.
Электрофизиологические эффекты. Эти эффекты серотонина различаются в разных областях мозга и в разных нейронах, и зависят от того, на какие рецепторы он действует (табл. 11.3; Aghajanian, 1995). На один и тот же нейрон серотонин может оказывать возбуждающее и тормозное действия, различающиеся по временной динамике. Так, в нейронах гиппокампа серотонин вызывает сначала гиперполяризацию (обусловленную активацией 5-НТ 1А-рецепторов), затем медленную деполяризацию (обусловленную активацией 5-НТ4-рецепторов).
Гиперполяризация и снижение сопротивления мембраны, возникающие при активации 5-НТ)А-рецепторов, вызваны повышением калиевой проницаемости. Эти эффекты блокируются коклюшным токсином, но не зависят от цАМФ. Следовательно, они могут быть обусловлены прямым сопряжением 5-НТ|А-рецепторов (через G-белок, сходный с Gi) с калиевым каналом (Andrade et al., 1986). Активация рецепторов, расположенных на теле и дендритах нейронов ядер шва ствола мозга также приводит к К+-зависимой гиперполяризации. В передаче j сигнала от рецептора к каналу здесь тоже участвует чувствительный к коклюшному токсину G-белок, но калиевый ток имеет иные характеристики, чем тот, который возникает при активации постсинаптических 5-НТ1А-рецепторов в гиппокампе. Пока не известно, посредством каких механизмов активация 5-HT1D-ayTopeuerrropoB приводит к подавлению высвобождения серотонина. Видимо, снижается число открывающихся в ответ на нервный импульс потенциалзависимых кальциевых каналов.
Активация 5-НТ2А-рецепторов сопровождается медленной деполяризацией. В некоторых отделах мозга (например, в префронтальной коре, прилегающем ядре и двигательном ядре лицевого нерва) эта деполяризация обусловлена снижением калиевой проницаемости (Aghajanian et al., 1987). Существует и другой механизм, связанный с влиянием на кальцийзависимые ионные каналы; он приводит к росту возбудимости нейрона и усилению реакции на возбуждающие медиаторы (например, глутамат). Роль фосфоинозитидной системы в этих эффект пока не установлена. В тех случаях, когда на одном и том же нейроне имеются и 5-НТ1-рецепторы и 5-НТ2д-рецепторы, конечная реакция на серотонин зависит от соотношения между гиперполяризацией, вызванной активацией 5-НТ1-рецепторов, и деполяризацией, обусловленной активацией 5-НТ2A-рецепторов. На фоне 5-НТ2д-блокаторов гиперполяризация усиливается. Во многих областях коры 5-НТ2A-рецепторы располагаются на ГАМКергических вставочных нейронах и на пирамидных нейронах. Следовательно, стимуляция этих рецепторов может приводить к разнонаправленным влияниям на пирамидные нейроны — в зависимости оттого, будет ли преобладать действие на сами эти нейроны или на ГАМКергические нейроны. Активация 5-НТ2с-рецепторов на ооцитах шпорцевой лягушки, экспрессирующих м РНК этих рецепторов, приводит к подавлению калиевого тока. В головном мозге такой эффект пока не выявлен. Стимуляция 5-НТ4-рецепторов, сопровождающаяся активацией аденилатциклазы, также вызывает в нейронах медленную деполяризацию, обусловленную снижением калиевой проницаемости. Пока не ясно, почему два разных типа серотониновых рецепторов, сопряженных с различными системами вторых посредников, оказывают один и тот же физиологический эффект. Более того, медленную деполяризацию вызывает активация еще одного типа серотониновых рецепторов — 5- НТ1Р-рецепторов. Эти рецепторы сопряжены с аденилатциклазой, имеются только на внутрикишечных нейронах и обладают особенными фармакологическими свойствами (Gershon, 1991).
Активация 5-НТ3-рецепторов вызывает быструю деполяризацию. Она обусловлена открыванием канала, пропускающего Na+ и К+ (Higashi and Nishi, 1982) и составляющего с рецептором единый комплекс (хемочувствительный канал). Подобная организация 5-НТ3-рецептора, сходная с организацией N-холинорецептора, была подтверждена в опытах с локальной фиксацией. 5-НТ3-рецепторы обнаружены в ЦНС, симпатических ганглиях, парасимпатических и симпатических афферентных волокнах, внутрикишечных нейронах и клеточных линиях нейронального происхождения (например, NG108-15). По своим фармакологическим свойствам 5-НТ3-рецепторы отличаются от других серотониновых рецепторов; возможно, существуют несколько подтипов этих рецепторов, отличающихся различными сочетаниями субъединиц.
Психические функции. Средства, действующие на серотониновые рецепторы, вызываютчрезвычайно разнообразные изменения психических функций. Многие экспериментальные модели, предназначенные для предварительной оценки стимулирующей или блокирующей активности препаратов по отношению к тем или иным рецепторам, основаны на исследовании таких стереотипных двигательных актов, как, например, четверохолмный рефлекс. Бихевиористские методики (например, метод выбора препарата) позволяют высказать предположения о субъективном компоненте реакций на психотропные средства. Эти методики используются и для исследования препаратов, действующих на серотонинертическую передачу, в частности галлюциногенов (см. ниже). Анализ колоссального числа работ, посвященных влиянию серотонина на поведение, выходит за рамки нашей книги, и мы остановимся только на тех экспериментах, которые имеют прямое отношение к психопатологии человека. Для более подробного ознакомления с этой темой можно порекомендовать прекрасные обзоры Glennon et Lucki (1988), Zifa and Fillion (1992), Koeketal. (1992).
Цикл сон—бодрствование. Регуляция цикла сон—бодрствование стала одной из первых психических функций, для которой была четко установлена роль серотонина. После классической работы на кошках, проведенной Муре и сотр. (Mouret et al., 1967), появилось множество данных о том, что истощение запасов серотонина с помощью парахлорфенилаланина вызывает бессонницу, устраняемую введением предшественника серотонина 5-гидрокситриптофана. Оказалось также, что триптофан и неизбирательные стимуляторы серотониновых рецепторов укорачивают время засыпания и удлиняют общую продолжительность сна. Блокаторы серотониновых рецепторов могут как повышать, так и понижать долю глубокого медленного сна, что, видимо, обусловлено действием на разные подтипы серотониновых рецепторов (Wasquier and Dugovic, 1990). Как у животных, так и у человека блокаторы 5-НТ2A- и 5-НТ2с-рецепторов (например, ритансерин) достаточно надежно вызывают повышение доли глубокого медленного сна.
Агрессивность и импульсивность. Данные, полученные как на животных, так и на человеке, свидетельствуют о том, что серотонин играет важнейшую роль в агрессивном и импульсивном поведении. Во многих клинических исследованиях показана связь между низким уровнем 5-гидроксииндолуксусной кислоты в СМЖ и такого рода поведением (Brown and Linnoila, 1990). Так, снижение этого уровня связывают с импульсивными попытками самоубийства (но не с суицидальными мыслями; Virkkunen et al.,1995). Как и в случае всех остальных эффектов серотонина, окончательных данных о влиянии серотонина на агрессивное поведение у животных пока нет, хотя предположение о таком влиянии вполне обосновано. Недавно появились генетические данные, подкрепляющие и расширяющие такие взгляды. Первым из серотониновых рецепторов, исследованных методами генной инженерии, был 5-НТ)В-рецептор. Путем гомологичной рекомбинации была получена линия мышей, у которых ген, кодирующий данный рецептор, был инактивирован (Saudau et al.,1994). У таких животных развивалась резчайшая агрессивность, что говорит о роли данных рецепторов либо в становлении нейронных контуров, отвечающих за агрессивное поведение, либо непосредственно в самом таком поведении. У человека выявлена точечная мутация гена, кодирующего МАО А; при этом также наблюдается чрезвычайная агрессивность в сочетании с умственной отсталостью (Brunner etal., 1993). Как оказалось, соответствующие проявления имеются и у мышей с мутациями, приводящими к дефициту МАО A (Cases et al., 1995). Эти данные, безусловно, подтверждают гипотезу о роли нарушений серотони-нергической передачи в агрессивном поведении.
Тревожность и депрессия. Эффективность средств, влияющих на серотонинергическую передачу (например, ингибиторов обратного захвата серотонина), при тревожных расстройствах и депрессии — убедительное свидетельство в пользу роли серотонина в патогенезе этих состояний. Однако на классических экспериментальных моделях данных расстройств получают неоднозначные результаты — эффект препарата зависит от вида и породы животного и применяемой методики. Так, частичный агонист 5-НТ1А-рецепторов буспирон (гл. 19), будучи эффективным транквилизатором у человека, не снижает у животных тревожность в опытах, поставленных по методике предпочтения или избегания; между тем именно эта методика использовалась при разработке бензодиазепиновых транквилизаторов. В то же время буспирон и другие блокаторы 5-НТ1A-рецепторов оказывают вполне эффективное анксиолитическое действие на других моделях тревожных расстройств (Barrett and Vanover, 1993). Недавние работы на мышах с инактивированными генами 5-НТ1Л-рецепторов также свидетельствуют в пользу роли этих рецепторов в патогенезе тревожности и, возможно, депрессии (Parks et al., 1998; Ramboz et al., 1998). С другой стороны, стимуляторы некоторых серотониновых рецепторов, в том числе 5-НТ2А-, 5-НТ2С- и 5-НТ3-рецепторов (например, метахлорфенилпиперазин), вызывают тревожность как у экспериментальных животных, так и у человека. Предполагается роль этих рецепторов и в экспериментальных моделях депрессии (например, обученной беспомощности).
У человека прямых данных о роли серотонина в патогенезе депрессии пока недостаточно. В то же время есть очень яркие клинические факты. Так, у больных с депрессией эффекты ингибиторов обратного захвата серотонина быстро устраняются при воздействиях, снижающих уровень серотонина в мозге. Такими воздействиями служат, например, прием парахлорфенилаланина или напитков, не содержащих триптофан, но богатых нейтральными аминокислотами (Delgado etal., 1990). Интересно, что сами по себе эти воздействия не вызывают и не усугубляют депрессию. Это говорит о том, что достаточный уровень серотонина в мозге необходим прежде всего для эффективности ингибиторов его обратного захвата.
Средства, влияющие на уровень серотонина в тканях[править | править код]
В экспериментах, направленных на выяснение физиологической роли серотонина, можно применять либо блокаторы серотониновых рецепторов, либо средства, влияющие на уровень серотонина в тканях. До недавнего времени в большинстве работ использовались только препараты второй из упомянутых групп — механизмы действия блокаторов серотониновых рецепторов были изучены плохо.
При низком содержании триптофана в диете уровень серотонина в головном мозге снижается, при высоком содержании триптофана — повышается. Поскольку лимитирующая реакция синтеза серотонина катализируется триптофангидроксилазой, ингибиторы этого фермента вызывают резкое падение уровня серотонина. Чаще всего используют необратимый избирательный ингибитор триптофангидроксилазы парахлорфенилаланин. Под действием этого вещества уровень серотонина значительно и надолго уменьшается, а содержание катехоламинов не изменяется.
Парахлорамфетамин и другие галогензамешенные амфетамины вызывают выброс серотонина из тромбоцитов и нейронов. В головном мозге после этого наступает длительное снижение запасов серотонина. Галогензамещенные амфетамины широко используются в экспериментальных работах. Два из них — фенфлурамин и дексфенфлурамин — применялись в качестве анорексантов, однако в связи с сообщениями об их кардиотоксическом действии в 1998 г. они в США были изъяты из продажи. Последствия применения этих средств до конца не изучены. В серотонинергических нейронах головного мозга они вызывают выраженное и длительное (до нескольких недель) снижение уровня серотонина, и одновременно уменьшается содержание специфических для этих нейронов белков — переносчика серотонина и триптофангидроксилазы. Это может свидетельствовать о нейротоксическом действии, однако признаков гибели нейронов под действием галогензамещенных амфетаминов не находят. Производные триптамина с дополнительными заместителями в индольном кольце (например, 5,7-дигидрокситриптамин; см. рис. 11.1) несомненно вызывают гибель серотонинергических нейронов. Введение 5,7-дигидрокситриптамина взрослым животным приводит к избирательному разрушению серотонинергических окончаний, однако тела нейронов не страдают, и со временем окончания регенерируют. Напротив, у новорожденных животных погибают и окончания, и тела серотонинергических нейронов, и поэтому регенерации не происходит.
К средствам, прицельно влияющим на серотонинергическую передачу, относятся ингибиторы обратного захвата серотонина, например флуоксетин. Механизм их действия состоит в продлении эффектов серотонина, выделяемого при возбуждении нервных окончаний. Если же одновременно с этими препаратами вводить 5-гидрокситриптофан, то серотонинергические влияния резко усиливаются. Ингибиторы обратного захвата серотонина — это одни из самых современных и распространенных антидепрессантов. Ингибитор обратного захвата серотонина, норадреналина и дофамина сибутрамин применяется в качестве анорексанта. В организме из него образуются два активных метаболита, которые, видимо, и оказывают терапевтическое действие. Пока не ясно, влиянием на какой именно медиатор обусловлен эффект сибутрамина.
К неизбирательным средствам, влияющим на уровень серотонина в тканях, относятся ингибиторы МАО и резерпин. Ингибиторы МАО блокируют основной путь метаболизма серотонина, а резерпин вызывает его выброс из нейрональных депо с последующим истощением. Все эти средства приводят к выраженному снижению содержания серотонина, однако одновременно в такой же степени уменьшается и уровень катехоламинов. Поэтому как средства для фармакологического анализа ингибиторы МАО и резерпин используются редко. Они применялись в психиатрии: резерпин в качестве нейролептика, а ингибиторы МАО — в качестве антидепрессантов.
Источники[править | править код]
- ↑ Strader A. D., Woods S. C. Gastrointestinal hormones and food intake // Gastroenterology. — 2005. — Vol. 128. — P. 175 – 191.
- ↑ Звенигородская Л. А., Кучеренко Т. В. Типы пищевого поведения и гормоны пищевого поведения у больных с метаболическим синдромом // Эксперим. и клин. гастроэнтерол. — 2007. — № 1. — С. 24 – 27
- ↑ http://www.dailymail.co.uk/sciencetech/article-2867554/The-metabolism-boosting-drug-REVERSE-obesity-let-eat-like-teenager-Researchers-key-controlling-body-s-natural-fat-burning-furnace.html