Препараты дженерики (аналоги) — различия между версиями
Monv (обсуждение | вклад) |
(→Недостатки дженериков) |
||
| Строка 24: | Строка 24: | ||
== Недостатки дженериков == | == Недостатки дженериков == | ||
| + | |||
| + | По-сути, единственным недостатком дженериков является невозможность реально контролировать их качество. Поскольку по определению дженерик - полный аналог оригинального лекарственного средства, никаких дополнительных исследований его эффективности и безопасности не требуется. Поэтому недобросовестный производитель дженерика может использовать некачественное сырье, разработать неудачную рецептуру или не обеспечить должных условий производства лекарственного средства. Фактически такую продукцию нельзя называть дженериком - это либо фальсификат либо просто некачественный продукт, и соответствующий орган государственного надзора за качеством фармацевтической породукции должен остановить его распространение на стадии выдачи сертификата (не выдавать сертификат). | ||
| + | Строго говоря, сертификация дженерика государственным органом для введения в реестр лекарственных средств и реализации в аптеках подтверждает его качество и полное соответствие оригинальному препарату. И единственной причиной появления на рынке некачественных препаратов - как оригинальных, так и дженериков, является недостаточная эффективность работы органов сертификации и контроля качества лекарственной продукции (а иногда и просто откровенная коррупция в этой сфере). | ||
Причины низкого качества дженерика многочисленны<ref>Дроздецкий С.И. Клиническая фармакология и терапия. 2005. №3. С.48-50</ref>. К ним относятся изменения методов синтеза (различная степень дисперсности, наличие стереоизомеров, токсических примесей, продуктов деградации и т.д.), различные нарушения реологических свойств, кинетики распространения препарата и т.п. Лишь наличие полной информации о соблюдении требований Good Manufacture Practice (GMP) при производстве, фармакологическая и терапевтическая эквивалентность дженерика оригинальному препарату позволяют рекомендовать его применение | Причины низкого качества дженерика многочисленны<ref>Дроздецкий С.И. Клиническая фармакология и терапия. 2005. №3. С.48-50</ref>. К ним относятся изменения методов синтеза (различная степень дисперсности, наличие стереоизомеров, токсических примесей, продуктов деградации и т.д.), различные нарушения реологических свойств, кинетики распространения препарата и т.п. Лишь наличие полной информации о соблюдении требований Good Manufacture Practice (GMP) при производстве, фармакологическая и терапевтическая эквивалентность дженерика оригинальному препарату позволяют рекомендовать его применение | ||
| − | Следует согласиться с проф. Ю.Б.Белоусовым<ref>Белоусов Ю Б Перспективы для клинического фармаколога Качественная клиническая практика 2002 2, 64-66 2. </ref>, который считает, что "формально выгодные ценовые показатели дженериков могут обернуться огромными дополнительными расходами, например, на лечение нежелательных побочных явлений". Для доказательства терапевтической эквивалентности воспроизведенных и оригинальных препаратов необходимы клинические исследования. Однако для регистрации дженериков они не являются обязательными, поэтому вопрос о терапевтической эквивалентности подобных средств часто остается открытым. В России пока нет централизованной базы данных для врачей и провизоров по оригинальным и воспроизведенным лекарствам. В США, напротив, каждому лекарственному препарату присвоен соответствующий код. Управление по контролю качества продуктов и лекарственных средств (FDA) не рекомендует в качестве альтернативы оригинальным средствам использовать препараты, которым оно присвоило код "В". К этой категории относятся лекарственные средства, которые по разным причинам нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения. Информация о кодах рецептурных средств содержится в специальных ежегодных изданиях и в Интернете, что позволяет обеспечить необходимую безопасность при лечении дженериками. На современном уровне ни один новый метод лечения, профилактики и диагностики не признается без проверки в рандомизированных контролируемых исследованиях. Как известно, "медицина, основанная на доказательствах, — добросовестное, точное и осмысленное использование результатов лучших клинических исследований для выбора лечения конкретного больного" (D.Sackett et al., 1996). | + | Следует согласиться с проф. Ю.Б.Белоусовым<ref>Белоусов Ю Б Перспективы для клинического фармаколога Качественная клиническая практика 2002 2, 64-66 2. </ref>, который считает, что "формально выгодные ценовые показатели дженериков могут обернуться огромными дополнительными расходами, например, на лечение нежелательных побочных явлений". Для доказательства терапевтической эквивалентности воспроизведенных и оригинальных препаратов необходимы клинические исследования. Однако для регистрации дженериков они не являются обязательными, поэтому вопрос о терапевтической эквивалентности подобных средств часто остается открытым. В России пока нет централизованной базы данных для врачей и провизоров по оригинальным и воспроизведенным лекарствам. В США, напротив, каждому лекарственному препарату присвоен соответствующий код. Управление по контролю качества продуктов и лекарственных средств (FDA) не рекомендует в качестве альтернативы оригинальным средствам использовать препараты, которым оно присвоило код "В". К этой категории относятся лекарственные средства, которые по разным причинам нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения. Информация о кодах рецептурных средств содержится в специальных ежегодных изданиях и в Интернете, что позволяет обеспечить необходимую безопасность при лечении дженериками. На современном уровне ни один новый метод лечения, профилактики и диагностики не признается без проверки в рандомизированных контролируемых исследованиях. Как известно, "медицина, основанная на доказательствах, — добросовестное, точное и осмысленное использование результатов лучших клинических исследований для выбора лечения конкретного больного" (D.Sackett et al., 1996). |
== Читайте также == | == Читайте также == | ||
Версия 19:43, 31 мая 2015
Препараты дженерики (аналоги)
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Дженерик — это аналог оригинального лекарственного препарата, поступивший в продажу после истечения срока действия исключительных патентных прав на оригинальное лекарственное средство.
Путь к выпуску нового лекарства не прост. Лекарство поступает на фармацевтический рынок под международным названием — торговой маркой, выбранной фармацевтической компанией, предложившей этот препарат. В продаже новое средство может появиться через некоторое время, после регистрации патентных прав владельца. Когда патент теряет силу, лекарство может продаваться под другим свободным названием как дженерик или под другой (новой) торговой маркой как препарат-последователь. Патентные права заявляются обычно уже на стадии разработки, поэтому времени для продажи лекарства под запатентованной маркой остается мало.
Значение нового лекарственного средства зависит оттого, лечит ли оно на основании какого-то нового принципа или лишь слегка улучшает действие старого аналогичного препарата, чья химическая структура была слегка изменена. Сложно открыть средство, обладающее совершенно новым механизмом действия и расширяющим терапевтические возможности. Примеры подобных принципиальных новинок последних лет — ингибитор ангиотензинпревращающего фермента, препараты статинового ряда для понижения уровня липидов в крови, ингибиторы протонного насоса, суперагонисты гонадорелина, блокаторы гиразы.
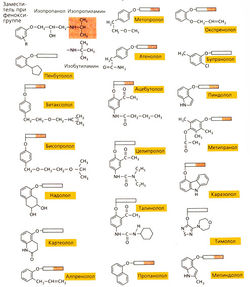
Очень часто «новые лекарства» — лишь аналоги, они имеют химическое строение «успешных» старых препаратов и содержат те же самые фармакологически активные группы. Лекарства-аналоги (в английской литературе — «mе too»-npenapaты) не привносят ничего нового в механизм действия лекарства. Ярким примером «переполнения» рынка лекарств-аналогов служат β-блокаторы: около 20 различных веществ содержат одну и ту же действующую основную группу и различаются только заместителями при фенокси-группе. Это объясняет сходство этих веществ по фармакокинетическим свойствам и относительному сродству к β-рецепторам (примеры химических формул приведены на рис. А). В медицине нашли применение лишь некоторые из известных β-блокаторов. Вещества-аналоги объединяют в лекарственные группы (например, бензодиазепины, антифлогистические средства, цефалоспорины). От большинства лекарств-аналогов можно отказаться.
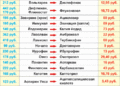
По истечении срока патента наиболее успешные медикаменты продаются конкурирующими фармацевтическими компаниями как препараты-последователи (вторичный патент). Препараты-последователи, дженерики (свободное название + торговая марка), а также препараты под новыми названиями дешевле, так как в их стоимость не входят затраты на исследования. Для некоторых старых препаратов насчитывается часто до 10-20 торговых названий. Многочисленные аналоги ибупрофена (болеутоляющего средства) представлены на рис. Б.
Переизбыток препаратов-аналогов и ненужное многообразие названий для одного и того же вещества усложняет возможность ориентироваться на рынке лекарственных средств. Было бы полезным критически сопоставить между собой применяемые лекарства с целью сделать рекомендации для медицинских назначений.
Недостатки дженериков
По-сути, единственным недостатком дженериков является невозможность реально контролировать их качество. Поскольку по определению дженерик - полный аналог оригинального лекарственного средства, никаких дополнительных исследований его эффективности и безопасности не требуется. Поэтому недобросовестный производитель дженерика может использовать некачественное сырье, разработать неудачную рецептуру или не обеспечить должных условий производства лекарственного средства. Фактически такую продукцию нельзя называть дженериком - это либо фальсификат либо просто некачественный продукт, и соответствующий орган государственного надзора за качеством фармацевтической породукции должен остановить его распространение на стадии выдачи сертификата (не выдавать сертификат). Строго говоря, сертификация дженерика государственным органом для введения в реестр лекарственных средств и реализации в аптеках подтверждает его качество и полное соответствие оригинальному препарату. И единственной причиной появления на рынке некачественных препаратов - как оригинальных, так и дженериков, является недостаточная эффективность работы органов сертификации и контроля качества лекарственной продукции (а иногда и просто откровенная коррупция в этой сфере).
Причины низкого качества дженерика многочисленны[1]. К ним относятся изменения методов синтеза (различная степень дисперсности, наличие стереоизомеров, токсических примесей, продуктов деградации и т.д.), различные нарушения реологических свойств, кинетики распространения препарата и т.п. Лишь наличие полной информации о соблюдении требований Good Manufacture Practice (GMP) при производстве, фармакологическая и терапевтическая эквивалентность дженерика оригинальному препарату позволяют рекомендовать его применение
Следует согласиться с проф. Ю.Б.Белоусовым[2], который считает, что "формально выгодные ценовые показатели дженериков могут обернуться огромными дополнительными расходами, например, на лечение нежелательных побочных явлений". Для доказательства терапевтической эквивалентности воспроизведенных и оригинальных препаратов необходимы клинические исследования. Однако для регистрации дженериков они не являются обязательными, поэтому вопрос о терапевтической эквивалентности подобных средств часто остается открытым. В России пока нет централизованной базы данных для врачей и провизоров по оригинальным и воспроизведенным лекарствам. В США, напротив, каждому лекарственному препарату присвоен соответствующий код. Управление по контролю качества продуктов и лекарственных средств (FDA) не рекомендует в качестве альтернативы оригинальным средствам использовать препараты, которым оно присвоило код "В". К этой категории относятся лекарственные средства, которые по разным причинам нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения. Информация о кодах рецептурных средств содержится в специальных ежегодных изданиях и в Интернете, что позволяет обеспечить необходимую безопасность при лечении дженериками. На современном уровне ни один новый метод лечения, профилактики и диагностики не признается без проверки в рандомизированных контролируемых исследованиях. Как известно, "медицина, основанная на доказательствах, — добросовестное, точное и осмысленное использование результатов лучших клинических исследований для выбора лечения конкретного больного" (D.Sackett et al., 1996).
Читайте также
- Создание лекарств
- Разработка новых лекарственных средств
- Этапы разработки лекарственных препаратов
- Регламенты и одобрение новых лекарственных средств
- Принятие фармакотерапевтического решения