Заболевания периферической нервной системы — различия между версиями
Dormiz (обсуждение | вклад) |
Lmass (обсуждение | вклад) (→Читайте также) |
||
| (не показана 1 промежуточная версия 1 участника) | |||
| Строка 226: | Строка 226: | ||
**[[Медикаментозное лечение психозов]] | **[[Медикаментозное лечение психозов]] | ||
*[[Препараты для лечения маний]] | *[[Препараты для лечения маний]] | ||
| + | *[[Лекарственные средства и нервная система]] | ||
*[[Анатомия центральной нервной системы]] | *[[Анатомия центральной нервной системы]] | ||
*[[Нейромедиаторы]] | *[[Нейромедиаторы]] | ||
*[[Заболевания ЦНС (центральной нервной системы)]] | *[[Заболевания ЦНС (центральной нервной системы)]] | ||
| + | *[[Массаж при заболеваниях нервной системы]] | ||
Текущая версия на 17:42, 9 июля 2015
Категория:
«Фармакология».
Содержание
Патофизиология и заболевания периферической нервной системы[править | править код]
Скелетно-мышечные нарушения[править | править код]
Миастения гравис[править | править код]
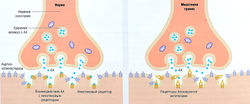
Миастения гравис — редкое аутоиммунное заболевание, влияющее на нервно-мышечную систему (рис. 8.15). Характерные симптомы: слабость скелетных мышц и утомление после кратковременного периода повторной деятельности с восстановлением после короткого периода отдыха. Однако в случае прогрессирования болезни сила мышцы у пациентов не всегда возвращается к исходному состоянию после отдыха. Около 85% больных миастенией испытывают общую слабость, поражающую веки, глазные мышцы, мышцы туловища, диафрагмы и длинные мышцы шеи. Иногда слабость ограничивается только веками и экстраокулярными мышцами (15% пациентов), что проявляется птозом.
Миастения гравис встречается в США приблизительно в 100 случаях на 1 млн, обычно у женщин в возрасте около 50 лет и у мужчин старше 60 лет.
Патофизиологические особенности миастении гравис—результат дефицита никотиновых холинергических рецепторов в мышцах
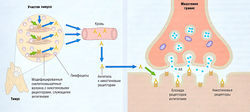
При миастении гравис количество никотиновых холинергических рецепторов в концевых мышечных пластинах составляет только « 30% нормы. Дефицит рецепторов связан с иммунологическим ответом, вовлекающим тимус, т.к. сила мышц у таких пациентов обычно улучшается после тимэктомии. В сыворотке крови пациентов с миастенией присутствуют антитела к никотиновому рецептору, и антиген может быть локализован в тимусе (рис. 8.16), т.к. холинергические рецепторы обнаружены на поверхности мышечных клеток в тимусе.
Рис. 8.16 Источник образования антигенов и антител при миастении гравис. Схематическое изображение участка тимуса, который содержит модифицированные мышечные клетки с никотиновыми рецепторами на поверхности. Предполагается, что эта железа может быть источником антигена, который служит моделью для получения никотиновых антител у больных миастенией. Эти антитела блокируют никотиновые рецепторы в нервно-мышечном соединении и предотвращают взаимодействие между нейротрансмиттером и никотиновыми рецепторами (см. рис. 8.18). АХ — ацетилхолин.
При миастении гравис сокращение скелетных мышц неадекватно для поддержания физической активности
При миастении гравис мышечное сокращение не может быть поддержано, т.к. число взаимодействий нейромедиатор-рецептор меньше нормы вследствие уменьшения количества доступных для функционирования никотиновых рецепторов в концевых мышечных пластинах из-за антител (см. рис. 8.16). В связи с этим во многих мышечных волокнах происходит нарушение передачи, т.е. потенциалы действия могут быть сгенерированы лишь в небольшом количестве мышечных волокон. Вероятно, поэтому сокращение невозможно даже после не большого периода мышечной активности. Однако это можно предотвратить увеличением числа холинергических взаимодействий нейромедиатор-рецептор.
Эффективная лекарственная терапия миастении гравис увеличивает число холинергических взаимодействий нейромедиатора с рецептором
Лечение миастении гравис заключается в следующем:
- увеличение концентрации АХ в нервно-мышечном синапсе (например, антихолинэстеразными средствами);
- подавление иммунного ответа.
Лечение миастении гравис[править | править код]
АХ неэффективен как лекарственный препарат, т.к. быстро метаболизируется ацетилхолинэстеразой в НМС и вызывает неблагоприятные эффекты стимуляции мускариновых рецепторов. Однако концентрация АХ в НМС может быть увеличена антихолинэстеразными средствами, которые ингибируют метаболизм АХ. Максимальные эффекты антихолинэстеразных средств обычно развиваются быстро в начале лечения, но после нескольких недель или месяцев терапии такие средства теряют эффективность. Тогда необходимо добавить другие препараты.
Фермент холинэстераза, которую ингибируют этими средствами, существует в двух структурно связанных изоэнзимах: (1) ацетилхолинэстераза (метаболизирует ацетилхолин), которая найдена преимущественно в НМС (и холинергических нейроэффекторных синапсах); (2) семейство эстераз, называемое псевдохолинэстераза или бутирилхолинэстераза (субстраты — неспецифические эфиры), которые найдены главным образом в плазме крови. Эти две разновидности фермента имеют два главных участка связывания — эстеразный и анионный, за которые антихолинэстеразные лекарства конкурируют с ацетилхолином, что ингибирует его метаболизм. Лекарства, которые ингибируют ацетилхолинэстеразу, можно объединить в две группы на основании участка связывания и стабильности взаимодействия с ферментом (например, обратимые и необратимые ингибиторы).
Карбаматы — обратимые антихолинэстеразные средства, широко используемые в лечении миастении гравис
Карбаматы, особенно неостигмин и пиридостигмин, обратимо ингибируют ацетилхолинэстеразу, связываясь в анионных и эстеразных участках. В течение периода ингибирования (3-6 час) концентрация АХ в НМС увеличивается, в результате происходят повторные взаимодействия с уменьшенным числом никотиновых холинергических рецепторов. Это ведет к улучшению сокращения мышц у пациента с миастенией. Оба средства назначают внутрь, но пиридостигмин имеет большую биодоступность и длительность действия (T1/2 = 4 час), чем неостигмин (Т1/2 = 2 час), и всасывается не полностью.
Силу дыхательных движений и жизненную емкость легких обычно используют для мониторирования увеличения мышечной силы после приема антихолинэстеразных средств
Для контроля и диагностики миастении гравис используют антихолинэстеразное средство ультракороткого действия — эдрофоний хлорид. Этот метод контроля является профилактической мерой для предотвращения передозировки, которая может уменьшить мышечную силу за счет АХ-вызванной блокады деполяризации никотиновых холинергических рецепторов в НМС у пациентов с миастенией гравис. Эдрофоний хлорид конкурирует с ацетилхолином за обратимое связывание в анионном участке ацетилхолинэстеразы. Улучшение мышечной силы с помощью эдрофония хлорида длится около 5 мин, если препарат вводят внутривенно. Однако, несмотря на непродолжительное действие эдрофония хлорида, в наличии должен быть атропин, чтобы противостоять мускариновым побочным эффектам в результате накопления ацетилхолина.
Длительно действующие антихолинэстеразные средства[править | править код]
Для лечения миастении гравис также используют длительно действующие (более 3-8 час) антихолинэстеразные средства типа амбенония. Этот препарат действует подобно карбаматам. Фосфорорганические соединения редко используют в клинике, т.к. трудно контролировать дозы из-за необратимого связывания этих препаратов с эстеразным центром ацетилхолинэстеразы. Фосфорорганические антихолинэстеразные вещества используют прежде всего как инсектициды (например, паратион, малатион) и как химическое оружие (например, табун, зарин). Иногда для лечения некоторых форм глаукомы применяют эхотиофат.
ПОБОЧНЫЕ ЭФФЕКТЫ. Эти эффекты возникают из-за накопления ацетилхолина, ведущего к возбуждению мускариновых рецепторов во многих тканях. Побочными эффектами могут быть абдоминальные спазмы, гиперсаливация, увеличение бронхиальной секреции, миоз и брадикардия. Эти эффекты устраняют антагонисты мускариновых рецепторов типа атропина, но обычно его не назначают, поскольку лучше не маскировать появление мускариновых эффектов, которые являются показателем чрезмерной антихолинэстеразной терапии. Большинство пациентов становятся толерантными к этим неблагоприятным эффектам.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ. Эффективность антихолинэстеразных веществ снижается, а симптомы миастении гравис усиливаются, если пациент подвергается воздействию тубокурарина (антидеполяризующий миорелаксант) или амино-гликозидного антибиотика, который нарушает нервно-мышечную передачу.
ЛЕКАРСТВА, КОТОРЫЕ ПОДАВЛЯЮТ ИММУННЫЙ ОТВЕТ ПРИ МИАСТЕНИИ ГРАВИС. Поскольку эффективность антихолинэстеразной терапии часто уменьшается через несколько недель или месяцев, используют дополнительные терапевтические меры: назначение иммунодепрессантов типа глюкокортикостероидов, которые показаны, если мышечная сила неадекватна.
Глюкокортикостероиды[править | править код]
Механизм действия глюкокортикостероидов обсужден подробно в Кортикостероиды. Глюкокортикостероиды используют в лечении миастении гравис, т.к. они ингибируют синтез антител к никотиновым холинергическим рецепторам в НМС (табл. 8.6). Для этого обычно назначают преднизолон или преднизон, что ведет к увеличению числа доступных никотиновых холинергических рецепторов для взаимодействия с АХ. В результате сила мышц у пациентов с миастенией улучшается. Есть предположение, что полезные эффекты преднизолона могут быть частично обусловлены увеличенным синтезом АХ-рецепторов, которые также улучшают нервно-мышечную передачу при миастении гравис из-за подавления образования антител.
Таблица 8.6 Препараты, используемые для лечения миастении гравис
|
Препараты |
Главный эффект |
|
Антихолинэстеразные (например, неостигмин, пиридостигмин, амбеноний) |
Увеличение концентрации ацетилхолина в нервно-мышечном синапсе |
|
Глюкокортикостероиды (например, преднизолон, преднизон) |
Подавляют синтез антител к никотиновым рецепторам |
|
Азатиоприн |
Ингибирует синтез антител к никотиновым рецепторам |
|
Циклоспорин |
Ингибирует синтез антител к никотиновым рецепторам |
На ранних стадиях терапии преднизолоном мышечная слабость может увеличиваться, поэтому пациентов необходимо госпитализировать при использовании этого лечения впервые. Риск может быть уменьшен начальной терапией: комбинацией антихолинэстеразных средств и малой суточной дозы преднизолона (20 мг). Как только мышечная сила улучшается, дозу глюкокортикостероида можно постепенно увеличивать, а дозу антихолинэстеразного средства одновременно уменьшать до тех пор, пока на фоне одного глюкокортикостероида будет наблюдаться желаемый уровень мышечной силы. Однако лечение миастении гравис глюкокортикостероидами часто длительное, с предпочтительным дневным режимом терапии, чтобы уменьшить риск неблагоприятных эффектов. В этом режиме максимальный .терапевтический эффект можно получить в пределах 6-12 мес.
Азатиоприн[править | править код]
Азатиоприн используют в качестве альтернативы преднизолону при генерализованной миастении гравис, не отвечающей на глюкокортикостероидную терапию (см. табл. 8.6). Азатиоприн подавляет синтез антител к никотиновому холинергическому рецептору, ингибируя пролиферацию В-лимфоцитов. Эффективность препарата может быть обусловлена метаболитом 6-меркаптопурином, который ингибирует синтез ДНК (см. Лечение злокачественных опухолей). Однако его терапевтическая эффективность развивается медленно, вызывая удовлетворительные клинические результаты после одного года приема.
ПОБОЧНЫЕ ЭФФЕКТЫ. Этими эффектами могут быть гриппоподобная реакция, тошнота и рвота, дерматиты, угнетение костного мозга и гепатотоксичность. Многие из этих неблагоприятных эффектов могут развиться в серьезную токсичность, если азатиоприн используют в комбинации с 6-меркаптопурином или аллопуринолом.
Циклоспорин А[править | править код]
Циклоспорин А — другой иммунодепрессант, используемый в лечении миастении гравис (см. табл.8.6). Его эффективность связана с ингибированием синтеза антител к никотиновому холинергическому рецептору путем блокирования активации Т-клеток-хелперов. Терапевтический эффект циклоспорина А развивается в пределах 1-2 мес.
ПОБОЧНЫЕ ЭФФЕКТЫ. Включают нефротоксичность, гепатотоксичность, гипертензию и тремор.
Другие подходы к лечению миастении гравис[править | править код]
При попытке полностью устранить антигенную стимуляцию для производства антител к никотиновым холинергическим рецепторам в НМС иногда проводят хирургическое удаление тимуса. Эта хирургическая процедура не показана детям, не достигшим половой зрелости, из-за необходимости сохранить роль тимуса в развивающейся иммунной системе.
Для удаления антител к АХ-никотиновым рецепторам можно использовать плазмафорез, но только в качестве экстренной терапии у пациентов с миастеническим кризом (при усилении симптомов заболевания). Терапевтическая эффективность этой процедуры наступает через несколько дней и длится в течение нескольких недель.
Мышечная спастичность[править | править код]
Мышечная спастичность — гипертоническое сокращение скелетных мышц. Она часто бывает симптомом неврологических нарушений типа церебрального паралича, рассеянного склероза и инсульта. Причины гипертонуса мышц:
- чрезмерное растяжение сухожилия, обусловленное повышенной активностью у-нейрона и вызванное возбуждением мышечного веретена;
- сокращение мышцы-сгибателя, приводящее к клонусу, из-за «залпа разгрузки» от афферентных волокон на расположенные ниже мотонейроны (а-мотонейроны).
Мышечную спастичность лечат лекарственными средствами, которые уменьшают чрезмерное центростремительное возбуждение а -мотонейронов, иннервирующих скелетные мышцы
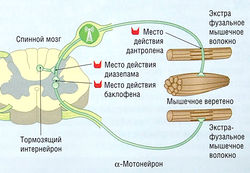
В качестве лекарственных средств, которые уменьшают чрезмерное центростремительное возбуждение а-мотонейронов (рис. 8.17), для лечения мышечной спастичности предпочтительнее использовать миорелаксанты, т.к. они более избирательны. По сравнению с другими средствами миорелаксанты вызывают расслабление, нарушая и нормальный тонус мышцы, и повышенный тонус из-за судорог любой этиологии.
Рис. 8.17 Нейронный путь, способствующий развитию миоклонуса при спастичности, ингибируется диазепамом и баклофеном. Растяжение мышц активизирует IA-афференты из мышечного веретена и посылает поток импульсов в а-мотонейрон, запуская сокращение мышцы. Это смягчает натяжение веретена и прекращает активность афферентов. Однако, когда мышцы расслабляются, натяжение на веретене восстанавливается, т.к. чувствительность рефлекса при спастичности увеличивается, и цикл событий повторяется, повышая миоклонус.
Баклофен[править | править код]
Баклофен — хлорофениловый аналог тормозного нейромедиатора ЦНС ГАМК. Препарат был разработан как источник ГАМК, который легко проникает с кровью через гематоэнцефалический барьер.
Баклофен используют преимущественно при спазмах сгибателей и разгибателей. Эти эффекты происходят на уровне спинного мозга, но не связаны воздействием на произвольную мышечную силу или с нормальными сухожильными рефлексами.
Баклофен ингибирует центростремительный импульс к а-мотонейронам через воздействие на пресинаптические ГАМКв-рецепторы центростремительных нервных окончаний и связанных с ними вставочных нейронов. Считают, что связывание баклофена с ГАМКв-рецепторами (соединенными с G-белком) уменьшает приток Са2+ в центростремительный нерв. Таким образом, меньшее количество нейромедиатора высвобождается для активации СХ-мотонейронов, которые становятся менее активными и менее восприимчивыми к циклу событий, ведущих в спастичности.
Баклофен эффективен при мышечной спастичности из-за повреждений спинного мозга и рассеянного склероза, но неэффективен при мышечной спастичности из-за внезапного инсульта и других поражений мозга
Баклофен обычно назначают внутрь; он быстро абсорбируется из кишечника. Период полувыведения в плазме крови составляет 3-4 час; « 35% выводится в неизмененном виде почками и через желудочно-кишечный тракт.
ПОБОЧНЫЕ ЭФФЕКТЫ. Включают сонливость (менее выраженную, чем у диазепама), двигательную дискоординацию, умственную заторможенность, тошноту и гипотензию (особенно в случае передозировки). Препарат не рекомендуется назначать пациентам с эпилепсией, т.к. может провоцировать приступы эпилепсии. Баклофен после длительного использования нужно отменять постепенно, т.к. внезапная отмена препарата может вызвать галлюцинации, беспокойство и тахикардию.
Диазепам[править | править код]
Диазепам эффективен для лечения спазма мышц, связанного с повреждениями спинного мозга, но менее эффективен, чем баклофен, особенно при спазме сгибателя
Диазепам — это бензодиазепин. Препарат полезен в лечении спастичности, т.к. уменьшает тонус мышц, понижая полисинаптические и моносинаптические рефлексы, которые способствуют поддержанию спазма мышц. Действие диазепама происходит как на спинальном, так и на супраспинальном уровнях. Спинальный уровень действия для уменьшения спастичности более важен. Для оказания этого эффекта в спинном мозге диазепам связывается с бензодиазепиновыми рецепторами в ГАМКд-рецепторном комплексе на центростремительных окончаниях нерва, образующих синапс с ОС-мотонейронами (см. рис. 8.17). Это увеличивает пресинаптическое ингибирование, вызываемое ГАМК, при котором возрастает поступление ионов Сl внутрь клетки после взаимодействия с ГАМКа-рецепторами (табл. 8.7). Диазепам можно назначать внутрь или внутривенно. Период полувыведения « 60 час, в который активный метаболит нордиазепам вносит свой вклад. Диазепам вызывает дозозависимую сонливость.
Таблица 8.7 Препараты, используемые для лечения спастичности
|
Препараты |
Механизм действия |
|
Баклофен |
Ингибирует сгибательный и разгибательный мышечный спазм через ГАМКв-рецептор-опосредованную блокаду афферентной стимуляции а-мотонейронов |
|
Диазепам |
ГАМКд-рецептор-опосредованная пресинаптическая блокада афферентной стимуляции а-мотонейронов |
|
Дантролен |
Ингибирование сопряжения возбуждение-сокращение в скелетной мышце путем уменьшения высвобождения Са2+ из саркоплазматического ретикулума |
Дантролен[править | править код]
В отличие от баклофена и диазепама, дантролен устраняет спастичность, оказывая прямое действие на скелетные мышцы (см. табл. 8.7).
Дантролен — производное гидантоина, которое не только устраняет мышечный спазм, но также вызывает мышечную слабость, что ограничивает его клиническое использование. Механизм действия заключается в ингибировании скелетномышечного сопряжения возбуждение-сокращение. Препарат уменьшает количество Са2+, высвобождаемого из саркоплазматического ретикулума, в результате снижается связь между возбуждением и сокращением, что заканчивается редукцией сокращения, генерируемого в мышце. Фармакологическая активность дантролена доказана уменьшением сокращений скелетных мышц в экспериментальных и клинических условиях.
Дантролен используют для устранения спазма при параплегии и гемиплегии
Дантролен используют для лечения злокачественной гипертермии (состояния, которое развивается во время общей анестезии) при чрезмерном накоплении внутриклеточного Са2+. Дантролен обычно назначают внутрь, но при этом он абсорбируется неполностью. Препарат имеет период полувыведения 9 час и метаболизируется печенью.
ПОБОЧНЫЕ ЭФФЕКТЫ. Включают мышечную слабость и угнетение, иногда гепатотоксичность. Препарат противопоказан пациентам с дыхательной недостаточностью или болезнью печени. Также рекомендуются регулярные обследования функции печени.
Двигательные нарушения в результате дефектов возбудимости мышцы[править | править код]
Многие нарушения движения связаны с дефектами в базальных ганглиях, но некоторые нарушения -результат ухудшения нервно-мышечной передачи и возбудимости скелетных мышц (например, синдром Ламберта-Итона, синдром Мак-Ардла, врожденная миотония и тетания).
Синдром Ламберта-Итона[править | править код]
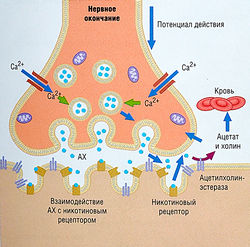
Синдром Ламберта-Итона (миастенический синдром) связан с некоторыми опухолями (особенно с раком легкого). Этот синдром чаще наблюдается у мужчин в возрасте 50-60 лет. Поскольку НМС - место дефекта, проявления напоминают миастению гравис (симптомы утомляемости и пониженных рефлексов конечностей). Однако синдром Ламберта-Итона отличается от миастении гравис тем, что мышечная слабость, которая особенно затрагивает мышцы конечностей, не купируется антихолинэстеразными средствами. Это связано с тем, что синдром Ламберта-Итона — результат разрушенного сопряжения между возбуждением окончания нерва и высвобождением АХ в НМС. У некоторых пациентов это связано с аутоантителами против нейрональных потенциал-зависимых Са2+-каналов. Оказывается, что потенциал-зависимые Са2+-каналы экспрессируются в ткани мелкоклеточного рака легкого и как антиген способствуют развитию антител Са2+-канала.
Терапия этого синдрома направлена на увеличение высвобождения нейромедиатора в НМС:
- физические упражнения для улучшения мышечной силы;
- соли кальция, которые могут быть полезны, т.к. Са2+ играет важную роль в высвобождении нейромедиаторов из нервных окончаний (рис. 8.18, табл. 8.8);
- 3,4-диаминопиридин, который увеличивает высвобождение медиатора, блокируя проведение К+ в нервных окончаниях. 3,4-Диаминопиридин — простой аналог пиридина, который способен блокировать разнообразные потенциал-зависимые Са2+-каналы с некоторой селективностью к одному типу К+-каналов по сравнению с другим. Этот препарат используют экспериментально, он имеет ограниченное клиническое применение из-за распространенных неблагоприятных эффектов, связанных с ингибированием потенциал-зависимых К+-каналов. Это приводит к широкому диапазону побочных эффектов, главный из которых — возбуждение ЦНС. Препарат назначают внутрь от 4 до 5 раз в день.
Синдром Мак-Ардла[править | править код]
Главными симптомами этого синдрома являются слабость, мышечная боль и неподвижность после кратковременного периода физической нагрузки. Причина симптомов заключается в том, что скелетные мышцы не в состоянии расслабиться из-за неадекватного производства АТФ, необходимого для секвестрации Са2+ в саркоплазматическом ретикулуме, что прекращает сокращение. Неадекватное производство АТФ обусловлено невозможностью высвобождения глюкозы из гликогена из-за наследственного дефицита гликогенфосфорилазы в скелетных мышцах. Такие пациенты имеют ограниченное поступление АТФ от глюкозы крови и жирных кислот, необходимых для деятельности мышцы, поэтому возможны лишь кратковременные периоды нормальной скелетномышечной деятельности. У пациентов с синдромом Мак-Ардла отсутствует типичное увеличение в крови лактата и пирувата после физической нагрузки.
Лечение синдрома проводят большими дозами глюкозы или введением эпинефрина или глюкагона для увеличения высвобождение глюкозы из печени (см. табл. 8.8).
Таблица 8.8 Лечение двигательных нарушений в результате дефектов возбудимости мышцы
|
Нарушение |
Лечение |
|
Синдром Ламберта-Итона |
Соли кальция, физические упражнения |
|
Синдром Мак-Ардла |
Большие дозы глюкозы, введение эпинефрина или глюкагона |
|
Врожденная миотония |
Мембранные стабилизаторы типа хинина и фенитоина |
|
Тетания |
Нормализация концентрации Са2+ в плазме |
Врожденная миотония[править | править код]
Врожденная миотония — наследственное нарушение, характеризующееся сильным мышечным спазмом из-за возбудимости мембраны скелетномышечного волокна. Возбудимость возникает из-за структурного дефекта в мембране мышечного волокна, который приводит к гипервозбудимости, поэтому волокно легко перевозбуждается следовыми потенциалами (потенциалами последействия).
Заболевание лечат хинидином или фенитоином, назначаемым внутрь для уменьшения частоты и выраженности судорог. Эти препараты блокируют Na+ и другие потенциал-зависимые ионные каналы. Эти лекарственные средства часто используют для лечения эпилепсии и аритмий.
Тетания[править | править код]
Тетания — это распространенное судорожное сокращение мышц (подергивание) вместе с постоянным сокращением мышц рук и ног, заканчивающееся болезненными судорогами. Главная причина — гипокальциемия, которая увеличивает возбудимость двигательных нервов. Считается, что низкий уровень внеклеточного Са2+ увеличивает возбудимость соматических нервов и вызывает повторный запуск, приводящий к постоянному мышечному сокращению. Тетанию также вызывает столбнячный токсин.
Заболевание лечат солями кальция (например, глюконатом кальция), благодаря чему восстановливается внеклеточная концентрация кальция.