Противоопухолевые антибиотики — различия между версиями
Febor (обсуждение | вклад) (Новая страница: «{{Клинфарм3}} == Противоопухолевые антибиотики == === Дактиномицин === '''Историческая справк…») |
Ars (обсуждение | вклад) (→Митомицин) |
||
| (не показано 6 промежуточных версий 2 участников) | |||
| Строка 4: | Строка 4: | ||
=== Дактиномицин === | === Дактиномицин === | ||
| − | '''Историческая справка'''. Первым антибиотиком, выделенным в кристаллическом виде из культуры стрептомицетов Streptomyces parvulus, стал актиномицин A (Waksman and Woodruff, 1940); в дальнейшем были получены и другие соединения, включая актиномицин D, или дактиномицин (Waksman Conference on Actinomycins, 1974). Последний обладает противоопухолевой активностью, особенно при хориокарциноме и некоторых опухолях у детей. | + | '''Историческая справка'''. Первым [[Антибиотики (антимикробные средства)|антибиотиком]], выделенным в кристаллическом виде из культуры стрептомицетов Streptomyces parvulus, стал актиномицин A (Waksman and Woodruff, 1940); в дальнейшем были получены и другие соединения, включая актиномицин D, или дактиномицин (Waksman Conference on Actinomycins, 1974). Последний обладает противоопухолевой активностью, особенно при хориокарциноме и некоторых опухолях у детей. |
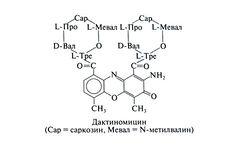
| − | '''Структурно-функциональная зависимость'''. Актиномицины — это хромопептиды; обычно они содержат один и тот же хромофор — актиноцин (плоское производное феноксазона), придающий им оранжево-красный цвет. Природные актиномицины отличаются строением аминокислот, входящих в пептидные цепи. Путем добавления в питательную среду различных аминокислот удается менять тип актиномицина и его биологическую активность (Crooke, 1983). Структурная формула дактиномицина следующая: | + | '''Структурно-функциональная зависимость'''. Актиномицины — это хромопептиды; обычно они содержат один и тот же хромофор — актиноцин (плоское производное феноксазона), придающий им оранжево-красный цвет. Природные актиномицины отличаются строением аминокислот, входящих в пептидные цепи. Путем добавления в питательную среду различных аминокислот удается менять тип актиномицина и его биологическую активность (Crooke, 1983). Структурная формула дактиномицина следующая:[[Image:Gm1099.jpg|250px|thumb|right|Структурная формула дактиномицина ]] |
'''Механизм действия'''. Цитотоксичность актиномицинов обусловлена способностью связываться с двойной спиралью ДНК. Объяснить действие дактиномицина позволило кристаллографическое исследование его комплекса с дезоксигуанозином (Sobell, 1973). Плоское феноксазоновое ядро вклинивается между соседними парами гуанин—цитозин и цитозин—гуанин, а пептидные цепи располагаются в малых бороздках ДН К. В результате образуется очень стойкий комплекс препарата с ДНК, блокирующий прежде всего транскрипцию: РНК-псшимеразы значительно более чувствительны к дактиномицину, чем ДНК-полимеразы. Кроме того, дактиномицин вызывает одноцепочечные разрывы ДНК, что может быть связано с образованием свободных радикалов или ингибированием ДНК-топоизомераз (Waksman Conference on Actinomycins, 1974; Goldberg et al., 1977). | '''Механизм действия'''. Цитотоксичность актиномицинов обусловлена способностью связываться с двойной спиралью ДНК. Объяснить действие дактиномицина позволило кристаллографическое исследование его комплекса с дезоксигуанозином (Sobell, 1973). Плоское феноксазоновое ядро вклинивается между соседними парами гуанин—цитозин и цитозин—гуанин, а пептидные цепи располагаются в малых бороздках ДН К. В результате образуется очень стойкий комплекс препарата с ДНК, блокирующий прежде всего транскрипцию: РНК-псшимеразы значительно более чувствительны к дактиномицину, чем ДНК-полимеразы. Кроме того, дактиномицин вызывает одноцепочечные разрывы ДНК, что может быть связано с образованием свободных радикалов или ингибированием ДНК-топоизомераз (Waksman Conference on Actinomycins, 1974; Goldberg et al., 1977). | ||
| Строка 20: | Строка 20: | ||
=== Антрациклины === | === Антрациклины === | ||
| − | Антрациклины и их производные относятся к наиболее мощным противоопухолевым препаратам. Даунорубицин и доксорубицин выделяют из культур Streptomyces peucetius caesius, идарубицин получают синтетическим путем. Эти препараты мало различаются построению, но даунорубицин и идарубицин используют главным образом при острых лейкозах, тогда как спектр активности доксорубицина шире и включает многие солидные опухоли. Существенным недостатком антрациклинов является их кардиотоксичность, приводящая к развитию дилатационной кардиомиопатии, часто необратимой. Это нетипичное для противоопухолевых препаратов побочное действие зависит от общей дозы препарата. В поисках более активных и менее кардиотоксичных препаратов были синтезированы сотни антрациклинов и близких построению веществ. Некоторые из них нашли клиническое применение: идарубицин — при лейкозах, эпирубицин — при солидных опухолях, митоксантрон (антрацендион, значительно менее кардиотоксичный, чем антрациклины) — при раке предстательной железы, лейкозах и для высокодозной химиотерапии (Arlin et al., 1990; Feldman etal., 1993; Berman etal., 1991; Wiemik etal., 1992; Launchbury and Habboubi, 1993). | + | Антрациклины и их производные относятся к наиболее мощным [[Противоопухолевые препараты (средства)|противоопухолевым препаратам]]. Даунорубицин и доксорубицин выделяют из культур Streptomyces peucetius caesius, идарубицин получают синтетическим путем. Эти препараты мало различаются построению, но даунорубицин и идарубицин используют главным образом при острых лейкозах, тогда как спектр активности доксорубицина шире и включает многие солидные опухоли. Существенным недостатком антрациклинов является их кардиотоксичность, приводящая к развитию дилатационной кардиомиопатии, часто необратимой. Это нетипичное для противоопухолевых препаратов побочное действие зависит от общей дозы препарата. В поисках более активных и менее кардиотоксичных препаратов были синтезированы сотни антрациклинов и близких построению веществ. Некоторые из них нашли клиническое применение: идарубицин — при лейкозах, эпирубицин — при солидных опухолях, митоксантрон (антрацендион, значительно менее кардиотоксичный, чем антрациклины) — при раке предстательной железы, лейкозах и для высокодозной химиотерапии (Arlin et al., 1990; Feldman etal., 1993; Berman etal., 1991; Wiemik etal., 1992; Launchbury and Habboubi, 1993). |
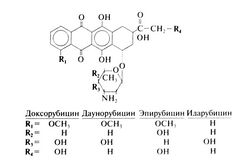
| − | '''Структурно-функциональная зависимость'''. Антрациклины содержат тетрациклическое ядро и моносахарид даунозамин, соединенный с ядром гликозидной связью. Благодаря сопряженным хиноновому и гидрохиноновому кольцам он легко окисляется и восстанавливается. Доксорубицин и даунорубицин сильно разнятся по спектру активности, но их формулы отличаются лишь одной гидроксигруппой у атома С-14. Идарубицин — синтетический аналог даунорубицина без метоксигрулпы у атома С-4 (в 1-м кольце). Структурные формулы доксорубицина, даунорубицина, эпирубицина и идарубицина следующие: | + | '''Структурно-функциональная зависимость'''. Антрациклины содержат тетрациклическое ядро и моносахарид даунозамин, соединенный с ядром гликозидной связью. Благодаря сопряженным хиноновому и гидрохиноновому кольцам он легко окисляется и восстанавливается. Доксорубицин и даунорубицин сильно разнятся по спектру активности, но их формулы отличаются лишь одной гидроксигруппой у атома С-14. Идарубицин — синтетический аналог даунорубицина без метоксигрулпы у атома С-4 (в 1-м кольце). Структурные формулы доксорубицина, даунорубицина, эпирубицина и идарубицина следующие:[[Image:Gm1100.jpg|250px|thumb|right|Структурные формулы доксорубицина, даунорубицина, эпирубицина и идарубицина]] |
'''Механизм действия'''. Описано несколько биохимических нарушений, вызываемых антрациклинами и антрацендионами, каждое из которых или все в совокупности могут лежать в основе лечебного и токсического действия этих препаратов. Антрациклины и их аналоги вклиниваются в молекулу ДНК, вызывая нарушение репликации и транскрипции, одно- и двухцепочечные разрывы ДНК, сестринские хроматидные обмены, оказывая тем самым мутагенное и канцерогенное действие на клетку. Разрывы ДНК возникают за счет связывания противоопухолевых препаратов с комплексом, состоящим из ДНК-топоизомеразы II и ДНК, что препятствует устранению разрывов ДНК, созданных ферментом (Tewey et al., 1984). Благодаря хиноно-вым группам антрациклины образуют свободные радикалы в растворе, а также в нормальных и опухолевых клетках (Gewirtz, 1999; Ikeda et al., 1999). В присутствии НАДФН они восстанавливаются НАДФН-оксидазой в нестабильные семихиноны, которые быстро реагируют с кислородом, образуя супероксидные радикалы. Последние способны превращаться в перекись водорода и гидроксильные радикалы, которые окисляют азотистые основания ДНК (Serrano etal., 1999). Выработка свободных радикалов существенно ускоряется при взаимодействии доксорубицина с ионами железа (Myers, 1988). Кроме того, внутримолекулярный перенос электронов в семихиноновых радикалах способствует образованию перекисей липидов, окиси азота и других высокореактивных соединений. В защите клеток от токсического действия антрациклинов важную роль играют ферменты, в частности супероксиддисмутаза и катал аза. Действие этих ферментов усиливают экзогенные антиоксиданты (а-то-коферол) и вещества, связывающие железо, например дексразоксан — препарат, снижающий кардиотоксичность антрациклинов (Speyer etal., 1988; Swain etal., 1997). Наконец, антрациклины реагируют с клеточной мембраной, нарушая ее функцию за счет образования перекисей липидов, — этот механизм может иметь значение как для противоопухолевой активности, так и для кардиотоксичности данных препаратов (Tritton et al., 1978). | '''Механизм действия'''. Описано несколько биохимических нарушений, вызываемых антрациклинами и антрацендионами, каждое из которых или все в совокупности могут лежать в основе лечебного и токсического действия этих препаратов. Антрациклины и их аналоги вклиниваются в молекулу ДНК, вызывая нарушение репликации и транскрипции, одно- и двухцепочечные разрывы ДНК, сестринские хроматидные обмены, оказывая тем самым мутагенное и канцерогенное действие на клетку. Разрывы ДНК возникают за счет связывания противоопухолевых препаратов с комплексом, состоящим из ДНК-топоизомеразы II и ДНК, что препятствует устранению разрывов ДНК, созданных ферментом (Tewey et al., 1984). Благодаря хиноно-вым группам антрациклины образуют свободные радикалы в растворе, а также в нормальных и опухолевых клетках (Gewirtz, 1999; Ikeda et al., 1999). В присутствии НАДФН они восстанавливаются НАДФН-оксидазой в нестабильные семихиноны, которые быстро реагируют с кислородом, образуя супероксидные радикалы. Последние способны превращаться в перекись водорода и гидроксильные радикалы, которые окисляют азотистые основания ДНК (Serrano etal., 1999). Выработка свободных радикалов существенно ускоряется при взаимодействии доксорубицина с ионами железа (Myers, 1988). Кроме того, внутримолекулярный перенос электронов в семихиноновых радикалах способствует образованию перекисей липидов, окиси азота и других высокореактивных соединений. В защите клеток от токсического действия антрациклинов важную роль играют ферменты, в частности супероксиддисмутаза и катал аза. Действие этих ферментов усиливают экзогенные антиоксиданты (а-то-коферол) и вещества, связывающие железо, например дексразоксан — препарат, снижающий кардиотоксичность антрациклинов (Speyer etal., 1988; Swain etal., 1997). Наконец, антрациклины реагируют с клеточной мембраной, нарушая ее функцию за счет образования перекисей липидов, — этот механизм может иметь значение как для противоопухолевой активности, так и для кардиотоксичности данных препаратов (Tritton et al., 1978). | ||
| Строка 54: | Строка 54: | ||
'''Новые аналоги доксорубицина'''. Валрубицин разрешен ФДА в 1998 г. для внутрипузырного введения при раке мочевого пузыря, устойчивом к вакцине БЦЖ, если цистэктомия сопряжена с неприемлемым риском осложнений и смерти. Эпирубицин (4'-эпи-доксорубицин) разрешен ФДА в 1999 г. для адъювантной химиотерапии рака молочной железы с метастазами в лимфоузлы. | '''Новые аналоги доксорубицина'''. Валрубицин разрешен ФДА в 1998 г. для внутрипузырного введения при раке мочевого пузыря, устойчивом к вакцине БЦЖ, если цистэктомия сопряжена с неприемлемым риском осложнений и смерти. Эпирубицин (4'-эпи-доксорубицин) разрешен ФДА в 1999 г. для адъювантной химиотерапии рака молочной железы с метастазами в лимфоузлы. | ||
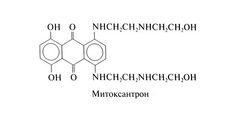
| − | Близкий по структуре антрацендион митоксантрон применяется при остром миелолейкозе. Структурная формула митоксантрона следующая: | + | Близкий по структуре антрацендион митоксантрон применяется при остром миелолейкозе. Структурная формула митоксантрона следующая:[[Image:Gm1101.jpg|250px|thumb|right|Структурная формула митоксантрона]] |
По сравнению с доксорубицином митоксантрон в меньшей степени образует хиноновые свободные радикалы и потому менее кардиотоксичен. Он ингибирует ДНК-топоизомеразу И, вызывая разрывы ДНК, а также вклинивается в ДНК. Препарат активен при лейкозах, а также при раке молочной и предстательной желез (Shenkenberg and Von Hoff, 1986), кроме того, его включают в экспериментальные схемы высокодозной химиотерапии. Основные побочные эффекты — угнетение кроветворения, поражение миокарда и стоматит. Тошнота, рвота и алопеция менее выражены, чем при лечении доксорубицином. | По сравнению с доксорубицином митоксантрон в меньшей степени образует хиноновые свободные радикалы и потому менее кардиотоксичен. Он ингибирует ДНК-топоизомеразу И, вызывая разрывы ДНК, а также вклинивается в ДНК. Препарат активен при лейкозах, а также при раке молочной и предстательной желез (Shenkenberg and Von Hoff, 1986), кроме того, его включают в экспериментальные схемы высокодозной химиотерапии. Основные побочные эффекты — угнетение кроветворения, поражение миокарда и стоматит. Тошнота, рвота и алопеция менее выражены, чем при лечении доксорубицином. | ||
| Строка 68: | Строка 68: | ||
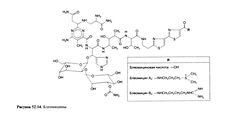
'''Строение'''. Блеомицины (рис. 52.14) — водорастворимые основные гликопептиды, содержащие пиримидиновое ядро, соединенное с пропионамидом, р-аминоаланинамидом, L-глюкозой и З-О-карбамоил-О-маннозой. Эта структура связывает в экви-малярном отношении ионы металлов, включая Си2+ и Fe +. К ядру последовательно присоединены трипептидная цепь, два тиа-зольных кольца и замещенный карбоксамид — фрагмент, связывающий ДНК. | '''Строение'''. Блеомицины (рис. 52.14) — водорастворимые основные гликопептиды, содержащие пиримидиновое ядро, соединенное с пропионамидом, р-аминоаланинамидом, L-глюкозой и З-О-карбамоил-О-маннозой. Эта структура связывает в экви-малярном отношении ионы металлов, включая Си2+ и Fe +. К ядру последовательно присоединены трипептидная цепь, два тиа-зольных кольца и замещенный карбоксамид — фрагмент, связывающий ДНК. | ||
| − | '''Механизм действия'''. Блеомицин имеет ряд любопытных биохимических свойств, но его цитотоксическое действие связано с окислением дезоксирибозы | + | '''Механизм действия'''. Блеомицин имеет ряд любопытных биохимических свойств, но его цитотоксическое действие связано с окислением дезоксирибозы цТМФ и других нуклеотидов с образованием одно- и двухцепочечных разрывов ДНК. In vitro блеомицин вызывает задержку клеток в периоде G2, во многих из них возникают хромосомные аберрации, включая разрывы, делеции, фрагментацию, а также транслокации (Twentyman, 1983). |
Блеомицин вызывает разрывы ДНК в присутствии ионов Fe‘+ и кислорода. In vitro комплекс препарата с железом активируется при наличии кислорода и восстановителя (например, дитиотреитола) и, действуя аналогично церулоплазмину (фер-рооксидазе), переносит электроны с Fe на кислород, образуя свободные радикалы (Burger et al., 1986; Burger, 1998). Активация блеомицина может происходить и при участии флавопро-теида НАДФН-оксидазы. Другая часть молекулы блеомицина связывается с ДНК; таким образом, возникающие свободные радикалы окисляют дезоксирибозу, разрушая цепи ДНК (Grol-lmanetal., 1985). | Блеомицин вызывает разрывы ДНК в присутствии ионов Fe‘+ и кислорода. In vitro комплекс препарата с железом активируется при наличии кислорода и восстановителя (например, дитиотреитола) и, действуя аналогично церулоплазмину (фер-рооксидазе), переносит электроны с Fe на кислород, образуя свободные радикалы (Burger et al., 1986; Burger, 1998). Активация блеомицина может происходить и при участии флавопро-теида НАДФН-оксидазы. Другая часть молекулы блеомицина связывается с ДНК; таким образом, возникающие свободные радикалы окисляют дезоксирибозу, разрушая цепи ДНК (Grol-lmanetal., 1985). | ||
| Строка 82: | Строка 82: | ||
Блеомицин хорошо помогает при герминогенных опухолях яичка и яичников. Его сочетание с цисплатином и этопозидом или винбластином позволяет излечивать опухоли яичка (Williams and Einhom, 1985); в комбинации с цисплатином и другими препаратами он высокоэффективен при плоскоклеточном раке, включая опухоли головы и шеи, пищевода и половых органов. Блеомицин часто включают в состав схем полихимиотерапии лимфогранулематоза и лимфом. | Блеомицин хорошо помогает при герминогенных опухолях яичка и яичников. Его сочетание с цисплатином и этопозидом или винбластином позволяет излечивать опухоли яичка (Williams and Einhom, 1985); в комбинации с цисплатином и другими препаратами он высокоэффективен при плоскоклеточном раке, включая опухоли головы и шеи, пищевода и половых органов. Блеомицин часто включают в состав схем полихимиотерапии лимфогранулематоза и лимфом. | ||
| − | '''Побочные эффекты'''. Блеомицин мало влияет на кроветворение и поэтому хорошо сочетается с другими цитостатиками. В то же время он вызывает поражение кожи, включая гиперпигментацию, гиперкератоз, эритему и даже изъязвление. Вначале возникают болезненность и отек кончиков пальцев, переходящие в покраснение и изъязвление кожи над локтевыми и межфаланговыми суставами и другими участками сдавления кожи. После заживления часто остается гиперпигментация, и при последующем лечении другими противоопухолевыми препаратами указанные явления могут возобновляться. | + | '''Побочные эффекты'''. Блеомицин мало влияет на кроветворение и поэтому хорошо сочетается с другими цитостатиками. В то же время он вызывает поражение кожи, включая гиперпигментацию, гиперкератоз, эритему и даже изъязвление. Вначале возникают болезненность и отек кончиков пальцев, переходящие в покраснение и изъязвление кожи над локтевыми и межфаланговыми суставами и другими участками сдавления кожи. После заживления часто остается гиперпигментация, и при последующем лечении другими противоопухолевыми препаратами указанные явления могут возобновляться.[[Image:Gm52_14.jpg|250px|thumb|right|Рнсунок 52.14. Блеомицины.]] |
| − | |||
| − | Рнсунок 52.14. Блеомицины. | ||
Основное побочное действие блеомицина — поражение легких, вплоть до угрожающего жизни пневмосклероза. Вначале появляются сухой кашель и крепитация, а на рентгенограмме — диффузная инфильтрация в нижних отделах легких, напоминающая интерстициальную пневмонию и раковый лимфангиит. В дальнейшем могут появиться пневмосклероз, полости в легких, ателектазы (вплоть до долевых) и даже ограниченные затемнения легочных полей. Блеомицин вызывает поражение легких в 5—10% случаев, причем 1% больных умирает именно от этого осложнения. У большинства больных, перенесших пневмонит, функция легких обычно значительно улучшается, но пневмосклероз бывает необратимым (Van Barneveld et al., 1987). Исследование функции внешнего дыхания не позволяет выявить поражение легких на ранней стадии; в частности, диффузионная способность легких снижается лишь при общей дозе блеомицина выше 250 мг. Риск поражения легких зависит от дозы и резко возрастает при дозах выше 250 мг. Другие факторы риска — возраст старше 70 лет, сопутствующие болезни легких, а также разовые дозы выше 30 мг/м2. Высокая во время анестезии или И ВЛ могут вызвать или усугубить поражение легких у больных, ранее получавших блеомицин. Специфических методов лечения этого осложнения нет, проводится обычная симптоматическая терапия. Эффективность глюкокортикоидов не доказана. Согласно экспериментам на крысах, важную роль в патогенезе данного осложнения играют цитокины (трансформирующий фактор роста Р и ФНОа), выделяемые макрофагами в ответ на апоптоз легочного эпителия (Mungeret al., 1999). | Основное побочное действие блеомицина — поражение легких, вплоть до угрожающего жизни пневмосклероза. Вначале появляются сухой кашель и крепитация, а на рентгенограмме — диффузная инфильтрация в нижних отделах легких, напоминающая интерстициальную пневмонию и раковый лимфангиит. В дальнейшем могут появиться пневмосклероз, полости в легких, ателектазы (вплоть до долевых) и даже ограниченные затемнения легочных полей. Блеомицин вызывает поражение легких в 5—10% случаев, причем 1% больных умирает именно от этого осложнения. У большинства больных, перенесших пневмонит, функция легких обычно значительно улучшается, но пневмосклероз бывает необратимым (Van Barneveld et al., 1987). Исследование функции внешнего дыхания не позволяет выявить поражение легких на ранней стадии; в частности, диффузионная способность легких снижается лишь при общей дозе блеомицина выше 250 мг. Риск поражения легких зависит от дозы и резко возрастает при дозах выше 250 мг. Другие факторы риска — возраст старше 70 лет, сопутствующие болезни легких, а также разовые дозы выше 30 мг/м2. Высокая во время анестезии или И ВЛ могут вызвать или усугубить поражение легких у больных, ранее получавших блеомицин. Специфических методов лечения этого осложнения нет, проводится обычная симптоматическая терапия. Эффективность глюкокортикоидов не доказана. Согласно экспериментам на крысах, важную роль в патогенезе данного осложнения играют цитокины (трансформирующий фактор роста Р и ФНОа), выделяемые макрофагами в ответ на апоптоз легочного эпителия (Mungeret al., 1999). | ||
| Строка 92: | Строка 90: | ||
=== Митомицин === | === Митомицин === | ||
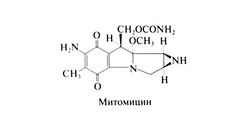
| − | В 1958 г. Вакаки и сотр. выделили митомицин (митомицин С) из культуры Streptomyces caespitosus. Основу митомицина составляет митозановое ядро; он включает хиноновое и этилени-миновое кольца, каждое из которых участвует в алкилирован и и ДНК. Структурная формула митомицина следующая: | + | В 1958 г. Вакаки и сотр. выделили митомицин (митомицин С) из культуры Streptomyces caespitosus. Основу митомицина составляет митозановое ядро; он включает хиноновое и этилени-миновое кольца, каждое из которых участвует в алкилирован и и ДНК. Структурная формула митомицина следующая:[[Image:Gm1103.jpg|250px|thumb|right|Структурная формула митомицина]] |
| − | '''Механизм действия'''. Митомицин активируется в клетке путем ферментативного или спонтанного восстановления хинонового кольца и отщепления метоксигруппы и становится моно-или бифункциональным алкилирующим средством (Verweij et al., 2001). In vitro восстановление наблюдалось преимущественно в условиях гипоксии. Митомицин образует сшивки | + | '''Механизм действия'''. Митомицин активируется в клетке путем ферментативного или спонтанного восстановления хинонового кольца и отщепления метоксигруппы и становится моно-или бифункциональным алкилирующим средством (Verweij et al., 2001). In vitro восстановление наблюдалось преимущественно в условиях гипоксии. Митомицин образует сшивки ДНК между атомом N-6 аденина и атомами 0-6 или N-7 гуанина, нарушает репликацию, вызывает одно- и двухцепочечные разрывы ДНК. Он обладает сильным радиосенсибилизирующим действием, а у грызунов оказывает тератогенное и канцерогенное действие. Механизмы устойчивости включают нарушение активации, инактивацию восстановленного хинонового кольца и выведение из клетки под действием Р-гликопротеида (Dorr, 1988; Crooke and Bradner, 1976). |
'''Фармакокинетика'''. При приеме внутрь митомицин не всегда хорошо всасывается, поэтому его назначают в/в. Введение в дозе 20 мг/м2 создает максимальную сывороточную концентрацию 0,4 мкг/мл; Т|/2составляет 25—90 мин (Dorr, 1988). Митомицин распределяется по всему организму, кроме ЦНС. Его инактивация происходит путем разрушения или конъюгации, менее 10% активного препарата выводится с мочой и желчью в неизмененном виде. | '''Фармакокинетика'''. При приеме внутрь митомицин не всегда хорошо всасывается, поэтому его назначают в/в. Введение в дозе 20 мг/м2 создает максимальную сывороточную концентрацию 0,4 мкг/мл; Т|/2составляет 25—90 мин (Dorr, 1988). Митомицин распределяется по всему организму, кроме ЦНС. Его инактивация происходит путем разрушения или конъюгации, менее 10% активного препарата выводится с мочой и желчью в неизмененном виде. | ||
| − | '''Применение'''. Митомицин вводят по 6—10 мг/м2 в/в струйно с интервалами в 6 нед, обычно в сочетании с другими | + | '''Применение'''. Митомицин вводят по 6—10 мг/м2 в/в струйно с интервалами в 6 нед, обычно в сочетании с другими цитостатиками. В дальнейшем дозу корректируют в зависимости от картины крови. Попадание препарата в подкожную клетчатку вызывает тяжелые местные реакции. Кроме того, митомицин применяется внутрипузырно при поверхностных опухолях мочевого пузыря (Boccardo et al., 1994). |
Различные сочетания митомицина с фторурацилом, цисплатином и доксорубицином используют при раке шейки матки, желудка, толстой кишки, молочной железы, мочевого пузыря, легкого и опухолях головы и шеи. Митомицин обладает радиосенсибилизирующим действием, поэтому сочетания химиотерапии митомицином с лучевой терапией продолжают привлекать внимание исследователей. | Различные сочетания митомицина с фторурацилом, цисплатином и доксорубицином используют при раке шейки матки, желудка, толстой кишки, молочной железы, мочевого пузыря, легкого и опухолях головы и шеи. Митомицин обладает радиосенсибилизирующим действием, поэтому сочетания химиотерапии митомицином с лучевой терапией продолжают привлекать внимание исследователей. | ||
'''Побочные эффекты'''. Основное значение имеет угнетение кроветворения с выраженными лейкопенией и тромбоцитопенией; на фоне высоких доз иногда наблюдается отсроченная кумулятивная панцитопения с восстановлением числа форменных элементов крови лишь через 6—8 нед. Наблюдаются также тошнота, рвота, понос, стоматит, дерматит, лихорадка и недомогание. Наиболее опасное побочное действие — гемолитико-уре-мический синдром, связанный с повреждением эндотелия: при общей дозе более 50 мг/м могут внезапно развиться гемолиз, неврологическая симптоматика, интерстициальная пневмония и повреждение почечных клубочков с ОПН. При общей дозе 70 мг/м2 и более риск ОПН достигает 28% (Valavaara and Nordman, 1985). Лечение гемолитико-уремического синдрома не разработано, переливание крови чревато отеком легких. Митомицин вызывает пневмосклероз; при общей дозе более 30 мг/м2 изредка возникает сердечная недостаточность (Verweij et al., 1988). Наконец, митомицин усиливает кардиотоксичность доксорубицина (Bachuret al., 1978). | '''Побочные эффекты'''. Основное значение имеет угнетение кроветворения с выраженными лейкопенией и тромбоцитопенией; на фоне высоких доз иногда наблюдается отсроченная кумулятивная панцитопения с восстановлением числа форменных элементов крови лишь через 6—8 нед. Наблюдаются также тошнота, рвота, понос, стоматит, дерматит, лихорадка и недомогание. Наиболее опасное побочное действие — гемолитико-уре-мический синдром, связанный с повреждением эндотелия: при общей дозе более 50 мг/м могут внезапно развиться гемолиз, неврологическая симптоматика, интерстициальная пневмония и повреждение почечных клубочков с ОПН. При общей дозе 70 мг/м2 и более риск ОПН достигает 28% (Valavaara and Nordman, 1985). Лечение гемолитико-уремического синдрома не разработано, переливание крови чревато отеком легких. Митомицин вызывает пневмосклероз; при общей дозе более 30 мг/м2 изредка возникает сердечная недостаточность (Verweij et al., 1988). Наконец, митомицин усиливает кардиотоксичность доксорубицина (Bachuret al., 1978). | ||
| + | |||
== Читайте также == | == Читайте также == | ||
Текущая версия на 23:44, 13 мая 2015
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Противоопухолевые антибиотики[править | править код]
Дактиномицин[править | править код]
Историческая справка. Первым антибиотиком, выделенным в кристаллическом виде из культуры стрептомицетов Streptomyces parvulus, стал актиномицин A (Waksman and Woodruff, 1940); в дальнейшем были получены и другие соединения, включая актиномицин D, или дактиномицин (Waksman Conference on Actinomycins, 1974). Последний обладает противоопухолевой активностью, особенно при хориокарциноме и некоторых опухолях у детей.
Структурно-функциональная зависимость. Актиномицины — это хромопептиды; обычно они содержат один и тот же хромофор — актиноцин (плоское производное феноксазона), придающий им оранжево-красный цвет. Природные актиномицины отличаются строением аминокислот, входящих в пептидные цепи. Путем добавления в питательную среду различных аминокислот удается менять тип актиномицина и его биологическую активность (Crooke, 1983). Структурная формула дактиномицина следующая:
Механизм действия. Цитотоксичность актиномицинов обусловлена способностью связываться с двойной спиралью ДНК. Объяснить действие дактиномицина позволило кристаллографическое исследование его комплекса с дезоксигуанозином (Sobell, 1973). Плоское феноксазоновое ядро вклинивается между соседними парами гуанин—цитозин и цитозин—гуанин, а пептидные цепи располагаются в малых бороздках ДН К. В результате образуется очень стойкий комплекс препарата с ДНК, блокирующий прежде всего транскрипцию: РНК-псшимеразы значительно более чувствительны к дактиномицину, чем ДНК-полимеразы. Кроме того, дактиномицин вызывает одноцепочечные разрывы ДНК, что может быть связано с образованием свободных радикалов или ингибированием ДНК-топоизомераз (Waksman Conference on Actinomycins, 1974; Goldberg et al., 1977).
Дактиномицин действует на быстро делящиеся нормальные и опухолевые клетки; это один из наиболее мощных противоопухолевых препаратов. У экспериментальных животных он приводит к атрофии тимуса, селезенки и других лимфоидных органов. Дактиномицин вызывает алопецию. Попадание в ткани ведет к выраженной воспалительной реакции. На участках кожи, облученных до, во время или после лечения дактиномицином, иногда возникает эритема и даже может развиться некроз. Фармакокинетика. Дактиномицин вводят в/в, так как при приеме внутрь его активность резко снижается. Препарат почти не метаболизируется и выводится с желчью и мочой. Конечный Т1/2 составляет 36 ч. Дактиномицин не проникает через гемато-энцефалический барьер.
Применение. Стандартная схема введения дактиномицина — 10—15 мкг/кг ежедневно в течение 5 сут, в отсутствие побочного эффекта проводят следующие курсы с интервалами в 2—4 нед. Детям препарат вводят по 0,1— 0,4 мг/сут в течение 5 сут; в других схемах — по 3—6 мкг/кг/сут до суммарной дозы 125 мкг/кг, далее в качестве поддерживающей терапии по 7,5 мкг/кг еженедельно. Дактиномицин безопаснее вводить в виде инфузии через венозный катетер; допустимы и инъекции, но только новой иглой (не той, что использовали при разведении препарата), так как даже в небольшом количестве препарат вызывает некроз окружающих тканей.
Дактиномицин применяют прежде всего у детей при рабдомиосаркоме и нефробластоме: в сочетании с другими препаратами, особенно винкристином и циклофосфамидом, а также лучевой терапией и операцией он нередко позволяет добиться излечения (Pinkel and Howarth, 1985). Препарат эффективен при саркоме Юинга, саркоме мягких тканей, саркоме Капоши и поздних стадиях хориокарциномы. В сочетании с хлорамбуцилом и метотрексатом он активен при метастазирующих опухолях яичка, однако эта схема по эффективности уступает комбинации винбластина или этопозида с цисплатином и блеомицином. Дактиномицин не нашел применения при других злокачественных новообразованиях у взрослых, хотя иногда к нему бывают чувствительны лимфогранулематоз и лимфомы. Дактиномицин применяют и как иммунодепрессант, особенно для профилактики отторжения трансплантированной почки.
Побочные эффекты. Дактиномицин вызывает потерю аппетита, тошноту и рвоту, обычно через несколько часов после введения. В 1-ю неделю после окончания лечения развивается угнетение кроветворения вплоть до панцитопении. Часто наблюдаются проктит, понос, глоссит, хейлит и стоматит. Облучение кожи одновременно или после лечения дактиномицином вызывает эритему, воспаление, шелушение и гиперпигментацию. Характерна алопеция; наконец, попадание препарата в ткани вызывает тяжелую местную реакцию.
Антрациклины[править | править код]
Антрациклины и их производные относятся к наиболее мощным противоопухолевым препаратам. Даунорубицин и доксорубицин выделяют из культур Streptomyces peucetius caesius, идарубицин получают синтетическим путем. Эти препараты мало различаются построению, но даунорубицин и идарубицин используют главным образом при острых лейкозах, тогда как спектр активности доксорубицина шире и включает многие солидные опухоли. Существенным недостатком антрациклинов является их кардиотоксичность, приводящая к развитию дилатационной кардиомиопатии, часто необратимой. Это нетипичное для противоопухолевых препаратов побочное действие зависит от общей дозы препарата. В поисках более активных и менее кардиотоксичных препаратов были синтезированы сотни антрациклинов и близких построению веществ. Некоторые из них нашли клиническое применение: идарубицин — при лейкозах, эпирубицин — при солидных опухолях, митоксантрон (антрацендион, значительно менее кардиотоксичный, чем антрациклины) — при раке предстательной железы, лейкозах и для высокодозной химиотерапии (Arlin et al., 1990; Feldman etal., 1993; Berman etal., 1991; Wiemik etal., 1992; Launchbury and Habboubi, 1993).
Структурно-функциональная зависимость. Антрациклины содержат тетрациклическое ядро и моносахарид даунозамин, соединенный с ядром гликозидной связью. Благодаря сопряженным хиноновому и гидрохиноновому кольцам он легко окисляется и восстанавливается. Доксорубицин и даунорубицин сильно разнятся по спектру активности, но их формулы отличаются лишь одной гидроксигруппой у атома С-14. Идарубицин — синтетический аналог даунорубицина без метоксигрулпы у атома С-4 (в 1-м кольце). Структурные формулы доксорубицина, даунорубицина, эпирубицина и идарубицина следующие:
Механизм действия. Описано несколько биохимических нарушений, вызываемых антрациклинами и антрацендионами, каждое из которых или все в совокупности могут лежать в основе лечебного и токсического действия этих препаратов. Антрациклины и их аналоги вклиниваются в молекулу ДНК, вызывая нарушение репликации и транскрипции, одно- и двухцепочечные разрывы ДНК, сестринские хроматидные обмены, оказывая тем самым мутагенное и канцерогенное действие на клетку. Разрывы ДНК возникают за счет связывания противоопухолевых препаратов с комплексом, состоящим из ДНК-топоизомеразы II и ДНК, что препятствует устранению разрывов ДНК, созданных ферментом (Tewey et al., 1984). Благодаря хиноно-вым группам антрациклины образуют свободные радикалы в растворе, а также в нормальных и опухолевых клетках (Gewirtz, 1999; Ikeda et al., 1999). В присутствии НАДФН они восстанавливаются НАДФН-оксидазой в нестабильные семихиноны, которые быстро реагируют с кислородом, образуя супероксидные радикалы. Последние способны превращаться в перекись водорода и гидроксильные радикалы, которые окисляют азотистые основания ДНК (Serrano etal., 1999). Выработка свободных радикалов существенно ускоряется при взаимодействии доксорубицина с ионами железа (Myers, 1988). Кроме того, внутримолекулярный перенос электронов в семихиноновых радикалах способствует образованию перекисей липидов, окиси азота и других высокореактивных соединений. В защите клеток от токсического действия антрациклинов важную роль играют ферменты, в частности супероксиддисмутаза и катал аза. Действие этих ферментов усиливают экзогенные антиоксиданты (а-то-коферол) и вещества, связывающие железо, например дексразоксан — препарат, снижающий кардиотоксичность антрациклинов (Speyer etal., 1988; Swain etal., 1997). Наконец, антрациклины реагируют с клеточной мембраной, нарушая ее функцию за счет образования перекисей липидов, — этот механизм может иметь значение как для противоопухолевой активности, так и для кардиотоксичности данных препаратов (Tritton et al., 1978).
Антрациклины вызывают апоптоз путем активации белка р’53 и каспаз (внутриклеточных протеаз); в этом процессе участвуют также церамид (продукт разрушения сфинголипидов) и рецептор CD95 (белок Fas) (Friesen et al., 1996; JafTrezou et al., 1996).
Как упоминалось выше, под действием антрациклинов опухолевые клетки могут приобрести полирезистентность. Она вызвана амплификацией гена АВСВ1, который кодирует Р-глико-п роте ид, выводящий эти и другие противоопухолевые препараты из клетки (Endicott and Ling, 1989). Антрациклины выводятся из клетки и белками-переносчиками семейства MRP (Doyle et al., 1998). Дополнительные механизмы устойчивости включают повышение активности глутатионпероксидазы (Sinha et al., 1989) и снижение активности ДНК-топоизомеразы II (Deffieet al., 1989; Jarvinen et al., 1998).
Фармакокинетика. Обычно антрациклины вводят в/в. Они метаболи зируются в печени и выделяются с желчью. Элиминация доксорубицина осуществляется в несколько фаз; промежуточный Т1/2 составляет 3 ч, конечный — около 30 ч. Конечный T1/2 идаруби ци на достигает лишь 15 ч, но Т1/2 его активного метаболита, идарубицинола — около 40 ч. Антрациклины быстро распределяются в сердце, почках, легких и селезенке, но не проникают через гематоэнцефалический барьер.
Доксорубицин и даунорубицин превращаются в менее активные и неактивные метаболиты — соответствующие спирты (доксорубицинол и даунорубицинол), агликоны (продукты отщепления моносахарида) и другие вещества. Из идарубицина прежде всего образуется близкий к нему по активности идарубицинол, который накапливается в плазме. Четкие рекомендации по снижению доз при печеночной недостаточности не разработаны, однако у таких больных клиренс антрациклинов снижается, и при гипербилирубинемии лечение следует начинать не более чем с половинной дозы (Twelves et al., 1998). Идарубицин назначают в/в по 12 мг/м ежедневно в течение 3 сут (в сочетании с цитарабином). Как и другие антрациклины, идарубицин вводят осторожно в течение 10— 15 мин, чтобы избежать попадания в подкожную клетчатку.
Даунорубицин[править | править код]
Применение. Даунорубицин назначают в/в до 30—60 мг/м2 ежедневно в течение 3 сут. Нельзя допускать попадания препарата в подкожную клетчатку, так как это вызывает ее некроз. Липосомный даунорубицин применяют для лечения саркомы Капоши при СПИДе; еГо вводят в дозе 40 мг/м2 путем в/в инфузии в течение 60 мин с интервалами в 2 нед. Больного предупреждают, что даунорубицин может придавать моче красноватый оттенок.
Даунорубицин хорошо помогает при остром лимфо-пейкозе и миелолейкозе. Сочетание даунорубицина или идарубицина с цитарабином — основная схема химиотерапии острого миелолейкоза.
Побочные эффекты. Даунорубицин и идарубицин вызывают угнетение кроветворения, стоматит, алопецию, поражение ЖКТ и кожи. Особое побочное действие этих препаратов — поражение миокарда с развитием тахикардии, аритмий, одышки, артериальной гипотонии, перикардиального выпота и сердечной недостаточности, устойчивой кдигоксину (см. ниже).
Доксорубицин[править | править код]
Применение. Доксорубицин вводят в дозе 50—75 мг/м2 путем быстрой в/в инфузии (не допуская попадания в подкожную клетчатку) с интервалами в 3 нед. Липосомный доксорубицин назначают при саркоме Капоши у больных СПИДом; его вводят в дозе 20 мг/м2 путем в/в инфузии в течение 30 мин с интервалами в 3 нед. Доксорубицин также придает моче красноватый оттенок.
Доксорубицин показан при лимфомах и острых лейкозах, но, в отличие от даунорубицина, он активен и в отношении солидных опухолей, прежде всего рака молочной железы. В сочетании с циклофосфамидом, винкристином, прокарбазином и другими препаратами он позволяет излечивать лимфогранулематоз и лимфомы. Доксорубицин — важный компонент схем полихимиотерапии рака молочной железы и мелкоклеточного рака легкого. Этот препарат активен при саркомах (остеогенной, Юинга, мягких тканей) у детей и взрослых, а также при раке тела и шейки матки, раке предстательной железы, опухолях головы и шеи, опухолях яичка и миеломной болезни.
Побочные эффекты. По токсичности доксорубицин близок к даунорубицину. Основное значение имеет угнетение кроветворения: лейкопения обычно достигает максимума на 2-й неделе лечения и исчезает к 4-й неделе; тромбоцитопения и анемия протекают аналогично, но, как правило, менее выражены. Характерны также обратимые стоматит, поражение ЖКТ и алопеция. В месте инъекции возможна аллергическая реакция в виде эритемы, которую следует отличать от реакции на попадание препарата в ткани. Изредка наблюдаются приливы, слезотечение и конъюнктивит. Возможно тяжелое поражение облученных органов (кожи, сердца, легких, пищевода, кишечника), даже при раздельном проведении лучевой и химиотерапии.
Особое побочное действие антрациклинов — поражение миокарда. Выделяют две его формы. Острая форма обычно легкая и быстро проходит. Для нее характерны отклонения на ЭКГ, включая аритмии и изменения сегмента ST и зубца Т. Изотопная вентрикулография указывает на острое преходящее снижение фракции выброса через 24 ч после однократного введения доксорубицина. В тяжелых случаях развивается миокардит с выраженными нарушениями проводимости и сердечной недостаточностью, часто в сочетании с перикардиальным выпотом. Хроническое кумулятивное поражение миокарда проявляется сердечной недостаточностью, устойчивой к дигоксину (доксорубициновая кардиомиопатия), и обычно возникает при общей дозе доксорубицина SS0 мг/м2 и более. Летальность превышает 50%. По результатам биопсий миокарда, это осложнение может вызвать даже общая доза 250 мг/м . При электронной микроскопии находят неспецифические признаки дистрофии кардиомиоцитов, включая снижение числа миофибрилл и изменения митохондрий. Многообещающий метод ранней диагностики этого осложнения — изотопная вентрикулография. Однако на сегодняшний день с уверенностью предсказать развитие тяжелой дилатационной кардиомиопатии невозможно: при общей дозе до 450 мг/м ее риск составляет 1—10% резко возрастая при дозе свыше 550 мг/м2 (> 20%). Превышать эту дозу допустимо лишь в крайних случаях, а также на фоне дексразоксана — кардиопротектора, превращающегося внутри клеток в комплексобразующее вещество (Speyer et al., 1988; Swain et al., 1997). Облучение сердца, высокодозная терапия циклофосфамидом и применение других антрациклинов повышают риск кардиомиопатии. Как у детей, так и у взрослых иногда наблюдается отсроченная дилатационная кардиомиопатия, с развитием сердечной недостаточности через несколько лет после химиотерапии (Lipschultz et al., 1991).
Новые аналоги доксорубицина. Валрубицин разрешен ФДА в 1998 г. для внутрипузырного введения при раке мочевого пузыря, устойчивом к вакцине БЦЖ, если цистэктомия сопряжена с неприемлемым риском осложнений и смерти. Эпирубицин (4'-эпи-доксорубицин) разрешен ФДА в 1999 г. для адъювантной химиотерапии рака молочной железы с метастазами в лимфоузлы.
Близкий по структуре антрацендион митоксантрон применяется при остром миелолейкозе. Структурная формула митоксантрона следующая:
По сравнению с доксорубицином митоксантрон в меньшей степени образует хиноновые свободные радикалы и потому менее кардиотоксичен. Он ингибирует ДНК-топоизомеразу И, вызывая разрывы ДНК, а также вклинивается в ДНК. Препарат активен при лейкозах, а также при раке молочной и предстательной желез (Shenkenberg and Von Hoff, 1986), кроме того, его включают в экспериментальные схемы высокодозной химиотерапии. Основные побочные эффекты — угнетение кроветворения, поражение миокарда и стоматит. Тошнота, рвота и алопеция менее выражены, чем при лечении доксорубицином.
Митоксантрон вводят в виде в/в инфузии. Для индукционной химиотерапии острого миелолейкоза его назначают по 12 мг/м /сут в течение 3 сут; эта схема включает также цитара-бин. В дозе 12—14 мг/м2 каждые 3 нед митоксантрон назначают при метастазирующем раке предстательной железы, устойчивом к гормональной терапии. В 2000 г. ФДА одобрило использование митоксантрона при тяжелом вторично-прогрессирую-щем рассеянном склерозе.
Блеомицин[править | править код]
Блеомицины — это группа антибиотиков, повреждающих ДНК. Умезава и сотр. впервые выделили их из культуры Streptomycesverticillus. Препарат блеомицин содержит смесь блеомицинов А2 и В2, которые представляют собой гликопептиды, связывающие медь. Блеомицины различаются только структурой концевого карбоксамида (рис. 52.14), которую можно изменить путем добавления в питательную среду различных аминов.
Интерес к блеомицинам привлекла их высокая активность при плоскоклеточном раке легкого, раке шейки матки, опухолях головы и шеи, а также при лимфомах и опухолях яичка. Эти препараты слабо подавляют кроветворение и иммунитет, однако вызывают необычное поражение кожи и легких. Поскольку блеомицины отличаются от других противоопухолевых препаратов по токсичности и механизму действия, они играют важную роль в полихимиотерапии.
Строение. Блеомицины (рис. 52.14) — водорастворимые основные гликопептиды, содержащие пиримидиновое ядро, соединенное с пропионамидом, р-аминоаланинамидом, L-глюкозой и З-О-карбамоил-О-маннозой. Эта структура связывает в экви-малярном отношении ионы металлов, включая Си2+ и Fe +. К ядру последовательно присоединены трипептидная цепь, два тиа-зольных кольца и замещенный карбоксамид — фрагмент, связывающий ДНК.
Механизм действия. Блеомицин имеет ряд любопытных биохимических свойств, но его цитотоксическое действие связано с окислением дезоксирибозы цТМФ и других нуклеотидов с образованием одно- и двухцепочечных разрывов ДНК. In vitro блеомицин вызывает задержку клеток в периоде G2, во многих из них возникают хромосомные аберрации, включая разрывы, делеции, фрагментацию, а также транслокации (Twentyman, 1983).
Блеомицин вызывает разрывы ДНК в присутствии ионов Fe‘+ и кислорода. In vitro комплекс препарата с железом активируется при наличии кислорода и восстановителя (например, дитиотреитола) и, действуя аналогично церулоплазмину (фер-рооксидазе), переносит электроны с Fe на кислород, образуя свободные радикалы (Burger et al., 1986; Burger, 1998). Активация блеомицина может происходить и при участии флавопро-теида НАДФН-оксидазы. Другая часть молекулы блеомицина связывается с ДНК; таким образом, возникающие свободные радикалы окисляют дезоксирибозу, разрушая цепи ДНК (Grol-lmanetal., 1985).
Механизмы устойчивости. Блеомицин разрушается ферментом блеомицингидролазой. Она содержится в различных тканях, включая печень, но в коже и легких ее активность низка (Sebti et al., 1987; Bromine et al., 19%). В некоторых клетках, устойчивых к блеомицину. активность этого фермента повышена (Sebti et al., 1991). В эксперименте найдены и другие механизмы устойчивости, включая ускоренную репарацию ДНК (Zuckerman et al., 1986), нарушение транспорта препарата в клетки и его инактивацию тиолами. Клиническое значение этих данных не ясно.
Фармакокинетика. Блеомицин вводят парентерально, а при раке мочевого пузыря — внутрипузырно (Bracken et al., 1977). После в/в введения экспериментальным животным высокая концентрация блеомицина создается в коже и легких — органах, с которыми связано основное побочное действие. Из-за высокой молекулярной массы блеомицин плохо проникает через гематоэнцефалический барьер.
После струйного в/в введения в дозе 15 мг/м2 максимальная сывороточная концентрация блеомицина достигает 1—5 мкг/мл. Т|/2 составляет около 3 ч. При длительной в/в инфузии по 30 мг/сут в течение 4—5 сут создается средняя сывороточная концентрация около 0,15 мкг/мл. Примерно 2/3 препарата выводится почками, вероятно, путем клубочковой фильтрации. При почечной недостаточности сывороточная концентрация блеомицина резко возрастает, повышая риск поражения легких, поэтому у таких больных дозу снижают (Dalgleish et al., 1984).
Применение. Блеомицин назначают по 10—20 мг/м2 в/в или в/м еженедельно или 2 раза в неделю. Кроме того, возможно введение п/к, внутриплеврально и внутрипузырно. При общей дозе выше 250 мг резко возрастает риск поражения легких, поэтому такие дозы следует применять с большой осторожностью. Впрочем, поражение легких иногда наблюдается и при более низких дозах (см. ниже).
Блеомицин хорошо помогает при герминогенных опухолях яичка и яичников. Его сочетание с цисплатином и этопозидом или винбластином позволяет излечивать опухоли яичка (Williams and Einhom, 1985); в комбинации с цисплатином и другими препаратами он высокоэффективен при плоскоклеточном раке, включая опухоли головы и шеи, пищевода и половых органов. Блеомицин часто включают в состав схем полихимиотерапии лимфогранулематоза и лимфом.
Побочные эффекты. Блеомицин мало влияет на кроветворение и поэтому хорошо сочетается с другими цитостатиками. В то же время он вызывает поражение кожи, включая гиперпигментацию, гиперкератоз, эритему и даже изъязвление. Вначале возникают болезненность и отек кончиков пальцев, переходящие в покраснение и изъязвление кожи над локтевыми и межфаланговыми суставами и другими участками сдавления кожи. После заживления часто остается гиперпигментация, и при последующем лечении другими противоопухолевыми препаратами указанные явления могут возобновляться.
Основное побочное действие блеомицина — поражение легких, вплоть до угрожающего жизни пневмосклероза. Вначале появляются сухой кашель и крепитация, а на рентгенограмме — диффузная инфильтрация в нижних отделах легких, напоминающая интерстициальную пневмонию и раковый лимфангиит. В дальнейшем могут появиться пневмосклероз, полости в легких, ателектазы (вплоть до долевых) и даже ограниченные затемнения легочных полей. Блеомицин вызывает поражение легких в 5—10% случаев, причем 1% больных умирает именно от этого осложнения. У большинства больных, перенесших пневмонит, функция легких обычно значительно улучшается, но пневмосклероз бывает необратимым (Van Barneveld et al., 1987). Исследование функции внешнего дыхания не позволяет выявить поражение легких на ранней стадии; в частности, диффузионная способность легких снижается лишь при общей дозе блеомицина выше 250 мг. Риск поражения легких зависит от дозы и резко возрастает при дозах выше 250 мг. Другие факторы риска — возраст старше 70 лет, сопутствующие болезни легких, а также разовые дозы выше 30 мг/м2. Высокая во время анестезии или И ВЛ могут вызвать или усугубить поражение легких у больных, ранее получавших блеомицин. Специфических методов лечения этого осложнения нет, проводится обычная симптоматическая терапия. Эффективность глюкокортикоидов не доказана. Согласно экспериментам на крысах, важную роль в патогенезе данного осложнения играют цитокины (трансформирующий фактор роста Р и ФНОа), выделяемые макрофагами в ответ на апоптоз легочного эпителия (Mungeret al., 1999).
Другие побочные эффекты блеомицина — лихорадка, головная боль, тошнота и рвота. При лимфомах бывает необычная молниеносная реакция на блеомицин с высокой лихорадкой, падением АД, остановкой дыхания и кровообращения. По-видимому, эта реакция отличается от типичной анафилактической; возможно, происходит выброс эндогенного пирогена. Такая реакция на блеомицин возникает примерно у 1% больных и иногда приводит к смерти, поэтому при лимфоме рекомендуют начинать лечение с пробной дозы блеомицина (l мг) и вводить полную дозу лишь после наблюдения в течение часа. Описаны случаи обострения ревматоидного артрита на фоне блеомицина. Сообщалось также о развитии синдрома Рейно и вазоспастической стенокардии у больных опухолями яичка, получавших блеомицин в составе полихимиотерапии.
Митомицин[править | править код]
В 1958 г. Вакаки и сотр. выделили митомицин (митомицин С) из культуры Streptomyces caespitosus. Основу митомицина составляет митозановое ядро; он включает хиноновое и этилени-миновое кольца, каждое из которых участвует в алкилирован и и ДНК. Структурная формула митомицина следующая:
Механизм действия. Митомицин активируется в клетке путем ферментативного или спонтанного восстановления хинонового кольца и отщепления метоксигруппы и становится моно-или бифункциональным алкилирующим средством (Verweij et al., 2001). In vitro восстановление наблюдалось преимущественно в условиях гипоксии. Митомицин образует сшивки ДНК между атомом N-6 аденина и атомами 0-6 или N-7 гуанина, нарушает репликацию, вызывает одно- и двухцепочечные разрывы ДНК. Он обладает сильным радиосенсибилизирующим действием, а у грызунов оказывает тератогенное и канцерогенное действие. Механизмы устойчивости включают нарушение активации, инактивацию восстановленного хинонового кольца и выведение из клетки под действием Р-гликопротеида (Dorr, 1988; Crooke and Bradner, 1976).
Фармакокинетика. При приеме внутрь митомицин не всегда хорошо всасывается, поэтому его назначают в/в. Введение в дозе 20 мг/м2 создает максимальную сывороточную концентрацию 0,4 мкг/мл; Т|/2составляет 25—90 мин (Dorr, 1988). Митомицин распределяется по всему организму, кроме ЦНС. Его инактивация происходит путем разрушения или конъюгации, менее 10% активного препарата выводится с мочой и желчью в неизмененном виде.
Применение. Митомицин вводят по 6—10 мг/м2 в/в струйно с интервалами в 6 нед, обычно в сочетании с другими цитостатиками. В дальнейшем дозу корректируют в зависимости от картины крови. Попадание препарата в подкожную клетчатку вызывает тяжелые местные реакции. Кроме того, митомицин применяется внутрипузырно при поверхностных опухолях мочевого пузыря (Boccardo et al., 1994).
Различные сочетания митомицина с фторурацилом, цисплатином и доксорубицином используют при раке шейки матки, желудка, толстой кишки, молочной железы, мочевого пузыря, легкого и опухолях головы и шеи. Митомицин обладает радиосенсибилизирующим действием, поэтому сочетания химиотерапии митомицином с лучевой терапией продолжают привлекать внимание исследователей.
Побочные эффекты. Основное значение имеет угнетение кроветворения с выраженными лейкопенией и тромбоцитопенией; на фоне высоких доз иногда наблюдается отсроченная кумулятивная панцитопения с восстановлением числа форменных элементов крови лишь через 6—8 нед. Наблюдаются также тошнота, рвота, понос, стоматит, дерматит, лихорадка и недомогание. Наиболее опасное побочное действие — гемолитико-уре-мический синдром, связанный с повреждением эндотелия: при общей дозе более 50 мг/м могут внезапно развиться гемолиз, неврологическая симптоматика, интерстициальная пневмония и повреждение почечных клубочков с ОПН. При общей дозе 70 мг/м2 и более риск ОПН достигает 28% (Valavaara and Nordman, 1985). Лечение гемолитико-уремического синдрома не разработано, переливание крови чревато отеком легких. Митомицин вызывает пневмосклероз; при общей дозе более 30 мг/м2 изредка возникает сердечная недостаточность (Verweij et al., 1988). Наконец, митомицин усиливает кардиотоксичность доксорубицина (Bachuret al., 1978).