Ожирение у женщин — различия между версиями
Django (обсуждение | вклад) (→Ожирение у девушек в период полового созревания) |
Django (обсуждение | вклад) (→Ожирение и климакс у женщин) |
||
| Строка 17: | Строка 17: | ||
'''Читайте также:''' [[Ожирение у девушек в период полового созревания]] | '''Читайте также:''' [[Ожирение у девушек в период полового созревания]] | ||
| − | + | '''Читайте также:''' [[Ожирение и климакс у женщин]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
=== Особенности распределения жира === | === Особенности распределения жира === | ||
Версия 02:27, 19 августа 2014
Содержание
Жировая ткань и половые органы
Данная тема стала актуальной после открытий, посвященных исследованию функции жировой ткани, в которой синтезируются гормоны, пептиды и другие биологически активные вещества, оказывающие ауто-, пара- и эндокринные воздействия.
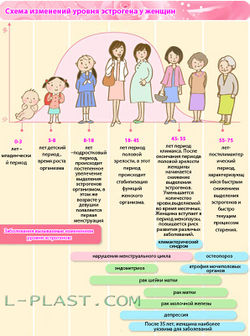
Характер распределения жира у женщин в основном определяется гормонами половых желез и коры надпочечников, важную роль играет конверсия андрогенов в эстрогены в жировой ткани.
Для репродуктивной системы женщины существуют три основных периода «испытаний», которые характеризуются тремя «М»:
— менархе;
— менструации;
— менопауза.
Также значимыми «испытаниями» являются беременность и роды. Именно в эти периоды важны оптимальное физиологическое взаимоотношение между жировой тканью и половыми гормонами.
Читайте также: Ожирение у девушек в период полового созревания
Читайте также: Ожирение и климакс у женщин
Особенности распределения жира
Воздействие половых гормонов на жировую ткань проявляется в особенностях распределения жира в различные периоды жизни женщины. Как уже отмечалось, для репродуктивного возраста в области бедер и ягодиц характерны более высокая активность липопротеинлипазы, низкая активность липолиза и гиноидное распределение жира. На фоне дефицита половых гормонов липопротеинлипаза не стимулируется и адипоциты жировой ткани бедренно-ягодичной области уже не служат источником запасов энергии в организме.
Однако в подкожной абдоминальной и особенно висцеральной жировой ткани идет интенсивный липолиз.
Как потеря массы тела, так и значительная ее прибавка в равной степени могут вести к нарушению функции репродуктивной системы женщины. Клинически это может проявляться нарушением менструального цикла от редких менструаций до аменореи. При избыточной массе тела могут также наблюдаться ациклические маточные кровотечения, ановуляция и бесплодие. При ожирении и беременности могут наблюдаться невынашивание беременности, гестационный диабет, преэклампсия, родовые травмы, тромбофилии.
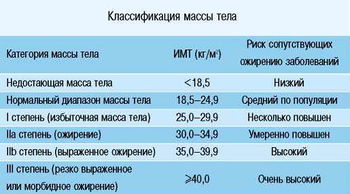
Индекс массы тела
Для характеристики массы тела наибольшее распространение в настоящее время получил (ИМТ) — это отношение массы тела в кг к квадрату роста, выраженного в метрах. В табл. 1 представлена международная классификация массы тела.
Различают избыточное отложение жира в области бедер и ягодиц или гиноидное, характерное для женщин, а также избыточное накопление жира в области туловища, и особенно живота, или висцеральное (абдоминальное) ожирение
В настоящее время на нашей планете отмечается пандемия ожирения. В России 30—40% женщин и 10—20% мужчин болеют ожирением (С.А. Бутрова). Каждый 10-й ребенок на Земле страдает ожирением.
К пренатальным факторам риска ожирения относятся:
Со стороны матери:
— ожирение;
— значительная прибавка массы тела при беременности;
— курение;
— диабет.
Со стороны плода:
— большой вес при рождении;
— низкий вес при рождении;
— искусственное вскармливание.
Метаболический синдром
Метаболический синдром (МС) — это совокупность метаболических нарушений, основными из которых являются:
— прибавка массы тела с формированием абдоминального ожирения,
— инсулинорезистентность и дислипидемия.
Другие метаболические проявления, которые могут наблюдаться при метаболическом синдроме, — это микроальбуминурия и нарушения в системе фибринолиза и коагуляции.
В 2005 г. Всемирная федерация по диабету предложила новое определение метаболического синдрома, согласно которому МС диагностируется при наличии центрального ожирения (объем талии (ОТ) >94 см у мужчин и >80 см у женщин) в сочетании как минимум с 2 из следующих нарушений:
— повышенные уровни триглицеридов: >1,7 ммоль/л (150 мг/дл);
— пониженные уровни ХС-ЛПВП: <1,04 ммоль/л (40 мг/дл) — у мужчин; <1,29 ммоль/л (50 мг/дл) — у женщин;
— повышенное АД: >130/85 мм рт. ст.;
— гипергликемия натощак: >5,6 ммоль/л (100 мг/дл);
— установленный ранее сахарный диабет или нарушение толерантности к глюкозе.
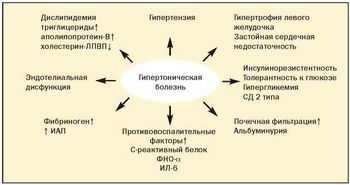
Абдоминальное (висцеральное) ожирение — основной клинический симптом метаболического синдрома, которое является важным фактором риска сердечно-сосудистых и других заболеваний (рис. 1).
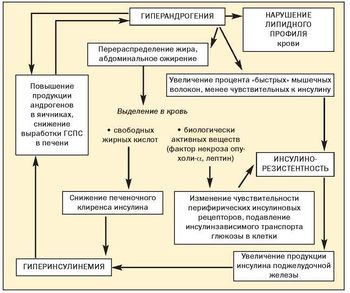
До настоящего времени не прекращается дискуссия о первичности или вторичности инсулинорезистентности и гиперандрогении при метаболическом синдроме (рис. 2).
Полагают, что повышение уровней провоспалительных цитокинов (ФНО-а, ИЛ-6) в жировой ткани может вести к дисфункции эндотелия, оксидативному стрессу, способствуя атеросклеротическим изменениям и развитию инсулинорезистентности. Единственным защитным фактором является адипонектин — антиатерогенный фактор, синтезируемый адипоцитами. Он оказывает следующие эффекты:
— уменьшает инсулинорезистентность;
— снижает поступление жирных кислот в печень;
— способствует снижению продукции глюкозы печенью и синтеза триглицеридов ЛПОНП;
— в мышечной ткани улучшает чувствительность к инсулину;
— тормозит адгезию моноцитов и тромбоцитов к эндотелию.
Защитные антиатерогенные механизмы адипонектина утрачиваются при ожирении, особенно при абдоминально-висцеральном. Низкий уровень адипонектина в плазме крови предшествует инсулинорезистентности.
В последние годы принято выделять также менопаузальный метаболический синдром (ММС), который развивается на фоне возрастного снижения и выключения функции яичников. Критерии диагностики его соответствуют вышеизложенным критериям метаболического синдрома, однако важную роль играют данные анамнеза: значительная прибавка массы тела (5—10 кг) за короткий период времени (6—12 месяцев) в период постменопаузы.
Подходы к терапии ожирения
Выделяют два основных метода терапии ожирения: I — немедикаментозный и II — медикаментозный. Существует также возможность оперативного лечения.
I. Немедикаментозный подход к лечению ожирения:
Для эффективного лечения метаболического синдрома и ожирения необходимо:
— формирование и поддержание внутренней мотивации пациентки к снижению массы тела;
— постоянный контакт с пациенткой с постановкой и согласованием промежуточных целей лечения и контролем за их достижением.
Пациентка должна усвоить следующее:
— избыточная масса тела и ожирение требуют пожизненного и многопланового внимания;
— масса тела регулируется сложными биологическими механизмами и влияниями внешней среды. Ее избыток не является следствием отсутствия воли;
— даже умеренное снижение массы тела приводит к улучшению общего состояния;
— ненаучный подход мешает лечебному процессу;
— важно постепенное и стойкое снижение массы тела (около 8—10% в год) и формирование условий, способствующих поддержанию достигнутого результата.
Итак, немедикаментозное лечение включает: обучение больных, рациональное гипо- и эукалорийное питание, повышение физической активности, изменение образа жизни.
II. Патогенетической медикаментозной терапией МС является:
— селективный ингибитор обратного захвата серотонина и норадреналина — сибутрамин (Меридиа);
— препарат периферического воздействия — орлистат (Ксеникал).
Эффективность терапии сибутрамином (Меридиа)
При метаболическом синдроме эффективным средством является сибутрамин (Меридиа). Механизм действия сибутрамина заключается в избирательном ингибировании обратного захвата нейромедиаторов серотонина и норадреналина в синапсах нейронов центральной нервной системы, результатом чего являются более быстрое возникновение и пролонгирование чувства насыщения и, как следствие, уменьшение объема потребляемой пищи. Помимо усиления чувства насыщения Меридиа повышает расход энергии, стимулируя термогенез. Этот эффект обусловлен стимуляцией рз-адренорецепторов жировой ткани, ответственных за липолиз. Таким образом, Меридиа способствует восстановлению баланса энергии, уменьшая потребление пищи и увеличивая расход энергии.
Начальная доза Меридиа составляет 10 мг/сут — одна капсула 1 раз в сутки в первой половине дня независимо от приема пищи. Меридиа в дозе 15 мг/сут применяется в том случае, если в течение первого месяца лечения снижение веса составило менее 2 кг и у больных с сахарным диабетом 2 типа.
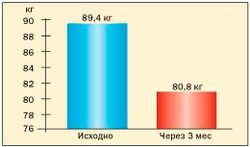
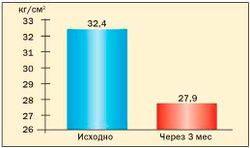
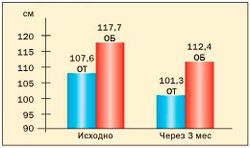
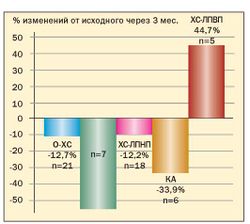
Опыт применения сибутрамина у молодых женщин с метаболическим синдромом и в постменопаузе в клинике гинекологической эндокринологии ФГУ «Научного центра акушерства, гинекологии и перинатологии Росмедтехнологий» представлен на рис. 3, 4, 5, 6 (Г.Е. Чернуха, И.Г. Шестакова).
Следует отметить, что наряду со снижением массы тела и нормализацией липидного спектра крови у подавляющего большинства женщин наблюдалось восстановление регулярных менструальных циклов (93,8%), овуляция отмечена у 36,7%.
В ходе исследования была отмечена хорошая переносимость препарата. Значительных изменений систолического и диастолического АД, а также частоты пульса на фоне приема Меридиа в дозах 10 и 15 мг нами не наблюдалось. Побочные эффекты (сухость во рту, запоры, тошнота), выявленные у 4% больных в течение первых 4 недель лечения, расценивались пациентками как умеренно выраженные и ни в одном случае не потребовали отмены препарата.
Результаты исследования свидетельствуют о высокой эффективности препарата Меридиа для лечения ожирения у женщин с МС. Применение сибутрамина в дозах 10 или 15 мг в течение 3 месяцев способствовало клинически значимой потере массы тела (в среднем на 9,1±2,4 кг), уменьшению ИМТ и количества абдоминального жира у 90 % больных. В ходе исследования установлено, что снижение массы тела у женщин с МС на фоне терапии Меридиа сопровождалось значительным улучшением липидного спектра крови, что является важным преимуществом препарата для данной группы больных, поскольку дислипидемия во многом определяет риск заболеваемости и смертности от сердечнососудистых заболеваний у женщин в постменопаузе.
Антидепрессанты в коррекции пищевого поведения
Больным с ожирением, у которых сниженная насыщаемость, эмоциогенное пищевое поведение сопровождаются тревожно-депрессивными расстройствами, паническими атаками, а также больным невротической булимией показаны антидепрессанты — селективные ингибиторы обратного захвата серотонина. Флуоксетин назначается в суточной дозе от 20 до 60 мг в течение трех месяцев, флу-воксамин — в суточной дозе от 50 до 100 мг в день также в течение трех месяцев. Данные препараты не рекомендованы FDA для лечения ожирения. Не доказан их эффект в отношении длительного удержания массы тела. Поэтому указанные средства предпочтительно назначать при наличии у пациентов с ожирением тревожно-депрессивных расстройств, панических атак и невротической булимии.
Заключение
Современного специалиста характеризует ясное понимание связи массы тела и гормонального статуса женщины. Врачу гинекологу в своей повседневной практике необходимо следующее:
• Своевременно диагностировать патологию массы тела и степень ее влияния на функцию женской репродуктивной системы.
• Знать и применять на практике современные подходы к коррекции массы тела и мотивации пациенток к здоровому образу жизни.
• Выбирать терапию с позиции эффективности, безопасности и улучшения качества жизни пациенток.
Читайте также
- Женская репродуктивная система
- Жировая ткань
- Эстрогены
- ПМС (предменструальный синдром) и спорт
- Ожирение
- Флуоксетин
Источники
ПОЛОВЫЕ ГОРМОНЫ И ЖИРОВАЯ ТКАНЬ. Сметник В.П. Ожирение и метаболизм. 2007. № 3. С. 17-22.