Хинолоны и мочевые антисептики
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Хинолоны
Первые препараты этой группы синтетических антимикробных средств, в частности налидиксовая кислота, уже много лет применяются для лечения инфекций мочевых путей. Из-за ограниченного числа показаний и быстрого развития устойчивости клиническая ценность старых препаратов относительно невелика. Появившиеся позднее фторированные производные хинолонов, такие, как ципрофлоксацин и офлоксацин, напротив, имеют очень большое терапевтическое значение, поскольку они обладают широким спектром действия и могут назначаться внутрь при многих инфекциях. Быстрое развитие устойчивости для фторхинолонов не характерно, а их побочные эффекты немногочисленны (Andriole, 1993; Hooper, 2000а).
Химические свойства
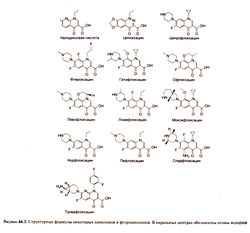
Препараты, которые сегодня применяют в США, представляют собой 4-хинолоны с карбоксильной группой в положении 3. Все фторхинолоны содержат атом фтора в положении 6, а некоторые из них — еще и пиперазиновое кольцо в положении 7 (рис. 44.3).
Механизм действия
Точки приложения хинолонов — бактериальные ферменты ДНК-гираза и ДНК-топоиэомераза IV (Driica and Zhao, 1997). У грамположительных бактерий (например. Staphylococcus aureus) основной мишенью служит ДНК-топоизомераза IV (Ng et al., 1996), а у неотрицательных (например, Escherichia coli) — ДНК-гираза (Hooper, 2000а; Alovero etal., 2000) Во время транскрипции и репликации ДНК цепи двойной спирали разъединяются. При этом происходит перекручивание двойной спирали с образованием положительных витков суперепирали. ДНК-гираза способствует раскручиванию ДНК переводя положительные витки суперспирали в отрицательные. Двойная спираль разрывается, через образовавшийся разрыв проходит сегмент ДН К, после чего цепи опять сшиваются (рис. 44.4). Процесс происходит с участием АТФ. ДНК-гираза Escherichia coli состоит из двух А-субъединиц с молекулярной массой 105 000 и двух В-субъединиц с молекулярной массой 95 000, которые кодируются соответственно генами gyrA иgyrB Мишенью хинолонов служит субъединица А, отвечающая за разрыв и сшивание двойной спирали ДНК. Концентрации которых эти препараты ингибируют ДНК-гиразу, соответствуют МПК (0,1 — 10 мкг/мл). В результате мутаций гена gyrA микроорганизмы могут приобретать устойчивость к хинолонам (Hooper, 2000а). У эукариот аналогом ДНК-гиразы служит ДНК-топоизомераза II, которая препятствует спутыванию молекул ДНК при репликации, устраняя положительные витки суперспирали. Хинолоны ингибируют ДНК-топоизомеразу эукариотических клеток только в очень высоких концентрациях (100—1000 мкг/мл).
ДНК-топоизомераза IV разделяет перекрученные между собой кольцевые молекулы ДНК, образующиеся при репликации. Этот фермент тоже состоит из четырех субъединиц, которые у Escherichia coli кодируются генами рагС и parE (Drlica and Zhao, 1997; Hooper, 2000a). Хинолоны препятствуют разъединению дочерних ДНК, подавляя активность ДНК-топоизомеразы IV (Cozzarelli, 1980).
Спектр действия
Фторхинолоны обладают высокой бактерицидной активностью в отношении Escherichia coli, а также многих видов Salmonella, Shigella, Enterobacter, Campylobacter и Neisseria (Eliopoulos and Eliopoulos, 1993). Минимальная концентрация фторхинолонов, при которой подавляется рост 90% штаммов этих микроорганизмов (МПКэд), обычно не превышает 0,2 мкг/мл. По отношению к Pseudomonas aeruginosa ципрофлоксацин более активен, чем норфлоксацин; МПК90 этих препаратов находятся в диапазоне от 0,5 до 6 мкг/мл. Фторхинолоны эффективны против стафилококков, в том числе метицил-линоустойчивых (МПК90 составляет 0,1—2 мкг/мл).
В отношении стрептококков активны только грепафлоксацин (в США изъят из продажи), левофлоксацин, гатифлоксацин, клинафлоксацин и моксифлоксацин (Hooper, 2000а; Eliopoulos and Eliopoulos, 1993). В терапевтических концентрациях фторхинолоны подавляют рост некоторых внутриклеточных бактерий — Chlamydia spp., Mycoplasma spp., Legionella spp., Brucella spp. и Mycobacterium spp., в том числе Mycobacterium tuberculosis (Le-ysen et al., 1989; Alangaden and Lemer, 1997). Для ципрофлоксацина, офлоксацина, пефлоксацина и спарфлоксацина МПК90 в отношении Mycobacterium fortuitum, Mycobacterium kansasii и Mycobacterium tuberculosis составляет 0,5—3 мкг/мл. У экспериментальных животных офлоксацин и пефлоксацин активны в отношении Mycobacterium leprae (Hooper, 2000а). Однако данных о клинической эффективности этих препаратов при микобактериальных инфекциях пока недостаточно.
Некоторые новые фторхинолоны — тровафлоксацин, гатифлоксацин, моксифлоксацин, клинафлоксацин и ситафлоксацин — активны в отношении анаэробов (Medical Letter, 2000).
Налидиксовая кислота и циноксацин бактерицидны в отношении большинства распространенных грамотрицательных возбудителей инфекций мочевых путей, хотя антимикробная активность этих препаратов невелика. Для большей части энтеробактерий бактерицидная концентрация налидиксовой кислоты составляет около 20 мкг/мл. На Pseudomonas aeruginosa налидиксовая кислота и циноксацин не действуют.
Устойчивость к хинолонам может возникать во время лечения в результате мутации генов, кодирующих ДНК-гиразу и ДНК-топоизомеразу IV (эти гены располагаются на хромосомах), или активного выведения препарата из клетки (Oethinger et al., 2000). Ферменты, инактивирующие фторхинолоны, у бактерий не обнаружены (Gold and Moellering, 1996; Ng et al., 1996; Okusu et al., 19%). С введением в практику фторхинолонов возникли и быстро распространились устойчивые к ним штаммы стафилококков и Pseudomonas spp. (Pegues et al., 1998; Peterson et al., 1998). Появляется все больше устойчивых штаммов Campylobacter jejuni, Salmonella spp., Neisseria gonorrhoeae и Streptococcus pneumoniae (Smith et al., 1999; Centers for Disease Control, 1994b; Thomsberry et al., 1997; MHbak et al., 1999).
Фармакокинетика
Хинолоны хорошо всасываются при приеме внутрь и легко проникают в ткани. Максимальная сывороточная концентрация после приема фторхинолонов в дозе 400 мг достигается через 1—3 ч и колеблется от 1,1 мкг/мл для спарфлоксацина до 6,4 мкг/мл для левофлоксацина. Максимальная сывороточная концентрация норфлоксацина относительно невелика, поэтому его применяют только при инфекциях мочевых путей. Прием пищи не снижает всасывание этих препаратов, но может увеличивать время достижения максимальной сывороточной концентрации. Взрослым внутрь фторхинолоны назначают в следующих дозах; офлоксацин и эноксацин — по 200—400 мг 2 раза в сутки, норфлоксацин и пефлоксацин — по 400 мг 2 раза в сутки, ломефлоксацин — по 400 мг 1 раз в сутки, ципрофлоксацин — по 250—750 мг 2 раза в сутки. Биодоступность всех фторхинолонов больше 50%, а у некоторых препаратов даже превышает 95%. Т1/2 колеблется от 3—5 ч для норфлоксацина и ципрофлоксацииа до 20 ч для спарфлоксацина. Фторхинолоны имеют большой объем распределения. При этом их концентрации в моче, почках, легких, ткани предстательной железы, кале, желчи, а также в макрофагах и нейтрофилах выше, чем в сыворотке, а в СМЖ, костной ткани и секрете предстательной железы — ниже. Концентрация пефлоксацина и офлоксацина в асцитической жидкости приближается к сывороточной. Ципрофлоксацин, офлоксацин и пефлоксацин проникают в молоко.
У разных хинолонов пути элиминации разные. Офлоксацин, ломефлоксацин и циноксацин преимущественно выводятся почками, в отличие от налидиксовой кислоты, пефлоксацина, спарфлоксацина, грепафлоксацина и тровафлоксацина. При почечной недостаточности необходимо уменьшать дозы циноксацина, норфлоксацина, ципрофлоксацииа, офлоксацина, энокса-цина и ломефлоксацина. Для налидиксовой кислоты, грепафлоксацина, тровафлоксацина и пефлоксацина коррекция дозы не требуется. При перитонеальном диализе и гемодиализе хинолоны почти не выводятся. Больным с печеночной недостаточностью не следует назначать тровафлоксацин, грепафлоксацин и пефлоксацин.
Побочные эффекты
Как правило, хинолоны переносятся хорошо (Lipsky and Baker, 1999). Из побочных эффектов чаще всего наблюдаются желудочно-кишечные нарушения: 3—17% больных жалуются на незначительную тошноту, рвоту и неприятные ощущения в животе. Понос и псевдомембранозный колит возникают редко. В 0,9—11% случаев развиваются побочные эффекты со стороны ЦНС, в основном легкая головная боль и головокружение. Изредка, обычно при одновременном приеме НПВС или теофиллина, появляются галлюцинации, эпилептические припадки и делирий. НПВС могут усиливать конкуренцию хинолонов за рецепторы ГАМК (Halliwell et al., 1993); у больных, одновременно получавших фенбуфен и эноксацин, возникали эпилептические припадки. Ципрофлоксацин, грепафлоксацин, пефлоксацин и эноксацин увеличивают сывороточную концентрацию теофиллина и усиливают его побочное действие за счет подавления метаболизма (Schwartz et al., 1988). Хинолоны могут вызвать сыпь и фотосенсибилизацию. В экспериментах на животных эти препараты повреждают растущие хрящи, а у детей могут вызвать боль и опухание суставов; поэтому детям и беременным хинолоны обычно не назначают. Однако у детей с муковисцидозом, принимавших ципрофлоксацин, норфлоксацин и налидиксовую кислоту, поражение суставов возникало редко и полностью исчезало после отмены препарата (Burkhardt et al., 1997). Поэтому в тех случаях, когда преимущества лечения значительно перевешивают риск побочного действия, назначение фторхинолонов детям может быть оправдано.
Изредка хинолоны вызывают лейкопению, эозинофилию и незначительное повышение активности аминотрансфераз. Нечастый, но опасный побочный эффект тровафлоксацина — тяжелое поражение печени, вплоть до печеночной недостаточности со смертельным исходом. Поэтому тровафлоксацин назначают только при тяжелых, угрожающих жизни инфекциях, когда польза от лечения заведомо перевешивает риск связанных с ним осложнений (Public Health Advisory, 1999). Темафлоксацин был снят с производства, поскольку примерно у 1 из 5000 больных, принимавших этот препарат, возникали острый гемолиз, почечная недостаточность, тромбоцитопения и ДВС-синдром. В редких случаях подобные побочные эффекты развиваются и при приеме других фторхинолонов. Грепафлоксацин (в США изъят из продажи) и спарфлоксацин могут вызывать удлинение корригированного интервала QT (QTc).
Применение
Инфекции мочевых путей
Налидиксовую кислоту и циноксацин применяют только при инфекциях мочевых путей, вызванных чувствительными к этим препаратам микроорганизмами. Фгорхинолоны намного активнее и обладают более широким спектром действия. Норфлоксацин разрешен к применению в США только при инфекциях мочевых путей. По данным сравнительных испытаний, норфлоксацин, ципрофлоксацин, офлоксацин и триметоприм/сульфаметоксазол одинаково эффективны при этих инфекциях (Stein et al., 1987; Hooper and Wolfson, 1991).
Простатит
В неконтролируемых испытаниях норфлоксацин, ципрофлоксацин и офлоксацин успешно применялись при простатите, вызванном чувствительными к этим препаратам микроорганизмами. Терапия фторхинолонами в течение 4—6 нед может оказаться эффективной при простатите, не поддающемся лечению триметопримом/сульфаметоксазолом (Hooper and Wolfson, 1991).
Заболевания, передающиеся половым путем
In vitro фторхинолоны активны в отношении Neisseria gonorrhoeae, Chlamydia trachomatis и Haemophilus ducreyi, но не действуют на Treponema pallidum. Следует помнить, что беременным фторхинолоны противопоказаны. При хламидийном уретрите или цервиците вместо недельного курса доксициклина или однократного приема азитромицина можно применять недельный курс офлоксацина или спарфлоксацина (другие фторхинолоны недостаточно эффективны). При гонорее однократное в/м введение цефтриаксона или однократный прием цефиксима можно заменить однократным приемом офлоксацина или ципрофлоксацина, хотя в последнее время все чаще встречаются устойчивые к фторхинолонам штаммы Neisseria gonorrhoeae (Centers for Disease Control, 1994b). При воспалительных заболеваниях матки и придатков назначают 2-недельный курс офлоксацина в сочетании с антибактериальным средством, активным в отношении анаэробов, — клиндамицином или метронидазолом (Centers for Disease Control and Prevention, 1998). Мягкий шанкр лечат цип-рофлоксацином или эноксацином в течение 3 сут.
Кишечные инфекции
При диарее путешественников (чаще всего она вызвана энтеротоксигенными штаммами Escherichia coli) фторхинолоны сокращают продолжительность поноса на 3 сут, не уступая по эффективности триметоприму/сульфаметоксазолу (DuPont and Ericsson, 1993). Пятидневный курс нор-флоксацина, ципрофлоксацина или офлоксацина успешно применяют при дизентерии, причем во многих случаях эффек-тивно и более короткое лечение (Bennish et al., 1992). Это заболевание одинаково успешно лечится ципрофлоксацином и азит-ромицином (Khan et al., 1997). Норфлоксацин сокращает продолжительность поноса при холере (Bhattacharya et al., 1990). Ципрофлоксацин и офлоксацин применяют при брюшном тифе, у больных СПИДом при других кишечных инфекциях, сопровождающихся бактериемией, а также при носительстве сальмонелл. При инфекциях, вызванных энтерогеморрагически-ми штаммами Escherichia coli, фторхинолоны не назначают, поскольку in vitro эти препараты увеличивают экспрессию гена stx2, кодирующего веротоксин — токсин, близкий к токсину Shigella dysenteriae (Miedouge et al., 2000).
Инфекции дыхательных путей
Раньше фторхинолоны не применяли при внебсшьничной пневмонии, поскольку ципрофлоксацин, офлоксацин и норфлоксацин малоактивны in vitro в отношении пневмококков и анаэробов. Современные препараты этой группы, в частности левофлоксацин, тровафлоксацин, гатифлоксацин, клинафлоксацин и моксифлоксацин, очень активны в отношении Streptococcus pneumoniae. По некоторым данным, по эффективности они не уступают р-лактамным антибиотикам (Aubieretal., 1998; File etal., 1997). Появляется все больше данных об эффективности монотерапии внебольнич-ной пневмонии современными фторхинолонами (Hooper, 2000а), хотя в последнее время появились устойчивые к этим препаратам штаммы пневмококков (Chen et al., 1999; Wortmann and Bennett, 1999). In vitro фторхинолоны активны и в отношении большинства других возбудителей инфекций дыхательных путей: Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella pneumophila. Наряду с азитромицином фторхинолоны (ципрофлоксацин или левофлоксацин) служат препаратами выбора при болезни легионеров (Yu, 2000). Фторхинолоны позволяют добиться исчезновения Haemophilus influenzae и Moraxella catarrhalis из мокроты. При легких и умеренных обострениях хронической псевдомонадной легочной инфекции у больных муковисцидозом эффективны фторхинолоны для приема внутрь. Инфекции костей, суставов и мягких тканей. При хроническом остеомиелите необходима длительная (в течение нескольких недель или месяцев) антимикробная терапия препаратами, активными в отношении Staphylococcus aureus и грамотрицатель-ных палочек. Фторхинолоны иногда вполне пригодны для этой цели, поскольку они обладают подходящим спектром действия и хорошо всасываются при приеме внутрь (Gentry and Rodrigu-ez-Gomez, 1991). Лечение этими препаратами проводят дольше и в более высоких дозах, чем при инфекциях мочевых путей. Так, ципрофлоксацин назначают по 500 мг (а в тяжелых случаях по 750 мг) 2 раза в сутки. Курс лечения составляет 4—6 нед, а иногда и дольше. При почечной недостаточности дозу ципрофлоксацина снижают. Как уже было сказано выше, беременным и детям фторхинолоны не назначают. По некоторым данным, эффективность фторхинолонов при остеомиелите, вызванном преимущественно грамотрицательными палочками, достигает 75% (Hooper, 2000а). Безуспешность лечения бывает обусловлена появлением устойчивых штаммов Staphylococcus aureus, Pseudomonas aeruginosa и Serratia marcescens. При диабетической стопе фторхинолоны используют в сочетании с антибиотиками, активными в отношении анаэробов, так как подобные инфекции обычно вызваны несколькими возбудителями, в том числе грамотрицательными палочками, анаэробами, стрептококками и стафилококками. Эффективность монотерапии ципрофлоксацином при диабетической стопе составляет (Peterson et al., 1989).
Прочие инфекции
В составе комбинированной терапии фторхинолоны используют при полирезистентном туберкулезе, а также у больных СПИДом при инфекциях, вызванных атипичными микобактериями и Mycobacterium avium-intracellulare (гл. 48).
У онкологических больных с нейтропенией и лихорадкой комбинированная терапия фторхинолонами и аминогликозидами столь же эффективна, как и комбинация р-лактамных антибиотиков с аминогликозидами, чего нельзя сказать о монотерапии фторхинолонами (Meunier et al., 1991). Профилактическое применение фторхинолонов при нейтропении снижает частоту бактериемии, вызванной грамотрицательными палочками (GIMEMA Infection Program, 1991). Прием внутрь ципрофлоксацина в сочетании с амоксициллином/клавуланатом — эффективная эмпирическая терапия при лихорадке у тех больных с возникшей на фоне химиотерапии нейтропенией, которые относятся к группе низкого риска тяжелой инфекции (Кеш et al., 1999; Freifeld et al., 1999). При перитоните у больных, находящихся на постоянном амбулаторном перитонеальном диализе, ципрофлоксацин и офлоксацин недостаточно эффективны, вероятно, из-за высокой МПК в отношении коагулазаотри-цательных стафилококков — распространенных возбудителей такого перитонита.
Мочевые антисептики
Мочевые антисептики подавляют рост многих видов бактерий. Для лечения системных инфекций эти препараты не назначают, поскольку в безопасных дозах они не достигают терапевтической концентрации в сыворотке. Зато мочевые антисептики можно принимать внутрь при инфекциях мочевых путей, так как эти препараты накапливаются в высоких концентрациях в почечных канальцах, чашечно-лоханочной системе и мочевом пузыре. Лечение мочевыми антисептиками можно считать местным, поскольку в других органах и тканях они не достигают терапевтических концентраций, за исключением отдельных случаев, рассмотренных ниже (Hooper, 2000b).
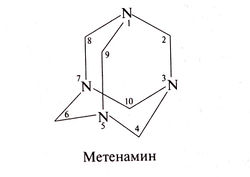
Метенамин
При распаде метенамина образуется формальдегид, который и обеспечивает антимикробное действие.
Химические свойства
Структурная формула метенамина (гексаметилентетрамина) следующая:
В кислой среде метенамин распадается с образованием формальдегида:
N4(CH2)6 + 6Н20 + 4Н+ ->4NH;+ 6НСНО.
При pH 7,4 распада практически не происходит; при pH 6 образуется 6% теоретически возможного количества формальдегида, а при pH 5 — 20%. Поэтому при закислении мочи антибактериальное действие метенамина усиливается. Реакция распада метенамина с образованием формальдегида протекает очень медленно. При pH 6 и концентрации метенамина 750 мкг/мл бактерицидная концентрация формальдегида (>28 мкг/мл) достигается за 3 ч (Strom and Jun, 1993).
Спектр действия
К формальдегиду в концентрации 20 мкг/мл чувствительны почти все бактерии. Устойчивость к нему не вырабатывается. Однако бактерии, расщепляющие мочевину (например, Proteus spp.), способствуют ощелачиванию мочи, препятствуя таким образом образованию формальдегида из метенамина.
Фармакокинетика
Метенамин всасывается при приеме внутрь, но 10—30% препарата распадается в желудке (это не касается таблеток в кислотоустойчивой оболочке). Метенамин противопоказан при печеночной недостаточности, поскольку в результате его распада образуется аммиак. Препарат почти полностью выводится с мочой. Если pH мочи равен 6, суточный диурез — 1—1,5 л, а доза метенамина — 2 г/сут, концентрация формальдегида в моче составляет 18—60 мкг/мл, что превышает МПК для большинства возбудителей инфекций мочевых путей. Низкий pH мочи не только усиливает образование формальдегида, но и сам по себе оказывает бактериостатическое действие. Для закисления мочи обычно используют неметаболизируемые кислоты (миндальную и гиппуровую).
Побочные эффекты
В дозах, превышающих 500 мг 4 раза в сутки, метенамин вызывает желудочно-кишечные нарушения (даже в виде таблеток в кислотоустойчивой оболочке). Прием препарата в дозе 4—8 г/сут дольше 3—4 нед может сопровождаться частым, болезненным мочеиспусканием, альбуминурией, гематурией и сыпью. Поэтому, как только моча становится стерильной, дозу снижают. В обычных дозах препарат почти не дает системных побочных эффектов. Метенамин не противопоказан при почечной недостаточности, чего нельзя сказать о назначаемых вместе с ним кислотах. Метенамина манделат при почечной недостаточности противопоказан, так как миндальная кислота может вызывать кристаллурию. Метенамин и сульфаниламиды ослабляют действие друг друга, так как в моче метенамин связывается с сульфаметизолом и, возможно, с другими препаратами этой группы.
Применение
Метенамин не является препаратом выбора при лечении острых инфекций мочевых путей, но может применяться в качестве длительной поддерживающей антимикробной терапии (Stamm and Hooton, 1993). Он особенно активен в отношении Escherichia coli, но подавляет рост и других распространенных грамотрицательных возбудителей инфекций мочевых путей, а также Staphylococcus aureus и Staphylococcus epider-midis. Enterobacter aerogenes и Proteus vulgaris обычно устойчивы к метенамину. При инфекциях, вызванных бактериями, расщепляющими мочевину, поддерживать низкий pH мочи бывает трудно (желательно, чтобы он не превышал 5,5).
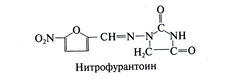
Нитрофурантоин
Это синтетическое производное нитрофурана используется для профилактики и лечения инфекций мочевых путей. Структурная формула нитрофурантоина следующая:
Спектр действия
Под действием восстанавливающих ферментов из нитрофурантоина образуются высокоактивные промежуточные продукты, которые, видимо, и вызывают повреждение ДНК. Считается, что избирательное действие препарата на бактериальные клетки обусловлено тем, что они быстрее восстанавливают нитрофурантоин, чем клетки млекопитающих. Во время лечения устойчивость к препарату возникает редко. Нитрофурантоин активен в отношении многих штаммов Escherichia coli и энтерококков. Большинство штаммов Proteus spp. и Pseudomonas spp., а также многие представители родов Enterobacter и Klebsiella устойчивы к препарату. Бактериостатическое действие нитрофурантоина на большинство чувствительных штаммов проявляется при концентрации 32 мкг/мл, а бактерицидное — начиная со 100 мкг/мл. При закислении мочи антибактериальная активность препарата усиливается.
Фармакокинетика
Нитрофурантоин быстро и полностью всасывается при приеме внутрь. Макрокристаллический нитрофурантоин всасывается и выводится медленнее. Около 40% препарата в неизмененном виде выводится с мочой. В стандартных дозах препарат не достигает терапевтической концентрации в сыворотке из-за быстрой экскреции (Т, о 0,3—1 ч), а его концентрацня в моче составляет около 200 мкг/мл. В таком количестве нитрофурантоин растворим в моче даже при pH выше 5, тем не менее нужно следить, чтобы реакция мочи была кислой, иначе активность препарата снижается. Скорость экскреции нитрофурантоина пропорциональна СКФ, поэтому при снижении последней эффективность лечения падает и могут возникать системные побочные эффекты. Нитрофурантоин окрашивает мочу в коричневый цвет.
Дозы
Взрослым нитрофурантоин назначают по 50—100 мг внутрь 4 раза в сутки во время еды и на ночь. Более точно дозу можно рассчитать так: 5—7 мг/кг/сут в 4 приема (максимум — 400 мг/сут). Для профилактики достаточно приема 50—100 мг на ночь. Детям назначают 5—7 мг/кг/сут. но при длительной профилактической терапии доза может быть снижена до I мг/кг/сут (Lohr et al., 1977). Продолжительность лечения не должна превышать 2 нед: между повторными курсами необходимо делать перерывы. Нитрофурантоин не назначают при беременности. почечной недостаточности (СКФ < 40 мл/мин), а также детям младше I мес.
Побочные эффекты
Чаше всего наблюдаются тошнота, рвота и понос. Макро кристаллический нитрофурантоин переносится лучше. Иногда возникают аллергические реакции, проявляющиеся ознобом, лихорадкой, лейкопенией, нейтропенией. гемолитической анемией, холестатической желтухой и повреждением пепатошттов. Редкое, но опасное осложнение — хронический активный гепатит (Black el al., 1980: Tolman. 1980). Гемолитическая анемия обычно возникает у больных с недостаточностью Г -6-ФД (Gait, 1990). Возможен острый экзогенный аллергический альвеолит: в течение нескольких часов или суток после начала лечения появляются лихорадка, озноб, кашель, одышка, боль в груди, эозинофилия. легочные инфильтраты. Заболевание обычно проходит в течение нескольких часов после отмены препарата. Встречается и под острая форма экзогенного аллергического альвеол ига. с более медленным нарастанием симптоматики. При длительном приеме препарата можгг развиться пневмосклероз. Повреждение легких, по-видимому, обусловлено образованием свободных радикалов кислорода при восстановлении нитрофурантоина в легких. Токсическому действию на легкие особенно подвержены пожилые (Holmberg et aL. 1980). Изредка возникает мегалобластная анемия. Неврологические нарушения — головная боль, головокружение, сонливость. мналгия и нистагм — обычно обратимы, но иногда развивается тяжелая полинейропатия с демнелнннзаиней и дегенерацией как чувствительных, так и двигательных волокон (Toole and Parrish. 1973). В результате мышцы денервируются и атрофируются. Нейропатия чаше возникает при почечной недостаточности и длительном лечении. Некоторые побочные эффекты нитрофурантоина обусловлены образованием токсичных метаболитов (SpKbrtj and Gordon. 1981).
Применение
Нитрофурантоин разрешен к применению только при инфекциях мочевых путей, вызванных чувствительными к нему возбудителями. В настоящее время он относится к препаратам второго ряда, так как устойчивость к нитрофурантоин) встречается чаше, чем к фторхинатонам и триметоприму/сульфаметоксазалу (Stamm and Hooton, 1993). Нитрофурантоин — эффективное средство профилактики рецидивирующих инфекций мочевых путей (Brumfitt and Hamilton* Miller, 1995). Для лечения пиелонефрита и простатита его не применяют.
Феназопиридин
Этот препарат не относится к мочевым антисептикам. Его применяют в качестве анальгетика при учащенном и болезненном мочеиспускании, жжении во время мочеиспускания и императивных позывах. Обычная доза — 200 мг 3 раза в сутки Фена зол иридии относится к азокрасителям и окрашивает мочу в оранжевый или красный цвет, о чем необходимо предупредить больного. Примерно в 10% случаев наблюдаются желудочно-кишечные нарушения, которые можно уменьшить, принимая препарат во время еды. Передозировка может привести к меттемоглобинемии. Феназопиридин выпускают также в составе комбинированных препаратов с сульфафуразолом и сульфаметоксазолом.
Перспективы
Из всех рассматриваемых в данной статье антимикробных средств к наиболее заметным достижениям последних лет можно отнести фторхинолоны. Привлекательность этих препаратов объясняется их высокой биодоступностью при приеме внутрь, широким спектром действия включающим грамотрицательные бактерии, и относительно немногочисленными побочными эффектами. Сейчас появляются новые фторхинолоны с еще более широким спектром действия, включающим грам положительные бактерии и анаэробы. Активность новых фторхинолонов в отношении пневмококков, устойчивых к пенициллинам и цефалоспоринам и возбудителей атипичных пневмоний позволяет использовать эти препараты для эмпирического лечения пневмонии. Продолжается разработка фторхинолонов, активных в отношении микобактерий (гл. 48).