Химиотерапия
Категория:
«Фармакология».
Принципы клеточной пролиферации и химиотерапии
Химиотерапия — это применение лекарственных веществ для уничтожения или инактивации клеток (в данном случае — клеток опухоли). Для понимания механизма действия противоопухолевых препаратов необходимо знание основных процессов клеточной пролиферации. Нормальные клетки находятся на одной из трех стадий:
- стадия активного деления (клеточный цикл);
- стадия дифференцировки (гибнущие клетки);
- стадия покоя (клетки могут активно делиться, если это позволяют условия окружающей среды).
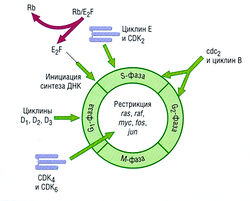
Различают четыре отдельные фазы клеточного цикла: S, G1, G2 и М (рис. 7.3). Во время S-фазы повышается активность таких ферментов репликации, как тимидинкиназа, ДНК-полимераза, дигидрофолатредуктаза, рибонуклеотидредуктаза, РНК-полимераза II и топоизомеразы I и II. Контроль перехода G2-M, когда происходит репарация ДНК или завершается синтез реплицирующейся ДНК, представляет собой критический элемент регуляции нормального клеточного цикла. Иногда Gi-фаза может отсутствовать, например у эмбриональных клеток, или же быть столь длительной, что клетки впадают в неактивное, покоящееся состояние (G0).
Рис. 7.3 Клеточный цикл и некоторые важные регуляторные белки. В S-фазе происходит активный синтез дезоксирибонуклеиновой кислоты (ДНК), она длится примерно 12-18 час; С2-фаза длится 1-8 час, число хромосом удваивается (4п). Продолжительность митоза (М) составляет около 1-2 час. Длительность Срфазы варьирует, и поздняя Срфаза ассоциирует с повышением уровня ферментов, синтезирующих ДНК. В комплексной регуляции точки рестрикции на старте S-фазы участвуют циклины и циклин-зависимые киназы (CDK), которые продолжают регулировать CDK на протяжении всего клеточного цикла. cdc2 — белок 2 цикла клеточного деления, важный продукт гена, контролирующего прохождение клеточного цикла; E2F — фактор транскрипции; ras, raf, туе, fos, jun — клеточные гомологи вирусных онкогенов, участвующие в клеточной пролиферации; Rb — белок ретинобластомы.
Способы определения и изучения клеточного цикла основаны на включении в делящиеся клетки меченного тритием тимидина (3H-TdR), что позволяет определить фракцию клеток, действительно синтезирующих ДНК. S-фазу можно идентифицировать также с помощью клеточного сортера, определяя число хромосом (т.е. 2п, 4п). В клинике эти определения используют для установления стадии рака молочной железы.
На протяжении развития опухоли рост популяции опухолевых клеток происходит нелинейно
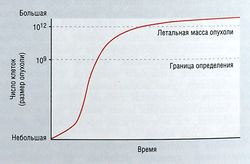
Рост популяции опухолевых клеток лучше всего описывает кинетика Гомпертца, характеризующаяся медленным линейным ростом опухоли при ее минимальной и максимальной величине и экспоненциальным ростом на промежуточной стадии (рис. 7.4).
Рис. 7.4 Рост популяции опухолевых клеток лучше всего описывает кинетика Гомпертца, а не логарифмическая. Низкая скорость роста характерна для очень небольших и очень крупных опухолей, тогда как при промежуточной величине опухоли наблюдается экспоненциальный рост.
Замедление роста опухоли и гибель злокачественных клеток коррелируют с цитологическими и пространственными факторами. Близость к кровеносным сосудам и доступ к кислороду являются существенными факторами, определяющими жизнеспособность и рост злокачественной клетки, что ведет к важным терапевтическим последствиям в случае применения:
- радиационной терапии, где кислород представляет собой важный метаболит;
- химиотерапии, когда многие противоопухолевые препараты целенаправленно поражают делящиеся клетки.
Дозолимитирующая токсичность противоопухолевых препаратов в отношении нормальных тканей часто прямо коррелирует со скоростью роста тканей
Нормальные ткани можно разделить на различные типы на основании кинетики пролиферации их клеток:
- быстро пролиферирующие ткани (индекс мечения [LI] > 5%): костный мозг, слизистая оболочка кишечника, репродуктивные органы и волосяные фолликулы;
- медленно пролиферирующие ткани (LI < 1%): трахея, эпителий бронхов, печень, почки и эндокринные органы;
- непролиферирующие ткани (у взрослых): скелетные мышцы, миокард, костная и нервная ткани. Из всех органов костный мозг наиболее чувствителен к нежелательному антипролиферативному действию противоопухолевых препаратов.
Различные опухоли имеют различный индекс мечения и время удвоения
Сравнение кинетики роста гранулоцитов нормального костного мозга и лейкозных клеток (табл. 7.1) показывает, что скорость пролиферации клеток при лейкозе ниже, чем клеток нормального костного мозга. Однако происходит экспансия популяции лейкозных клеток, т.к. скорость клеточной пролиферации превосходит скорость созревания и гибели клеток. Солидные злокачественные опухоли обычно содержат гораздо меньшую фракцию активно растущих клеток. LI медленно растущих аденокарцином составляет 1-5%, однако он достигает 30% у лимфомы Беркитта, рака яичка, саркомы Эвинга, НХЛ и рака молочной железы на субклинической стадии.
Таблица 7.1 Кинетика пролиферации лейкозных клеток и нормальных клеток костного мозга
|
Тип клеток |
Индекс мечения (%) |
Длительность клеточного цикла (час) |
|
Острый лейкоз |
3-12 |
48-72 |
|
Хронический миелогенный лейкоз |
6-25 |
48-72 |
|
Хронический лимфолейкоз |
0-1 |
48-72 |
|
Нормальные миелобласты |
32-75 |
16-24 |
|
Нормальные миелоциты |
18-25 |
16-24 |
Время удвоения опухоли при болезни Ходжкина, остеосаркоме и фибросаркоме составляет 30-70 сут. К медленно растущим зрелым карциномам со временем удвоения более 70 сут относится рак легких, толстой кишки, желудочно-кишечного тракта и запущенный рак молочной железы. Более медленный рост обусловлен присутствием большого числа непролиферирующих клеток и высокой скоростью клеточной гибели.
Фундаментальные принципы терапии рака определяются кинетикой клеточной пролиферации
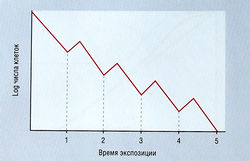
Гипотеза log-киллинга (log kill hypothesis) постулирует, что определенная доза лекарства убивает постоянную фракцию опухолевых клеток (выраженную в log числа клеток), а не постоянное число клеток (рис. 7.5). Это означает, что после проведения курса лечения часть клеток опухоли случайно выживает, не приобретая при этом специфической резистентности к лекарству. В связи с этим излечение более вероятно при использовании комбинированной терапии по сравнению с монотерапией: при действии нескольких лекарств выживают фракции от фракций опухолевых клеток и число выживших клеток может быть столь мало, что защитные силы организма легко с ними справляются, вызывая 100% гибель.
Рис. 7.5 Гипотеза log-киллинга. Лекарство или комбинация лекарств убивают постоянную фракцию опухолевых клеток. Некоторые клетки случайно выживают после каждой обработки и чувствительны к последующему воздействию лекарства.
Log-киллинг варьирует в зависимости от скорости клеточного роста, при этом наблюдается его прогрессирующее снижение на поздних стадиях роста опухоли, когда клетки уже не вступают в клеточный цикл. Ранние рецидивы медленно растущих опухолей возникают в результате их незначительного log-киллинга. Поздние рецидивы быстро растущих опухолей могут появиться, несмотря на эффективное лечение, если проведено слишком мало курсов терапии. Это так называемый период риска.
Некоторые противоопухолевые средства убивают опухолевые клетки только в определенные фазы клеточного цикла
Некоторые виды терапевтических вмешательств (например, противоопухолевые препараты и радиотерапия) оказывают фазоспецифический летальный эффект.
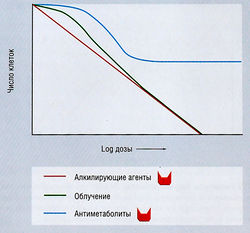
В терапии злокачественных опухолей существует несколько характерных кривых, отражающих соотношение между дозой препарата и выживаемостью клеток (рис. 7.6). При экспоненциальной кривой пропорция выживающих клеток экспоненциально связана с дозой данного препарата, т.е. по мере повышения дозы возрастает гибель клеток. Эффект лекарств (а также других средств), обладающих этим свойством, не является специфичным для цикла или стадии (т.е. этот препарат убивает клетки, находящиеся на любой стадии клеточного цикла и даже покоящиеся). К таким средствам относятся:
- 5-фторурацил, цисплатин, глюкокортикостероиды, азотиприт и мелфалан;
- радиотерапия.
Рис. 7.6 Фазоспецифический летальный эффект противоопухолевых препаратов. Если агент не является фазоспецифическим (например, облучение и алкилирующие препараты), повышение его дозы увеличивает гибель клеток. Для фазоспецифических агентов, в частности антиметаболитов, которые убивают только активно пролиферирующие клетки, повышение дозы вызывает эффект плато, т.к. по мере продолжения химиотерапии клеточный рост замедляется. Увеличение продолжительности воздействия антиметаболитов повышает клеточную гибель.
Циклофосфамид и другие алкилирующие агенты оказывают летальное действие на всех стадиях клеточного цикла, однако наблюдается повышенная летальность клеток на границе перехода Gj-S.
Кривая фазоспецифической выживаемости имеет плато с отсутствием увеличения гибели при повышении дозы. Однако киллинг может быть осуществлен повышением времени экспозиции, но не дозы. К препаратам, для которых характерен этот тип кривой, относятся:
- цитотоксические антиметаболиты, такие как цитарабин, тиогуанин и гидроксимочевина, активные только в S-фазе;
- метотрексат, доксорубицин, эпиподофиллотоксин и алкалоиды барвинка, обладающие максимальной летальной активностью в течение S-фазы;
- блеомицин, наиболее активный во время G2- и М-фаз.
Цитотоксические вещества блокируют клеточный цикл
Все цитотоксические противоопухолевые лекарства препятствуют прохождению клетками клеточного цикла, приводя к синхронизации и замедлению пролиферации быстро размножающихся клеток. Результатом является снижение чувствительности к лекарствам в S-фазе.
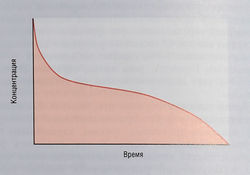
Цитотоксичность пропорциональна общей лекарственной экспозиции
Фармакокинетика противоопухолевых лекарств — это сложный процесс, т.к. цитотоксичность для злокачественных клеток пропорциональна общей лекарственной экспозиции (площадь под кривой; ППК), а не концентрации препарата в плазме на пике (рис. 7.7). Сначала вещество должно проникнуть в отдельные злокачественные клетки, а затем взаимодействовать со своими молекулярными мишенями. Поскольку это взаимодействие часто обратимо, по крайней мере сначала, цитотоксическая концентрация должна сохраняться все это время. Кроме того, число индивидуальных взаимодействий между лекарством и молекулами-мишенями, необходимое для киллинга одиночной клетки, может быть очень велико. Подсчитано, что для киллинга одной клетки с ее ДНК должен связаться как минимум 1 млн молекул цисплатина.
Принципы противоопухолевой терапии
- Лекарства убивают постоянную фракцию клеток, а не их постоянное количество
- Существуют отдельные периоды «повышенной ранимости» клеток при действии цитотоксических препаратов
- Цитотоксические препараты замедляют прохождение клетками клеточного цикла
- Цитотоксические препараты не обладают избирательной токсичностью в отношении злокачественных клеток
- Цитотоксичность пропорциональна общему времени воздействия лекарства
Принципы комбинированном химиотерапии
Комбинации противоопухолевых препаратов стали применять после того, как было обнаружено, что использование одного препарата не дает значительной ремиссии или не излечивает пациента (за исключением метотрексата при лечении хориокарциномы). Это явление объясняет гипотеза log-киллинга (см. ранее).
Лекарства, используемые для комбинированной терапии, должны обладать определенными свойствами:
- оказывать некоторый эффект при использовании в отдельности;
- вызывать преимущественно полный ответ (гибель всех клеток опухоли), а не частичный (гибель менее 50% клеток);
- биохимические механизмы действия препаратов должны быть разными для воздействия на опухоль, содержащую гетерогенную клеточную популяцию;
- препараты не должны обладать сходным побочным действием, т.к. в этом случае необходимо снижать их дозы, что приводит к утрате аддитивного эффекта комбинации.
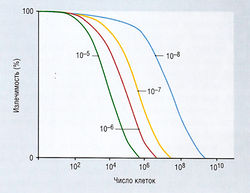
По многим показателям различные опухоли являются гетерогенными, включая чувствительность к лекарственным веществам, в результате нестабильности их генетической конституции. Злокачественные клетки способны мутировать, что крайне важно для терапии, поскольку такие мутации могут привести к возникновению резистентности к лекарствам. В большинстве случаев такая резистентность определяется свойствами конкретного типа опухолей. Клинически резистентность может стать очевидной, когда чувствительные клоны опухоли погибают, а резистентные выживают и становятся доминирующими. Излечимость пропорциональна числу злокачественных клеток, и, в соответствии с гипотезой Голди-Колдмана, существует более высокая вероятность мутаций, приводящих к лекарственной резистентности, в более многочисленной клеточной популяции (рис. 7.8).
Рис. 7.8 Гипотеза Голди-Колдмана. В случае мутаций, приводящих к возникновению резистентности к лекарствам, вероятность отсутствия терапевтического эффекта препарата (неизлечимость) возрастает вместе с повышением размеров опухоли (величины от 10-5 до 10~8 показывают частоту мутаций в расчете на клеточное деление, т.е. 10~5 соответствует одной мутации на 100 000 делений).
Принципы комбинированной химиотерапии
- Применяемые препараты должны обладать противоопухолевым эффектом при использовании их по отдельности, иметь неперекрывающуюся токсичность и различные механизмы действия
- Дозы и схемы применения должны быть оптимальными
- Интервалы между введениями препаратов должны быть минимальными
Преимущества комбинированной терапии по сравнению с монотерапией
- Максимальная степень клеточной гибели и снижение токсичности
- Гибель опухолевых клеток, принадлежащих к гетерогенным клеточным популяциям
- Снижение шансов возникновения резистентных клонов