Генотерапия
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
ГЕНОТЕРАПИЯ
Благодаря достижениям молекулярной и клеточной биологии мы уже многое знаем о белковых нарушениях, лежащих в основе целого ряда заболеваний, а методы генной инженерии дают возможность воздействовать на гены, управляющие синтезом белка. Размер, сложность структуры белковых молекул, а также отграниченность внутриклеточной среды препятствуют восполнению дефицита белков или их модификации с помощью обычных фармакологических методов. Генотерапия, в принципе, способна преодолеть указанные препятствия, поскольку ее методы позволяют ввести рекомбинантную ДНК в клетки, что обеспечивает синтез функционально активных белков взамен дефектных. Поэтому доставка рекомбинантной ДНК — важнейшая проблема генотерапии. Существуют и другие подходы, использующие ДНК и РНК в качестве лекарственных средств. Первоначально целью генотерапии было лечение наследственных заболеваний, однако сейчас разработаны подходы к лечению и приобретенных заболеваний, таких, как злокачественные новообразования и инфекционные болезни. В этой главе кратко рассмотрены клинические аспекты и методы генотерапии.
Современная эра молекулярной медицины подготовлена революционными достижениями генетики и молекулярной биологии человека. Многие ожидают, что медицина вскоре преобразится благодаря новым методам воздействия непосредственно на геном человека — иными словами, благодаря генотерапии. О развитии этой относительно новой дисциплины свидетельствует экспоненциальный рост числа соответствующих научных и клинических публикаций. Недавно появились пять новых биомедицинских журналов, посвященных исключительно генотерапии или использованию нуклеиновых кислот в качестве лекарственных средств, а также многочисленные книги и монографии. Сейчас проводится более 300 клинических испытаний методов, включающих трансфекцию клеток (Rosenberg et al., 2000), а первое лекарственное средство на основе нуклеиновой кислоты (фомивирсен) уже одобрено ФДА.
Несмотря на грандиозные достижения последнего десятилетия, генотерапия остается в основном экспериментальным подходом. Еще предстоит преодолеть многочисленные препятствия на пути безопасной и эффективной доставки нуклеиновой кислоты в клетки, а также обеспечения длительной и тканеспецифичной экспрессии введенного генетического материала — так называемых трансгенов. В этой главе рассмотрены три основные раздела генотерапии: методы доставки, принципы лечения и патогенетические мишени.
Методы трансфекции клеток
Идеальная система доставки ДНК должна обеспечивать:
1) перенос молекул разной длины, 2) легкость получения в концентрированном виде и 3) избирательность по отношению к клеткам-мишеням. Кроме того, она должна гарантировать длительную экспрессию трансгенов, быть нетоксичной и неиммуногенной. Такая система пока не создана, а все существующие методы трансфекции in vivo имеют существенные недостатки. Сейчас разрабатываются несколько новых методов, основанных как на вирусных векторах, так и на невирусных способах доставки трансгенов. В табл. 5.1 сопоставлены особенности, преимущества и недостатки наиболее широко используемых методов.
Проблемы генотерапии
Каждое открытие в области клеточной биологии ведет к созданию новых методов генотерапии. К сожалению, на пути от научных достижений к клинической практике есть несколько принципиальных препятствий. В обозримом будущем влияние генотерапии ограничено лишь соматическими клетками (не зародышевыми). Трансген должен избирательно попасть в клетки определенной ткани, чему сейчас уделяется существенное внимание. Как только произошла трансфекция, на первый план выходит проблема поддержания экспрессии трансгена. Наконец, сам вектор может обладать опасным побочным действием (Jolly, 1994).
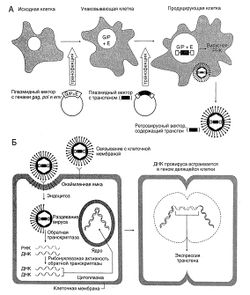
Описание к рисунок 5.1. Использование ретровирусного вектора. А. Схема получения ретровирусного вектора. Для получения не способных к репродукции ретровирусных векторов используют специальные линии клеток, способные синтезировать те вирусные белки, гены которых удалены при конструировании вектора. В клетки подходящей линии (например, эмбриональные клетки почки человека) с помощью бактериальных плазмид вводят гены gag (G), pol (Р) и env (Е). Клетки, синтезирующие соответствующие вирусные белки, называют упаковывающими. Затем плазмиду, содержащую рекомбинантную ДНК провируса, в которой вместо генов gag, pol и env находится нужный трансген, используют для трансфекции упаковывающих клеток. Теперь клетки содержат все, что нужно для сборки вирусов, и ретровирусные векторы начинают накапливаться в культуральной среде. Эти векторы содержат трансген, но лишены вирусных генов gag, pol и env, а потому при заражении следующей клетки они не могут репродуцироваться. Б. Экспрессия трансгена в клетке-мишени после внедрения РНК-содержащего ретровирусного вектора (см. «Жизненный цикл»).
Фармакокинетика
Доставка чужеродной ДНК и ее последующие преобразования в клетке-мишени не могут быть описаны обычными уравнениями фармакокинетики (гл. 1). Важны не только судьба собственно вводимой ДНК (например, объем распределения, скорость поступления в ткани), но и последствия изменения экспрессии генов и функции белков. Обязательно нужно учитывать следующее: 1) распределение введенной ДНК в тканях, 2) эффективность поглощения ДНК клетками-мишенями, 3) распределение ДНК между внутриклеточными органеллами, 4) скорость разрушения введенной ДНК,5) скорость транскрипции, 6) время жизни образующейся мРНК, 7) количество и стабильность синтезируемого белка, 8) распределение белка внутри клетки или уровень его секреции. Если учитывать все эти параметры, то можно (хотя пока еще — чисто теоретически) подбирать уровень трансфекции и экспрессии гена в соответствии с конкретными клиническими задачами. Во всяком случае, многокамерные фармакокинетические модели для генотерапии уже появились (Ledley and Ledley, 1994).
Продолжительность экспрессии трансгенов
Этот вопрос очень важен. При лечении наследственных заболеваний желательно иметь стабильную экспрессию на протяжении многих лет. Напротив, при лечении злокачественного новообразования продолжительный синтез нового белка может быть излишним и даже вредным.
Векторы, которые обеспечивают встраивание ДНК в хромосомы клетки-мишени (например, ретровирусные и аденоассоциированные векторы), способствуют наиболее длительной экспрессии. Однако само по себе присутствие чужеродной ДНК в геноме еще не гарантирует ее стабильной экспрессии. Транскрипция трансгена и синтез соответствующего белка могут снижаться, например из-за инактивации трансгенного промотора (Bestor,2000). В некоторых случаях иммунная система организма уничтожает трансфицированные клетки (Jolly, 1994).
Неблагоприятные последствия экспрессии трансгенов
В случае успешной трансфекции и экспрессии трансгенов возникают новые проблемы. Как и с любым новым лекарственным средством, невозможно заранее предвидеть все возможные последствия генотерапии. Однако некоторые процессы вполне предсказуемы. Поскольку обычно трансфекция приводит к синтезу нового белка, возможна активация иммунной системы организма. Выраженный иммунный ответ может привести к инактивации секретируемого белка (как это происходит у больных гемофилией, получающих фактор VIII) или повреждению трансфицированных клеток. В некоторых случаях сама система доставки ДН К является иммуногенной, что было показано для аденовирусных векторов. Иммунный ответ на вектор снижает эффективность трансфекции, а при повторном введении вектора препятствует ей.
Таблица 5.1. Сравнение способов доставки трансгенов
|
Способ |
Емкость, тысячи нуклеотидов |
Спектр клеток-К- мишеней |
Длительность экспрессии |
Основные преимущества |
Основные недостатки |
|
Ретровирусы |
<8 |
Только делящиеся клетки |
Длительная |
Длительная экспрессия; низкая иммуно-генность |
Применим только для делящихся клеток; низкая эффективность трансфекции; сомнения в безопасности случайного встраивания в геном |
|
Аденовирусы |
<7,5 |
Большинство клеток |
Кратковременная |
Широкий спектр клеток-мишеней; заражает неделящиеся клетки; возможность получения высокой концентрации вектора; высокая эффективность трансфекции |
Кратковременная экспрессия; иммунный ответ организма |
|
Аденоассоцииро-ванные вирусы |
<5,2 |
Большинство клеток |
Длительная |
Широкий спектр клеток-мишеней; непатогенны и неиммуно-генны; длительная экспрессия |
Малая емкость; трудность получения высокой концентрации вектора и определения его титра |
|
Лентивирусы |
<8 |
Делящиеся и некоторые неделящиеся клетки |
Длительная |
Длительная экспрессия; заражает неделящиеся клетки |
Сомнения в безопасности вектора на основе ВИЧ; трудность получения |
|
Вирус простого герпеса |
20-30 |
Многие неделящиеся клетки, особенно нейроны |
Большая емкость |
Цитотоксичность; инактивация промотора | |
|
Липосомы |
> 10 |
Большинство клеток |
Кратковременная |
Непатогенны; дешевы и просты в получении; безопасны |
Низкая эффективность; кратковременная экспрессия |
|
ДНК-белковые комплексы |
> 10 |
Большинство клеток |
Кратковременная |
Непатогенны; дешевы и просты в получении; безопасны |
Низкая эффективность; кратковременная экспрессия |
Причиной побочного действия может быть репродукция вирусного вектора. Значительные усилия направлены на разработку вирусных векторов, не способных к репродукции в клетках-мишенях. Для этого из вирусного генома удаляют некоторые гены, необходимые для репродукции (рис. 5.1). Чтобы получить такие вирусы в большом количестве, их приходится выращивать в культуре специальных линий клеток, восполняющих утраченные функции. Так получают ретровирусы, аденовирусы, аденоассоциированные вирусы и герпесвирусы, не способные к репродукции в обычных клетках. Однако этот подход не гарантирует полной потери способности вирусов к репродукции. Вирус может компенсировать потерю удаленных участков генома за счет неизвестных клеточных факторов или за счет рекомбинации с аналогичными дикими вирусами в организме больного. К счастью, последний феномен пока на практике не наблюдался.
Этические и юридические проблемы
Большое внимание привлечено к этическим аспектам генотерапии (Juengst and Walters, 1999). В основном обсуждается следующее: 1) соотношение риска и пользы для больных, участвующих в отработке экспериментальных методов генотерапии, 2) отбор и защита таких больных и 3) этические аспекты трансфекции зародышевых клеток. Обеспечение безопасности больных — основная цель официальных инструкций, регулирующих исследования в области генотерапии (см. ниже). Теоретически возможная трансфекция зародышевых клеток человека вызывает множество этических вопросов. Общество обеспокоено тем, что изменение генетического материала будущих поколений может привести к дискриминации лиц с определенным генотипом. Кроме того, существует опасность, что методы генотерапии будут использованы для немедицинских целей, например для косметических и других изменений организма. Продолжающееся обсуждение среди специалистов, а также в обществе исключительно важно для успеха и распространения генотерапии как стандартной практики.
Обеспокоенность общества и правительства этическими вопросами и безопасностью генотерапии привело к жесткому контролю за такими исследованиями (Wivel and Anderson, 1999). Вначале 1980-х гг. правительственный надзор за исследованиями в этой области в США был поручен Консультативному совету по генной инженерии Национального института здоровья. Этот совет рассматривает все клинические испытания, использующие методы генотерапии, а также обеспечивает обсуждение важнейших научных и этических аспектов генотерапии. Как и в случае других новых методов лечения, для проведения клинических испытаний необходимо получить разрешение ФДА. На местном уровне разрешение на проведение клинических исследований по генотерапии дают две независимые комиссии (наблюдательный совет и совет по биологической безопасности), имеющиеся в медицинских центрах и исследовательских институтах. Задача наблюдательного совета — защитить людей от излишнего риска при применении нового метода лечения, тогда как совет по биологической безопасности следит за соблюдением «Правил проведения исследований в области генной инженерии», принятых Национальным институтом здоровья. Этот механизм обеспечивает строгое соблюдение как правил техники безопасности, так и этических и профессиональных норм при проведении подобных клинических исследований.
Перспективы
Генотерапия пока остается экспериментальным методом, но, суля по всему, на втором десятилетии своего развития она станет эффективной и безопасной альтернативой существующим методам лечения многих наследственных и приобретенных заболеваний. Уже сейчас проводятся несколько клинических испытаний (3-й фазы) с целью сравнения эффективности и безопасности генотерапии и обычных методов лечения злокачественных новообразований. В ближайшем будущем несколько новых препаратов на основе антисмысловых олигонуклеотидов получат разрешение ФДА на использование для лечения вирусных инфекций (в том числе ВИЧ) и, возможно, злокачественных новообразований, Предполагается, что скоро начнется широкое использование методов генотерапии для создания эктопической экспрессии факторов свертывания (при гемофилиях) и эритропоэтина (при хронической анемии).
Для успеха большинства методов генотерапии необходима разработка более безопасных и эффективных способов доставки трансгенов, поэтому успех зависит от прогресса в конструировании и получении новых векторов. Вероятно, станут возможными более рискованные процедуры, такие, как внутриутробная генотерапия. Наконец, необходимо обеспечить безопасность больных, участвующих в клинических испытаниях новых методов, и учесть этические сомнения, выражаемые общественностью.
Потребность в генотерапии наследственных болезней будет, безусловно, расти по мере открытия новых генетических нарушений и выяснения их патогенеза. Кроме того, с увеличением наших знаний об аллельной гетерогенности как основы различной предрасположенности к заболеваниям генотерапия может стать важным способом лечения и для распространенных болезней. По мере наступления эры генетической медицины необходимость в улучшении методов трансфекции и в создании новых подходов к лечению только увеличивается.
Читайте также
- Генная терапия наследственных заболеваний
- Генная терапия отдельных заболеваний
- Вирусные векторы (генотерапия)
- Невирусная доставка генов (генотерапия)
- Эктопический синтез белков (генотерапия)
- Генотерапия рака (злокачественных опухолей)
Литература
- Abonour, R., Williams, D.A., Einhom, L., Hall, K.M., Chen, J., Coffman. J,, TraycolT, C.M., Bank, A., Kato, I., Ward, М., Williams, S.D., Hromns, R.. Robertson, M.J., Smith, F.O., Woo, D., Mills, B., Srour, E.F., and Comctta, K. Efficient retrovirus-mediated transfer of the multidrug resistance 1 gene into autologous human long-term repopulating hematopoietic stem cells. Nat. Med., 2000,6:652-658.
- Acsadi. G., Jani, A., Massie, B., Simoneau, М., Holland, ft, Blase-huk. K.. and Karpati, G. A differential efficiency of adenovirus-mediated in vivo gene transfer into skeletal muscle cells of different maturity. Hum. Mol. Gantt., 1994, 3:579-584.
- Aghi, М., Chou.T.C., Suling, K., Breakefleld, X.O., andChiocca, E.A. Multimodal cancer treatment mediated by a replicating oncolytic virus that delivers the oxazaphosphorine/rat cytochrome P450 2B1 and gan-ciclovir/herpcs simplex virus thymidine kinase gene therapies. Cancer Res.. 1999. 59:3861-3865.
- Batra, R.K., Wang-Johanning, F., Wagner, E., Garver, R.I. Jr., and Curiel, D.T. Receptor-mediated gene delivery employing lectin-binding specificity. Gene Ther., 1994, 1:255—260.
- Boyer, J.D., Cohen, A.D., Vogt, S., Schumann, K., Nath, B., Ahn, L., Lacy, K., Bagarazzi, M.L., Higgins, T.J., Baine, Y., Ciccarelli, R.B., Ginsberg, R.S., MacGregor, R.R., and Weiner, D.B. Vaccination of seronegative volunteers with a human immunodeficiency virus type 1 env/rev DNA vaccine induces antigen-specific proliferation and lymphocyte production of beta-chemokines. У. Infect. Dis., 2000, 181:476—483.
- Brigham, K.L., Lane, K.B., Meyrick, B., Stecenko, A.A., Strack, S., Cannon, D.R., Caudill, М., and Canonico, A.E. Transfection of nasal mucosa with a normal alpha 1-antitrypsin gene in alpha 1-antitrypsin-deficient subjects: comparison with protein therapy. Hum. Gene Ther., 2000, 11:1023-1032.
- Buchschacher, G.L. Jr., and Wong-Staal, F. Development of lentiviral vectors for gene therapy for human diseases. Blood, 2000,95:2499—2504.
- Canonico, A.E., Conary, J.T., Meyrick, B.O., and Brigham, K.L. Aerosol and intravenous transfection of human alpha 1-antitrypsin gene to lungs of rabbits. Am. J. Respir. Cell Mol. Biol., 1994,10:24—29.
- Clemens, P.R., Kochanek, S., Sunada, Y., Chan, S., Chen, H.H., Campbell, K.P., and Caskey, C.T. In vivo muscle gene transfer of full-length dystrophin with an adenoviral vector that lacks all viral genes. Gene Пег., 1996,3:965-972.
- Blaese, R.M., Culver, K.W., Miller, A.D., Carter, C.S., Fleisher, Т., Clerici, М., Shearer, G., Chang, L., Chiang, Y., Tolstoshev, P., et at. T lymphocyte-directed gene therapy for ADA-SCID: initial trial results after 4 years. Science, 1995, 270:475—480.
- Frank, D.N., and Pace, N.R. Ribonuclease P: unity and diversity in a tRNA processing ribozyme. Annu. Rev. Biochem., 1998, 67:153—180.
- Galderisi, U., Cascino, A., and Giordano, A. Antisense oligonucleotides as therapeutic agents. /. Cell Physiol., 1999, 181:251-257.
- Gewirtz, A.M., Sokol, D.L., and Ratajczak, M.Z. Nucleic acid therapeutics: state of the art and future prospects. Blood, 1998, 92:712—736.
- Simonato, М., Manservigi, R., Marconi, P., and Glorioso, J. Gene transfer into neurones for the molecular analysis of behaviour: focus on herpes simplex vectors. Trends Neurosci., 2000, 23:183—190.
- Smith, R.M., and Wu, G.Y. Hepatocyte-directed gene delivery by receptor-mediated endocytosis. Semin. Liver Dis., 1999, 19:83—92.
- Springer, C.J., and Niculescu-Duvaz, I. Prodrug-activating systems in suicide gene therapy. J. Clin. Invest., 2000,105:1161—1167.
- Sullenger, B.A. RNA repair as a novel approach to genetic therapy. Gene Ther., 1999,6:461-462.
- Symons, R.H. Small catalytic RNAs. Annu. Rev. Biochem., 1992, 61: 641-671.
- Yuen, A.R., and Sikic, B.I. Clinical studies of antisense therapy in cancer. Front. Biosci., 2000, 5:D588—D593.