Метаболический синдром
Метаболический синдром
Метаболический синдром («полиметаболический синдром», «синдром изобилия», «синдром Х», «смертельный квартет», «гормональный метаболический синдром», «синдром инсулинорезистентности», «смертельный секстет», «метаболический сосудистый синдром», «дисметаболический синдром», «гипертриглицеридемическая талия», «кардиометаболический синдром»)[1] — это сочетание нарушенного углеводного обмена, абдоминального ожирения, дислипидемии и гипертензии, и связан с развитием сахарного диабета 2 типа и сердечно-сосудистых заболеваний [2].
История
В 1922 г. Г.Ф. Ланг в своих трудах отмечал наличие ассоциации артериальной гипертензии и ожирения, нарушений обмена углеводов и подагры, об этой связи доложили на Х съезде терапевтов его сотрудники А.Л. Мясников иД.М. Гротель.
1923 г. шведский исследователь E.Kylin. впервые указал связь артериальной гипертензии (АГ) с гипергликемией и гиперурикемией.
В 1948 г. выдающийся клиницист Е.М. Тареев отмечал: « Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза-холестерином, мочевой кислотой».
В 1966 г. связь сахарного диабета и атеросклероза описал Л.С. Шварц. В это же время J.Camus назвал сочетание у одного и того же больного сахарного диабета, дислипидемии и поражения суставов метаболическим трисиндромом.
В 1968 г. H.Mehnert и H. Kuhlman обозначили сочетание нарушения обменов как « синдром изобилия».
M. Hannefeld и W. Leonard в 1981 г. впервые сделали подробное описание метаболического синдрома. В силу существования в эпоху «холодной войны» политической тенденциозности, труды исследователей из России и стран «Восточного блока» замалчивались медицинской общественностью Запада.
В 1988 г. G. Reaven в своей Бантингской лекции, обобщив эпидемиологические, клинические и экспериментальные данные, выдвинул концепцию, в которой указал, что резистентность к инсулину, абдоминальное ожирение, АГ, дислипидемия и коронарная болезнь сердца являются проявлением единого патологического состояния, обозначенного им как « Синдром Х».
А. Regenauer В 1988 г., описывая прогностические аспекты МС, назвал его «good life syndrome», то есть « синдром благополучия» (сытости).
В 1989 г. N. Kaplan привел данные популяционных исследований, свидетельствующие о неблагоприятном жизненном и трудовом прогнозе у больных с сочетанием ожирения, сахарного диабета, АГ и коронарной болезни сердца, назвав симптомокомплекс «смертельным квартетом».
В последние годы в исследовательской и практической медицине укоренился термин « метаболический синдром», сущность его постепенно расширялась, так как стали выявляться ранее неизученные нарушения, наблюдавшиеся у части больных.
А.И.Мартынов в 2000 отнес к ним повышенное содержание фибриногена, уровня «малых» липопротеинов, ингибитора-1 активатора плазминогена и микроальбуминурию.
Результатом совместной работы ведущих международных организаций по изучению МС явилось создание нового определения. Принято решение отказаться от приоритета абдоминального ожирения среди остальных критериев МС. В настоящее время для установления диагноза МС необходимо наличие трех из пяти нижеперечисленных критериев.
Критерии метаболического синдрома: IDF, NHLBI, AHA, WHF, IAS, IASO, 2009 г.
Любые 3 из перечисленных:
- Абдоминальное ожирение (данные, специфичные для отдельных стран и популяций)
- Триглицериды 1,7 ммоль/л (150 мг/дл) или медикаментозная терапия гипертриглицеридемии
- Снижение ЛПВП: у мужчин: <1,0 ммоль/л (40 мг/дл), у женщин: <1,3 ммоль/л (50 мг/дл) или медикаментозная терапия дислипидемии
- Повышенный уровень АД 130/85 мм рт. ст. или прием антигипертензивной терапии пациентом с артериальной гипертензией в анамнезе
- Повышенный уровень гликемии натощак 100 мг/дл или прием сахароснижающей терапии
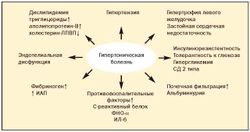
Абдоминальное (висцеральное) ожирение — один из основных клинических симптомов метаболического синдрома, которое является важным фактором риска сердечно-сосудистых и других заболеваний (рис. 1).
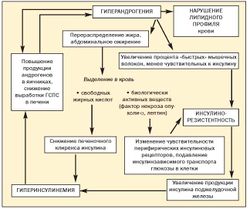
До настоящего времени не прекращается дискуссия о первичности или вторичности инсулинорезистентности и гиперандрогении при метаболическом синдроме (рис. 2).
Полагают, что повышение уровней провоспалительных цитокинов (ФНО-а, ИЛ-6) в жировой ткани может вести к дисфункции эндотелия, оксидативному стрессу, способствуя атеросклеротическим изменениям и развитию инсулинорезистентности. Единственным защитным фактором является адипонектин — антиатерогенный фактор, синтезируемый адипоцитами. Он оказывает следующие эффекты:
- уменьшает инсулинорезистентность;
- снижает поступление жирных кислот в печень;
- способствует снижению продукции глюкозы печенью и синтеза триглицеридов ЛПОНП;
- в мышечной ткани улучшает чувствительность к инсулину;
- тормозит адгезию моноцитов и тромбоцитов к эндотелию.
Защитные антиатерогенные механизмы адипонектина утрачиваются при ожирении, особенно при абдоминально-висцеральном. Низкий уровень адипонектина в плазме крови предшествует инсулинорезистентности.
В последние годы принято выделять также менопаузальный метаболический синдром (ММС), который развивается на фоне возрастного снижения и выключения функции яичников. Критерии диагностики его соответствуют вышеизложенным критериям метаболического синдрома, однако важную роль играют данные анамнеза: значительная прибавка массы тела (5—10 кг) за короткий период времени (6—12 месяцев) в период постменопаузы.
Источники
- ↑ Бурова СА. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению. РМЖ 2001;2(9):56—62.
- ↑ Метаболический синдром: аргументы «за» и «против» Учамприна В.А.1, Романцова Т.И., Калашникова М.Ф.ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова 2012г