Действие лекарств на клетки
Содержание
- 1 Действие лекарств на клеточном уровне
- 2 ДЕЙСТВИЕ ЛЕКАРСТВ НА КЛЕТКИ
- 2.1 G-белок-связанная трансдукция
- 2.2 Са2+-связанная трансдукция
- 2.3 Трансдукция, связанная с протеинкиназой С
- 2.4 Трансдукция, инициируемая ДНК-связанными рецепторами
- 2.5 Трансдукция, инициируемая рецепторами с тирозинкиназной активностью
- 2.6 Трансдукция, инициируемая РСК
- 2.7 Примеры интеграции клеточного и молекулярного механизмов
- 3 Читайте также
Действие лекарств на клеточном уровне
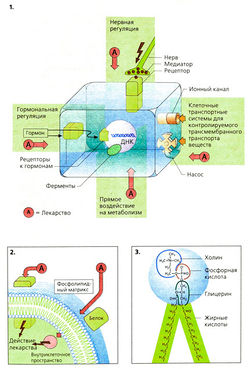
Целью фармакотерапии является устранение симптомов заболевания путем воздействия на механизмы его возникновения. Клетка самая маленькая жизнеспособная структурная единица организма. Внешняя клеточная мембрана — плазмапемма — отделяет клетку от внеклеточной среды, что необходимо для сохранения гомеостаза клетки. Обменные процессы между клеткой и внешней средой контролируются встроенными в клеточную мембрану транспортными белками, такими как энергетически зависимые насосы (например, Na/K-АТФа-за), транспортные системы (котранспорт глюкозы) или ионные каналы (Na-канал; Са-канал) (1).
Функциональная согласованность клетки является основой существования всего организма. Управление клеточными функциями осуществляется с помощью цитозольных контактов и веществ-посредников, передающих информацию. К ним относятся освобождаемые в нервных окончаниях «трансмиттеры». На поверхности клеточных мембран имеются специальные образования, воспринимающие информацию, рецепторы. К сигнальным веществам относятся также гормоны, выделяемые эндокринными железами и поступающие к клеткам через кровь и внеклеточную жидкость. Сигнальные вещества поступают также из соседних клеток: паракринный эффект (выделение эндокринными железами локально действующих веществ, например простагландинов).
Эффект лекарственного вещества часто обусловлен его влиянием на клеточные функции. Участками действия лекарств могут быть рецепторы (антагонисты или агонисты рецепторов). Изменение активности мембранных транспортных систем также влияет на функционирование клетки (сердечные гликозиды; петлевые диуретики; антагонисты кальция). Лекарства могут действовать внутри клетки, влияя на клеточный метаболизм, например блокируя действие ферментов (ингибиторы фосфодиэстеразы) или активируя их (органические нитраты) (2); могут оказывать влияние на клеточное ядро (повреждение ДНК цитостатиками).
Лекарства, имеющие внутриклеточный механизм действия, должны проникать через клеточную мембрану.
Клеточная мембрана представляет собой двухслойную фосфолипидную мембрану (толщиной ~ 50 А = 5 нм), в которую включены интегральные мембранные белки, например рецепторы или транспортные белки. Молекулы фосфолипидов содержат две длинноцепочечные жирные кислоты, связанные с глицерином по двум его гидроксильным группам. К третьей гидроксильной группе глицерина присоединена фосфорная кислота, имеющая связь с еще одним остатком, например холином (фос-фатидилхолин, т. е. лецитин), аминокислотой серином (фосфатидилсерин) или сахаром инозитом (фосфатидилинозитол). В растворах фосфолипиды проявляют амфифильные свойства, поскольку неполярная часть их молекулы — цепь жирной кислоты — липофильна, а полярная головка гидрофильна. Поэтому молекулы фосфолипидов «автоматически» образуют двойной слой: полярные головки обращены наружу, к полярной водной среде, а цепочки жирной кислоты обращены внутрь клетки (3).
Гидрофобный внутренний слой фосфолипидной мембраны непроницаем для полярных соединений (диффузионный барьер). Неполярные соединения легко проходят через мембрану, что имеет большое значение для поступления, распределения и выведения лекарств.
ДЕЙСТВИЕ ЛЕКАРСТВ НА КЛЕТКИ
Категория:
«Фармакология».
Большинство молекулярных мишеней связано различными биохимическими механизмами с компонентами клеточного ответа (G-белки, ферменты, ионные каналы и др.). Эти реакции связывания называют трансдукцией.
G-белок-связанная трансдукция
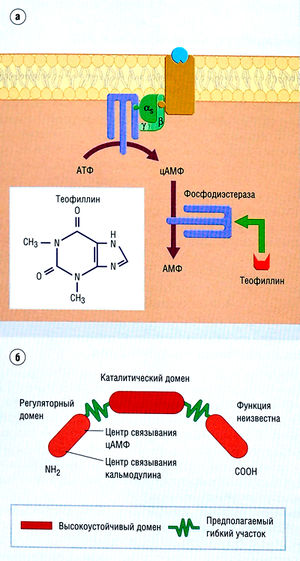
G-белки — это молекулы, связанные непосредственно со специфической группой рецепторов или опосредованно с другими молекулярными мишенями. Активированный G-белок инициирует (или подавляет) разные каскады клеточных реакций, что в итоге изменяет функцию ионных каналов, ферментов, ДНК и других компонентов клетки, например открытие К+-канала в сердечной мышце после связывания ацетилхолина с мускариновым рецептором или увеличение активности протеин-киназы после связывания адреналина с β-адренорецептором.
G-белок состоит из трех субъединиц — а, β и у— и работает как переключатель сигналов клетки (рис. 2.25)
При активации агонистом G-белок-связанного рецептора конформационные изменения в рецепторе обусловливают активацию G-белка, что приводит к выходу гуанозиндифосфата и связыванию гуано-зинтрифосфата (ГТФ) с а-субъединицей и диссоциации этой субъединицы от гетеродимера βу. а- и βy-субъединицы активируют компоненты трансдукции. а-Субъединица гидролизует ГТФ до ГДФ, который, в свою очередь, инактивирует а-субъединицу, способствуя восстановлению ее связи с βу-комплексом и инактивации G-белка.
Стимуляция или ингибирование G-белка ведет к модуляции ферментных систем, ответственных за продукцию следующих компонентов трансдукции (иногда их называют вторичными мессенджерами):
- циклических нуклеотидов;
- диацилглицерола;
- инозитолфосфата.
Например, активация β2-адренорецептора активирует G-белок. Это, в свою очередь, активирует аденилилциклазу — фермент, катализирующий образование цАМФ. Трансдукция протекает путем активации цАМФ за счет протеинкиназы и фосфорилирования ферментов, типы которых зависят от вида ткани.
В клетках существует несколько подтипов G-белков. а-Подтип определяет главные свойства G-белка. Например, β-адренорецепторы обычно взаимодействуют с G-белками, несущими аs-субъединицы, которые активируют аденилилциклазу.
Описание к рис. 2.25 Пример трансдукции, инициированной ферментом. Ферменты фосфодиэстеразы (а) участвуют в обмене циклических нуклеотидов (например, цАМФ). Эта группа ферментов ингибируется теофиллином. Ингибирование ведет к накоплению циклических нуклеотидов в клетке (б). Следует учесть, что циклические нуклеотиды накапливаются в ответ на действие препаратов на ферменты нуклеотидциклазы, связанные с С-белком. АМФ — аденозинмонофосфат; АТФ — аденозинтрифосфат; цАМФ — циклический аденозинмонофосфат.
Са2+-связанная трансдукция
Мобилизация внутриклеточного Са2+ как вторичного мессенджера — последнее звено в цепи реакций, продуцирующих компоненты трансдукции.
Ион Са2+ вовлечен в трансдукцию в следующих процессах:
- сокращение гладких мышц;
- ускорение сокращения и расслабления кардио-миоцитов;
- секреция трансмиттеров и железистая секреция;
- выброс гормонов;
- цитотоксичность;
- активация некоторых ферментов.
Мобилизация Са2+ связана с активностью других компонентов трансдукции. Са2+ накапливается в эндоплазматическом ретикулуме гладких мышц и выходит при действии IР3 на специфический РСК, называемый IР3-рецептором.
Выброс ДАГ происходит при прямом действии фосфолипазы С (или D) на активность мембраносвязанной протеинкиназы С, которая обеспечивает фосфорилирование остатков серина и треонина и последующую активацию более 50 различных белков. Существует как минимум шесть типов протеинкиназы С, каждый из которых имеет субстратную специфичность.
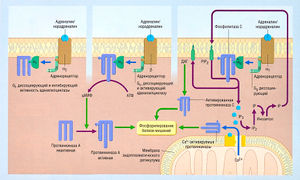
Действие важных G-белков
- Gs стимулирует адеиилилциклазу и активирует Са2+-каналы
- Gi ингибирует адеиилилциклазу и активирует К+-каналы
- Gq активирует фосфолипазу С
- Go ингибирует ток Са2+
- Gt стимулирует адеиилилциклазу глаза
- Gdf стимулирует адеиилилциклазу носа
- β-, а-субъединицы активируют многие компоненты трансдукции
Трансдукция, связанная с протеинкиназой С
Протеинкиназа С является важным компонентом трансдукции в следующих реакциях:
- модуляции выброса эндокринных гормонов и нейротрансмиттеров;
- сокращения гладких мышц;
- воспаления;
- ионного транспорта;
- роста опухолей.
Трансдукция, инициируемая ДНК-связанными рецепторами
Активация ДНК-связанной трансдукции влечет изменение синтеза белка. Например, стероиды перемещают HSP90 и образуемый комплекс стероид-рецептор в ядро. В ядре комплекс стероид-рецептор может различать специфические последовательности оснований и активировать специфические гены. Этот процесс идет медленнее, чем миллисекундные ответы, наблюдаемые при других формах трансдукции. Например:
- глюкокортикостероиды увеличивают продукцию липокортина, что объясняет их противовоспалительное действие;
- минералокортикостероиды увеличивают в почках продукцию специфических молекул, вовлеченных в тубулярный транспорт ионов Na+ и К+.
Трансдукция, инициируемая рецепторами с тирозинкиназной активностью
Активация тирозинкиназных рецепторов обеспечивает аутофосфорилирование остатков тирозина, которые служат селективными центрами для разных внутриклеточных белков. Фосфорилированный рецептор действует как платформа для связывания других белков, что ведет к фосфорилированию и активации сложных реакций через каскад других протеинкиназ. Многие из образуемых реакций сходны с реакциями, инициируемыми G-белками.
Многие тирозинкиназные рецепторы несут связывающие центры для других белков, вовлеченных в сигнальную трансдукцию. Один из таких связывающих центров называют SH2. Присоединение неактивного фермента к SH2 ведет к высокоселективной активации фермента. Часто активированные ферменты вовлечены в транскрипцию генов. Ряд протеинкиназ, IР3 и Са2+ могут участвовать в промежуточных этапах трансдукции. Многие факторы роста действуют посредством этого механизма. В связи с этим интерес представляет разработка препаратов, взаимодействующих с SH2 или повторяющих активность SH2, т.к. эти препараты влияют на рост и дифференцировку клеток, поэтому возможно применение таких препаратов при злокачественных опухолях, иммунологической патологии и других заболеваниях. К протеинам, участвующим в трансдукции через тирозинкиназные рецепторы, относят небольшой G-белок ras.
Трансдукция, инициируемая РСК
Когда РСК инициирует трансдукцию, запускаются реакции вследствие изменения потенциала мембран, связанного с увеличением (или уменьшением) проницаемости к тем ионам, которые проходят через РСК. Таким образом, трансдукция начинается с изменения заряда, что ведет к деполяризации или гиперполяризации мембраны. Типичной локализацией РСК является плазматическая мембрана, но РСК также найдены в митохондриях и других внутриклеточных органеллах.
Изменение мембранного потенциала может прямо модулировать функцию ткани. В скелетных мышцах активация никотиновых РСК деполяризует мембрану концевой пластинки, а следовательно, и саркоплазматического ретикулума (после генерации потенциала в сарколемме), что приводит к выходу Са2+ в цитоплазму и сокращению мышц.
Примеры интеграции клеточного и молекулярного механизмов
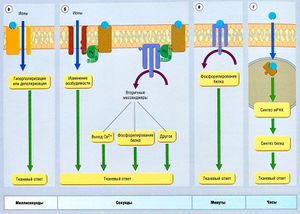
Некоторые примеры интеграции молекулярного и клеточного механизмов описаны далее (рис. 2.26). Скорость трансдукции и проявление тканевого ответа определяются молекулярной мишенью (рецептором) и механизмом трансдукции. Эта скорость определяет начало тканевого ответа. Например:
- взаимодействие агониста с РСК приводит к быстрой (миллисекунды) клеточной деполяризации или гиперполяризации;
- взаимодействие агониста с G-белок-связанным рецептором может привести к одному из многих ответов, длящихся секунды;
- взаимодействие препарата непосредственно с ферментом может привести к изменениям в течение нескольких минут;
- взаимодействие препарата непосредственно с ДНК может изменить экспрессию генов и синтез нового белка в течение нескольких часов. Примеры интеграции между молекулярными и клеточными ответами показаны на рис. 2.26, 2.27, 2.28.
Описание к рис. 2.26 Несколько типов траисдукции могут привести к фосфорилированию белков. Циклический аденозинмонофосфат (цАМФ) и фосфатидилинозитол являются важными компонентами трансдукции (вторичные мессенджеры). Продукция цАМФ возрастает в ответ на активацию многих С-белок-связанных рецепторов (например, активацию а2- или Рррецепторов адреналином, как показано в центре рисунка, вследствие агонизма к p-адренорецептору). Протеинкиназы (например, протеинкиназа А), активированные цАМФ, являются вторичными мессенджерами, участвующими в клеточном ответе. Определенные типы агонизма (например, активация а2-адренорецептора) ведут к ингибированию продукции цАМФ из-за активации ингибиторных G-белков (Gi) (верхняя левая часть рисунка). Фермент фосфолипаза С (локализованная на клеточной мембране) активируется агонистом, продуцируя вторичные мессенджеры lns(l,4,5)P3 (инозитол-1,4,5-трифосфат, 1Р3) и диацилглицерол (ДАГ) (правая часть рисунка). Внутриклеточный 1Р3 выводит внутриклеточный Са2+, в то время как ДАГ остается на мембране, где активирует протеинкиназу С. 1Р3 подвергается последующему дефосфорилированию внутриклеточными фосфатазами с образованием IP2, IP и инозитола, который затем может быть заключен в мембрану с образованием фосфатидилинозитола (PI), который фосфорилируется через аденозинтрифосфат (АТФ) до фосфатидилинозитолдифосфата (Р1Р2). Переход 1Р3 и ДАГ в PI блокируется литием, который истощает инозитоловые липиды в мозге. Литий используют как средство лечения маниакальных депрессий (см. главу 8). Gs — стимулирующий G-белок.
Описание к рис. 2.27 Взаимосвязь молекулярных и клеточных механизмов, (а) Очень быстрая трансдукция, ассоциированная с рецептор-связанными каналами, (б) Быстрая трансдукция, связанная с С-белком. (в) Медленная трансдукция, связанная с ферментами и насосами, (г) Очень медленная трансдукция, связанная с дезоксирибонуклеиновой кислотой. мРНК — матричная рибонуклеиновая кислота.
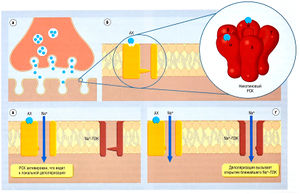
Описание к рис. 2.28 Пример трансдукции, ассоциированной с рецептор-связанным ионным каналом, (а) В ответ на электрический импульс, поступающий с нервного окончания, везикулы с ацетилхолином (АХ) сливаются с мембраной терминальной пластинки, что ведет к выбросу АХ в синаптическую щель, (б) АХ связывается с рецептором в участке а-субъединицы рецептор-связанного канала (РСК), вызывает его открытие и, как следствие, вход Na+ и выход К+, что ведет к локальной деполяризации (в). Деполяризация инициирует трансдукцию, которая ведет к открытию Na+-n3K в соседних участках мембраны скелетных мышц, вызывая дальнейший вход Na+ и запуская обширную деполяризацию, активацию Са2+-ПЗК и сокращение мышечных волокон (г). ПЗК — потенциал-зависимый канал.