Печень
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Содержание
Печень как орган выведения
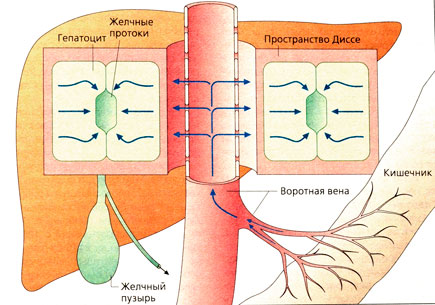
Печень является главным органом, котором происходит метаболизм лекарственных веществ. В печень ежеминутно поступает 1100 мл крови через портальную вену и 350 мл через печеночную артерию. Печень имеет очень большое кровенаполнение: в ее сосудах и синусах содержится 500 мл крови. В сильно разветвленной сосудистой сети печени скорость протекания крови снижается (А). Специализированный эндотелий печеночных сосудов быстро пропускает белки из крови. Фенестрированный эндотелий печеночной сосуд истой системы обеспечивает необычайно тесный контакт и интенсивный обмен между кровью и паренхиматозными клетками печени, который усиливается микроворсинками пространства Диссе.
Гепатоциты выделяют желчь, которая по желчным протокам направляется в желчный пузырь (зеленый цвет). Секреторная активность гепатоцитов направлена в сторону желчного пузыря (А).
Гепатоцит содержит множество ферментов, расположенных в митохондриях или на мембранах шероховатого (ШЭР) или гладкого (ГЭР) эндоплазматического ретикулума. Наиболее важны в метаболизме лекарственных веществ ферменты гладкого эндоплазматического ретикулума; там происходят окислительно-восстановительные реакции с участием молекулярного кислорода. Ферменты, осуществляющие гидроксилирование, а также окислительное расщепление N—С- или О—С-связей, называются гидроксилазами или оксидазами. Главной составной частью ферментативной системы ГЭР является железосодержащий цитохром Р 450.
Существует несколько типов цитохром-оксидаз. Они отличаются субстратной специфичностью и на основании первичной структуры подразделяются на группы (например, CYP3), подгруппы (например, CYP3A) и отдельные изоферменты (например, CYP3A4). Встречаются генетически обусловленные различия в ферментативной системе (например, CYP2D6), приводящие к тому, что биотрансформация лекарственных веществ у разных людей происходит по-разному. Это также относится к другим ферментативным системам {генетический полиморфизм биотрансформации).
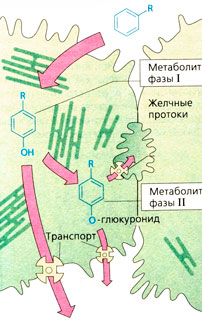
Липофильные лекарственные вещества по сравнению с гидрофильными быстрее захватываются гепатоцитами и поступают на мембраны гладкого эндоплазматического ретикулума, на котором расположены многофункциональные оксидазы. Например, вещество, проявляющее благодаря наличию ароматической структуры (фенильная группа) липофильные свойства, гидроксилируется (реакция фазы I) и становится гидрофильным (Б). Кроме оксидаз на гладком эндоплазматическом ретикулуме имеются редуктазы и глюкуронилтрансферазы. Последние присоединяют глюкуроновую кислоту (фаза II) к гидрокси-, карбокси-, амино- и амидной группе, например к фенолу, который образуется в фазе I. Метаболиты фаз I и II благодаря транспорту по градиенту концентрации или с помощью так называемых ABC-переносчиков могут попадать в кровь или оседать в желчном пузыре. Для различных целей служат различные транспортные белки. Так, белок MRP2 {от англ. multidrug resistance associated protein 2) транспортирует анионные конъюгаты в желчные потоки, а белок MRP3 может доставлять их через мембраны гепатоцитов в кровь.
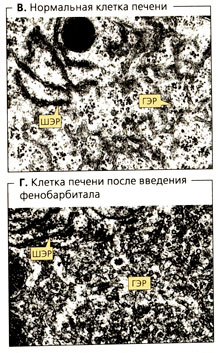
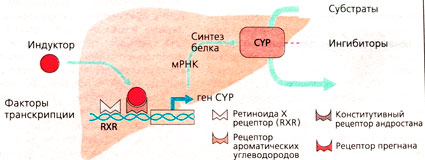
Длительное применение лекарственного препарата или вредного вещества может привести к разрастанию гладкого эндоплазматического ретикулума (см. В и Г). Молекулярный механизм такой «гипертрофии» ГЭР и его ферментов для некоторых веществ известен: так, фенобарбитал связывается с ядерным рецептором (конститутивным рецептором андростатина), который управляет экспрессией цитохромов CYP2C9 и CYP2D6. Такая индукция ферментов затрагивает все ферменты, находящиеся на ГЭР. Индукция ферментов ускоряет биотрансформацию не только тех лекарств, которые вызывают индукцию, но и других лекарств (взаимодействие лекарственных веществ). Этот процесс протекает в печени несколько дней, повышает метаболизм в 2-3 раза и заканчивается после отмены препарата.
Биотрансформация лекарств
Попадая в организм, многие лекарства подвергаются химическим изменениям (биотрансформация). Чаще всего эти изменения приводят к понижению активности и повышению гидрофильности (растворимости в воде). Гидрофильность способствует выведению вещества почками. Хорошая управляемость лекарством достигается только при его быстром выведении, поэтому многие лекарственные вещества имеют в молекуле быстро гидролизующиеся связи.
Например, эфирная связь расщепляется под действием ферментов (гидролиз). Гидролиз, окисление, восстановление, алкилирование и дезалкилирование относятся к метаболическим реакциям фазы I, которая включает все реакции обмена веществ, приводящие к изменению молекулярного строения вещества. В метаболических реакциях фазы II лекарство или продукт метаболизма, образовавшийся в фазе I, связывается с глюкуроновой или серной кислотой.
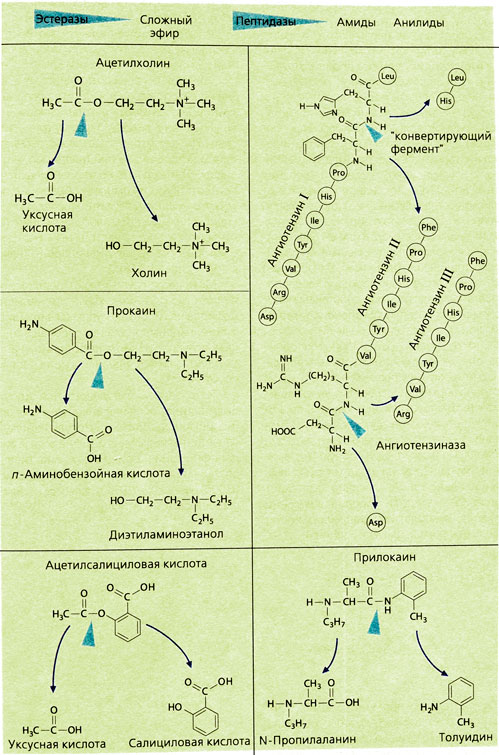
Одним из быстро гидролизуемых по эфирной связи веществ является медиатор ацетилхолин. С помощью специфической ацетилхолинэстеразы и неспецифической холинэстеразы плазмы ацетилхолин расщепляется в организме так быстро, что его терапевтическое применение невозможно. Гидролиз других эфиров эстеразами протекает медленнее, хотя по сравнению с остальными реакциями биотрансформации эти реакции все же являются очень быстрыми. Например, местный анестетик прокаин действует только в месте инъекции и не оказывает системного влияния, так как при попадании в кровь быстро разлагается.
Расщепление по эфирной связи не всегда приводит к образованию неактивных метаболитов: продукт распада ацетилсалициловой кислоты — салициловая кислота также фармакологически активна. Синтез лекарств в форме эфиров имеет следующие цели: улучшение всасывания (эналаприл — эналаприловая кислота, тестостерона ундеканоат — тестостерон) или улучшение переносимости препарата желудком или кишечником (ацетилсалициловая кислота —салициловая кислота, эритромицина сукцинат — эритромицин). Эти эфиры сами неактивны, лишь продукт их гидролиза может оказывать лечебное действие. Таким образом, неактивное вещество (пролекарство) после гидролиза в крови становится активным.
Некоторые лекарства, имеющие амидную связь, например прилокаин (а также природные пептиды), гидролизуются пептидазами и таким путем инактивируются.
Таким образом, пептидазы представляют большой интерес для фармакологии, так как они могут образовывать из биологически неактивных белков высокоактивные продукты расщепления (фибрин) или олигопептиды (ангиотензин II; брадикинин, энкефалин). Ферменты, гидролизующие пептиды, специфичны к субстратам и могут быть селективно заблокированы. Например, гормон ангиотензин II, являющийся вазоконстриктором, образуется из ангиотензина I при отщеплении двух концевых аминокислот лейцина (Leu) и гистидина (His). Г идролиз катализирует специфическая дипептидаза ангиотензин-превращающий фермент (АПФ). Аналог этого пептида каптоприл может блокировать гидролиз. Ангиотензин II расщепляется после того, как под действием ангиотензиназы А от него отщепляется N-концевая аминокислота аспарагин (Asp). Образовавшийся ангиотензин III не обладает вазоконстрикторным действием.
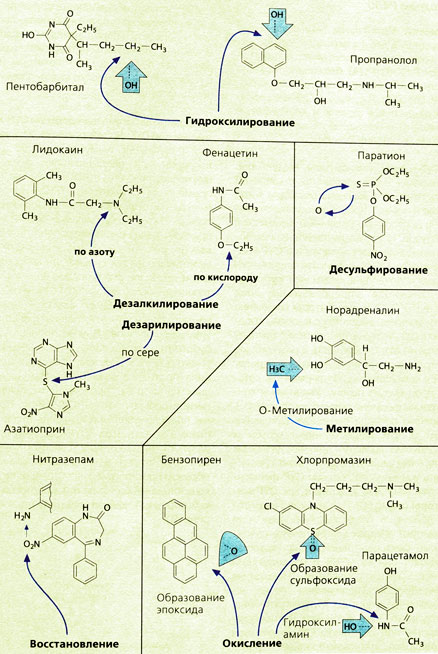
Реакции окисления протекают либо с присоединением кислорода к лекарственному веществу, либо с отщеплением части молекулы вследствие ее первичного окисления. К первому типу реакций окисления относятся гидроксилирование, эпоксидирование и сульфоксидирование. Гидроксилированию подвергаются алкильные цепи молекул (например, в пентобарбитале) или ароматические кольца (например, в пропранололе). В обоих случаях образуются продукты, которые связываются в фазе II, например, с глюкуроновой кислотой (реакция конъюгации). Гидроксилирование может происходить при связывании гидроксильной группы с атомом азота с образованием гидроксиламина (например, в случае парацетамола). Бензол, полициклические ароматические соединения (например, бензопирен) и ненасыщенные циклические углеводороды метаболизируются под действием монооксигеназ с образованием эпоксисоединений, которые благодаря сильной электрофильности очень реакционноспособны, гепатотоксичны и, возможно, канцерогенны.
Ко второму типу реакций окислительной биотрансформации относится деалкилирование. Деалкилирование аминов происходит по атому азота одновременно с гидроксилированием соседнего с азотом атома углерода. Промежуточный продукт нестабилен и распадается на деалкилированный амин и альдегид. Аналогично протекает деалкилирование по кислороду (например, в случае фенацетина) или деарилирование по сере (например, для азатиоприна).
Окислительное деаминирование, т. е. отщепление одной ЫН2-группы, соответствует деалкилированию первичного амина (R1 = R2 = Н). Гидроксилированный промежуточный продукт распадается на аммиак и соответствующий альдегид. Последний частично восстанавливается до спирта или же окисляется до карбоновой кислоты.
Реакции восстановления протекают по кислороду или по азоту. При восстановлении кортизона до гидрокортизона (кортизола), как и преднизона до преднизолона, кислород кетогруппы образует гидроксильную группу. Это пример перехода лекарственного вещества в активную форму (биоактивация). По азоту протекает восстановление азо- и нитросоединений (например, нитразепам). Нитрогруппы восстанавливаются до соответствующих аминов, образуя на промежуточных стадиях нитрозосоединения и гидроксиламины. Дегалогенирование тоже относится к восстановительным реакциям, в которых участвуют углеводороды (например, галотан).
Метильные группы могут переноситься с помощью ряда специфических метилтрансфераз на гидроксигруппы (О-метипирование, например, для норадреналина) или аминогруппы (N-метилирование, например, для норадреналина, гистамина или серотонина).
Тиосоединения подвергаются десульфированию, обменивая серу на кислород (например, паратион). Десульфирование является примером того, что не всякая биотрансформация приводит к инактивации соединения: образующийся из паратиона (Е605) параоксон (Е 600) является активным веществом (биоактивация).
Метаболизм лекарств под действием фермента цитохром Р450
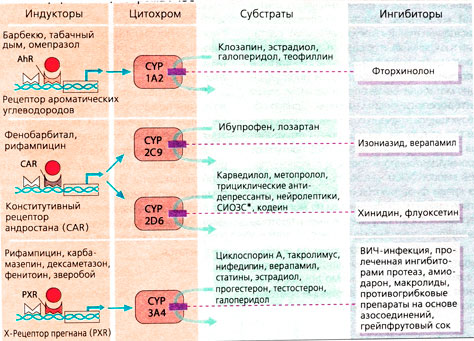
Фермент. Метаболизм лекарства можно разделить на две фазы. Реакции фазы I в основном катализируются белком цитохром Р450 (CYP) (А). Для метаболизма лекарств наиболее важны цитохромы CYP1, CYP2, CYP3 (В). В основном CYP-ферменты продуцируются в печени и кишечнике, и именно в этих органах протекают основные реакции метаболизма лекарств.
Субстраты, ингибиторы, индукторы. Цитохромы - это ферменты с широкой субстратной специфичностью. Один такой фермент может преобразовывать лекарства с совершенно различной химической структурой. После взаимодействия некоторых лекарственных препаратов с CYP-изо-ферментом могут возникать клинически важные последствия. Различают субстраты (лекарства, преобразуемые под действием CYP) и ингибиторы (медленно разлагающиеся лекарства с высоким сродством к CYP, которые препятствуют распаду субстрата) (А). Способность к разложению субстрата в значительной степени определяется количеством CYP-ферментов, которые продуцирует печень. Увеличение концентрации ферментов ведет, как правило, к ускорению распада лекарства. Под действием многих веществ, продуцируемых внутренними органами или поступающих извне, в том числе и лекарств, может происходить усиление экспрессии CYP-ферментов; эти вещества действуют как CYP-индукторы. Большинство индукторов действуют следующим образом: они активируют в ядрах клеток печени специфичные факторы транскрипции, которые запускают синтез мРНК и последующий синтез CYP-изоферментов. Некоторые CYP-индукторы увеличивают также экспрессию транспортных Р-гликопротеинов, в результате чего активный метаболизм лекарства под действием CYP-ферментов дополняется транемембранным транспортом, и лекарство становится неактивным.
Из схемы Б можно получить общие представления о различных CYP-изоферментах, блокаторах и индукторах. Особенно важно учитывать их действие в случае пациентов, получающих различные лекарственные препараты: перед началом терапии необходимо проверить, не содержат ли назначаемые лекарства CYP-блокаторы или CYP-индукторы, что может иметь драматические последствия.
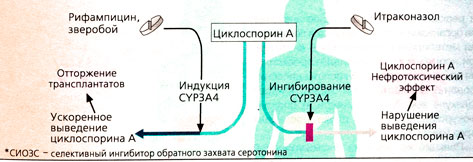
Взаимодействие лекарств при CYP-индукции или CYP-ингибировании. У пациентов, получавших иммуносупрессор циклоспорин А для предотвращения отторжения после пересадки почек или сердца, при применении индукторов СУРЗА4-изофер-ментов наблюдались опасные для жизни реакции. При приеме рифампицина, а также препаратов на основе зверобоя, отпускаемых без рецепта врача, экспрессия CYP3A4 может вырасти так сильно, что концентрация циклоспорина А в плазме падает ниже терапевтического уровня (В). При недостаточном подавлении иммунной реакции возрастает опасность отторжения трансплантируемых органов. Другие препараты — субстраты для CYP3A4 — не оказывают такого действия. Поэтому прием рифампицина противопоказан ВИЧ-инфицированным пациентам, проходившим лечение ингибиторами протеаз. CYP-Ингибиторы, как правило, увеличивают концентрацию в плазме субстратов CYP-ферментов, в результате чего возрастает опасность нежелательных токсических эффектов. Таким же образом противогрибковый препарат итра-коназол может увеличивать нефротоксичес-кий побочный эффект действия циклоспорина (В).
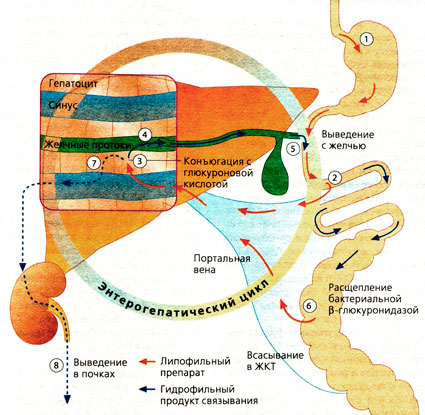
Энтерогепатическое циклирование
После всасывания в кишечнике лекарственные вещества попадают по портальной вене в печень, где могут связываться с глюкуроновой кислотой (Б, слева: механизм действия салициловой кислоты), с серной кислотой (Б, справа: механизм действия деацетилированного бисакодила) или с другими полярными молекулами. Образовавшиеся гидрофильные соединения при помощи транспортных механизмов переносятся из гепатоцита в желчь и с ней выводятся из организма через кишечник. Гидрофильные соединения не могут проникать через эпителий кишечника. Однако О-глюкурониды расщепляются β-глюкуронидазами бактерий в кишечнике, а образующееся при этом соединение всасывается вновь (обратное всасывание). В совокупности происходящие метаболические процессы называются энтерогепатическим циклом. Однако образующиеся в печени соединения попадают не только в желчь, но и в кровь. Глюкурониды с молекулярной массой <300 поступают преимущественно в кровь, а с молекулярной массой >300 — в желчь. Глюкурониды из крови фильтруются почками, но вследствие своей гидрофильности не могут подвергаться обратному всасыванию и поэтому выводятся из организма с мочой.
Лекарства, циркулирующие по энтерогепатическому циклу, выводятся медленно. К таким препаратам, помимо других, относятся дигитоксин и нестероидные противовоспалительные препараты.
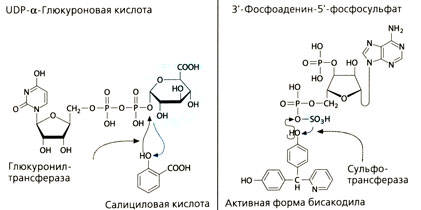
Реакции конъюгации
Из реакций фазы II наибольшее значение для организма имеет конъюгация лекарства или метаболита с глюкуроновой кислотой. При нормальном значении pH карбоксильная группа глюкуроновой кислоты диссоциирована. Отрицательный заряд придает молекуле высокую полярность, и поэтому глюкуроновая кислота плохо проникает через мембраны.
Реакция конъюгации с глюкуроновой кислотой происходит только тогда, когда она находится в активном состоянии, а именно связана с уридиндифосфатом (UDP). Микросомальные глюкуронилтрансферазы, взаимодействуя с этим комплексом, переносят глюкуроновую кислоту на акцепторную молекулу. Если акцепторная молекула присоединяет глюкуроновую кислоту по своей фенольной, спиртовой или карбоксильной группе, то образуется глюкуронид. Если акцепторная молекула — амид, может образоваться N-глюкуронид, но N-глюкурониды, в отличие от О-глюкуронидов, не расщепляются β-глюкуронидазами бактерий.
Сульфотрансферазы, находящиеся в цитоплазме, переносят активированные серные кислоты (3'-фосфоаденин-5'-фосфосульфат) на спирты и фенолы. Продуктом реакции, как и в случае глюкуронидов, является кислота.
Продукт реакции активной уксусной кислоты (ацетилкофермент А) со спиртом или фенолом, протекающей под действием ацилтрансферазы, не является кислотой.
Ацилтрансферазы участвуют также в переносе аминокислот глицина и глутамина на карбоксикислоты. В этом случае карбоксигруппа акцепторной молекулы и аминогруппа переносимой аминокислоты образуют амидную связь. Кислотная функция глицина и глутамина в образовавшемся соединении сохраняется.