Прочие противоопухолевые средства
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Другие группы противоопухолевых препаратов
Препараты платины
В 1965 г. Розенберг и сотр. обнаружили цитотокснческое действие комплексных соединений платины, показав, что ток, пропущенный между платиновыми электродами, погруженными в питательную среду, нарушает пролиферацию Escherichia coli. Вскоре выяснилось, что это обусловлено образованием неорганических соединений платины в присутствии ионов хлора и аммония (Rosenberg etal., 1965,1967). Наиболее активным из этих соединений оказался цисплатин (цис-диаминдихлорплатина), нашедший широкое клиническое применение (Rosenberg, 1973). В дальнейшем было получено более 100 различных препаратов платины. Один из них, карбоплатин, в 1989 г. был одобрен ФДА для лечения рака яичников, другие препараты проходят испытания. Спектр активности цисплатина весьма широк, особую ценность представляет его действие на эпителиальные опухоли. Он служит основой схем химиотерапии, позволяющих излечивать опухоли яичка; препарат показал высокую активность при раке яичников, мочевого пузыря, пищевода, легких, а также при опухолях головы и шеи.
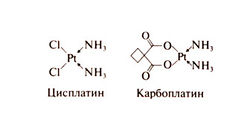
Структурно-функциональная зависимость. Цисплатин — это водорастворимое неорганическое соединение двухвалентной платины. Проводятся клинические испытания других препаратов платины — тетраплатина, ормиплатина, ипроплатина, оксалиплатина; опухоли, устойчивые к цисплатину, сохраняют чувствительность к некоторым из них (Kelland, 1993). Комплексные соединения двух- или четырехвалентной платины с различными органическими радикалами более стабильны и менее нефротоксичны, чем цисплатин, однако высокой противоопухолевой активности они пока не показали. В молекуле карбоплатина платина также связана со сложным органическим радикалом. Структурные формулы карбоплатина и цисплатина следующие:
Механизм действия. Атомы хлора в составе цисплатина легко замещаются нуклеофилами, например тиолами или водой. В последнем случае молекула приобретает положительный заряд, за счет чего, по-видимому, и происходит активация препарата, который затем реагирует с нуклеиновыми кислотами и белками. Гидролизу способствует низкая концентрация ионов хлора. В противном случае цисплатин стабилизируется, поэтому создание высокой концентрации ионов хлора в моче препятствует токсическому действию препарата на почки (см. ниже). Карбоплатин гидролизуется медленнее цисплатина, при этом отщепляется двухосновная цикл обута ндикарбоновая кислота. Реагируя с ДНК, прежде всего с атомом N-7 гуанина, препараты платины образуют в одной цепи ДН К сшивки между соседними гуанинами или между гуанином и аденином. Сшивки между цепями возникают медленнее и в меньшем количестве. Связавшись с ДНК, цисплатин нарушает репликацию и транскрипцию, а также вызывает мутации и разрыв цепи. Хотя четкая зависимость между связыванием препаратов платины с ДНК и их активностью не установлена, противоопухолевый эффект, по-видимому, зависит от способности клеток к образованию и накоплению комплексов платины с ДНК. Количественная оценка цитотоксического действия этих комплексов затруднена, так как сложно определить роль генетических особенностей и средовых факторов, действующих на нормальные и опухолевые клетки, а кроме того, роль других противоопухолевых препаратов, обычно назначаемых вместе с препаратами платины. Тем не менее, согласно экспериментальным исследованиям, решающее значение для цитотоксичности имеют сшивки между гуанином и аденином (Reed et al., 1986; Parker et al., 1991b; Comess et al., 1992; Fichtinger-Schepman et al., 1995; Welters etal., 1999).
Активность цисплатина в разных периодах клеточного цикла зависит от типа клеток, однако сшивки цепей ДНК проявляются прежде всего в периоде S. Цисплатин обладает мутагенным, канцерогенным и тератогенным действием. Описаны случаи вторичных лейкозов; в частности, лечение рака яичников цисплатином или карбоплатином повышает риск лейкоза в 4 раза (Jeha et al., 1992; Travis etal., 1999).
Механизмы устойчивости к препаратам платины изучены неполно. Экспериментальные опухоли, устойчивые к цисплатину, могут сохранять чувствительность к его аналогам. Устойчивость к цисплатину и карбоплатину обычно перекрестная, но при этом сохраняется чувствительность к оксалиплатину и производным четырехвалентной платины, что привлекает интерес к этим препаратам. На чувствительность к цисплатину влияет ряд факторов — накопление препарата в опухолевых клетках, внутриклеточная концентрация глутатиона и других тиолов, например металлотионеина, которые связывают и инактивируют препарат (Meijer et al., 1990), а также скорость репарации ДНК (Parker etal., 1991а). Связывание с цисплатином вызывает перегиб спирали ДН К, распознаваемый особыми белками с высокоподвижными доменами (Huang et al., 1994); считается, что они препятствуют репарации. Комплекс цисплатина с ДН К устраняется в процессе эксцизионной репарации нуклеотидов (Dab-holkar et al., 1994; Reed, 1998; de Laat et al., 1999). Ферменты репарации распознают измененный нуклеотид, удаляют поврежденный фрагмент цепи вокруг него и восстанавливают целость цепи ДНК. Ингибирование эксцизионной репарации может повышать чувствительность к цисплатину.
Очевидно, устойчивость к цисплатину связана также с системой репарации неспаренных нуклеотидов ДНК. Белки, входящие в эту систему, особенно MLH1 и MSH6, вероятно, играют важную роль в распознавании нуклеотидов, связанных с платиной, и запуске апоптоза. Дефицит этих белков вызывает устойчивость к цисплатину in vitro (Vaisman et al., 1998). Распознавание белком MLH1 комплекса ДНК с цисплатином усиливает синтез белка р73 (аналога р53) и тирозинкиназы АЫ1, что в итоге приводит к апоптозу (Gong et al., 1999). При дефиците белков, участвующих в репарации неспаренных нуклеотидов, или при неспособности к активации тирозинкиназы АЫ1 клетки не подвергаются апоптозу под действием цисплатина.
Цисплатин
Фармакокинетика. При быстром в/в введении в обычных дозах начальный Т1/2 цисплатина составляет 25— 50 мин, далее снижение сывороточной концентрации препарата (как свободного, так и связанного) замедляется, и конечный Т1/2 составляет 24 ч и более. В крови более 90% цисплатина ковалентно связано с белками. Он накапливается в почках, печени, кишечнике и яичках, но плохо проникает в ЦНС. В первые 6 ч с мочой выводится лишь небольшая часть цисплатина, через 24 — до 25%, через 5 сут—до 43%. При длительной инфузии Т1/2 уменьшается и доля препарата, выводимая с мочой, возрастает. Цисплатин почти не экскретируется кишечником и с желчью (Bajorin et al., 1986).
Применение. Цисплатин вводят по 20 мг/м2 в/в ежедневно в течение 5 сут или по 100 мг/м2 каждые 4 нед. При поздних стадиях рака яичников цисплатин (в виде монотерапии или в сочетании с циклофосфамидом) применялся в дозах до 40 мг/м2 ежедневно в течение 5 сут, однако такое лечение сопровождалось выраженной нефро-, ото- и нейротоксичностью (Ozols et al., 1984). Чтобы избежать поражения почек, перед цисплатином вводят 1—2 л физиологического раствора. Сам цисплатин разводят в 5% глюкозе или физиологическом растворе и вводят в течение 6—8 ч. Во время приготовления и введения раствора нельзя использовать иглы и другие приспособления, содержащие алюминий, так как последний инактивирует цисплатин.
Комбинация цисплатина, блеомицина и этопозида (или винбластина) излечивает опухоли яичка в 85% случаев (Williams and Einhorn, 1985; Einhorn, 1986). Цисплатин эффективен при раке яичников в сочетании с паклитакселом, циклофосфамидом или доксорубицином (Durant and Omura, 1985). Кроме того, к цисплатину чувствительны рак мочевого пузыря, рак тела матки, мелкоклеточный рак легкого, опухоли головы и шеи и некоторые солидные опухоли у детей. Наконец, цисплатин оказывает радиосенсибилизирующее действие (Pearson and Raghavan, 1985).
Побочные эффекты. Благодаря инфузионной терапии и диуретикам поражение почек на фоне цисплатина сейчас возникает намного реже. Однако ототоксическое действие при этом сохраняется. Оно проявляется звоном в ушах и снижением слуха в области высоких частот (4—8 кГц), бывает односторонним, носит кумулятивный характер и тяжелее протекает у детей. Почти всегда возникают выраженные тошнота и рвота, но их можно ослабить с помощью блокаторов серотониновых рецепторов и высоких доз глюкокортикоидов. Длительное лечение и высокие дозы ведут к нейропатии, она может прогрессировать даже после отмены препарата. Цисплатин умеренно угнетает кроветворение: наблюдаются преходящие лейкопения, тромбоцитопения и анемия. Часто наблюдаются электролитные нарушения, включая снижение концентрации магния, кальция, калия и фосфатов в крови. Гипокальциемия и гипомагниемия связаны с потерей этих ионов с мочой; эти нарушения могут сопровождаться тетанией. Рекомендуется следить за концентрацией магния в плазме. Описаны также гиперурикемия, эпилептические припадки, гемолитическая анемия и аритмии. В течение нескольких минут после введения возможны анафилактоидные реакции, включая отек лица, бронхоспазм, тахикардию и снижение АД; в этих случаях показано в/в введение адреналина, глюкокортикоидов и Н1-блокаторов.
Карбоплатин
Карбоплатин по механизму действия и спектру активности соответствует цисплатину. Однако эти препараты существенно различаются по строению, фармакокинетике и токсичности (Von Hoff, 1987; Muggia, 1989; Ozols, 1989).
Карбоплатин менее активно, чем цисплатин, вступает в химические реакции и слабо связывается с белками плазмы. Поэтому кровь практически не содержит продуктов гидролиза карбоплатина, и почти весь препарат выводится почками в неизмененном виде; Т1/2 составляет около 2 ч. Платина карбоплатина, ковалентно связанная с белками плазмы, выводится медленнее (Т1/2 составляет 5 сут и более).
Карбоплатин переносится достаточно хорошо. Он реже, чем цисплатин, вызывает тошноту и рвоту, он также менее нейро-, ото- и нефротоксичен. Основное побочное действие — угнетение кроветворения, в первую очередь тромбоцитопения. При раке яичников (после циторедуктивной операции), немелкоклеточном раке легкого и поздней стадии мелкоклеточного рака легкого карбоплатин по эффективности не уступает цисплатину, но при герминогенных опухолях, раке пищевода и опухолях головы и шеи карбоплатин менее эффективен (Go and Adjei, 1999). Карбоплатин можно назначить онкологическим больным, которым противопоказан цисплатин, например при почечной недостаточности, упорной тошноте, значительном снижении слуха и нейропатии. Карбоплатин используют для высокодозной терапии с трансплантацией костного мозга или стволовых клеток крови. При почечной недостаточности дозу уменьшают пропорционально снижению СКФ (Van Echo et al., 1989). Предложена формула для расчета дозы карбоплатина (Calvert et al., 1989):
Доза (мг) = ПФК х (СКФ + 25).
При монотерапии карбоплатином его доза рассчитывается для ПФК 5—7 мг I мин х мл'1.
Карбоплатин вводят в/в не быстрее чем за 15 мин. Обычная доза — 360 мг/м2 с интервалами в 4 нед. Карбоплатин используют прежде всего при раке яичников (в сочетании с паклитакселом или циклофосфамилом), а также при раке легкого, мочевого пузыря, опухолях головы и шеи.
Оксалиплатин
В молекуле оксалигшатина ([транс-1,2-диами-ноциклогексано]-оксалатоплатины|II]) лигандом платины выступает диаминоциклогексан, благодаря которому ферменты эксцизионной репарации нуклеотидов и репарации неспаренных нуклеотидов не распознают комплекс препарата с ДНК. Структурная формула оксалиплатина следующая:
В отличие от цисплатина и карбоплатина оксалиплатин одинаково эффективен в отношении клеточных линий и ксенотрансплантатов опухолей с нормальной и с дефектной репарацией неспаренных нуклеотидов (Fink et al., 19%; Fink et al., 1997). В частности, мутации гена MLHl вызывают устойчивость к нистатину in vitro, не влияя на чувствительность к оксалиплатину (Vaisman et al., 1998). Кроме того, оксалиплатин не повышает активность тирозинкиназы АЫ1, что наблюдается под действием цисплатина при ненарушенной репарации неспаренных нуклеотидов (Nehme et al., 1999).
В отличие от цисплатина и карбоплатина оксалиплатин обладает очень большим объемом распределения (Graham et al., 2000). Его элиминация характеризуется тремя фазами: начальный Т,/2 составляет 0,28 ч, промежуточный — 16,3 ч, конечный — 273 ч. Препарат на 80% связывается с белками плазмы и в значительной степени подвергается метаболизму. Через 5 сут около 50% введенного оксалиплатина выводится с мочой (2— 12% — в виде диаминоциклогексана) и лишь 5% — с калом. Клиренс оксалиплатина снижается при почечной недостаточности, но токсичность при этом не усиливается (Massari et al., 2000). Основной побочный эффект — нейропатия, включающая парестезию и дизестезию в руках, ногах, глотке и во рту. Нейропатию часто провоцирует пребывание на холоде; она носит кумулятивный характер и при обшей дозе 1560 мг/м2 в той или иной степени наблюдается у 75% больных. Оксалиплатин умеренно угнетает кроветворение, а тошноту и рвоту позволяют предотвратить блокаторы серотониновых рецепторов (гл. 38). В присутствии ионов хлора и щелочей оксалиплатин неустойчив.
Подобно цисплатину, оксалиплатин имеет широкий спектр активности; он эффективен при раке яичников, шейки матки и герминогенных опухолях. В отличие от цисплатина оксалиплатин (в сочетании с фторурацилом) нашел широкое применение при раке толстой кишки, вероятно, за счет того, что его действие не зависит от ферментов репарации неспаренных нуклеотидов.
Гидроксимочевина
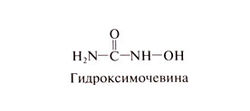
Гидроксимочевину синтезировали Дреслер и Штейн в 1869 г., но ее биологическая активность была открыта лишь в 1928 г., когда оказалось, что гидроксимочевина вызывает лейкопению и мегалобластную анемию у экспериментальных животных. В 1950-х гг. была обнаружена ее активность в отношении различных опухолей мышей, включая лейкозы и солидные опухоли; в 1960-х гг. начались клинические испытания. И по сей день гидроксимочевина представляет интерес для клинической и экспериментальной медицины; благодаря ряду уникальных и весьма разнообразных биологических эффектов она была испытана при многих заболеваниях, включая и неонкологические. Важное достоинство этого препарата — возможность приема внутрь и умеренная токсичность (подробнее см. Navarra and Preziosi, 1999; Paz-Ares and Donehower, 2001). Структурная формула гидроксимочевины следующая:
Механизм действия. Гидроксимочевина относится к ингибиторам рибонуклеозиддифосфатредуктазы. Выявлена четкая зависимость между активностью этого фермента и скоростью роста рака печени у крыс. Рибонуклеозиддифосфатредуктаза — хорошая мишень для противоопухолевых препаратов, так как она катализирует восстановление рибонуклеотидов до дезоксири-бонуклеотидов — лимитирующую реакцию в репликации ДНК. Гидроксимочевина инактивирует свободный радикал тирозина, образующийся в активном центре фермента. Она действует в периоде S, когда активность фермента максимальна, и вызывает остановку клеточного цикла на границе периодов G и S. Поскольку клетки в периоде G, высокочувствительны к облучению, препарат обладает радиосенсибилизирующим действием (Schilsky etal., 1992). Гидроксимочевина способна также усиливать действие препаратов, повреждающих ДНК: цисплатина, алкилирующих средств, ингибиторов ДНК-топоизомеразы II. Но более любопытно усиление действия антиметаболитов, особенно аналогов нуклеозидов, так как уменьшение запасов дезоксирибонуклеотидов под действием гидроксимочевины способствует включению в ДНК цитарабина, гемцитабина и флударабина. Такое взаимодействие имеет значение и для антиретровирусной терапии: ингибирование рибонуклеозиддифосфатредуктазы в клетке хозяина облегчает включение в вирусную ДНК нуклеозид-ных ингибиторов обратной транскриптазы (Lori et al., 1994). Показано, что гидроксимочевина превращается in vivo в окись азота, усиливая тем самым экспрессию генов, кодирующих ФНОа, ИЛ -6, p-цепь глобина и другие белки, а также ускоряя разрушение двойных микрохромосом, содержащих многочисленные копии генов. Впрочем, клиническое значение этих наблюдений не ясно (Paz-Ares and Donehower, 2001; Navarra and Preziosi, 1999).
Основной механизм устойчивости к гидроксимочевине — повышение активности рибонуклеозиддифосфатредуктазы, например вследствие амплификации кодирующего ее гена или усиления трансляции. Кроме того, устойчивость может быть вызвана синтезом фермента со сниженным сродством к гидроксимочевине.
Фармакокинетика. Благодаря высокой биодоступности (80— 100%) сывороточная концентрация гидроксимочевины после приема внутрь и в/в введения примерно одинакова (Rodriguezet al., 1998). После приема внутрь в дозе 15—80 мг/кг эта концентрация достигает максимума через 1 — 1,5 ч; Т1/2 составляет 3,5— 4,5 ч. Гидроксимочевина легко проникает через гематоэнцефалический барьер, а также накапливается в значительном количестве в молоке. Через 12 ч после приема внутрь или в/в введения 40—80% препарата выделяется с мочой. Хотя точных рекомендаций не разработано, при почечной недостаточности целесообразно начинать с небольших доз и в дальнейшем ориентироваться на индивидуальную переносимость. В экспериментах на животных показано, что гидроксимочевина подвергается метаболизму, однако его степень и клиническая значимость у человека не установлены.
Применение. Используются две схемы лечения гидроксимочевиной (в виде монотерапии или в сочетании с другими препаратами): 1) по 80 мг/кг внутрь в один прием через 2 сут и 2) по 20—30 мг/кг ежедневно. Дозу корректируют в зависимости от числа лейкоцитов. При онкологических заболеваниях лечение обычно продолжают 6 нед, после чего оценивают его эффективность. При положительном результате лечение может продолжаться сколь угодно долго, рекомендуется лишь еженедельный контроль числа лейкоцитов.
Гидроксимочевина применяется главным образом при миелопролиферативных заболеваниях, особенно хроническом миелолейкозе, эритремии и тромбоцитемии. В настоящее время ее назначают при противопоказаниях к препаратам интерферона а или в сочетании с ними в качестве индукционной химиотерапии (Silver et al., 1999). Несмотря на отдельные сообщения о ремиссиях при поздних стадиях меланомы, опухолей головы и шеи и половых органов, гидроксимочевина не входит в стандартные схемы химиотерапии ни одной солидной опухоли. Поскольку гидроксимочевина вызывает задержку опухолевых клеток в периоде G,, когда они чувствительны к лучевой терапии, она включена в ряд схем комбинированного лечения, сочетающего лучевую и химиотерапию. Эти схемы показали хорошие результаты при раке шейки матки, первичных опухолях головного мозга, опухолях головы и шеи и немелкоклеточном раке легкого, однако не превзошли по эффективности аналогичные комбинированные схемы с цисплатином.
Гидроксимочевина одобрена ФДА для лечения серповидноклеточной анемии у взрослых. Она снижает риск болевых кризов и острого синдрома грудной клетки, уменьшает сроки госпитализации и потребность в переливании крови (Charache et al., 1995). Гидроксимочевина помогает также при серповидноклеточной анемии у детей, при HbS-p-тапассемии и гемоглобинопатии SC, однако опыт ее применения у таких больных ограничен.
Действие гидроксимочевины при ВИЧ-инфекции может послужить основой для создания нового типа антиретровирусных средств, не влияющих непосредственно на ферменты и структурные белки вируса (Lori, 1999). Сама по себе она малоэффективна, однако существенно усиливает действие диданозина и его комбинации со ставудином у ВИЧ-инфицированных с высоким уровнем виремии (гл. 51). Важно заметить, что гидроксимочевина может восстанавливать чувствительность к нуклеозидным ингибиторам обратной транскриптазы даже при мутациях, вызывающих устойчивость ВИЧ к этим препаратам.
Побочные эффекты. Основной побочный эффект — угнетение кроветворения (лейкопения, мегалобластная анемия, изредка тромбоцитопения); при отмене препарата на несколько дней эти явления быстро проходят. Возможны также нарушения со стороны ЖКТ и легкие кожные реакции, реже наблюдаются стоматит, алопеция и неврологические расстройства. Встречаются воспаление и гиперпигментация облученных ранее участков кожи. Гидроксимочевина повышает риск вторичных лейкозов, поэтому при неонкологических заболеваниях ее используют с осторожностью. Ввиду тератогенного действия, наблюдаемого у всех экспериментальных животных, препарат противопоказан женщинам детородного возраста.
Прокарбазин
В поисках ингибиторов МАО были получены многие производные гидразина, в том числе метилгидразины, некоторые из которых обладают противоопухолевой активностью (Bollag, 1963). Лишь один из них, прокарбазин, эффективный при лимфогранулематозе, нашел клиническое применение. Его структурная формула следующая:
Механизм действия. При метаболической активации прокар-базина образуются цитотоксичные производные метилгидразина, алкилирующие ДНК. Пути активации сложны и изучены неполно. Вначале окисляется гидразиновый фрагмент с образованием азопрокарбазина; реакция может протекать как спонтанно (в нейтральном растворе в присутствии кислорода), так и под действием микросомальных ферментов печени. При дальнейшем окислении получаются метил- и бензилазоксипроизводные препарата. Метилазоксипрокарбазин способен разлагаться, выделяя катион метилдиазония с выраженными ап-килирующими свойствами. В цитотоксическом действии препарата могут участвовать и свободные радикалы. Прокарбазин вызывает повреждение хромосом, включая разрывы сестринских хроматид и транслокации, и поэтому оказывает мутагенное и канцерогенное действие. Препарат вызывает остановку синтеза нуклеиновых кислот и белка in vivo. Монотерапия прокарбазином ведет к быстрой выработке устойчивости, один из механизмов последней — удаление метильных групп с помощью метилгуанин-ДНК-метилтрансферазы (Souliotis et al.,1990).
Фармакокинетика. После приема внутрь прокарбазин почти полностью всасывается. При в/в введении препарат быстро проникает через гематоэнцефалический барьер и его концентрации в СМЖ и плазме сравниваются. Ввиду быстрого разрушения препарата его Тtщ составляет лишь около 7 мин. При окислении прокарбазина образуются азопрокарбазин и перекись водорода. При дальнейшем окислении (по-видимому, в печени) образуются активные азоксипроизводные препарата, снова попадающие в кровь (Erikson et al., 1989). Индукторы микросомальных ферментов, например фенобарбитал, ускоряют активацию прокарбазина; сочетание прокарбазина с другими субстратами микросомальных ферментов также ведет к лекарственным взаимодействиям. Через 24 ч после приема внутрь или в/в введения 25—70% препарата выделяется с мочой, причем менее 5% — в неизмененном виде, а основная часть — в виде N-изопропилтерефталамовой кислоты (Friedman, 2001).
Применение. Взрослым прокарбазин назначают ежедневно по 100 мг/м2 в течение 10—14 сут, как правило, в составе полихимиотерапии.
Прокарбазин используется прежде всего при лимфогранулематозе в сочетании с хлорметином, винкристином и преднизоном в составе схемы МОРР (DeVita, 1981). Важно отметить отсутствие перекрестной устойчивости к прокарбазину и хлорэ-тиламинам. Кроме того, прокарбазин активен при глиомах, меланоме, лимфомах, миеломной болезни и мелкоклеточном раке легкого.
Побочные эффекты. Основное значение имеют лейкопения и тромбоцитопения, которые появляются на 2-й неделе лечения и проходят в течение 2 нед после его окончания. Как правило, возникают тошнота и рвота, у 5—10% больных наблюдаются поражения ЖКТ и кожи, неврологические нарушения; описаны изменения поведения. Прокарбазин нельзя сочетать с препаратами, угнетающими ЦНС, так как он усиливает их действие. Препарат нарушает окисление ацетальдегида, поэтому одновременное употребление алкоголя может вызвать чувство жара, покраснение лица и другие проявления антабусной реакции (гл. 18). Как слабый ингибитор МАО прокарбазин повышает АД при сочетании с симпатомиметиками, трициклическими антидепрессантами и пищевыми продуктами с высоким содержанием тирамина. Он обладает выраженным канцерогенным, мутагенным и тератогенным действием. Риск острых лейкозов на фоне схемы МОРР составляет 5—10%, он особенно высок при сочетании химиотерапии с лучевой терапией (Tucker et al., 1988). Кроме того, прокарбазин вызывает иммунодефицит и бесплодие, особенно у мужчин.
Митотан
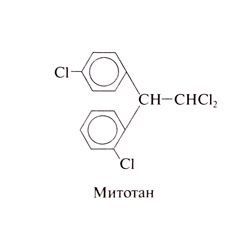
Митотан (дихлордифенилдихлорэтан; о,п'-ДДД), аналог инсектицида ДДТ, применяется при опухолях коры надпочечников. Внимание к нему привлекли испытания различных инсектицидов на собаках, показавшие, что митотан вызывает атрофию коры надпочечников. Структурная формула митотана следующая:
Механизм действия митотана не установлен. Известно, что этот препарат обладает относительно избирательной токсичностью в отношении нормальных и опухолевых клеток коры надпочечников. Митотан быстро снижает концентрацию глюкокор-тикондов и их метаболитов в крови и моче, что облегчает подбор доз и дальнейшее наблюдение при синдроме Кушинга, связанном с гиперплазией или опухолью коры надпочечников. Препарат не вызывает поражения почек, печени и костного мозга.
Фармакокинетика. При приеме внутрь всасывается около 40% препарата, остальная часть выводится с калом. При ежедневном приеме по 5—15 г сывороточная концентрация митотана составляет 10—90 мкг/мл, а его метаболитов — 30—50 мкг/мл. После отмены препарат определяется в крови на протяжении 6—9 нед. М итотан можно обнаружить во всех тканях, но прежде всего он накапливается в жировой клетчатке. Водорастворимый метаболит митотана попадает в мочу; в таком виде выделяется около 25% препарата как при приеме внутрь, так и при парентеральном введении.
Применение. Лечение начинают с 2—6 г/сут внутрь в 3—4 приема, максимальная суточная доза колеблется в пределах 2—16 г. Митотан принимают в течение хотя бы 3 мес, при достижении эффекта лечение продолжается неопределенно долго. Нельзя одновременно назначать спиронолактон, так как он нарушает действие митотана (Wortsman and Soler, 1977).
Митотан назначают при неоперабельном раке коры надпочечников. В двух испытаниях, включавших 138 и 115 больных, частота ремиссий составила соответственно 34 и 54% (Hutter and Kayhoe, 1966; Lubitzet al., 1973). Описаны полные ремиссии даже при наличии метастазов (Becker and Schumacher, 1975; Os-tuni and Roginsky, 1975).
Побочные эффекты. Примерно в 80% случаев митотан вызывает тошноту и потерю аппетита, в 34% — сонливость и спутанность сознания и в 15—20% — дерматит, но эти побочные эффекты не требуют снижения дозы. Поскольку митотан повреждает кору надпочечников, одновременно с ним назначают глюкокортикоилы. особенно при надпочечниковой недостаточности, шоке и тяжелых травмах (Hogan et al., 1978).