Препараты витамина D в спортивной медицине: научный обзор
Содержание
- 1 Препараты витамина D в спортивной медицине (обзор)
- 2 Методы определения содержания витамина D в организме и оценка полученных результатов
- 3 Метаболизм витамина D в организме
- 4 Фармакодинамика витамина D в организме спортсменов и тренирующихся лиц
- 5 Потенциальные эргогенные эффекты витамина D в спортивной медицине
- 6 Витамин D и тестостерон
- 7 Принципы дозирования и рекомендации по приему витамина D
- 8 Рекомендации МЗ РФ по дозированию витамина D
- 9 Витамин D в составе НМП спортивных команд
- 10 Препараты кальция
- 11 Роль витамина К в контексте действия и применения витамина D
- 12 Коммерческие формы витамина D на рынке РФ
- 13 Фармакокинетика готовых форм витамина D
- 14 Заключение
- 15 Читайте также
- 16 Ссылки
Препараты витамина D в спортивной медицине (обзор)
Авторы: д.м.н. Александр Дмитриев, врач-эндокринолог Алексей Калинчев
Пересчет для витамина D3: экзогенные источники – 40 МЕ (IU) = 1 мкг (1 μg)
Концентрация в плазме: 2,5 нмол/л (nmol/L) = 1 нг/мл (ng/mL)
Введение
В соответствии со всеми имеющимися международными и национальными классификациями витамин D и его препараты относятся к категории «А» (высшая степень доказательности и целесообразности применения в спортивной медицине) со следующим определением: «медицинские добавки – используются по врачебным показаниям, включая диагностированный дефицит данного нутриента (фармаконутриента); требует индивидуального дозирования и контроля специалиста в области спортивной медицины (спортивный врач, спортивный нутрициолог, спортивный диетолог). Как справедливо отмечено в обобщающем обзоре НИИ спорта «Gatorade» (Великобритания), «последнее десятилетие можно назвать «ренессансом» интереса к научным исследованиям витамина D. Простой поиск в PubMed по директории «витамин D» дает цифру в 3500 статей за 2013 год по сравнению, например, с 1000 публикаций в 1993 году. Частично такой всплеск интереса к этой теме обусловлен важной ролью витамина D в предотвращении заболеваний костной системы. Дополнительно появилось лучшее понимание метаболизма и функций витамина D, множественности биологической роли в активности стероидных гормонов» (G.L.Close, 2015). С момента идентификации рецепторов витамина D в разных тканях, воздействуя на которые он оказывает свое биологическое действие (М.В.Demay, 2006), за последующие 10 лет произошли колоссальные подвижки в расширении наших знаний о спектре фармакологической активности витамина D. В настоящее время клинический спектр витамина D дополнительно включает сердечно-сосудистые эффекты, изменение иммунитета, функций скелетной мускулатуры и многие другие. Несмотря на такой вал новых знаний и расширение представлений о важности витамина D, негативной роли его дефицита в организме, распространенности этого дефицита среди всех слоев населения планеты, в практическом плане нет таких же серьезных подвижек. Точно также неважно обстоят дела и в спортивной медицине, где дефицит или недостаточность витамина D у атлетов носят характер эпидемии. Надо помнить, что благодаря колоссальным физическим и психологическим нагрузкам, особенно в спорте высших достижений, стрессорные воздействия на костно-мышечную систему, иммунитет, центральную и периферическую нервную систему, носят предельный характер. Дополнительно, требуется максимальная скорость восстановления функций после прекращения нагрузок. Поэтому ликвидация дефицита витамина D является не временной, а постоянной мерой, что диктует необходимость подробного рассмотрения всех клинико-фармакологических аспектов действия и применения витамина D и его препаратов.
Методы определения содержания витамина D в организме и оценка полученных результатов
Оценка уровней витамина D производится с помощью рутинных методов внутривенного забора крови или крови из пальца. Определяется концентрация в сыворотке метаболитов 25(OH)D следующими методами:
- Масс-спектрометрия (жидкостная хроматография высокого давления) (LC-MS/MS)
- Радиоиммуноанализ (RIA)
- Ферментный иммуноанализ (EIA)
- Конкурентный анализ связывания с белками (CPBA)
- Автоматизированный хемолюминисцентный анализ связывания с белками (CLPBA)
- Хемолюминисцентный иммуноанализ (CLIA)
Полученные результаты в зависимости от страны, где проводится исследование, дают значения концентрации метаболитов витамина D в крови либо в нг/мл (ng/mL), либо в нмол/л (nmol/L), где 1 нг/мл = 2.496 нмол/л. При этом чаще всего метаболиты витамина D2 (25(OH)D2) и D3 (25(OH)D3) не разделяются и анализируются вместе под общим названием «общий сывороточный 25(OH)D». Институт Медицины США (U.S. IOM) представил рекомендации по оценке результатов анализа уровня общего сывороточного 25(OH)D у спортсменов (табл.1.).
Таблица 1. Оценка показателей содержания в сыворотке крови общего сывороточного 25(OH)D в соответствии с рекомендациями Института Медицины США для поддержания оптимального содержания в организме витамина D (А.Zittermann, 2003; R.P.Heaney, 2011).
| Общий сывороточный 25(OH)D | Оценка статуса |
|---|---|
| <12 нмол/л | Выраженный дефицит |
| 12 - <30 нмол/л | Дефицит |
| 30 - 50 нмол/л | Недостаточность |
| >50 нмол/л | Адекватный уровень |
| >100 - 250 нмол/л | Оптимальный ((А.Zittermann, 2003) |
| >120 - 225 нмол/л | Оптимальный (R.P.Heaney, 2011) |
В то же время, многие научные спортивные организации, в частности НИИ Спорта и физической культуры «Gatorade» (Ливерпуль, Великобритания), считают, что данные рекомендации в силу вариабельности показателей в разных странах и регионах, не могут быть универсальными, и в зависимости от этого каждая страна должна выработать свои рекомендации (например, Австралия, см. в разделе этого обзора «Основные положения Австралийского Института Спорта (AIS) в отношении витамина D»). Причем дифференцировка должна учитывать: регион страны, время года, пол и некоторые другие факторы. Только такой подход даст возможность правильной коррекции дефицита или недостаточности (доза, длительность курсового назначения). Полученные результаты должны внедряться в широкую практику спортивной медицины в качестве составной части общей Национальной Программы нутритивно-метаболической поддержки - НМП (примеры - см. далее в обзоре). В РФ оценка витамин-D-статуса взрослых базируется на клинических рекомендациях «Дефицит витамина D у взрослых. Диагностика, лечение и профилактика», разработанных Российской Ассоциацией эндокринологов ФГБУ «Эндокринологический Научный Центр МЗ РФ» (Москва, 2015) (таблицы 2 и 3).
Критерии оценки дефицита витамина D МЗ РФ («Клинические рекомендации «Дефицит витамина D у взрослых. Диагностика, лечение и профилактика». Российская Ассоциация эндокринологов ФГБУ «Эндокринологический Научный Центр МЗ РФ», Москва, 2015)
- Оценка статуса витамина D должна проводиться путем определения уровней 25(ОН)D в сыворотке крови надежным методом. Рекомендуется проверка надежности используемого в клинической практике метода определения 25(ОН)D относительно международных стандартов (DEQAS, NIST). При определении уровней 25(OH)D в динамике рекомендуется использование одного и того же метода. Определение 25(OH)D после применения препаратов природного витамина D в лечебных дозах рекомендуется проводить через как минимум три дня с момента последнего приема препарата. (Уровень доказательности А II)
- Дефицит витамина D определяется как концентрация 25(ОН)D <20 нг/мл (50 нмоль/л), недостаточность - концентрация 25(ОН)D от 20 до 30 нг/мл (от 50 до 75 нмоль/л), адекватные уровни - более 30 нг/мл (75 нмоль/л). Рекомендуемые целевые значения 25(ОН)D при коррекции дефицита витамина D - 30-60 нг/мл (75-150 нмоль/л). (таблица 2). (Уровень доказательности А I).
Таблица 2. Классификация дефицита, недостаточности и оптимальных уровней витамина D по мнению различных международных профессиональных организаций (из материалов МЗ РФ).
| Наименование профессиональной организации | Дефицит витамина D | Недостаточное содержание витамина D | Достаточное содержание витамина D |
|---|---|---|---|
| Институт Медицины США | <12 нг/мл (<30 нмол/л) | 12-20 нг/мл (30-50 нмол/л) | ≥20 нг/мл (≥50 нмол/л) |
| Международное Эндокринологическое Общество 2011 | <20 нг/мл (<50 нмол/л) | 21-29 нг/мл (51-74 нмол/л) | ≥30 нг/мл (≥75 нмол/л) |
| Федеральная Комиссия по питанию Швейцария | <20 нг/мл (<50 нмол/л) | 21-29 нг/мл (51-74 нмол/л) | ≥30 нг/мл (≥75 нмол/л) |
| Испанское Общество исследования костей и минерального обмена | <20 нг/мл (<50 нмол/л) | 21-29 нг/мл (51-74 нмол/л) | ≥30 нг/мл (≥75 нмол/л) |
| Европейское Общество клинических и экономических аспектов остеопороза | <10 нг/мл (<25 нмол/л) | <20 нг/мл (<50 нмол/л) | 20-30 нг/мл (50-75 нмол/л) |
| Национальное Общество Остеопороза Великобритании | <12 нг/мл (<30 нмол/л) | 12-20 нг/мл (30-50 нмол/л) | >20 нг/мл (>50 нмол/л) |
Таблица 3. Интерпретация концентраций 25(OH)D, принимаемая Российской Ассоциацией Эндокринологов (из материалов МЗ РФ).
| Классификация | Уровни 25(ОН)D в крови нг/мл (нмол/л) | Клинические проявления |
|---|---|---|
| Выраженный дефицит витамина D | <10 (<25) | Повышенный риск рахита, остеомаляции, вторичного гиперпаратиреоза, миопатии, падений и переломов |
| Дефицит витамина D | <20 (<50) | Повышенный риск потери костной ткани, вторичного гиперпаратиреоза, падений и переломов |
| Недостаточность витамина D | ≥20 и <30 (≥50 и <75) | Низкий риск потери костной ткани, вторичного гиперпаратиреоза, переломов при падении |
| Адекватные уровни витамина D | ≥30 (≥75) | Оптимальное подавление паратиреоидного гормона, низкий риск потери костной ткани и переломов |
| Уровни с возможным проявлением токсичности витамина D | >150 (>375) | Гиперкальциемия, гипер-кальциурия, нефрокальциноз, кальцифилаксия |
Рекомендуемый референсный интервал для лабораторий 30-100 нг/мл (75-250 нмол/л)
Позиция МЗ РФ: Дефицит витамина D определяется как концентрация 25(ОН)D <20 нг/мл (50 нмоль/л), недостаточность - концентрация 25(ОН)D от 20 до 30 нг/мл (от 50 до 75 нмоль/л), адекватные уровни 30-100 нг/мл (75-250 нмоль/л). Рекомендуемые целевые значения 25(ОН)D при коррекции дефицита витамина D - 30-60 нг/мл (75-150 нмоль/л). (Уровень доказательности А I)
Метаболизм витамина D в организме
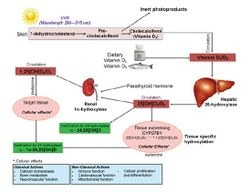
Существует две природные формы витамина D: эргокальциферол (витамин D2) и холекальциферол (витамин D3). Витамин D2 доступен в ограниченном количестве из растительных источников (см. в обзоре ниже) и в виде некоторых добавок и препаратов, в то время как витамин D3 поступает с пищей в виде жиров рыбы и молочных продуктов. Однако, основным источником витамина D3, составляющем 90% от всего поступающего количества, является реакция фотосинтеза в коже при условии достаточного пребывания человека на солнце. Независимо от пути поступления, 99% витамина D связывается со специфическими белками (витамин-D связывающий протеин - DBP), в то время как остаток связывается с альбумином. Обе формы витамина D подвергаются гидроксилированию сначала в печени (катализируется 25-гидроксилазой до метаболита 25-гидроксивитамин D (25(OH)D), а затем – в почках (катализируется 1-α-гидроксилазой до биологически активной формы витамина D - 1-α-дигидроксивитамин-2D3 (1-α,25(OH)D) (Рис.1). Эта последняя форма и взаимодействует с рецепторами витамина D в клетках (VDR), которые локализуются во всех тканях организма, а затем расшифровывается внутри клетки и связывается с витамин-D-ответственными элементами (VDREs), которые располагаются в ДНК. При отсутствии такого взаимодействия VDREs подвергается деградации с образованием неактивной формы.
Фармакодинамика витамина D в организме спортсменов и тренирующихся лиц
Влияние на функцию мышечной ткани и VO2
1,25-дигидроксивитамин D оказывает прямое влияние на активность скелетных мышц за счет взаимодействия с витамин-D3 рецепторами мышечных клеток (H.Bischoff и соавт., 2001). Исследование мышечных эффектов витамина D3 ограничено здоровыми нетренированными лицами (R.B.Tomlinson и соавт., 2014) или пациентами с различной патологией (Y.Sato и соавт., 2005; K.A.Stockton и соавт., 2010). В нескольких обзорах и мета-анализах показано, что возрастание концентрации в сыворотке 25(OH)D позитивно влияет на мышечную силу, мощность и массу тела (K.A.Stockton и соавт., 2010; R.B.Tomlinson и соавт., 2014; С.Beaudart и соавт., 2014; P.R.Von Hurst, K.L.Beck, 2014), но только одна работа (P.R.Von Hurst, K.L.Beck, 2014) имеет отношение к спортсменам, и дала, к тому же смешанные результаты.
Максимальное потребление кислорода
Рецепторы витамина D представлены в сердечной мышце и ткани сосудов (V.S.Reddy и соавт., 2010), что косвенно свидетельствует о возможном влиянии 1,25-дигидроксивитамина D на максимальное потребление VO2 за счет изменения транспорта и утилизации кислорода внутри сосудистого русла в разных тканях. Большинство исследований показали положительную корреляционную связь между VО2max и сывороточной концентрацией 25(OH)D у лиц, не имеющих отношения к спорту (таблица 4). Однако при этом не учитывалось влияние ряда привходящих факторов (другие добавки), например наличие мультивитаминов и других компонентов в пищевых добавках (D.A.Mowry и соавт., 2009; A.Ardestani и соавт., 2011; S.M.Gregory и соавт., 2013). Исследования у спортсменов дали разноречивые результаты. N.E.Koundourakis и соавторы (2011) выявили значимую корреляцию между уровнем 25(OH)D и уровнем физической готовности у 67 профессиональных игроков в футбол (возраст 25,6 ± 6,2 года). Была отслежена линейная связь между пре- и постсезонными показателями уровня 25(OH)D и мышечной силой, оцениваемой по прыжкам со сгибанием ног (SJ), прыжками в противоход (CMJ), спринту (10 и 20-метровый спринт), а также VО2max. По результатам исследования J.Fitzgerald и соавторов (2014) сделан вывод об отсутствии ассоциации между уровнями 25(OH)D и VО2max у 52 игроков в хоккей на льду. Кроме того, отмечено, что инверсия обычной корреляционной зависимости между сывороточными показателями 25(OH)D и VО2max, увеличивает физическую активность и тренировочный статус (A.Ardestani и соавт., 2011). L.Forney и соавторы (2014) провели исследование у 39 (20 мужчин, 19 женщин) студентов-спортсменов взаимосвязи между уровнями сывороточного 25(OH)D, VО2max и тренировочного статуса. Установлено, что участники с исходно повышенными (>35 нг/мл) уровнями сывороточного 25(OH)D имеют более высокие показатели VО2max (+20 %) по сравнению с участниками с исходно низкими значениями (<35 нг/мл) 25(OH)D. Однако, такая связь была характерна только для мужчин. К сожалению, интервенционных исследований крайне недостаточно. Только в одной работе изучались эффекты пищевых добавок витамина D на VО2max. Z.Jastrzebski (2014) выполнил одиночное-слепое исследование добавок 6000 МЕ/день витамина D3 в течение 8-недельного тренировочного цикла у 14 элитных гребцов с исходно удовлетворительным уровнем 25(OH)D (>30 нг/мл). Установлено возрастание VО2max (12.1 %) и концентраций 25(OH)D на 400 % (~120 нг/мл). Это позволило авторам сделать заключение, что добавки витамина D3 на протяжении 8 недель в рамках тренировочного периода улучшает аэробный метаболизм у элитных гребцов. В то же время, наметившаяся тенденция большей эффективности высоких доз витамина D3 требует дальнейшей экспериментальной проверки в других спортивных дисциплинах. Специфические механизмы, лежащие в основе положительных изменений, также нуждаются в дополнительном исследовании. Существует гипотеза, что витамин D может опосредованно повышать аффинитет гемоглобиновых рецепторов к кислороду (H.Sugimoto, Y.Shiro, 2012).
Восстановление
В процессе восстановления метаболит 1,25-дигидроксивитамин D увеличивает миогенную дифференциацию и пролиферацию (L.A.Garcia и соавт., 2013), и подавляет активность миостатина – тормозного регулятора мышечного синтеза (L.A.Garcia и соавт., 2011).
Таблица 4. Корреляция уровней метаболитов витамина D в плазме крови [25(OH)D], максимального потребления кислорода (VО2max) и физической готовности при физических нагрузках (из D.T. Dahlquist и соавт., 2015)
| Автор,популяция | Хар-ка группы | Тип исследования | Описание показателей | Тиссл недели | Результаты |
|---|---|---|---|---|---|
| Gregory 2013 здоровые взрослые |
М (n=213) Ж (n=104) | Корреляция | 3 группы: <50 нмол/л (n=16); 50-75 нмол/л (n=57); >75 нмол/л (n=140) | 24 | Нет взаимосвязи уровней 25(OH)D и показателей в аэробном фитнесе |
| Mowry, Costello, Heelan 2007 женщины | 59 Ж (В=16-24) VO2 =39±7 | Корреляция | 25(OH)D 46,2± 20,2 нг/мл | - | Положительная связь V02 и 25(OH)D; обратная связь ЖМТ и V02 и 25(OH)D |
| Ardestani 2011 здоровые взрослые | М (n=92) VO2=40±9 Ж (n=108) VO2=30±8 В=40±14 | Корреляция | 25(OH)D 34 ± 13.3 нг/мл | - | Положительная связь V02 и 25(OH)D; чем выше 25(OH)D, тем выше активность |
| Koundourakis 2014 спортсмены | М (n=67) футбол В=26±6 | Корреляция | Тесты ФГ: приседания, прыжки, 10 и 20-метровый спринт, антропометрия, VO2 | 6 | Положительная связь 25(OH)D и всеми показателями ФГ |
| Fitzgeral 2014 спортсмены | М (n=52) хоккей на льду VO2=55±4 В=20±2 | Кросс-секциональное | Тесты ФГ: VO2, ЧСС, общее время поддержания ТН | 4 | У всех 25(OH)D <. 65,0 нг/мл; 37.7 % -
25(OH)D < 32 нг/мл 25(OH)D-статус не влиял на тесты ФГ |
| Forney 2014 спортсмены | М (n=20) Ж (n=19) | Корреляция | 25(OH)D=21±2 (n = 20) или 44±2 нг/мл (n=19). Тесты ФГ: ИМТ, % ЖМТ, УМП, VO2, мышечная сила и мощность | - | Положительная связь V02 и 25(OH)D; негативная связь ИМТ и 25(OH)D-статусом |
| Jastrzebski 2014 спортсмены | М (n=14) гребля | Интервенционное | D3 6000 МЕ/день спортсменам с 25(OH)D>30 нг/мл | 8 | Увел. VO2 на 12% и 25(OH)D на 400% (~120 нг/мл) |
Примечания: M – мужчины; Ж – женщины; n – количество участников исследования; 25(OH)D – концентрация метаболитов витамина D в сыворотке крови; VO2 – максимальное потребление кислорода (мл/кг/мин); В – возраст в годах; Тиссл – продолжительность исследования; ЖМТ – жировая масса тела; ФГ – физическая готовность; ЧСС – частота сердечных сокращений; ТН – тренировочная нагрузка; УМП – уровень метаболизма в покое; Тиссл – время исследования.
I.Stratos и соавторы (2013) в экспериментах на крысах показали значительное увеличение регенерации скелетной мускулатуры при повреждениях камбаловидной мышцы после применения сверхфизиологических доз (~100 000 МЕ) витамина D. Они подразделили животных на две группы: с потреблением высокой (332 000 МЕ/кг) и низкой (33 200 МЕ/кг) доз, а затем исследовали время восстановления камбаловидной мышцы. В группе с высокой дозой витамина D отмечено значительное ослабление апоптоза клеток через 4 дня после повреждения, возрастание клеточной протеиновой матрицы, которая играет критическую роль в процессе регенерации (D.Lund, D.Cornelison, 2013). Такое увеличение клеточного обмена ведет к ускорению восстановления, повышению способности к тетаническому напряжению (всего на 10% ниже, чем в неповрежденной конечности) и поворотной силы по сравнению с контрольной группой. Добавки витамина D улучшают такой показатель восстановления скелетных мышц, как пик изометрической силы после интенсивных тренировок. В рандомизированном двойном-слепом плацебо-контролируемом исследовании Т.Barker и соавторы (2013) показали, что пищевые добавки витамина D в дозе 4000 МЕ/день в течение 35 дней здоровым взрослым людям со средним уровнем физической активности ослабляют уровень воспалительной реакции (оцениваемый по биомаркерам воспаления - аланину и аспартату) в ответ на сложный комбинированный тест физической нагрузки - 10 сетов по 10 повторов, пик изометрического напряжения при выполнении эксцентрик-концентрических прыжков сразу после нагрузки. Хотя пик мощности снижался сразу после тренировки как в контрольной, так и в экспериментальной группах, в группе с добавками витамина D снижение составило только 6%, в то время как в плацебо-группе - 32%. Суммарные данные приведены в таблице 5.
Таблица 5. Витамин D in vitro, in vivo и интервенционные исследования по восстановлению(из D.T. Dahlquist и соавт., 2015)
| Автор, популяция | Субъекты/ образцы | Тип исследования | Интервенция | Тиссл дни | Результаты |
|---|---|---|---|---|---|
| Garcia 2013 человек ex vivo | Миобласты человека | In vitro | Миобласты C2C12 под воздействием 100 нM 1,25-D3 | 1,4 и 10 | ↑ миогенной дифференциации и пролиферации |
| Garcia 2011 человек ex vivo | Миобласты человека | In vitro | Миобласты C2C12 под воздействием 100 нM 1,25-D3 | 1,3,4,7 и 10 | Снижение тормозя-щей функции миостатина |
| Stratos 2013 крысы | 56 крыс – самцов | In vivo | ВДГ и НДГ: регенерация камбаловидной мышцы | 42 дня | ВДГ vs НДГ: ↓ апоптоза, ↑ клеточной протеиновой матрицы ↑ силы, улучшение восстановления |
| Barker 2013 мужчины | 28 крыс, 30 мин тренинг 3 недели (n=14) | РДСПК | Прыжковый тест на изометрическую силу; 4000 МЕ D3 или плацебо | 28 дней | Витамин D vs Плацебо: ↓ALT и AST, меньше падение пика мощности |
Примечания: Тиссл – время исследования (дни); РДСПК – рандомизированное двойное слепое плацебо-контролируемое исследование; ВДГ – группа с высокой дозой витамина D (332000 МЕ/кг); НДГ – группа с низкой дозой витамина D (32200 МЕ/кг).
Таблица 6. Корреляция с витамином D при исследованиях силы и мощности (из D.T. Dahlquist и соавт., 2015)
| Автор, популяция | Субъекты/ образцы | Тип исследования | Интервенция | Тиссл дни | Результаты |
|---|---|---|---|---|---|
| Ceglia 2013 пожилые лица | 21 женщин с ограничением подвижности 25{OH)D=60 – 225 нмол/л | РДСПК | 4000 МЕ/день вит. D vs плацебо | 4 мес | ↑Интрамионуклеар. VDR на
30 %, размера МВ на 10% у пожилых с огран. подвижностью, у женщин с дефицитом |
| Close 2013 спортсмены | 10 профессиональных футболистов-мужчин | РКИ корреляция +интервенция | 5000 МЕ/день вит. D vs плацебо | 8 нед | ↑25(OH)D ↑вертик.прыжков ускорение спринта |
| Close 2013 спортсмены | 30 спортсменов клубного уровня | РКИ +интервенция | 3 группы: плацебо, 20000 МЕ/нед или 40000 МЕ/нед D3. Тесты ФГ: жим пресса, конечностей, вертик. прыжки | 12 нед | Обе дозы D3: ↑25(OH)D>50 нмол/л без изменения ФГ |
| Fitzgeral 2014 спортсмены | 52 хоккеиста на льду 20.1±1.5 года (V02max 54.6 ±4.3) | Кросс-секционное | Тесты ФГ: пик V02, ЧССмax Peak RER, ОВТ | 1 мес | Нет связи между 25(OH)D и параметрами ФГ |
| Forney 2014 студенты-спортсмены | 20 мужчин и 19 женщин спортсменов студентов | Корреляция | 25(OH)D 21±2 нг/мл (n=20) или 44 ±2 нг/мл (n=19). Параметры: ИМТ, % ЖМТ, УМП, VО2max, мышечная сила и мощность | 14 дней | Значимая позитивная связь 25(OH)D и VО2max; негат. с вязь 25(OH)D и ИМТ |
Примечания: Тиссл – время исследования; РДСПК – рандомизированное двойное слепое плацебо-контролируемое исследование; РКИ – рандомизированное контролируемое исследование; ФГ – физическая готовность; VО2max – максимальное потребление кислорода (мл/кг/мин); ЧССmax – максимальная частота сердечных сокращений; Peak RER – дыхательный коэффициент на пике нагрузки; ОВТ – общее время тренировки; 25(OH)D – концентрация метаболитов витамина D в сыворотке крови; ИМТ – индекс массы тела; ЖМТ – жировая масса тела; УМП – уровень метаболизма в покое; МВ – мышечные волокна.
Влияние на силу и мощность
В 2013 году D.Ogan и K.Pritchett было показано, что Витамин D увеличивает силу и мощность скелетной мышечной ткани, возможно, за счет повышения чувствительности (сенситизации) мест связывания кальция в саркоплазматическом ретикулюме, что приводит у усилению мышечного сокращения. Получены также доказательства, что витамин D увеличивает размер и количество мышечных волокон II типа (Y.Sato и соавт., 2005; J.J.Todd и соавт., 2015; I.Ceglia и соавт., 2013). В рандомизированном плацебо-контролируемом исследовании у футболистов получены данные об увеличении силы и мощности (G.L.Close и соавт., 2013): продолжительная 8-и недельная интервенция витамина D3 в дозе 5000 МЕ/день приводит не только к повышению концентрации 25(OH)D в сыворотке крови, но и параллельному улучшению показателей 10-метрового спринта и вертикальных прыжков. Однако, не во всех исследованиях получены положительные результаты. В основном отсутствие положительных сдвигов касалось спортсменов с исходно незначительным уровнем дефицита витамина D или его отсутствием (G.L.Close и соавт., 2013; J.Fitzgerald и соавт., 2014; L.Forney и соавт., 2014). Таким образом, основанием для пищевых интервенций витамина D3 у спортсменов является наличие его дефицита в организме.
Потенциальные эргогенные эффекты витамина D в спортивной медицине
Перед тем, как обсуждать механизмы и пути улучшение витамин D-статуса спортсменов, влияние на физическую форму и восстановление после физических нагрузок (важнейшие показатели эргогенного эффекта препаратов и БАДов) необходимо иметь в виду ряд соображений количественного плана (G.L.Close, 2015). Чрезвычайно важно понимать разницу между дозировками в МЕ (IU) и нг (ng): 100 МЕ = 2,5 мкг = 2500 нг витамина D2/D3. В случае ошибки дозы могут получиться либо экстремально большими, либо маленькими и неэффективными. Следующее соображение касается соотношения эффективности D2 и D3: витамин D3 примерно на 87% более эффективен в поддержании уровня 25(OH)D в плазме крови и продуцирует в 2-3 раза больший запас витамина D в организме, чем эквимолярное количество витамина D2.
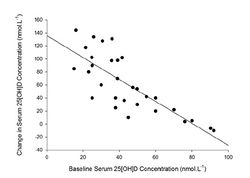
Еще один важнейший фактор – исходные (базовые) значения уровня 25(OH)D в сыворотке крови у спортсменов. Как показали исследования, исходные значения этого показателя во многом определяют ответ на экзогенное введение пищевых добавок и препаратов витамина D (рис.7). Имеется обратная корреляция между исходным уровнем 25(OH)D в сыворотке крови и эффектом экзогенного введения витамина D. При исходно высоких (удовлетворительных) значениях витамина D в плазме (в диапазоне 80-100 нмол/л) его дополнение в пищу не вызывает практически никакого эффекта. Наоборот, при исходно низких (дефицит, недостаточность) значениях 25(OH)D в сыворотке, эффект дополнительного приема витамина D очень существенный.
Таким образом, в практическом плане необходимо принять во внимание и выполнить ряд условий при назначении добавок или препаратов витамина D, чтобы обеспечить максимальную эффективность: 1) исходные концентрации общего циркулирующего 25(OH)D должны быть измерены; 2) измерение должно быть точным с использованием валидированного метода, желательно методами LC-MS/MS; 3) назначаемые пероральные добавки витамина D должны быть индивидуально адаптированы к полученным исходным показателям, а именно: при концентрации <75 нмол/л назначается доза 5000 МЕ для увеличения показателя >75 нмол/л. Если у спортсмена имеется выраженный дефицит (<30 нмол/л) и, особенно, глубокий дефицит (<12,5 нмол/л), необходимо назначить дозу витамина D 10000 МЕ/день на протяжении не менее 4-х недель, с дальнейшим переходом на дозу 5000 МЕ/день; 4) В течение всего года (особенно в зимний период) необходимо регулярно брать образцы крови спортсменов для контроля уровня 25(OH)D и оценки эффективности лечения; 5) в течение летнего периода целесообразно дополнительное солнечное облучение (до минимальной эритемы) ежедневно в пределах 30 минут.
G.L.Close и соавторы (2013) в Великобритании исследовали у 30 спортсменов эффекты добавок витамина D (20000-40000 МЕ/неделю в течение 12 недель) на показатели функционального состояния мышц (1-RM жим лежа, жим ногами и высота вертикальных прыжков). Спортсмены были рандомизированы в три группы: плацебо, витамин D в дозе 20000 МЕ/неделю и 40000 МЕ/неделю в течение 12 недель. Показатели состояния мышц и уровень 25(OH)D в плазме крови тестировались через 6 и 12 недель исследования, поскольку оказалось, что 6-и недель приема добавок витамина D достаточно для коррекции дефицита витамина в крови, но недостаточно для достижения оптимального его уровня по международным стандартам (>40 нг/мл). В отличие от результатов у пожилых лиц, не выявлено заметного улучшения мышечных функций, несмотря на достижение высокого уровня витамина D в крови. В данном исследовании имелся один, но существенный недостаток – пищевые добавки витамина D производились без учета исходных (базовых) концентраций витамина D в крови спортсменов и в разные сезоны при недостаточной выборке. А как видно из информации, приведенной в обзоре выше, это имеет чрезвычайно важное значение. Простое усреднение исходных показателей может искажать картину. Высокие уровни циркулирующего 25(OH)D необходимы для появления физиологического ответа внутри скелетных мышц, при этом сами мышцы нуждаются в более высокой концентрации витамина D по сравнению с другими тканями (G.L.Close и соавт., 2013). Авторы предложили применение более высоких доз витамина D у спортсменов, имеющих исходный дефицит витамина в плазме крови (а не всех подряд), для того, чтобы целевым образом достичь концентрации в плазме 25(OH)D выше 40 нг/мл. Авторы увеличили выборку (n = 61 спортсмен, n = 31 здоровый контрольный субъект) и с помощью пищевых добавок витамина D3 достигли целевого уровня 25(OH)D. Как результат, сформирована схема - 5000 МЕ/день витамина D3 в течение 8 недель, которая существенно повышает физическую готовность. Такой режим применения пищевых добавок витамина D достоверно повышает уровень 25(OH)D с 11,62 ± 10,02 нг/мл до 41,27 ± 10,02 нг/мл, в то время как в плацебо-группе изменений не отмечено. Параллельно в группе с добавками витамина D статистически значимо (Р = 0,008) улучшались показатели в тестах 10-метрового спринта и вертикальных прыжков (без изменений в жиме лежа и жиме ногами). Такие данные поддерживают гипотезу, что повышение уровня 25(OH)D в плазме крови выше 40 нг/мл у спортсменов с исходно низкими уровнями этого показателя может генерировать хороший мышечный ответ и улучшать анаэробную физическую готовность. К сожалению, до настоящего времени нет сопоставимых по качеству исследований влияния пищевых добавок витамина D на аэробную активность и выносливость спортсменов. Тем не менее, основной вывод: необходимо в течение зимнего сезона (а в северных районах – осенне-зимнего сезона) поддерживать концентрацию метаболитов витамина D в крови на уровне 40 нг/мл. Этот целевой для спортсменов уровень обеспечивает сохранение запаса витамина D в мышцах и жировой ткани для дальнейшего использования.
Помимо этих исследований в Великобритании, большинство других работ фокусировались на вопросе о дефиците витамина D в организме спортсменов (см. выше), но не на влиянии этого витамина на физическую готовность. Тем не менее, они заложили фундамент для будущих направлений исследований пищевых добавок витамина D. Наиболее важными предпосылками следует считать обнаружение негативной роли дефицита витамина D в развитии воспаления (увеличение маркеров воспаления) при физических нагрузках на выносливость (K.S.Willis и соавт., 2012), что является прямым указанием на необходимость изучения пищевых добавок витамина D как потенциальных противовоспалительных средств в спорте. Дополнительно M.Z.Razavi и соавторы (2011) обнаружили, что витамин D при аэробных физических нагрузках улучшает переносимость тренировок у пациентов-астматиков, что может служить основой для дальнейшего изучения у спортсменов с так называемой «астмой физического напряжения» у лыжников, велосипедистов, конькобежцев и некоторых других категорий атлетов. С тех же позиций, режим применения витамина D3 в дозе 5000 МЕ в день в течение 8 недель, более эффективный со всех точек зрения, потенциально может редуцировать риск возникновения стрессовых переломов и других повреждений опорно-двигательного аппарата (J.Lappe и соавт., 2008; V.V.Valimaki и соавт., 2004).
Исследования, выполненные в последующий период, подтвердили правомерность выбранного направления дальнейшего изучения пищевых добавок витамина D.
D.T.Dahlquist и соавторы в 2015 году опубликовали обзор под названием «Правдоподобные эргогенные эффекты витамина D в отношении физической готовности и восстановления спортсменов».
В 2016 году C.M.Chiang и соавторами был выполнен очень важный мета-анализ, целью которого был систематический обзор литературы по исследованию эффектов добавок витамина D на мышечную силу спортсменов. Производился компьютерный поиск по трем базам данных (PubMed, Medline, и Scopus). В обзор были включены рандомизированные контролируемые исследования, опубликованные на английском языке, в которых измерялись концентрации витамина D и мышечная сила у здоровых тренированных лиц в возрасте от 18 до 45 лет. Было идентифицировано пять рандомизированных контролируемых исследований (их качество оценено как «превосходное») и одно контролируемое исследование (качество оценено как «хорошее»). Продолжительность исследований составляла от 4 недель до 6 месяцев, а дозы витамина D варьировали в диапазоне от 600 МЕ до 5000 МЕ в день. Витамин D2 оказался неэффективен в отношении мышечной силы во всех исследованиях, где он использовался. Наоборот, витамин D3 оказывал достоверное и существенное позитивное влияние на мышечную силу (Р < 0,05). В разных работах улучшение мышечной силы составило от 1,37% до 18,75%.
Витамин D и тестостерон
Тестостерон – эндогенный гормон андроген, играющий важную роль в адаптации скелетной мускулатуры в процессе физических тренировок. Исходно низкие уровни тестостерона у молодых мужчин обусловливают замедление анаболических процессов (синтез белка), снижение мышечной силы и мощности, бета-окисления, увеличение жировых запасов (N.Mauras и соавт., 1998). Соответственно, атлеты нуждаются в легальном недопинговом поддержании адекватных нагрузкам уровней тестостерона в организме за счет разрешенных веществ (андрогены и их аналоги входят в список запрещенных WADA в спорте фармакологических средств и добавок). Клинический анализ в старших возрастных группах показал корреляцию уровней 25(OH)D и андрогенов у мужчин (F.Wehr и соавт., 2010). Низкий уровень тестостерона (гипогонадизм) идентифицирован у 18 % мужчин старшей возрастной группы и коррелировал с низкими значениями 25(OH)D. Только у 11.4 % участников этой группы отмечен удовлетворительный уровень витамина D. Крупное интервенционное 12-месячное двойное-слепое рандомизированное контролируемое исследование у мужчин показало, что прием 3332 МЕ/день витамина D повышает циркулирующий 25-гидроксивитамин D, общий тестостерон, биоактивный тестостерон и свободный тестостерон (S.Pilz и соавт., 2011). Эти данные свидетельствуют, что целенаправленное повышение уровней 25(OH)D может стимулировать продукцию организмом тестостерона у мужчин, т.е. препараты и добавки витамина D3 обладают эргогенным потенциалом, опосредованным усилением продукции тестостерона. Ряд выполненных работ показывает, что потенциальными специфическими механизмами таких эффектов витамина D в отношении тестостерона могут быть: угнетение ароматизации тестостерона и повышение связывания андрогенов (данные экспериментальных исследований - (K.Kinuta и соавт., 2014; J.M.Blomberg и соавт., 2010; J.M.Blomberg, S.Dissing, 2012). В результате повышается концентрация стероидных гормонов, увеличивается гипертрофия мышц, сила и мощность движений (K.L.Herbst, S.Bhasin, 2004; R.J. Urban, 2011).
В этом плане большой интерес представляет только что опубликованное исследование L.M.Wentz и соавторов (2016) уровней витамина D, тестостерона и их корреляционных связей, у военнослужащих по контракту и ветеранов армии США. Работа выполнена на базе Армейского Медицинского Центра (Womack, Fort Bragg, NC) в период с января 2012 года по сентябрь 2013 года. Основанием для работы L.M.Wentz и соавторов были ранее проведенные исследования (J.C.Umhau и соавт., 2013; L.M.Wentz и соавт., 2014) у штатного состава армии США. Ретроспективный анализ архивных образцов сыворотки крови 990 человек выявил дефицит 25(OH)D < 25 нг/мл у 35% военнослужащих. Исследование у женщин-рекрутов (N.E.Andersen и соавт., 2010), проходивших базовый курс начальной физической подготовки, также выявило в 57% случаев низкий уровень 25(OH)D (< 30 нг/мл), причем после 8-и недель физической подготовки на открытых площадках частота недостаточности возросла до 75%. Еще в двух работах констатирована высокая частота встречаемости дефицита витамина D у военнослужащих-мужчин (V.V.Valimaki и соавт., 2004; I.Gailyte и соавт., 2013). Более того, операционный стресс во время военных тренировок снижает концентрацию тестостерона у здоровых мужчин (I.Bendik и соавт., 2014). Исходя из этого, целью работы L.M.Wentz и соавторов была проверка гипотезы о том, что низкий статус витамина D ограничивает синтез тестостерона у мужской части военного персонала. Сформулированы задачи: идентифицировать корреляционные связи между концентрациями в сыворотке крови витамина D и тестостерона у наемного персонала и ветеранов; оценить влияние низких концентраций тестостерона на мышечную массу, развитие усталости при нагрузках, физическую готовность. Проведен ретроспективный биохимический анализ 796 архивных образцов сыворотки крови. Средние значения сывороточной концентрации 25(OH)D для всех 796 образцов составили 29,2 ± 11,1 нг/мл (очень широкий диапазон 5-99 нг/мл). 17% персонала имели дефицит, 38,7% - недостаточность, а 44.3% - удовлетворительный уровень витамина D. Средний уровень концентрации тестостерона был 426,9 ± 178,6 нг/дл (диапазон 12-972 нг/дл). В соответствии с Рекомендациями Эндокринологического Общества Клинической Практики США (Endocrine Society Clinical Practice Guideline) в 24,1% образцов крови военнослужащих-мужчин обнаруживается низкий уровень тестостерона. Таблица 9 иллюстрирует соотношение таких показателей как концентрация 25(OH)D и тестостерона в сыворотке крови, возраст и индекс массы тела (ИМТ).
Таблица 9. Возраст, ИМТ и концентрация тестостерона в сыворотке крови у участников исследования L.M.Wentz и соавторов (2016) в соответствии с их статусом по содержанию 25-гидроксивитамина D в крови
| Статус военнослужащего по уровню 25(OH)D | |||
|---|---|---|---|
| Показатель | Дефицит (<20 нг/мл) (n=135) | Недостаточность (20-29 нг/мл) (n =308) | Удовлетворительный статус (30-100 нг/мл) (n=353) |
| 25(OH)D (нг/мл) | 15.2 ± 3.3 | 25.0 ± 2.8 | 38.3 ± 9.6 |
| Возраст (годы) | 39.8 ± 10.0 | 40.9 ± 9.7 | 41.1 ± 10.1 |
| ИМТ (кг/м2) | 30.4 ± 4.2 | 29.8 ± 4.4 | 29.5 ± 3.7 |
| Тестостерон (нг/дл) | 396.1 ± 162.5 | 435.6 ± 177.1 | 431.7 ± 184.1 |
Примечания: ИМТ – индекс массы тела.
Таблица 10. Возраст, ИМТ, концентрации тестостерона и 25(OH)D в сыворотке крови у участников исследования L.M.Wentz и соавторов (2016) в разных группах военнослужащих
| Показатель | Действующие контрактники (n=684) | Ветераны (n =112) | Р |
|---|---|---|---|
| 25(OH)D (нг/мл) | 29.0 ± 10.3 | 30.7 ± 14.8 | 0.237 |
| Возраст (годы) | 38.5 ± 7.9 | 54.6 ± 9.8 | <0.001 |
| ИМТ (кг/м2) | 29.6 ± 4.0 | 31.1 ± 4.6 | 0.003 |
| Тестостерон (нг/дл) | 436.8 ± 178.2 | 366.1 ± 169.4 | <0.001 |
Таблица 11. Возраст, ИМТ и концентрация тестостерона в сыворотке крови у участников исследования L.M.Wentz и соавторов (2016) в соответствии с их статусом по содержанию 25-гидроксивитамина D в крови после математической обработки (модель см. в тексте)
| Показатель | Квинтиль 1 ≤21 нг/мл |
Квинтиль 2 22-26 нг/мл |
Квинтиль 3 27-31 нг/мл |
Квинтиль 4 32-36 нг/мл |
Квинтиль 5 >36 нг/мл |
|---|---|---|---|---|---|
| Тестостерон (нг/дл) | 398.3 ± 165.1 | 426.3 ± 189.6 | 440.3 ± 178.51 | 424.4 ± 168.1 | 447.5 ± 189.61 |
| Возраст (годы) | 40.3 ± 9.6 | 40.7 ± 9.9 | 40.8 ± 10.0 | 39.6 ± 9.3 | 42.5 ± 10.71+ |
| ИМТ (кг/м2) | 30.6 ± 4.4 | 29.5 ± 4.31 | 29.9 ± 4.2 | 29.5 ± 3.9 | 29.2 ± 3.61 |
Примечания: ИМТ – индекс массы тела; 1P < 0,05 по сравнению с квинтилем 1; +P < 0,05 по сравнению с квинтилем 4. Квинтили делят выборку на 5 равных частей.
Из таблицы 9 видна тенденция снижения уровней тестостерона у мужчин-военнослужащих по мере снижения уровней 25(OH)D, но, с точки зрения статистики, эта тенденция находится на грани достоверности. Сравнение антропометрических и возрастных показателей у действующих контрактников и ветеранов показывает больший возраст и ИМТ последних (табл. 10). С возрастом снижается и содержание тестостерона в крови. Математический анализ (распределение показателей по квинтелям соответственно концентрации 25(OH)D в сыворотке крови, табл.11) показывает, что лица с наименьшей концентрацией 25(OH)D имеют также и самую низкую концентрацию тестостерона. Но в целом, если не дифференцировать испытуемых на группы, такая корреляция есть, но довольно слабая. Авторы исследования делают следующее заключение: 1) превалирование дефицита витамина D у военнослужащих-мужчин в армии США; 2) низкие концентрации 25(OH)D в сыворотке крови линейно коррелируют с низкими уровнями тестостерона, что указывает на дефицит витамина D как фактор, снижающий синтез тестостерона и потенциально ухудшающий физическую готовность военнослужащих; 3) ИМТ и возраст – два других, не менее важных, чем витамин D, фактора, влияющих на уровень тестостерона, которые необходимо учитывать при составлении общей схемы нутритивно-метаболической поддержки (НМП) военнослужащих (антивозрастная терапия, изменение структуры тела – повышение ТМТ и снижение жировой массы тела).
Основные положения Австралийского Института Спорта (AIS) в отношении витамина D (часть государственной Программы Правительства Австралии по пищевым добавкам в спорте 2014)
- Витамин D классифицируется как жирорастворимый витамин, который в функциональном плане действует как гормон, и имеет структуру, сходную со структурой стероидных гормонов.
- Существует две различные изоформы витамина D: D3 (холекальциферол) – наиболее важный изомер, образующийся в коже человека; и D2 (эргокальциферол), имеющий растительное происхождение. D2 был первой описанной в литературе изоформой витамина D и примененной в качестве пищевой добавки и в составе функциональной пищи. В настоящее время предпочтительной формой является витамин D3. D3 биологически инертен до тех пор, пока в печени не превратится в 25(OH)D, а в почках - в 1,25(OH)D.
- Витамин D играет важную роль в фосфорно-кальциевом обмене (состояние костной системы), экспрессии генов и клеточном росте. Нахождение рецепторов витамина D в большинстве тканей организма указывает на его универсальную роль в обменных процессах. С точки зрения спортивной медицины важна его регулирующая функция в скелетных мышцах.
- Принципиальным источником циркулирующего в организме витамина D является ультрафиолетовое излучение солнечного света.
- В 2010 году Институт Медицины Австралии опубликовал новые нормы потребления витамина D: 600 МЕ/день, а верхний предел – 4000 МЕ/день.
- Дефицит витамина D может приводить к серьезным нарушениям функций организма, включая повышение риска повреждений костей, хронические мышечные боли и ОРЗ.
- Имеются серьезные доказательства, что пищевые добавки витамина D, сопровождающиеся повышением его концентрации в организме, улучшают физическую готовность спортсменов, особенно физическую силу, мощность, быстроту реакции и сбалансированность движений.
- Хотя в настоящее время нет универсального определения дефицита витамина D, наиболее часто используются следующие определения в научной и клинической литературе, базирующиеся на концентрации в плазме крови метаболита 25(OH)D:
- Дефицит: < 20 нг/мл (50 нмол/л)
- Недостаточность: < 30 нг/мл (75 нмол/л)
- Удовлетворительный уровень > 30 нг/мл (75 нмол/л)
- Идеальный интервал1: 75-120 нмол/л
- Токсический уровень: >375 нмол/л при сочетании с повышением Са
(1 - верхние границы указанного интервала предпочтительны для сохранения высокой физической готовности у элитных спортсменов и безопасны).
- Научные исследования показывают недостаточный уровень витамина D спортсменов (G.Lovell 2008; K.S.Willis и соавт., 2008; J.J.Cannell и соавт., 2009).
- Категории спортсменов в Австралии, имеющих риск возникновения дефицита витамина D, включают:
- с низким уровнем пребывания на открытом воздухе (тренировки в зале) или на солнце (тренировки рано утром или поздно вечером);
- имеющие темный цвет кожи;
- живущие на широте >35 градусов к северу или югу от экватора;
- носящие одежду, закрывающую большую часть или все тело;
- постоянно использующие солнцезащитные кремы или избегающие пребывания на солнце;
- лица с ограниченными возможностями (лишенные конечностей);
- лица с мальабсорбцией ЖКТ;
- лица с наследственными заболеваниями костной системы или дефицитом витамина D.
Источники витамина D
- В регионе Австралии основным природным источником витамина D является солнечное облучение (табл.12).
Таблица 12. Региональные рекомендации для спортсменов Австралии по времени пребывания на солнце
| Регион Австралии | Лето, мин 10 утра или 2 часа после полудня |
Зима, мин 10 утра или 2 часа после полудня |
Зима, мин 12 часов |
|---|---|---|---|
| Северная Австралия (например, Кэрнс) | 6-7 | 9-12 | 7 |
| Центральная Австралия (например, Брисбен) | 6-7 | 15-19 | 11 |
| Южная Австралия - Сидней - Мельбурн - Хобарт |
6-8 6-8 7-9 |
26-28 32-52 40-47 |
16 25 29 |
Примечание: таблица адаптирована на основе: «Vitamin D and Adult Bone Health in Australia and New Zealand: A Position Statement: MJA, 2005».
- Небольшие количества витамина D поступают с пищей (рыбьим жиром, яичными желтками, функциональной пищей с повышенным содержанием витамина D. Однако, даже усиленная функциональная пища может обеспечить только 40-150 МЕ витамина D на порцию пищи, что не покрывает суточные потребности.
- Исходя из этого, спортсменам, имеющим по результатам анализа крови уровень 25(OH)-витамина D < 75 нмол/л (32 нг/мл), необходимы пищевые добавки витамина D.
Принципы дозирования и рекомендации по приему витамина D
Таблица 13. Рекомендуемые уровни потребления витамина D в соответствии с мнениями Института Медицины (C.Ross и соавт., 2011) и Эндокринологического Общества США (M.F.Holick и соавт., 2011)
| Возрастная группа | Рекомендованная суточная доза МЕ | Верхний предел МЕ/день | |
|---|---|---|---|
| Национальный Институт Медицины | |||
| Дети (0-18 лет) | 400-600 | 2500 (1-3 года) 3000 (4-8 лет) 4000 (13-18 лет) | |
| Взрослые (19-70 лет) | 600 | 4000 | |
| Пожилые лица (>70 лет) | 800 | 4000 | |
| Беременные/лактирующие | 600 | 4000 | |
| Общество Эндокринологов | |||
| Дети (0-18 лет) | 400-1000 | 2000-4000 | |
| Взрослые (19-70 лет) | 1500-2000 | 10 000 | |
| Пожилые лица (>70 лет) | 1500-2000 | 10 000 | |
| Беременные/лактирующие | 600-1000 (14-18 лет) 1500-2000 (19-50 лет) |
10 000 | |
Примечания: Экстраполируя данные таблицы, можно сделать вывод, что спортсмены (в таблице не отражены) относятся к категории лиц, которым рекомендованы предельные значения суточных доз витамина D с точки зрения Национального Института Медицины США; Общество Эндокринологов допускает и более высокие значения этого показателя (до 10 000 МЕ/день), что используется профессиональными спортсменами при больших тренировочных нагрузках.
Рекомендации МЗ РФ по дозированию витамина D
Выписка из «Клинических рекомендаций «Дефицит витамина D у взрослых: диагностика, лечение и профилактика» - Российская Ассоциация Эндокринологов, ФГБУ «Эндокринологический Научный Центр» МЗ РФ
Профилактика
- Рекомендуемыми препаратами для профилактики дефицита витамина D являются холекальциферол (D3) и эргокальциферол (D2). (Уровень доказательности B I)
- Лицам в возрасте 18-50 лет для профилактики дефицита витамина D рекомендуется получать не менее 600-800 МЕ витамина D в сутки.
- Лицам старше 50 лет для профилактики дефицита витамина D рекомендуется получать не менее 800-1000 МЕ витамина D в сутки. (Уровень доказательности B I)
- Беременным и кормящим женщинам для профилактики дефицита витамина D рекомендуется получать не менее 800-1200 МЕ витамина D в сутки. (Уровень доказательности B I).
- Для поддержания уровня 25(ОН)D более 30 нг/мл может потребоваться потребление не менее 1500-2000 МЕ витамина D в сутки. (Уровень доказательности А I)
- При заболеваниях/состояниях, сопровождающихся нарушением всасывания/метаболизма витамина D, рекомендуется прием витамина D в дозах в 2-3 раза превышающих суточную потребность возрастной группы. (Уровень доказательности B I)
- Без медицинского наблюдения и контроля уровня 25(ОН)D в крови не рекомендуется назначение доз витамина D более 10 000 МЕ в сутки на длительный период (> 6 месяцев). (Уровень доказательности B I).
Лечение
- Рекомендуемым препаратом для лечения дефицита витамина D является колекальциферол (D3) (Уровень доказательности А I). В дополнение к пп. 2.1 о выборе препарата витамина D, предпочтением отдается форме D3 (холекальциферол), которая обладает сравнительно большей эффективностью в достижении и сохранении целевых значений 25(OH)D в сыворотке крови.
- Лечение дефицита витамина D (уровень 25(ОН)D в сыворотке крови <20 нг/мл) у взрослых рекомендуется начинать с суммарной насыщающей дозы колекальциферола 400 000 МЕ с использованием одной из предлагаемых схем, с дальнейшим переходом на поддерживающие дозы (таб. ). (Уровень доказательности B I).
- Коррекция недостаточности витамина D (уровень 25(ОН)D в сыворотке крови 20-29 нг/мл) у пациентов из групп риска костной патологии рекомендуется с использованием половинной суммарной насыщающей дозы колекальциферола равной 200 000 МЕ с дальнейшим переходом на поддерживающие дозы (Таб. ) (Уровень доказательности B II).
- У пациентов с ожирением, синдромами мальабсорбции, а также принимающих препараты, нарушающие метаболизм витамина D, целесообразен прием высоких доз колекальциферола (6000-10000 МЕ/сут) в ежедневном режиме. (Уровень доказательности B II).
Дополнительные рекомендации
- Всем лицам рекомендуется адекватное возрасту потребление кальция с пищей. При недостаточном потреблении кальция с продуктами питания необходимо применение добавок кальция для обеспечения суточной потребности в этом элементе. (Уровень доказательности А I).
Таблица 14. Схемы лечения дефицита и недостаточности витамина D (МЗ РФ)
| Доза | Примеры схем лечения | |
|---|---|---|
| Коррекция дефицита витамина D (при уровне 25(OH)D менее 20 нг/мл) | ||
| 1 | 50 000 МЕ еженедельно в течение 8 недель внутрь | Вигантол2: 100 капель в неделю или по 50 капель 2 раза в неделю Аквадетрим: 100 капель в неделю или по 50 капель 2 раза в неделю |
| 2 | 200 000 МЕ ежемесячно в течение 2 месяцев внутрь | Вигантол: 10 мл (1 флакон) внутрь 1 раз в месяц - 2 месяца |
| 3 | 150 000 МЕ ежемесячно в течение 3 месяцев внутрь | Аквадетрим: 10 мл (1 флакон) внутрь 1 раз в месяц - 3 месяца |
| 4 | 7 000 МЕ в день - 8 недель внутрь | Вигантол2: 14 капель в день – 8 недель Аквадетрим: 14 капель в день - 8 недель |
| Коррекция дефицита витамина D (при уровне 25(OH)D 20-29 нг/мл) | ||
| 1 | 50 000 МЕ еженедельно в течение 4 недель внутрь | Вигантол2: 100 капель в неделю или по 50 капель 2 раза в неделю Аквадетрим: 100 капель в неделю или по 50 капель 2 раза в неделю |
| 2 | 200 000 МЕ однократно внутрь | Вигантол2: 10 мл (1 флакон) внутрь |
| 3 | 150 000 МЕ однократно внутрь | Аквадетрим: 10 мл (1 флакон) внутрь |
| 4 | 7 000 МЕ в день - 4 недели внутрь | Вигантол2:14 капель в день – 4 недели Аквадетрим: 14 капель в день - 4 недели |
| Поддержание уровней витамина D > 30 нг/мл | ||
| 1 | 1000-2000 МЕ ежедневно внутрь | Вигантол2/Аквадетрим 2 -4 капли в сутки |
| 2 | 6000-14 000 МЕ однократно в неделю внутрь | Вигантол2/Аквадетрим 15-30 капель однократно в неделю |
1 - NB! Объем капель и, таким образом, доза препарата, содержащегося в одной капле, зависят от многих факторов (характер растворителя (водный или масляные раствор), температура раствора, тип пипетки/встроенной капельницы, колебаний пузырька при отмеривании дозы и др.). 2 - NB! Ранее в инструкции к препарату Вигантол указывалась доза 667 МЕ холекальциферола в одной капле масляного раствора препарата.
Витамин D в составе НМП спортивных команд
Таблица 15. Примеры включения препаратов витамина D в официальные Протоколы и схемы НМП ведущих спортивных команд
| Спортивная команда, сборная | Рекомендации, схема дозирования | Документ, ссылка |
|---|---|---|
| ФК Барселона, Испания | 5000 МЕ/день, курс 6 недель до достижения концентрации 25(OH)D в крови >100 нмол/л; 40000 МЕ/неделю 8 недель до достижения концентрации 25(OH)D в кров >100 нмол/л. Индивидуально (протокол) при низких значениях 25(OH)D | FC Barcelona Sports Nutri-tion Guide 2014-2016
Med.Depart. |
| ФК Арсенал, Англия | 40000 МЕ/неделю 8 недель до достижения концентрации 25(OH)D в крови >100 нмол/л. Индивидуально (протокол) при низких значениях 25(OH)D | FC Arsenal Sports Nutrition Guide 2016 Med.
Depart. |
| ФК из Брюсселя, Бельгия, высшая лига | 40000 МЕ/неделю 8 недель до достижения концентрации 25(OH)D в крови >75 нмол/л. Индивидуально (протокол) при низких значениях 25(OH)D | G. Slagmolen 2014 Sports Med Dop Stud 4(2) |
| ФК из Амстердама, Голландия, высшая лига | 40000 МЕ/неделю 8 недель до достижения концентрации 25(OH)D в крови >75 нмол/л. Индивидуально ( ротокол) при низких значениях 25(OH)D | G. Slagmolen 2014 Sports Med Dop Stud 4(2) |
| Сборная по плаванию Loughborough University, UK | 5000 МЕ/день 14 недель курс в зимний период всем спортсменам | Ch-S.He, J.Sports Sci., 2015 |
| Сборная по триатлону Loughborough University, UK | 5000 МЕ/день 14 недель курс в зимний период всем спортсменам | Ch-S.He, J.Sports Sci., 2015 |
| Сборная по велосипедному спорту Loughborough University, UK | 5000 МЕ/день 14 недель курс в зимний период всем спортсменам | Ch-S.He, J.Sports Sci., 2015 |
Курсовой профилактический прием препаратов витамина D3 проводится во всех ведущих командах. В зависимости от материально-технической оснащенности медицинских отделов команд режим приема варьирует от избирательного (при дефи-ците и недостаточности витамина D) – при возможности определения 25(OH)D в сыворотке крови, до тотального назначения всем спортсменам. Курсы сроком 8-14 недель проводятся либо только в зимний и ранний весенний период, либо 4 раза в год. Целевой показатель – достижение концентрации 25(OH)D 75-120 нмол/л.
Препараты кальция
В клинической практике стандартным вариантом курсового применения препаратов витамина D является их сочетание с соединениями кальция. Австралийский Институт Спорта сформулировал следующую позицию в отношении препаратов (добавок) кальция (2011).
- В отсутствие специальных указаний для спортсменов, рекомендуется применять нормы, принятые для общей популяции:
Таблица 16. Рекомендованные суточные дозы кальция по данным AIS
| Группа населения | Суточная доза Са мг (RDIs) |
|---|---|
| Мальчики (14-18 лет) | 1300 |
| Девочки (14-18 лет) | 1300 |
| Мужчины (19-30 лет) | 1000 |
| Женщины (19-30 лет) | 1000 |
Таблица 17. Рекомендованные суточные дозы кальция по данным МЗ РФ
| Группа населения | Суточная доза Са мг (RDIs) |
|---|---|
| Дети до 3 лет | 700 |
| Дети от 4 до 10 лет | 1000 |
| Дети от 10 до 13 лет | 1300 |
| Подростки от 13 до 16 лет | 1300 |
| Лица старше 16 лет и до 50 | 1000 |
| Женщины в менопаузе или старше 50 лет | 1000-1200 |
| Беременные и кормящие грудью женщины | 1000-1300 |
- Поддержание оптимального состояния костной системы спортсменов требует постоянной нагрузочной тренировки и комплексной нутритивной поддержки, включая сбалансированое поступление кальция и витамина D.
- Потребности в кальции растут с возрастом у детей и подростков. Неадекватное поступление кальция в этой возрастной группе может приводить к снижению здоровья костей, возникновению дисбаланса между органической и неорганической составными частями костей к 25-30 годам. У взрослых эти же процессы могут вызывать развитие остеопороза.
- Недостаточное поступление энергии и/или повышенная потребность в ней непосредственно нарушают баланс между разрушением старой и образованием новой костной ткани. У женщин-спортсменов нарушается менструальный цикл и гормональный баланс, что, в свою очередь, вносит негативный аспект в обмен кальция. Увеличение поступления кальция нормализует этот процесс (рекомендуемая доза кальция при этом составляет 1500 мг/день), но одной лишь этой меры недостаточно для полного восстановления костной ткани.
- Некоторые категории спортсменов имеют риск субоптимального поступления кальция и недостаточности костной матрицы, а именно:
- при недостаточном поступлении энергии или неадекватного потребления молочных продуктов или усиленных соевых продуктов;
- с нарушенным кальциевым балансом при мальабсорбции (нарушение всасывания кальция в тонком кишечнике при таких заболеваниях как целиакия и хронические воспалительные заболевания кишечника).
- женщины-спортсмены с нарушениями менструального цикла (вторичная аменорея, менопауза и др.).
- Научные исследования не дают пока точного ответа на вопрос, как связаны уровень поступление кальция в организм и устойчивость костной системы к повреждающим воздействиям интенсивных физических тренировок. Ряд проспективных исследований у женщин-спортсменов показал, что усиленное потребление кальция (> 1500 мг/день) увеличивает минерализацию костей и снижает инциденты стрессовых переломов. В целом, выполненные ретроспективные работы показывают смешанные результаты.
- Ряд работ показывает, что острая потеря кальция вместе с потом при интенсивных физических нагрузках (циклические виды спорта) увеличивает уровни активного паратиреоидного гормона как компенсаторная реакция организма, направленная на поддержание концентрации кальция в плазме крови (усиливается его вымывание из костной матрицы). При этом превентивное потребление соединений кальция снижает компенсаторную реакцию, защищая, тем самым, костную систему.
Профиль кальциевых добавок
- Чаще всего используется карбонат кальция, хотя для клинического применения доступны такие формы как цитрат кальция, фосфат и глюконат. Карбонат кальция хорошо переносится и хорошо всасывается в ЖКТ в дозах < 500 мг. При использовании больших суточных доз (> 500-600 мг/день) используют разделение суточной дозы на 2-3 порции.
- Высокие дозы кальция в пищевых добавках составляют 500-1000 мг на порцию.
- Имеются комбинированые формы с витамином D.
Условия для использования в спорте
- Применение препаратов кальция, особенно в сочетании с витамином D, не должно носить хаотического характера, проводиться под наблюдением спортивного врача и в составе общей Программы НМП с учетом других назначаемых добавок и препаратов.
- Необходим регулярный (желательно не реже 1 раза в месяц) биохимический и клинический контроль состояния кальциевого обмена и уровня витамина D
- Сами по себе пищевые добавки кальция не гарантируют успеха без нормализации гормонального статуса и функции ЖКТ, обеспечения достаточного поступления энергии, макро- и микронутриентов, и согласования с тренировочной программой.
- Спортсмены с нарушениями функции ЖКТ, несбалансированной диетой, требуют предварительной коррекции пищевого статуса с участием диетолога или нутрициолога.
Роль витамина К в контексте действия и применения витамина D
Очень часто возникают дискуссии о целесообразности совместного применения витаминов D и К для улучшения физической формы спортсменов и лиц, ведущих активный образ жизни. Для этого имеются серьезные научные и клинические основания. Так, витамин К работает синергично с витамином D и соединениями кальция в регуляции обмена костной ткани (P.M.Kidd, 2010). Более того, токсичность витамина D проявляется только в отсутствие достаточных запасов витамина К (C.Masterjohn, 2007). Рекомендованные дозы витамина К составляют от 50 мкг до 1000 мкг (N.C.Binkley, 2002). Существует три типа витамина К (Р.Pankaj, М.Mageda, 2008): K1 (филлоквинон), который поступает из растений; K2 (менаквинон), продуцируемый кишечной флорой и K3 – синтетического происхождения, являющийся, в отличие от двух предыдущих форм, водорастворимым. Наиболее распространенной формой в диете человека является витамин K1. Наибольшей биодоступностью обладает витамин К2 из различных видов рыб, мяса, молочных продуктов, ферментированного сыра и т.д.. Обе формы витамина К играют разную роль в организме (P.Dowd и соавт., 1994), но международные рекомендации даны в отношении изоформы К1 – 90 мкг/день для женщин и 120 мкг/день для мужчин. С другой стороны, один из структурных вариантов витамина К2 - MK-4 -, наиболее эффективен на сегодняшний день в регуляции обмена в костной ткани (M.S.Hamidi, A.M.Cheung, 2014; J.Iwamoto, 2014). Однако это требует дальнейших исследований, поэтому не входит в официальные рекомендации по спортивной нутрициологии.
Коммерческие формы витамина D на рынке РФ
Таблица 18. Некоторые коммерческие формы витамина D (в аптеках и интернет-магазинах)
| Наименование | Краткая характеристика |
|---|---|
| Витамин D3 600 ME Solgar |
60 капсул. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Низкодозный препарат. Курсы от 30 дней. |
| Витамин D3 1000 ME Solgar на iHerb |
250 капсул. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Курсы от 30 дней. |
| Витамин D3 10000 ME Solgar на iHerb |
120 капсул. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Очень высокое (на пределе) содержание витамина D! Курсы от 30 дней. |
| Витамин D3 5000 МЕ Doctor's Best на iHerb |
180 мягких капсул. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Высокое содержание витамина D! |
| Витамин D3 2000 МЕ Now Foods на iHerb |
120 капсул. . Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Курсы от 30 дней. |
| Витамин D3 5000 МЕ Now Foods на iHerb |
120 и 240 капсул. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Высокое содержание витамина D! Курсы от 30 дней. |
| Витамин D3 5000 МЕ и 10000 МЕ Healthy Origins на iHerb |
120 желатиновых капсул по 5000 МЕ и 360 капсул по 10000 МЕ. Рекомендован взрослым по 1 капсуле 1 раз в день во время еды. Очень высокое (на пределе) содержание витамина D! Курсы от 30 дней. |
| Аквадетрим (витамин D3) фл.10 мл | Водный р-р для приема внутрь. 1 мл содержит 15000 МЕ витамина D3 (в 1 мл 30 капель). 1 капля = 500 МЕ. Курсы от 30 дней. |
| Вигантол (витамин D3) фл. 10 мл | Масляный р-р для приема внутрь. 1 мл (30 капель) содержит 20000 МЕ. Курсы от 30 дней. |
Фармакокинетика готовых форм витамина D
Для эффективного применения различных готовых форм витамина D необходимо знать характеристики всасывания в кишечнике, распределения по органам и тканям, депонирования и выделения вещества из организма.
Для ликвидации дефицита витамина D в клинической медицине существует два метода (схемы) перорального назначения препаратов холекальциферола (природного, нативного витамина D3): однократное (раз в месяц) применение большой дозы (от 100 тысяч МЕ и выше); ежедневное применение рекомендованных большинством медицинских организаций суточных доз в диапазоне 4000-10000 МЕ. При однократном приеме внутрь стандартных доз витамина D максимальная концентрация в сыворотке крови наблюдается в среднем через 12 ч после приема, и возвращается к исходному уровню через 72 ч. На фоне длительного применения этих препаратов (особенно в больших дозах) их выведение из циркуляции значительно замедляется и может достигать месяцев. В рандомизированном исследовании M.E.Meekins и соавторов (2014) на протяжении 28 дней сравнивались значения концентрации сывороточного 25(OH)D в двух группах: 1) при однократном приеме 150 000 МЕ холекальциферола и 2) при ежедневном приеме 5000 МЕ холекальциферола в течение всего периода наблюдения. Результаты работы представлены в таблице 19.
Таблица 19. Динамика показателей концентрации метаболитов витамина D, кальция и фосфора в плазме крови при однократном (высокая доза) и ежедневном (рекомендованная суточная доза) назначении холекальциферола (M.E.Meekins и соавт.,2014)
|
Концентрация в сыворотке крови после перорального приема витамина Dз (нмоль/л) | |||||||
|
Вариант приема вит Dз |
День 0 (прием) |
День 1 |
День 3 |
День 7 |
День 14 |
День 28 |
AUC28 |
|
150000 ME однократно |
10.3 ±9.9 |
236.5±58.3 *# |
73.6 ± 18.8 *# |
23.6 ± 13.3 * |
9.6 ± 5.4 |
7.1 ± 2.5 |
700.9 ± 226.4 |
|
5000 ME ежедневно |
6.6 ± 1.7 |
9.4 ± 7.6 |
14.8 ± 12.2 * |
27.1 ±9.0 * |
27.9 ± 7.4 # |
27.9±15.6 *# |
651.5 ± 216.4 |
|
Концентрация 25-гидроксивитамина Р в сыворотке крови после перорального приема витамина DЗ нмоль/л) | |||||||
|
150000 ME однократно |
64.0 ±21.7 |
110.0±28.5 *# |
133.5±29.3 *# |
139.0±26.0 *# |
137.5±25.5 *# |
122.0±24.8 * |
1875.0 ± 481.2# |
|
5000 ME ежедневно |
70.1 ±21.9 |
73.1±22.б * |
79.5 =22.6 * |
91.2 ±22.9 * |
108.5 ± 28.0 * |
130.5±25.1 * |
973.7 ± 312.5 |
|
Концентрация кальция в сыворотке крови после перорального приема витамина DЗ (нмоль/л) | |||||||
|
150000 ME однократно |
2.3 ± 0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 | |
|
5000 ME ежедневно |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 |
2.4 ±0.1 | |
|
Концентрация фосфора в сыворотке крови после перорального приема витамина DЗ _ (нмоль/л)_ | |||||||
|
150000 ME однократно |
1.2 ±0.1 |
1.3 ±0.1 |
1.2 ±0.1 |
1.3 ±0.1 |
1.2 ±0.1 |
1.2 ±0.2 | |
|
5000 ME ежедневно |
1.2 ±0.2 |
1.2 ±0.1 |
1.2 ±0.2 |
1.3 ±0.2 |
1.3 ±0.1 |
1.2 ±0.1 | |
Примечания: *Р < 0,05 по сравнению с исходными значениями; # Р < 0,05 по сравнению с другими группами приема витамина D; AUC28 – площадь под кривой «время-концентрация» за 28 дней наблюдения.
Как видно из представленных данных, ежедневное назначение рекомендованных суточных доз 5000 МЕ дает более ровное, контролируемое повышение концентрации метаболитов витамина D в сыворотке крови, чем однократное применение высокой дозы. В клиническом плане это наиболее эффективно для достижения требуемых концентраций витамина D в организме.
В ранее выполненной работе M.Ilahi и соавторов (2008) уточнено место однократного высокодозного (более 100 000 МЕ) приема витамина D3 у мужчин и женщин: «прием дозы 100 000 МЕ холекальциферола каждые два месяца безопасен, эффективен и экономичен при концентрации 25(ОН)D выше 20 нг/мл, однако при наличии исходного дефицита – концентрации кальцидиола в крови <20 нг/мл, даже высокие дозы не обеспечивают адекватного и равномерного повышения концентрации метаболитов витамина D».
Другая форма витамина D - альфакальцидол - предшественник активного метаболита витамина D3 - кальцитриола. Повышает абсорбцию кальция и фосфора в кишечнике, увеличивает их реабсорбцию в почках. После приема внутрь альфакальцидол быстро всасывается из желудочно-кишечного тракта (ЖКТ). Максимальная концентрация (Сmах) достигается через 8-12 часов (Tmax) после однократного приема альфакальцидола. Превращение альфакальцидола в кальцитриол (1.25-дигидроксиколекальциферол) происходит в печени путем гидроксилирования по 25 атому углерода, причем процесс гидроксилирования происходит очень быстро (носит субстрат-зависимый характер). В отличие от нативного витамина D альфакальцидол не нуждается в гидроксилировании в почках, поэтому эффективен даже у пациентов со сниженной активностью почечной 1-альфа-гидроксилазы (патология почек, пожилой возраст). Выводится почками и через кишечник с желчью примерно в равных долях. Период полувыведения составляет 19 дней.
Заключение
В настоящее время не вызывает сомнения, что витамин D является важнейшим фактором защиты от физического стресса в спортивной медицине и веществом, нормализующим функцию костной системы в норме и при физических нагрузках (категория доказательности «А»). Несмотря на некоторые отличия в результатах, большинство исследователей рекомендуют поддержание уровней метаболитов витамина D 25(OH)D в плазме крови >40 нг/мл. В результате исследований последнего десятилетия получены доказательства участия витамина D не только в росте и поддержании функционального состояния костной ткани, но и регуляции электролитного обмена, синтеза протеинов, экспрессии генов и регуляции иммунной функции (R.P.Heaney, 2008; J.J.Cannell, B.W.Hollis, 2009). Такой широкий спектр активности особенно важен у тренирующихся лиц, включая элитных спортсменов. Препараты витамина D в сочетании с другими макро-, микро- и фармаконутриентами входят не только в индивидуальные программы нутритивно-метаболической поддержки (НМП) отдельных спортсменов, но и в структуру диеты клубных и сборных команд по всему миру. Более того, в некоторых странах, где проблеме НМП спортсменов придается особенное значение, регулярный контроль дефицита и недостаточности витамина D, применение пищевых добавок этого витамина оформлены в виде отдельной национальной программы (как составная часть общей программы НМП).
Эффекты витамина D можно условно разделить на две группы: 1) специальные, которые включают прямое и опосредованное эргогенное влияние на показатели физической готовности спортсменов; 2) защитные, заключающиеся в повышении устойчивости к инфекционным болезням, нормализации липидного и углеводного обмена (снижение риска сердечно-сосудистых заболеваний, ожирения, диабета II типа, аутоиммунных болезней) (M.Wacker, M.F.Holick, 2013).
В соответствии со всеми имеющимися международными и национальными классификациями витамин D и его препараты относятся к категории «А» (высшая степень доказательности и целесообразности применения в спортивной медицине) со следующим определением: «медицинские добавки – используются по врачебным показаниям, включая диагностированный дефицит данного нутриента (фармаконутриента); требует индивидуального дозирования и контроля специалиста в области спортивной медицины (спортивный врач, спортивный нутрициолог, спортивный диетолог). Совокупность фармакологических эффектов и спектр действия, наличие дозо-зависимости во влиянии на показатели физической готовности спортсменов, позволяет отнести витамин D и его препараты к фармаконутриентам.
В соответствии с позицией МЗ РФ, дефицит витамина D определяется как концентрация 25(ОН)D <20 нг/мл (50 нмоль/л), недостаточность - концентрация 25(ОН)D от 20 до 30 нг/мл (от 50 до 75 нмоль/л), адекватные уровни 30-100 нг/мл (75-250 нмоль/л). Рекомендуемые целевые значения 25(ОН)D при коррекции дефицита витамина D - 30-60 нг/мл (75-150 нмоль/л). (Уровень доказательности А I).
Метаболиты витамина D в организме, определяемые суммарно как 25(ОН)D, оказывают непосредственное эргогенное влияние, проявляющееся повышением активности скелетных мышц за счет взаимодействия с витамин-D3 рецепторами мышечных клеток. В нескольких обзорах и мета-анализах показано, что возрастание концентрации в сыворотке 25(OH)D позитивно влияет на мышечную силу, мощность и массу тела (K.A.Stockton и соавт., 2010; R.B.Tomlinson и соавт., 2014; С.Beaudart и соавт., 2014; P.R.Von Hurst, K.L.Beck, 2014). В отдельных видах спорта установлено влияние 1,25-дигидроксивитамина D на максимальное потребление VO2 за счет изменения транспорта и утилизации кислорода внутри сосудистого русла в разных тканях. Показана положительная корреляционную связь между VО2max и сывороточной концентрацией 25(OH)D. N.E.Koundourakis и соавторы (2011) выявили значимую корреляцию между концентрациями 25(OH)D в крови и уровнем физической готовности у профессиональных игроков в футбол. L.Forney и соавторы (2014) установили, что у спортсменов-любителей (студенческий спорт) с исходно повышенными (>35 нг/мл) уровнями сывороточного 25(OH)D имеются более высокие показатели VО2max (+20 %) по сравнению с участниками с исходно низкими значениями (<35 нг/мл) 25(OH)D. Была отслежена линейная связь между пре- и постсезонными показателями уровня 25(OH)D и мышечной силой, оцениваемой по прыжкам со сгибанием ног, прыжками в противоход и спринту, а также VО2max. Z.Jastrzebski (2014) выявил у элитных гребцов возрастание VО2max (12.1 %) и концентраций 25(OH)D на 400 % (~120 нг/мл) под влиянием добавок витамина D. Это позволило авторам сделать заключение, что добавки витамина D3 на протяжении 8 недель в рамках тренировочного периода улучшают аэробный метаболизм у элитных гребцов. С другой стороны J.Fitzgerald и соавторы (2014) не нашли ассоциации между уровнями 25(OH)D и VО2max у хоккеистов. Таким образом, эргогенный эффект витамина D может носить видоспецифичный характер.
Практически однозначные результаты получены для добавок витамина D в плане ускорения восстановительных процессов. Так, прием витамина D в дозе 4000 МЕ/день в течение 35 дней у лиц со средним уровнем физической готовности ослабляет уровень воспалительной реакции (оцениваемый по биомаркерам воспаления) в ответ на сложные комбинированные тесты физической нагрузки, и ускоряет процесс восстановления.
Весьма важным представляется вывод большинства исследований о том, что основанием для пищевых интервенций витамина D3 у спортсменов является наличие его дефицита или недостаточности в организме. При нормальном уровне витамина D в организме эффективность пищевых добавок либо резко падает, либо даже дает отрицательный результат. Этот факт еще раз подчеркивает важность периодического (не реже раза в месяц) контроля уровня метаболитов витамина D в крови как отправной точки для проведения интервенций (метаболической коррекции).
Эпидемиологические исследования, проведенные в разных странах, выявили высокий уровень дефицита или недостаточности витамина D у спортсменов (в среднем в 56% случаев с широким диапазоном колебаний): усиливающийся в зимнее и раннее весеннее время; преобладающий у спортсменов в залах; примерно одинаковый паттерн дефицита у травмированных и не травмированных спортсменов. Все это обусловливает необходимость регулярного курсового назначения препаратов и добавок витамина D.
В практическом плане выработан ряд конкретных рекомендаций для использования в спортивной медицине:
- Установленное соотношение эффективности D2 и D3 - витамин D3 примерно на 87% более эффективен в поддержании уровня 25(OH)D в плазме крови и продуцирует в 2-3 раза больший запас витамина D в организме, чем эквимолярное количество витамина D2, указывает на выбор витамина D3 в качестве основного средства коррекции дефицита.
- Имеется обратная корреляция между исходным уровнем 25(OH)D в сыворотке крови и эффектом экзогенного введения витамина D. При исходно высоких (удовлетворительных) значениях витамина D в плазме (в диапазоне 80-100 нмол/л) его дополнение в пищу не вызывает практически никакого эффекта. Наоборот, при исходно низких (дефицит, недостаточность) значениях 25(OH)D в сыворотке, эффект дополнительного приема витамина D очень существенный.
- В практическом плане необходимо принять во внимание и выполнить ряд условий при назначении добавок или препаратов витамина D, чтобы обеспечить максимальную эффективность: 1) исходные концентрации общего циркулирующего 25(OH)D должны быть измерены; 2) измерение должно быть точным с использованием валидированных методов, желательно LC-MS/MS; 3) назначаемые перорально добавки витамина D должны быть индивидуально адаптированы к полученным исходным показателям, а именно: при концентрации <75 нмол/л назначается доза 5000 МЕ для увеличения показателя >75 нмол/л. Если у спортсмена имеется выраженный дефицит (<30 нмол/л) и, особенно, глубокий дефицит (<12,5 нмол/л), необходимо назначить дозу витамина D 10000 МЕ/день на протяжении не менее 4-х недель, с дальнейшим переходом на дозу 5000 МЕ/день; 4) В течение всего года (особенно в зимний период) необходимо регулярно брать образцы крови спортсменов для контроля уровня 25(OH)D и оценки эффективности лечения; 5) в течение летнего периода целесообразно дополнительное солнечное облучение (до минимальной эритемы) ежедневно в пределах 30 минут.
- Доказано, что схема перорального приема 5000 МЕ/день витамина D3 в течение 8 недель при его дефиците или недостаточности существенно повышает физическую готовность. Такой режим достоверно повышает уровень 25(OH)D с 11,62 ± 10,02 нг/мл до 41,27 ± 10,02 нг/мл.
- Необходимо в течение зимнего сезона (а в северных районах – осенне-зимнего сезона) поддерживать концентрацию метаболитов витамина D в крови на уровне 40 нг/мл. Этот целевой для спортсменов уровень обеспечивает сохранение запаса витамина D в мышцах и жировой ткани для дальнейшего использования.
- Витамин D при аэробных физических нагрузках улучшает переносимость тренировок у пациентов-астматиков (так называемая «астма физического напряжения» у лыжников, велосипедистов, конькобежцев и некоторых других категорий атлетов). С тех же позиций, режим применения витамина D3 в дозе 5000 МЕ в день в течение 8 недель наиболее эффективен и потенциально может редуцировать риск возникновения стрессовых переломов и других повреждений опорно-двигательного аппарата.
- Прием 3300-3500 МЕ/день витамина D повышает циркулирующий 25-гидроксивитамин D, общий тестостерон, биоактивный тестостерон и свободный тестостерон (S.Pilz и соавт., 2011). Эти данные свидетельствуют, что целенаправленное повышение уровней 25(OH)D может стимулировать продукцию организмом тестостерона у мужчин, т.е. препараты и добавки витамина D3 обладают эргогенным потенциалом, опосредованным усилением продукции тестостерона. В результате повышается концентрация стероидных гормонов, увеличивается гипертрофия мышц, сила и мощность движений.
- Ежедневное курсовое (от 8 недель) назначение рекомендованных суточных доз витамина D3 4000-10000 МЕ дает более ровное, контролируемое повышение концентрации метаболитов витамина D в сыворотке крови, чем однократное применение высокой дозы (свыше 100 000 МЕ один раз в два месяца).
Указанные принципы и схемы терапии витамином D3 используются в рамках НМП во многих медицинских центрах клубных команд и сборных разных стран.
В то же время, несмотря на большое количество исследований роли витамина D в спортивной подготовке, остается не меньшее число «белых пятен». В первую очередь, мало изучен такой эргогенный компонент как влияние витамина D на выносливость. Требует детализации возрастной аспект, сезонность дозирования в разных группах тренирующихся лиц, интенсивность репаративных процессов при травмах. Недостаточно работ по влиянию витамина D в разных дозах и применении разных схем назначения в увеличении мощности и мышечной силы. Практически не изучено влияние пищевых добавок витамина D на когнитивные функции спортсменов, хотя ряд исследователей включает препараты витамина D в общую классификацию средств, улучшающих мозговую деятельность.
Приложения. Схемы биохимических и клинических механизмов действия и эффектов витамина D в спортивной медицине (M.Stachowicz, A.Lebiedzińska, 2016)
Читайте также
- Дефицит витамина D
- Бета-аланин: научный обзор
- Глутамин: научный обзор
- HMB: научный обзор
- Донаторы оксида азота: научный подход
- Нейростимуляторы и нейропротекторы в спортивном питании: научный обзор
- Креатин: научный обзор
- Спортивные напитки: научный обзор
Ссылки
- Клинические рекомендации «Дефицит витамина D у взрослых. Диагностика, лечение и профилактика». Российская Ассоциация эндокринологов ФГБУ «Эндокринологический Научный Центр МЗ РФ», Москва, 2015.
- Andersen N.E., Karl J.P., Cable S.J. et al. Vitamin D status in female military personnel during combat training. J. Int. Soc. Sports Nutr., 2010, 7: 38.
- Ardestani A., Parker B., Mathur S. et al. Relation of vitamin D level to maximal oxygen uptake in adults. Am. J. Cardiol., 2011, 107:1246–1249.
- Australian Sports Institute. Calcium Supplement. Initiative of AIS Sports Nutrition. 2011.
- Barker T., Schneider E.D., Dixon B.M. et al. Supplemental vitamin D enhances the recovery in peak isometric force shortly after intense exercise. Nutr. Metab. (Lond). 2013, 10:69.
- Bartoszewska М. Vitamin D, Muscle Function, and Exercise Performance. Pediatr. Clin. N. Am., 2010, 57: 849–861.
- Beaudart C., Buckinx F., Rabenda V. et al. The effects of vitamin D on skeletal muscle strength, muscle mass and muscle power: A systematic review and meta-analysis of randomized controlled trials. J. Clin. Endocrinol. Metab., 2014, 99:4336–4345.
- Binkley N.C., Krueger D.C., Kawahara T.N. et al. A high phylloquinone intake is required to achieve maximal osteocalcin γ-carboxylation. Am. J. Clin. Nutr., 2002, 76:1055–1060.
- Bischoff H., Borchers M., Gudat F. et al. In situ detection of 1,25-dihydroxyvitamin D3 receptor in human skeletal muscle tissue. Histochem J., 2001, 33:19–24.
- Blomberg J.M., Nielsen J.E., Jørgensen A. et al. Vitamin D receptor and vitamin D metabolizing enzymes are expressed in the human male reproductive tract. Hum. Reprod., 2010, 25:1303–1311.
- Blomberg J.M, Dissing S. Non-genomic effects of vitamin D in human spermatozoa. Steroids, 2012, 77:903–909.
- Cannell J.J., Hollis B.W., Sorenson M.B. et al. Athletic performance and vitamin D. Med. Sci. Sports Exerc., 2009, 41(5): 1102-1110.
- Ceglia L., Niramitmahapanya S., da Silva M.M. et al. A randomized study on the effect of vitamin D3 supplementation on skeletal muscle morphology and vitamin D receptor concentration in older women. J. Clin. Endocrinol. Metab., 2013, 98:E1927–1935.
- Chiang C.M., Ismaeel A., Griffis R.B., Weems S. Effects of Vitamin D Supplementation on Muscle Strength in Athletes A Systematic Review. J.Strength Cond.Res., 2016, Jun 28.
- Close G.L., Leckey J., Patterson M. et al. The effects of vitamin D3 supplementation on serum total 25(OH) D concentration and physical performance: a randomised dose-response study. Br. J. Sports Med., 2013a, 47:692-696.
- Close G.L., Russell J., Cobley J.N. et al. Assessment of vitamin D concentration in non-supplemented professional athletes and healthy adults during the winter months in the UK: implications for skeletal muscle function. J. Sports Sci., 2013b, 31:344-353.
- Close G.L. Vitamin D Measurement and supplementation: what, when, why and how? Research Institute for Sports and Exercise Sciences (Liverpool John Moores University, United Kingdom), Sports Science Exchange, 2015, 28, 147, 1-4.
- Dahlquist D.T., Dieter B.P., Koehle M.S. Plausible ergogenic effects of vitamin D on athletic performance and recovery. J.Intern. Soc.Sports Nutrition, 2015, 12:33-45.
- Demay M.B. Mechanism of vitamin D receptor action. Ann. N. Y. Acad. Sci., 2006, 1068:204-213.
- Dietary Reference Intakes for Calcium and Vitamin D. Institute of Medicine, National Academy of Science:Washington, USA, 2011.
- Dowd P., Hershline R., Ham S.W., Naganathan S. Mechanism of action of vitamin K. Nat Prod. Rep. 1994, 11:251–264.
- Fitzgerald J., Peterson B., Warpeha J. et al. Vitamin D status and VO2peak during a skate treadmill graded exercise test in competitive ice hockey players. J. Strength Cond. Res., 2014, 28:3200–3205.
- Forney L., Earnest C.C., Henagan T. et al. Vitamin D Status, Body Composition, and Fitness Measures in College-Aged Students. J. Strength Cond. Res., 2014, 28:814–824.
- Garcia L.A., Ferrini M.G., Norris K.C., Artaza J.N. 1,25(OH)2vitamin D3 enhances myogenic differentiation by modulating the expression of key angiogenic growth factors and angiogenic inhibitors in C2C12 skeletal muscle cells. J.Steroid Biochem.Mol.Biol., 2013,133:1–11.
- Garcia L.A., King K.K., Ferrini M.G. et al. 1,25(OH)2vitamin D3 stimulates myogenic differentiation by inhibiting cell proliferation and modulating the expression of promyogenic growth factors and myostatin in C2C12 skeletal muscle cells. Endocrinology, 2011, 152:2976–2986.
- Gregory S.M., Parker B.A., Capizzi J.A. et al. Changes in vitamin D are not associated with changes in cardiorespiratory fitness. Clin. Med. Res., 2013, 2:68.
- Halliday T.M., Peterson N.J., Thomas J.J. et al. Vitamin D status relative to diet, lifestyle, injury and illness in college athletes. Med. Sci. Sport Exerc., 2010, 42, 335–343.
- Hamidi M.S., Cheung A.M. Vitamin K and musculoskeletal health in postmenopausal women. Mol. Nutr. Food Res., 2014, 58:1647–1657.
- He Ch-S., Frazer W.D.,., Tang J. et al. The effect of 14 weeks of vitamin D3 supplementation on antimicrobial peptides and proteins in athletes. J.Sports Sci., 2015.
- Heaney R.P., Recker P.R., Grote J. et al. Vitamin D3 is more potent than vitamin D2 in humans. J. Clin. Endocrinol. Metab., 2011, 96:E447-452.
- Herbst K.L., Bhasin S. Testosterone action on skeletal muscle. Curr. Opin. Clin. Nutr. Metab. Care, 2004, 7:271–277.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: An endocrine society clinical practice guideline. J. Clin.. Endocrinol. Metab., 2011, 96, 1911–1930.
- Iwamoto J. Vitamin K2 therapy for postmenopausal osteoporosis. Nutrients, 2014, 6:1971–1980.
- Jastrzębski Z. Effect of vitamin D supplementation on the level of physical fitness and blood parameters of rowers during the 8-week high intensity training. Facicula Educ. Fiz. şi Sport., 2014, 2:57–67.
- Kidd P.M. Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern. Med. Rev., 2010, 15:199–222.
- Kinuta K., Tanaka H., Moriwake T. et al. Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads*. Endocrinology, 2014, 141:1317–1324.
- Koundourakis N.E., Androulakis N.E., Malliaraki N., Margioris A.N. Relation of vitamin D level to maximal oxygen uptake in adults. Am. J. Cardiol., 2011, 107:1246–1249.
- Lappe J., Cullen D., Haynatzki G. et al. Calcium and vitamin D supplementation decreased incidence of stress fractures in female navy recruits. J. Bone Miner.Res., 2008, 23, 741–749.
- Lovell G. Vitamin D status of females in an elite gymnastics program. Clin. J. Sport Med., 2008, 18(2): 159-161.
- Lund D., Cornelison D. Enter the matrix: shape, signal and superhighway. FEBS J. 2013, 280:4089–4099.
- Masterjohn C. Vitamin D toxicity redefined: vitamin K and the molecular mechanism. Med. Hypotheses. 2007, 68:1026–1034.
- Mauras N., Hayes V., Welch S. et al. Testosterone deficiency in young men: Marked alterations in whole body protein kinetics, strength, and adiposity*. J.Clin.Endocrinol.Metab., 1998, 83:1886–1892.
- Medelli J., Lounana J., Menuet J.J. et al. Is osteopenia a health risk in professional cyclists? J. Clin. Densitom., 2009, 12: 28-34.
- Meekins M.E., Oberhelman S.S., Lee B.R. Pharmacokinetics of daily versus monthly vitamin D3 supplementation in non-lactating women. Eur. J. Clin. Nutr., 2014, 68(5): 632–634.
- Mowry D.A., Costello M.M., Heelan K.A. Association among cardiorespiratory fitness, body fat, and bone marker measurements in healthy young females. J. Am. Osteopath. Assoc., 2009, 109(10):534–539.
- National Health and Medical Research Council. Nutrient reference values for Australia and New Zealand: Vitamin D. 2005.
- Nattiv A., Loucks A.B., Manore M.M. et al. American College of Sports Medicine position stand. The female athlete triad. Med. Sci. Sports Exerc., 2007, 39: 1867-1882.
- Ogan D., Pritchett K. Vitamin D and the Athlete: Risks, Recommendations, and Benefits. Nutrients, 2013, 5, 1856-1868.
- Pankaj P., Mageda M. Vitamin K deficiency. Department of Gastroenterology, Winthrop University Hospital and SUNY-Stony Brook, 2008. pp.4-7.
- Pilz S., Frisch S., Koertke H. et al. Effect of vitamin D supplementation on testosterone levels in men. Horm. Metab. Res., 2011, 43:223–225.
- Razavi M.Z., Nazarali P., Hanachi, P. The effect of an exercise programme and consumption of vitamin D on performance and respiratory indicators in patients with asthma. Sport Sci. Health, 2011, 6, 89–92.
- Reddy V.S., Good M., Howard P.A., Vacek J.L. Role of vitamin D in.cardiovascular health. Am. J. Cardiol., 2010, 106:798–805.
- Ross C., Taylor A., Yaktine C.L. Institute of Medicine of the National Academies. Dietary Reference Intakes for Calcium and Vitamin D; Eds.; The National Academy of Sciences: Washington, DC, USA, 2011.
- Sato Y., Iwamoto J., Kanoko T., Satoh K. Low-dose vitamin D prevents muscular atrophy and reduces falls and hip fractures in women after stroke: a randomized controlled trial. Cerebrovasc. Dis., 2005, 20:187–192.
- Slagmolen V.G., van Hellemondt F.J., Wielders J.P.M. Do Professional Soccer Players have a Vitamin D Status Supporting Optimal Performance in Winter time? Sports Med.Dop.Stud., 2014, 4:2.
- Stachowicz M., Lebiedzińska A. The role of vitamin D in health preservation and exertional capacity of athletes. Postepy Hig Med Dosw (online), 2016; 70: 637-643 e-ISSN 1732-2693.
- Stockton K.A., Mengersen K., Paratz J.D. et al. Effect of vitamin D supplementation on muscle strength: a systematic review and meta-analysis. Osteoporos Int., 2010, 22:859–871.
- Stratos I., Li Z., Herlyn P. et al. Vitamin D increases cellular turnover and functionally restores the skeletal muscle after crush injury in rats. Am. J.Pathol., 2013, 182:895–904.
- Sugimoto H., Shiro Y. Diversity and substrate specificity in the structures of steroidogenic cytochrome P450 enzymes. Biol. Pharm. Bull., 2012, 35:818–823.
- Tenforde A.S., Sayres L.C., Sainani K.L., Fredericson M. Evaluating the relationship of calcium and vitamin D in the prevention of stress fracture injuries in the young athlete: a review of the literature. P M R. 2010, 2: 945-949.
- Todd J.J., Pourshahidi K.L., McSorley E.M. et al. Vitamin D: Recent advances and implications for athletes. Sport Med., 2015, 45:213–229.
- Tomlinson P.B., Joseph C., Angioi M. Effects of vitamin D supplementation on upper and lower body muscle strength levels in healthy individuals. A systematic review with meta-analysis. J. Sci. Med.Sport, 2014, 18(5):575-580.
- Umhau J.C., George D.T., Heaney R.P. et al. Low vitamin D status and suicide: a case-control study of active duty military service members. PLoS One 2013, 8(1): e51543.
- Urban R.J. Growth hormone and testosterone: Anabolic effects on muscle. Horm. Res. Pædiatrics, 2011, 76:81–83.
- Valimaki V.V., Alfthan H., Lehmuskallio E. et al. Vitamin D status as a determinant of peak bone mass in young. Finnish men. J. Clin. Endocr. Metab., 2004, 89, 76–80.
- Von Hurst P.R., Beck K.L. Vitamin D and skeletal muscle function in athletes. Curr. Opin. Clin. Nutr. Metab. Care., 2014,17:539–545.
- Wacker M., Holick M.F. Vitamin D—Effects on skeletal and extraskeletal health and the need for supplementation. Nutrients, 2013, 5, 111–148.
- Wehr E., Pilz S., Boehm B. et al. Association of vitamin D status with serum androgen levels in men. Clin. Endocrinol. (Oxf). 2010, 73:243–248.
- Wentz L.M., Eldred J.D., Henry M.D. et al. Clinical relevance of optimizing vitamin D status in soldiers to enhance physical and cognitive performance. J. Spec. Oper. Med., 2014, 14(1): 58-66.
- Wentz L M., Berry-Cabán C S., Wu Q., Eldred J D. Vitamin D Correlation with Testosterone Concentration in Male US Soldiers and Veterans. J.Military and Veterans’ Health, 24(3):17-23.
- Willis K.S., Peterson N.J., Larson-Meyer D.E. Should we be concerned about the vitamin D status of athletes? Int. J. Sport Nutr. Exerc. Metab., 2008, 18: 204-224.
- Willis K.S., Smith D.T., Broughton, K.S., Larson-Meyer D.E. Vitamin D status and biomarkers of inflammation in runners. Open Access J. Sports Med., 2012, 3, 35–42.
- Working Group of the Australian and New Zealand Bone and Mineral Society, Endocrine Society of Australia and Osteoporosis Australia. Vitamin D and adult bone health in Australia and New Zealand: A position statement. MJA. 2005, 182(6): 281-285.
- Zittermann A. Vitamin D in preventive medicine: are we ignoring the evidence? Br. J. Nutr., 2003, 89:552-572.
- Gailyte I., Lasaite L., Verkauskiene R. et al. Does winter time vitamin D3 deficiency result in parathyroid hormone and osteocalcin deviation in healthy 18–26 year old males? The endocrine society’s 95th annual meeting and expo; June 17, 2013: San Francisco, CA.
- Valimaki V.V., Alfthan H., Ivaska K.K. et al. Serum estradiol, testosterone, and sex hormone-binding globulin as regulators of peak bone mass and bone turnover rate in young Finnish men. J. Clin. Endocrinol. Metab.,2004, 89(8): 3785-3789.
- Bendik I., Friedel A., Roos F.F. et al. Vitamin D: a critical and essential micronutrient for human health. Front Physiol., 2014, 5:248.