Вегетативная нервная система
Содержание
Вегетативная нервная система[править | править код]
Организация вегетативной нервной системы[править | править код]
В соматической нервной системе нервные волокна тянутся к скелетной мышце, коже и органам чувств, а также от них. Соматические нервные волокна обычно реагируют на стимулы из окружающей среды, как, например, в случае рефлекса отдергивания. Большая часть активности соматической нервной системы происходит сознательно и под волевым контролем. Напротив, вегетативная, или автономная, нервная система (ВНС) в основном занята регуляцией кровообращения и деятельности внутренних органов. Она отвечает на изменяющиеся условия среды ортостатической реакцией, запуском реакций с целью регуляции внутренней среды организма. Основные виды деятельности вегетативной нервной системы не подлежат волевому контролю.
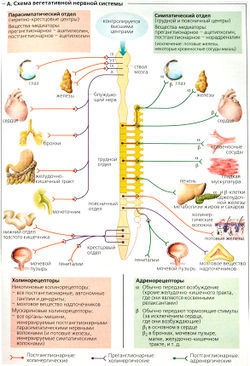
Вегетативная и соматическая нервные системы, в основном на периферии, разделены анатомически и функционально (А), но тесно контактируют в центральной нервной системе (ЦНС). Периферическая вегетативная нервная система является эфферентной (двигательной), но большинство вегетативных нервов несут также афферентные (сенсорные) нейроны. Они называются также висцеральными афферентными нейронами, потому что проводят сигналы от висцеральных (внутренних) органов, таких как пищевод, желудочно-кишечный тракт, печень, легкие, сердце, артерии и мочевой пузырь. Некоторые из них называются по нерву, который они сопровождают, например афферентный нейрон блуждающего нерва.
Активность вегетативной нервной системы обычно регулируется рефлекторной дугой, которая имеет афферентный сегмент (висцеральные и/или соматические афферентные нейроны) и эфферентный сегмент (автономные и/или соматические афферентные нейроны). Афферентные волокна проводят стимулы от кожи (болевые, или ноцицептивные, стимулы) и болевых рецепторов, от механорецепторов и хеморецепторов в таких органах, как легкие, желудочно-кишечный тракт, желчный пузырь, сосудистая система и гениталии. Вегетативная система содержит автономные эфферентные волокна, которые проводят рефлекторный ответ на афферентную информацию, индуцируя сокращение гладких мышц в таких органах, как глаза, легкие, пищеварительный тракт и желчный пузырь, и влияя на работу сердца и желез. Примеры действия соматической нервной системы - афферентные стимулы от кожи и органов чувств (например, реакция на световые стимулы) и эфферентные импульсы к скелетной мускулатуре (например, кашель и рвота).
Простые рефлексы могут быть внутри органа (например, в желудке), но сложные (комплексные) рефлексы идут через контролирующие вегетативные центры в ЦНС, в основном в спинном мозге (А). Эти центры контролируются гипоталамусом, активность которого связана с вегетативной нервной системой. Кора головного мозга -самый высокоорганизованный нервный центр, связывающий вегетативную нервную систему с другими системами.
Периферическая ВНС состоит из симпатического и парасимпатического отделов (А), которые в большинстве случаев действуют независимо. Вегетативные центры симпатического отдела расположены в грудном и поясничном отделах спинного мозга, а центры парасимпатического отдела - в стволовом отделе головного мозга (глаза, железы и органы, иннервируемые блуждающим нервом) и в крестцовом отделе спинного мозга (мочевой пузырь, нижняя часть толстой кишки и половые органы) (А). Преганглионарные волокна обоих отделов вегетативной нервной системы тянутся от центров к ганглиям, где заканчиваются на постганглионарных нейронах.
Преганглионарные симпатические нейроны, начинающиеся в спинном мозге, заканчиваются или в околопозвоночной ганглионарной цепи, в шейном или брюшном ганглии, или в так называемых терминальных ганглиях. Передача стимула от преганглионарных к постганглионарным нейронам является холинергической, т. е. опосредована высвобождением нейромедиатора ацетилхолина. Стимуляция постганглионарными симпатическими волокнами всех эффекторных органов, кроме потовых желез, является адренергической, т. е. опосредована высвобождением норадреналина.
Парасимпатические ганглии расположены вблизи или внутри эффекторных органов. Синаптическая передача в парасимпатических ганглиях и эффекторных органах является холинергической (А).
Большинство органов иннервируется симпатическими и парасимпатическими нервными волокнами. Однако ответы органов на активность этих двух систем могут быть или антагонистическими (как в сердце), или комплементарными (в половых органах).
Мозговое вещество надпочечников - это и ганглий, и эндокринная железа одновременно. Преганглионарные симпатические волокна в мозговом веществе надпочечников высвобождают ацетил-холин, что ведет к выделению в кровоток адреналина (и некоторого количества норадреналина).
Ацетилхолин и холинергическая передача[править | править код]
Ацетилхолин (АЛ) служит нейромедиатором не только двигательной концевой пластинки и в центральной нервной системе, но и в вегетативной нервной системе, ВНС , где проявляет активность
- во всех преганглионарных волокнах ВНС
- во всех парасимпатических постганглионарных нервных окончаниях
- в некоторых симпатических постганглионарных нервных окончаниях (потовые железы).
Синтез ацетилхолина. Ацетилхолин (АХ) синтезируется в цитоплазме нервных окончаний, а ацетилкофермент А (ацетил-КоА) - в митохондриях. Реакция ацетил-КоА + холин катализируется холинацетилтрансферазой, которая синтезируется в соме и достигает нервных окончаний при помощи аксоплазматического транспорта. Поскольку холин должен быть удален из внутриклеточной среды при помощи переносчиков, этот этап является лимитирующей стадией в процессе синтеза ацетилхолина.
Высвобождение ацетилхолина. Пузырьки у пресинаптического нервного окончания высвобождают содержимое в синаптическую щель, когда концентрация Са2+ в цитоплазме возрастает в ответ на потенциал действия (ПД) (А). Адреналин и норадреналин могут ингибировать высвобождение ацетилхолина путем стимуляции пресинаптических a2-адренорецепторов. В постганглионарных парасимпатических волокнах ацетилхолин блокирует свое собственное высвобождение при помощи связывания с пресинаптическими ауторецепторами (М-рецепторами; см. ниже), как показано на рис. Б.
Ацетилхолин связывается с постсинаптическими холинергическими рецепторами, или холинорецепторами, в вегетативных ганглиях и органах, иннервируемых парасимпатическими волокнами, например в сердце, в гладкой мускулатуре (глаз, бронхов, мочеточников, мочевого пузыря, гениталий, кровеносных сосудов, пищевода и желудочно-кишечного тракта), в слюнных и слезных железах, а также в симпатически иннервируемых потовых железах. Холинорецепторы бывают никотинергическими (N) или мускаринергическими (М). N-холинорецепторы (никотинергические) стимулируются алкалоидом никотином, а М-холинорецепторы (мускаринергические) - алкалоидом яда грибов мускарином.
NN-холинорецепторы вегетативных ганглиев, специфичные для нервов (А), отличаются от специфичных для мышц NM-холинорецепторов на двигательной концевой пластинке тем, что образованы разными субъединицами. Они сходны тем, что и те и другие являются ионотропными рецепторами, т. е. они действуют одновременно как холинорецепторы и как катионные каналы. Связывание ацетилхолина ведет к быстрому притоку ионов Na+ и Са2+ и к раннему (быстрому) возбуждающему постсинаптическому потенциалу действия (ВПСП), который запускает постсинаптический потенциал действия (ПД), как только превышается пороговый потенциал (А, левая часть).
М-холинорецепторы (М1-М5) воздействуют на синаптическую передачу не прямо, а посредством G-белков (метаботропные рецепторы).
М—холинорецепторы находятся в основном в вегетативных ганглиях (А), в ЦНС, в клетках желез внешней секреции. Они активируют фосфолипазу Сβ (ФЛ-Сβ) с помощью Gq-белков в постганглионарных нейронах, в результате чего высвобождаются инозитолтрифосфат (ИТФ) и диацилглицерол (ДАГ) (вторичные мессенджеры). Это стимулирует приток Са2+ и поздний возбуждающий постсинаптический потенциал (ВПСП) (А, средняя часть рисунка). Передача синаптического сигнала модулируется поздним ВПСП, а также котрансмиттерными пептидами, запускающими пептидергический ВПСП или ингибирующий постсинаптический потенциал СИПСП1 (А, правая часть).
М2-холинорецепторы расположены в сердце и функционируют в основном опосредованно, через Gj-белки. Gj-белок открывает специфические К+-каналы, локализованные в основном в синусном узле, атриовентрикулярном узле и в клетках предсердия, таким образом оказывая отрицательный хронотропный и дромотропный эффекты на сердце (Б). Gj-белки также ингибируют аденилатциклазу, снижая таким образом приток Са2+ (Б).
М3-холинорецепторы расположены в основном в гладких мышцах. Как и М1-холинорецепторы (А, средняя часть рисунка), М3-холинорецепторы запускают сокращение путем стимуляции входа Са2+ в клетку. Однако они также могут индуцировать релаксацию путем активации Са2+-зависимой NO-син-тазы, например в клетках эндотелия.
Конец действия ацетилхолина достигается путем опосредованного ацетилхолинэстеразой расщепления молекулы ацетилхолина в синаптической щели. Примерно 50% высвобождаемого холина вновь поглощается пресинаптическими нервными окончаниями (Б).
Антагонисты. Атропин блокирует все М-холинорецепторы, тогда как пирензепин, метоктрамин, гекса-гидрозиладифенидол и тропикамид селективно блокируют M1-, М2-, М3- и М4-холинорецепторы соответственно, тубокурарин- NM-холинорецепторы, а триметафан- NM-холинорецепторы.
Катехоламины. Адренергическая передача и адренорецепторы[править | править код]
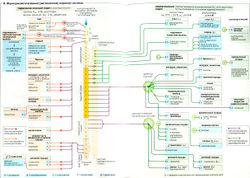
Некоторые нейроны могут образовывать (при участии ферментов) L-допа или L-дофа (L-дигидрооксифенилаланин) из аминокислоты L-тирозина. L-допа - предшественник дофамина, норадреналина и адреналина - трех природных катехоламинов, которые синтезируются в указанной последовательности. Дофамин является финальным продуктом синтеза в нейронах, содержащих только ферменты, необходимые на первой стадии синтеза (это декарбоксилаза ароматических L-аминокислот). Дофамин используется в качестве медиатора дофаминергическими нейронами в ЦНС и вегетативными нейронами, иннервирующими почки.
Норадреналин (НА) синтезируется в том случае, если присутствует также второй фермент (дофамин-β-карбоксилаза). В большинстве симпатических постганглионарных нервных окончаниях и в норадре-нергических центральных нейронах норадреналин служит нейромедиатором наряду с комедиаторами -аденозинтрифосфатом (АТФ), соматостатином и нейропептидом Y (НП-Y).
В мозговом веществе надпочечников (см. ниже) и в адренергических нейронах продолговатого мозга N-метилтрансфераза фенилэтаноламина превращает норадреналин в адреналин (А).
Окончания немиелинизированных симпатических постганглионарных нейронов являются шишковидными (узловатыми), или варикозными (А). Эти узлы представляют собой синаптические контакты, хотя и не всегда близкие, с эффекторными органами. Они также служат участками синтеза и хранения норадреналина. L-Тирозин (А1) активно поглощается нервными окончаниями и превращается в дофамин. При адренергической стимуляции эта стадия ускоряется зависимым от протеинкиназы А (ПК-A; А2) фосфорилированием соответствующего фермента. Это приводит к увеличению запасов дофамина. Дофамин помещается в хромаффинные везикулы, где превращается в норадреналин (АЗ). Норадреналин, будучи конечным продуктом, ингибирует дальнейший синтез дофамина (отрицательная обратная связь).
Высвобождение норадреналина. Норадреналин высвобождается в синаптическую щель после поступления в нервные окончания потенциала действия и инициации притока Са2+ (А4).
Адренергические рецепторы, или адренорецепторы (В). Различают четыре основных типа адренорецепторов (а1, а2, β1 и β2) в зависимости от их аффинности к адреналину и норадреналину, а также к многочисленным агонистам и антагонистам. Все адренорецепторы реагируют на адреналин; однако норадреналин оказывает слабое действие на β2-адренорецепторы. Изопротеренол (изопреналин) активирует только β-адренорецепторы, а фентоламин блокирует только а-адренорецепторы. Активность всех адренорецепторов опосредована G-белками.
Выделяют различные подтипы (a1A, а1B. а1D) a1-адренорецепторов (Б1). Их расположение и функции; ЦНС (усиление симпатической активности), слюнные железы, печень (усиление гликогенолиза), почки (действие на порог высвобождения ренина) и гладкая мускулатура (сигнал к сокращению артериол, матки, различных протоков, бронхиол, мочевого пузыря, желудочно-кишечных сфинктеров и расширителя зрачка).
Активация а1-адренорецепторов (Б1), опосредованная Gq-белками и фосфолипазой Сβ (ФЛ-Сβ), ведет к формированию вторичных мессенджеров: инозитолтрифосфата (ИТФ), который увеличивает внутриклеточную концентрацию Са2+, и диацилглицерола (ДАГ), который активирует протеинкиназу С (ПК-С). Опосредованная Gj-белками активация a1-адренорецепторов также приводит к активации Са2+-зависимых К+-каналов. Результирующая утечка К+ гиперполяризует и расслабляет мишень - гладкую мышцу (например, в желудочно-кишечном тракте).
Различают три подтипа (a2A, а2B, а2C) a2-адренорецепторов (Б2). Их расположение и функции: ЦНС (снижение симпатической активности; например, использование а2-агониста клонидина для снижения кровяного давления), слюнные железы (уменьшение слюноотделения), островковые клетки поджелудочной железы (снижение секреции инсулина), жировые клетки (снижение липолиза), тромбоциты (увеличение агрегации) и нейроны (пресинаптические ауторецепторы, см. ниже). Активированные а2-адренорецепторы (Б2) связываются с G1 белком и ингибируют (посредством аi-субъединицы Gj-белков) аденилатциклазу (синтез цАМФ) и в то же время при помощи βу-субъединицы Gj-белков увеличивают вероятность открывания зависимых от потенциала К+-каналов (гиперполяризация). Так как аг-адренорецепторы сопряжены с Go-белками, они также ингибируют зависимые от потенциала Са2+-каналы (снижая [Са2+]внутр ).
Все β-адренорецепторы сопряжены с GS-белком и их aS-субъединицы высвобождают цАМФ как вторичный мессенджер. Затем цАМФ активирует протеинкиназу А (ПК-A), которая фосфорилирует различные белки, что зависит от типа клеток-мишеней.
Норадреналин и адреналин действуют через β1-адренорецепторы (БЗ) и открывают посредством цАМФ и протеинкиназы А Са2+-каналы L-типа в мембранах клеток сердца. Это увеличивает [Са2+]внутр. и таким образом производит положительные хронотропные, дромотропные и инотропные эффекты. Активированные Gs-белки могут также напрямую увеличивать вероятность открывания зависимых от потенциала Са2+-каналов в сердце (БЗ). В почках базальная секреция ренина увеличивается посредством β1-адренорецепторов.
Активация β2-адренорецепторов адреналином (БД) увеличивает уровень цАМФ, таким образом снижая [Са2+]внутр. (механизм этого процесса пока не ясен). Это расширяет бронхиолы и кровеносные сосуды в скелетных мышцах и расслабляет мышцы матки, различных протоков и желудочно-кишечного тракта. Дальнейшие эффекты активации β2-адренорецепторов - увеличенная секреция инсулина и гликогенолиз в печени и мышцах, а также пониженная агрегация тромбоцитов.
Адреналин также увеличивает высвобождение норадреналина в норадренергических волокнах посредством активации пресинаптических β2-адренорецепторов (Д2, А5).
Продукция тепла увеличивается при помощи β3-адренорецепторов клеток бурого жира.
Норадреналин в синаптической щели инактивируется при помощи (А6а-г):
- диффузии норадреналина из синаптической щели в кровь;
- вненейронного поглощения адреналина (в сердце, железах, гладких мышцах, нейроглии и печени) и последующей внутриклеточной деградации норадреналина посредством катехоламин-O-метилтрансферазы (КОМТ) и моноаминоксидазы (МАО);
- активного вторичного поглощения норадреналина (70%) пресинаптическим нервным окончанием. Некоторое количество поглощенного норадреналина входит во внутриклеточные везикулы (АЗ) и используется повторно, а остальная часть инактивируется при помощи МАО;
- стимуляции пресинаптических а2-адренорецепторов (ауторецепторов А6г, 7) норадреналином синаптической щели, который ингибирует дальнейшее высвобождение норадреналина.
Пресинаптические а2-адренорецепторы также можно обнаружить в холинергических нервных окончаниях, например в желудочно-кишечном тракте (снижение подвижности) и предсердии (отрицательный дромотропный эффект), а пресинаптические М-холинорецепторы присутствуют в норадренергических нервных окончаниях. Их взаимодействие позволяет в некоторой степени регулировать периферическую нервную систему. Мозговое вещество надпочечников
После стимуляции преганглионарных симпатических волокон (холинергическая передача) 95% всех клеток в мозговом веществе секретирует в кровь при помощи экзоцитоза гормон адреналин (А), а другие 5% - высвобождают норадреналин (НА). Синтез норадреналина в мозговом веществе аналогичен таковому в норадренергических нейронах (см. выше), но большая часть норадреналина покидает везикулы и превращается в цитоплазме в адреналин. Специальные везикулы, называемые хромаффинными тельцами, после этого активно запасают адреналин и готовятся к высвобождению его и комедиаторов: знкефалина, нейропептида Y путем экзоцитоза.
При реакциях организма на стресс секреция адреналина (и некоторого количества норадреналина) мозговым веществом существенно увеличивается - ответ на физический, ментальный или эмоциональный стресс. Таким образом, клетки, не иннервированные симпатически, активируются и при стрессовой реакции. Адреналин увеличивает высвобождение норадреналина из нейронов посредством пресинаптических β2-адренорецепторов (А2). Секреция адреналина мозговым веществом (опосредованная увеличением симпатической активности) стимулируется некоторыми триггерами, например физической работой, холодом, теплом, тревогой, гневом (стрессом), болью, дефицитом кислорода или снижением кровяного давления. Например, при тяжелой гипогликемии (< 0,3 г/л) концентрация адреналина в плазме может увеличиваться до 20 раз, тогда как концентрация норадреналина увеличивается только в 2,5 раза, что ведет в соответствующему росту соотношения А/НА.
Основная задача, выполняемая адреналином, - мобилизовать хранящуюся химическую энергию, например, посредством липолиза и гликогенолиза. Адреналин увеличивает поглощение глюкозы в скелетных мышцах и активирует ферменты, которые ускоряют гликолиз и образование лактата. Чтобы увеличить кровоток в мышцах, организм увеличивает минутный сердечный выброс, сдерживая желудочно-кишечный кровоток и активность. Адреналин надпочечников и норадреналин нейронов начинают стимулировать секрецию гормонов, отвечающих за восполнение исчерпанных резервов энергии (например, АКТГ), пока продолжается реакция организма на стресс.
Нехолинергические и неадренергические нейромедиаторы[править | править код]
У человека гастринвысвобождающий пептид (ГВП) и вазоактивный интестинальный (кишечный) пептид (ВИП) служат комедиаторами в преганглионарных симпатических волокнах; а нейропептид Y (НП-Y) и соматостатин - в постганглионарных волокнах. Постганглионарные парасимпатические волокна используют в качестве комедиаторов нейропептиды энкефалин, вещество Р и/или НП-Y.
Первичной целью преганглионарной секреции пептидов, по-видимому, является регуляция постсинаптических нейронов. Существует весомое доказательство того, что АТФ (аденозинтрифосфат), НП-Y и ВИП также функционируют как независимые нейромедиаторы в вегетативной нервной системе. ВИП и ацетилхолин часто присутствуют одновременно (но в нескольких разных везикулах) в парасимпатических волокнах кровеносных сосудов, экзокринных железах и потовых железах. В желудочно-кишечном тракте ВИП (вместе с оксидом азота) индуцирует истощение слоя круговых мышц и мышц сфинктера, а также (вместе с комедиаторами динорфином и галанином) увеличивает желудочную секрецию. Oксид азота (N0) высвобождается из нитроергических нейронов.