Адренергические рецепторы и синапсы
Источник:
Клиническая фармакология по Гудману и Гилману том 1.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Адренергическая передача[править | править код]
Передача адренергических воздействий осуществляется с помощью катехоламинов, к которым относятся: 1) медиатор большинства симпатических постганглионарных волокон и некоторых центральных нейронов норадреналин, 2) важнейший медиатор экстрапирамидной системы, а также некоторых мезокортикальных и мезолимбических путей у млекопитающих дофамин, 3) главный гормон мозгового вещества надпочечников адреналин.
В последние годы катехоламинам и близким к ним соединениям было посвящено огромное число работ. Это связано, в частности, с тем, что для клинической практики крайне важны взаимодействия между эндогенными катехоламинами и целым рядом препаратов, используемых в лечении гипертонической болезни, психических расстройств и т. д. Подробно эти препараты и взаимодействия будут рассмотрены в последующих главах. Здесь же мы разберем физиологию, биохимию и фармакологию адренергической передачи.
Синтез, хранение, высвобождение и инактивация катехоламинов[править | править код]
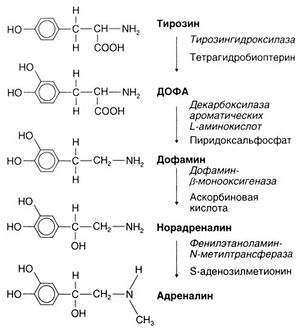
Синтез. Предположение о синтезе адреналина из тирозина и о последовательности этапов этого синтеза (рис. 6.3) было впервые высказано Блашко в 1939 г. С тех пор все соответствующие ферменты были выявлены, охарактеризованы и клонированы (Nagatsu, 1991). Важно, что все эти ферменты не обладают абсолютной специфичностью и поэтому в катализируемые ими реакции могут вступать и другие эндогенные вещества и лекарственные средства. Так, декарбоксилаза ароматических L-аминокислот (ДОФА-декарбоксилаза) может катализировать не только превращение ДОФА в дофамин, но и 5-гидрокситриптофана в серотонин (5-гидрокситриптамин) и метилдофы — в а-метилдофамин; последний под действием дофамин-β-монооксигеназы (дофамин-β-гидроксилазы) превращается в «ложный медиатор» — а-метилнорадреналин.
Лимитирующей реакцией синтеза катехоламинов считают гидроксилирование тирозина (Zigmond et al., 1989). Катализирующий эту реакцию фермент тирозингидроксилаза (тирозин-3-монооксигеназа) активируется при стимуляции адренергических нейронов или клеток мозгового вещества надпочечников. Этот фермент служит субтратом протеинкиназы А (цАМФ-зависимой), Са2+-кальмодулинзависимой протеинкиназы и протеинкиназы С. Полагают, что именно его фосфорилирование под действием протеинкиназ и приводит к повышению его активности (Zigmond et al., 1989; Daubner et al., 1992). Это важный механизм усиления синтеза катехоламинов при возросшей активности симпатических нервов. Кроме того, раздражение этих нервов сопровождается отсроченным повышением экспрессии гена тирозингидроксилазы. Есть данные о том, что это повышение может быть обусловлено изменениями на разных уровнях — транскрипции, процессинга РНК, регуляции стабильности РНК, трансляции и стабильности самого фермента (Kumer and Vrana, 1996). Биологический смысл этих эффектов заключается в том, что при усиленном высвобождении катехоламинов поддерживается их уровень в нервных окончаниях (или клетках мозгового вещества надпочечников). Кроме того, активность тирозингидроксилазы может подавляться катехоламинами по механизму аллостерической модификации; таким образом, здесь действует отрицательная обратная связь. Описаны мутации гена тирозингидроксилазы у человека (Wevers et al., 1999).
Описание к рис. 6.3. Синтез катехоламинов. Справа от стрелок приведены ферменты (курсивом) и кофакторы. Последний этап (образование адреналина) протекает только о мозговом веществе надпочечников и некоторых адреналинсодержащих нейронах ствола мозга.
Наши знания о механизмах и локализации в клетке процессов синтеза, хранения и высвобождения катехоламинов основаны на изучении органов с симпатической иннервацией и мозгового вещества надпочечников. Что касается органов с симпатической иннервацией, то почти весь содержащийся в них норадреналин локализован в нервных волокнах — через несколько суток после перерезки симпатических нервов его запасы полностью истощаются. В клетках мозгового вещества надпочечников катехоламины обнаружены в так называемых хромаффинных гранулах (Winkler, 1997; Aunis, 1998). Это пузырьки, содержащие не только катехоламины в чрезвычайно высокой концентрации (около 21% сухого веса), но и аскорбиновую кислоту, АТФ и ряд белков — хромогранины, дофамин-β-монооксигеназу, энкефалины, нейропептид Y и другие. Интересно, что N-концевой фрагмент хромогранина А — вазостатин-1 — обладает антибактериальными и противогрибковыми свойствами (Lugardon et al., 2000). В окончаниях симпатических нервов обнаружены 2 типа пузырьков: крупные электроноплотные, соответствующие хромаффинным гранулам, и мелкие электроноплотные, содержащие норадреналин, АТФ и связанную с мембраной дофамин-β-монооксигеназу.
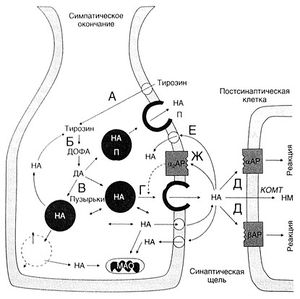
Основные механизмы синтеза, хранения, высвобождения и инактивации катехоламинов приведены на рис. 6.4. В адренергических нейронах ферменты, ответственные за синтез норадреналина, образуются в теле и по аксонам переносятся в окончания. Гидроксилирование тирозина с образованием ДОФА и декарбоксилирование ДОФА с образованием дофамина (рис. 6.3) происходит в цитоплазме. Затем примерно половина от образовавшегося дофамина путем активного транспорта переносится в пузырьки, содержащие дофамин-β-монооксигеназу, и здесь дофамин превращается в норадреналин. Остальной дофамин претерпевает сначала дезаминирование (с образованием 3,4-дигидроксифенилуксусной кислоты), а затем О-метилирование (с образованием гомованилиновой кислоты). В мозговом веществе надпочечников имеются 2 типа катехоламинсодержащих клеток: с норадреналином и адреналином. В последних имеется фермент фенилэтаноламин-N-метилтрансфераза. В этик клетках норадреналин выходит из хромаффинных гранул в цитоплазму (видимо, путем диффузии) и здесь метилируется указанным ферментом до адреналина. Последний вновь входит в гранулы и хранится в них до момента высвобождения. У взрослых на долю адреналина приходится около 80% всех катехоламинов мозгового вещества надпочечников; остальные же 20% — это преимущественно норадреналин (von Euler, 1972).
Описание к рис. 6.4. Основные механизмы синтеза, хранения, высвобождения и инактивации катехоламинов. Приведено схематическое изображение симпатического окончания. Тирозин переносится путем активного транспорта в аксоплазму (А), где под действием цитоплазматических ферментов превращается в ДОФА, а затем в дофамин (Б). Последний поступает в пузырьки, где превращается в норадреналин (В). Потенциал действия вызывает вход в окончание Са2+ (не показано), что приводит к слиянию пузырьков с пресинаптической мембраной и высвобождению норадреналина (Г). Последний активирует α- и β- адренорецепторы постсинаптической клетки (Д) и частично поступает в нее (экстранейрональный захват); в этом случае он , видимо, инактивируется путем превращения под действием КОМТ до норметанефрина. Главный же механизм инактивации норадреналина - это его обратный захват пресинаптическим окончанием (Е), или нейрональный захват. Выделившийся в синаптическую щель норадреналин может также взаимодействовать с пресинаптическими α2- адренорецепторами (Ж),подавляя собственное высвобождение (пунктир). В адренергическом окончании могут присутствовать и другие медиаторы (например, пептиды и АТФ)- в тех же пузырьках, что и норадреналин, либо в отдельных пузырьках. АР - адренорецептор, ДА - дофамин, НА - норадреналин, НМ - норметанефрин, П- пептид
Основной фактор, регулирующий скорость синтеза адреналина (а следовательно, и секреторный резерв мозгового вещества надпочечников), — это глюкокортикоиды, вырабатываемые корковым веществом надпочечников. Эти гормоны через воротную систему надпочечников поступают в высокой концентрации непосредственно к хромаффинным клеткам мозгового вещества и индуцируют в них синтез фенилэтаноламин-N-Meтилтрансферазы (рис. 6.3). Под действием глюкокортикоидов возрастает также активность в мозговом веществе тирозингидроксилазы и дофамин-β-монооксигеназы (Carroll et al., 1991; Viskupic et al., 1994). Поэтому достаточно длительный стресс, вызывающий повышение секреции АКТГ, приводит к возрастанию синтеза гормонов и коркового (в основном кортизола), и мозгового вещества надпочечников.
Этот механизм работает только у тех млекопитающих (в том числе у человека), у которых хромаффинные клетки мозгового вещества целиком окружены клетками коркового вещества. У налима, например, хромаффинные и стероидсекретирующие клетки расположены в отдельных, не связанных друг с другом железах, и адреналин у него не секретируется. В то же время фенилэтаноламин-N-метилтрансфераза у млекопитающих обнаружена не только в надпочечниках, но и в ряде других органов (головном мозге, сердце, легких), то есть возможен вненадпочечниковый синтез адреналина (Kennedy and Ziegler, 1991; Kennedy et al., 1993).
Запасы норадреналина в окончаниях адренергических волокон восполняются не только благодаря его синтезу, но и за счет обратного захвата выделившегося норадреналина. В большинстве органов именно обратный захват обеспечивает прекращение действия норадреналина. В кровеносных сосудах и в других тканях, где синаптические щели адренергических синапсов достаточно широки, роль обратного захвата норадреналина не столь велика — значительная его часть инактивируется путем экстранейронального захвата (см. ниже), ферментативного расщепления и диффузии. И обратный захват норадреналина в адренергические окончания, и его поступление в синаптические пузырьки из аксоплазмы идут против градиента концентрации этого медиатора, и поэтому они осуществляются с помощью двух систем активного транспорта, включающих соответствующие переносчики. Хранение. Благодаря тому что катехоламины хранятся в пузырьках, их высвобождение может быть достаточно точно регулируемым; кроме того, они не подвергаются действию цитоплазматических ферментов и не просачиваются в окружающую среду. Системы транспорта биогенных моноаминов достаточно хорошо изучены (Schuldiner, 1994). Захват катехоламинов и АТФ изолированными хромаффинными гранулами, видимо, осуществляется за счет градиентов pH и потенциала, создаваемых Н+-АТФазой. Перенос в пузырьки одной молекулы моноамина сопровождается выбросом двух протонов (Browstein and Hoffman, 1994). Транспорт моноаминов сравнительно неизбирателен. Например, одна и та же система способна переносить дофамин, норадреналин, адреналин, серотонин, а также мета-1 '1-бензилгуани-дин — вещество, используемое для изотопной диагностики опухоли из хромаффинных клеток феохромоцитомы (Schuldiner, 1994). Везикулярный транспорт аминов подавляется резерпином; под действием этого вещества в симпатических окончаниях и головном мозге истощаются запасы катехоламинов. Методами молекулярного клонирования были обнаружены несколько кДНК, имеющих отношение к системам везикулярного транспорта. В них были выявлены открытые рамки считывания, позволяющие предположить кодирование белков с 12 трансмембранными доменами. Эти белки должны быть гомологичны другим транспортным белкам, например белкам-переносчи-кам, опосредующим устойчивость бактерий к лекарственным средствам (Schuldiner, 1994). Изменения экспрессии этих белков могут играть важную роль в регуляции синаптической передачи (Varoqui and Erickson, 1997).
Катехоламины (например, норадреналин), введенные в кровь животным, быстро накапливаются в органах с обильной симпатической иннервацией, в частности в сердце и селезенке. При этом меченые катехоламины обнаруживаются в симпатических окончаниях; десимпатизированные органы катехоламины не накапливают (см. обзор Browstein and Hoffman, 1994). Эти и другие данные позволили предположить наличие в мембране симпатических нейронов системы транспорта катехоламинов. Оказалось, что эта система зависит от Na+ и избирательно блокируется некоторыми препаратами, в том числе кокаином и трициклическими антидепрессантами, например имипрамином. Она обладает высоким сродством к норадреналину и несколько меньшим — к адреналину. Синтетический бета-адреностимулятор изопреналин эта система не переносит. Нейрональный захват катехоламинов был назван также захватом 1-го типа (Iversen, 1975). Методами очистки белков и молекулярного клонирования были выявлены несколько высокоспецифичных переносчиков медиаторов, в частности высокоаффинных переносчиков дофамина, норадреналина, серотонина и ряда аминокислот (Amara and Kuhar, 1993; Browstein and Hoffman, 1994; Masson et al., 1999). Все они входят в обширное семейство белков, к общим чертам которых относятся, например, 12 трансмембранных доменов. Видимо, специфичность мембранных переносчиков выше, чем везикулярных. Кроме того, эти переносчики служат точками приложения таких веществ, как кокаин (переносчик дофамина) и флуоксетин (переносчик серотонина).
Так называемые непрямые симпатомиметики (например, эфедрин и тирамин) оказывают свои эффекты опосредованно, как правило, вызывая выход норадреналина из симпатических окончаний. Таким образом, действующим началом при назначении этих препаратов является сам норадреналин. Механизмы действия непрямых симпатомиметиков сложны. Все они связываются с переносчиками, обеспечивающими нейрональный захват катехоламинов, и вместе с ними переходят в аксоплазму; при этом переносчик перемещается к внутренней поверхности мембраны и тем самым становится доступным для норадреналина (обменная облегченная диффузия). Кроме того, эти препараты вызывают выход норадреналина из пузырьков, конкурируя с ним за системы везикулярного транспорта. Резерпин, вызывающий истощение запасов норадреналина в пузырьках, также блокирует везикулярный транспорт, но, в отличие от непрямых симпатомиметиков, поступает в окончание путем простой диффузии (Bonish and Trendelenburg, 1988).
При назначении непрямых симпатомиметиков часто наблюдается привыкание (тахифилаксия, десенситизация). Так, при повторном приеме тирамина его эффективность довольно быстро снижается. Напротив, повторное введение норадреналина не сопровождается снижением эффективности. Более того, устраняется привыкание к тирамину. Окончательного объяснения этим феноменам нет, хотя высказывались некоторые гипотезы. Одна из них заключается в том, что та фракция норадреналина, которую вытесняют непрямые симпатомиметики, невелика по сравнению с общими запасами этого медиатора в адренергических окончаниях. Предполагается, что эта фракция соответствует пузырькам, расположенным рядом с мембраной, и именно из них норадреналин вытесняется менее активным непрямым симпатомиметиком. Как бы то ни было, непрямые симпатомиметики не вызывают выхода из окончания дофамин-β-монооксигеназы и могут действовать в бескальциевой среде — значит, их эффект не связан с экзоцитозом.
Существует также система экстранейронального захвата катехоламинов (захват 2-го типа), обладающая низким сродством к норадреналину, несколько более высоким — к адреналину и еше более высоким — к изопреналину. Эта система распространена повсеместно: она обнаружена в клетках глии, печени, миокарда и других. Экстранейрональный захват не блокируется имипрамином и кокаином. В условиях ненарушенного нейронального захвата его роль, видимо, невелика (Iversen, 1975; Trendelenburg, 1980). Возможно, он имеет большее значение для удаления катехоламинов крови, чем для инактивации катехоламинов, выделившихся нервными окончаниями.
Высвобождение. Последовательность событий, в результате которых под действием нервного импульса из адренергических окончаний выделяется адреналин, до конца не ясна. В мозговом веществе надпочечников пусковым фактором является действие выделяемого преганглионарными волокнами ацетилхолина на N-холинорецепторы хромаффинных клеток. При этом возникает локальная деполяризация, в клетку входит Са2\ и содержимое хромаффинных гранул (адреналин, АТФ, некоторые нейропептиды и их предшественники, хромогранины, дофамин-β-монооксигеназа) выбрасывается путем экзонитоза. В адренергических окончаниях вход Са2+ по потенциалзависимым кальциевым каналам также играет ключевую роль в сопряжении деполяризации пресинаптической мембраны (потенциала действия) и высвобождения норадреналина. Блокада кальциевых каналов N-типа вызывает снижение АН — видимо, за счет подавления высвобождения норадреналина (Bowersox etal., 1992). В механизмах экзоцитоза, запускаемого кальцием, участвуют высококонсервативные белки, обеспечивающие прикрепление пузырьков к клеточной мембране и их дегрануляцию (Aunis, 1998). Повышение симпатического тонуса сопровождается увеличением концентрации в крови дофамин-β-монооксигеназы и хромогранинов. Это говорит о том, что экзоцитоз пузырьков участвует в высвобождении норадреналина при раздражении симпатических нервов.
Если синтез и обратный захват норадреналина не нарушены, то даже длительное раздражение симпатических нервов не приводит к истощению запасов этого медиатора. Если же потребности в выделении норадреналина возрастают, то вступают в действие регуляторные механизмы. направленные, в частности, на активацию тирозингидроксилазы и дофамин-β-монооксигеназы (см. выше).
Инактивация. Прекращение действия норадреналина и адреналина обусловлено: 1) обратным захватом нервными окончаниями, 2) диффузией из синаптической щели и экстра нейрональным захватом, 3) ферментативным расщеплением. Последнее обусловлено двумя основными ферментами — МАО и КОМТ (Axelrod, 1966; Kopin, 1972). Кроме того, катехоламины разрушаются сульфотрансферазами (Dooley, 1998). В то же время роль ферментативного расшепления в адренергическом синапсе гораздо меньше, чем в холинергическом, и на первое место в инактивации катехоламинов выступает обратный захват. Это видно, например, из того, что блокаторы обратного захвата катехоламинов (кокаин, имипрамин) значительно усиливают эффекты норадреналина, а ингибиторы МАО и КОМТ — лишь очень слабо. МАО играет роль в разрушении норадреналина, попавшего в аксоплазму. КОМТ (особенно в печени) имеет важнейшее значение для инактивации эндогенных и экзогенных катехоламинов крови.
МАО и КОМТ широко распространены в организме, в том числе в головном мозге. Наиболее высока их концентрация в печени и почках. В то же время в адренергических нейронах КОМТ почти отсутствует. Эти два фермента различаются и по внутриклеточной локализации: МАО преимущественно связана с наружной мембраной митохондрий (в том числе в адренергических окончаниях), а КОМТ находится в цитоплазме. От всех этих факторов зависит, по какому пути будут распадаться катехоламины в разных условиях, а также механизмы действия ряда препаратов. Выявлены 2 изофермента МАО (МАО А и МАО В), причем их соотношение в разных нейронах ЦНС и разных органах широко варьирует. Имеются избирательные ингибиторы этих двух изоферментов (гл. 19). Необратимые ингибиторы МАО А повышают биодоступность тирамина, содержащегося в ряде пищевых продуктов; поскольку тирамин усиливает высвобождение норадреналина из симпатических окончаний, при сочетании этих препаратов с тираминсодержащими продуктами возможен гипертонический криз. Избирательные ингибиторы МАО В (например, селегилин) и обратимые избирательные ингибиторы МАО А (например, моклобемид) реже вызывают это осложнение (Volz and Geiter, 1998; Wouters, 1998). Ингибиторы МАО применяют влечении болезни Паркинсона и депрессии (гл. 19 и 22).
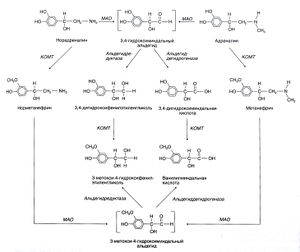
Большая часть адреналина и норадреналина, поступающих в кровь — будь то из мозгового вещества надпочечников или адренергических окончаний, — метилируется КОМТ с образованием соответственно метанефрина и норметанефрина (рис. 6.5). Норадреналин, выходящий под действием некоторых препаратов (например, резерпина) из пузырьков в аксоплазму, вначале дезаминируется под действием МАО до 3,4-гидроксиминдально-го альдегида; последний восстанавливается альдегидредуктазой до 3,4-дигидроксифенилэтиленгликоля либо окисляется альдегиддегидрогеназой до 3,4-дигидроксиминдальной кислоты. Главный метаболит катехоламинов, выделяемый с мочой, — это З-метокси-4-гидроксиминдальная кислота, которую часто (хотя и неточно) называют ванилилминдальной кислотой. Соответствующий метаболит дофамина, не содержащий гидроксильной группы в боковой цепи, — это гомованилиновая кислота. Другие реакции метаболизма катехоламинов показаны на рис. 6.5. Измерение концентраций катехоламинов и их метаболитов в крови и моче — важный метод диагностики феохромоцитомы (опухоли, секретирующей катехоламины).
Ингибиторы МАО (например, паргилин и ниаламид) могут вызвать повышение концентрации норадреналина, дофамина и серотонина в головном мозге и других органах, проявляющееся разнообразными физиологическими эффектами. Подавление активности КОМТ не сопровождается какими-либо яркими реакциями. В то же время ингибитор КОМТ энтакапон оказался достаточно эффективным при болезни Паркинсона (Chong and Mersfelder, 2000; см. также гл. 22).
Описание к рис. 6.5. Метаболизм катехоламинов. В инактивации катехоламинов участвуют и МАО, и КОМТ, но очередность их действия может бьггь различной. В первом случае метаболизм катехоламинов начинается с окислительного дезаминирования под действием МАО; адреналин и норадреналин при этом сначала превращаются в 3,4-гидроксиминдальный альдегид, который затем либо восстанавливается до 3,4-дигидроксифенилэтиленгликоля, либо окисляется до 3,4-дигидроксиминдальной кислоты. Первой реакцией второго пути служит их метилирование КОМТ до метанефрина и норметанефрина соответственно. Затем действует второй фермент (в первом случае — КОМТ, во втором — МАО), и образуются основные метаболиты, выделяющиеся с мочой, — 3-меток-си-4-гидроксифенилэтиленгликоль и З-метокси-4-гидроксиминдальная (ванилилминдальная) кислота. Свободный 3-меток-си-4-гидроксифенилэтиленгликоль в значительной степени превращается в ванилилминдальную кислоту. 3,4-дигидроксифенил-этиленгликоль и, в известной степени, О-метилированные амины и катехоламины могут конъюгироваться с сульфатами или глюкуронидами. Axelrod, 1966, и др.
Классификация адренорецепторов[править | править код]
Для того чтобы ориентироваться в удивительном многообразии эффектов катехоламинов и других адренергических веществ, необходимо хорошо знать классификацию и свойства адренорецепторов. Выяснение этих свойств и тех биохимических и физиологических процессов, на которые влияет активация разных адренорецепторов, помогло разобраться в разнообразных и порой, казалось бы, противоречивых реакциях разных органов на катехоламины. Все адренорецепторы по своей структуре близки между собой (см. ниже), но они сопряжены с разными системами вторых посредников, и поэтому их активация приводит к разным физиологическим последствиям (табл. 6.3 и 6.4).
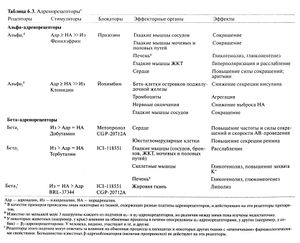
Впервые предположение о существовании разных типов адренорецепторов было высказано Алквистом (Ahlquist, 1948). Этот автор основывался на различиях в физиологических реакциях на адреналин, норадреналин и другие близкие к ним вещества. Было известно, что эти агенты могут, в зависимости от дозы, органа и конкретного вещества, вызывать как сокращение, так и расслабление гладких мышц. Так, норадреналин оказывает на них мощный стимулирующий эффект, но слабый — тормозный, а изопреналин — наоборот; адреналин оказывает оба эффекта. В связи с этим Алквист предложил использовать обозначения а и β для рецепторов, активация которых приводит соответственно к сокращению и расслаблению гладких мышц. Исключение составляют гладкие мышцы ЖКТ — активация обоих типов рецепторов обычно вызывает их расслабление. Активность адреностимуляторов в отношении β-адренорецепторов убывает в ряду изопреналин > адреналин норадреналин, а в отношении а-адренорецепторов — в ряду адреналин > норадреналин » изопреналин (табл. 6.3). Эта классификация была подтверждена тем, что некоторые блокаторы (например, феноксибензамин) устраняют влияние симпатических нервов и адреностимуляторов только на а-адренорецепторы, а другие (например, пропранолол) — на β-адренорецепторы.
В дальнейшем β-адренорецепторы были подразделены на подтипы β1 (в частности, в миокарде) и β2 (в гладких мышцах и большинстве других клеток). Это было основано на том, что адреналин и норадреналин одинаково действуют на β1-адренорецепторы, но адреналин в 10— 50 раз сильнее действует на β2-адренорецепторы (Lands et al., 1967). Были разработаны избирательные блокаторы β1- и β2-адренорецепторов (гл. 10). В дальнейшем был выделен ген, кодирующий третий подтип β-адренорецепторов, — β3 (Emorine et al., 1989; Granneman et al., 1993). Поскольку β3-адренорецепторы примерно в 10 раз чувствительнее к норадреналину, чем к адреналину, и сравнительно устойчивы к действию блокаторов типа пропранолола, именно они могут отвечать за атипичные реакции некоторых органов и тканей на катехоламины. К таким тканям относится, в частности, жировая. В то же время роль β3-адренорецепторов в регуляции липолиза у человека пока не ясна (Rosenbaum et al., 1993; Kriefctal., 1993; Lonnqvist et al., 1993). Существует гипотеза, что с полиморфизмом гена данного рецептора может быть связана предрасположенность к ожирению или инсулинонезависимому сахарному диабету у некоторых групп населения (Агпег and HofTstedt, 1999). Интерес представляет возможность использования избирательных β3-адреноблокаторов в лечении этих заболеваний (Weyeretal., 1999).
Альфа-адренорецепторы также подразделяются на подтипы. Первым основанием для такого подразделения послужили данные о том, что норадреналин и другие а-адреностимуляторы могут резко подавлять высвобождение норадреналина из нейронов (Starke, 1987; см. также рис. 6.4). Напротив, некоторые а-адреноблокаторы приводят к значительному повышению количества норадреналина, выделяемого при раздражении симпатических нервов. Оказалась, что этот механизм подавления высвобождения норадреналина по принципу отрицательной обратной связи опосредован а-адренорецепторами, по своим фармакологическим свойствам отличающимися oт расположенных на эффекторных органах. Эти пресинаптические адренорецепторы были названы а2, а классические постсинаптические адренорецепторы — a, (Langer,1997). Клонидин и некоторые другие адреностимуляторы сильнее действуют на а2-адренорецепторы, а, например, фенилэфрин и метоксамин — на а1-адренорецепторы. Данных о наличии в нейронах вегетативной нервной системы пресинаптических а1-адренорецепторов мало. В то же время а2-адренорецепторы были обнаружены во многих тканях и на постсинаптических структурах, и даже вне синапсов. Так, активация постсинаптических а2-адренорецепторов в головном мозге приводит к снижению симпатического тонуса и, видимо, в значительной степени обусловливает гипотензивное действие клонидина и подобных ему препаратов (гл. 10). В связи с этим представления об исключительно пресинаптических а2-адренорецепторах и постсинаптических а1-адренорецепторах надо считать устаревшими (табл. 6.3).
Методами молекулярного клонирования были выявлены еще несколько подгрупп в пределах обоих подтипов а-адренорецепторов (Bylund, 1992). Обнаружены три подгруппы а,-адренорецепторов (а1А, а1B и а1D; табл. 6.5), различающиеся про фармакологическим свойствам, структуре и распределению в организме. В то же время их функциональные особенности почти не изучены. Среди a2-адренорецепторов также были выделены 3 подгруппы а2В и а2С; табл. 6.5), различающиеся по распределению в головном мозге. Возможно, по крайней мере а2А-адренорецепторы могут играть роль пресинаптических ауторецепторов (Aantaa et al., 1995; Lakhlani et al., 1997).
Молекулярные основы функционирования адренорецепторов[править | править код]
Видимо, реакции на активацию всех типов адренорецепторов опосредованы G-белками, вызывающими образование вторых посредников или изменение проницаемостей ионных каналов. Как уже обсуждалось в гл. 2,подобные системы включают 3 основных белковых компонента — рецептор, G-белок и эффекторный фермент либо канал. Биохимические последствия активации адренорецепторов во многом такие же, как М-холинорецепторов (см. выше и табл. 6.4).
Структура адренорецепторов[править | править код]
Адренорецепторы представляют собой семейство родственных белков. Кроме того, они структурно и функционально сходны с большим числом других рецепторов, сопряженных с G-белками (Lefkowitz, 2000), — от М-холинорецепторов до фоторецепторного белка родопсина (гл. 2). Исследование связывания лигандов, использование специфических меток и направленного мутагенеза показало, что для сродства рецепторов к лигандам ключевое значение имеют консервативные трансмембранные домены (Strader etal., 1994; Hutchins, 1994). Видимо, они создают своего рода карман для лиганда — подобно тому, который образуется трансмембранными доменами родопсина для ковалентно связанного с ним ретиналя. В разных моделях катехоламины располагаются в этом кармане либо параллельно (Strader et al., 1994), либо перпендикулярно (Hutchins,1994) к поверхности мембраны. Расшифровка кристаллической структуры родопсина позволила подтвердить ряд гипотез относительно структуры рецепторов, сопряженных с G-белками (Palczewski et al., 2000).
Бета-адренорецепторы[править | править код]
Аминокислотная последовательность трансмембранных доменов (образующих предполагаемый карман для адреналина и норадреналина) всех трех подтипов β-адренорецепторов оказалась на 60% сходной. Методом направленного мутагенеза в β2-адренорецепторе выявлены аминокислоты, взаимодействующие с отдельными функциональными группировками молекул катехоламинов.
Активация всех β-адренорецепторов приводит к повышению активности аденилатциклазы через белок Gs (гл. 2; Taussig and Gilman, 1995). При этом накапливается цАМФ, активируется протеинкиназа А, фосфорилируются и активируются многочисленные клеточные белки (см. ниже). Кроме того, белок Gs непосредственно действует на медленные кальциевые каналы поверхностной мембраны клеток сердца и скелетных мышц, повышая вероятность их открывания. Это создает дополнительную возможность для регуляции функции этих органов.
Протеинкиназа А (цАМФ-зависимая протеинкиназа) обычно считается основной мишенью цАМФ. В неактивном виде она представляет собой тетрамер из двух регуляторных (R) и двух каталитических (С) субъединиц — Связывание с ней цАМФ приводит к снижению сродства регуляторных субъединиц к каталитическим в 10 000—100 000 раз, отсоединению регуляторных субъединиц и активации каталитических субъединиц (Francis and Corbin, 1994; Smith et al., 1999). Активная протеинкиназа А фосфорилирует различные клеточные белки, что и приводит к характерным для активации β-адренорецепторов эффектам. После прекращения действия протеинкиназы А белки дефосфорилируются фосфопротеидфосфатазами. Специфичность реакций, катализируемых протеинкиназой А, обусловлена тем, что она связана с определенными участками клеточных мембран. Эта связь, в свою очередь, опосредована так называемыми якорными белками протеинкиназы A (Edwards and Scott, 2000).
Типичным и широко известным примером этой последовательности реакций служит активация печеночной фосфорилазы. Этот фермент катализирует лимитирующую реакцию гликогенолиза — превращение глюкозы в глюкозо-1-фосфат. Его активация происходит следующим образом: протеинкиназа А фосфорилирует киназу фосфорилазы, а та, в свою очередь, фосфорилирует и тем самым активирует фосфорилазу. Благодаря такому каскаду реакций фосфорилирования происходит значительное усиление сигнала: достаточно активации лишь нескольких β-адренорецепторов, чтобы через короткое время образовалось большое количество активных молекул фосфорилазы.
Одновременно с активацией печеночной фосфорилазы протеинкиназа А фосфорилирует и тем самым инактивирует другой фермент — гликогенсинтетазу. Этот фермент катализирует перенос глюкозных остатков с УДФ-глюкозы на гликоген, и его инактивация сопровождается торможением образования последнего. Таким образом, цАМФ не только усиливает образование глюкозы из гликогена, но и подавляет его синтез; и то, и другое приводит к мобилизации глюкозы из печени.
Сходные реакции приводят к активации гормон-чувствительной липазы (триглицеридлипазы) и мобилизации свободных жирных кислот из жировой ткани. Эта липаза фосфорилируется и тем самым активируется протеинкиназой А. Так катехоламины приводят к высвобождению дополнительных субстратов для окислительного метаболизма.
В сердце активация β-адренорецепторов оказывает положительный инотропный и хронотропный эффекты. При стимуляции этих рецепторов в кардиомиоцитах возрастает концентрация цАМФ и усиливается фосфорилирование таких белков, как тропонин и фосфоламбан. Это может влиять как на внутриклеточные потоки Са3+, так и на эффекты этого иона. Кроме того, белок Gs может непосредственно действовать на медленные кальциевые каналы, повышая вероятность их открывания.
Альфа-адренорецепторы[править | править код]
Аминокислотная последовательность всех 6 подгрупп а-адренорецепторов была установлена на основании структуры трех генов а1 -адренорецепторов (а1А, а1В и а1D; Zhong and Miimeman, 1999) и трех генов а2-адренорецепторов (aM, a2B и a2C; Bylund,1992). Оказалось, что эта последовательность вполне соответствует распространенной схеме рецепторов с семью трансмембранными доменами, сопряженных с G-белками. Хотя a-адренорецепторы изучены и не так хорошо, как β-адренорецепторы, их структура и ее связь со сродством к лиганду и активацией G-белков в целом такие же, как для β-адренорецепторов (см. выше) и других рецепторов, сопряженных с G-белками (гл. 2). Аминокислотная последовательность трансмембранных доменов всех трех подгрупп а,-адренорецепторов и всех трех подгрупп а2-адренорецепторов оказалась на 75% сходной.
В то же время между собой ar и а2-адренорецепторы не более сходны, чем а- и β-адренорецепторы (на 30 и 40% соответственно).
Альфа2-адренорецепторы. Как видно из табл. 6.4, а2-адреноре-цепторы могут быть сопряжены с разнообразными эффекторами (Aantaa etal., 1995; Bylund, 1992). Первым из обнаруженных эффектов активации этих рецепторов было торможение аденилатциклазы. Однако в некоторых случаях наблюдается, напротив, повышение активности этого фермента, опосредованное либо Ру-субъединицами белка G,, либо слабой прямой стимуляцией белка Gs. Физиологическая роль увеличения активности аденилатциклазы не ясна. Активация а2-адренорецепторов приводит к открыванию зависимых от G-белков калиевых каналов и, как следствие, к гиперполяризации. Активация а2-адреноре-цепторов может также сопровождаться снижением вероятности открывания медленных кальциевых каналов; этот механизм опосредован белками G0. К другим эффектам активации этих рецепторов относится ускорение Ыа+/Н+-обмена, повышение активности фосфолипазы Ср2 и образование арахидоновой кислоты, повышение гидролиза фосфоинозитилов, возрастание внутриклеточной концентрации Са. Последним механизмом обусловлено сокращение гладких мышц под действием а2-адреностимуляторов. Кроме того, показано, что активация а2-ад-ренорецепторов может приводить к стимулированию митоген-активируемых протеинкиназ — видимо, путем высвобождения комплекса Ру из G-белков, чувствительных к коклюшному токсину (Della Rocca et al., 1997; Richman and Regan, 1998). Этот и сходные механизмы вызывают активацию тирозинкиназ и всю последующую цепь событий (подобно рецепторам пептидов, сопряженным с тирозинкиназами). Итак, а2-адренорецепторы могут запускать несколько систем внутриклеточной передачи сигнала, однако роль каждой из них в последствиях активации этих рецепторов пока не ясна. Важнейшую роль в торможении высвобождения норадреналина из симпатических окончаний и в уменьшении центральной симпатической посылки (приводящем к снижению АД) играют a2A-адренореиепторы (MacMillan et al., 1996; Docheity, 1998; Kable et al., 2000). Кроме того, эти рецепторы частично опосредуют седативный эффект избирательных а2-адреностимуляторов и их способность снижать необходимую дозу ингаляционных анестетиков (Lakhlani etal., 1997).
Альфа1-адренорецепторы. Эти рецепторы также сопряжены с разнообразными механизмами внутриклеточной передачи сигнала. Важнейший из них — это выход Са2* из эндоплазматического ретикулума в цитоплазму. Видимо, это обусловлено активацией фосфолипазы Сβ белком Gq. В свою очередь, фосфолипаза Сβ вызывает гидролиз мембранных фосфоинозитидов с образованием двух вторых посредников — ДАГ и ИФ3. Последний, действуя на соответствующий рецептор, вызывает выход Са из эндоплазматического ретикулума; ДАГ же является мощным активатором протеинкиназы С (Berridge, 1993), которая вдобавок активируется кальцием. Изменение активности протеинкиназ — не только протеинкиназы С, но и, например, ряда Са2+-кальмодулинзависимых протеинкиназ (Dempsey et al., 2000; Braun and Schulmanm, 199S) — это важный компонент реакции на активацию а1-адренорецепторов. Так, у некоторых видов животных а1-адренорецепторы стимулируют мобилизацию глюкозы из печени; это осуществляется, во-первых, за счет активации высвобождающимся кальцием киназы фосфорилазы, во-вторых — за счет фосфорилирования протеинкиназой С и, как следствие, инактивации гликогенсинтетазы. Вообще протеинкиназа С фосфорилирует многие субстраты, в том числе мембранные белки, образующие ионные каналы, насосы и обменники (например, Са2+-АТФазу). Возможно, эти механизмы участвуют в регуляции ионных проницаемостей.
Стимуляция а1-адренорецепторов приводит также к активации фосфолипазы А2 и образованию арахидоновой кислоты. Ее метаболизм по циклооксигеназному и липоксигеназному пути сопровождается образованием соответственно простагландинов и лейкотриенов (гл. 26). Альфа1-адреностимуляторы (в том числе адреналин) вызывают повышение активности фосфолипазы А2 во многих тканях и культурах клеток, что свидетельствует о важности данного пути. Под действием фосфолипазы D из лецитина (фосфатидилхолина) образуется фосфатидная кислота. Последняя сама по себе может играть роль второго посредника, вызывая выход кальция из эндоплазматического ретикулума, но кроме того, она превращается в ДАГ. Недавно было показано, что фосфолипаза D служит точкой приложения АДФ-рибозилирующего фактора (ARF) — значит, она может играть роль в регуляции внутриклеточного переноса макромолекул. Наконец, есть данные о том, что в гладких мышцах активация а-адренорецепторов влияет на медленные кальциевые каналы через G-белки.
В большинстве гладких мышц повышение внутриклеточной концентрации Са + вызывает сокращение вследствие активации кальцийзависимых протеинкиназ, например Са2+-кальмодулинзависимой киназы легких цепей миозина (в гладкой мышце сокращение запускается именно фосфорилированием этих цепей; Stull et al., 1990). С другой стороны, в гладких мышцах ЖКТ увеличение внутриклеточной концентрации Са3* при активации а1-адренорецепторов приводит, наоборот, к расслаблению — в результате открывания Са2+-зависимых калиевых каналов и гиперполяризации (McDonald et al., 1994).
Как и в случае а2-адренорецепторов, есть достаточно оснований полагать, что стимуляция а1-адренорецепторов приводит к активации митоген-активируемых и других протеинкиназ (например, фосфатидилинозитол-3-киназа), регулирующих рост и пролиферацию клеток (Dorn and Brown, 1999; Gutkind, 1998). Так, длительная стимуляция этих рецепторов усиливает рост кардиомиоцитов и гладких мышц сосудов.
Локализация адренорецепторов[править | править код]
Пресинаптические а2- и β2-адренорецепторы играют важную роль в регуляции высвобождения норадреналина из симпатических окончаний. Кроме того, пресинаптические а2-адренорецепторы могут подавлять выделение и других медиаторов из центральных и периферических нейронов. Постсинаптические а2- и β2-адренорецепторы найдены на многих типах нейронов в головном мозге. На периферии постсинаптические а2-адренорецепторы обнаружены на гладких мышцах сосудов и других органов (активация этих рецепторов приводит к сокращению гладких мышц), липоцитах и секреторных эпителиальных клетках (в кишечнике, почках и эндокринных железах). Постсинаптические β2-адренорецепторы имеются в рабочем миокарде (их активация сопровождается положительным инотропным эффектом), на гладких мышцах сосудов и других органов (активация сопровождается расслаблением). Как а2-, так и β2-адренорецепторы нередко располагаются в участках, отдаленных от адренергических окончаний. Чаще всего такие внесинаптические рецепторы встречаются на гладких мышцах сосудов и форменных элементах крови (тромбоцитах и лейкоцитах); они могут активироваться преимущественно катехоламинами крови (адреналином).
Постсинаптические а1- и β1-адренорецепторы, напротив, в периферических органах обычно располагаются непосредственно в области адренергических окончаний и поэтому активируются главным образом выделяющимся из этих окончаний медиатором. Их много также в головном мозге у млекопитающих.
Распределение отдельных подгрупп а1- и а2-адренорецепторов (см. выше) до конца не изучено. Методом флюоресцентной гибридизации in situ для выявлениям РНК рецепторов и с помощью антител, специфичных к отдельным подгруппам рецепторов, было показано, что а2А-адренорецепторы в головном мозге могут быть как пресинаптическими, так и постсинаптическими. Эти и другие данные позволяют предположить, что рецепторы данной подгруппы играют роль пресинаптических ауторецепторов в центральных адренергических нейронах (Aantaa et al., 199S; Lakhlani et al., 1997). Аналогичными методами было обнаружено, что в гладких мышцах предстательной железы преобладают а1А-адренорецепторы (Walden et al., 1997).
Десенситизация[править | править код]
Длительное действие на ткань катехоламинов сопровождается постепенным снижением реакции на них. Это явление, называемое привыканием, рефрактерностью, тахифилаксией и десенситизацией, существенно ограничивает время действия и эффективность катехоламинов и подобных им веществ (гл. 2). Десенситизация широко известна, но механизмы ее до конца не ясны. Подробнее всего они изучены на примере β-адренорецепторов, активация которых приводит к образованию цАМФ.
Есть данные о том, что величина реакции ткани на катехоламины регулируется на разных уровнях, включая рецепторы, G-белки, аденилатциклазу и фосфодиэстеразу. Таким образом, десенситизация может быть обусловлена разными механизмами; соответственно, и проявляться она может по-разному. Иногда (особенно при изменениях на уровне рецепторов) она касается только β-адреностимуляторов. Это так называемая гомологичная десенситизация. В других же случаях в ответ на действие β-адреностимулятора снижается реакция на многие вещества, усиливающие сопряженный с рецепторами синтез цАМФ. Такая десенситизация называется гетерологичной; она также может быть обусловлена изменениями на уровне рецепторов, но может затрагивать и другие этапы каскада внутриклеточной сигнализации.
Один из важнейших механизмов быстрой регуляции функции β-адренорецепторов — это фосфорилирование данных рецепторов при их стимуляции лигандом. В результате чувствительность рецепторов к катехоламинам снижается. Это фосфорилирование может быть обусловлено разными протеинкиназами, но последствия его одинаковые — разобщается связь рецептора с Gs-белком и, как следствие, уменьшается активация аденилатциклазы.
Гетерологичная десенситизация[править | править код]
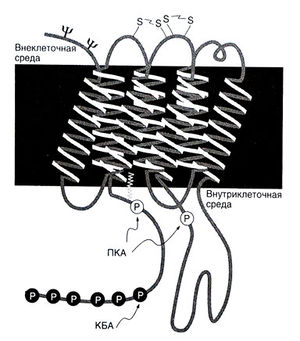
Одна из протеинкиназ, фосфорилирующих сопряженные с G-белками рецепторы, — это протеинкиназа А. Как уже говорилось, она активируется цАМФ, образующимся под действием аденилатциклазы; последняя, в свою очередь, активируется при стимуляции β-адренорецепторов. Таким образом, протеинкиназа А обеспечивает отрицательную обратную связь: в ответ на стимуляцию β-адренорецепторы фосфорилируются и десенситизируются (Hausdorff et al., 1990). Показано, что фосфорилирование β2-адренорецепторов происходит в области дистального участка третьей внутриклеточной петли и проксимального участка внутриклеточного (С-концевого) домена (рис. 6.6). Гетерологичная десенситизация обусловлена фосфорилированием участка третьей внутриклеточной петли (Clark et al., 1989). Видимо, при этом изменяется конформация рецептора и, как следствие, нарушается его связь с белком Gs.
Описание к рис. 6.6. Участки фосфорилирования β2-адренорецептора. С внеклеточной стороны показаны предполагаемые дисуль-фидные мостики между двумя внеклеточными петлями и — в области внеклеточного (N-концевого) домена — два характерных участка гликозилирования аспарагиновой кислоты (ЧР). С цитоплазматической стороны изображены участки фосфорилирования протеинкиназой А и киназой Р-адренорецепторов. Фосфорилирование внутриклеточного (С-концевого) домена киназой p-адренорецепторов приводит к соединению с рецептором p-аррестина и нарушению связи рецептора с белком G,. Этот механизм лежит в основе гомологичной десенситизации, тогда как фосфорилирование протеинкиназой А приводит к гетерологичной десенситизации (см. текст). Зигзагообразной фигурой изображена пальмитоиловая группа, ковалентно связанная в р2-адренорецепторе с Цис341. КБА — киназа Р-адреноре-цепторов, ПКА — протеинкиназа A. Collins et al., 1992.
Гомологичная десенситизация[править | править код]
Особая протеинкиназа — киназа β-адренорецепторов — фосфорилирует только эти рецепторы и только тогда, когда с ними связан стимулятор (Benovic et al., 1986). Оказалось, что она относится к семейству, включающему по меньшей мере шесть киназ рецепторов, сопряженных с G-белками. Эти киназы, образующие семейство GRK (G-protein-coupled receptor kinases), фосфорилируют и тем самым регулируют функцию многочисленных рецепторов данного семейства. Поскольку киназы семейства GRK действуют только на активированные рецепторы, связанные со стимуляторами, они обеспечивают гомологичную — специфичную по отношению к лиганду — десенситизацию. Строение всех киназ семейства GRK сходно (Krupnick and Benovic, 1998; Pitcher et al.,1998). Примером таких киназ может быть киназа GRK1, называемая раньше родопсинкиназой. Этот фермент регулирует функцию фоторецепторного белка родопсина. Киназа GRK1 обнаруживается преимущественно в палочках и колбочках, а, например, киназа GRK2 — в самых разных клетках. На настоящий лень киназа GRKI — это единственная киназа данного семейства, для которой установлен субстрат (родопсин); для остальных киназ семейства GRK четкой связи с теми или иными рецепторами не выявлено. Активированные стимуляторами β-адреноренепторы взаимодействуют с белком Gs, вызывая его распад на субъединицу а, и комплекс Ру (гл. 2). Последний остается фиксированным на клеточной мембране посредством липидного (геранил-геранилового) остатка и при этом, видимо, способствует связыванию с мембраной киназы β-адренорецепторов (киназой GRK I) или стабилизирует эту связь. Тем самым и обеспечивается фосфорилирование соединенного со стимулятором и активированного β-адренорецептора, которое происходит в области множественных сериновых остатков рядом с С-концевым фрагментом (рис. 6.6).
Домен, связывающий комплекс Ру, имеется также у киназы GRK3. Киназы GRK4 и GRK6 содержат остаток пальмитиновой кислоты, а киназа GRK5 — два основных фосфолипидсвязываюших домена (Krupnick and Benovic, 1998). Киназы семейства GRK фосфорилируют и множество других рецепторов, сопряженных с G-белками (в том числе а1А- и а2А-адренорецепторы, рецепторы тромбина, ангиотензиновые рецепторы), и некоторые другие белки. Ингибиторы киназ семейства GRK могут уменьшать выраженность десенситизации, а избыточная экспрессия киназ семейства GRK в кардиомиоцитах снижает их реакцию на β-адреностимуляторы (Koch et al., 1995). Интересно, что снижение этой реакции часто бывает при сердечной недостаточности, и есть данные, что у таких больных увеличена экспрессия киназ семейства GRK в миокарде (Lingerer et al.1993).
Если фосфорилирование сопряженного с G-белком рецептора протеинкиназой А непосредственно приводит к десенситизации, то самого по себе фосфорилирования киназами семейства GRK, очевидно, недостаточно. Полагают, что должна происходить еще одна реакция, при которой некий белок соединяется с фосфорилированным рецептором и путем аллосте-рической модификации блокирует его взаимодействие с G-бел-ком. На самом деле речь идет о целом семействе белков, действующих сходным образом во многих рецепторах (Krupnick and Benovic, 1998; Lefkowitz, 1998). В случае рецепторов, сопряженных с G-белками, этот белок называется p-аррестином (от англ. arrest — задерживать, останавливать), а в случае фоторецепторных клеток — просто аррестином. Фосфорилирование рецептора резко ускоряет его связывание с аррестинами. Это связывание играет важнейшую роль в регулировании клеточных реакций на активацию рецепторов.
Кроме того, действие на рецепторы стимуляторов вызывает быструю (в течение нескольких минут) обратимую интернализацию рецепторов и более медленное (в течение часов) снижение их количества. Значение интернализации не совсем ясно. Есть данные, что она играет роль в некоторых (Daaka et al.,1998), но не во всех случаях стимуляции митоген-активируемых протеинкиназ в ответ на активацию рецепторов, сопряженных с G-белками (Schramm and Limbird, 1999; Pierce et al., 2000). С количественной точки зрения значение интернализации для десенситизации может быть невелико, в частности потому, что во многих клетках на этапах между активацией β-адренорецептора и конечными реакциями эффекторных белков происходит значительное усиление сигнала. Тем не менее есть данные, что при интернализации может происходить дефосфорилирование рецепторов и восстановление их чувствительности к стимуляторам. Снижение количества рецепторов обусловливает длительную десенситизацию. Не вызывает сомнения, что оно опосредовано несколькими механизмами, в том числе изменением скорости оборота рецепторов, транскрипции их генов и стабильности их мРНК. Процессы эти сложны и до конца не изучены (Collins et al., 1992).
Есть данные об интернализации и о снижении количества а2-адренорецепторов, хотя у разных их подгрупп эти процессы сильно различаются (Saunders and Limbird, 1999; Heck and Bylund, 1998). Кроме того, в ряде работ обнаружены интернализация и фосфорилирование после активации стимулятором и а-адренорецепторов (Wang et al., 1997; Diviani et al., 1997; Garcia-Sainz et al., 2000).