Реабсорбция в почках
Содержание
Реабсорбция органических веществ
Фильтрационная нагрузка вещества - произведение концентрации этого вещества в плазме на скорость клубочковой фильтрации (СКФ). Поскольку СКФ высокая (примерно 180 л в сутки], каждые сутки в первичную мочу выходят огромные количества разных веществ (например, 160 г D-глюкозы в сутки).
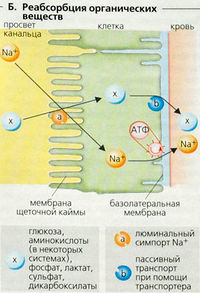
Фракция экскреции (ФЭ) D-глюкозы очень мала (» 0,4%). Практически полная ее реабсорбция достигается при помощи вторичного активного транспорта (симпорт Na+-глюкозы) в клеточной мембране с люминальной стороны канальца (Б). Примерно 95% этой активности проявляется в проксимальных канальцах.
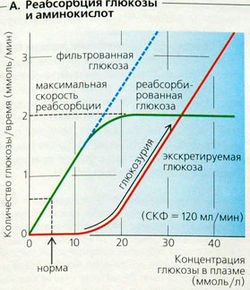
Если концентрация глюкозы в плазме превышает 10-15 ммоль/л, как при сахарном диабете (норма 5 ммоль/л), то развивается глюкозурия, и концентрация глюкозы в моче растет (А). Реабсорбция глюкозы демонстрирует кинетику насыщения (кинетика Михаэлиса-Ментен). Приведенный выше пример иллюстрирует преренальную глюкозурию. Почечная глюкозурия может развиваться, если один из канальцевых транспортеров глюкозы имеет дефекты.
За реабсорбцию глюкозы отвечают переносчики (транспортеры) с низким сродством в клеточной мембране просвета извитых канальцев (транспортер Na+-глюкозы 2-го типа, SGLT2) и переносчики с высоким сродством в прямых канальцах (SGLT1). В обоих случаях это достигается за счет котранспорта D-глю-козы и Na+, при соотношении 1:1 в случае SGLT2 и 1:2 в случае SGLT1. Энергия для данного типа вторичного активного транспорта глюкозы поставляется электрохимическим градиентом Na+, направленным во внутреннее пространство клетки. Поскольку SGLT1 осуществляет котранспорт 2Na+ на одну молекулу глюкозы, градиент для этого транспортера в 2 раза больше градиента для SGLT2. Унипортер GLUT2 (транспортер глюкозы 2-го типа) со стороны кровотока облегчает пассивный транспорт аккумулированной внутриклеточной глюкозы из клетки [облегченная диффузия). D-галактоза также использует SGLT1-транспортер, тогда как D-фруктоза пассивно абсорбируется клетками канальцев (GLUT5).
Плазма содержит более 25 аминокислот, и ежедневно фильтруется около 70 г аминокислот. Аналогично D-глюкозе, большинство L-аминокислот реабсорбируется в клетках проксимальных канальцев путем Na+-сопряженного вторичного активного транспорта (Б). В проксимальных канальцах находятся по крайней мере 7 переносчиков аминокислот, и некоторые из них транспортируют одинаковые аминокислоты. Jmax и Км и, следовательно, растворимость и способность к реабсорбции варьируют в зависимости от типа аминокислоты и переносчика. Фракция экскреции большинства аминокислот составляет примерно 1% (от 0,1% для L-валина до 6% для L-гистидина).
Иногда развивается повышенная экскреция аминокислот с мочой (гипераминоацидурия). Предпочечна ипераминоацидурия происходит при повышении концентрации аминокислот в плазме (и при выходе реабсорбции на плато насыщения, как на А), а причиной почечной гипераминоацидурии является недостаточный транспорт. Такая дисфункция может быть специфической (например, цистинурия, когда повышенной экскреции подвергаются только L-цистеин, L-аргинин и L-лизин) или неспецифической (например, синдром Фанкони, когда повышенной экскреции подвергаются не только аминокислоты, но также глюкоза, фосфаты, бикарбонаты и т. д.).
Некоторые вещества (лактат, сульфат, фосфат, дикарбоксилаты и т. д.) тоже реабсорбируются в проксимальных канальцах путем Na cимпорта, тогда как мочевина подлежит пассивной обратной диффузии.
И ураты, и оксалаты реабсорбируются и секретируются, причем для урата преобладает реабсорбция (ФЗ » 0,1), а для оксалата - секреция (ФЭ > 1). Если концентрация в моче этих слаборастворимых веществ поднимается выше нормы, то они начинают осаждаться (увеличивается риск образования мочевых камней). Подобным же образом повышенная экскреция цистеина может вести к образованию цистеиновых камней.
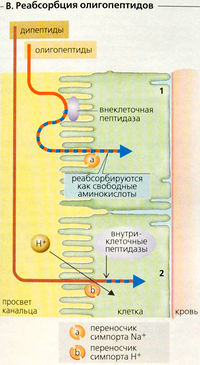
Олигопептиды, такие как глутатион и ангиотензин II, так быстро расщепляются люминальными пептидазами на щеточной каемке, что могут реабсорбироваться в качестве свободных аминокислот (В1). Дипептиды (например, карнозин), устойчивые к гидролизу в просвете канальца, должны абсорбироваться как интактные молекулы. Симпорт-переносчик (РерТ2), приводимый в действие направленным внутрь градиентом ионов Н+, транспортирует молекулы в клетку (третичный активный Н+-симпорт). Затем внутри клетки дипептиды гидролизуются (В2). Переносчик РерТ2 также используется некоторыми лекарствами и токсинами.
Белки. Хотя альбумин имеет низкий коэффициент фильтрации (0,0003), в сутки фильтруется 2400 мг альбумина при его концентрации в плазме 45 г/л (180 д/суг • 45 г/л • 0,0003 = 2400 мг/сут). При этом за сутки экскретируется только от 2 до 35 мг альбумина (ФЭ » 1%). В проксимальных канальцах альбумин, лизоцим, а1-микроглобулин, β2-микроглобулин и другие белки реабсорбируются путем рецепторопосредованного эндоцитоза и «перевариваются» лизосомами (Г).
Поскольку этот тип реабсорбции при нормальных фильтрационных нагрузках по белкам происходит почти на плато насыщения, повышенная концентрация белка в плазме или повышенный коэффициент фильтрации белка ведет к протеинурии.
25-ОН-холекальциферол, связанный в плазме и в клубочковом фильтрате с D-СБ (витамин D-связывающим белком), реабсорбируется (в комбинации с D-СБ) путем рецепторопосредованного эндоцитоза.
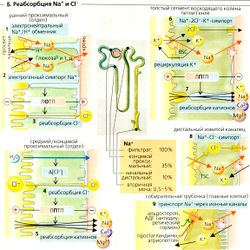
Реабсорбция Na+ и Cl-
Примерно 99% фильтруемого Na+ реабсорбируется (—27 000 ммоль/сут), т. е. фракция экскреции Na+ (ФЭNa+) составляет около 1%. ФЭNa+ (от 0,5 до 5%) регулируется альдостероном, атриопептином и другими гормонами (Б9).
Участки реабсорбции Na+. Реабсорбция происходит во всех частях почечных канальцев и собирательной трубочки. Примерно 65% фильтруемого Na+ реабсорбируется в проксимальном канальце, при постоянной концентрации Na+ в просвете. Еще 25% реабсорбируются в петле Генле, где концентрация Na+ в просвете резко снижается. Дистальные извитые канальцы и собирательная трубочка также реабсорбируют Na+. Собирательная трубочка является участком тонкой гормональной регуляции экскреции Na+.
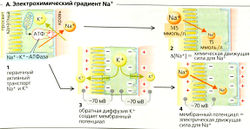
Механизмы реабсорбции Na+. Na+-К+-АТФаза откачивает ионы Na+ из клетки, при этом проводя ионы К+ в клетку (А); таким образом создается химический градиент Na+ (А4). Обратная диффузия К+ (АЗ) ведет к формированию мембранного потенциала (А4). Суммарный результат -высокий электрохимический градиент Na+, который обеспечивает движущую силу для пассивного входа Na+ и имеет свои особенности в разных сегментах нефрона (Б).
- В проксимальных канальцах ионы Na+ пассивно диффундируют из просвета канальцев внутрь клеток посредством: (а) электронейтрального Na+/Н+-обменника 3-го типа (NHE3), переносчика - Na+/H+-антипорта для электронейтрального обмена Na+ на Н+ (Б1); (б) различных переносчиков Na+-симпорта для реабсорбции D-глюкозы и т. д. (Б1). Поскольку большинство этих переносчиков сим-порта электрогенны, клеточная мембрана просвета канальцев поляризована и на ней образуется ранний проксимальный люмен-отрицательный трансэпителиальный потенциал (ЛОТП).
- В толстом сегменте восходящего колена (ТСВК) петли Генле (Б6) Na+ реабсорбируется при помощи буметанидчувствительного котранспортера BSC, Na+-K+ -2СГ-симпортера. Хотя BSC преимущественно электронейтрален, абсорбированный К+ рециркулирует назад в просвет канальца через К+-канал. Это гиперполяризует мембрану просвета канальца, что приводит к образованию на ней люмен-положительного трансэпителиального потенциала (ЛПТП).
- В дистальном извитом канальце (ДИК) (Б8) Na+ реабсорбируется при помощи триазидчувствительного котранспортера TSC, электронейтрального Ма+-Cl--симпортера.
- В главных клетках соединительных канальцев и собирательной трубочки (Б9) Na+ выходит из просвета через Na+-каналы, активируемые альдостероном и антидиуретическим гормоном (АДГ) и ингибируемые простагландином и атриопептином.
Поскольку эти четыре стадии пассивного транспорта Na+ в люминальной мембране последовательно соединены с активным транспортом Na+ в базолатеральной мембране (Na+-К+-АТФаза), связанная с этим трансэпителиальная реабсорбция Na+ также происходит активно. Она составляет около 1/з от общей реабсорбции Na+ в проксимальных канальцах, и на 3 абсорбированных иона Na+ потребляется 1 молекула АТФ. Остальные 2/3 от общей реабсорбции Na+ обусловлены пассивным и парацеллюлярным транспортом.
За этот процесс отвечают две движущие силы: (1) ЛПТП в средней и дальней части проксимальных канальцев (Б5) и петле Генле (Б7) проводит Na+ и другие катионы на эпителий со стороны кровотока; (2) захват растворителем: когда реабсорбируется вода, то растворенные вещества «захватываются» благодаря силе трения (как кусок древесины дрейфует вместе с потоком воды). Поскольку движущие силы (1) и (2) - непрямые результаты активности Na+-К+-АТФазы, энергетический баланс возрастает примерно до 9 ионов Na+ на 1 молекулу АТФ в проксимальных канальцах (и до 5 Na+ на молекулу АТФ в остальных отделах почек).
На базолатеральной стороне ионы Na+ покидают клетку проксимального канальца при помощи Na+-К+-АТФазы и переносчика, осуществляющего симпорт Na+—ЗHCO3. В последнем случае Na+ покидает клетку за счет третичного активного транспорта, тогда как вторичная активная секреция Н+ (на противоположной стороне клетки) приводит к внутриклеточной аккумуляции ионов HCO3.
Фракция экскреции CI (ФЗСl) колеблется от 0,5 до 5%. Примерно 50% всей реабсорбции Сl~ происходит в проксимальных канальцах. Ранний проксимальный ЛВТП проводит Cl через парацеллюляр-ные пространства из просвета канальца (БЗ). Реабсорбция Cl- отстает по сравнению с реабсорбцией Na+ и Н2О, и концентрация Cl- в просвете возрастает. В результате Cl начинает диффундировать парацеллюлярно по своему химическому градиенту вдоль средней и дальней части проксимального канальца (Б4), таким образом создавая ЛПТП (обращение потенциала, Б5). В тонком сегменте нисходящего колена (ТСНК) и дистальном извитом канальце (ДИК) Cl- входит в клетку путем вторичного активного транспорта и выходит пассивно через активируемые АДГ базолатеральные Cl--каналы (Б6, 8).
Механизм концентрирования мочи
Клубочковый фильтр пропускает около 180 л жидкости (плазмы) ежедневно (СКФ). По сравнению с этим количеством выход мочи в норме (VU) относительно мал (от 0,5 до 2 л/сут). Отклонения от нормы называются антидиурезом (низкая скорость VU) или диурезом (высокая скорость VU). Выход мочи выше уровня нормы называется полиурией, а ниже уровня нормы - олигоурией (< 0,5 л/сут) или анурией (< 0,1 л/сут). Осмоляльность плазмы и клубочкового фильтрата составляет около 290 мОсм/кг HgO (= Posm)', а осмоляльность вторичной мочи Wosm) колеблется от 50 (гипотоническая моча при увеличенном водном диурезе) до 1200 мОсм/кг НдО (гипертоническая моча с максимальной концентрацией). При водном диурезе происходит экскреция больших объемов воды без одновременной потери NaCI и других растворенных веществ, поэтому эта патология известна как «экскреция свободной воды» или «свободный водный клиренс» (СН2O). Это позволяет почке, например, нормализовать снижение осмоляльности плазмы. СН2O - объем воды, который теоретически может быть экстрагирован, чтобы моча достигла той же осмоляльности, что и плазма:
СН2O = VU(1 - Uosm/Posm). [7.11]
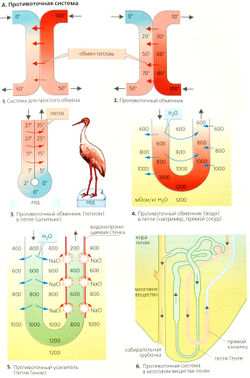
Системы противотока
Простой теплообменик (А1) состоит из двух трубок, в которых текут параллельные (в одном направлении) потоки воды, один холодный (О °С), а другой - горячий (100 °С). Благодаря теплообмену выходящая из обеих трубок вода будет иметь температуру около 50 °С, т. е. компенсируется начальный большой температурный градиент в 100 °С.
В противоточиом теплообменнике (А2) жидкость в трубках течет в противоположных направлениях. Поскольку градиент температуры присутствует вдоль всей длины трубок, теплообмен происходит также по всей длине трубок. В обмене могут участвовать также молекулы растворенных веществ, если стенки трубок проницаемы для них и если для данного вещества существует градиент концентрации.
Если теплообмен происходит в противоточной системе в трубке в виде петли (шпильки), перегиб которой находится в контакте со средой, а температура этой среды отличается от температуры внутри трубки теплообменника (лед, АЗ), жидкость, выходящая из трубки, скоро будет немного холоднее, чем входящая в трубку, поскольку тепло всегда передается от более теплого колена петли к более холодному.
Противоточный обмен воды в прямом сосуде в мозговом веществе почек (А6) происходит в том случае, если гипертоничность мозгового 170 вещества увеличивается по отношению к сосочкам (см. ниже) и если прямой сосуд проницаем для воды. Часть воды диффундирует путем осмоса из нисходящего прямого сосуда к восходящему, таким образом обходя внутренний слой мозгового вещества (А4). Вблизи почечных сосочков концентрация всех компонентов крови возрастает благодаря экстракции воды. Осмоляльность плазмы в прямом канальце при этом непрерывно изменяется, стремясь к осмоляльности интерстиция, осмоляльность которого увеличивается по направлению к сосочкам. Ге-матокрит в прямом сосуде также возрастает. И наоборот, вещества, переходящие в кровь в мозговом веществе почек, диффундируют из восходящего прямого сосуда в нисходящий участок при условии, что стенки обоих сосудов проницаемы для них (например, для мочевины: В). Противоточный обмен в прямом сосуде обеспечивает необходимый приток крови к мозговому веществу почек, не изменяя в значительной степени высокой осмоляльности мозгового вещества и не ухудшая концентрационной емкости почек.
В противоточном усилителе, таком как петля Генле, градиент концентрации между двумя коленами поддерживается с затратой энергии (А5). Противоток усиливает относительно небольшой градиент во всех точках между коленами (локальный градиент —200 мОсм/кг НдО) до достаточно высокого градиента вдоль колена петли (—1000 мОсм/кг Н2О). Чем длиннее петля и чем выше градиент в одном колене, тем больше усиление градиента. Кроме того, он обратно пропорционален квадрату скорости потока в петле.
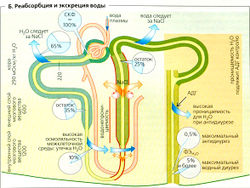
Реабсорбция воды
Примерно 65% СКФ обусловлено реабсорбцией в проксимальных извитых канальцах (ПИК) (Б). Движущая сила этого процесса - реабсорбция растворенных веществ, особенно Na+ и Cl- Это немного разбавляет мочу в канальце, но Н2О немедленно следует по этому осмотическому градиенту, поскольку ПИК «протекают». Реабсорбция воды происходит парацеллюлярно (через протекающие плотные контакты) или трансцеллюлярно, т. е. через водные каналы (аквапорины типа 1 = AQP1) в двух клеточных мембранах. Моча в ПИК, таким образом, остается практически изотонической. Онкотическое давление в перитубулярных капиллярах обеспечивает дополнительную движущую силу для реабсорбции воды. Чем больше воды фильтруется в клубочках, тем выше онкотическое давление. Таким образом, реабсорбция воды в проксимальных канальцах до определенной степени выравнивается в соответствии с клубочково-канальцевый равновесием (ККР).
Поскольку нисходящее колено петли Генле содержит аквапорины CAQP1), которые делают его проницаемым для воды, моча в нем в основном находится в осмотическом балансе с гипертоническим межклеточным пространством, которое становится все более гипертоническим при приближении к сосочкам (А5). Моча, таким образом, при продвижении в этом направлении становится все более концентрированной. В тонком сегменте нисходящего колена, которое мало проницаемо для солей, это приводит к увеличению концентрации Na+ и Cl-. Большая часть воды из межклеточного пространства удаляется по прямому канальцу (Б). Поскольку тонкий и толстый сегменты восходящего колена петли Генле почти непроницаемы для воды, Na+ и Cl- диффундируютпассивно (тонкий сегмент), но транспортируются активно (толстый сегмент) наружу, в межклеточную жидкость (Б). Вода не может быть удалена, и поэтому моча, выходящая из петли Генле, гипотонична.
Активная реабсорбция Na+ и Cl- из тонкого сегмента восходящего колена петли Генле (ТСВК) создает локальный градиент (примерно 200 мОсм/кг H2O; А5) во всех точках между ТСВК нисходящей петли с одной стороны и внеклеточной жидкостью мозгового вещества почек - с другой. Поскольку высокая осмоляльность внеклеточной жидкости мозгового вещества почек является причиной, по которой вода экстрагируется из собирательной трубочки (см. ниже), активный транспорт NaCI является АТФ-зависимым «мотором» почечного механизма, концентрирующего мочу, и регулируется постоянной стимуляцией секреции АДГ.
По ходу дистальных извитых канальцев и в конце собирательной трубочки, где есть аквапорины и рецепторы АДГ типа V2 (см. ниже), жидкость в канальцах снова становится изотонической (в осмотическом равновесии с изотонической внеклеточной жидкостью коры почек), если присутствует АДГ, т. е. при антидиурезе. Хотя Na+ и Cl- здесь все еще реабсорбируются, осмоляльность значительно не меняется, так как вода реабсорбируется (примерно 5% от СКФ) во внеклеточную жидкость под действием осмотического давления и осмоляльность канальцевой жидкости все больше определяет мочевина.
Конечная корректировка объема выводящейся мочи происходит в собирательной трубочке. В присутствии антидиуретического гормона (АДГ) (который связывается с базолатеральными Уд-рецепторами, названными так по названию гормона, АДГ = вазопрессин), аквапорины (AQP2) люминальной мембраны главных клеток (в отсутствие аквапоринов водонепроницаемой) экстрагируют воду из мочи, проходящей через все более гипертоническое мозговое вещество почек. Таким образом, Uosm возрастает и становится примерно в 4 раза выше, чем Posm Uosm/Posm = 4), что соответствует максимальному антидиурезу. Отсутствие АДГ приводит к водному диурезу, когда Uosm/Posm может упасть вплоть до < 0,3. К концу ТСВК Uosm может упасть даже ниже осмоляльности, поскольку реабсорбция Na+ и Cl- продолжается в дистальном извитом канальце и собирательной трубочке, но вода вряд ли может за ними следовать.
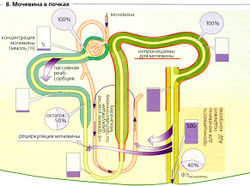
Мочевина также играет важную роль в формировании концентрированной мочи. Богатая белком диета приводит к увеличению образования мочевины, что увеличивает способность почек концентрировать мочу. Примерно 50% фильтрованной мочи покидает проксимальные канальцы путем диффузии (В). Поскольку нисходящее колено петли Генле, дистальный извитой каналец, а также кортикальный и внешний мозговой участки собирательной трубочки лишь незначительно проницаемы для мочи, ее концентрация увеличивается ниже этих частей нефрона ( В). АДГ может (при помощи Уд-рецепторов) вводить переносчики мочевины (транспортер мочевины 1-го типа, UT1) в люминальную мембрану, таким образом делая собирательную трубочку во внутреннем слое мозгового вещества проницаемой для мочевины. Мочевина теперь диффундирует назад в межклеточное пространство (при высокой осмоляльности половина приходится на мочевину) с помощью UT1 и затем с помощью UT2 транспортируется назад в нисходящее колено петли Генле, завершая рециркуляцию мочевины (В). Нереабсорбируемая фракция мочевины экскретируется: ФЭмочевины = 40%. Экскреция мочевины увеличивается при водном диурезе и снижается при антидиурезе, вероятно, по причине активации переносчика UT2.
Нарушения процесса концентрирования мочи в основном происходят (а) из-за очень высокого кровотока в мозговом веществе почек (вымывание Na+, Cl- и мочевины); (б) при приеме осмотических диуретиков; (в) при приеме петлевых диуретиков; (г) дефиците секреции или неэффективности АДГ, как при центральном или нефрогенном несахарном диабете соответственно.
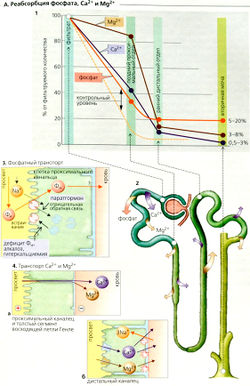
Реабсорбция и экскреция фосфата, Са2+ и Мg2+
Метаболизм фосфатов
Концентрация фосфатов в плазме обычно находится в диапазоне 0,8-1,4 ммоль/л. Каждый день фильтруется соответствующее количество неорганического фосфата Фн (НР042-⇆ Н2PO4-) (примерно 150-250 ммоль/суг), и большая его часть реабсорбируется. Фракция экскреции (А1), которая колеблется между 5 и 20%, необходима для поддержания баланса Фн, Н + и Са2+. Экскреция Фн возрастает при избытке Фн (повышенный уровень Фн в плазме) и падает при дефиците Фн. К фосфатурии и увеличению экскреции Н+ также приводит ацидоз (титруемая кислотность). Это происходит и при фосфатурии от других причин. Гипокальциемия и паратиреоидный гормон (паратгормон) тоже индуцируют увеличение экскреции Фн (АЗ).
Фн реабсорбируется в проксимальных канальцах (А2, 3). Мембрана их просвета содержит 3-й тип 3Na+-Фн-симпортера (NaPi-З). Этот переносчик связывает ионы НР042- и Н2РО4 и котранспортирует их путем вторичного активного транспорта.
Регуляция реабсорбции Фн
Дефицит Фн, алкалоз, гиперкальциемия и низкий уровень паратгормона приводят к усиленному включению транспортера NaPi-З в мембрану просвета, тогда как избыток Фн, ацидоз, гипокальциемия и увеличенная секреция паратгормона приводят (по отрицательной обратной связи) к интернализации и последующему расщеплению NaPi-З в лизосомах (АЗ).
Метаболизм кальция
В отличие от метаболизма Na+ метаболизм кальция регулируется в основном путем абсорбции Са2+ в желудке и, во вторую очередь, путем почечной экскреции. Общий кальций плазмы (связанный кальций + ионизованный кальций) в среднем составляет 2,5 ммоль/л. Примерно 1,3 ммоль/л кальция присутствует как свободный, ионизованный Са?+, 0,2 ммоль/л образует комплексы с фосфатом, цитратом и т. д., а остальные 1 ммоль/л связаны с белками плазмы и, следовательно, не подлежат клубочковой фильтрации. Фракция экскреции Са2+ (ФЭСа в моче - 0,5-3% (А1).
Реабсорбция Са2+ происходит почти по всему нефрону (А1, 2). Реабсорбция фильтрованного Са2+ примерно на 60% происходит в проксимальных канальцах, на 30% - в толстом сегменте восходящего колена (ТСВК) петли Генле, и является парацеллюлярной, т. е. пассивной (А4а). В основном движущая сила для этого вида активности обеспечивается люмен-положительным трансэпителиальным потенциалом (ЛПТП). Поскольку реабсорбция Са2+ в ТСВК зависит от реабсорбции NaCI, петлевые диуретики ингибируют реабсорбцию Са2+. Всасывание Са2+ в ТСВК обеспечивает паратгормон, так же как и в дистальных извитых канальцах, где Са2+ реабсорбируется при помощи трансцеллюлярного активного транспорта (А4б). Таким образом, приток Са2+ в клетку является пассивным процессом и происходит при помощи Са2*-каналов просвета, а отток Са2+ - активный процесс и осуществляется посредством Са2+-АТФазы (первичный активный транспорт Са2+) и 3Na+-1Са2+-антипорта (вторичный активный транспорт Са2+). Ацидоз ингибирует реабсорбцию Са2+ неизвестными пока механизмами.
Мочевые камни обычно состоят из фосфата кальция или оксалата кальция. Когда увеличиваются концентрации Са2+, Фн или оксалата, может достигаться произведение растворимости фосфорных и оксалатных солей кальция; обычно же лиганды, образующие с кальцием комплексы (например, цитрат), и ингибиторы кристаллизации (например, нефрокальцин) допускают некоторую степень пересыщения. Образование камней может произойти при дефиците этих веществ, или если в моче присутствует очень высокая концентрация Са2+. Фн или оксалата (применимо ко всем трем при ярко выраженном антидиурезе).
Метаболизм магния и реабсорбция
Поскольку часть магния в плазме связана с белками (0,7-1,2 ммоль/л), концентрация магния в фильтрате составляет только 80% его концентрации в плазме. Фракция экскреции Мg2+ (ФЭмд) составляет 3-8% (А1,2). Однако в отличие от Са2+, только 15% фильтрованных ионов Мg2+ покидают проксимальные канальцы. Около 70% Мg2+ подлежит парацеллюлярной реабсорбции в ТСВК (А4). Другие 10% Мg2+ всасываются трансцеллюлярно в дистальных канальцах (А4б), вероятнее всего как Са2+ (см. ранее).
Экскреция Мдг+ стимулируется гипермагнезиемией, гиперкальциемией, гиперволемией и петлевыми диуретиками, а ингибируется дефицитом Мg2+. Дефицит Са2+, дефицит объема, а также паратгормон и другие гормоны в основном оказывают влияние в ТСВК.
Почки содержат рецепторы для двухвалентных катионов, таких как Са2+ и Мg2+. При активации рецепторы в ТСВК ингибируют реабсорбцию NaCI, который, как и петлевые диуретики, уменьшает движущую силу парацеллюлярной резорбции катионов, таким образом уменьшая в норме активное всасывание Мg2+.
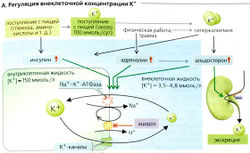
Баланс калия
Потребление К+ с пищей составляет примерно 100 ммоль/сут (минимальное потребление 25 ммоль/сут). Примерно 90% К+ выводится с мочой и 10% - с фекалиями. Концентрация К+ в плазме крови в норме колеблется от 3,5 до 4,8 ммоль/л, тогда как внутриклеточная концентрация К+ может быть более чем в 30 раз выше (из-за активности Na+-К+-АТФазы; А). Таким образом, около 98% из 3000 ммоль ионов К+ в организме присутствует в клетке. Хотя внеклеточная концентрация К+ составляет только 2% от общего К+ организма, она тем не менее очень важна, потому что (а) необходима для регуляции гомеостаза К+ и (б) относительно небольшие изменения в клеточном К+ (приток или отток) могут вести к значительным изменениям в концентрации К+ в плазме (и связанному с этим риску сердечной аритмии). Регуляция гомеостаза К+, следовательно, подразумевает распределение К+ во внутриклеточных и внеклеточных компартментах и баланс выведения К+ и его потребления.
Срочная регуляция внеклеточной концентрации К+ достигается путем внутреннего смещения концентрации К+ между внеклеточной и внутриклеточной жидкостью (А). Этот относительно быстрый процесс предотвращает или смягчает опасные повышения внеклеточного К+ (гиперкалиемия) в тех случаях, когда присутствуют большие количества К+ из-за его потребления с пищей или внутриклеточного высвобождения К+ (например, при внезапном гемолизе). Данные сдвиги в концентрации К+ в основном подлежат гормональной регуляции. Инсулин, который выделяется после еды, стимулирует Na+-К+-АТФазу и распределяет К+, поступивший с растительной или животной пищей, по клеткам тела. Данный тип регуляции используется также при гиперкалиемии, не связанной с питанием: сама по себе гиперкалиемия вызывает секрецию инсулина. Адреналин подобным же образом увеличивает потребление К+ клетками, которые задействованы при мышечной работе и при травме - двух причинах, ведущих к увеличению К+ в плазме крови. В обоих случаях повышенный уровень адреналина способствует поглощению К+ в этих и других клетках. Увеличение внутриклеточной концентрации К+ вызывает также альдостерон (см. далее).
Изменения pH тоже влияют на внутриклеточное и внеклеточное распространение К+ (А). Это происходит в основном по той причине, что широко распространенный Na+-К+-антипортер работает быстрее при алкалозе, чем при ацидозе (А). Следовательно, при ацидозе вход Na+ уменьшается, работа Na+-К+-АТФазы замедляется и внеклеточная концентрация К+ возрастает (особенно при нереспираторном ацидозе; на 0,6 ммоль/л на 0,1 единицы изменения pH). Алкалоз приводит к гипокалиемии.
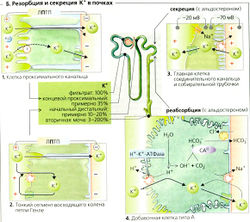
Постоянная регуляция гомеостаза К+ в основном осуществляется почками (Б). К+ подлежит свободной клубочковой фильтрации, и большая часть фильтруемого К+ обычно реабсорбируется [общая реабсорбция). Экскретируемое количество в некоторых случаях может превышать фильтруемое (общая секреция, см. далее). Около 65% фильтрованного К+ обычно реабсорбируется ранее конца проксимальных канальцев, независимо от запасов К+. Это сравнимо с процентом реабсорбции Na+ и Н2О (Б1). Ионы К+ транспортируются в основном парацеллюлярно, т. е. пассивно. Движущими силами этого процесса являются захват растворенного вещества и положительный на люминальной стороне трансэпителиальный потенциал, ЛПТП (Б1) в среднем и конечном сегментах проксимальных канальцев. В петле Генле еще 15% фильтрованного К+ реабсорбируется парацеллюлярно и параэпителиально (Б2). В соединительных канальцах и собирательной трубочке можно определить количество экскретируемого К+. Затем, в зависимости от потребностей, большие или меньшие количества К+ или реабсорбируются, или секретируются. В экстремальных случаях в ответ на высокий уровень поглощения К+ фракционная экскреция К+ (ФЭk) может возрастать более чем на 100% или при дефиците К+ падать примерно на 3-5% (Б).
Клеточные механизмы почечного транспорта К+. Соединительные канальцы и собирательная трубочка содержат главные клетки (БЗ), которые реабсорбируют Na+ и секретируют К+. Аккумулированный внутриклеточный К+ может выходить из клеток через К+ -каналы с любой стороны клетки. Решающее значение для оттока К+ через мембрану имеет электрохимический градиент. Мембрана просвета главных клеток также содержит Na+-каналы, через которые Na+ входит в клетку. Это деполяризует мембрану просвета, потенциал на которой достигает примерно -20 мВ, в то время как базолатеральная мембрана поддерживает свой нормальный потенциал величиной примерно -70 мВ (БЗ). Движущая сила оттока К+ (Em - Ek), следовательно, выше на стороне просвета. Таким образом, К+ покидает клетку предпочтительно в направлении просвета [секреция). Это является основной причиной того, что секреция К+ сопряжена с всасыванием Na+, т. е. чем больше Na+ реабсорбируется главными клетками, тем больше секретируется К+.
Другая видимая причина заключается в том, что связанное с всасыванием увеличение внутриклеточной концентрации Na+ снижает движущую силу обмена 3Na+/Са2+ на базолатеральной мембране, что приводит к увеличению концентрации Са2+ в цитозоле. Это повышение действует как сигнал для более частого открывания К+-каналов просвета.
Добавочные клетки типа А (Б4) в дополнение к секреции ионов Н+ могут активно реабсорбировать К+. Для этой цели люминальная мембрана этих клеток, как и у париетальных (обкладочных) клеток желудка, содержит Н+/К+-АТФазу.
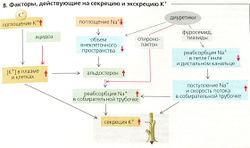
Факторы, влияющие на экскрецию К+ (В):
- Увеличенное потребление К+ повышает внутриклеточную концентрацию К+ и его концентрацию в плазме крови, что, в свою очередь, увеличивает химическую движущую силу для секреции К+.
- pH крови: внутриклеточная концентрация К+ в клетках почек увеличивается при алкалозе и падает при остром ацидозе. Это ведет к одновременному падению экскреции К+, которая опять возрастает при хроническом ацидозе. Причинами этого является то, что (а) ацидоз-зависимое ингибирование Na+-К+-АТФазы уменьшает проксимальную реабсорбцию Na+, что приводит к увеличенному дистальному оттоку мочи, и (б) результирующая гиперкалиемия стимулирует секрецию альдостерона (см. п. 4).
- Если существует увеличенный отток мочи в соединительных канальцах и собирательной трубочке (например, по причине большой реабсорбции Na+, осмотического диуреза или других факторов, ингибирующих реабсорбцию Na+), то будут экскретироваться большие количества К+. Этим объясняется эффект потери калия при употреблении некоторых диуретиков. Причиной данного эффекта, возможно, является ограничение секреции К+ при определенной концентрации этого иона в просвете. Следовательно, чем больше сотношение объем/время, тем больше К+ удаляется со временем.
- Альдостерон ведет к удержанию Na+, увеличению клеточного объема, умеренному усилению секреции Н+ (росту клеточного pH) и повышенной экскреции К+. Это также увеличивает количество молекул 1Na+-К+-АТФазы в клетках-мишенях и ведет к хроническому увеличению плотности митохондрий при адаптации к повышенному содержанию К+ (см. далее).
Клеточные механизмы эффектов альдостерона. Усиленное обратное всасывание достигается путем увеличения синтеза транспортных белков, называемых альдостерОН-ин-дуцируемыми белками. Этот генетически обусловленный эффект начинается примерно через 30-60 мин после введения или секреции альдостерона. Максимальный эффект наступает через несколько часов. Альдостерон увеличивает реабсорбцию Na+, деполяризуя мембрану просвета (БЗ). Вслед за этим он увеличивает движущую силу секреции К+ и проводимость К+ путем увеличения pH клетки. Оба эти эффекта ведут к увеличению выведения К+. Кроме того, альдостерон имеет очень быстрый (от нескольких секунд до нескольких минут] не связанный с генетикой эффект на клеточную мембрану, физиологическая значимость которого еще должна быть исследована.
Емкость К+-выводящего механизма возрастает в ответ на длительное увеличение притока К+ (К+-адаптация) Даже когда работа почек нарушена, этот механизм в основном способен поддерживать баланс К+ в оставшихся интактных частях канальцевого аппарата. Взять на себя выведение более чем 1/3 общего количества К+ может также прямая кишка.
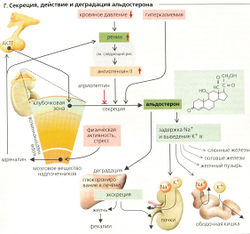
Минералокортико(стеро)иды. Альдостерон - зто наиболее распространенный минералокортикоидный гормон, синтезирующийся и секретирующийся в гломерулярной (клубочковой) зоне коры надпочечников (Г). Как и другие стероидные гормоны, альдостерон не хранится, а образуется при необходимости. Основная функция альдостерона состоит в регуляции транспорта Na+ и К+ в почках, желудке и других органах (Г). Секреция альдостерона возрастает в ответ на (а) падение объема крови и кровяного давления (опосредованное ангиотензином II) и (б) гиперкалиемию (Г). Синтез альдостерона ингибируется атриопептином.
Нормальная концентрация кортизола не влияет на рецепторы альдостерона только потому, что кортизол превращается в кортизон 11 бета-гидроксистероид-оксидоредуктазой в клетках-мишенях альдостерона.
Гиперальдостеронизм может быть либо первичным (секретирующие альдостерон опухоли в коре надпочечников, что наблюдается при синдроме Конна), либо вторичным (при уменьшении объема жидкости). Удержание Na+ приводит к большому объему внеклеточного пространства и повышенному кровяному давлению с одновременными потерями К+ и, как следствие, гипокалиемическому алкалозу. Когда более чем 90% коры надпочечников разрушено, например, по причине аутоиммунного воспаления надпочечников, метастазирующего рака или туберкулеза, развивается первичная хроническая недостаточность коры надпочечников (болезнь Аддисона). Дефицит альдостерона ведет к резкому увеличению экскреции Na+, что приводит к гиповолемии, гипотензии и удерживанию К+ (гиперкалиемии). Когда одновременно развивается также дефицит глюкокортикоидов, осложнения могут быть опасны для жизни, особенно при серьезных инфекциях и травмах. Если разрушена только одна железа, АКТГ вызывает гипертрофию другой.