Прочие противотуберкулезные препараты
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Этионамид[править | править код]
Химические свойства[править | править код]
Этионамид (тиоамид а-этилизоникотиновой кислоты) был открыт в ходе синтеза и изучения производных никотинамида. По антимикробной активности этионамид намного превосходит своего предшественника. Структурная формула этионамида следующая:
Антимикробная активность[править | править код]
МПК этионамида для Mycobacterium tuberculosis составляет 0,6—2,5 мкг/мл. In vitro к нему быстро развивается устойчивость. В концентрации не более 10 мкг/мл этионамид подавляет рост 75% штаммов фотохромогенных микобактерий; скотохромогенные микобактерии более устойчивы к нему. Этионамид чрезвычайно эффективен при туберкулёзе у экспериментальных животных, хотя данные, полученные в разных экспериментах, сильно колеблются.
Фармакокинетика[править | править код]
Через 3 ч после приёма в дозе 1 г сывороточная концентрация этионамида достигает максимума (около 20 мкг/мл), а через 9 ч снижается до 3 мкг/мл. Т|/2 составляет примерно 2 ч. При приёме в разовой дозе более 500 мг около половины больных плохо переносят препарат из-за желудочно-кишечных нарушений. Этионамид быстро и равномерно распределяется по всему организму, хорошо проникая во все ткани и биологические жидкости, в том числе в СМЖ. Его концентрация в тканях почти равна сывороточной. Подобно аминосалициловой кислоте, этионамид ингибирует ацетилирование изониазида in vitro. Этионамид выводится почками, в основном в виде метаболитов (доля неизменённого препарата составляет менее 1%).
Применение[править | править код]
Этионамид относится к препаратам второго ряда. Его применяют в сочетании с другими противотуберкулёзными средствами в тех случаях, когда препараты первого ряда неэффективны или противопоказаны.
Этионамид назначают только внутрь. Начальная доза — 250 мг 2 раза в сутки. Каждые 5 сут её увеличивают на 125 мг/сут до тех пор, пока суточная доза не достигнет 15—20 мг/кг/сут (но не более 1 г/сут). Препарат желательно назначать в несколько приёмов во время еды, чтобы свести к минимуму раздражающее действие на желудок. Доза у детей составляет 15—20 мг/кг/сут (но не более 1 г/сут) в 2 приёма.
Побочные эффекты[править | править код]
Чаще всего наблюдаются снижение аппетита, тошнота, рвота; иногда во рту появляется металлический вкус. Возможны тяжёлая ортостатическая гипотония, депрессия, сонливость, астения. К редким побочным эффектам относятся эпилептические припадки и нейропатия. Из других неврологических расстройств отмечались нарушения обоняния, нечёткость зрения, диплопия, головокружение, парестезия, головная боль, беспокойство, тремор. Встречаются также тяжёлые кожные аллергические реакции, геморрагическая сыпь, стоматит, гинекомастия, импотенция, меноррагия, угри, алопеция. В 5% случаев развивается гепатит (Simon et al., 1969), поэтому у всех больных необходимо регулярно оценивать функцию печени. После отмены препарата гепатит исчезает. Одновременно с этионамидом рекомендуется назначать пиридоксин.
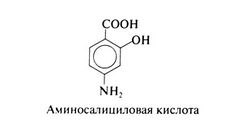
Аминосалициловая кислота[править | править код]
Химические свойства[править | править код]
Структурная формула аминосалициловой кислоты (n-аминосалициловой кислоты) следующая:
Антимикробная активность[править | править код]
Аминосалициловая кислота обладает бактериостатическим действием, высокоспецифичным в отношении Mycobacterium tuberculosis (МПК для большинства штаммов составляет 1 мкг/мл). На другие микроорганизмы, включая большинство атипичных микобактерий, этот препарат не действует.
Аминосалициловая кислота эффективна при туберкулёзе у экспериментальных животных, но только при условии непрерывного лечения довольно высокими дозами. Роль аминосалициловой кислоты в противотуберкулеёзной терапии у человека невелика.
Устойчивость[править | править код]
In vitro получены штаммы Mycobacterium tuberculosis, устойчивые к очень высоким концентрациям аминосалициловой кислоты, превышающим МПК в несколько сотен раз. Устойчивость может развиться и в ходе лечения, но гораздо медленнее, чем при лечении стрептомицином.
Механизм действия[править | править код]
Будучи, как и сульфаниламиды (гл. 44) структурным аналогом парааминобензойной кислоты, аминосалициловая кислота, по-видимому, сходна с ними по механизму действия. Поскольку сульфаниламиды не действуют на микобактерии туберкулёза, а аминосалициловая кислота не активна в отношении чувствительных к сульфаниламидам бактерий, можно предположить, что у разных микроорганизмов ферменты участвующие в синтезе фолиевой кислоты, различаются по своему сродству к разным аналогам парааминобензойной кислоты. Фармакокинетика. Аминосалициловая кислота быстро всасывается в ЖКТ. После приёма внутрь в дозе 4 г максимальная сывороточная концентрация препарата достигается через 1,5—2 ч и составляет 75 мкг/мл. Натриевая соль всасывается ещё быстрее. Аминосалициловая кислота распределяется по всему организму и накапливается в высоких концентрациях в плевральном выпоте и очагах казеозного некроза. Содержание препарата в СМЖ низкое, возможно, за счёт выведения путём активного транспорта.
Т1/2 равен 1 ч, поэтому уже через 4—5 ч после однократного приёма аминосалициловая кислота в крови почти не определяется. Более 80% принятой дозы выводится с мочой, свыше 50% — в виде ацетилированного производного (остальное приходится в основном на неизменённую аминосалициловую кислоту). При почечной недостаточности препарат не назначают, так как его выведение у таких больных сильно замедлено. Пробенецид снижает почечную экскрецию аминосалициловой кислоты.
Применение[править | править код]
С появлением более эффективных и безопасных препаратов (таких, как рифампицин и этамбутол) показания к применению аминосалициловой кислоты сильно сократились. В настоящее время её используют как препарат второго ряда (см. ниже).
Аминосалициловую кислоту назначают внутрь в дозе 10—12 г/сут в 2—4 приёма. Из-за раздражающего действия на желудок желательно принимать её после еды. Детям назначают 150— 300 мг/кг/сут в 3—4 приёма.
Побочные эффекты[править | править код]
Эти эффекты возникают у 10—30% больных. В основном это желудочно-кишечные нарушения — снижение аппетита, тошнота, боль в эпигастрии, неприятные ощущения в животе, понос. Из-за них больные часто не соблюдают предписаний врача. Особенно плохо переносится препарат при язвенной болезни. Аллергические реакции встречаются в 5-10% случаев. Возможна лихорадка: внезапная, высокая, с периодическим повышением и снижением температуры или нарастающая постепенно, умеренная. Одновременно могут наблюдаться недомогание, артралгия, боль в горле, сыпь (последняя иногда возникает и в отсутствие лихорадки). Встречаются гематологические нарушения — лейкопения, агранулоцитоз, эозинофилия, лимфоцитоз, тромбоцитопения, атипичные моно-нуклеары. В некоторых случаях развивается острая гемолитическая анемия.
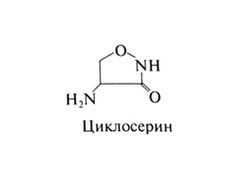
Циклосерин[править | править код]
Циклосерин — антибиотик широкого спектра действия, вырабатываемый Streptomyces orchidaceus. Впервые препарат был выделен в 1955 г. из пивной закваски, а затем синтезирован. Его используют в тех случаях, когда препараты первого ряда (изониазид, рифампицин, этамбутол, пиразинамид и стрептомицин) неэффективны. Циклосерин назначают в комбинации с другими противотуберкулёзными средствами при всех формах туберкулёза.
Химические свойства[править | править код]
Циклосерин представляет собой D-4-амино-3-изоксазолидон. Его структурная формула следующая:
Препарат устойчив в щелочных растворах, но быстро разрушается в нейтральной и кислой среде.
Антимикробная активность и механизм действия[править | править код]
In vitro циклосерин подавляет рост Mycobacterium tuberculosis в концентрации 5—20 мкг/мл. Перекрёстной устойчивости к циклосерину и другим противотуберкулёзным средствам не возникает. По данным экспериментальных исследований, циклосерин эффективен при многих инфекциях, однако in vitro при культивировании на обычных средах (содержащих D-аланин) он не проявляет антимикробной активности. Дело в том, что циклосерин — структурный аналог D-аланина — конкурентно ингибирует реакции синтеза клеточной стенки, в которых участвует D-аланин (гл. 45). В условиях избытка субстрата ингибирования не происходит. В отсутствие D-аланина циклосерин оказывает бакгериостатическое действие на энтерококки, Escherichia coli, Staphylococcus aureus, Nocardia spp. и Chlamydia spp.
Фармакокинетика[править | править код]
При приёме внутрь циклосерин всасывается быстро и почти полностью, на 70—90%. Максимальная сывороточная концентрация достигается через 3—4 ч; у детей после приёма препарата в дозе 20 мг/кг она составляет 20—35 мкг/мл. Через 12 ч после однократного приёма сывороточная концентрация циклосерина очень низкая. Циклосерин проникает во все ткани и биологические жидкости; его концентрация в СМЖ приближается к сывороточной даже в отсутствие менингита. Около 50% принятой дозы выводится с мочой в неизменённом виде в первые 12 ч; ещё 15% — в последующие 60 ч. Метаболизму подвергается лишь очень незначительное количество препарата. У больных с почечной недостаточностью циклосерин накапливается в токсических концентрациях. Препарат выводится при диализе.
Применение[править | править код]
Циклосерин назначают только при повторных курсах лечения или устойчивости возбудителя к другим противотуберкулёзным средствам. В качестве монотерапии препарат не используют. Доза у взрослых составляет 250—500 мг внутрь 2 раза в сутки.
Побочные эффекты[править | править код]
Чаще всего поражается ЦНС. Неврологические нарушения обычно возникают в течение первых 2 нед лечения и исчезают после отмены препарата. Наблюдаются сонливость, головная боль, тремор, дизартрия, головокружение, спутанность сознания, повышенная возбудимость, раздражительность, психозы (возможны суицидальные намерения), параноидные состояния, кататония, депрессия, судорожные подёргивания мышц, клонус стопы, гиперрефлексия, нарушения зрения, парезы, большие эпилептические припадки, абсансы. Риск эпилептических припадков возрастает при использовании высоких доз циклосерина, а также при одновременном употреблении алкоголя. Больным с эпилептическими припадками в анамнезе препарат противопоказан.
Прочие противотуберкулёзные средства[править | править код]
Лекарственные средства, рассматриваемые в данной статье, во многом похожи друг на друга. Все они относятся к препаратам второго ряда, которые назначают только в тех случаях, когда микобактерии туберкулёза устойчивы к препаратам первого ряда, или при инфекциях, вызванных атипичными микобактериями. Все обсуждаемые здесь препараты предназначены для парентерального введения, сходны по фармакокинетическим свойствам и побочным эффектам. Из-за нефро- и ототоксичности эти препараты нельзя сочетать ни друг с другом, ни со стрептомицином.
Канамицин — препарат из группы аминогликозидов. МПК канамицина для Mycobacterium tuberculosis не превышает 10 мкг/мл. Поданным, полученным на небольших группах больных туберкулёзом, канамицин в дозе 1 г/сут часто вызывает побочные эффекты, в том числе тяжёлые — блокаду нервно-мышечной передачи, угнетение дыхания, агранулоцитоз, анафилактические реакции, поражение почек.
Амикацин тоже представляет собой аминогликозид. Он чрезвычайно активен в отношении нескольких видов микобактерий и помимо туберкулёза используется при инфекциях, вызванных атипичными микобактериями (Brown and Wallace, 2000).
Капреомицин — циклический полипептидный антибиотик, вырабатываемый Streptomyces capreolus. Он состоит из четырёх активных компонентов — капреомицинов IA, IB, 1IA и ИВ. В клинике используют препарат, содержащий в основном капреомицины IA и 1В. При монотерапии капреомицином появляются устойчивые штаммы, которые проявляют перекрестную устойчивость к канамицину и неомицину. Капреомицин применяют только в составе комбинированной терапии туберкулёза лёгких при непереносимости других противотуберкулёзных средств или устойчивости к ним.
Капреомицин вводят в/м в дозе 15—20 мг/кг/сут (до' 1 г/сут) в течение 60—120 сут, а затем — по 1 г 2—3 раза в неделю.
Капреомицин может вызвать снижение слуха, шум в ушах, преходящую протеинурию, цилиндрурию, азотемию. Тяжёлая почечная недостаточность возникает редко. Характерна эозинофилия. Возможны также лейкоцитоз, лейкопения, сыпь и лихорадка. Инъекции могут быть болезненны.
Лечение и профилактика туберкулёза[править | править код]
Современные антимикобактериальные средства настолько облегчили лечение туберкулёза, что теперь в большинстве случаев оно проводится амбулаторно (диагностику и начальный этап лечения, как правило, осуществляют в больнице общего профиля). Длительный постельный режим не только не является обязательным условием выздоровления, но даже не ускоряет его. Чтобы следить за результатами лечения и контролировать соблюдение врачебных назначений, больных регулярно наблюдают. Обо всех случаях туберкулёза сообщают в местные органы здравоохранения. Лиц, контактировавших с больным, надо обследовать и при необходимости назначить им профилактическое лечение изониазидом.
В США в большинстве случаев нелеченного туберкулёза возбудитель чувствителен к изониазиду, рифампицину, этамбутолу и стрептомицину. Поскольку устойчивость часто развивается в ходе лечения, одновременно назначают не менее двух препаратов, к которым данный штамм чувствителен. И детям, и взрослым обычно проводят стандартный 6-месячный курс лечения: изониазид + рифампицин + пиразинамид в течение первых 2 мес, а затем изониазид + рифампицин в течение следующих 4 мес. Столь же эффективен 9-месячный курс лечения изониазидом и рифампицином (при условии, что возбудитель чувствителен к ним). В связи с распространением лекарственной устойчивости Центр по контролю заболеваемости рекомендует до определения чувствительности назначать комбинацию четырёх препаратов (изониазид + рифампицин + пиразинамид + этамбутол или стрептомицин). Приём препаратов под непосредственным наблюдением медицинских работников позволяет добиться соблюдения всех врачебных предписаний в 90% случаев (Chaulk and Kazandjian, 1998).
Особую трудность представляет лечение туберкулёза у больных, получающих антиретровирусные средства, так как рифамицины усиливают метаболизм ингибиторов протеазы ВИЧ и ненуклеозидных ингибиторов обратной транскриптазы. Из всех рифамицинов меньше всего влияет на метаболизм индинавира и нелфинавира рифабутин.
ВИЧ-инфицированным требуется более длительный курс противотуберкулёзной терапии, в течение 9—12 мес (Havlir and Barnes, 1999). На начальном этапе одновременно назначают не менее четырёх противотуберкулёзных средств (изониазид + рифампицин + пиразинамид + этамбутол или стрептомицин), а при подозрении на по-лирезистентный туберкулёз — комбинацию из пяти или шести препаратов (Lane et al., 1994; Gallant et al., 1994). Лечение продолжают не менее 6 мес после того, как результаты трёх посевов окажутся отрицательными, а если изониазид или рифампицин использовать нельзя — не менее 12 мес (общая длительность лечения при этом увеличивается до 18 мес). Медикаментозная профилактика туберкулёза (см. ниже) показана ВИЧ-инфицированным в следующих случаях: 1) положительная туберкулиновая проба (диаметр папулы > 5 мм), 2) положительная туберкулиновая проба в анамнезе (если профилактика не проводилась), 3) недавний тесный контакт с больным активным туберкулёзом (даже при отрицательной туберкулиновой пробе). От профилактического применения изониазида у ВИЧ-инфицированных с отрицательной туберкулиновой пробой и отрицательными кожными пробами с другими антигенами отказались, поскольку оно не снижает риск туберкулёза у этой категории больных (Gordin et al., 1997).
Лечение отдельных форм туберкулёза[править | править код]
При неосложнённом лёгочном туберкулёзе назначают изониазид (5 мг/кг/сут, максимум 300 мг/сут), рифампицин (10 мг/кг/сут, максимум 600 мг/сут) и пиразинамид (15—30 мг/кг/сут, максимум 2 г/сут) при условии, что возбудитель чувствителен к этим препаратам. Чтобы снизить риск побочных эффектов, одновременно с изониазидом взрослым обычно назначают пиридоксин, 15—50 мг/сут (Snider, 1980). В течение первых 2 мес принимают изониазид, рифампицин и пиразинамид, в течение следующих 4 мес — изониазид и рифампицин. Детям препараты назначают по той же схеме в следующих дозах: изониазид — 10 мг/кг/сут, максимум 300 мг/сут; рифампицин — 10—20 мг/кг/сут, максимум 600 мг/сут, пиразинамид — 15—30 мг/кг/сут, максимум 2 г/сут (Bass etal., 1994). К хирургическому вмешательству прибегают редко (Haas, 2000). Беременным назначают изониазид, рифампицин и этамбутол.
Иногда лечение начинают с комбинации 4 препаратов, чтобы возбудитель наверняка оказался чувствителен хотя бы к двум из них: 1) при заражении устойчивым штаммом микобактерий, 2) иммигрантам из стран Азии и Латинской Америки, особенно недавно прибывшим в США, 3) больным милиарным туберкулёзом и другими формами внелёгочного туберкулёза, 4) больным туберкулёзным менингитом, 5) больным с обширным поражением лёгких, 6) ВИЧ-инфицированным. В качестве четвёртого препарата используют этамбутол (15 мг/кг 1 раз в сутки) или стрептомицин (1 г 1 раз в сутки в течение 2 мес, затем 1 -2 раза в неделю). Некоторые врачи предпочитают назначать этамбутол в дозе 25 мг/кг/сут в течение первых 60 сут, а затем снижать дозу до 15 мг/кг/сут, особенно если больной ранее уже получал противотуберкулёзную терапию.
Если лечение подобрано грамотно, в подавляющем большинстве случаев лёгочного туберкулёза заметное улучшение наступает уже в первые 2 нед: уменьшаются лихорадка и кашель улучшается самочувствие, больной набирает вес. Положительная динамика наблюдается и при рентгенографии грудной клетки. Более чем у 90% больных результаты посева становятся отрицательными в течение 3—6 мес, в зависимости от тяжести заболевания. Если через 6 мес результаты посева всё ещё положительны, возбудитель, скорее всего, устойчив к применяемым противотуберкулёзным средствам и схему лечения нужно пересмотреть.
Неэффективность противотуберкулёзной терапии может быть обусловлена несколькими причинами. Во-первых, лечение туберкулёза длительное, поэтому больные не всегда соблюдают предписания врача и принимают препараты нерегулярно.
В результате возбудитель не только не уничтожается, но и приобретает устойчивость. Другими причинами могут быть монотерапия, неправильный подбор схемы лечения и первично-резистентный туберкулёз.
Устойчивость возбудителя к противотуберкулёзным средствам. Это одна из самых больших помех в лечении туберкулёза. Как правило, устойчивость возникает при несоблюдении больным схемы лечения. Для решения этой проблемы разработана система контролируемой амбулаторной терапии, когда 2—5 раз в неделю больной принимает противотуберкулёзные препараты под непосредственным наблюдением медицинского работника (Barnes and Barrows, 1993; Chaulk and Kazandjian, 1998).
При подозрении на резистентный туберкулёз (например, у больных, несколько раз проходивших курс лечения) до определения чувствительности возбудителя назначают 5—6 препаратов, 2—3 из которых прежде не использовались. Лечение может включать изониазид, рифампицин, этамбутол, стрептомицин, пиразинамид и этионамид и должно длиться не менее 24 мес. Некоторые врачи назначают изониазид даже в тех случаях, когда микобактерии устойчивы к нему (существует мнение, что таким образом удаётся остановить прогрессирование болезни). Другие предпочитают отменять изониазид, чтобы свести к минимуму риск побочных эффектов.
Профилактика туберкулёза[править | править код]
Существует несколько схем медикаментозной профилактики туберкулёза. Стандартная схема — приём изониазида в течение года — снижает риск активного туберкулёза на 75% (с 14,3 до 3,6%) в течение 5 лет. Шестимесячный курс профилактики изониазидом почти так же эффективен (риск снижается на 65%), но более безопасен — реже возникает токсический гепатит (IUAT, 1982). Доза у взрослых — 300 мг/сут, у детей — 10 мг/кг/сут (но не более 300 мг/сут). По данным одного исследования, у ВИЧ-инфицированных ежедневный приём рифампицина и пиразинамида в течение 2 мес не уступает по эффективности годичному приёму изониазида (Halsey et al., 1998).
Медикаментозная профилактика оправдана при высоком риске активного туберкулёза (Haas, 2000). Её проводят в следующих случаях: 1) лицам, контактировавшим с больным туберкулёзом, но не имеющим никаких признаков инфекции, 2) лицам, инфицированным Mycobacterium tuberculosis (с положительной туберкулиновой пробой), но не имеющим клинических и рентгенологических признаков инфекции, 3) больным с нелеченым туберкулёзом в анамнезе (Bass et al., 1994; Stead and To, 1987; Wilkinson et al., 1998; Gordin et al., 1997; Gallant et 1994). Туберкулиновая проба состоит во внутрикож-ном введении 5 ед очищенного туберкулина. У ВИЧ-инфицированных проба считается положительной при диаметре папулы более 5 мм, у лиц с нормальным иммунитету более 10 мм. Основное осложнение профилактики изониазидом — лекарственный гепатит. Чаще всего оно возникает у лиц старше 35 лет. Однако, по мнению некоторых авторов, при тщательном наблюдении риск гепатита невелик даже в этой возрастной группе (Salpeter et al., 1997).
Лица из первой группы — находившиеся в тесном контакте с больным туберкулёзом (например, проживающие с ним в одной квартире), но не имеющие никаких признаков инфекции, должны принимать изониазид по крайней мере в течение 6 мес после прекращения контакта, вне зависимости от возраста. В первую очередь это касается детей. Если в процессе лечения туберкулиновая проба становится положительной, приём препарата продлевают до 12 мес.
Лицам из второй группы (с положительной туберкулиновой пробой, но без клинических и рентгенологических признаков инфекции), у которых вираж туберкулиновой пробы произошёл в течение последних 2 лет (то есть недавно заразившимся), показан приём изониазида в течение 12 мес независимо от возраста. По мнению некоторых авторов, годичный курс необходим всем лицам с положительной туберкулиновой пробой любой давности, если они моложе 35 лет или относятся к группе риска активного туберкулёза, то есть страдают ВИЧ-инфекцией, лейкозами, лимфомами, силикозом либо получают иммуносуп-рессивную терапию (Bass etal., 1994; Gallant etal., 1994). В возрасте старше 35 лет профилактическое лечение изониазидом может принести больше вреда, чем пользы.
Лицам из третьей группы (больным с нелеченным туберкулёзом в анамнезе) также показана годичная профилактика изониазидом (Comstock, 1983). У ВИЧ-инфицированных инъекционных наркоманов вероятность развития активного туберкулёза составляет 8% в год (Selwyn etal., 1989). Согласно рекомендациям Центра по контролю заболеваемости, длительность профилактического приёма изониазида у ВИЧ-инфицированных должна составлять 12 мес. Эффективность такого лечения такая же, как и у лиц с нормальным иммунитетом (Wilkinson et al., 1998). Профилактическое лечение показано при положительной туберкулиновой пробе (см. выше). Ранее Центр по контролю заболеваемости рекомендовал его и ВИЧ-инфицированным с отрицательной туберкулиновой пробой при условии, что у них отрицательны кожные пробы с другими антигенами и высок риск туберкулёза (1991 г.). В 1997 г. эти рекомендации были отменены как необоснованные (Gordin et al., 1997; Whalen et al., 1997). ВИЧ-инфицированным, контактировавшим с больным полирезистентным туберкулёзом, профилактически назначают этамбутол в высоких дозах в сочетании с пиразинамидом, а иногда и с фторхинолонами (Gallant et al., 1994).
Противопоказания к профилактике изониазидом включают заболевания печени и побочные реакции на препарат в анамнезе. Альтернативой приёму изониазида, возможно, станет двухмесячный курс рифампицина в сочетании с пиразинамидом, сравнимый по эффективности у ВИЧ-инфицированных с годичным приёмом изониазида (Halsey et al., 1998). Беременным профилактическое лечение откладывают до родоразрешения.
Лечение инфекций, вызванных атипичными микобактериями[править | править код]
Атипичные микобактерии вызывают ряд заболеваний у человека (Brown and Wallace, 2000). Поскольку эти микроорганизмы часто устойчивы ко многим антимикобактериальным средствам, при выборе препарата обязательно учитывают данные о чувствительности возбудителя in vitro. В некоторых случаях для излечения необходимо хирургическое вмешательство (удаление инфицированных тканей) с последующей длительной антимикобактериальной терапией. Средства, действующие на Mycobacterium avium-intracellulare, подробно рассмотрены в следующем разделе.
Mycobacterium kansasii вызывает поражение лёгких, напоминающее туберкулёз, но протекающее легче. Хотя Mycobacterium kansasii может быть устойчива к изониазиду, инфекция поддаётся комбинированному лечению изониазидом, рифампицином и этамбутсшом (Pezzia et al., 1981; Lane et al., 1994). Mycobacterium marinum вызывает поражение кожи, известное как гранулёма купальщиков. Эффективна комбинация рифампицина с этамбуто-лом; иногда применяют миноциклин (Loria, 1976) или тетрациклин (Izumi et al., 1977), активные в отношении Mycobacterium таrinum in vitro. Mycobacterium scrofulaceum — редкий возбудитель шейного лимфаденита; методом выбора остаётся хирургическое вмешательство (Lincoln and Gilberg, 1972). Mycobacterium fortuiturn, Mycobacterium chelonae и Mycobacterium abscessus — canpoфиты, которые могут вызвать хроническое поражение лёгких, а также инфекции кожи и мягких тканей. Эти микроорганизмы высокоустойчивы к большинству антимикробных средств, но in vitro чувствительны к амикацину, цефокситину и тетрациклинам (Sanders et al., 1977; Sanders, 1982).