Препараты для анестезии
Категория:
«Фармакология».
Содержание
- 1 Лекарственные средства, используемые в анестезии и интенсивной терапии
- 2 ПАТОФИЗИОЛОГИЯ ХИРУРГИЧЕСКОГО ПОВРЕЖДЕНИЯ И КРИТИЧЕСКИХ СОСТОЯНИЙ
- 3 Реакция на тканевое повреждение во время хирургического вмешательства
- 4 ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ПРЕМЕДИКАЦИЯ ДО АНЕСТЕЗИИ
- 5 Премедикация и техника аэрации, предотвращающая легочную аспирацию
- 6 Премедикация для лечения сопутствующих сердечно-сосудистых, дыхательных и эндокринных заболеваний
- 7 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ОБЩЕЙ АНЕСТЕЗИИ
- 8 Молекулярный механизм действия общих анестетиков
- 9 Индукция и поддержание общей анестезии
- 10 Ингаляционные анестетики
- 11 Внутривенные анестетики
- 12 Миорелаксанты
- 13 МЕСТНАЯ АНЕСТЕЗИЯ
- 14 Местные анестетики
- 15 СЕДАЦИЯ
- 16 ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
- 17 Внутримышечное и внутривенное введение опиоидов
- 18 РЕАНИМАЦИЯ И ИНТЕНСИВНАЯ ТЕРАПИЯ
- 19 Оксигенотерапия и искусственная вентиляция легких
- 20 Устранение гемодинамических нарушений
- 21 Средства для жизнеобеспечения
- 22 Читайте также
- 23 Литература
Лекарственные средства, используемые в анестезии и интенсивной терапии
ПАТОФИЗИОЛОГИЯ ХИРУРГИЧЕСКОГО ПОВРЕЖДЕНИЯ И КРИТИЧЕСКИХ СОСТОЯНИЙ
Развитие хирургии стало возможным благодаря открытию местной и общей анестезии. Цели хирургии:
- заживление, восстановление или замещение поврежденных тканей либо тканей, изменившихся в результате заболевания;
- перемещение нормальной ткани в качестве органа-донора для трансплантации.
В современной хирургии необходимо использование анестезии как местной, так и общей.
Развитие анестезии происходило в результате изучения лекарственных средств
Облегчать боль и страх при хирургических вмешательствах научились совсем недавно. Даже в «золотой век» хирургии для уменьшения боли и страха использовали только этанол, опиум, корень мандрагоры и кокаин. Эти средства подавляют боль, беспокойство и угнетают сознание, но не являются общими анестетиками. Древнеримский врач Диоскорид применял их в качестве обезболивающих уже 2000 лет назад, но современное использование наркоза с 1847 г. связывают с именем Оливера Венделла Холмса. Он описал использование эфира и закиси азота (N20) для достижения обратимого бессознательного состояния, находясь в котором пациент переносил хирургическое вмешательство без ощущения боли (общая анестезия). Только через 40 лет, после появления лекарственных средств местной анестезии, стало возможно проводить операцию, при которой пациент сохраняет сознание, но не испытывает боль благодаря введению в оперируемую область местных анестетиков.
Действие первого анестетика — закиси азота (синтезированного в 1776 г. Пристли) — было описано Дэви, который вместе с другими исследователями в 1790-х гг. открыл, что закись азота (а позднее — эфир) угнетает сознание. Дэви предположил также, что оба препарата вводят пациента в бессознательное состояние, следовательно, возможно хирургическое вмешательство без чувства боли. Однако опередившее время открытие до определенного момента не было использовано. Эфир и закись азота для анестезии не применяли до 1846 г., хотя оба препарата регулярно использовали по отдельности («эфирная веселость»). Их применение сопровождалось интоксикацией.
С середины XIX в. врачи стали стремиться сделать хирургию безболезненной. Это положило начало систематическим попыткам внедрения закиси азота и эфира в медицину в качестве средств общей анестезии. Значительных успехов достигли в США в 1844-1846 гг. Уэллс и Мортон. Уэллс внедрил применение закиси азота в стоматологии, а Мортон — эфира в хирургии. В Великобритании Симпсон (1847 г.) начал поиск новых анестетиков, изучая пахучие испарения органических растворителей, эффекты которых он проверял на себе и коллегах. Вскоре эти опасные исследования привели к открытию хлороформа, который стал в Великобритании препаратом выбора при анестезии на 100 лет.
Таким образом, до середины 1900-х гг. эфир, закись азота (доступен в стальных баллонах с 1868 г.) и хлороформ были основными препаратами общей анестезии во всем мире. Постепенно открывали новые и более эффективные анестетики, но все они были далеки от идеала. Закись азота обладает недостаточной силой обезболивания и его нельзя использовать в концентрациях, необходимых для полной анестезии; эфир огнеопасен, его действие развивается медленно и оказывает вред на систему дыхания; хлороформ более эффективен и неогнеопасен, но может вызвать фатальную сердечную аритмию и гепатотоксичность. Газ циклопропан был открыт в качестве анестетика в 1929 г. Несмотря на взрывоопасность, его применяли долгие годы.
Ситуация изменилась с открытием гипнотического эффекта барбитуратов. Тиопентал — барбитурат, вызывающий общую непродолжительную анестезию при в/в введении. Открытие Равентосом и Саклингом галотана, первого из новых анестетиков — галогенированных углеводородов, которые были легкодоступны и безопасны при ингаляционном введении и неогнеопасны, произвело революцию в анестезиологии. Ценность галотана была настолько велика, что многие новые препараты (см. далее) создавались на его основе. Другой значительный шаг в анестезии был сделан с открытием кураре — вещества, блокирующего нервно-мышечную передачу. Анестезиологам удалось обеспечить контролируемую миорелаксацию, вследствие чего уменьшилась потребность в высоких концентрациях препаратов общей анестезии.
- Синтез закиси азота: 1776 г.
- Использование закиси азота и эфира в хирургии: 1844-1846 гг.
- Хлороформ: 1847 г.
- Циклопропан: 1929 г.
- Галогены: 1950-е гг.
Контроль анестезии упростился после открытия 4 стадий, которые проходили больные, получавшие эфирный наркоз:
- 1-я стадия — анальгезия;
- 2-я стадия — возбуждение с потерей сознания, но с сохранением рефлексов;
- 3-я стадия — хирургический наркоз, при котором все рефлексы постепенно исчезают;
- 4-я стадия — паралич мозга с уменьшением ЧСС и вазомоторного контроля (возможен летальный исход).
У других анестетиков не выявили точно таких же стадий, но их обнаружение позволило понять, как наркоз усиливается, главным образом во 2-й стадии. В настоящее время для общей анестезии используют препараты, которые вызывают потерю сознания (гипноз), анальгезию, нервно-мышечную блокаду, амнезию и угнетение двигательных и автономных рефлексов нервной системы. Для достижения подобных эффектов необходимо использовавать комбинации препаратов, а не один анестетик.
Местная (региональная) анестезия имеет давнюю историю. В 1884 г. австрийский врач Кёллер стал проводить глазные операции под кокаиновым обезболиванием. Кокаин блокирует потенциал-зависимые и время-зависимые Ма+-каналы в нейронах и в результате анестезирует чувствительные и двигательные нервы. Новые местные анестетики (например, лидокаин, открытый в 1943 г.) стали применять и в других областях хирургии. Таким образом, определенная область тела (например, кожа) может быть анестезирована путем инфильтрации анестетиком этой области. При блокировании больших нервов можно лишить чувствительности большую площадь. Максимальной площади достигают путем введения препарата рядом со спинным мозгом при спинальной или эпидуральной анестезии. В отличие от общей анестезии применение местного обезболивания в разных странах различается.
Реанимационные мероприятия для больных без сознания (система ABC)
- A (Airway, дыхательный путь) — обеспечение проходимости дыхательных путей
- В (Breathing, дыхание) — искусственная вентиляция легких и оксигенация крови
- С (Circulation, циркуляция) — непрямой массаж сердца при отсутствии пульса, создание условий для венозного доступа и инфузионной терапии
- D (Defibrillate heart, дефибрилляция сердца) — если необходимо: диагностика и лечение обратимых причин остановки сердца
Парадоксально, но хирурги используют метод повреждения для лечения повреждений. Конечно, хирургия отличается от случайной травмы, поскольку процесс и степень повреждения тщательно контролируют, а реакцию организма частично уменьшают с помощью анестетиков. Общая анестезия сопровождается подавлением реакций со стороны дыхательной и сердечно-сосудистой систем на время операций. Иногда это полезно, но полное подавление таких реакций может привести к критическому повреждению жизненно важных органов, особенно у пациентов с дыхательной недостаточностью и сердечно-сосудистыми заболеваниями. Мониторинг жизненно важных функций и интенсивная терапия во время проведения анестезии параллельно с реанимационными мероприятиями способствуют выздоровлению пациента.
Реакция на тканевое повреждение во время хирургического вмешательства
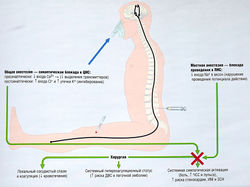
Подавление анестетиками физиологических реакций имеет большое значение в периоперационном периоде. Реакциями на тканевое повреждение могут быть местные изменения и стимуляция нейрогуморальных патогенетических звеньев, образующих дыхательный, сердечно-сосудистый, эндокринный, метаболический и воспалительный компоненты реакции, которые необходимы для повышения шансов на выживание при смертельно опасной ране, например (рис. 21.1):
- сужение сосудов и коагуляция уменьшают кровотечение;
- стимуляция активности симпатической нервной системы компенсирует уменьшение объема циркулирующей крови (ОЦК).
Рис. 21.1 Методы угнетения физиологических реакций в хирургии с помощью анестезии. Т —увеличение; 1 — снижение; ДВС — диссеминированное внутрисосудистое свертывание; ЗСН — застойная сердечная недостаточность; ИМ — инфаркт миокарда; ПНС — периферическая нервная система; ЦНС — центральная нервная система; ЧСС — частота сердечных сокращений.
Активация механизмов тромбообразования приводит к состоянию системной гиперкоагуляции, когда значительно увеличивается высвобождение катехоламинов из симпатической нервной системы, что приводит к тахикардии и гипертензии и повышает риск ишемии миокарда и остановки сердца в результате тромбоза.
Анестезия и мониторинг боли в послеоперационный период уменьшают перечисленные реакции, а также снижают риск сердечно-сосудистых осложнений.
Хирургические повреждения и такие осложнения, как кровотечение, связаны со значительной потерей жидкости, особенно при открытой ране живота. Выпот появляется при оголении большой площади серозной поверхности кишечника, когда аккумуляция жидкости приводит к интерстициальному замещению кишечника — потере 1/3 пространства. Такую потерю жидкости необходимо замещать уже во время операции, чтобы предотвратить гиповолемию и гемодинамическую нестабильность крови. Однако в первые несколько дней после операции потеря 1/3 пространства восполняется, приводя к увеличению сосудистого доступа и усиливая предрасположенность пациентов к таким заболеваниям, как стенокардия и сердечная недостаточность.
Осложнения в послеоперационный период
- Циркуляторные: кровотечения, потеря жидкости, нарушение электролитного баланса, тромбоз глубоких вен, легочная эмболия, повышение артериального давления
- Раневые: инфекция, расхождение швов
- ЖКТ: паралич подвздошной кишки, язва желудка, недостаточная усвояемость пищи
- Повреждение жизненно важных органов: мозга, легких, сердца, почек, печени
Анестетиками и другими препаратами, используемыми во время операции, обычно подавляют боль, тревогу и беспокойство с целью сохранения оксигенации, гемодинамической стабильности, баланса жидкости в организме и предотвращения сепсиса.
Анестезия — это отсутствие чувствительности к боли за счет подавления:
- центральной нервной системы (общая анестезия);
- периферической нервной системы (местная анестезия).
Неврологические реакции во время операции пропорциональны стимуляции ноцицептивной системы и степени тканевого повреждения. Например, реакции при внутриполостной хирургии выражены более ярко, чем при хирургии конечностей. Чтобы подавить стимуляцию ноцицептивной системы, необходима большая концентрация анестетиков.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ПРЕМЕДИКАЦИЯ ДО АНЕСТЕЗИИ
Лекарственные средства до анестезии используют с целью:
- седации;
- анальгезии;
- антимускаринового эффекта (табл. 21.1);
- антибиотикопрофилактики для предотвращения инфекции ран и бактериальных эндокардитов;
- антикоагуляционной профилактики для предотвращения тромбоза глубоких вен. Однако антикоагуляционную профилактику откладывают, если используют эпидуральную или спинальную анестезию, т.к. существует риск эпидуральной гематомы и компрессии спинного мозга.
Таблица 21.1 Назначение лекарственных средств в предоперационном периоде
|
Лекарственные средства |
Цель | |
|
ПРЕКРАТИТЬ |
Пероральные гипогликемические |
Избежать гипогликемии и энергетического голодания мозга |
|
Ингибиторы моноаминоксидазы |
Избежать гипертонического криза и гиперпирексии | |
|
Варфарин (при фибрилляции предсердий и протезе клапана заменить на гепарин и приостановить курс перед операцией) |
Избежать сильного кровотечения во время операции (с минимальным риском острого нарушения мозгового кровообращения) | |
|
Диуретики |
Избежать гиповолемии и гипокалиемии | |
|
ПРОДОЛЖИТЬ |
Наркотические анальгетики |
Устранить боль перед операцией и избежать синдрома отмены |
|
Противосудорожные |
Избежать судорог | |
|
Бронходилататоры |
Избежать бронхоконстрикции | |
|
Антигипертензивные и сердечно-сосудистые препараты, за исключением диуретиков |
Избежать гипертензии, ишемии миокарда, инфаркта миокарда и аритмий | |
|
Адренокортикостероиды (увеличить дозу) |
Поддержать достаточное количество адреналина | |
|
Инсулин (снизить дозу) |
Избежать кетоацидоза | |
|
НАЧАТЬ |
Антагонисты гистаминовых Н1 и Н2-рецепторов |
Профилактика реакций гиперчувствительности |
|
Бензодиазепины |
Успокоить беспокойных больных и предупредить антероградную амнезию | |
|
Ингаляционные бронходилататоры |
Избежать бронхоконстрикции у больных астмой | |
|
Антихолинергические препараты |
Избежать брадикардии у маленьких детей | |
|
Адренокортикостероиды (увеличить дозу) |
Поддержать достаточное количество адреналина | |
|
Антациды, антагонисты гистаминовых Н1-рецепторов, препараты, влияющие на моторную функцию желудка |
Повысить желудочный pH, уменьшить резидуальный объем желудка | |
|
Противорвотные |
Снизить риск тошноты и рвоты | |
|
Гепарин |
Предотвратить тромбоз вен и легочную эмболию | |
|
Антибиотики |
Предотвратить инфицирование раны |
Премедикация и техника аэрации, предотвращающая легочную аспирацию
Анестетики могут вызвать регургитацию и рвоту с риском аспирации, т.к. анестезия подавляет рефлексы нормальной защитной аэрации. Недавний прием пищи и жидкости увеличивает риск развития у пациента легочной аспирации и летального исхода во время анестезии. Риск легочной аспирации уменьшается при плановой хирургии за счет предоперационного голодания. При экстренной хирургии необходимо учитывать возможное наличие содержимого в желудке. И боль, и опиоиды уменьшают моторику желудка. Чтобы защитить желудок от аспирации кислыми компонентами, следует использовать антациды. Антагонисты Н2-рецепторов и ингибиторы протонового насоса также уменьшают продукцию кислоты. Препараты, увеличивающие усвояемость и подвижность в верхних отделах ЖКТ (метоклопрамид), помогают опорожнять желудок. Их следует назначать до анестезии, чтобы предотвратить гастроэзофагеальный рефлюкс, но такая терапия не всегда успешна.
Для предотвращения легочной аспирации во время экстренной хирургии используют одну из техник обеспечения дыхания:
- интубацию трахеи с местной анестезией и седацией;
- интубацию с последующей быстрой водной анестезией и нервно-мышечной блокадой.
Риск легочной аспирации сохраняется, пока существует возможность гастроэзофагеального рефлюкса, например в период между введением лекарств и интубацией или сразу после удаления трубки во время процесса пробуждения от анестезии. Интубация у людей в сознании невозможна у неконтактных больных. При быстрой интубации увеличивается риск у пожилых людей с сердечно-сосудистыми заболеваниями.
Премедикация для лечения сопутствующих сердечно-сосудистых, дыхательных и эндокринных заболеваний
Ограничение дыхания, например при ХОБЛ, является предрасполагающим фактором к послеоперационному ателектазу, пневмонии, гипоксемии и нарушению вентиляции, особенно после абдоминальной и торакальной хирургии. Лечение бронхоспазма бронходилататорами и хронической инфекции антибиотиками в сочетании с физиотерапией нужно проводить в течение нескольких дней до операции.
Таблица 21.2 Взаимодействие анестетиков с другими лекарственными средствами
|
Локализация |
Лекарственные средства |
Взаимодействие с анестетиком |
|
Мозг |
Острая алкогольная интоксикация |
Потенцирует действие общих анестетиков |
|
Постоянное злоупотребление алкоголем |
Увеличивает потребность в анестетике | |
|
Клонидин |
Потенцирует действие общих анестетиков (но его не следует назначать в предоперационном периоде из-за риска гипертензии во время операции) | |
|
Легкие |
Курение |
Повреждение легких снижает транспорт кислорода, а угарный газ снижает кислородную емкость крови |
|
Предшествующее употребление блеомицина |
Высокий уровень FiO2 может форсировать респираторный дистресс-синдром взрослых | |
|
Кровообращение |
Диуретики |
Гиповолемия увеличивает риск гипотензии и острой гипокалиемии и, соответственно, возникновения аритмий в состоянии наркотического сна |
|
Агонисты β-адренорецепторов, бронходилататоры |
Увеличивают риск развития аритмий от ингаляционных анестетиков | |
|
Антагонисты β-адренорецепторов |
Потенцируют угнетение миокарда общими анестетиками | |
|
Блокаторы кальциевых каналов |
Потенцируют угнетение миокарда общими анестетиками | |
|
Ингибиторы моноаминоксидазы |
Могут форсировать гипертензию и гиперпирексию | |
|
Предшествующее употребление доксорубицина |
Кардиомиопатия увеличивает риск инфаркта миокарда | |
|
Нервно-мышечные соединения |
Аминогликозиды |
Потенцируют действие антидеполяризующих миорелаксантов |
Общие анестетики являются миокардиальными депрессантами при эпидуральной и спинальной анестезии, которые приводят к вазодилатации вследствие блокады вазосимпатических нервов. Сердечную недостаточность и гиповолемию нужно лечить в предоперационном периоде, чтобы избежать гипотензивных эффектов анестезии. При миокардиальной ишемии, гипертензии и аритмии необходимо использовать соответствующие препараты, по возможности исключая диуретики.
Недостаток калия в организме, вызванный использованием диуретиков и адренокортикостероидов, необходимо скорректировать в течение нескольких дней, чтобы минимизировать риск аритмии во время операции (табл. 21.2).
С усовершенствованием препаратов для лечения диабета уменьшилась необходимость в пероральных гипогликемических средствах. Диабетические препараты принимают утром в день операции для предотвращения низкой концентрации глюкозы в крови. Иногда, в зависимости от продолжительности действия, их прием прекращают за 1-2 дня до операции (например, хлорпропамид).
Пациентам с инсулинозависимым диабетом необходимо в/в вливание глюкозы и снижение обычной дозы инсулина до операции. При недостатке инсулина свободные жирные кислоты мобилизуются из жировой ткани и метаболизируются в кетоновые тела, вызывая инсулиновую недостаточность печени. Это может привести к кетоацидозу, угрожающему жизни человека. В результате операционного стресса может образоваться дефицит адреналина. Парентеральную заместительную терапию начинают утром в день операции и прекращают в послеоперационный период при устранении стресса (см. табл. 21.1).
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ОБЩЕЙ АНЕСТЕЗИИ
В основе классификации препаратов общей анестезии лежит способ их введения: ингаляционный или внутривенный.
К ингаляционным общим анестетикам относят закись азота и некоторые галогенированные углеводороды, которые испаряются при комнатной температуре. Эфир и хлороформ обладают непродолжительным действием, поэтому их постепенно заменили галогенированные анестетики: галотан, метоксифлуран, энфлуран, изофлуран, севофлуран и дезфлуран.
К препаратам общей анестезии, вводимым внутривенно, относят тиопентал и метогекситал (барбитураты), пропофол (фенольное соединение), этомидат (карбоксилированный имидазол) и кетамин (производный фенциклидина).
Молекулярный механизм действия общих анестетиков
Молекулярное влияние в/в анестетиков на ЦНС осуществляется через специфические рецепторы, но для ингаляционных анестетиков этот механизм до сих пор неясен. В/в анестетики действуют на ионные каналы. Например, эффект в/в анестетиков тиопентала, пропофола и этомидата проявляется ГАМКергическим или глутаматергическим ингибированием, тогда как действие ингаляционных анестетиков предполагает ингибирование через калиевые каналы. Были проведены исследования их влияния на многие другие рецепторы. На клеточном уровне ионные изменения приводят к подавлению синаптической передачи в таламусе, коре больших полушарий и спинном мозге. Все сенсорные стимулы, кроме обоняния, проходят через таламус, их активность контролируют нейроны таламокортикальной зоны, т.е. они определяют состояние сна и бодрствования.
Было установлено, что общие анестетики подавляют активность и приводят к неподвижности широкого круга организмов — от бактерий до людей. Основной мишенью общих анестетиков является ЦНС, но эти препараты в различных концентрациях способны также подавлять активность всех видов возбуждения в тканях. Подавление сердечно-сосудистой системы — важная способность анестетиков понижать возбудимость, особенно в клинических условиях.
Механизмы ЦНС, на основе которых местные анестетики вводят пациента в бессознательное состояние и подавляют его двигательные и автономные рефлекторные реакции на хирургическое вмешательство, не определены. Во-первых, механизмы, лежащие в основе сознания, понятны не полностью. Во-вторых, процесс анестезии состоит из определенных стадий, которые трудно поддаются количественной оценке, включая обезболивание, гипноз и амнезию. Сочетание двух или более в/в средств с ингаляционными анестетиками, в том числе бензодиазепинами и опиоидами, которые являются компонентами сбалансированной анестезии, обеспечивает наилучший контроль за гемодинамикой во время операции.
Индукция и поддержание общей анестезии
Общая анестезия — достижение бессознательного состояния и анальгезии путем в/в введения анестетиков. В дальнейшем анестезию поддерживают ингаляционными анестетиками с использованием опиоидов и нервно-мышечных блокаторов или без них
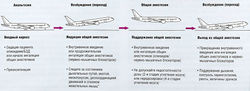
Общую анестезию начинают с вводного наркоза, или индукции анестезии (рис. 21.2). Во время индукции дыхательные и циркуляторные рефлексы подавляются анестетиками в зависимости от дозы.
Рис. 21.2 Стадии общей анестезии. Выбор анестетиков описан в тексте. БЗД — бензодиазепины. * Признаки возбуждения появляются при внутривенной анестезии, если не используют нервно-мышечные блокаторы.
Дыхательные рефлексы — снижение ответных реакций на уменьшение вентиляции, гиперкапнию и особенно гипоксемию.
Циркуляторные рефлексы — подавление сократимости миокарда, ослабление тонуса гладких мышц сосудов и ослабление контроля периферической нервной системы за сердцем и сосудами.
Эти эффекты являются общими для всех анестетиков. Также возникают различные рефлексы в результате ноцицептивной стимуляции во время операции.
Различные электронные приборы, которые применяют для контроля уровня анестезии, не всегда эффективны. Глубину анестезии оценивают по стабильности сердечно-сосудистой системы.
При вводном наркозе необходимы осторожная аэрация и контроль вентиляции с мониторированием пульса и жизненно важных функций с помощью оксиметрии и капнометрии. При подавлении гемодинамики используют адекватную оксигенацию и вентиляцию. Необходимо исключить гиповолемию, ишемию сердца и избыточное введение анестетика.
Медленный вводный наркоз с помощью инфузии или летучих ингаляционных анестетиков не всегда оказывается менее опасным, чем быстрый при введении болюсно.
Например, нейровозбуждение с рвотой, ларин-госпазм, кашель и одышка могут возникнуть при медленном переходе от бодрствования к анестезии.
Для взрослых предпочтительнее внутривенный вводный наркоз, а для детей используют ингаляционный вводный наркоз, т.к. сотрудничество с ними может быть ограничено.
Выбор анестетика определяет технику вентиляции и влияет на процесс мониторирования аэрации и вентиляции
Ручное обеспечение вентиляции приводит к болезненности и рефлекторной мышечной активности, которые должны быть подавлены для уменьшения травмирования. В отношении интенсивности стимуляции, обеспечиваемой с помощью вентиляции, ороларингеальная и ларингеальная маски дают наименьшую стимуляцию, тогда как эндотрахеальная трубка — наибольшую. В результате высокие дозы в/в анестетиков и опиоидов используют именно для интубации трахеи, к тому же при интубации необходимо применение блокаторов нервно-мышечной передачи (табл. 21.3).
При выведении из наркоза ни внутривенные, ни ингаляционные анестетики не обеспечивают необходимого обезболивания
При выведении из наркоза используют опиоиды (например, морфин, меперидин, фентанил, алфентанил, суфентанил, ремифентанил; см. главу 8), которые назначают для усиления обезболивающего эффекта в послеоперационный период. Дополнительная польза от применения опиоидов во время анестезии выражается в уменьшении потребности в ингаляционных анестетиках, что уменьшает подавление циркуляции. Осложнение может быть вызвано повышенными дозами опиоидов, которые приводят к дозозависимому подавлению дыхания (см. далее).
Ингаляционные анестетики
Использование галотана способствовало созданию новых видов анестетиков на основе углеводородов. Энфлуран и изофлуран появились в 1970-1980-х гг. Дальнейшие исследования позволили создать в 1990-х гг. два фторированных углеводорода — севофлуран и дезфлуран. Эти новейшие ингаляционные анестетики характеризуются значительно более быстрой фазой введения и выведения из наркоза, а также меньшим риском интоксикации печени.
Таблица 21.3 Методы вентиляции легких во время общей анестезии
|
Вопрос |
Альтернатива |
Выход |
|
Чем вентилировать? |
Лицевая или ларингеальная маска |
Менее инвазивно, но и менее надежно, больше подходит для непродолжительных процедур |
|
Интубация трахеи |
Требует введения миорелаксантов и может травмировать Дает гарантию вентиляции Защищает легкие от аспирации рвотных масс, крови и др. Усиливает искусственную вентиляцию легких | |
|
Как вентилировать? |
Спонтанно |
Менее инвазивно, т.к. дыхательные объемы отрицательны |
|
Механически |
Устраняет остановку дыхания и снижает потребление кислорода |
Фармакокинетические и фармакодинамические характеристики ингаляционных анестетиков
Между ингаляционными и внутривенными анестетиками существует фармакокинетическое отличие. Ингаляционные анестетики поступают в организм через легкие и не нуждаются в метаболизации для элиминации легкими, поэтому являются предпочтительными при поддержании анестезии. При выдохе анестетики быстро элиминируются из головного мозга и сердца и, следовательно, изменяют уровень анестезии.
Фармакодинамически эти анестетики назначают в виде определенного газа или концентрации какого-либо вещества без дозы, т.к. процесс вдоха и выдоха неразрывно связаны. Поскольку парциальное давление ингаляционных анестетиков в легких и мозге одинаково, достигается устойчивое состояние, когда концентрация препарата в легких соответствует концентрации его в мозге. Мониторирование концентрации анестетиков на выдохе и гемодинамических реакций позволяет анестезиологу контролировать отношение доза-ответ во время операции. Концентрация в/в анестетиков в мозге точно не определяется, хотя некоторые приборы позволяют определить влияние этих анестетиков на мозг.
Конечная концентрация анестетика на выдохе, или минимальная альвеолярная концентрация (МАК), отражает эффективность действия ингаляционных анестетиков и является основанием для построения кривой отношения доза-ответ. МАК — это концентрация анестетика, которая предотвращает движение в ответ на хирургический разрез кожи у 50% исследуемых. МАК позволяет сравнить влияние анестетика на мозг и сердечно-сосудистую систему (табл. 21.4). Например, увеличение МАК ингаляционных анестетиков в 1,3 раза предотвращает движение у 95% больных, но гемодинамика существенно варьирует (индивидуальные факторы конкретного пациента могут увеличивать или уменьшать МАК).
МАК — мера воздействия ингаляционных анестетиков
- МАК — минимальная альвеолярная концентрация (или конечная концентрация анестетика на выдохе), которая предотвращает движение в ответ на хирургический разрез кожи у 50% пациентов
- Увеличение МАК в 1,3 раза предотвращает движение у 95% больных, согласно кривой отношения доза-ответ
Закись азота обычно назначают в сочетании с летучими анестетиками из-за их слабой активности (МАК > 100%). Низкая эффективность летучих анестетиков ограничивает количество закиси азота, которое может быть назначено. Вследствие низкой растворимости в крови минимальное количество закиси азота должно раствориться в крови до достижения равновесия между альвеолярным и артериальным парциальным давлением. Это способствует быстрому вводному наркозу и выходу из него.
Клиническое применение и токсичность ингаляционных анестетиков
Севофлуран и дезфлуран заменили галотан у детей и изофлуран — у взрослых. Эти препараты сокращают время выхода из наркоза.
Часто галогенированные углеводороды назначают в сочетании с закисью азота, если есть противопоказания, угрожающие жизни больного.
По сравнению с севофлураном дезфлуран не подходит для ингаляций, т.к. вызывает кашель и задержку дыхания при слишком быстрой подаче. У всех подопытных животных летучие анестетики показали дозозависимое снижение аэрационной резистентности. Севофлуран метаболизирует с образованием флуорида и компонента А с потенциальной почечной токсичностью, в то время как дезфлуран инертен. Все летучие ингаляционные анестетики противопоказаны больным с наследственным, угрожающим жизни гиперметаболиче-
Токсичность ингаляционных анестетиков
- Летучие анестетики гепатотоксичны (галотановый гепатит)
- Энфлуран и севофлуран редко вызывают нефротоксичность
- Закись азота вызывает подавление костного мозга, периферическую нейропатию (в результате снижения доступности витамина В12), аборты. В связи с этим в операционных используют специальные системы, которые удаляют газы и пары
ским состоянием скелетных мышц, которое характеризуется тахикардией, повышенными парциальным давлением углекислого газа и тонусом мышц, а также смешанным ацидозом — синдромом, известным как злокачественная гипертермия (повышение температуры тела). Это состояние лечат дантроленом.
Внутривенные анестетики
История
В течение 50 лет препаратом выбора был тиопентал, но в 1990-е гг. начали применять пропофол. Для индукции и поддержания анестезии в кардиохирургии или для хирургических больных с низким сердечным выбросом в течение 25 лет использовали большие дозы фентанила и суфентанила, но при этом необходима была послеоперационная искусственная вентиляция легких (ИВА). Кетаминовую анестезию сопровождает симпатическая стимуляция, которая желательна для анестезии у больных с циркуляторным шоком или острым бронхоспазмом. К сожалению, при пробуждении от кетамино-вого наркоза больного могут беспокоить галлюцинации.
Сравнительная характеристика И тиопентала и пропофола
- Тиопентал растворяется в физиологическом растворе
- Пропофол растворяется в эмульсии из соевых бобов
- Оба препарата после разового введения действуют в течение короткого времени, но время действия тиопентала увеличивается после повторного введения
- Тиопентал быстро перераспределяется в тканях, но медленно метаболизируется
- Пропофол быстро перераспределяется и метаболизируется
Фармакокинетические и фармакодинамические характеристики тиопентала и пропофола
Тиопентал хорошо растворяется в липидах. Для придания ему водорастворимых свойств его смешивают с гидрокарбонатом натрия. Пропофол совсем не растворяется в воде, поэтому для в/в введения готовят эмульсию из масла соевых бобов, лецитина и гликоля. Высокая растворимость тиопентала и пропофола в липидах позволяет им легко проходить через гематоэнцефалический барьер. После инъекции оба препарата быстро попадают в мозг, и бессознательное состояние наступает в течение 30 сек. Затем концентрация в мозге снижается, и препарат перераспределяется в другие хорошо кровоснабжаемые ткани с низким содержанием липидов. Перераспределение и отсутствие метаболизма являются причиной ультракороткой продолжительности действия и пробуждения через 10 мин после разовой дозы тиопентала или пропофола.
Метаболизм тиопентала в печени протекает медленно. Вследствие аккумуляции препарата после введения повторных доз тиопентала пробуждение происходит медленно. Пропофол, наоборот, быстро метаболизируется и перераспределяется в тканях, поэтому его можно вводить в/в для поддержания анестезии.
Медленный метаболизм бензодиазепинов и большинства наркотических анальгетиков не позволяет использовать их по отдельности в качестве вводного наркоза. К тому же обе группы лекарственных средств могут не вызвать полного бессознательного состояния. Выраженное послеоперационное состояние дремоты, являющееся следствием низкой скорости метаболизма, клинически неприемлемо. Исключение составляет опиоид ремифентанил, вводимый в/в. Он очень быстро метаболизируется тканевой эстеразой.
Клиническое применение и токсичность тиопентала и пропофола
Тиопентал также используют в реанимации для прекращения судорог и лечения повышения внутричерепного давления. Тиопентал не используют как седативное средство, поскольку в малых дозах он снижает болевой порог и вызывает парадоксальное эмоциональное возбуждение. При использовании ларингеальной маски с последующим введением тиопентала необходимо применять миорелаксанты для свободного наложения маски и предотвращения ларингоспазма. Если вводят пропофол, миорелаксанты не нужны. Введение пропофола не вызывает в раннем послеоперационном периоде дремоту и в меньшей степени сопровождается тошнотой и рвотой, поэтому он подходит для ежедневного применения в хирургической практике, хотя стоит дороже тиопентала. Как и ингаляционные анестетики, тиопентал и пропофол угнетают дыхательный центр и оказывают дозозависимый угнетающий эффект на сердечный выброс и артериальное давление. Пропофол противопоказан пациентам с аллергией на яйца и соевые бобы, а тиопентал — больным с острой перемежающейся порфирией.
Миорелаксанты
При эндотрахеальной интубации необходимо применение миорелаксантов, т.к. механическое воздействие на гортань может вызвать рефлекторное смыкание голосовых связок и нарушение легочной вентиляции. Интубация нужна для поддержания просвета дыхательных путей и усиления ИВА (см. табл. 21.3). Нервно-мышечную блокаду используют и в торакальной, и в абдоминальной хирургии для предупреждения мышечных сокращений, мешающих хирургу. Мышечные сокращения можно подавить высокими концентрациями летучих ингаляционных анестетиков, но этот эффект сопровождается падением давления. При использовании миорелаксантов интубация и ИВА являются обязательными.
Классификация лекарственных средств и историческая справка
Миорелаксанты блокируют передачу импульса в нервно-мышечном соединении путем связывания с никотиновыми холинергическими рецепторами скелетных мышц. В зависимости от времени начала, продолжительности действия и нежелательных эффектов выделяют 2 типа блокады:
- деполяризующая;
- антидеполяризующая.
Начало и время действия антидеполяризующих миорелаксантов, как правило, заметно больше, поэтому они лучше подходят для миорелаксации, чем для интубации. Оба типа миорелаксантов (сукцинилхолин — деполяризующий, d-тубокурарин — антидеполяризующий) изначально использовали в качестве компонентов общей анестезии, однако сейчас появились новые антидеполяризующие миорелаксанты:
- аминостероиды: ранкуроний, векуроний, рокуроний;
- бензилизохинолины: атракурий, цисатракурий,миватракурий.
В табл. 21.5 представлены фармакологические эффекты и характеристики этих препаратов.
Таблица 21.5 Сравнительная фармакология и фармакокинетика миорелаксантов
|
Характеристики |
Сукцинилхолин |
Панкуроний |
Рокуроний |
|
Класс |
Деполяризующий |
Антидеполяризующий |
Антидеполяризующий |
|
Время интубации (мин) |
< 1 |
3-8 |
1,5 |
|
Длительность действия (мин) |
5 |
60-75 |
30-45 |
|
Выброс гистамина |
Небольшой |
Нет |
Нет |
|
Выделение почками (%) |
0 |
80 |
30 |
|
Влияние на нАХР |
Стимулирует |
Нет эффекта |
Нет эффекта |
|
Влияние на мАХР |
Стимулирует |
Ограниченная блокада |
Нет эффекта |
Открытие первого антидеполяризующего препарата тубокурарина связано с изучением свойств кураре — смеси алкалоидов, в которую южноамериканские индейцы обмакивали стрелы, чтобы сделать их ядовитыми. Клод Бернар в серии классических экспериментов (1856 г.) показал, что блокада происходила на уровне нервного окончания, а не нерва или мышцы. Клинически значимым алкалоидом кураре является тубокурарин, который, будучи четвертичным амином, не проходит через гематоэнцефалический барьер.
Блокирующие свойства сукцинилхолина не были известны до 1906 г., когда стали изучать его парасимпатические эффекты: у подопытных животных развивался паралич. В 1950-е гг. сукцинилхолин был официально признан миорелаксантом с отличающимся от тубокурарина механизмом и меньшей продолжительностью действия.
Молекулярный механизм действия
Для понимания механизма действия миорелаксантов нужно вспомнить механизм нервно-мышечной передачи.
Ацетилхолин в двигательных нервных окончаниях заключен в везикулы, каждая из которых содержит около 10 ООО молекул АХ. Потенциал действия, достигая нервного окончания, вызывает открытие находящихся там Са2+-каналов N-типа, и вход Са2+ обусловливает высвобождение АХ из везикул в синаптическую щель. Большая часть молекул АХ связывается с никотиновыми ацетил-холиновыми рецепторами (нАХР), которые являются интегральной частью лиганд-зависимых ворот На+/К+-каналов. Ионный канал имеет структуру пентамера, окружающего центральную трансмембранную пору; на пентамере есть два участка для связывания АХ. После связывания АХ с двумя рецепторами канал открывается и вызывает деполяризацию концевой пластинки скелетной мышцы. В результате распространения деполяризации на мембрану соседнего мышечного волокна активируются ее потенциал-зависимые Ка+-каналы, изменяется потенциал на мембране и высвобождается внутриклеточный Са2+, что приводит к сокращению мышцы. Отсоединившись от рецептора, АХ разрушается ацетилхолинэстеразой, поэтому большая часть АХ повторно с нАХР не связывается.
Нервно-мышечное соединение имеет большой коэффициент безопасности, и деполяризация концевой пластинки должна быть значительно уменьшена антидеполяризующими миорелаксантами до наступления истощения. В клинической практике мониторируют ответ в виде мышечного сокращения при воздействии четырьмя электрическими стимулами с частотой 2 Гц на конкретный нерв. Антидеполяризующие миорелаксанты уменьшают или блокируют эти сокращения. В абдоминальной хирургии при эффективной нервно-мышечной блокаде заметно только первое сокращение: последовательные стимулы вызывают прогрессирующее снижение количества высвобождаемого АХ и, соответственно, коэффициента безопасности. По истечении эффекта миорелаксантов момент появления двух или более сокращений является индикатором того, что ингибирование ацетилхолинэстеразы противостоит блокаде. Ингибирование фермента позволяет достаточному количеству АХ накапливаться в синаптической щели и неоднократно взаимодействовать с рецепторами. Таким образом, откроется большее число каналов и восстановится нервно-мышечная передача. В случае избыточной антидеполяризующей блокады увеличение потенциала концевой пластинки из-за дезактивации ацетилхолинэстеразы не повлияет на восстановление передачи.
Важно понимать, что летучие анестетики и другие лекарственные средства тоже могут блокировать нервно-мышечную передачу, однако этот эффект не проявляется при введении клинических доз. Тем не менее они будут усиливать эффект антидеполяризующих миорелаксантов.
Молекулярный механизм действия деполяризующих миорелаксантов также включает связывание с нАХР. Когда два нАХР связываются с АХ или молекулами миорелаксанта, канал открывается и концевая пластинка деполяризуется. Это действие АХ быстротечно, поскольку он подвергается расщеплению ацетилхолинэстеразой на неактивные ацетат и холин, последний из которых возвращается в нервное окончание. Когда тубокурарин блокирует нервно-мышечную передачу, связываясь с нАХР, он не активирует рецептор, а устраняет доступ к АХ. Сукцинилхолин же, представляющий собой две молекулы АХ, связанные через ацетильные группы, активирует нАХР, связываясь с ним. Действуя как аналог АХ, сукцинилхолин оказывает те же эффекты. Однако он разрушается не под действием ацетилхолинэстеразы, а медленно гидролизуется в плазме холинэстеразами. В результате сукцинилхолин сохраняется в синаптической щели в высоких концентрациях дольше, чем АХ. Вслед за длительной активацией нАХР сукцинилхолином поддерживается деполяризация концевой пластинки и десенситизация потенциал-зависимых натриевых каналов мембраны скелетной мышцы, и, следовательно, нейротрансмиссия отсутствует. Аналогичная нервно-мышечная блокада имеет место в эксперименте, когда блокируют ацетилхолинэстеразу и в концевую пластинку поступает большое количество АХ.
Основные отличия в молекулярном механизме действия двух групп миорелаксантов обусловливают характер их действия. Одним из основных отличий является то, что сукцинилхолин вызывает мышечные фасцикуляции — асинхронные сокращения всей двигательной единицы. Предполагают, что они становятся причиной устойчивой миалгии, длящейся довольно долго после операции. Одним из возможных механизмов считают стимуляцию множественно иннервируемых интрафузальных мышечных волокон, расположенных в рецепторах растяжения скелетных мышц. В результате рефлек-торно активируются мотонейроны и соответствующие двигательные единицы. Другой возможный механизм основан на действии пресинаптических никотиновых рецепторов. Можно отметить и то, что единственными множественно иннервируемыми мышцами в человеческом организме являются интрафузальные волокна и внеглазничные мышцы. Такая мышца отвечает ступенчатым сокращением на нарастание концентрации АХ или сукцинилхолина. Так, сукцинилхолин, вызывая ненужные и нескоординированные сокращения мышц глазного яблока, может усугубить глаукому.
Фасцикуляции по природе своего происхождения могут повредить мышцу и вследствие этого увеличить концентрацию натрия в сыворотке. Обычно это не имеет значения, за исключением больных с недавно полученными ожогами, спинальными травмами или миопатиями. У них значительное увеличение концентрации натрия может быть связано с денервацией поврежденной области
Молекулярная мишень миорелаксантов — нАХР скелетных мышц
- Антидеполяризующие миорелаксанты связываются с ацетилхолин-связывающими участками на нАХР, не активируя рецепторы
- Деполяризующие миорелаксанты связываются с ацетилхолин-связывающими участками на нАХР и активируют рецепторы
- АХ конкурирует с антидеполяризующими миорелаксантами за эти участки
- АХ усиливает эффект деполяризующих миорелаксантов и последующим образованием избыточного количества нАХР вне синапса, а рецепторы, активируясь, вызывают потерю натрия мышцами.
У некоторых людей (1 из 2000) имеется недостаток в плазме эстераз, разрушающих сукцинилхолин (недостаточность псевдохолинэстераз). В результате этого возникает продолжительная нервно-мышечная блокада. При полном отсутствии этих ферментов она может длиться несколько часов.
Фармакокинетика и фармакодинамика сукцинилхолина ирокурония
Сукцинилхолин, в норме метаболизируемый в плазме холинэстеразой, имеет период полувыведения ~ 5 мин. Фармакодинамический период полувыведения — то же самое, что и фармакокинетический, поэтому сукцинилхолин, вводимый в/в, вызывает непродолжительную нервно-мышечную блокаду, что делает его удобным препаратом для интубации. Однако большие или повторные дозы сукцинилхолина могут вызвать так называемую вторую фазу блокады, которая сходна с блокадой антидеполяризующих миорелаксантов, но механизм ее действия неизвестен.
Антидеполяризующий миорелаксант рокуроний не вызывает фасцикуляций или миалгий. Через = 30 мин после блокады происходит частичное восстановление в результате метаболизма препарата в печени. Для дальнейшего восстановления после паралича назначают антихолинэстеразный препарат (например, эдрофоний, неостигмин или пиридо-стигмин), в результате снизится разрушение АХ, и конкурентная блокада будет преодолена. Эти препараты также увеличивают количество АХ в мускариновых ацетилхолиновых рецепторах (мАХР), что вызывает появление парасимпатических эффектов. В связи с этим назначают и антагонисты мАХР (например, атропин или гликопиролат), чтобы в результате усиленной стимуляции мАХР не возникла выраженная брадикардия, вплоть до асистолии, а также бронхоспазм, усиление деятельности ЖКТ и др.
Если необходимо устранить эффекты миорелаксантов, можно ввести a-циклодекстрин. Он связывает рокуроний и восстанавливает передачу импульса в синапсе.
Клиническое применение и токсичность сукцинилхолина и рокурония
Быстрое начало и короткая продолжительность действия сукцинилхолина позволяют применять его в своей практике анестезиологам и опытным реаниматологам. Также препарат используют в электроимпульсной терапии. Время начала действия рокурония 90 сек) приближается к таковому у сукцинилхолина, а продолжительность действия более длительная. Таким образом, препарат можно использовать при наличии противопоказаний к сукцинилхолину.
Недостаточность в плазме псевдохолинэстеразы — относительное противопоказание к применению сукцинилхолина, а предрасположенность к злокачественной гипертермии или наличие риска гиперкалиемии — абсолютное.
Рокуроний имеет несколько недостатков. Например, он не понижает давление и не вызывает высвобождение гистамина (как делают бензилизохинолины, например d-тубокурарин) и повышает частоту сердечных сокращений (как панкуроний). Больные с миастенией гравис (аутоиммунное заболевание, характеризующееся выработкой антител к нАХР) очень чувствительны к антидеполяризущим миорелаксантам.
Атракурий и цисатракурий находятся в сфере интересов исследователей, поскольку разрушаются путем деградации Гофмана.
МЕСТНАЯ АНЕСТЕЗИЯ
Местная (региональная) анестезия является альтернативой общей анестезии при хирургии конечностей или нижней части живота. Выбор делают в зависимости от операции, опыта хирурга и анестезиолога, состояния и предпочтения больного. Техники местной блокады можно комбинировать с общей анестезией, чтобы снизить концентрацию используемого общего анестетика, а также для улучшения послеоперационной анальгезии. Однако для некоторых хирургических манипуляций (кесарево сечение, трансуретральная простатэктомия, хирургия бедра и колена у взрослых) местная анестезия не всегда безопаснее общей. При ее неэффективности необходимо использовать общую.
Региональной анестезии достигают различными методами:
- местной анестезией;
- местной инфильтрацией;
- блокадой периферического нерва;
- в/в местной анестезией;
- эпидуральной анестезией;
- спинальной анестезией.
В двух последних методах в растворы местных анестетиков часто включают опиоиды, т.к. периферические и спинальные опиоидные рецепторы участвуют в образовании чувства боли.
Местные анестетики
Историческая справка, механизм действия и химические преобразования
Местные обезболивающие свойства кокаина были обнаружены в конце XIX в. Прокаин и лидокаин были синтезированы в 1905 и 1943 гг.
Основой химической структуры многих других анестетиков является липофильное ароматическое кольцо с гидрофильным четвертичным анионом, отделенным гидрокарбонатной цепью. Она связана с липофильным компонентом амидной или эфирной связью, и этот факт лежит в основе классификации местных анестетиков на сложные эфиры и замещенные амиды. Эфиры (кокаин, прокаин, тетракаин, бензокаин) метаболизируются плазматической и печеночной холинэстеразой с образованием потенциального аллергена — парааминобензойной кислоты. Для сравнения амиды (лидокаин, мепивакаин, бупивакаин, этидокаин, прилокаин и ропивакаин) более медленно метаболизируются в печени и редко вызывают аллергическую реакцию. Главные характеристики лидокаина и бупивакаина приведены в табл. 21.6.
Таблица 21.6 Сравнительная фармакология и фармакокинетика лидокаина и бупивакаина
|
Характеристики |
Лидокаин |
Бупивакаин |
|
Класс |
Замещенный |
Замещенный |
|
амид |
амид | |
|
рКа |
7,9 |
8,1 |
|
Начало действия |
Быстрое |
Медленное |
|
Связывание с белком (%) |
70 |
95 |
|
Длительность анестезии (час) |
1-2 |
4-8 |
|
Растворимость в липидах |
2,9 |
28 |
|
Потенциал |
1 |
4 |
Местные анестетики блокируют генерацию потенциалов действия и проведение возбуждения по аксонам нейронов, а также нейронные потенциалзависимые натриевые каналы. Полагают, что точкой приложения их действия являются внутриклеточные аспекты работы натриевых каналов. Местные анестетики в незаряженной форме проходят через нейрональную мембрану, а внутри приобретая заряд, связываются с каналом и блокируют его. Существуют природные блокаторы потенциал-зависимых натриевых каналов: тетродотоксин иглобрюхов и сакситоксин динофлагеллятов, вызывающих паралич у моллюсков. Молекулы этих веществ связываются с внеклеточным участком канала.
рКа — характеристика способности местным анестетиков связывать белки и растворяться в липидах, определяющая начало и длительность действия и потенциал. Поскольку они являются слабыми основаниями с рКа 8-9, превышающим физиологический уровень pH 7,4, большая их часть изначально находится в заряженной форме в нормальной ткани в нормальных физиологических условиях. Местные анестетики с рКа, близким pH 7,4, будут действовать быстрее, т.к. они находятся в незаряженной липидорастворимой форме, ко торая легко диффундирует в тканях и проходит через нейрональные мембраны, где уже приобретет заряд. Высокий рКа большинства синтетических анестетиков объясняет, почему они неэффективна в инфицированных тканях, где среда кислая молекулы препарата имеют заряд.
Местные анестетики, обладающие выраженной способностью к связыванию с белками, присоединяются к белковому компоненту нейрональной мембраны и больше не действуют по назначению. Способность же растворяться в липидах увеличивает потенциал. Физиологические и анатомические факторы тоже играют свою роль. Например, не большой размер и недостаток миелинизации приводит к тому, что небольшие волокна, отвечающие за проведение болевого и температурного импульсов, чувствительнее к блокаде, чем более крупные волокна, проводящие тактильный и двигательный импульсы.
Послеоперационные осложнения анестезии
- Общая анестезия и/или опиоиды: угнетение ЦНС (преимущественно дыхательного центра), тошнота и рвота, аспирация
- Эпидуральная и спинальная анестезия: задержка мочи, гипотензия
- Спинальная анестезия: головная боль, связанная с положением тела
- Во время операции: периферические параличи
- Сукцинилхолин: миалгия и гиперкалиемия
- Опиоиды: подавление кашлевого рефлекса, приводящее к пневмонии из-за задержки секрета
Влияние вазоконстрикторов на фармакокинетику и фармакодинамику местных анестетиков
Можно увеличить длительность действия местных анестетиков, добавив вазоконстриктор, например эпинефрин. Следует помнить, что эпинефринсодержащие растворы нельзя вводить подкожно, в пальцы, нос, уши, половые органы из-за риска развития гангрены. В принципе, системная абсорбция введенного анестетика зависит от васкуляризации места инъекции, наличия или отсутствия эпинефрина, дозы и свойств самого препарата.
Клиническое применение и токсичность местных анестетиков
Для компенсации слабого действия лидокаин назначают в более высоких концентрациях, чем бупивакаин. В то же время лидокаин обладает более ранним началом и короткой продолжительностью действия. В случаях, когда исчезает болевая чувствительность, но сохраняется тактильная, беспокойные больные жалуются на недостаточную анестезию. Седация может способствовать эффекту местной анестезии.
При выполнении местной анестезии должны быть доступны средства для общего наркоза, аналептики и аппараты для реанимации. Системная токсичность местных анестетиков проявляется эпилептическими приступами и нарушением сердечной деятельности. Высокая концентрация анестетика в позвоночнике может привести к остановке сердца и дыхания.
СЕДАЦИЯ
Седация (обезболивание с сохранением сознания) посредством в/в введения бензодиазепинов и/или пропофола с опиоидами или без них позволяет многим больным переносить неприятные диагностические и лечебные процедуры, устраняя боль и беспокойство. В идеале отсутствие страха снижает потребность в обезболивании, что позволяет больному сотрудничать с хирургом и анестезиологом. К сожалению, больные могут внезапно терять сознание в связи с чрезмерным введением седативного препарата. Бессознательное состояние может быть связано с непроходимостью дыхательных путей и угнетением дыхания, что должно быть немедленно устранено для исключения гипоксемического поражения мозга или остановки сердца. Чтобы свести к минимуму этот риск, предоперационная подготовка включает голодание. В ходе анестезии всегда нужно использовать кислород. Подверженный риску больной должен быть готов к мониторингу кислородного статуса с помощью пульсового оксиметра, артериального давления и отвечать на вопросы врача во время процедуры и после нее.
Внутривенное введение бензодиазепинов и их антагонистов
Внутривенно бензодиазепины (диазепам, мидазолам; см. главу 8) назначают попеременно в разных дозах для обеспечения седации во время манипуляций и при интенсивной терапии. Бензодиазепины могут снижать память. Амнезия может быть полезной, если длится недолго, и нежелательной, если продолжается в течение нескольких часов.
Угнетение дыхания и кровообращения, вызванное бензодиазепинами, обычно минимально, если опиоиды и другие депрессанты ЦНС используют в разумных количествах. Для пожилых людей дозу необходимо снижать. Флумазенил, конкурентный антагонист бензодиазепиновых рецепторов, используют для уменьшения избыточной седации. Может потребоваться повторное введение, поскольку его период полувыведения в два раза меньше.
Безопасность во время внутривенной седации и анальгезии
- Сознание: контроль третьим лицом
- Дыхательные пути: голодание с целью предотвратить аспирацию в момент отсутствия сознания
- Дыхание: дополнительный кислород и пульсовая оксиметрия
- Кровообращение: в/в доступ для срочного введения лекарственных средств
ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Сильная неуправляемая боль в послеоперационном периоде ассоциируется с ухудшением течения основного заболевания и даже смертью. Например, после эндоторакальных и эндоабдоминальных операций могут развиться гипоксемия и пневмония, если боль мешает полноценной экскурсии грудной клетки и откашливанию секрета. Вдобавок повреждение тканей инициирует стрессорные реакции. В зависимости от степени повреждения тканей и состояния пациента применяют одну или несколько групп препаратов и манипуляций: наркотические анальгетики парентерально, эпидурально и/или интратекально; местную анестезию; НПВС. Боль и наркотические анальгетики описаны в главе 8.
Нежелательные эффекты наркотических анальгетиков: тошнота и рвота, задержка мочи, крапивница, зуд, седация и угнетение дыхания. Они уменьшают рефлекторный ответ на повышение углекислого газа в крови и ликвидируют ответ на гипоксемию. Хотя вероятность полной остановки дыхания очень низкая, больной должен находиться под наблюдением, пока существует угроза для его жизни. Должны быть доступны ИВА, кислород, налоксон (антагонист опиоидных рецепторов), пульсовая оксиметрия.
Внутримышечное и внутривенное введение опиоидов
Препарат при в/м введении начинает действовать позднее (по сравнению с в/в введением). Возможны большие колебания концентрации препарата в крови. Повторное в/м введение каждые 3-4 час вызывает попеременно передозировку и недостаточность. В фазу передозировки велика вероятность побочных эффектов, а при малой концентрации препарата обезболивание будет недостаточным.
Когда вводят в/в ударную дозу наркотического анальгетика, сопровождаемую длительной в/в инфузией, вероятность развития побочных эффектов в ходе общей анестезии ниже, чем в случае многократного введения, т.к. не происходит резких колебаний концентрации препарата в крови. Однако у детей такие вливания могут завершиться летальным исходом. Кроме того, мониторинг состояния больного возможен, когда пациент находится в сознании, следовательно, нужно либо снижать скорость вливания во время отдыха и сна с целью предотвращения угнетения дыхания, либо назначать ударные дозы, чтобы снимать боль непосредственно перед ходьбой и физиотерапией.
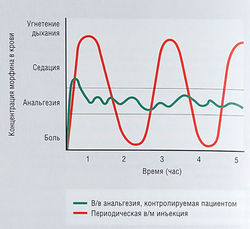
Обезболивание, контролируемое пациентом
Этот вид обезболивания предпочитают и пациенты, и медицинский персонал (рис. 21.3). Когда обезболивание контролирует медсестра, больному приходится сообщать медсестре о наличии болей и ждать инъекции. Для обезболивания, контролируемого самим пациентом, он получает специальное устройство. Аппарат сконструирован таким образом, что риск передозировки сведен к минимуму, т.к. доза наркотика, который больной может сам себе назначить, ограничена. Например, аппарат выделяет максимально возможную дозу только по прошествии определенного времени с момента последнего приема. Кроме того, можно запрограммировать аппарат на лимит 4-часовой дозы.
Рис. 21.3 Концентрация в крови и эффективность морфина при внутривенной анальгезии, контролируемой пациент, по сравнению с внутримышечным введением морфк: (предоставлено Pat Sullivan) [Anaesthesia for Medical Studen: Ottawa Ciyic Hospital, 1999].
РЕАНИМАЦИЯ И ИНТЕНСИВНАЯ ТЕРАПИЯ
Быстрое осуществление мер, направленное на поддержание жизни, имеет решающее значение, ее больной без сознания. Чрезвычайно важно поддет живать проходимость дыхательных путей. Так же как гипоксемия, ведущая к повреждению мозга остановке сердца или смерти, гиперкар бия у больных с обширными внутричерепными повреждение ми может вызвать церебральную вазодилатацию, повышение внутричерепного давления и усугубить ишемию. Дыхание нужно поддерживать для осуществления доставки к тканям кислорода и выведения углекислого газа. Если больной длительное время остается без сознания, применяют интубацию. Больных с множественными травмами или с угрожающими жизни повреждениями подключают к системе ИВА (рис. 21.4). Например:
- сдавливающие повреждения грудной клетки или пневмония вызывают ателектаз и гипоксическую гипоксемию;
- кровотечение снижает кислородную емкость крови и приводит к анемической гипоксемии;
- неадекватный кровоток из-за сосудистых нарушении приводит к развитию ишемическои гипоксемии.
Мониторинг реанимации и анестезии
- ЦНС: сознание
- Дыхание: частота дыхания, пульсовая оксиметрия, капнометрия, исследование газов в артериальной крови
- Кровообращение: частота сердечных сокращений, артериальное давление, ЭКГ, выведение мочи
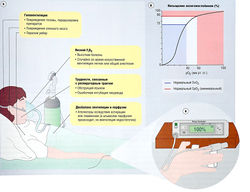
Рис. 21.4 Гипоксемия, насыщение кислородом гемоглобина и мониторинг, (а) Возможные причины гипоксемии. Нормальная ок-сигенация предполагает достаточное количество вдыхаемого кислорода, проходимость дыхательных путей, интактный центр дыхания, иннервируемую и стабильную стенку грудной клетки, вентиляцию и перфузию в альвеолах и адекватный сердечный выброс, (б) Кривая диссоциации оксигемоглобина (02НЬ). Кривая диссоциации 02НЬ описывает соотношение между величиной сатурации гемоглобина кислородом и величиной парциального давления кислорода (р02) в крови. Плоский сверху участок сигмовидно изогнутой кривой говорит о почти максимальном насыщении кислородом. Насыщение кислородом составляет 90% при р02 = 60 мм рт. ст. и около 100%, когда р02 составляет 100 мм рт. ст. и выше, (в) Пульсовую оксиметрию проводят с помощью неинвазивного монитора, выявляющего содержание кислорода в артериальной крови и адекватность пульсирующей перфузии. Пульсовая оксиметрия показывает адекватность кровотока. F02 — фракция вдыхаемого кислорода; Sa02 — насыщение артериальной крови гемоглобином; Sv02 — насыщение венозной крови гемоглобином.
Удаление углекислого газа может быть ослаблено, например, из-за снижения экскурсии грудной клетки при черепно-мозговой травме или травме грудной клетки. Управление подобными состояниями включает оксигенотерапию и мониторинг состояния больного.
Оксигенотерапия и искусственная вентиляция легких
Аппарат, осуществляющий снабжение кислородом, обеспечивает различные фракции вдыхаемого кислорода (FiO2), смешанного с воздухом помещения. Кислород может подаваться через носовые канюли (FiO2 0,24-0,4 со скоростью подачи кислорода 1-6 л/мин) или через маску (FiO2 0,4-0,6 со скоростью подачи кислорода 5-8 л/мин). Токсическое действие кислорода на легкие возможно при длительном использовании и при высоком парциальном давлении кислорода (например, при FiO2 = 1,0 в течение 12 час).
Поскольку важным моментом в ходе процедуры является подача кислорода, необходимо удостовериться, что доставка его к тканям (DO2) соответствует значениям сердечного выброса и кислородной емкости крови. Кислородная емкость крови зависит от парциального давления артериального кислорода, содержания гемоглобина и его насыщения. Сердечный выброс обусловлен объемом сердца и частотой сердечных сокращений. Это соотношение позволяет четко определить и скорректировать причины гипоксемии. Необходимость ИВА у больных с травмами головы или грудной клетки очевидна, но диагностика острой и прогрессирующей дыхательной недостаточности у больных с уже имеющимися сердечно-сосудистыми заболеваниями сложна. Нарастающая частота дыхания, увеличение концентрации углекислого газа и снижение кислорода в артериальнои-крови могут помочь при ранней диагностике. Интубация и ИВЛ сопряжены с риском, поскольку в состоянии наркоза возможна остановка дыхания и сердцебиения. Хотя анестетики, миорелаксанты и интубация достаточно хорошо способствуют адекватной вентиляции, лучше применять наркотические анальгетики и бензодиазепины.
Устранение гемодинамических нарушений
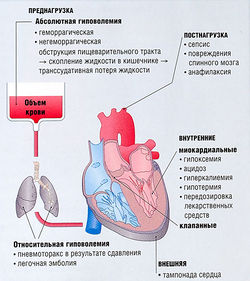
Рис. 21.5 Факторы, ответственные за острую недостаточность кровообращения и вызывающие неадекватную пред-и постнагрузку, а также нарушения насосной функции сердца.
Доставка кислорода к тканям зависит от состояния системы кровообращения. Острое нарушение кровообращения (рис. 21.5) происходит из-за:
- гиповолемии (снижение преднагрузки);
- нарушения сердечной деятельности (изменений ЧСС, снижения силы сокращений, аритмии, нарушения функции клапанов). Септический шок, развивающийся после выброса вазоактивных веществ, вызывает гиповолемию путем вазодилатации и повышения проницаемости капилляров. Для устранения гемодинамических нарушений необходим контроль ЧСС, артериального и центрального венозного давления. Хотя зачастую гиповолемия вызвана кровотечением, встречаются и негеморрагические гиповолемии и кардиогенный шок. Например, у взрослых с обструкцией двенадцатиперстной кишки она связана с аккумуляцией желудочного сока, последующим сепсисом, приводящим к нарушению кровообращения и проявляющимся тахикардией, а также гипоперфузией коронарных сосудов и даже инфарктом миокарда.
Здоровый взрослый организм может компенсировать геморрагические потери до 15% ОЦК (т.е. 15% х 70 мл/кг) за счет увеличения сердечного выброса. Однако симпатические рефлексы, отвечающие за эту компенсацию, во время наркоза угнетены, и может произойти стремительное падение артериального давления и перфузии тканей. Таким образом, важно восстановить ОЦК перед анестезией, поскольку у большинства больных до операции потеря объема крови составляет около 30%.
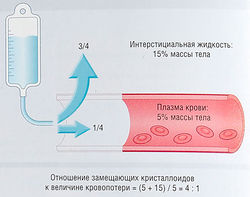
Рис. 21.6 Внеклеточный жидкостный компартмент крс кровопотеря и жидкие кровезаменители. Вода и электрол: свободно диффундируют между плазмой и интерстициальй§ жидкостью через поры в капиллярах. При геморрагиях вода электролиты выходят из интерстициального пространства и пешШ мещаются в сосуды. Кровопотерю возмещают физиологическ раствором или раствором Рингера, 3/4 введенного раствора пеЩ мещается впоследствии из сосудистого русла в интерстициальь; пространство. Для компенсации кровопотери количество солее.: раствора должно превышать величину кровопотери в 4 раза.
Инфузионная терапия и гемотрансфузия
Для успешного лечения острой недостаточности кровообращения необходимо сначала восстановить ОЦК (при условии, что вентиляция легких адекватная). При остром шоке назначают инотропные и вазодилатирующие препараты вместе с растворами для инфузий. Немедленный хирургический контроль за кровотечением — это лучшее лечение. При гиповолемии инфузионную терапию назначают сразу же. Растворы для инфузий представляют собой растворы электролитов в изотонической концентрации. Терапию проводят четырехкратно, пока не начинается быстрое перераспределение воды и ионов из сосудистого русла в ЖКТ (рис. 21.6).
|
Таблица 21.7 Мишени при лечении острого нарушения кровообращения | |
|
Мишень |
Поддерживающая терапия |
|
Основное жизнеобеспечение |
Оксигенация, вентиляция, закрытый массаж сердца и дефибрилляция при остановке сердца |
|
Преднагрузка | |
|
Гиповолемия |
Инфузия растворов электролитов и коллоидов |
|
Низкая кислородная емкость крови |
Эритроцитарная масса |
|
Коагулопатия |
Замороженная плазма, тромбоцитарная масса |
|
Сердце | |
|
Брадикардия |
Атропин, дофамин, эпинефрин |
|
Острая тахикардия |
Фармакологическая или электрическая кардиоверсия |
|
Низкий сердечный выброс |
Эфедрин, дофамин, добутамин |
|
Аритмии |
Снижение преднагрузки: нитропруссид натрия, нитроглицерин Антиаритмические средства (см. главу 13) |
|
Постнагрузка | |
|
Низкое мозговое и сердечное перфузионное давление |
Вазопрессоры: фенилэфрин, дофамин, эпинефрин, норэпинефрин |
Плазмо- и кровезаменители
Если при проведении инфузионной терапии у больного с острым гиповолемическим шоком давление не повышается, ему назначают синтетические или природные коллоидные растворы. Они имеют то же онкотическое давление, что и плазма, и так же распределяются внутри сосудов. В идеале препараты крови не используют для одноразового поднятия давления из-за иммунологических и инфекционных осложнений гемотрансфузий.
Наблюдение за замещением жидкости
Ответ системы кровообращения на кровезамещающую терапию принято оценивать по частоте сердечных сокращений, артериальному давлению и объему выделяемой мочи.
Иногда для определения объемного статуса и сердечного выброса используют инвазивные методы (например, измерение центрального венозного давления, давления легочной артерии). Концентрация гемоглобина в крови не является надежным показателем кровопотери.
По достижении стабильного состояния снижение гемоглобина на 10 г/л эквивалентно одной единице кровопотери (500 мл крови или 300 мл эритроци-тарной массы) у взрослого с массой тела 70 кг.
Если донорскую кровь разделяют на составные элементы, замещение 50% ОЦК растворами, неплазменными коллоидами, эритроцитами приведет к дилюции тромбоцитов и факторов свертывания.
Средства для жизнеобеспечения
Если гипотония и низкое мочевыделение сохраняются несмотря на проведение инфузионной терапии, назначают симптоматическое лечение:
- бикарбонат натрия при ацидозе;
- антибиотики при сепсисе;
- инотропные средства при снижении сердечного выброса, сопровождающемся (или несопрово-ждающемся) снижением постнагрузки;
- сосудорасширяющие средства для обеспечения адекватной перфузии мозга и сердца.
Если после восстановления кровообращения состояние пациента улучшилось, необходимо выявить основную причину и начать терапию без промедления. Лекарственные средства перечислены в табл. 21.7.
Читайте также
Литература
- American Heart Association. ACLS Provider Manual; 2004.
- Brenner M, Safani M (eds). Critical Care Medicine. Laguna Hill, CA: CCS Publishing; 2005.
- Evers AS, Maze M (eds). Anesthetic Pharmacology - Physiological Principles and Clinical Practice. Philadelphia: Churchill Livingstone; 2004. [A standard text on the subject.]
- Guidelines 2000 for cardiopulmonary resuscitation and emergency cardiovascular care: international consensus on science. Circulation 2000; 102 (8 Suppl). [A multi-authored consensus manual of both cardiac and noncardiac resuscitation.]
- Morgen EC, Mikhail MS, Murray MJ (eds). Clinical Anaesthesiology, 3rd edn. New York: *McGraw-Hill; 2001. [A good, easily readable introductory text with the 4th edn. due in 2005.]