Пенициллины — различия между версиями
Zabava (обсуждение | вклад) (→Механизмы действия пенициллинов и цефалоспоринов) |
Dormiz (обсуждение | вклад) (→Другие побочные эффекты) |
||
| (не показаны 3 промежуточные версии 1 участника) | |||
| Строка 20: | Строка 20: | ||
==== Полусинтетические пенициллины ==== | ==== Полусинтетические пенициллины ==== | ||
| − | Вскоре ученые обнаружили, что если удалить из среды, на которой выращивают Penicillium chrysogenum, предшественники боковых радикалов, то впоследствии из нее можно выделить 6-аминопенициллановую кислоту. Присоединяя затем к молекуле этой кислоты другие боковые радикалы, можно получить пенициллины, отличающиеся по чувствительности к β-лактамазам, антимикробной активности и другим фармакологическим свойствам. Сегодня 6-аминопенициллановую кислоту получают в больших количествах из Penicillium chrysogenum, используя для этого бактериальную амидазу. Этот фермент расщепляет пептидную связь, которая соединяет боковой радикал с 6-аминопенициллановой кислотой (рис. 45.1). | + | Вскоре ученые обнаружили, что если удалить из среды, на которой выращивают Penicillium chrysogenum, предшественники боковых радикалов, то впоследствии из нее можно выделить 6-аминопенициллановую кислоту. Присоединяя затем к молекуле этой кислоты другие боковые радикалы, можно получить пенициллины, отличающиеся по чувствительности к β-лактамазам, антимикробной активности и другим фармакологическим свойствам. Сегодня 6-аминопенициллановую кислоту получают в больших количествах из Penicillium chrysogenum, используя для этого бактериальную амидазу. Этот фермент расщепляет пептидную связь, которая соединяет боковой радикал с 6-аминопенициллановой кислотой (рис. 45.1).[[Image:Gmt45_1.jpg|250px|thumb|right|Таблица 45.1. Химическое строение и основные свойства пенициллинов]][[Image:Gmt45_1_1.jpg|250px|thumb|right|Таблица 45.1(окончание). Химическое строение и основные свойства пенициллинов]] |
=== Единицы активности пенициллинов === | === Единицы активности пенициллинов === | ||
| Строка 38: | Строка 38: | ||
На второй стадии происходит полимеризация УДФ-ацетил-мурамил-пентапептида и УДФ-ацетилглюкозамина с освобождением уридиновых нуклеотидов. | На второй стадии происходит полимеризация УДФ-ацетил-мурамил-пентапептида и УДФ-ацетилглюкозамина с освобождением уридиновых нуклеотидов. | ||
| − | На третьей, последней, стадии формируются пептидные мостики. Это происходит за пределами цитоплазматической мембраны путем транспептидирования; катализатором служит фермент транспептидаза, связанный с цитоплазматической мембраной. Концевой глициновый остаток пентаглицинового мостика соединяется с четвертым остатком пентапептида (D-аланином) с освобождением пятого остатка (также D-аланина) (рис. 45.2). Именно на этой стадии действуют β-лактамные и гликопептидные (например, ванкомицин) антибиотики, препятствуя синтезу пептидогликана (конкретные механизмы действия гликопептидных и β-лактамных антибиотиков отличаются; см. гл. 46). Пенициллины и D-Ала—D-Ала обладают пространственным сходством (Waxman et al., 1980; Kelly et al., 1982). Предположительно, пенициллины образуют ацильную связь с активным центром транспептидазы и тем самым необратимо ингибируют ее. При этом связь —СО—N— в р-лактамном кольце разрывается, и образуется пенициллоиновая группа. | + | На третьей, последней, стадии формируются пептидные мостики. Это происходит за пределами цитоплазматической мембраны путем транспептидирования; катализатором служит фермент транспептидаза, связанный с цитоплазматической мембраной. Концевой глициновый остаток пентаглицинового мостика соединяется с четвертым остатком пентапептида (D-аланином) с освобождением пятого остатка (также D-аланина) (рис. 45.2). Именно на этой стадии действуют β-лактамные и гликопептидные (например, ванкомицин) антибиотики, препятствуя синтезу пептидогликана (конкретные механизмы действия гликопептидных и β-лактамных антибиотиков отличаются; см. гл. 46). Пенициллины и D-Ала—D-Ала обладают пространственным сходством (Waxman et al., 1980; Kelly et al., 1982). Предположительно, пенициллины образуют ацильную связь с активным центром транспептидазы и тем самым необратимо ингибируют ее. При этом связь —СО—N— в р-лактамном кольце разрывается, и образуется пенициллоиновая группа.[[Image:Gm45_3.jpg|250px|thumb|right|Рисунок 45.3. Клеточная стенка бактерий.]] |
Транспептидазы — это только один вид белков, на которые действуют β-лактамные антибиотики. В совокупности все эти белки называются пенициллинсвязывающими белками (Spratt, 1980; Ghuysen, 1991). Они есть у всех бактерий — например, у Staphylococcus aureus их четыре, а у Escherichia coli — по крайней мере семь. Со всеми этими белками β-лактамные антибиотики связываются ковалентно, хотя и с разной скоростью. Под действием антибиотика происходит инактивация пенициллинсвязывающих белков, что так или иначе приводит к повреждению бактерии. Самые крупные пенициллинсвязывающие белки Escherichia coli (la и lb) — уже упоминавшиеся транспептидазы — завершают синтез пептидогликана. При их инактивации бактерии принимают форму шариков и разрываются. Пенициллинсвязываюший белок 2 также участвует в поддержании формы бактерии, однако при его инактивации бактерия разрушается медленнее, чем при инактивации транспептидаз. Пенициллинсвязывающий белок 3 необходим для образования клеточной перегородки при делении. При его инактивации неразделившиеся бактерии принимают вид длинных тонких нитей. Есть и другие механизмы гибели бактерий. Так, пенициллины нарушают равновесие между синтезом пептидогликана и его разрушением эндогенными пептидогликангидролазами (ауто-лизинами), при этом наступает аутолиз бактерий. Кроме того, пенициллины взаимодействуют с белками цитоплазматической мембраны бактерий, напоминающими белки-холины, — в результате бактериальная клетка деполяризуется (Bayles, 2000). | Транспептидазы — это только один вид белков, на которые действуют β-лактамные антибиотики. В совокупности все эти белки называются пенициллинсвязывающими белками (Spratt, 1980; Ghuysen, 1991). Они есть у всех бактерий — например, у Staphylococcus aureus их четыре, а у Escherichia coli — по крайней мере семь. Со всеми этими белками β-лактамные антибиотики связываются ковалентно, хотя и с разной скоростью. Под действием антибиотика происходит инактивация пенициллинсвязывающих белков, что так или иначе приводит к повреждению бактерии. Самые крупные пенициллинсвязывающие белки Escherichia coli (la и lb) — уже упоминавшиеся транспептидазы — завершают синтез пептидогликана. При их инактивации бактерии принимают форму шариков и разрываются. Пенициллинсвязываюший белок 2 также участвует в поддержании формы бактерии, однако при его инактивации бактерия разрушается медленнее, чем при инактивации транспептидаз. Пенициллинсвязывающий белок 3 необходим для образования клеточной перегородки при делении. При его инактивации неразделившиеся бактерии принимают вид длинных тонких нитей. Есть и другие механизмы гибели бактерий. Так, пенициллины нарушают равновесие между синтезом пептидогликана и его разрушением эндогенными пептидогликангидролазами (ауто-лизинами), при этом наступает аутолиз бактерий. Кроме того, пенициллины взаимодействуют с белками цитоплазматической мембраны бактерий, напоминающими белки-холины, — в результате бактериальная клетка деполяризуется (Bayles, 2000). | ||
| Строка 44: | Строка 44: | ||
=== Механизмы устойчивости бактерий к пенициллинам и цефалоспоринам === | === Механизмы устойчивости бактерий к пенициллинам и цефалоспоринам === | ||
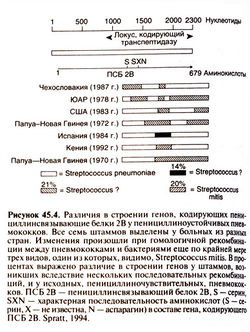
| − | Пенициллинсвязывающие белки есть у большинства, если не у всех, бактерий. Тем не менее β-лактамные антибиотики не способны уничтожить или хотя бы подавить рост всех бактерий без остатка. Причина тому — устойчивость к этим препаратам. Бактерии некоторых видов всегда устойчивы к β-лактамным антибиотикам — пенициллинсвязывающие белки этих микроорганизмов не соответствуют данным препаратам по структуре. Такое несоответствие может быть приобретенным; в этих случаях бактерии вырабатывают высокомолекулярные пенициллинсвязывающие белки с более низким сродством к β-лактамным антибиотикам. Поскольку β-лактамные антибиотики взаимодействуют с разными пенициллинсвязываюшими белками одной и той же бактерии, то для того, чтобы возникла устойчивость, должно снизиться сродство к β-лактамным антибиотикам сразу у нескольких таких белков. Это возможно при гомологичной рекомбинации, когда между бактериями разных видов происходит обмен генами, кодирующими пенициллинсвязывающие белки. Именно за счет гомологичной рекомбинации снизилось сродство к пенициллинам четырех из пяти высокомолекулярных пенициллинсвязывающих белков у наиболее устойчивых к β-лактамным антибиотикам штаммов Streptococcus рпеumoniae (рис. 45.4). Некоторым штаммам для приобретения устойчивости к цефалоспоринам третьего поколения потребовалось изменить лишь два высокомолекулярных пенициллинсвязывающих белка из пяти, поскольку остальные три обладали исходно низким сродством к препаратам этой группы. У Streptococcus sanguis и других зеленящих стрептококков устойчивость к пенициллинам возникла, очевидно, путем гомологичной рекомбинации со Streptococcus pneumoniae. При этом зеленящие стрептококки приобрели способность синтезировать пенициллинсвязывающие белки с низким сродством к пенициллинам (Carratala et al., 1995). Staphylococcus aureus приобрел устойчивость к метициллину с появлением способности синтезировать новый высокомолекулярный пенициллинсвязывающий белок с очень низким сродством ко всем р-лактамным антибиотикам (ген этого белка попал в клетку с транспозоном от неустановленного микроорганизма). Тот же ген обеспечивает устойчивость к метициллину у коагулазаотрицательных стафилококков (Spratt, 1994). | + | Пенициллинсвязывающие белки есть у большинства, если не у всех, бактерий. Тем не менее β-лактамные антибиотики не способны уничтожить или хотя бы подавить рост всех бактерий без остатка. Причина тому — устойчивость к этим препаратам. Бактерии некоторых видов всегда устойчивы к β-лактамным антибиотикам — пенициллинсвязывающие белки этих микроорганизмов не соответствуют данным препаратам по структуре. Такое несоответствие может быть приобретенным; в этих случаях бактерии вырабатывают высокомолекулярные пенициллинсвязывающие белки с более низким сродством к β-лактамным антибиотикам. Поскольку β-лактамные антибиотики взаимодействуют с разными пенициллинсвязываюшими белками одной и той же бактерии, то для того, чтобы возникла устойчивость, должно снизиться сродство к β-лактамным антибиотикам сразу у нескольких таких белков. Это возможно при гомологичной рекомбинации, когда между бактериями разных видов происходит обмен генами, кодирующими пенициллинсвязывающие белки. Именно за счет гомологичной рекомбинации снизилось сродство к пенициллинам четырех из пяти высокомолекулярных пенициллинсвязывающих белков у наиболее устойчивых к β-лактамным антибиотикам штаммов Streptococcus рпеumoniae (рис. 45.4). Некоторым штаммам для приобретения устойчивости к цефалоспоринам третьего поколения потребовалось изменить лишь два высокомолекулярных пенициллинсвязывающих белка из пяти, поскольку остальные три обладали исходно низким сродством к препаратам этой группы. У Streptococcus sanguis и других зеленящих стрептококков устойчивость к пенициллинам возникла, очевидно, путем гомологичной рекомбинации со Streptococcus pneumoniae. При этом зеленящие стрептококки приобрели способность синтезировать пенициллинсвязывающие белки с низким сродством к пенициллинам (Carratala et al., 1995). Staphylococcus aureus приобрел устойчивость к метициллину с появлением способности синтезировать новый высокомолекулярный пенициллинсвязывающий белок с очень низким сродством ко всем р-лактамным антибиотикам (ген этого белка попал в клетку с транспозоном от неустановленного микроорганизма). Тот же ген обеспечивает устойчивость к метициллину у коагулазаотрицательных стафилококков (Spratt, 1994).[[Image:Gm45_4.jpg|250px|thumb|right|Рисунок 45.4. Различия в строении генов, кодирующих пенициллинсвязывающие белки 2В у пенициллиноустойчивых пневмококков. ]] |
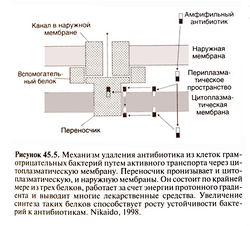
| − | + | Еще один механизм устойчивости связан с тем, что антибиотик либо плохо проникает в клетку, либо быстро удалятся из нее путем активного транспорта (Jacoby, 1994; Nikaido, 1998) (рис. 45.5). У грамположительных бактерий пептидогликан расположен очень близко к цитоплазматической мембране (рис. 45.3). У некоторых видов бактерий поверх пептидогликана находится капсула. Молекулы β-лактамных антибиотиков небольшие, поэтому они быстро достигают наружной поверхности цитоплазматической мембраны, в которую встроены пенициллинсвязывающие белки (именно здесь завершается синтез пептидогликана). Клеточная стенка грамотрицательных бактерий устроена сложнее (рис. 45.3). Кроме цитоплазматической мембраны у них имеется наружная мембрана, в состав которой входят липополисахариды. У некоторых грамотрицательных бактерий есть капсула. Существуют антибиотики, для которых наружная мембрана служит непроницаемым барьером (Nakae, 1986), хотя гидрофильные низкомолекулярные антибиотики могут проникнуть в клетку через поры наружной мембраны, образованные белками поринами. Пенициллины с широким спектром действия, например ампициллин и амоксициллин, а также большинство цефалоспоринов проходят через такие поры Escherichia coli намного быстрее, чем бензилпенициллин. Число и размер пор у разных грамотрицательных бактерий различаются. Например, Pseudomonas aeruginosa обладает природной устойчивостью к целому ряду антибиотиков, поскольку у нее отсутствуют поры с высокой проницаемостью (Nikaido,1994). У некоторых бактерий (например, Pseudomonas aeruginosa, Escherichia coli и Neisseria gonorrhoeae) устойчивость к β-лактамным антибиотикам обусловлена тем,что они быстро выводятся из клетки путем активного транспорта и не успевают подействовать на мишени (Nikaido, 1998).[[Image:Gm45_5.jpg|250px|thumb|right|Рисунок 45.5. Механизм удаления антибиотика из клеток грамотрицательных бактерий путем активного транспорта через цитоплазматическую мембрану.]] | |
| − | |||
| − | |||
| − | |||
| − | Еще один механизм устойчивости связан с тем, что антибиотик либо плохо проникает в клетку, либо быстро удалятся из нее путем активного транспорта (Jacoby, 1994; Nikaido, 1998) (рис. 45.5). У грамположительных бактерий пептидогликан расположен очень близко к цитоплазматической мембране (рис. 45.3). У некоторых видов бактерий поверх пептидогликана находится капсула. Молекулы β-лактамных антибиотиков небольшие, поэтому они быстро достигают наружной поверхности цитоплазматической мембраны, в которую встроены пенициллинсвязывающие белки (именно здесь завершается синтез пептидогликана). Клеточная стенка грамотрицательных бактерий устроена сложнее (рис. 45.3). Кроме цитоплазматической мембраны у них имеется наружная мембрана, в состав которой входят липополисахариды. У некоторых грамотрицательных бактерий есть капсула. Существуют антибиотики, для которых наружная мембрана служит непроницаемым барьером (Nakae, 1986), хотя гидрофильные низкомолекулярные антибиотики могут проникнуть в клетку через поры наружной мембраны, образованные белками поринами. Пенициллины с широким спектром действия, например ампициллин и амоксициллин, а также большинство цефалоспоринов проходят через такие поры Escherichia coli намного быстрее, чем бензилпенициллин. Число и размер пор у разных грамотрицательных бактерий различаются. Например, Pseudomonas aeruginosa обладает природной устойчивостью к целому ряду антибиотиков, поскольку у нее отсутствуют поры с высокой проницаемостью (Nikaido,1994). У некоторых бактерий (например, Pseudomonas aeruginosa, Escherichia coli и Neisseria gonorrhoeae) устойчивость к β-лактамным антибиотикам обусловлена тем,что они быстро выводятся из клетки путем активного транспорта и не успевают подействовать на мишени (Nikaido, 1998). | ||
| − | |||
| − | Рисунок 45.5. Механизм удаления антибиотика из клеток грамотрицательных бактерий путем активного транспорта через цитоплазматическую мембрану. | ||
Многие бактерии содержат ферменты, способные разрушать β-лактамные антибиотики. К ним относятся амидогидролазы, но они недостаточно активны и не обеспечивают надежной защиты бактерий. Зато концентрация β-лактамаз может быть достаточно велика, и они успешно разрушают некоторые β-лактамные антибиотики (рис. 45.1 и 45.3). Известно несколько видов β-лактамаз, но большинство бактерий вырабатывают только один вид фермента. Субстратная специфичность некоторых β-лактамаз относительно высока, поэтому их часто называют пенициллиназами или цефалоспориназами. Бета-лактамазы широкого спектра действия могут разрушать многие β-лакгамные антибиотики. Разные препараты по-разному чувствительны к β-лактамазам. | Многие бактерии содержат ферменты, способные разрушать β-лактамные антибиотики. К ним относятся амидогидролазы, но они недостаточно активны и не обеспечивают надежной защиты бактерий. Зато концентрация β-лактамаз может быть достаточно велика, и они успешно разрушают некоторые β-лактамные антибиотики (рис. 45.1 и 45.3). Известно несколько видов β-лактамаз, но большинство бактерий вырабатывают только один вид фермента. Субстратная специфичность некоторых β-лактамаз относительно высока, поэтому их часто называют пенициллиназами или цефалоспориназами. Бета-лактамазы широкого спектра действия могут разрушать многие β-лакгамные антибиотики. Разные препараты по-разному чувствительны к β-лактамазам. | ||
| Строка 369: | Строка 363: | ||
Пенициллины изменяют состав нормальной микрофлоры, вызывая гибель чувствительных микроорганизмов, — этот побочный эффект возникает независимо от пути введения, но ярче проявляется при приеме препарата внутрь. Сам по себе дисбактериоз не опасен, так как нормальная микрофлора восстанавливается обычно вскоре после окончания лечения; однако у некоторых больных он приводит к суперинфекции. Прием пенициллинов внутрь и, реже, их парентеральное введение может привести к избыточному росту Clostridium difficile, чей токсин может стать причиной псевдомембранозного колита. | Пенициллины изменяют состав нормальной микрофлоры, вызывая гибель чувствительных микроорганизмов, — этот побочный эффект возникает независимо от пути введения, но ярче проявляется при приеме препарата внутрь. Сам по себе дисбактериоз не опасен, так как нормальная микрофлора восстанавливается обычно вскоре после окончания лечения; однако у некоторых больных он приводит к суперинфекции. Прием пенициллинов внутрь и, реже, их парентеральное введение может привести к избыточному росту Clostridium difficile, чей токсин может стать причиной псевдомембранозного колита. | ||
| + | == Читайте также == | ||
| + | |||
| + | *[[Антибиотики (антимикробные средства)]] | ||
| + | **[[Выбор антибиотика]] | ||
| + | **[[Комбинированная антибиотикотерапия]] | ||
| + | **[[Профилактическая антибиотикотерапия]] | ||
| + | **[[Механизмы действия антибиотиков]] | ||
| + | *[[Антибактериальные средства]] | ||
| + | |||
| + | *[[Сульфаниламиды, триметоприм/сульфаметоксазол]] | ||
| + | *[[Хинолоны и мочевые антисептики]] | ||
| + | *[[Бета-лактамные антибиотики]] | ||
| + | **[[Цефалоспорины]] | ||
| + | **[[Карбапенемы]] | ||
| + | **[[Ингибиторы бета-лактамаз]] | ||
| + | *[[Аминогликозиды]] | ||
| + | *[[Ингибиторы синтеза белка]] | ||
| + | **[[Тетрациклины]] | ||
| + | **[[Левомицетин(хлорамфеникол)]] | ||
| + | **[[Макролиды (эритромицин, кларитромицин, азитромицин)]] | ||
| + | **[[Клиндамицин]] | ||
| + | **[[Хинупристин (дальфопристин)]] | ||
| + | **[[Линезолид]] | ||
| + | **[[Ванкомицин]] | ||
| + | |||
| + | *[[Противотуберкулезные средства (антимикобактериальные)]] | ||
| + | **[[Изониазид]] | ||
| + | **[[Рифампицин]] | ||
| + | **[[Этамбутол]] | ||
| + | **[[Стрептомицин]] | ||
| + | **[[Пиразинамид]] | ||
| + | **[[Прочие противотуберкулезные препараты]] | ||
Текущая версия на 18:06, 9 ноября 2014
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
- 1 Пенициллины
- 2 Классификация и фармакологические свойства
- 3 Природные пенициллины: бензилпенициллин и феноксиметилпенициллин
- 3.1 Антимикробная активность
- 3.2 Всасывание
- 3.3 Распределение
- 3.4 Элиминация
- 3.5 Применение
- 3.5.1 Пневмококковые инфекции
- 3.5.2 Стрептококковые инфекции
- 3.5.3 Анаэробные инфекции
- 3.5.4 Стафилококковые инфекции
- 3.5.5 Менингококковая инфекция
- 3.5.6 Гонококковая инфекция
- 3.5.7 Сифилис
- 3.5.8 Актиномикоз
- 3.5.9 Дифтерия
- 3.5.10 Сибирская язва
- 3.5.11 Клостридиальные инфекции
- 3.5.12 Инфекция Венсана
- 3.5.13 Болезнь крысиного укуса
- 3.5.14 Листериоз
- 3.5.15 Лаймская болезнь
- 3.5.16 Эризипелоид
- 3.6 Профилактическое применение
- 4 Полусинтетические пенициллины, устойчивые к пенициллиназе
- 5 Аминопенициллины: ампициллин, амоксициллин и их аналоги
- 6 Пенициллины, активные в отношении псевдомонад: карбоксипенициллины и уреидопенициллины
- 7 Побочные эффекты пенициллинов
- 8 Читайте также
Пенициллины[править | править код]
Пенициллины — одна из важнейших групп антибиотиков. Со времени появления первого пенициллина создано много других антимикробных препаратов, но природные пенициллины все еще находят широкое применение. На их основе синтезируют и новые препараты. Среди последних многие обладают уникальными свойствами, что делает антибиотики этой группы наилучшим средством лечения при целом ряде инфекционных заболеваний.
Историческая справка[править | править код]
История выдающегося научного исследования — открытия и изучения пенициллина — описана самими его участниками (Fleming, 1946; Florey, 1946, 1949; Abraham, 1949; Chain, 1954). В 1928 г., изучая различные виды стафилококков в лаборатории госпиталя Св. Марии в Лондоне, Александр Флеминг заметил, что одна из культур заражена плесневыми грибами и колонии бактерий вокруг нее погибли. Питательная среда, на которой росли грибы, заметно подавляла жизнедеятельность многих микроорганизмов. Плесневый грибок принадлежал к роду Penicillium, и Флеминг назвал антибактериальное вещество пенициллином.
Спустя 10 лет группа исследователей из Оксфордского университета под руководством Флори, Чейна и Эйбрехема получила препарат пенициллина для системного применения. К маю 1940 г. было обнаружено, что введение неочищенного пенициллина мышам, зараженным стрептококками, оказывало сильнейшее лечебное действие. Несмотря на то что получать пенициллин в лабораторных условиях было очень нелегко, к 1941 г. ученые сумели собрать достаточное количество вещества, чтобы испытать его на больных с тяжелыми стафилококковыми и стрептококковыми инфекциями, которые не поддавались лечению всеми известными тогда лекарственными средствами. Неочищенный препарат, который удавалось выделить в те годы, содержал всего 10% пенициллина, и для получения одной суточной дозы требовалось около 100 л среды, на которой выращивали плесневые грибы. Penicillium notatum выращивали тогда на подкладных суднах (Herrell, 1945). Среди больных, на которых проводили испытания в 1941 г., был полицейский с тяжелой смешанной инфекцией, вызванной стафилококками и стрептококками. Часть пенициллина, которым его лечили, была выделена из мочи других больных, получавших препарат. Говорят, что один оксфордский профессор назвал пенициллин «удивительным веществом, выращенным в подкладных суднах и пропущенным через полицию Оксфорда для очистки».
Вскоре в США началось широкомасштабное исследование пенициллина. В 1942 г. было получено 122 млн ед пенициллина, а проведенные в Йельском университете и клинике Мейо первые клинические испытания дали превосходные результаты. К весне 1943 г. пенициллином уже пролечили 200 больных. Результаты лечения были настолько впечатляющими, что главный военный врач США дал согласие на клиническое испытание пенициллина в военном госпитале. Вскоре после этого пенициллин стали применять во всех медицинских учреждениях вооруженных сил США.
Решающим шагом на пути к массовому производству пенициллина стало открытие технологии глубинных культур. Если вначале удавалось выделить менее 500 г вещества в месяц, то к 1950 г. уже получали почти 150 тонн пенициллина. Первый пенициллин на фармацевтическом рынке стоил несколько долларов за 100 000 ед, а сейчас то же количество препарата можно купить за несколько центов.
Химические свойства[править | править код]
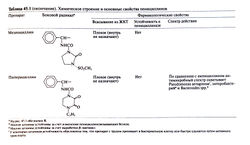
Молекула пенициллина состоит из двух колец — тиазолидинового и бета-лактамного (рис. 45.1). Вместе они составляют пенициллиновое ядро, которое обеспечивает биологическую активность пенициллинов. При малейших изменениях и структуре этой части молекулы антимикробные свойства препаратов пропадают. С бета-лактамным кольцом связан боковой радикал, определяющий многие фармакологические свойства препарата (табл. 45.1). У природных пенициллинов строение радикала зависит от состава среды, на которой растут Penicillium spp. Самой высокой антимикробной активностью среди природных пенициллинов обладает бензилпенициллин — кроме феноксиметилпенициллина, он единственный природный препарат, который применяют в лечебной практике.
Полусинтетические пенициллины[править | править код]
Вскоре ученые обнаружили, что если удалить из среды, на которой выращивают Penicillium chrysogenum, предшественники боковых радикалов, то впоследствии из нее можно выделить 6-аминопенициллановую кислоту. Присоединяя затем к молекуле этой кислоты другие боковые радикалы, можно получить пенициллины, отличающиеся по чувствительности к β-лактамазам, антимикробной активности и другим фармакологическим свойствам. Сегодня 6-аминопенициллановую кислоту получают в больших количествах из Penicillium chrysogenum, используя для этого бактериальную амидазу. Этот фермент расщепляет пептидную связь, которая соединяет боковой радикал с 6-аминопенициллановой кислотой (рис. 45.1).
Единицы активности пенициллинов[править | править код]
За единицу активности пенициллинов принимают активность 0,6 мкг натриевой соли бензилпенициллина. Таким образом, 1 мг чистой натриевой соли бензилпенициллина соответствует 1667 ед, а 1 мг чистой калиевой соли бензилпенициллина — 1595 ед. Дозу и активность полусинтетических пенициллинов рассчитывают по массе.
Механизмы действия пенициллинов и цефалоспоринов[править | править код]
Бета-лактамные антибиотики оказывают бактерицидное действие на чувствительных микроорганизмов. Механизм этого действия до конца не изучен, но полученные на сегодня данные уже позволяют понять основные его закономерности (Tomasz, 1986; Ghuysen, 1991; Bayles, 2000).
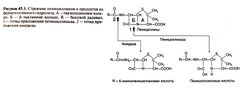
Для нормального роста и развития бактериям необходима клеточная стенка. Ее основу составляет гетерополимер пептидогликан; его сетчатая структура с перекрестными сшивками придает клеточной стенке прочность (рис. 45.2). У грамположительных бактерий клеточная стенка содержит 50—100 слоев пептидогликана, а у грамотрицательных — только 1—2 (рис. 45.3). Пептидогликан состоит из линейных полисахаридных цепочек, которые построены из чередующихся остатков моносахаридов (N-ацетилглюкозамина и N-ацетилмурамовой кислоты) и связаны между собой пептидными мостиками.
В биосинтезе пептидогликана участвуют около 30 бактериальных ферментов. Этот процесс состоит из трех этапов. Первый этап — синтез предшественника — происходит в цитоплазме. При этом образуется УДФ-ацетилмурамил-пентапептид, который называют нуклеотидом Парка в честь его первооткрывателя
Джеймса Парка (Park and Strominger, 1957). При подавлении последующих стадий синтеза УДФ-ацетилмурамил-пентапептид накапливается в клетках. Синтез нуклеотида Парка завершается присоединением дипептида D-Ала—D-Ала. Образование дипептида начинается с рацемизации L-аланина, затем, под действием D-аланил-D-аланинлигазы, происходит его конденсация. Циклосерин — структурный аналог D-аланина — является конкурентным ингибитором какаланинрацемазы, таки D-аланил-D-аланинлигазы (гл. 48).
На второй стадии происходит полимеризация УДФ-ацетил-мурамил-пентапептида и УДФ-ацетилглюкозамина с освобождением уридиновых нуклеотидов.
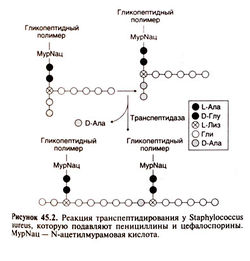
На третьей, последней, стадии формируются пептидные мостики. Это происходит за пределами цитоплазматической мембраны путем транспептидирования; катализатором служит фермент транспептидаза, связанный с цитоплазматической мембраной. Концевой глициновый остаток пентаглицинового мостика соединяется с четвертым остатком пентапептида (D-аланином) с освобождением пятого остатка (также D-аланина) (рис. 45.2). Именно на этой стадии действуют β-лактамные и гликопептидные (например, ванкомицин) антибиотики, препятствуя синтезу пептидогликана (конкретные механизмы действия гликопептидных и β-лактамных антибиотиков отличаются; см. гл. 46). Пенициллины и D-Ала—D-Ала обладают пространственным сходством (Waxman et al., 1980; Kelly et al., 1982). Предположительно, пенициллины образуют ацильную связь с активным центром транспептидазы и тем самым необратимо ингибируют ее. При этом связь —СО—N— в р-лактамном кольце разрывается, и образуется пенициллоиновая группа.
Транспептидазы — это только один вид белков, на которые действуют β-лактамные антибиотики. В совокупности все эти белки называются пенициллинсвязывающими белками (Spratt, 1980; Ghuysen, 1991). Они есть у всех бактерий — например, у Staphylococcus aureus их четыре, а у Escherichia coli — по крайней мере семь. Со всеми этими белками β-лактамные антибиотики связываются ковалентно, хотя и с разной скоростью. Под действием антибиотика происходит инактивация пенициллинсвязывающих белков, что так или иначе приводит к повреждению бактерии. Самые крупные пенициллинсвязывающие белки Escherichia coli (la и lb) — уже упоминавшиеся транспептидазы — завершают синтез пептидогликана. При их инактивации бактерии принимают форму шариков и разрываются. Пенициллинсвязываюший белок 2 также участвует в поддержании формы бактерии, однако при его инактивации бактерия разрушается медленнее, чем при инактивации транспептидаз. Пенициллинсвязывающий белок 3 необходим для образования клеточной перегородки при делении. При его инактивации неразделившиеся бактерии принимают вид длинных тонких нитей. Есть и другие механизмы гибели бактерий. Так, пенициллины нарушают равновесие между синтезом пептидогликана и его разрушением эндогенными пептидогликангидролазами (ауто-лизинами), при этом наступает аутолиз бактерий. Кроме того, пенициллины взаимодействуют с белками цитоплазматической мембраны бактерий, напоминающими белки-холины, — в результате бактериальная клетка деполяризуется (Bayles, 2000).
Механизмы устойчивости бактерий к пенициллинам и цефалоспоринам[править | править код]
Пенициллинсвязывающие белки есть у большинства, если не у всех, бактерий. Тем не менее β-лактамные антибиотики не способны уничтожить или хотя бы подавить рост всех бактерий без остатка. Причина тому — устойчивость к этим препаратам. Бактерии некоторых видов всегда устойчивы к β-лактамным антибиотикам — пенициллинсвязывающие белки этих микроорганизмов не соответствуют данным препаратам по структуре. Такое несоответствие может быть приобретенным; в этих случаях бактерии вырабатывают высокомолекулярные пенициллинсвязывающие белки с более низким сродством к β-лактамным антибиотикам. Поскольку β-лактамные антибиотики взаимодействуют с разными пенициллинсвязываюшими белками одной и той же бактерии, то для того, чтобы возникла устойчивость, должно снизиться сродство к β-лактамным антибиотикам сразу у нескольких таких белков. Это возможно при гомологичной рекомбинации, когда между бактериями разных видов происходит обмен генами, кодирующими пенициллинсвязывающие белки. Именно за счет гомологичной рекомбинации снизилось сродство к пенициллинам четырех из пяти высокомолекулярных пенициллинсвязывающих белков у наиболее устойчивых к β-лактамным антибиотикам штаммов Streptococcus рпеumoniae (рис. 45.4). Некоторым штаммам для приобретения устойчивости к цефалоспоринам третьего поколения потребовалось изменить лишь два высокомолекулярных пенициллинсвязывающих белка из пяти, поскольку остальные три обладали исходно низким сродством к препаратам этой группы. У Streptococcus sanguis и других зеленящих стрептококков устойчивость к пенициллинам возникла, очевидно, путем гомологичной рекомбинации со Streptococcus pneumoniae. При этом зеленящие стрептококки приобрели способность синтезировать пенициллинсвязывающие белки с низким сродством к пенициллинам (Carratala et al., 1995). Staphylococcus aureus приобрел устойчивость к метициллину с появлением способности синтезировать новый высокомолекулярный пенициллинсвязывающий белок с очень низким сродством ко всем р-лактамным антибиотикам (ген этого белка попал в клетку с транспозоном от неустановленного микроорганизма). Тот же ген обеспечивает устойчивость к метициллину у коагулазаотрицательных стафилококков (Spratt, 1994).
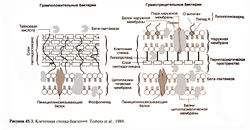
Еще один механизм устойчивости связан с тем, что антибиотик либо плохо проникает в клетку, либо быстро удалятся из нее путем активного транспорта (Jacoby, 1994; Nikaido, 1998) (рис. 45.5). У грамположительных бактерий пептидогликан расположен очень близко к цитоплазматической мембране (рис. 45.3). У некоторых видов бактерий поверх пептидогликана находится капсула. Молекулы β-лактамных антибиотиков небольшие, поэтому они быстро достигают наружной поверхности цитоплазматической мембраны, в которую встроены пенициллинсвязывающие белки (именно здесь завершается синтез пептидогликана). Клеточная стенка грамотрицательных бактерий устроена сложнее (рис. 45.3). Кроме цитоплазматической мембраны у них имеется наружная мембрана, в состав которой входят липополисахариды. У некоторых грамотрицательных бактерий есть капсула. Существуют антибиотики, для которых наружная мембрана служит непроницаемым барьером (Nakae, 1986), хотя гидрофильные низкомолекулярные антибиотики могут проникнуть в клетку через поры наружной мембраны, образованные белками поринами. Пенициллины с широким спектром действия, например ампициллин и амоксициллин, а также большинство цефалоспоринов проходят через такие поры Escherichia coli намного быстрее, чем бензилпенициллин. Число и размер пор у разных грамотрицательных бактерий различаются. Например, Pseudomonas aeruginosa обладает природной устойчивостью к целому ряду антибиотиков, поскольку у нее отсутствуют поры с высокой проницаемостью (Nikaido,1994). У некоторых бактерий (например, Pseudomonas aeruginosa, Escherichia coli и Neisseria gonorrhoeae) устойчивость к β-лактамным антибиотикам обусловлена тем,что они быстро выводятся из клетки путем активного транспорта и не успевают подействовать на мишени (Nikaido, 1998).
Многие бактерии содержат ферменты, способные разрушать β-лактамные антибиотики. К ним относятся амидогидролазы, но они недостаточно активны и не обеспечивают надежной защиты бактерий. Зато концентрация β-лактамаз может быть достаточно велика, и они успешно разрушают некоторые β-лактамные антибиотики (рис. 45.1 и 45.3). Известно несколько видов β-лактамаз, но большинство бактерий вырабатывают только один вид фермента. Субстратная специфичность некоторых β-лактамаз относительно высока, поэтому их часто называют пенициллиназами или цефалоспориназами. Бета-лактамазы широкого спектра действия могут разрушать многие β-лакгамные антибиотики. Разные препараты по-разному чувствительны к β-лактамазам.
Обычно грамположительные бактерии образуют β-лактамазы в большом количестве и секретируют их во внешнюю среду (рис. 45.3). Большая часть β-лактамаз — пенициллиназы. Гены стафилококковой пенициллиназы находятся в плазмиде, которую бактериофаги переносят от одной бактерии к другой (трансдукция). Пенициллиназа индуцируется субстратом, и иногда ее доля достигает 1% сухого веса бактерии. Грамотрицательные бактерии, наоборот, вырабатывают β-лактамазы в небольшом количестве, из клетки они не выводятся, а накапливаются в периплазматическом пространстве, между наружной и цитоплазматической мембранами (рис. 45.3). Такое расположение β-лактамаз наиболее выгодно для защиты бактерий, так как ферменты, участвующие в синтезе клеточной стенки, находятся у наружной поверхности цитоплазматической мембраны. У грамотрицательных бактерий гены, кодирующие β-лактамазы, расположены как на хромосомах, так и в плазмидах. При конъюгации плазмиды передаются от бактерии к бактерии. Сами же ферменты могут быть конститутивными или индуцируемыми. Они действуют и на пенициллины, и на цефалоспорины (Davies, 1994). Однако существуют антибиотики, чувствительные к β-лактамазам (например, карбенициллин) и все же способные вызвать гибель некоторых грамотрицательных микроорганизмов, вырабатывающих эти ферменты.
Другие факторы, влияющие на активность β-лактамных антибиотиков[править | править код]
Активность β-лактамных антибиотиков зависит от концентрации бактерий и от стадии инфекционного процесса. Исследования показали, что активность антибиотиков может быть в несколько тысяч раз выше при действии на колонии с низкой концентрацией бактерий, чем при действии на колонии с высокой концентрацией. Причин тому может быть несколько. В колониях с высокой концентрацией доля умеренно устойчивых к антибиотикам бактерий больше, больше вырабатывается β-лактамаз; играет роль и фаза роста культуры. Клиническое значение этого явления не определено. Длительность и интенсивность антибактериальной терапии зависят и от стадии инфекционного процесса. Чем позже начинают лечить зараженных лабораторных животных, тем большие дозы пенициллинов требуются и тем дольше длится лечение. Объясняется это тем, что скорость размножения бактерий выше всего в начале заболевания, а пенициллины более активны в отношении бактерий в фазе логарифмического роста. При переходе в стационарную фазу, когда синтез пептидогликана завершен, активность этих антибиотиков падает.
Присутствие белков и других компонентов гноя, низкий pH и низкое Р02 существенно не снижают активность β-лактамных антибиотиков. Но на бактерий, находящихся внутри клеток, они не действуют.
Классификация и фармакологические свойства[править | править код]
Пенициллины удобно классифицировать по спектру действия (табл. 45.1; Chambers, 2000).
Бензилпенициллин и близкий к нему феноксиметилпенициллин высокоактивны в отношении чувствительных к ним штаммов грамположительных кокков, но оба препарата легко разрушаются пенициллиназой и поэтому не действуют на большинство штаммов Staphylococcus aureus.
Пенициллины, устойчивые к пенициллиназе (метициллин, нафциллин, оксациллин, клоксацилпин и диклокса-циллин), менее активны в отношении микроорганизмов, чувствительных к бензилпенициллину, но в то же время хорошо действуют на Staphylococcus aureus и Streptococcus epidermidis, которые вырабатывают пенициллиназу и чувствительны к метициллину.
Антимикробный спектр ампициллина, амоксициллина, бакампициллина и некоторых других препаратов расширен за счет действия на грамотрицательных бактерий, таких, как Haemophilus influenzae, Escherichia coli и Proteus mira-bilis. К сожалению, как эти, так и другие, описанные ниже, препараты быстро разрушаются β-лактамазами широкого спектра действия, которые все чаще обнаруживают у выделенных от больных грамотрицательных бактерий.
Спектр действия карбенициллина, кариндациллина (инданилового эфира карбенициллина) и тикарциллина шире за счет активности в отношении Pseudomonas spp., En-terobacter spp. и Proteus spp. На грамположительных кокков и Listeria monocytogenes эти препараты действуют слабее, чем ампициллин.
Мезлоциллин, азлоциллин и пиперациллин активны в отношении Pseudomonas spp., Klebsiella spp. и некоторых других грамотрицательных бактерий. Кроме того, пиперациллин, подобно ампициллину, очень хорошо действует на грамположительные кокки и Listeria monocytogenes.
Фармакокинетика и фармакодинамика каждого препарата подробно рассмотрены ниже, здесь же мы коснемся лишь наиболее общих их фармакологических свойств. При приеме внутрь пенициллины всасываются и распределяются по всему организму, быстро достигая терапевтических концентраций в тканях и биологических жидкостях (синовиальной, плевральной, перикардиальной, желчи). Однако в секрете предстательной железы, головном мозге и водянистой влаге глаза концентрация этих препаратов низка. Почти не проникают они и в живые фагоциты. Концентрация пенициллинов в СМЖ может быть различной в зависимости от условий: в норме она не достигает и 1% сывороточной концентрации, а при воспалительном процессе может возрастать до 5%. Пенициллины быстро выводятся, в основном путем клубочковой фильтрации и канальцевой секреции. Поэтому Т1/2у них короткий (обычно 30—90 мин), а концентрация в моче — высокая.
Природные пенициллины: бензилпенициллин и феноксиметилпенициллин[править | править код]
Антимикробная активность[править | править код]
Действие бензилпенициллина и феноксиметилпенициллина на аэробные грамположительные микроорганизмы весьма сходно. Однако бензилпенициллин в 5—10 раз активнее феноксиметилпенициллина в отношении чувствительных Neisseria spp, и некоторых анаэробов.
Бензилпенициллин активен в отношении целого ряда грамположительных и грамотрицательных кокков, хотя многие бактерии, ранее чувствительные к этому препарату, теперь приобрели устойчивость. Большинство стрептококков (кроме энтерококков) высокочувствительны к бензилпенициллину; для лечения достаточно уже концентрации менее 0,01 мкг/мл. Однако все чаще встречаются пенициллиноустойчивые штаммы зеленящих стрептококков (Carratala et al., 1995) и Streptococcus pneumoniae. Так, за 1997 г. 13,6% Streptococcus pneumoniae, выделенных из стерильных в норме сред организма, оказались устойчивыми (МПК12 мкг/мл), а 11,4% — умеренно устойчивыми (МПК > 0,12 мкг/мл) (Centers for Disease Control and Prevention, 1999). Пенициллиноустойчивые пневмококки особенно часто встречаются у детей, которые посещают детские сады. На многие пенициллиноустойчивые пневмококки не действуют и цефалоспорины третьего поколения.
Когда бензилпенициллин только начали применять, Staphylococcus aureus были высокочувствительны к нему; сегодня же на 90% штаммов Staphylococcus aureus, вызывающих как больничные, так и внебольничные инфекции, этот препарат в той же концентрации не оказывает никакого действия. Устойчивы к бензилпенициллину и большинство штаммов Staphylococcus epidermidis. Все чаще встречаются штаммы гонококков, способные к выработке пенициллиназы и потому устойчивые к бензилпенициллину. Менингококки, за редким исключением, сохраняют чувствительность к этому препарату.
К бензилпенициллину чувствительны подавляющее большинство Corynebacterium diphtheriae и Bacillus anthracis, но некоторые штаммы обладают ярко выраженной устойчивостью к нему. Большинство анаэробных микроорганизмов, в том числе Clostridium spp., высокочувствительны к бензилпенициллину; исключение составляют Bacteroidesspp., многие штаммы которых защищены от действия бензилпенициллина выработкой Р-лактамаз. Это свойство приобрели и некоторые штаммы Вас-teroides melaninogenicus. Бензилпенициллин подавляет рост Actinomyces israelii, Streptobacillus moniliformis, Pasteurella multoci-da и Listeria monocytogenes. Большинство бактерий рода Leptospira умеренно чувствительны к препарату. Один из самых уязвимых микроорганизмов — Treponema pallidum. Возбудитель Лаймской болезни — Borrelia burgdorferi — также чувствителен к бензилпенициллину. На амеб, плазмодиев, риккетсий, грибы и вирусы пенициллины не действуют.
Всасывание[править | править код]
Прием бензилпенициллина внутрь[править | править код]
В ЖКТ всасывается в лучшем случае около трети бензилпенициллина. При pH 2 он быстро разрушается желудочным соком. С возрастом кислотность желудочного сока снижается, поэтому у пожилых бензилпенициллин всасывается лучше. Всасывание происходит быстро, и уже через 30—60 мин достигается максимальная сывороточная концентрация — у взрослых примерно 0,5 ед/мл (0,3 мкг/мл) при приеме внутрь 400 000 ед (около 250 мг) бензилпенициллина. При приеме во время еды всасывание бензилпенициллина замедляется, по-видимому, из-за его адсорбции на частицах пищи. Поэтому препарат назначают внутрь не менее чем за 30 мин до или через 2 ч после еды. Несмотря на удобство приема бензилпенициллина внутрь, этот путь введения надо использовать только в тех случаях, когда его эффективность доказана клиническим опытом.
Прием феноксиметилпенициллина внутрь[править | править код]
Феноксиметилпенициллин стабильнее бензилпенициллина в кислой среде и потому лучше всасывается из ЖКТ. При приеме внутрь одинаковых доз бензилпенициллина и феноксиметилпенициллина сывороточная концентрация последнего в 2—5 раз больше. У взрослых при приеме внутрь 500 мг феноксиметилпенициллина максимальная сывороточная концентрация составляет около 3 мкг/мл. Распределение и выведение феноксиметилпенициллина такие же, как у бензилпенициллина.
Парентеральное введение бензилпенициллина[править | править код]
При в/м введении максимальная сывороточная концентрация бензилпенициллина достигается через 15—30 мин. Но затем она быстро снижается, так как Т,/2 препарата составляет всего 30 мин.
Уменьшить частоту инъекций можно, увеличив время пребывания антибиотика в организме. Так, пробенецид блокирует канальцевую секрецию и замедляет выведение пенициллинов, но с этой целью его используют нечасто (см. ниже). Обычно назначают бензилпенициллин длительного действия. В настоящее время отдают предпочтение двум препаратам: прокаинбензилпенициллину и бензатинбензилпенициллину. Образуя депо в месте инъекции, они медленно высвобождают бензилпенициллин и обеспечивают относительно низкую, но постоянную сывороточную концентрацию препарата.
Растворимость прокаинбензилпенициллина в воде — лишь
0,4%, его применяют в виде водной суспензии. Препарат содержит эквимолярные количества прокаина и бензилпенициллина; на 300 000 ед прокаинбензилпенициллина приходится примерно 120 мг прокаина. При введении больших доз прокаинбензилпенициллина (например, 4,8 млн ед) сывороточная концентрация прокаина может достигнуть токсического уровня. Если есть основания предполагать аллергию к прокаину, то сначала вводят 0,1 мл 0,1% раствора прокаина внутрикожно. Поскольку прокаин — это местный анестетик, инъекции прокаинбензилпенициллина практически безболезненны.
После введения 300 000 ед прокаинбензилпенициллина максимальная сывороточная концентрация бензилпенициллина (около 0,9 мкг/мл) достигается через 1 —3 ч, за сутки она снижается до 0,1 мкг/мл, а через 2 сут составляет всего 0,03 мкг/мл. При увеличении дозы прокаинбензилпенициллина до 600 000 ед сывороточная концентрация бензилпенициллина будет выше, и сохраняется она в течение 4—5 сут.
Бензатинбензилпенициллин — это N,N-дибензилэтилендиа-миновая соль бензилпенициллина, получаемая при взаимодействии 1 моля N,N-дибензилэтилендиамина с 2 молями бензилпенициллина. Растворимость бензатинбензилпенициллина в воде составляет лишь 0,02%, поэтому его применяют в виде водной суспензии. При введении бензатинбензилпенициллина бензилпенициллин длительно сохраняется в крови, что избавляет от необходимости часто вводить препарат, а значит, предупреждает повреждение тканей в месте инъекции. Снижаются и затраты на лечение. Подобно прокаинбензилпенициллину, бензатинбензилпенициллин обладает местноанестезирующим действием.
При введении бензатинбензилпенициллина высвобождающийся из него бензилпенициллин очень медленно проникает из мышц в кровь и сохраняется в ней дольше, чем при введении всех других пенициллинов длительного действия. Так, у взрослых при в/м введении 1,2 млн ед бензатинбензилпенициллина сывороточная концентрация бензилпенициллина в первые сутки составляет 0,09 мкг/мл, через 2 нед — 0,02 мкг/мл и на 32-е сутки — 0,002 мкг/мл. Ниже минимального уровня, обеспечивающего антимикробную активность, она падает в среднем на 27-е сутки.
Распределение[править | править код]
Бензилпенициллин распределяется по всему организму, но его концентрации в разных тканях и биологических жидкостях неодинаковы. Объем распределения составляет около 0,35 л/кг. Примерно на 60% бензилпенициллин обратимо связывается с альбумином плазмы. Достаточно высокие концентрации антибиотика обнаруживают в печени, желчи, почках, сперме, синовиальной жидкости, лимфе и кишечнике.
Сывороточная концентрация бензилпенициллина повышается при назначении его вместе с пробеницидом, который не только подавляет канальцевую секрецию пенициллинов, но и существенно снижает их объем распределения.
СМЖ. В норме пенициллины почти не проникают в СМЖ. Однако при остром менингите проницаемость мозговых оболочек увеличивается, и содержание бензилпенициллина в СМЖ возрастает. Концентрация антибиотика в СМЖ может быть различной, но, как правило, при остром менингите она составляет около 5% сывороточной концентрации. Этого количества вполне достаточно для действия на чувствительные микроорганизмы.
Как и другие органические кислоты, пенициллины вскоре покидают СМЖ путем активного транспорта и вновь поступают в кровоток. Пробенецид — конкурентный ингибитор канальцевого транспорта органических анионов — повышает концентрацию пенициллинов в СМЖ. При уремии в СМЖ накапливаются и другие органические кислоты. Конкурируя с пенициллинами за секрецию, они замедляют выведение препаратов. В результате концентрация пенициллинов в СМЖ может достигнуть токсического уровня и вызвать эпилептические припадки.
Элиминация[править | править код]
В норме бензилпенициллин быстро выводится из организма — главным образом почками, частично — с желчью и другими путями. При в/м введении водного раствора бензилпенициллина около 60—90% дозы выделяется с мочой, большей частью в первый час после инъекции. Оставшийся бензилпенициллин превращается в пенициллоиновую кислоту. Т 1/2 бензилпенициллина у взрослых составляет около 30 мин. Примерно 10% удаляемого почками препарата выводится путем клубочковой фильтрации, а 90% — путем канальцевой секреции. Почечный клиренс почти равен почечному плазмотоку. Максимальная канальцевая секреция бензилпенициллина у здоровых взрослых мужчин составляет около 3 млн ед (1,8 г) в час.
У новорожденных и детей грудного возраста бензилпенициллин выводится медленнее, так как развитие почек у них еще не закончено. Поэтому при введении одной и той же дозы (из расчета на площадь поверхности тела) у недоношенных бензилпенициллин в крови сохраняется в несколько раз дольше, чем у здоровых новорожденных, более старших детей и взрослых. Т1/2 бензилпенициллина у детей первой недели жизни составляет 3 ч, а к концу второй недели — уже 1,4 ч. По окончании созревания почек бензилпенициллин у детей выводится намного быстрее, чем у взрослых.
При анурии Т1/2 бензилпенициллина возрастает до 10 ч (в норме, напомним, 30 мин). При нарушении функции почек бензилпенициллин разрушается в печени; за 1 ч при этом может инактивироваться 7—10% введенной дозы. Если большие дозы антибиотиков необходимы больному с ОПН, то сначала вводят 3 млн ед бензилпенициллина, а затем — по 1,5 млн ед 2—3 раза в сутки. Во время гемодиализа и при восстановлении функции почек дозу увеличивают. При сочетании почечной и печеночной недостаточности Т!/2 возрастает еще больше.
Применение[править | править код]
Пневмококковые инфекции[править | править код]
Бензилпенициллин — по-прежнему лучшее средство для лечения инфекций, вызванных чувствительными штаммами Streptococcus pneumoniae. Однако в некоторых странах, включая США, все чаше выделяют штаммы пневмококков, устойчивые к обычным дозам бензилпенициллина (Centers for Disease Control and Prevention, 1999; Fiore et al., 2000).
Пневмококковая пневмония. Эмпирическую терапию пневмококковой пневмонии следует начинать с цефалоспоринов третьего поколения или ванкомицина. На бензилпенициллин или прокаинбензилпенициллин переходят, когда есть веские основания полагать или точно установлено, что пневмококки пенициллиночувствительны. Для лечения пневмококковой пневмонии с успехом применяли феноксиметилпенициллин внутрь по 500 мг 4 раза в сутки, но сейчас для эмпирической терапии его не рекомендуют из-за устойчивости пневмококков. Пенициллины вводят в течение 7—10 сут, включая 3—5 сут после нормализации температуры.
Пневмококковый менингит. До тех пор, пока не установлено, что пневмококки пенициллиночувствительны, пневмококковый менингит следует лечить комбинацией ванкомицина с одним из цефалоспоринов третьего поколения (John, 1994; Catalan et al., 1994). Иногда рекомендуют цефалоспорины третьего поколения в сочетании с рифампицином. Когда при пневмококковом менингите начали применять пенициллины (а пенициллиноустойчивые штаммы пневмококков еще не появились), смертность при этом заболевании снизилась почти со 100 до 25%. Обычно бензилпенициллин назначают в дозе 20—24 млн ед/сут в/в путем инфузии или дробно 8—12 раз в сутки. Лечение обычно длится 2 нед.
Стрептококковые инфекции[править | править код]
Стрептококковая ангина (в том числе при скарлатине). Это самая частая из болезней, которые вызывает Streptococcus pyogenes (р-гемолитический стрептококк группы А). Пенициллиноустойчивые штаммы Streptococcus pyogenes пока не обнаружены (Tomasz, 1994). При стрептококковой ангине отдают предпочтение феноксиметилпеницил-лину, 500 мг внутрь 4 раза в сутки в течение 10 сут. Хорошие результаты дает и в/м введение прокаинбензилпенициллина в дозе 600 000 ед 1 раз в сутки в течение 10 сут или бензатинбензилпенициллина — 1,2 млн ед однократно. Если есть сомнения, что больной будет выполнять назначения врача, препараты лучше вводить парентерально. Лечение стрептококковой ангины пенициллинами уменьшает риск ревматической атаки, однако, по современным данным, не снижает риск постстрептококко-вого гломерулонефрита.
Стрептококковые пневмония, артрит, менингит и эндокардит встречаются нечасто. Если заболевание вызвано Streptococcus pyogenes, то больному назначают бензилпенициллин в/в по 12—20 млн ед/сут в течение 2—4 нед. При стрептококковом эндокардите лечение должно продолжаться не менее 4 нед.
Инфекции, вызванные другими стрептококками. Зеленящие стрептококки — самые частые возбудители инфекционного эндокардита. Они относятся к негруппируемым а-гемолитическим стрептококкам, устойчивость которых к бензилпенициллину растет (МПКдля чувствительных штаммов меньше 0,1 мкг/мл). У больных инфекционным эндокардитом очень важно количественно определить чувствительность возбудителя к бензилпенициллину, поскольку, во-первых, некоторые энтерококки могут давать а-гемолиз и, во-вторых, некоторые а-гемолитические стрептококки, отличные от зеленящих, могут обладать умеренной устойчивостью к бензилпенициллину. Инфекционный эндокардит, вызванный пенициллиночувствительными зеленящими стрептококками, хорошо излечивается прокаинбензилпени-циллином, который вводят в/м по 1,2 млн ед 4 раза в сутки в течение 2 нед. Подругой схеме больному назначают бензилпенициллин в/в по 12—20 млн ед/сут в течение 2 нед. В обоих случаях одновременно назначают стрептомицин, 500 мг 2 раза в сутки в/м или гентамицин, 1 мг/кг 3 раза в сутки в/в. Некоторые врачи рекомендуют монотерапию бензилпенициллином втечение4нед.
Энтерококковый эндокардит — одно из немногих заболеваний, для лечения которого лучше всего использовать комбинацию из двух антибиотиков. При эндокардите, вызванном чувствительными к бензилпенициллину и аминогликозидам энтерококками, рекомендуют назначать 20 млн ед/сут бензилпенициллина в/в или 12 г/сут ампициллина в/в в сочетании с аминогликозидами. Как правило, лечение продолжают в течение 6 нед, однако известны случаи, когда больные, у которых заболевание длилось меньше обычного (менее 3 мес), полностью поправлялись за 4 нед лечения (Wilson et al., 1984).
Анаэробные инфекции[править | править код]
Многие анаэробные инфекции — смешанные, а их возбудители обычно чувствительны к бензилпенициллину. Исключение составляет род Bacteroides, до 75% представителей которого могут быть устойчивы даже к большим дозам этого препарата. Легочные инфекции и пародонтит (кроме вызванных штаммами Prevotella melaninogenica, способными к выработке р-лактамаз) обычно хорошо лечатся бензилпенициллином, хотя проведенное в 1983 г. кооперированное испытание показало, что при абсцессе легкого клиндамицин помогает лучше, чем пенициллины (Levison et al., 1983). При легких и среднетяжелых легочных инфекциях и пародонтите пенициллины можно назначать внутрь — 250 мг феноксиметилпенициллина или 400 000 ед бензилпенициллина — 4 раза в сутки. Однако тяжелые инфекции той же локализации требуют уже в/в введения 12—20 млн ед бензилпенициллина в сутки. Абсцесс мозга также зачастую бывает вызван несколькими видами анаэробных микроорганизмов. В большинстве случаев применяют большие дозы бензилпенициллина (20 млн ед/сут в/в) в сочетании с метронидазолом или хлорамфениколом. Иногда добавляют цефалоспорин третьего поколения, активный в отношении аэробных грамотрицательных палочек.
Стафилококковые инфекции[править | править код]
Подавляющее большинство стафилококков способны вырабатывать пенициллиназу, поэтому для лечения стафилококковых инфекций применяют устойчивые к этому ферменту пенициллины: нафциллин, оксациллин, метициллин и другие.
Так называемые метициллиноустойчивые штаммы стафилококков нечувствительны ни к бензилпенициллину, ни к устойчивым к пенициллиназе пенициллинам, ни к цефалоспоринам. Иногда метициллиноустойчивые штаммы проявляют чувствительность к цефалоспоринам in vitro, но во время лечения появляются устойчивые штаммы, и терапия оказывается безуспешной (Chambers et al., 1984). Такие инфекции лучше всего лечить ванкомицином, хотя чувствительность стафилококков к нему в последнее время снижается (Centers for Disease Control and Prevention, 1997). Хорошо действует и ципрофлоксацин, однако при длительном лечении часто появляются устойчивые к нему штаммы Staphylococcus aureus.
Менингококковая инфекция[править | править код]
Лучшим средством при менингококковой инфекции остается бензилпенициллин. Его вводят в/в в больших дозах, как при пневмококковом менингите (см. выше). В Великобритании и Испании выявляли устойчивые к бензилпенициллину штаммы Neisseria meningitidis, но сейчас они встречаются редко. В 1997 г. в США 97% выделенных штаммов Neisseria meningitidis оказались пенициллиночувствительными (Rosenstein et al., 2000). О появлении пенициллиноустойчивого штамма следует подумать, если на фоне лечения состояние больного улучшается медленно (Sprott et al., 1988; Mendel-man et al., 1988). Нельзя забывать и о том, что бензилпенициллин не помогает при носительстве менингококков, поэтому назначение его для профилактики не оправдано.
Гонококковая инфекция[править | править код]
Устойчивость гонококков к бензилпенициллину постепенно растет. Пенициллины перестали быть основными препаратами при гонококковой инфекции — за исключением некоторых местностей, где распространены чувствительные к этим средствам штаммы гонококков. Самая частая из гонококковых инфекций — неосложненный гонококковый уретрит, для его лечения достаточно однократной в/м инъекции 250 мг цефтриаксона (Sparling and Handsfield, 2000).
При диссеминированной гонококковой инфекции с высыпаниями, гонококковом артрите и гонококкемии назначают цефтриаксон 1 г/сут в/м или в/в в течение 7—10 сут. Гонококковый конъюнктивит у новорожденных также лечат цефтриаксоном, 25—50 мг/кг/сут в/м или в/в однократно.
Сифилис[править | править код]
Сифилис хорошо поддается лечению бензилпеницил-лином. Первичный, вторичный и латентный сифилис продолжительностью менее 1 года можно лечитьлибо прокаинбензил-пенициллином (2,4 млн ед/сут в/м) в сочетании с пробенецидом (1 г/сут внутрь) в течение 10 сут, либо бензатинбензилпени-циллином по 2,4 млн ед в/м 1 раз в неделю в течение 1—3 нед (при ВИЧ-инфекции препарат вводят в течение 3 нед). При позднем латентном сифилисе, нейросифилисе и поражении сердечно-сосудистой системы применяют несколько схем лечения. На этих стадиях изменения необратимы и часто становятся причиной гибели больного; однако антибиотики могут остановить прогрессирование заболевания. Назначают большие дозы бензилпенициллина — по 20 млн ед/сут в/м в течение 10 сут.
Детям грудного возраста, у которых врожденный сифилис обнаружили при рождении или вскоре после него, назначают бензилпенициллин, 50 000 ед/кг/сут в/в или в/м в 2 приема, или прокаинбензилпенициллин, 50 000 ед/кг в/м 1 раз в сутки. Лечение продолжают не менее 10 сут (Tramont, 2000).
У 70—90% больных со вторичным сифилисом развивается реакция Яриша—Герксгеймера. Бывает она и при других формах сифилиса. Спустя несколько часов после первой инъекции пенициллина повышается температура, появляются озноб, головная боль, боль в мышцах и суставах. Высыпания становятся более заметными, яркими, а кожа на их месте — отечной. Эти проявления обычно сохраняются несколько часов; сыпь бледнеет в течение 2 сут. При последующих инъекциях реакция Яриша—Герксгеймера больше не возникает. Полагают, что она связана с высвобождением антигенов при массовой гибели спирохет. Реакция Яриша—Герксгеймера — не показание для отмены препарата. Аспирин дает некоторое облегчение.
Актиномикоз[править | править код]
Все формы заболевания хорошо лечатся бензил-пенициллином. Его вводят в/в по 12—20 млн ед/сут в течение 6 нед. Иногда на последующие 2—3 мес назначают феноксиме-тилпенициллин внутрь по 500 мг 4 раза в сутки. Может потребоваться хирургическое дренирование или иссечение очага.
Дифтерия[править | править код]
Достоверных данных о том, что антибиотики, в том числе пенициллины, могут снизить частоту осложнений и повлиять на исход дифтерии, на сегодня нет. Единственный способ лечения — введение противодифтерийной сыворотки. Тем не менее бензилпенициллин помогает при носительстве корине-бактерий. Введение бензилпенициллина в дозе 2—3 млн ед/сут в/м или в/в дробно в течение 10—12 сут в 100% случаев позволяет полностью уничтожить бактерий в глотке и других очагах инфекции. Бензилпенициллин можно заменить прокаинбензилпенициллином — доза и длительность лечения те же, но вводят препарат один раз в сутки.
Сибирская язва[править | править код]
Бензилпенициллин применяют и для лечения сибирской язвы. Однако у человека выделены и устойчивые к этому антибиотику штаммы Bacillus anthracis. Доза бензилпенициллина при сибирской язве составляет 12—20 млн ед/сут в/в или в/м.
Клостридиальные инфекции[править | править код]
При газовой гангрене бензилпенициллин вводят в/в или в/м по 12—20 млн ед/сут. Обязательна хирургическая обработка очага инфекции. На исход столбняка антибиотики, по-видимому, не влияют — необходима обработка входных ворот инфекции и введение противостолбнячного иммуноглобулина. Бензилпенициллин назначают, чтобы уничтожить вегетативные формы клостридий, которые могут подолгу сохраняться в организме.
Инфекция Венсана[править | править код]
Язвенно-некротический гингивит, вызванный симбиозом Leptotrichia buccalis и спирохет, обитающих в ротовой полости, хорошо поддается лечению пенициллинами. При неосложненном гингивите назначают феноксиметилпенициллин внутрь по 500 мг 4 раза в сутки, лечение длится несколько суток.
Болезнь крысиного укуса[править | править код]
Это заболевание в Азии вызывается Spirillum minor и носит название содоку, в США и в Европе вызывается Streptobacillus moniliformis и известно под названием хейверхиллская лихорадка. Оба возбудителя высокочувствительны к бензилпенициллину. Большинство случаев, вызванных Streptobacillus spp., сопровождаются бактериемией; при этом нередко появляются вторичные очаги инфекции, особенно в синовиальной оболочке и эндокарде, поэтому применяют большие дозы бензилпенициллина — по 12—15 млн ед/сут в/м или в/в в течение 3—4 нед.
Листериоз[править | править код]
Инфекции, вызванные Listeria monocytogenes, успешно лечатся бензилпенициллином или ампициллином (иногда в сочетании с гентамицином). Бензилпенициллин рекомендуют вводить по 15—20 млн ед/сут в/в в течение по меньшей мере 2 нед. При листериозном эндокардите доза та же, но продолжительность лечения должна быть не менее 4 нед.
Лаймская болезнь[править | править код]
На ранней стадии Лаймскую болезнь обычно лечат тетрациклином, но можно с успехом применять и амоксициллин по 500 мг внутрь 3 раза в сутки в течение 3 нед. В тяжелых случаях назначают цефалоспорины третьего поколения или бензилпенициллин, последний вдозе 20 млн ед/сут в/в вте-чение 2 нед.
Эризипелоид[править | править код]
Возбудитель — Erysipelothrix rhusiopathiae — пенициллиночувствителен. Неосложненная инфекция излечиваются однократным введением 1,2 млн ед бензатинбензилпеницилли-на в/м. При сопутствующем эндокардите назначают бензилпенициллин, 12—20 млн ед/сут в/в в течение 4—6 нед.
Профилактическое применение[править | править код]
За первым опытом успешного лечения пенициллинами почти сразу последовали попытки использовать их в качестве профилактических средств. Пенициллины стали назначать при малейшем риске бактериальной инфекции. Однако в дальнейшем контролируемые испытания показали, что в одних случаях пенициллины действительно служат высокоэффективным средством профилактики, в других — бесполезны и даже вредны, а в-третьих, их эффект оказался неопределенным (гл. 43).
Стрептококковые инфекции[править | править код]
У лиц, контактировавших со Streptococcus pyogenes, пенициллины предотвращают развитие инфекции. При вспышках стрептококковых инфекций в закрытых коллективах (например, в школах-интернатах или гарнизонах) назначают 200 000 ед бензилпенициллина или 125 мг фе-ноксиметилпенициллина внутрь 2 раза в сутки или 1,2 млн ед бензатинбензилпенициллина в/м однократно. У больных с обширными глубокими ожогами высок риск раневой инфекции, вызванной Streptococcus pyogenes, и профилактическое назначение малых доз антибиотиков в течение нескольких суток уменьшает частоту этого осложнения.
Повторные ревматические атаки[править | править код]
Прием 200 000 ед бензилпенициллина или 125 мг феноксиметилпенициллина внутрь 2 раза в сутки резко уменьшает частоту повторных ревматических атак. Далеко не все больные прилежно соблюдают режим лечения, и в этом отношении надежнее парентеральный путь введения, особенно у детей. Превосходный результат дает ежемесячное в/м введение 1,2 млн ед бензатинбензилпенициллина. При аллергии к пенициллинам применяют сульфафуразол или сульфадиазин по 1 г внутрь 2 раза в сутки. Детям, вес которых не превышает 27 кг, назначают половину этой дозы. Профилактику проводят круглогодично, однако вопрос об ее продолжительности окончательно не решен. Профилактические дозы пенициллинов предлагали вводить в течение всей жизни, поскольку повторные ревматические атаки наблюдали и у больных 50—60 лет. Но позднее столь длительную профилактику нашли неоправданной, в частности у молодых людей с небольшим риском рецидива (Berrios et al., 1993).
Сифилис[править | править код]
Профилактику у лиц, контактировавших с больным, проводят по той же схеме, что и лечение первичного сифилиса. В последующие 4 мес ежемесячно выполняют серологическое исследование на сифилис.
Хирургические процедуры у больных с пороками сердца[править | править код]
Примерно в 25% случаев подострый инфекционный эндокардит возникает после удаления зубов; почти в 80% случаев эта операция приводит к преходящей бактериемии. Все это свидетельствует о важности медикаментозной профилактики перед удалением зубов у больных с врожденными и приобретенными пороками сердца. Профилактику проводят и перед другими хирургическими вмешательствами (тонзиллэктомией, операциями на ЖКТ, гинекологическими и урологическими операциями), а также перед родами, поскольку последние тоже иногда становятся причиной преходящей бактериемии. Влияние такой профилактики на заболеваемость инфекционным эндокардитом изучается.
Разработаны подробные рекомендации по проведению медикаментозной профилактики взрослым и детям с пороками сердца (Dajani et al., 1990; Durack, 2000).
Полусинтетические пенициллины, устойчивые к пенициллиназе[править | править код]
В этом разделе мы рассмотрим пенициллины, устойчивые к действию стафилококковой пенициллиназы. Их применяют только в тех случаях, когда известно или есть веские основания полагать, что инфекция вызвана стафилококками, вырабатывающими β-лактамазы (а это большая часть стафилококков). На другие пенициллиночувствительные микроорганизмы, в том числе стафилококки, не вырабатывающие β-лактамазы, эти препараты действуют намного слабее, чем бензилпенициллин.
Не так давно пенициллины, устойчивые к пенициллиназе, были лучшими средствами для лечения стафилококковых инфекций. Однако вскоре картина может измениться, так как от больных все чаще выделяют метициллиноустойчивые штаммы стафилококков. Они защищены от действия всех пенициллинов, устойчивых к пенициллиназе, и всех цефалоспоринов. Нередко такие штаммы проявляют устойчивость и к аминогликозидам, тетрациклинам, эритромицину и клиндамицину. При инфекциях, вызванных метициллиноустойчивыми стафилококками (в том числе Staphylococcus epidermidis), рекомендуют назначать ванкомицин. Иногда — особенно при инфекциях, возникших при попадании инородных тел, и угрожающих жизни инфекциях — к ванкомицину добавляют рифампицин. Метициллиноустойчивые штаммы Staphylococcus aureus вырабатывают особые высокомолекулярные пенициллинсвязывающие белки с очень низким сродством к р-лактамным антибиотикам (Spratt, 1994). Тот же механизм обеспечивает нечувствительность к пенициллинам, устойчивым к β-лактамазам, у 40—60% штаммов Staphylococcus epidermidis. И те, и другие стафилококки могут быть высокочувствительны к цефалоспоринам in vitro, но с началом лечения возникают популяции бактерий, устойчивых к этим препаратам.
Изоксазолиловые пенициллины: оксациллин, клоксациллин и диклоксациллин[править | править код]
Фармакологические свойства этих полусинтетических пенициллинов сходны, поэтому их удобно рассмотреть вместе. Их химические формулы приведены в табл. 45.1. Все препараты относительно стабильны в кислой среде и устойчивы к действию пенициллиназы. Однако при заболеваниях, которые хорошо излечиваются бензилпенициллином, их не применяют. При тяжелых стафилококковых инфекциях, когда необходимы пенициллины, устойчивые к пенициллиназе, парентеральное введение изоксазолиловых пенициллинов предпочтительнее приема внутрь, так как степень их всасывания в ЖКТ колеблется в широких пределах (см. ниже).
Фармакологические свойства[править | править код]
Оксациллин, клоксациллин и диклоксациллин значительно подавляют рост большинства стафилококков, вырабатывающих пенициллиназу. На этом и основано их клиническое применение. Самый активный из этих препаратов — диклоксациллин; рост многих штаммов Staphylococcus aureus прекращается при концентрации диклок-сациллина 0,05—0,8 мкг/мл. Такое же действие оказывают клоксациллин и оксациллин в концентрациях 0,1—3 мкг/мл и 0,4—6 мкг/мл соответственно. Однако в клинической практике эти различия особого значения не имеют, так как их учитывают при подборе дозы (см. ниже). Препараты этой группы обычно менее активны в отношении микроорганизмов, чувствитель-ных к бензилпенициллину, и совсем не действуют на грамотрицательных бактерий.
Изоксазолиловые пенициллины быстро, но не полностью (на 30—80%) всасываются в ЖКТ. Всасывание улучшается при приеме натощак, поэтому их назначают за час до или через 2 ч после еды. После приема внутрь 1 г оксациллина его максимальная сывороточная концентрация достигается через час и составляет примерно 5—10 мкг/мл; при приеме в той же дозе клоксациллина сывороточная концентрация немного выше, а для ди клоксациллина она достигает 15 мкг/мл. Эти различия связаны с разной скоростью выведения препаратов почками и разной устойчивостью к разрушению в печени; впрочем, практическая значимость таких различий, видимо, невелика. Находясь в крови, все препараты данной группы на 90—95% связаны с альбумином плазмы; ни один из полусинтетических пенициллинов не выводится из организма при гемодиализе.
Изоксазолиловые пенициллины быстро выводятся почками. В норме в течение первых 6 ч после приема внутрь обычной дозы половина ее выделяется с мочой; кроме того, значительная часть препарата выводится с желчью. Т1/2 всех антибиотиков этой группы составляет 30—60 мин. При почечной недостаточности интервалы между приемами оксациллина, клоксациллина и диклоксациллина можно не увеличивать.
Нафциллин[править | править код]
Нафциллин обладает высокой устойчивостью к пенициллиназе и потому действует на Staphylococcus aureus, вырабатывающих этот фермент. Химическая формула нафциллина приведена в табл. 45.1.
Фармакологические свойства[править | править код]
Нафциллин немного активнее оксациллина в отношении Staphylococcus aureus, устойчивых к бензилпенициллину (в концентрации 0,06—2 мкг/мл он подавляет рост большинства штаммов). В отношении остальных микроорганизмов нафциллин активнее всех других устойчивых к пенициллиназе пенициллинов (хотя и менее активен, чем бензилпенициллин).
Нафциллин в различной степени инактивируется в кислой среде желудка. Всасывание препарата из ЖКТ зависит от того, принят ли он вместе с пищей или натощак. Поэтому, хотя препараты нафциллина для приема внутрь существуют, лучше вводить его парентерально. Максимальная сывороточная концентрация 8 мкг/мл достигается через час после в/м введения 1 г нафциллина. Примерно на 90% нафциллин связывается с белками плазмы. Его максимальная концентрация в желчи намного выше сывороточной. Концентрация нафциллина в СМЖ достаточна для лечения стафилококкового менингита.
Аминопенициллины: ампициллин, амоксициллин и их аналоги[править | править код]
Антимикробная активность этих препаратов сходна, а спектр их действия шире, чем у рассмотренных выше антибиотиков. Все они разрушаются β-лактамазами (как грам положительных, так и грамотрицательных бактерий).
Антимикробная активность[править | править код]
Ампициллин и другие аминопени ниллины оказывают бактерицидное действие как на грамположительных, так и на грамотрицательных бактерий. К препаратам чувствительны менингококки и Listeria monocytogenes. Мно гие штаммы пневмококков в той или иной мере устойчивы к ампициллину. Устойчивые к бензилпенициллину штаммы пнев мококков устойчивы также к ампициллину и амоксициллин)
Разной степенью устойчивости обладают Haemophilus influenzae и зеленящие стрептококки. Энтерококки почти в 2 раза чувствительнее к ампициллину, чем к бензилпенициллину (МПК ампициллина составляет около 1,5 мг/мл). Когда в начале 1960-х гг. впервые начали применять ампициллин, большинство штаммов Neisseria gonorrhoeae, Escherichia coli, Proteus mira-bilis, Salmonella spp., Shigella spp. были высокочувствительны к нему, но сейчас все больше и больше видов приобретают устойчивость. К ампициллину устойчивы большинство штаммов Shigella spp., Pseudomonas spp., Klebsiella spp., Serratia spp., Aci-netobacter spp. и индолположительных видов Proteus, а также 30—50% Escherichia coli, значительная часть Proteus mirabilis и почти все виды Enterobacter. В разных странах все чаще встречаются устойчивые (за счет плазмидных генов) штаммы Salmonella spp. На Bacteroides spp. аминопенициллины действуют слабее, чем бензилпенициллин. Однако применение в комбинации с ингибиторами р-лактамаз, например клавулановой кислотой или сульбактамом, заметно расширяет спектр действия аминопенициллинов (см. ниже).
Ампициллин[править | править код]
Это родоначальник группы аминопенициллинов. Его химическая формула приведена в табл. 45.1.
фармакологические свойства. Ампициллин не разрушается в кислой среде и хорошо всасывается при приеме внутрь. Максимальная сывороточная концентрация (3 мкг/мл) достигается через 2 ч после приема внутрь 0,5 г препарата. После еды ампициллин всасывается хуже. При в/м введении 0,5 или 1 г препарата максимальная сывороточная концентрация (соответственно 7 и 10 мкг/мл) достигается через 1 ч. Затем сывороточная концентрация экспоненциально снижается (ТЦ около 80 мин). При тяжелой почечной недостаточности сывороточная концентрация ампициллина сохраняется высокой намного дольше. Препарат не выводится при перитонеальном диализе, но при гемодиализе за 7 ч удаляется примерно на 40%. При нарушении функции почек дозу снижают. Ампициллин поступает также в желчь, претерпевает кишечно-печеночный кругооборот и в довольно больших количествах удаляется с калом.
Амоксициллин[править | править код]
Этот полусинтетический пенициллин по фармакологическим свойствам и химической структуре близок к ампициллину и тоже разрушается пеницилли-назой (табл. 45.1). Амоксициллин стабилен в кислой среде и предназначен для приема внутрь. Его главное отличие от ампициллина — более быстрое и более полное всасывание из ЖКТ. Антимикробные спектры амоксициллина и ампициллина почти совпадают, за исключением того, что ампициллин лучше помогает при дизентерии.
Максимальная сывороточная концентрация после приема внутрь 250 мгамоксициллина достигается через 2 ч. Она составляет 4 мкг/мл, что в 2—2,5 раза больше, чем после такой же дозы ампициллина. Прием пищи не влияет на всасывание. Амоксициллин реже, чем ампициллин, вызывает понос — по-видимому, это объясняется более полным всасыванием первого. В остальном побочные эффекты обоих препаратов отличаются мало. Т1/2 памоксициллина и ампициллина сходны, однако при приеме амоксициллина внутрь сывороточная концентрация препарата, обеспечивающая антимикробную активность, сохраняется вдвое дольше, чем при приеме ампициллина, — опять же из-за более полного всасывания. Около 20% амоксициллина (как и ампициллина) связывается с белками плазмы. Оба препарата в больших количествах выделяются в неизмененном виде с мочой. Пробенецид замедляет их выведение.
Применение[править | править код]
Инфекции верхних дьисательных путей. Ампициллин и амоксициллин активны в отношении Streptococcus pyogenes, многих штаммов Streptococcus pneumoniae и Haemophilus influenzae — важнейших возбудителей инфекций верхних дыхательных путей. Эти препараты показаны при синуситах, среднем отите, обострении хронического бронхита и эпиглоттите, вызванных чувствительными штаммами перечисленных микроорганизмов. Из всех р-лактамных антибиотиков для приема внутрь амоксициллин наиболее активен в отношении как пенициллиночувствительных, так и пенициллиноустойчивых штаммов Streptococcus pneumoniae (Friedland and McCracken, 1994). Пенициллиноустойчивость пневмококков встречается все чаще, поэтому для эмпирической терапии острого среднего отита у детей рекомендуют назначать более высокие дозы амоксициллина — 80—90 мг/кг/сут внутрь (прежняя доза составляла 40—45 мг/кг/сут) (Dowell et al., 1999). Справиться с инфекцией, вызванной устойчивыми к ампициллину штаммами Haemophilus influenzae, может быть нелегко. В таких случаях к амокси-циллину добавляют клавулановую кислоту, а к ампициллину — сульбактам, которые, подавляя Р-лактамазы, расширяют спектр действия аминопенициллинов. Такая комбинация препаратов действует на Haemophilus influenzae и энтеробактерий, вырабатывающих р-лактамазы. Ангину лечат бензилпенициллином или феноксиметилпенициллином, так как чаще всего ее вызывает пенициллиночувствительный Streptococcus pyogenes.
Инфекции мочевых путей. Возбудителями большинства неосложненных инфекций мочевых путей становятся энтеробактерии, чаще всего — Escherichia coli. Как правило, помогает ампициллин, но все больше штаммов приобретают устойчивость к нему. Энтерококковые инфекции мочевых путей поддаются монотерапии ампициллином.
Менингит. Самые частые возбудители острого бактериального менингита у детей — Streptococcus pneumoniae и Neisseria meningitidis. Поскольку 20—30% Streptococcus pneumoniae могут оказаться устойчивыми к ампициллину, сегодня этот препарат не рекомендуют для монотерапии менингита. Ампициллин высокоактивен в отношении Listeria monocytogenes, которые часто вызывают менингит у лиц с ослабленным иммунитетом. Таким образом, при подозрении на бактериальный менингит лечение начинают с комбинации ампициллина, ванкомицина и одного из цефалоспоринов третьего поколения.
Сальмонеллезные инфекции. Брюшной тиф, паратифы и другие сальмонеллезы, сопровождающиеся бактериемией и формированием вторичных очагов инфекции, хорошо поддаются лечению антибиотиками. Некоторые врачи отдают предпочтение фторхинолонам и цефтриаксону, однако не хуже действуют и триметоприм/сульфаметоксазол или большие дозы ампициллина (12 г/сут внутрь для взрослых). В некоторых местностях распространены устойчивые к ампициллину штаммы сальмонелл. В отсутствие желчнокаменной болезни от носительства сальмонелл удавалось избавиться с помощью ампициллина, триметоприма/сульфаметоксазола или ципрофлоксацина.
Пенициллины, активные в отношении псевдомонад: карбоксипенициллины и уреидопенициллины[править | править код]
Карбоксипенициллины — карбенициллин, тикарциллин и их аналоги — активны в отношении некоторых штаммов Pseudomonas aeruginosa и индолположительных Proteus spp., устойчивых к ампициллину и другим аминопе-нициллинам. На большую часть штаммов Staphylococcus aureus, Enterococcus faecalis, Klebsiella spp. и Listeria monocytogenes карбоксипенициллины не действуют. Bacteroides spp. чувствительны к большим дозам этих препаратов, но такие же дозы бензилпенициллина помогают намного лучше. Уреидопенициллины — мезлоциллин и пиперациллин — активнее карбоксипенициллинов в отношении Pseudomonas aeruginosa. Их используют и при лечении инфекций, вызванных Klebsiella spp. Карбоксипенициллины и уреидопенициллины разрушаются р-лактамазами.
Карбенициллин и кариндациллин[править | править код]
Карбенициллин. Этот препарат чувствителен к пенициллиназе. Он представляет собой производное 6-аминопенициллановой кислоты (химическая формула приведена в табл. 45.1). Карбенициллин — первый из пенициллинов, активных в отношении Pseudomonas aeruginosa и некоторых штаммов Proteus spp., устойчивых к ампициллину. Сейчас карбенициллин все больше вытесняют тикарциллин и пиперацнллин.
Карбенициллин обладает некоторыми особыми побочными эффектами помимо свойственных всем пенициллинам. Карбенициллин представляет собой динатриевую соль, и избыток натрия. возникающий при его приеме, может привести к сердечной недостаточности. Нереабсорбируемые анионы карбенициллина выводятся только в комплексе с ионами калия — таким образом, секреция калия в дистальных почечных канальцах возрастает и может развиться гипокалиемия. Препарат нарушает функцию тромбоцитов — снижение их агрегации может вызвать кровотечение.
Кариндациллин. Эго инданиловый эфир карбенициллина. Препарат стабилен в кислой среде, и его можно принимать внутрь.
В крови кариндациллин быстро подвергается гидролизу с высвобождением карбенициллина; поэтому антимикробный спектр кариндациллина совпадает со спектром карбенициллина. Сывороточная концентрация препарата невелика, он быстро выводится с мочой в неизмененном виде. Поэтому кариндациллин используют только для лечения инфекций мочевых путей, вызванных Proteus spp. (кроме Proteus mirabilis) и Pseudomonas aeruginosa.
Тикарциллин. Этот полусинтетический пенициллин (табл. 45.1) сходен с карбенициллином. но в 2—4 раза активнее последнего в отношении Pseudomonas aeruginosa. Тем не менее при лечении тяжелых инфекций, вызванных Pseudomonas spp., тикарциллин уступает по эффективности мезлоциллину и пиперациллину.
Мезлоциллин. Этот препарат из группы уреидопенициллинов более активен в отношении Klebsiella spp., чем карбенициллин, а по действию на Pseudomonas spp. in vitro подобен тикарцилл tiny. По сравнению с последним он сильнее действует на Enterococcus faecal is. Мезлоциллин выпускают в виде порошка для инъекций, в одном грамме которого содержится 2 ммоль натрия. Средняя доза для взрослых составляет 6— 18 г/сут, вводят ее в/м или в/в в 4—6 приемов. Мезлоциллин и пиперациллин в значительной степени выводятся с желчью. Если нет обструкции желчных путей, то в/в введение мезлоциллина позволяет создать высокую концентрацию препарата в желчи.
Пиперациллин. Спектр действия пиперациллина шире, чем у ампициллина, и включает большинство штаммов Pseudomonas aeruginosa, энтеробактерий (не вырабатывающих р-лактамазы) и многие виды Bacteroides. В комбинации с ингибитором Р-лактамаз (пиперациллин/та-зобактам) пиперациллин обладает самым широким среди пенициллинов антимикробным спектром. Фармакокинетика пиперациллина сходна с фармакокинетикой других уреидопенициллинов. Как и в случае мезлоциллина. удается достичь высокой концентрации пиперациллина в желчи.
Применение. Карбоксипенициллины и уреидопенициллины незаменимы при лечении больных с тяжелыми инфекциями, вызванными грамотрицательными бактериями. Часто это больничные инфекции улюдей с ослабленным иммунитетом. Многие врачи используют в таких случаях р-лактамные антибиотики в сочетании с ами-ногликозидами. Поэтому карбоксипенициллины и уреидопенициллины широко применяют при бактериемии, инфекциях мочевых путей, раневой инфекции при ожогах и пневмонии, вызванных устойчивыми к бензилпенициллину и ампициллину микроорганизмами. К кар-боксипенициллинам особенно чувствительны Pseudomonas aeruginosa, индолположительные штаммы Proteus spp. и Enterobacterspp. Поскольку у больных с нейтропенией часты тяжелые инфекции, вызванные Pseudomo-nas spp., в схему лечения таких больных включают β-лактамный антибиотик с высокой активностью в отношении этих микроорганизмов.
Побочные эффекты пенициллинов[править | править код]
Аллергические реакции[править | править код]
Это, безусловно, самый частый побочный эффект пенициллинов, и, по-видимому, последние чаще других препаратов становятся причиной лекарственной аллергии. По разным источникам, аллергические реакции встречаются в 0,7—10% случаев применения пенициллинов. Убедительных доказательству го, что пенициллины отличаются друг от друга по способности вызывать аллергию, нет. Аллергические реакции на пенициллины могут проявляться (в порядке снижения частоты): пятнисто-папулезной сыпью, крапивницей, лихорадкой, бронхоспазмом, васкулитами, сывороточной болезнью, эритродермией, синдромом Стивенса-Джонсона и анафилактическим шоком (Anonymous, 1988; Weiss and Adkinson, 2000).
Пенициллины могут вызвать аллергическую реакцию в любой дозе и любой лекарственной форме. При аллергии к одному из пенициллинов велика вероятность того, что аллергическая реакция разовьется и на другие. С другой стороны, появление побочных эффектов при первом введении отнюдь не означает, что всякий раз при введении пенициллинов они будут возникать вновь. Иногда аллергическая реакция развивается уже при первом введении, так как сенсибилизация может произойти незаметно (например, при употреблении пищевых продуктов животного происхождения или вырабатывающих пенициллины фибов). После элиминации препарата аллергические проявления обычно быстро исчезают, но могут сохраняться в течение 1—2 нед после отмены и даже дольше. Аллергические реакции бывают легкими и могут пройти даже на фоне лечения пенициллинами; в других случаях требуется немедленная отмена препарата. Тяжелая аллергическая реакция — абсолютное противопоказание к введению пенициллинов в дальнейшем. Больному нужно обязательно разъяснить, что даже очень небольшое количество пенициллинов, попавшее в организме пищей или при кожных пробах, может оказаться смертельно опасным.
Пенициллины и их метаболиты приобретают иммуно-генность в соединении с белками. Считают, что аллергия к пенициллинам связана главным образом с их промежуточным метаболитом — пенициллоиновой группой; Она называется большой антигенной детерминантой и образуется при разрыве β-лактамного кольца. Существуют и другие, так называемые малые антигенные детерминанты пенициллинов. К ним, в частности, относятся неизмененные молекулы пенициллинов, бензилпенициллоат. Эти вещества образуются in vivo, но их можно найти и в растворах пенициллинов, приготовленных для введения. Термины большая и малая детерминанта отражают не тяжесть аллергических реакций, а частоту, с которой образуются антитела к этим антигенам. Анафилактические реакции на пенициллины обычно опосредованы IgE-антителами к малым детерминантам.
Антитела к пенициллинам есть почти у всех, кто когда-либо получал эти препараты, а нередко их обнаруживают и у людей, которые никогда не лечились пенициллинами (Klaus and Fellner, 1973). Введение пенициллинов усиливает выработку антител к большой антигенной детерминанте, которые вызывают кожную воспалительную реакцию. У больных с атопическими заболеваниями кожные пробы бывают положительны в 3—4 раза чаще, чем среди населения в целом. Считают, что ранние аллергические реакции на пенициллины опосредованы главным образом lgE-антителами к малым антигенным детерминантам. Отсроченные и поздние аллергические реакции (крапивница) обычно опосредованы IgE-анти-телами к большой антигенной детерминанте. Полагают, что с IgE-антителами к малым антигенным детерминантам связана рецидивирующая артралгия. Пятнисто-папулезную сыпь могут вызвать цитотоксические иммунные комплексы, состоящие из большой антигенной детерминанты и IgM-антител. Отсроченные и поздние аллергические реакции иногда разрешаются самостоятельно за счет образования блокирующих антител.
На коже может появиться скарлатиноподобная, кореподобная, уртикарная, везикулярная или буллезная сыпь. Геморрагическая сыпь встречается редко и обычно обусловлена васкулитом. Еще реже наблюдают тромбоцитопеническую пурпуру. Редкое осложнение — геморрагический васкулит с поражением почек. У врачей, фармацевтов и медицинских сестер, которые готовят растворы пенициллинов, иногда развивается аллергический контактный дерматит. Может возникнуть и фиксированная токсидермия. Эритродермия и полиморфная экссудативная эритема (как эритематозно-папулезного, так и везикулобуллезного типа) могут иметь нетипичную локализацию и протекать очень тяжело, например в виде синдрома Стивенса—Джонсона. Чаще всего кожную реакцию дает ампициллин (около 9% случаев), при инфекционном мононуклеозе она возникает почти у всех больных. Сыпь часто появляется и при одновременном назначении ампициллина и аллопуринола. У таких больных кожная реакция носит скорее токсический, чем истинно аллергический характер. Кожные пробы с большой и малыми детерминантами могут быть отрицательными. Сыпь может исчезнуть, даже если больному продолжают вводить антибиотик.
Самые тяжелые из аллергических реакций, возникающих при применении пенициллинов, — отек Квинке и анафилактический шок. Отек Квинке захватывает губы, язык, клетчатку глазниц и все лицо; часто он сочетается с крапивницей и бронхоспазмом. Отек Квинке может развиться к различным пенициллинам независимо от способа их введения.
При лечении пенициллинами наибольшую опасность представляют анафилактический шок и анафилактоид-ные реакции. Пенициллины вызывают их чаще, чем другие лекарственные средства. Анафилактоидные реакции могут возникнуть в любом возрасте. У больных, получающих пенициллины, они встречаются в 0,004—0,04% случаев (Kucers and Bennett, 1987). От анафилактического шока погибают около 0,001% больных, что составляет по крайней мере 300 человек в год. Из них около 70% уже лечились пенициллинами ранее, причем у трети из этих 70% больных ранее отмечались аллергические реакции на данные препараты. Чаще всего анафилактический шок развивается при парентеральном введении пенициллинов, но может возникать и при приеме внутрь, и даже при проведении кожных проб, когда в организм попадают очень маленькие дозы препаратов. Тяжесть анафилактического шока может быть различной. В худшем случае внезапное падение АД быстро приводит к смерти. У других больных развивается тяжелый бронхоспазм, возникают боль в животе, тошнота, рвота, понос, геморрагическая сыпь, резкая слабость, снижается АД.
Проявления сывороточной болезни разнообразны: от небольшой лихорадки, сыпи и лейкопении до тяжелой артралгии или артрита, геморрагической сыпи, увеличения лимфоузлов, спленомегалии, нарушений сознания, характерных для миокардита изменений ЭКГ. Возможны генерализованный отек, альбуминурия или гематурия. Сывороточная болезнь опосредована IgG-антителами. Обычно она возникает к концу первой недели лечения пенициллинами, но иногда развивается и через 1—2 нед после отмены препарата. Заболевание может длиться неделю и дольше.
Еще одно проявление аллергии к пенициллинам — васкулиты. При длительном лечении пенициллинами или цефалоспоринами часто становится положительной проба Кумбса, но иммунная гемолитическая анемия возникает редко. В костном мозге замедляется дифференци-ровка клеток. Возможна преходящая нейтропения, но не ясно, следует ли считать ее аллергической реакцией. Преходящая нейтропения описана при лечении всеми препаратами группы пенициллинов; при введении нафциллина в дозе 8—12 г/сут в течение более 3 нед она развивалась почти у 30% больных.
Иногда единственный симптом аллергической реакции на пенициллины — лихорадка. Она бывает высокой, по характеру — постоянной, ремиттирующей или перемежающейся, иногда сопровождается ознобом. При отмене препарата лихорадка обычно исчезает через 24—36 ч, но может держаться еще несколько дней.
Аллергические реакции могут сопровождаться эозинофилией. При этом доля эозинофилов в лейкоцитарной формуле может достигать 10—20% и больше. Иногда эозинофилия — единственное проявление аллергии.
Интерстициальный нефрит встречается редко, чаще всего его вызывает метициллин. Возникают гематурия, альбуминурия, лейкоцитурия, цилиндрурия, повышается концентрация креатинина в сыворотке, может наступить олигурия. Биопсия почки выявляет лимфоцитарную и эозинофильную инфильтрацию, повреждение канальцев, отложения IgG в интерстиции. После отмены препарата поражение почек обычно проходит.
Антибиотикотерапия при аллергии к пенициллинам[править | править код]
Большинство больных с аллергией к пенициллинам можно и нужно лечить антибиотиками других групп. Избежать назначения пенициллинов больным с высоким риском аллергии помогает тщательный сбор анамнеза. К сожалению, иногда невозможно установить, действительно ли у больного имела место аллергическая реакция на пенициллины. Из-за отсутствия в продаже комбинированных препаратов на основе малых антигенных детерминант кожные пробы на аллергические реакции немедленного типа, опосредованные IgE-антителами, удается провести не всегда. Кроме того, по результатам кожных проб с большой и малыми антигенными детерминантами нельзя с уверенностью сказать, возникнет ли у больного аллергическая реакция на полусинтетические пенициллины. Те же недостатки присущи и радиоаллерго-сорбентному тесту (Weiss and Adkinson, 2000).
Больным с положительными кожными пробами, которым все же необходимы пенициллины, проводят десенсибилизацию. Дозу пенициллина постепенно увеличивают в надежде избежать тяжелой аллергической реакции в дальнейшем. При этом аллергические реакции немедленного типа могут протекать бессимптомно, и к тому времени, как будет назначена полная доза, все IgE-ан-титела уже оказываются связанными. Десенсибилизацию проводят только в отделении реанимации. В кожу предплечья с интервалами в 1 ч вводят 1, 5, 10, 100 и 1000 ед препарата. В отсутствие аллергических реакций последующие дозы — 10 000 и 50 000 ед — вводят п/к. Для десенсибилизации пенициллин можно назначать и внутрь (Sullivan et al., 1982). Достигнув терапевтической дозы, 5сразу переходят к лечению, так как введение полной дозы пенициллина после перерыва чревато повторной аллергической реакцией (Weiss and Adkinson, 2000). Во время десенсибилизации за больным надо постоянно наблюдать, ему заранее устанавливают венозный катетер; адреналин и все оборудование для ИBЛ должны быть наготове. Следует подчеркнуть, что десенсибилизация небезопасна, а эффективность ее не доказана.
У больных с угрожающими жизни инфекциями, например инфекционным эндокардитом или менингитом, лечение пенициллинами не стоит прекращать даже при появлении пятнисто-папулезной сыпи, однако по возможности лучше перейти на другие антибиотики. Часто через некоторое время сыпь исчезает, что объясняют выработкой блокирующих lgG-антител. Можно назначить Н,-блокаторы или глюкокортикоиды, но данных, свидетельствующих о целесообразности такого лечения, недостаточно. Изредка при продолжении терапии пенициллинами возникает эритродермия, а иногда и васкулит. Токсические реакции. Токсичность пенициллинов невысока. Описаны случаи угнетения кроветворения, нейтропении, гепатита, который встречается редко и чаше развивается при лечении оксациллином и нафциллином (Kirkwood et al., 1983). Бензилпенициллин, карбенициллин, пиперациллин и тикарциллин могут препятствовать агрегации тромбоцитов и, как следствие, нарушать гемостаз (Fass et al., 1987).
Среди местных реакций чаше всего встречаются боль и асептическое воспаление в месте в/м инъекций. Эти реакции зависят от концентрации препарата. В результате повреждения мышечной ткани может повышаться активность аминотрансфераз и ЛДГ. При в/в введении пенициллинов у некоторых больных возникает флебит или тромбофлебит. Прием препаратов внутрь часто вызывает тошноту, иногда рвоту и понос. Выраженность этих проявлений определяется дозой препарата.
Случайное введение пенициллина в седалишный нерв сопровождается сильной болью, возникают двигательные и чувствительные расстройства, которые могут сохраняться несколько недель. Интратекальное введение бензилпенициллина может вызвать арахноидит или тяжелую, иногда смертельную, энцефалопатию. К этому пути введения прибегают лишь в крайнем случае. В/в введение больших доз бензилпенициллина (более 20 млн ед/сут; при почечной недостаточности — меньше) может вызвать сонливость, спутанность сознания, подергивание мышц, генерализованную миоклонию, парциальные или генерализованные эпилептические припадки. Такие нарушения чаше встречаются при почечной недостаточности, очаговых поражениях UHC и гипонатриемии. При концентрации бензилпенициллина в СМЖ больше 10 мкг/мл возможны выраженные нарушения со стороны ЦНС. У больных со сниженной функцией почек введение 20 млн ед калиевой соли бензилпенициллина, содержащей 34 ммоль калия, может вызвать тяжелую гиперкалиемию, иногда со смертельным исходом.
При введении прокаинбензилпенициллина могут внезапно возникнуть дурнота, шум в ушах, головная боль, галлюцинации, эпилептические припадки. Это происходит из-за быстрого высвобождения токсических концентраций прокаина. Такую реакцию наблюдали у 1 из 200 больных, которым вводили 4,8 млн ед прокаинбензилпенициллина для лечения и профи-лактики сифилиса и гонореи.
Другие побочные эффекты[править | править код]
Пенициллины изменяют состав нормальной микрофлоры, вызывая гибель чувствительных микроорганизмов, — этот побочный эффект возникает независимо от пути введения, но ярче проявляется при приеме препарата внутрь. Сам по себе дисбактериоз не опасен, так как нормальная микрофлора восстанавливается обычно вскоре после окончания лечения; однако у некоторых больных он приводит к суперинфекции. Прием пенициллинов внутрь и, реже, их парентеральное введение может привести к избыточному росту Clostridium difficile, чей токсин может стать причиной псевдомембранозного колита.