Типы мышечных волокон — различия между версиями
Kron (обсуждение | вклад) (→Читайте также) |
Anes (обсуждение | вклад) (→Типы мышечных волокон) |
||
| Строка 149: | Строка 149: | ||
В мышечном веретене мышц также содержатся совершенно разные типы мышечных волокон. Эти структуры воспринимают напряжение мышц. Чувствительность мышечных веретен может быть отрегулирована при сокращении их особых интрафузальных мышечных волокон. Веретена расположены параллельно основной мышце или экстра-фузальным волокнам. Уровнем сокращения интрафузальных мышечных волокон в веретенах управляют гамма-мотонейроны, тогда как альфа-мотонейроны регулируют экстра-фузальные мышечные волокна, которые непосредственно отвечают за сокращение мышц. | В мышечном веретене мышц также содержатся совершенно разные типы мышечных волокон. Эти структуры воспринимают напряжение мышц. Чувствительность мышечных веретен может быть отрегулирована при сокращении их особых интрафузальных мышечных волокон. Веретена расположены параллельно основной мышце или экстра-фузальным волокнам. Уровнем сокращения интрафузальных мышечных волокон в веретенах управляют гамма-мотонейроны, тогда как альфа-мотонейроны регулируют экстра-фузальные мышечные волокна, которые непосредственно отвечают за сокращение мышц. | ||
| − | == | + | == Эндокринология и мышечные волокна == |
{{Эндокринология}} | {{Эндокринология}} | ||
Существование различных типов мышечных волокон обеспечивает значительную гетерогенность тканей скелетных мышц и их способность выполнять разнообразные функциональные задачи. Иммуногистохимический и биохимический анализ скелетных мышц показал, что такое структурно-функциональное разнообразие мышечных волокон обусловлено существованием широкого спектра изоформ миозина. '''Миозин''' — молекула, от которой наряду с актином зависит мышечное сокращение. Молекула миозина состоит из двух тяжелых цепей (МуНС) и четырех легких цепей (MyLC) (Schiaffino, Reggiani, 1996; Pette, Staron, 1997). Тяжелые цепи миозина представлены несколькими изоформами, от свойств которых зависят скоростно-силовые качества мышечных волокон. | Существование различных типов мышечных волокон обеспечивает значительную гетерогенность тканей скелетных мышц и их способность выполнять разнообразные функциональные задачи. Иммуногистохимический и биохимический анализ скелетных мышц показал, что такое структурно-функциональное разнообразие мышечных волокон обусловлено существованием широкого спектра изоформ миозина. '''Миозин''' — молекула, от которой наряду с актином зависит мышечное сокращение. Молекула миозина состоит из двух тяжелых цепей (МуНС) и четырех легких цепей (MyLC) (Schiaffino, Reggiani, 1996; Pette, Staron, 1997). Тяжелые цепи миозина представлены несколькими изоформами, от свойств которых зависят скоростно-силовые качества мышечных волокон. | ||
| Строка 172: | Строка 172: | ||
[[Гормоны щитовидной железы]], или тироидные гормоны, оказывают сильное регуляторное воздействие на соотношение различных изоформ тяжелой цепи миозина в составе скелетной мышцы (D’Albis, Butler-Browne, 1993). Показано, что регуляция соотношения МуНС в скелетных мышцах крысы является специфической для пола и типа мышц (Larsson, Yu, 1997). Применение 3.5.3’-трийодтиронина (Т3) приводит к подавлению содержания MyHCI и увеличению содержания MyHCIIA в камбаловидной мышце самцов и самок, тогда как стимуляция содержания МуНСИХ наблюдалась только в мышцах самцов крыс (Larsson, Yu, 1997). Применение Т3 не вызывало никаких изменений в длинном разгибателе пальцев стопы у самцов крыс. В то же время в аналогичной ситуации в той же мышце у самок отмечалось достоверное изменение соотношения изоформ MyHCIIA и ИВ в пользу увеличения последней (Larsson, Yu, 1997). В целом эти результаты показывают, что сократительные качества скелетных мышц находятся под контролем ряда гормонов и ростовых факторов и изменение гормонального фона в этих мышцах при выполнении физических упражнений может быть в определенной степени ответственным за изменение характеристик мышцы в соответствии с физиологическими потребностями. Становится все более очевидным, что изменения структуры и функции мышц, происходящие под влиянием изменений гормонального фона, могут зависеть от пола и типа мышц. | [[Гормоны щитовидной железы]], или тироидные гормоны, оказывают сильное регуляторное воздействие на соотношение различных изоформ тяжелой цепи миозина в составе скелетной мышцы (D’Albis, Butler-Browne, 1993). Показано, что регуляция соотношения МуНС в скелетных мышцах крысы является специфической для пола и типа мышц (Larsson, Yu, 1997). Применение 3.5.3’-трийодтиронина (Т3) приводит к подавлению содержания MyHCI и увеличению содержания MyHCIIA в камбаловидной мышце самцов и самок, тогда как стимуляция содержания МуНСИХ наблюдалась только в мышцах самцов крыс (Larsson, Yu, 1997). Применение Т3 не вызывало никаких изменений в длинном разгибателе пальцев стопы у самцов крыс. В то же время в аналогичной ситуации в той же мышце у самок отмечалось достоверное изменение соотношения изоформ MyHCIIA и ИВ в пользу увеличения последней (Larsson, Yu, 1997). В целом эти результаты показывают, что сократительные качества скелетных мышц находятся под контролем ряда гормонов и ростовых факторов и изменение гормонального фона в этих мышцах при выполнении физических упражнений может быть в определенной степени ответственным за изменение характеристик мышцы в соответствии с физиологическими потребностями. Становится все более очевидным, что изменения структуры и функции мышц, происходящие под влиянием изменений гормонального фона, могут зависеть от пола и типа мышц. | ||
| + | |||
== Заключение == | == Заключение == | ||
Версия 03:32, 17 июля 2016
Источник:
«Спортивная энциклопедия систем жизнеобеспечения».
Редактор: Жуков А.Д. Изд.: Юнеско, 2011 год.
Содержание
Типы волокон скелетных мышц
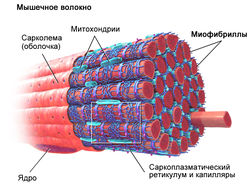
Мышечное волокно является сруктурной единицей мышечной ткани, которое состоит из:
- миофибрилл (сократительных элементов)
- митохондрий (энергопродукция)
- ядер (регуляция)
- сарколемы (соединительно-тканной оболочки)
- саркоплазматический или эндоплазматический ретикулум (депо кальция, необходимого для возбуждения миофибриллы)
- капилляры (поставка питательных веществ и кислорода)
У людей все волокна скелетных мышц имеют разные механические и метаболические свойства. Различные типы мышечных волокон определяют по максимальной скорости их сокращения (быстрой и медленной) и главного метаболического пути, который они используют для образования АТФ (окислительный и гликолитический). Мышечные волокна в целом делятся на:
- медленные окислительные (МО) и
- быстрые гликолитические волокна, которые в свою очередь делятся на:
- быстрые окислительно-гликолитические (БОГ)
- быстрые гликолитические волокна (БР).
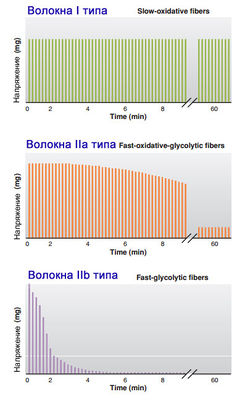
Быстрые и медленные волокна содержат изоферменты, которые различаются по максимальной скорости, с которой они расщепляют АТФ, чтобы высвободить энергию для сокращения или сделать возможным расслабление. Волокна, содержащие миозин с высокой активностью АТФазы, относят к быстрым волокнам, а те, что содержат миозин с более низкой активностью АТФазы, - к медленным.
Медленные окислительные волокна содержат множество митохондрий и обладают высокой способностью к окислительному фосфорилированию. Эти волокна могут содержать значительное количество липидов, но меньшее количество гликогена. Большая часть АТФ, произведенного такими волокнами, зависит от снабжения крови кислородом и топливных молекул. Эти волокна окружают многочисленные капилляры. Они также содержат большое количество связывающего кислород миоглобина, который увеличивает поглощение кислорода тканями и способствует небольшому внутриклеточному накоплению кислорода. Миоглобин придает темно-красный цвет, поэтому окислительные волокна часто называют красными мышечными волокнами.
В быстрых волокнах, также названных гликолитическими волокнами, напротив, содержится мало митохондрий, но они обладают высокой концентрацией гликолитических ферментов и большим запасом гликогена. Из-за ограниченного использования кислорода их окружает относительно небольшое количество капилляров, и они содержат мало миоглобина. Их называют белыми мышечными волокнами вследствие их более светлого цвета по сравнению с красными окислительными волокнами.
Гликолитические волокна, как правило, намного больше в диаметре, чем окислительные волокна. Чем больше диаметр, тем больше максимальное растяжение, которого они могут достичь (т.е. тем они сильнее).
Свойства различных типов мышечных волокон. Для классификации мышечных волокон в тексте использована система 1, но также приведены и названия, используемые в других системах
|
Система 1 |
Медленные окислительные (МО) волокна |
Быстрые окислительно-гликолитические (БОГ) волокна |
Быстрые гликолитические (БГ) волокна |
|
Система 2 |
Медленно сокращающиеся |
Быстро сокращающиеся А |
Быстро сокращающиеся В |
|
Система 3 |
Тип I |
Тип IIа |
Тип IIb |
|
Основной источник образования АТФ |
Окислительное фосфорилирование |
Окислительное фосфорилирование |
Анаэробный гликолиз |
|
Тип миозиновой АТФ-азной активности |
Медленный |
Быстрый |
Быстрый |
|
Митохондрии |
Много |
Много |
Много |
|
Содержание миоглобина |
Высокое (красные мышцы) |
Высокое (красные мышцы) |
Низкое (белые мышцы) |
|
Активность гликолитических ферментов |
Низкая |
Промежуточная |
Высокая |
|
Содержание гликогена |
Низкое |
Промежуточное |
Высокое |
|
Диаметр волокна |
Малый |
Промежуточный |
Большой |
|
Размер моторной единицы |
Малый |
Промежуточный |
Большой |
|
Скорость сокращения |
Низкая |
Высокая |
Высокая |
|
Сила моторной единицы |
Низкая |
Высокая |
Высокая |
|
Капилляры |
Много |
Много |
Мало |
|
Скорость наступления усталости |
Медленная |
Промежуточная |
Быстрая |
Двигательная единица - это один мотонейрон и иннервируемые им мышечные волокна. Когда МО мотонейрон стимулирует свои волокна, сокращается гораздо меньше мышечных волокон, чем когда свои волокна стимулирует мотонейрон БГ. Следовательно, двигательные БГ волокна достигают пикового напряжения быстрее и, взятые вместе, развивают большее усилие, чем МО волокна.
Волокна скелетных мышц различаются также по их способности противостоять усталости. Утомление БГ волокон происходит быстрее, тогда как МО волокна очень устойчивы к усталости. Быстро окисляющиеся волокна обладают промежуточной способностью сопротивляться усталости. Характеристики различных типов волокон скелетных мышц отображены в табл. 1.
Все мышцы человека обладают разным процентным соотношением БГ и МО мышечных волокон. В зависимости от доли имеющихся типов волокон, мышцы могут значительно различаться по максимальной скорости сокращения, силе и утомляемости. Например, в икроножных мышцах наблюдается преобладание БГ волокон, придающее им способность к сильному и быстрому сокращению, которое используется, например, при прыжках. С другой стороны, в камбаловидной мышце больше МО мышечных волокон, и она используется при длительной активности мышц ног.
В целом, МО мышечные волокна обладают высоким уровнем аэробной выносливости. Способность поддерживать мышечную активность в течение длительного времени известна как мышечная выносливость. Так как МО волокна обладают высокой аэробной выносливостью, они чаще всего задействуются во время нагрузок на выносливость (например, в марафонском беге) и во время большинства повседневных занятий, где требования к мышечной силе невысоки (например, ходьба).
БГ мышечные волокна, с другой стороны, обладают относительно низкой аэробной выносливостью. При нормальной, малоинтенсивной деятельности БГ волокна используются довольно редко, но при «взрывных» нагрузках они преобладают. Предполагается, что они активизируются, когда во время физической нагрузки оказывается превышен анаэробный порог; тогда уровень молочной кислоты в крови и в мышечных волокнах начинает повышаться немного раньше.
БОГ двигательные единицы генерируют гораздо большую силу, чем МО двигательные единицы, но они легко устают из-за своей ограниченной выносливости. Поэтому БОГ волокна, по всей видимости, используются в основном при непродолжительной интенсивной нагрузке на выносливость, например при пробежке на 1 милю или заплыве на 400 м.
Как было доказано, спортивные тренировки не меняют относительное соотношение БГ и МО волокон. По всей видимости, напротив, - это почти полностью определяется генетическим наследованием, и это, в свою очередь, может определять основные спортивные способности разных людей. С практической точки зрения двигательный нерв определяет тип мышечных волокон в двигательной единице. Если нерв, иннервирующий медленную двигательную единицу, отрезать и соединить с другим нервным волокном, иннервирующим быструю двигательную единицу, эта прежде быстрая двигательная единица может постепенно измениться и стать медленной. Варьирующиеся доли волокон разных типов в четырехглавых мышцах некоторых спортсменов, представляющих различные виды спорта, показаны в табл. 2.
Многие люди интересуются конными скачками. Лошади также участвуют в Олимпийских играх ~ естественно, не одни. Финская лошадь (ее мышцы примерно на 70% состоят из быстрых волокон) может бежать со скоростью 12,5 м/с, в то время как лошадь для состязаний на короткие дистанции (быстрые волокна составляют около 90% ее мышц) может развить скорость 20 м/с - это явный признак различия их свойств, которые развивались в течение многих поколений.
Таблица 2. Процентное соотношение МО и БГ волокон в четырехглавых мышцах спортсменов по сравнению с обычным человеком
|
Медленные окислительные волокна (%) |
Быстрые гликолитические волокна (%) | |
|
Бегуны на марафонскую дистанцию |
82 |
18 |
|
Тяжелоатлеты |
45 |
55 |
|
Спринтеры |
37 |
63 |
|
Обычный человек |
45 |
55 |
В мышечном веретене мышц также содержатся совершенно разные типы мышечных волокон. Эти структуры воспринимают напряжение мышц. Чувствительность мышечных веретен может быть отрегулирована при сокращении их особых интрафузальных мышечных волокон. Веретена расположены параллельно основной мышце или экстра-фузальным волокнам. Уровнем сокращения интрафузальных мышечных волокон в веретенах управляют гамма-мотонейроны, тогда как альфа-мотонейроны регулируют экстра-фузальные мышечные волокна, которые непосредственно отвечают за сокращение мышц.
Эндокринология и мышечные волокна
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Существование различных типов мышечных волокон обеспечивает значительную гетерогенность тканей скелетных мышц и их способность выполнять разнообразные функциональные задачи. Иммуногистохимический и биохимический анализ скелетных мышц показал, что такое структурно-функциональное разнообразие мышечных волокон обусловлено существованием широкого спектра изоформ миозина. Миозин — молекула, от которой наряду с актином зависит мышечное сокращение. Молекула миозина состоит из двух тяжелых цепей (МуНС) и четырех легких цепей (MyLC) (Schiaffino, Reggiani, 1996; Pette, Staron, 1997). Тяжелые цепи миозина представлены несколькими изоформами, от свойств которых зависят скоростно-силовые качества мышечных волокон.
В скелетных мышцах взрослого человека происходит экспрессия четырех наиболее важных изоформ МуНС: MyHCip, MyHCIIA, MyHCIIX/IID и МуНСПВ. Каждая изоформа характеризуется специфической скоростью сокращения и развиваемым усилием. Волокна, содержащие MyHCI, отличаются низкой скоростью сокращения и развивают меньшее усилие по сравнению с волокнами, содержащими MyHCIIA, ИХ и IIB. Среди волокон, состоящих их быстрых МуНС, наиболее быстрыми и сильными являются те, которые построены из МуНСПВ, за ними следуют волокна, в состав которых входят МуНСИХ и MyHCIIA (Bottineli et al., 1994a, 1994b).
Занятия физическими упражнениями могут приводить к существенным изменениям сократительных свойств скелетных мышц. Принято считать, что тренировка выносливости сопровождается увеличением количества медленных изоформ миозина (Baumann et al., 1987; Schaub et al., 1989). В то же время силовая тренировка вызывает увеличение MyHCIIA и уменьшение МуНСПХ (Staron et al., 1991; Adams et al., 1993; Andersen J.L. et al., 1994; Fry et al., 1994; Kraemer et al., 1995; Kadi, Thorncll, 1999; Andersen J.L., Aagaard, 2000). Кроме того, предполагается, что мышечные волокна, содержащие МуНСИХ, у основной массы людей очень редко вовлекаются в выполнение работы в процессе обычной ежедневной активности. Если они начинают вовлекаться в выполнение работы, например в процессе физической тренировки, то превращаются в волокна, содержащие MyHCIIA (волокна, включающие эту изоформу тяжелых цепей миозина, обладают большей выносливостью по сравнению с волокнами типа ИХ) (Goldspink G. et al., 1991; Staron et al., 1991; Kraemer et al., 1995). Во время тренировки мышечной силы или выносливости происходит значительное изменение гормонального фона скелетных мышц, которое является мощным сигналом, способным запустить процесс изменения содержания изоформ миозина в мышцах, подвергающихся физической нагрузке.
Влияние тестостерона
В некоторых экспериментах на животных после применения андрогенных анаболических стероидов наблюдали изменение соотношения изоформ тяжелых цепей миозина в сторону увеличения медленных изоформ (Fritzshe et al., 1994; Czesla ct al., 1997). Сообщалось об увеличении доли волокон, содержащих MyHCIIA, наряду с сокращением количества волокон, содержащих МуНСПВ, в ряде скелетных мышц грызунов после применения андрогенных анаболических стероидов (Eggington, 1987; Dimauro et al., 1992). Однако сообщалось также о том, что андрогенные стероиды вызывают уменьшение доли мышечных волокон, содержащих MyHCIIA, по отношению к волокнам, состоящим из МуНСПВ (Kelly et al., 1985; Lyons et al., 1986; Salmons, 1992). Эти результаты говорят о том, что характер воздействия андрогенных анаболических стероидов на сократительные способности может зависеть от типа мышц и у различных видов может быть разным. Действительно, существуют и другие данные, свидетельствующие об отсутствии какого-либо воздействия андрогенных анаболических стероидов па соотношение мышечных волокон, содержащих различные изоформы МуНС. Например, в экспериментах на животных чрезмерная нагрузка мышц вызывала увеличение содержания медленных MyHCI, и дополнительное использование андрогенных анаболических стероидов не влияло на характер содержания тяжелых цепей миозина (Boissonneault et al., 1987). Точно так прием андрогенных анаболических стероидон не вызывал изменений сдвига соотношения изоформ МуНС, вызванного экспериментами с обездвиживанием нижней конечности (Tsika et al., 1987). Наконец, не удалось обнаружить никаких различий в соотношении разных изоформ МуНС в трапециевидной мышце хорошо тренированных тяжелоатлетов, принимавших и не принимавших андрогенные анаболические стероиды (Kadi et al., 1999b).
Влияние эстрогенов
Хорошо известен тот факт, что уменьшение развиваемой силы происходит в менопаузе (Greeves et al., 1999; Dionne et al., 2000; Meeuwsen et al., 2000). Ha клеточном уровне показано, что удаление яичников сопровождается изменением соотношения изоформ тяжелых цепей миозина в сторону увеличения медленных волокон и понижением спонтанного бега у крыс (Kadi et al., 2000). В целом изменения соотношения изоформ МуНС имеют следующую тенденцию: МуНС I < IIA < ИХ < ИВ. Эти результаты можно интерпретировать как то, что после удаления яичников происходят общие изменения содержания изоформ МуНС в сторону преобладания медленных изоформ, специфическая стимуляция генов медленных изоформ МуНС, или специфическое подавления генов, кодирующих медленные изоформы МуНС. Если животным с удаленными яичниками позволяли бегать и вводили эстрогены, в составе МуНС не происходило никаких изменений (Kadi et al., 2000). Таким образом, можно предположить, что двигательная активность в сочетании с введением эстрогенов способствуют поддержанию исходного соотношения быстрых и медленных волокон в мышцах.
Влияние соматотропного гормона
Сообщается о том, что прием соматотропного гормона (СТГ) индуцирует увеличение количества МуНСИХ в латеральной широкой мышце бедра у здоровых мужчин старшего возраста (Lange et al., 2002). Изменение соотношения изоформ МуНС в сторону увеличения МуНСИХ авторы исследования рассматривали как “омоложение” состава тяжелых цепей миозина, поскольку старение обычно сопровождается уменьшением доли МуНСИХ в этой группе мышц (Lange et al., 2002). Однако доля МуНСИХ у пациентов с дефицитом СТГ была выше по сравнению с основной массой здорового населения (Daugaard et al., 1999). Более того, после лечения больных с дефицитом СТГ препаратами рекомбинантного гормона роста в течение 6 месяцев у них не было выявлено никаких изменений в соотношении различных ияоформ МуНС (Daugaard et al., 1999). Аналогичным образом было показано, что применение СТГ у крыс приводит к существенному увеличению поперечного сечения мышечных волокон типа II в камбаловидной мышце, не оказывая заметного влияния на содержание различных изоформ в составе мышечных волокон (Aroniadou-Anderjaska et al., 1996). Вопрос о том, приводит ли повышение уровня СТГ к изменению соотношения изоформ МуНС в сторону увеличения быстрых изоформ миозина, требует дальнейших исследований.
Влияние гормонов щитовидной железы
Гормоны щитовидной железы, или тироидные гормоны, оказывают сильное регуляторное воздействие на соотношение различных изоформ тяжелой цепи миозина в составе скелетной мышцы (D’Albis, Butler-Browne, 1993). Показано, что регуляция соотношения МуНС в скелетных мышцах крысы является специфической для пола и типа мышц (Larsson, Yu, 1997). Применение 3.5.3’-трийодтиронина (Т3) приводит к подавлению содержания MyHCI и увеличению содержания MyHCIIA в камбаловидной мышце самцов и самок, тогда как стимуляция содержания МуНСИХ наблюдалась только в мышцах самцов крыс (Larsson, Yu, 1997). Применение Т3 не вызывало никаких изменений в длинном разгибателе пальцев стопы у самцов крыс. В то же время в аналогичной ситуации в той же мышце у самок отмечалось достоверное изменение соотношения изоформ MyHCIIA и ИВ в пользу увеличения последней (Larsson, Yu, 1997). В целом эти результаты показывают, что сократительные качества скелетных мышц находятся под контролем ряда гормонов и ростовых факторов и изменение гормонального фона в этих мышцах при выполнении физических упражнений может быть в определенной степени ответственным за изменение характеристик мышцы в соответствии с физиологическими потребностями. Становится все более очевидным, что изменения структуры и функции мышц, происходящие под влиянием изменений гормонального фона, могут зависеть от пола и типа мышц.
Заключение
Были рассмотрены лишь отдельные аспекты значения специфических гормонов и ростовых факторов в регуляции некоторых важных параметров мышц, определяющих спортивные показатели. Эта сфера мышечной физиологии только начинает развиваться и здесь еще многое предстоит открыть прежде чем станет понятно взаимоотношение различных факторов, принимающих участие в разнообразных процессах адаптации скелетных мышц к различным видам двигательной активности. Последовательное описание различных этапов адаптации мышц к двигательной активности позволит создать основу для концепции индивидуализированного выбора упражнений с целью оптимизации качества тренировочных программ как для хорошо физически подготовленных лиц, так и для тех, кто ведет малоподвижный образ жизни, а также для специальных групп населения.
Читайте также
- Андрогенные рецепторы
- Факторы роста фибробластов
- Инсулиноподобные факторы роста и их рецепторы
- Кровоснабжение скелетных мышц
- Гипертрофия мышц
- Нервно-мышечная передача
- Двигательная единица мыщцы
- Мышечная клетка
- Сокращение скелетных мышц
Литература
- Adams, G.R. & Haddad, F. (1996) The relationships among IGF-1, DNA content, and protein accumulation during skeletal muscle hypertrophy. Journal of Applied Physiology 81, 2509-2516.
- Adams, G.R., Hather, B.M., Baldwin, K.M. & Dudley, G.A. (1993) Skeletal muscle myosin heavy chain composition and resistance training. Journal of Applied Physiology 74, 911-915.
- Allen, D.L., Monke, S.R., Talmadge, R.J., Roy, R.R. & Edgerton, V.R. (1995) Plasticity of myonuclear number in hypertrophied and atrophied mammalian skeletal muscle fibers. Journal of Applied Physiology 78, 1969-1976.
- Allen, D.L., Yasui, W., Tanaka, T. et al. (1996) Myonuclear number and myosin heavy chain expression in rat soleus single muscle fibers after spaceflight. Journal of Applied Physiology 81, 145-151.
- Allen, D.L., Roy, R.R. & Edgerton, V.R. (1999) Myonuclear domains in muscle adaptation and disease. Muscle and Nerve 22, 1350-1360. Andersen, J.L. & Aagaard, P. (2000) Myosin heavy chain IPX overshoot in human skeletal muscle. Muscle and Nerve 23, 1095-1104. Andersen, J.L., Klitgaard, H. & Sal tin, B. (1994) Myosin heavy chain isoforms in single fibres from m. vastus lateralis of sprinters: influence of training. Acta Physiologica Scandinavica 151, 135-142. Andersen, P. & Henriksson, J. (1977) Capillary supply of the quadriceps femoris muscle of man: adaptive response to exercise. Journal of Physiology 270, 677-690.
- Antonio, J. & Gonyea, WJ. (1993) Skeletal muscle fiber hyperplasia. Medicine and Science in Sports and Exercise 25, 1333-1345. Aroniadou-Anderjaska, V., Lemon, P.W., Gilloteaux, J. (1996) Effects of exogenous growth hormone on skeletal muscle of young female rats. Tissue and Cell 28, 719-724.
- Baker, J., Liu, J.P., Robertson, E.J. & Efstratiadis, A. (1993) Role of insulin-like growth factors in embryonic and postnatal growth. Cell 75, 73-82.
- Bamman, M.M., Shipp, J.R., Jiang, J. et al. (2001) Mechanical load increases muscle IGF-I and androgen receptor mRNA concentrations in humans. American Journal of Physiology 280, 383-390.
- Baumann, H., Jaggi, М., Sol and, F., Howald, H. & Schaub, M.C. (1987) Exercise training induces transitions of myosin isoform subunits within histochemically typed human muscle fibres. Pfingers Arcfiiv 409, 349-360.
- Bhasin, S., Storer, T.W., Berman, N. et al. (1996) The effects of sup-raphysiologic doses of testosterone on muscle size and strength in normal men. New England Journal of Medicine 335, 1-7.
- Biolo, G.f Fleming, R.Y., Maggi, S.P. & Wolfe, R.R. (1995) Transmembrane transport and intracellular kinetics of amino acids in human skeletal muscle. American Journal of Physiology 268, E75-E84.
- Biolo, G., Tipton, K.D., Klein, S. & Wolfe, R.R. (1997) An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. American Journal of Physiology 273, E122-E129. Bischoff, R., 1994. The satellite cell and muscle regeneration. In: Myology (Engel, A.G., Franzini-Armstrong, C, eds.). McGraw-Hill, New York: 97-117.
- Boissonneault, G., Gagnon, J., Ho-Kim, M.A. & Tremblay, R.R. (1987) Lack of effect of anabolic steroids on specific mRNAs of skeletal muscle undergoing compensatory hypertrophy. Molecular and Cellular Endocrinology 51, 19-24.
- Bottinelli, R., Betto, R., Schiaffino, S. & Reggiani, C. (1994a) Maximum shortening velocity and coexistence of myosin heavy chain isoforms in single skinned fast fibres of rat skeletal muscle. Journal of Muscle Research and Cell Motility 15, 413-419.
- Bottinelli, R., Betto, R., Schiaffino, S. & Reggiani, C. (1994b) Unloaded shortening velocity and myosin heavy chain and alkali light chain isoform composition in rat skeletal muscle fibres. Journal of Physiology 478, 341-349.
- Brahm, H., Piehl-Aulin, K., Saltin, B. & Ljunghall, S. (1997) Net fluxes over working thigh of hormones, growth factors and biomarkers of bone metabolism during short lasting dynamic exercise. Calcified Tissue International 60, 175-180.
- Bricout, V., Germain, P., Serrurier, B. & Guezennec, C. (1994) Changes in testosterone muscle receptors: effects of an androgen treatment on physically trained rats. Cellular and Molecular Biology 40, 291-294.
- Cabric, M. & James, N.T. (1983) Morphometric analyses on the muscles of exercise trained and untrained dogs. American Journal of Anatomy 166, 359-368.
- Campion, D.R. (1984) The muscle satellite a review. International Review of Cytology 87 , 225-251.
- Charifi, N.. Kadi, F., Feasson, L. & Denis, C. (2003a) Effects of endurance training on satellite cell frequency in skeletal muscle of old men. Muscle and Nerve 28, 87-92.
- Charifi, N., Kadi, F., Feasson, L. et ah (2003b) Enhancement of microvessel tortuosity in the vastus lateralis muscle of old men in response to endurance training. Journal of Physiology 554, 559-569.
- Cheek, D.B. (1985) The control of cell mass and replication. The DNA unit: a personal 20-year study. Early Human Development 12, 211-239.
- Chesley, A., MacDougall J.D., Tarnopolsky, M.A., Atkinson, S.A. & Smith, K. (1992) Changes in human muscle protein synthesis after resistance exercise. Journal of Applied Physiology 73, 1383-1388.
- Clarke, M.S. & Feeback, D.L. (1996) Mechanical load induces sarcoplasmic wounding and FGF release in differentiated human skeletal muscle cultures. FASEB Journal 10, 502-509.
- Czesla, Mv Mehlhom, G., Fritzsche, D. & Asmussen, G. (1997) Cardiomyoplasty: improvement of muscle fibre type transformation by an anabolic steroid (metenolone). Journal of Molecular and Cellular Cardiology 29, 2989-2996.
- D’albis, A. & Butler-Browne, G. (1993) The hormonal control of myosin isoform expression in skeletal muscle of mammals: a review. Basic and Applied Myology 3(1), 7-16.
- Daugaard, J.R., Bramnert, М., Manhem, P. et al. (1999) Effect of 6 months of GH treatment on myosin heavy chain composition in GH-deficient patients. European Journal of Endocrinology 141, 342-349.
- DeChiara, T.M., Efstratiadis, A. & Robertson, EJ. (1990) A growth-deficiency phenotype in heterozygous mice carrying an insulin-like growth factor II gene disrupted by targeting. Nature 345, 78-80.
- Deschenes, M.R., Maresh, CM., Armstrong, L.E. et al. (1994) Endurance and resistance exercise induce muscle fiber type specific responses in androgen binding capacity. Journal of Steroid Biochemistry and Molecular Biology 50, 175-179.
- Dimauro, J., Balnave, R.J. & Shorey, CD. (1992) Effects of anabolic steroids and high intensity exercise on rat skeletal muscle fibres and capillarization. A morphometric study. European Journal of Applied Physiology 64, 204-212.
- Dionne, I,J., Kinaman, K.A. & Poehlman, E.T. (2000) Sarcopenia and muscle function during menopause and hormone-replacement therapy. Journal of Nutrition, Health and Aging 4(3), 156-161.
- Dodson, M.V., Allen, R.E. & Hossner, K.L. (1985) Ovine somatomedin, multiplication-stimulating activity, and insulin promote skeletal muscle satellite cell proliferation in vitro. Endocrinology 117. 2357-2363.
- Dorlochter, М., Astrow, S.H. & Herrera, A.A. (1994) Effects of testosterone on a sexually dimorphic frog muscle: repeated in vivo observations and androgen receptor distribution. Journal of Neurobiology 25, 897-916.
- Doumit, M.E., Cook, D.R. & Merkel, R.A. (1996) Testosterone up-regulates androgen receptors and decreases differentiation of porcine myogenic satellite cells in vitro. Endocrinology 137, 1385-1394.
- Egginton, S. (1987) Effects of an anabolic hormone on striated muscle growth and performance. Pflugers Archio 410, 349-355.
- Fernandez, A.M., Dupont, J., Farrar, R.P. et al. (2002) Muscle-specific inactivation of the IGF-I receptor induces compensatory hyperplasia in skeletal muscle. Journal of Clinical Investigation 109, 347-355.
- Florini, J.R., Ewton, D.Z. & Roof, S.L. (1991) Insulln-like growth factor-I stimulates terminal myogenic differentiation by induction of myogenin gene expression. Molecular Endocrinology (Baltimore, Md.) 5, 718-724.
- Floss, Т., Arnold, H.H. & Braun, T. (1997) A role for FGF-6 in skeletal muscle regeneration. Genes and Development 11, 2040-2051.
- Frederickson, R. & Sonenberg, N.. 1993. eIF-4E phosphorylation and the regulation of protein synthesis. In: Translational Regulation of Gene Expression (Ilan, J., ed.). Plenum Press, New York: 143-162.
- Fritzsche, D., Krakor, R., Asmussen, G. et al. (1994) Effect of an anabolic steroid (Metenolon) on contractile performance of the chronically stimulated latissimus dorsi in sheep. European Journal of Cardio-thoracic Surgery 8, 214-219.
- Fry, A.C, Allemeier, C.A. & Staron, R.S. (1994) Correlation between percentage fiber type area and myosin heavy chain content in human skeletal muscle. European Journal of Applied Physiology 68, 246-251.
- Galavazi, G. & Szirmai, J.A. (1971) Cytomorphometry of skeletal muscle: the influence of age and testosterone on the rat m. levator ani. Zeitschrift fur Zellforschung und Mikroskopische Anatomic 121, 507-530.
- Gerber, H.P., Condorelli, F., Park, J. & Ferrara, N. (1997) Differential transcriptional regulation of the two vascular endothelial growth factor receptor genes. Fit-1, but not Flk-1 / KDR, is up-regulated by hypoxia. Journal of Biological Chemistry 272, 23 659-23 667.
- Giddings, CJ. & Gonyea, W.J. (1992) Morphological observations supporting muscle fiber hyperplasia following weight-lifting exercise in cats. Anatomical Record 233, 178-195.
- Goldberg, A.L., Et linger, J.D., Goldspink, D.F. & Jablecki, С (1975) Mechanism of work-induced hypertrophy of skeletal muscle. Medicine and Science in Sports 7, 185-198.
- Goldspink, D.F., Cox, V.M., Smith, S.K. et al. (1995) Muscle growth in response to mechanical stimuli. American Journal of Physiology 268, 288-297.
- Goldspink, G. (1999) Changes in muscle mass and phenotype and the expression of autocrine and systemic growth factors by muscle in response to stretch and overload. Journal of Anatomy 194, 323-334.
- Goldspink, G., Scutt, A., Martindale, J. et al. (1991) Stretch and force generation induce rapid hypertrophy and myosin isoform gene switching In adult skeletal muscle. Biochemical Society Transactions 19, 368-373.
- Greeves, J.P., Cable, N.T., Reilly, T. & Kingsland, C. (1999) Changes in muscle strength in women following the menopause: a longitudinal assessment of the efficacy of hormone replacement therapy. Clinical Science (London, England) 97(1), 79-84.
- Gustafsson, Т., Puntschart, A., Kaijser, L., Jansson, E. & Sundberg, CJ. (1999) Exercise-induced expression of angiogenesis-related transcription and growth factors in human skeletal muscle. American Journal of Physiology 276, 679-685.
- Gustafsson, Т., Knutsson, A., Puntschart, A. et al. (2002) Increased expression of vascular endothelial growth factor in human skeletal muscle in response to short-term onelegged exercise training. Pflugers Archiv 444, 752-759.
- Hail, Z.W. & Ralston, E. (1989) Nuclear domains in muscle cells. Cell 59, 771-772.
- Hameed, М., Harridge, S.D. & Goldspink, G. (2002) Sarcopenia and hypertrophy: a role for insulin-like growth factor-I in aged muscle? Exercise and Sport Sciences Reviews 30, 15-19.
- Hameed, М., Orrell, R.W., Cobbold, М., Goldspink, G. & Harridge, S.D. (2003) Expression of IGF-I splice variants in young and old human skeletal muscle after high resistance exercise. Journal of Physiology 547 , 247-254.
- Hellsten, Y., Hansson, H.A., Johnson, L., Frandsen, U. & Sjodin, B. (1996) Increased expression of xanthine oxidase and insulin-like growth factor I (IGF-I) immunoreactivity in skeletal muscle after strenuous exercise in humans. Acta Physiologica Scandinavica 157, 191-197.
- Hickson, R.C. & Kurowski, T.G. (1986) Anabolic steroids and training. Clinics in Sports Medicine 5, 461-469.
- Hikida, R.S., Van-Nostran, S., Murray, J.D. et al. (1997) Myonuclear loss in atrophied soleus muscle fibers. Anatomical Record 247, 350-354.
- Hikida, R.S., Walsh, S., Barylski, N. et al. (1998) Is hypertrophy limited in elderly muscle fibers? A comparison of elderly and young strength-trained men. Basic and Applied Myology 8(6), 419-427.
- Hudlicka, O., Brown, M. & Egginton, S. (1992) Angiogenesis in skeletal and cardiac muscle. Physiological Reviews 72, 369-417.
- Inoue, K., Yamasaki, S., Fushiki, T. et al. (1993) Rapid increase in the number of androgen receptors following electrical stimulation of the rat muscle. European Journal of Applied Physiology 66, 134-140.
- Inoue, K., Yamasaki, S., Fushiki, Т., Okada, Y. & Sugimoto, E. (1994) Androgen receptor antagonist suppresses exercise-induced hypertrophy of skeletal muscle. European Journal of Applied Physiology 69, 88-91.
- Janssen, P.J., Brinkmann, A.O., Boersma, W.J. & Van-Der-Kwast, Т.Н. (1994) Immunohistochemical detection of the androgen receptor with monoclonal antibody F39.4 in routinely processed, paraffin-embedded human tissues after microwave pre-treatment. Journal of Histochemistry and Cytochemistry 42, 1169-1175.
- Jennische, E. (1989) Sequential immunohistochemical expression of IGF-I and the transferrin receptor in regenerating rat muscle in vivo. Acta Endocrinologica 121, 733-738.
- Jennische, E. & Matejka, G.L. (1992) IGF-I binding and IGF-I expression in regenerating muscle of normal and hypophysectomized rats. Acta Physiologica Scandinavica 146, 79-86.
- Jennische, E., Skottner, A. & Hansson, H.A. (1987) Satellite cells • express the trophic factor IGF-I in regenerating skeletal muscle. Acta Physiologica Scandinavica 129, 9-15.
- Joubert, Y. & Tobin, C. (1989) Satellite cell proliferation and increase in the number of myonuclei induced by testosterone in the levator ani muscle of the adult female rat. Developmental Biology 131, 550-557.
- Joubert, Y. & Tobin, C. (1995) Testosterone treatment results in quiescent satellite cells being activated and recruited into cell cycle in rat levator ani muscle. Developmental Biology 169, 286-294.
- Kadi, F. (2000) Adaptation of human skeletal muscle to training and anabolic steroids. Acta Physiologica Scandinavica 646, 1-52.
- Kadi, F. & Thomell, L.E. (1999) Training affects myosin heavy chain phenotype in the trapezius muscle of women. Histochemistry and Cell Biology 112, 73-78.
- Kadi, F. & Thomell, L.E. (2000) Concomitant increases in myonuclear and satellite cell content in female trapezius muscle following strength training. Histochemistry and Cell Biology 113, 99-103.
- Kadi, F., Eriksson, A., Holmner, S., Butler-Browne, G.S. & Thomell, L.E. (1999a) Cellular adaptation of the trapezius muscle in strength-trained athletes. Histochemistry and Cell Biology 111, 189-195.
- Kadi, F., Eriksson, A., Holmner, S. & Thomell, L.-E. (1999b) Effects of anabolic steroids on the muscle cells of strength-trained athletes. Medicine and Science in Sports and Exercise 31, 1528-1534.
- Kadi, F., Ahlgren, C, Waling, K., Sundelin, G. & Thomell, L.E. (2000a) The effects of different training programs on the trapezius muscle of women with work-related neck and shoulder myalgia. Acta Neuropathologica 100, 253-258.