|
|
| (не показаны 2 промежуточные версии этого же участника) |
| Строка 1: |
Строка 1: |
| | == Почки. Солевой и водный баланс == | | == Почки. Солевой и водный баланс == |
| | | | |
| − | == Строение и работа почек == | + | == Функции == |
| | | | |
| − | В [[Почки|почках]] протекают три процесса: (1) большие количества воды и растворенных в ней веществ фильтруются из крови - образуется первичная моча; (2) первичная моча входит в почечные канальцы, где большая ее часть реабсорбируется, т. е. выходит из канальцев и поступает обратно в кровь; (3) некоторые вещества (например, токсины) не реабсорбируются, а активно секретируются в просвет канальцев. Нереабсорбированный остаточный фильтрат выводится ([[Экскреция (выведение) лекарственных средств|экскретируется]]) вместе с растворенными в нем веществами в виде вторичной мочи.
| + | [[Почки]] регулируют выведение из организма воды и солей с целью поддержания постоянного объема внеклеточной жидкости и осмоляльности, помогают поддерживать [[Кислотно-щелочной баланс|кислотно-основной гомеостаз]]; удаляют конечные продукты [[Метаболизм препаратов и лекарств|метаболизма]] и чужеродные вещества; предотвращают выведение полезных веществ (например, глюкозы) путем реабсорбции; продуцируют гормоны (например, [[Эритропоэтин в спорте|эритропоэтин]]) и активаторы гормонов (ренин); выполняют метаболические функции ([[катаболизм]] белков и пептидов, [[глюконеогенез]] и т. д.). |
| − | | |
| − | === Функции ===
| |
| − | | |
| − | Почки (1) регулируют выведение из организма воды и солей с целью поддержания постоянного объема внеклеточной жидкости и осмоляльности (2) помогают поддерживать [[Кислотно-щелочной баланс|кислотно-основной гомеостаз]]; (3) удаляют конечные продукты [[Метаболизм препаратов и лекарств|метаболизма]] и чужеродные вещества; (4) предотвращают выведение полезных веществ (например, глюкозы) путем реабсорбции; (5) продуцируют гормоны (например, [[Эритропоэтин в спорте|эритропоэтин]]) и активаторы гормонов (ренин); (6) выполняют метаболические функции ([[катаболизм]] белков и пептидов, [[глюконеогенез]] и т. д.).
| |
| − | | |
| − | === Строение нефрона ===
| |
| − | [[Image:Naglydnay_fiziologiya142.jpg|250px|thumb|right|А. Анатомия почек (схема)]]
| |
| − | Каждая почка имеет около 10<sup>6</sup> нефронов, каждый состоит из мальпигиева тельца и канальца. Мальпигиево тельце расположено в коре почек (А) и состоит из пучка капилляров (клубочка), окруженного капсулой с двойными стенками (боуменовой капсулой, капсулой Боумена-Шумлянского). Первичная моча аккумулируется в просвете между двумя стенками капсулы (Б). Кровь входит в клубочек через приносящую артериолу (приносящий сосуд) и выходит через выносящую артериолу (выносящий сосуд), которая распадается на капиллярную сеть. Клубочковый фильтр (Б) отделяет кровеносную систему от просвета боуменовой капсулы.
| |
| − | | |
| − | Клубочковый фильтр состоит из фенестрированного (окончатого, дырчатого или перфорированного) эндотелия клубочковых капилляров (размер поры 50-100 нм), за ним следует второй слой базальной мембраны и со стороны мочи висцеральная мембрана боуменовой капсулы. Последняя мембрана образована подоцитами с многочисленными пальцеобразными отростками [ножками). Щели между ними покрыты щелевой мембраной, поры которой имеют около 5 нм в диаметре. Они образованы белком неф-рином, который заякорен на цитоскелете подоцитов.
| |
| − | [[Image:Naglydnay_fiziologiya143.jpg|250px|thumb|right|Б. Клубочек и боуменова капсула]]
| |
| − | *Проксимальный каналец (А, темно-зеленый цвет) - самый длинный отдел нефрона (примерно 10 мм). Его скрученный начальный сегмент [проксимальный извитой каналец, ПИК', АЗ) переходит в прямой отдел [собирательной трубочки, А4).
| |
| − | | |
| − | *Петля Генле состоит из толстого сегмента нисходящего колена, который тянется в мозговое вещество почки (А4 = ППК, проксимальный прямой каналец), тонкого сегмента нисходящего колена (А5), тонкого сегмента восходящего колена (только в юкстамедуллярных нефронах, имеющих длинную петлю) и толстого сегмента восходящего колена, СВК (А6). Петля Генле имеет плотное пятно - группу специализированных клеток, которые близко контактируют с клубочком соответствующего нефрона. Только около 20% всех петель Генле (глубоких юкстамедуллярных нефронов) имеют достаточную длину для того, чтобы проникнуть в мозговое вещество. Кортикальные нефроны имеют более короткие петли (А).
| |
| − | | |
| − | *Дистальный каналец (А, серо-зеленый цвет) имеет прямой начальный отдел (= СВК петли Генле, АБ), который сливается с извитым канальцем [дистальный извитой каналец, ДИК, А7).
| |
| − | | |
| − | ДИК переходит в соединительный каналец (А8). Большинство из них ведет в собирательную трубочку, СТ (А9), которая тянется сквозь кору почки (корковая собирательная трубочка) и мозговое вещество (мозговая собирательная трубочка). У почечных сосочков собирательная трубочка открывается в почечную лоханку. Отсюда моча, проталкиваемая перистальтическими сокращениями, по мочеточнику поступает в мочевой пузырь и далее в мочеиспускательный канал (уретру), по которому и выводится из организма.
| |
| − | Мочеиспускание
| |
| − | | |
| − | Опорожнение мочевого пузыря регулируется реф-лекторно. Наполнение пузыря активирует гладкую мускулатуру стенки мочевого пузыря посредством сократительных рецепторов и парасимпатических нейронов (S2-S4). При малом объеме наполнения стенки расслабляются посредством симпатических нейронов (L1-L2), контролируемых супраспинальными центрами (варолиев мост). При увеличении объема наполнения (> 0,3 л) достигается пороговое давление (около 1 кПа), запускающее мочеиспускательный рефлекс по принципу положительной обратной связи. Мышцы стенки пузыря сокращаются, что ведет к увеличению давления, дальнейшему увеличению сокращения и т. д. до тех пор, пока не открываются внутренние (гладкомышечные) и внешние сфинктеры (поперечно-полосатые мышцы); в результате происходит мочеиспускание.
| |
| − | | |
| − | == Почечная циркуляция ==
| |
| − | [[Image:Naglydnay_fiziologiya144.jpg|200px|thumb|right|А. Кровоток в почках]]
| |
| − | Дуговые артерии (А1) проходят между корой и мозговым веществом почек. По направлению к коре они разветвляются на междольковые артерии (А2), от которых отходят приносящие артериолы (или приносящие сосуды) (АЗ). Кровоснабжение почек уникально и устроено по принципу двух последовательных капиллярных сетей, которые соединены друг с другом выводящими артериолами (выносящими сосудами) (А, Б). Давление в первой сети клубочковых капилляров относительно высокое (Б) и регулируется путем изменения просвета междольковой артерии, приносящих и/или выносящих сосудов (АЗ, 4). Вторая сеть перитубулярных капилляров (А) обвивает кортикальные канальцы. Эта сеть снабжает кровью клетки канальцев, но также выполняет обмен веществ с просветом канальцев (реабсорбция, секреция).
| |
| − | | |
| − | Почечный кровоток (ПКТ) относительно быстрый (высокий), примерно 1,2 л/мин, что эквивалентно 20-25% минутного сердечного выброса. Это требует поддержания высокого уровня (скорости) клубочковой фильтрации (СКФ) и ведет к очень низкой артериально-венозной разнице О2 (примерно 15 мл/л крови). В коре почек О2 потребляется (примерно 18 л/мин) для окислительного метаболизма жирных кислот и других веществ. Большая часть продуцируемого АТФ используется для обеспечения активного транспорта. В мозговом веществе почек метаболизм в основном анаэробный.
| |
| − | | |
| − | Около 90% почечного кровотока идет в кору почек. В расчете на грамм ткани примерно 5,1,75 и 0,5 мл/мин крови проходит через кору, внешний и внутренний слои мозгового вещества соответственно. Даже самый обедненный кровью внутренний слой мозгового вещества (всего 0,5 мл/мин) получает крови больше, чем большинство других органов.
| |
| − | [[Image:Naglydnay_fiziologiya145.jpg|200px|thumb|right|Б. Почечное кровяное давление]]
| |
| − | Почки содержат два типа нефронов, которые различаются свойствами второй капиллярной сети (А).
| |
| − | | |
| − | *Нефроны коры оснащены перитубулярными капиллярами и имеют короткие петли Генле.
| |
| − | | |
| − | *Юкстамедуллярные нефроиы расположены на границе коры и мозгового вещества. Их выносящие артериолы дают начало сравнительно длинным (s 40 мм) прямым артериолам, которые проходят через мозговое вещество. Прямые артериолы снабжают мозговое вещество почек и могут сопровождать длинные петли Генле юкстамедуллярных нефронов до самых вершин почечных сосочков. Их волосообразная форма важна для концентрирования мочи.
| |
| − | | |
| − | Любые изменения распределения крови в этих двух типах нефронов воздействуют на выведение NaCI. Антидиуретический гормон (АДГ) увеличивает скорость клубочковой фильтрации (СКФ) юкстамедуллярных нефронов.
| |
| − | [[Image:Naglydnay_fiziologiya146.jpg|250px|thumb|right|В. Саморегуляция почечного кровотока (ПКТ) и скорость клубочковой фильтрации (СКФ)]]
| |
| − | Благодаря саморегуляции почечного кровотока колебания кровяного давления в интервале 80-180 мм рт. ст. вызывают лишь небольшие изменения почечного плазмотока (ППТ) и скорости клубочковой фильтрации (СКФ) (даже в деиннервированной почке) (В). Сопротивление в междольковых артериях и приносящих артериолах, расположенных выше клубочков коры, автоматически выравнивается, когда меняется среднее кровяное давление (Б, В). Однако, если кровяное давление падает ниже 80 мм рт. ст., почечная циркуляция и фильтрация уменьшаются (В). ПКТ и СКФ могут регулироваться независимо друг от друга путем изменения сопротивления приносящих и выносящих артериол.
| |
| − | | |
| − | Неинвазивным методом можно определить ПКТ в том случае, если известен почечный плазмоток (ППТ) (обычно около 0,6 л/мин). ПКТ измеряют по равновесному количеству (согласно принципу Фика) внутривенно введенного контрастного вещества (например, п-аминогиппурата, ПАГ), которое должно почти полностью выводиться с мочой за время одного почечного цикла (ПАГ фильтруется и очень эффективно выводится). Выводимое количество ПАГ можно найти как разность между скоростью притока ПАГ в почки по артерии и скоростью венозного опока ПАГ из почек:
| |
| − | | |
| − | Количество вещества/время = (объем раствора/время) • концентрация [7.1]
| |
| − | | |
| − | (ППТ • РаПАГ) - (ППТ • РrvПАГ) = VU * UПАГ[7.2] или ППТ = VU • UПАГ/(РаПАГ - РrvПАГ) [7 3!
| |
| − | | |
| − | где РаПАГ - концентрация ПАГ в артериальной крови, РrvПАГ - концентрация ПАГ в венозной крови, UПАГ - концентрация ПАГ в моче, VU - скорость продукции мочи (в единицу времени); РrvПАГ составляет только 10% РаПАГ и в норме ее не измеряют напрямую, а оценивают как 0,9 клиренса ПАГ (= VU * UПАГ/0,9 • РаПАГ). Таким образом, ППТ = VU * UПАГ/0,9 • РаПАГ 17.4]
| |
| − | | |
| − | Эта формула верна только в том случае, если значение РаПАГ не очень высокое. Иначе секреция ПАГ выходит на насыщение, и клиренс ПАГ гораздо меньше, чем ППТ.
| |
| − | | |
| − | Почечный кровоток (ПКТ) получаем, вводя известное значение гематокрита (Hct) в следующее уравнение:
| |
| − | | |
| − | ПКТ = ППТ/(1 - Hct). [7.5]
| |
| − | | |
| − | == Клубочковая фильтрация и клиренс ==
| |
| − | [[Image:Naglydnay_fiziologiya147.jpg|250px|thumb|right|А. Клиренс инулина - скорость клубочковой фильтрации (СКФ)]]
| |
| − | '''Скорость клубочковой фильтрации (СКФ)''' - общий объем жидкости, фильтруемый клубочками обеих почек за единицу времени. Обычно он составляет 120 мл/мин на 1,73 м2 поверхности тела, что эквивалентно 180 л/сутки. Соответственно объем внеклеточной жидкости всего тела (примерно 17 л) проходит через почечные канальцы около 10 раз в сутки. Около 99% СКФ возвращается во внеклеточное пространство за счет канальцевой реабсорбции. В среднем на экскрецию Н2О, таким образом, приходится около 1% от СКФ, а абсолютная экскреция Н2О (выход мочи/время = VU] составляет около 1-2 л в сутки.
| |
| − | | |
| − | СКФ составляет около 20% почечного плазмотока, ППТ. Фильтрационная фракция (ФФ) определяется как отношение СКФ/ППТ. Фракция фильтрации увеличивается под действием атриопептина, пептидного гормона, усиливающего сопротивление выносящих артериол (Re) и одновременно снижающего сопротивление приносящих артериол (Ra). Это повышает давление эффективной фильтрации в клубочковых капиллярах, при этом существенно не меняя общего сопротивления почечной циркуляции.
| |
| − | | |
| − | Эффективное фильтрационное давление (Реff) -это движущая сила фильтрации. Peff равно разности давлений в клубочковых капиллярах (Рсaр « 48 мм рт. ст.), в просвете боуменовой капсулы [Pbow~ 13 мм рт. ст.) и онкотического давления капиллярной крови (πсaр от 25 до 35 мм рт. ст.):
| |
| − | | |
| − | Рeff = Рcap - Pbow - πсaр (7.6]
| |
| − | | |
| − | На артериальном конце капилляров Peff- 48-13-25 = 10 мм рт. ст. По причине большой фильтрационной фракции концентрация белков в плазме и, следовательно, величина πсaр в клубочковых капиллярах увеличивается, а снижается. (Среднее эффективное фильтрационное давление Peff использовано в уравнении [7.7].) Таким образом, фильтрация прекращается (у дистального конца капилляров), когда πсaр увеличивается примерно до 35 мм рт. ст., снижая до нуля давление Peff (наступает фильтрационное равновесие).
| |
| − | | |
| − | СКФ является функцией (среднее для всех клубочков), площади фильтрации А (зависит от количества интактных клубочков) и гидравлической проводимости к клубочкового фильтра для воды*. Иногда используют коэффициент фильтрации Kf= А- к.
| |
| − | | |
| − | СКФ = Peff * Кf, [7.7]
| |
| − | | |
| − | к- это объем воды, фильтруемой через единицу площади в единицу времени при единичной разности давлений.
| |
| − | [[Image:Naglydnay_fiziologiya148.jpg|250px|thumb|right|Б. Клиренс ниже (1) или выше (2) клиренса инулина]]
| |
| − | Для измерения СКФ в кровь вводят индикаторное вещество и определяют его содержание в плазме. Индикаторное вещество должно удовлетворять следующим требованиям:
| |
| − | | |
| − | *свободно фильтроваться почками;
| |
| − | | |
| − | *количество этого вещества не меняется из-за ресорбции или секреции в канальцах;
| |
| − | | |
| − | *не метаболизироваться в почках;
| |
| − | | |
| − | *не влиять на функцию почек.
| |
| − | | |
| − | Этим требованиям удовлетворяет инулин, вводимый внутривенно. Используют также эндогенный креатинин, в норме присутствующий в крови, хотя для этого индикатора существуют ограничения.
| |
| − | | |
| − | Количество индикатора, фильтрующегося в единицу времени (А), определяется как произведение его концентрации в плазме [Pin, в г/л или моль/л) на СКФ, в л/мин. За данное время в моче появляется такое же количество индикатора (условия 2 и 3, см. выше), которое находят как произведение V*U (л/мин) на концентрацию индикатора в моче (Uin в г/л или моль/л), т. е. Pin • СКФ =VU* Ujn, или
| |
| − | | |
| − | СКФ =VU*Uin/Pin [л/мин]. [7.8]
| |
| − | | |
| − | Выражение в правой части уравнения [7.8] называется клиренсом, вне зависимости от того, какое вещество изучается. Таким образом, клиренс инулина или клиренс креатинина характеризует СКФ. (Концентрация креатинина в плазме, Рсr, растет с уменьшением СКФ, однако креатинин не очень надежен для определения СКФ.)
| |
| − | | |
| − | Клиренс равен абсолютно свободному (очищенному) объему плазмы, проходящему через почку в единицу времени. Фракция экскреции (ФЭ) определяется как отношение клиренса вещества X к клиренсу инулина [Cx/Cin). ФЭ показывает, какая доля фильтруемого количества вещества X была удалена через почки . Если вещество удаляется из канальца путем реабсорбции (например, Na<sup>+</sup>, Cl“, аминокислоты, глюкоза и т.д.; Б1), то ФЭ < 1, а если вещество подлежит фильтрации и секреции в канальцах, то его ФЭ > 1 (Б2). Для ПАГканальцевая секреция очень эффективна, и ФЭпaг = 5 (500%).
| |
| − | | |
| − | Абсолютный уровень реабсорбции и секреции свободно фильтруемого почками вещества X (ммоль/мин) определяется как разность между фильтруемым за определенное время количеством (СКФ • Рх) и экскретируемым количеством за то же время (VU • Ux), причем положительное число означает чистую реабсорбцию, а отрицательное - чистую секрецию. (Для инулина результат был бы равен 0.)
| |
| − | | |
| − | == Транспорт в нефроне ==
| |
| − | [[Image:Naglydnay_fiziologiya149.jpg|250px|thumb|right|А. Фракция экскреции (ФЭ) Б. Канальцевый транспорт]]
| |
| − | === Фильтрация растворенных веществ ===
| |
| − | Клубочковый фильтрат также содержит в растворе небольшие молекулы из плазмы (ультрафильтрат). Клубочковый коэффициент просеивания (ККС) данного вещества (отношение концентрации в фильтрате к концентрации в плазме) - это мера гидравлической проницаемости клубочкового фильтра для этого вещества. Молекулы с радиусом r < 1,8 нм (молекулярная масса <10 000 Да) могут свободно проходить через фильтр (ККС »1,0), а молекулы с радиусом r > 4,4 нм (например, глобулины, молекулярная масса >80 000 Да) обычно не проходят (ККС = 0). Лишь часть молекул размером 1,8 нм < r < 4,4 нм способна пройти через фильтр (ККС от 0 до 1). Отрицательно заряженные частицы (например, альбумин: r = 3,4; ККС « 0,0003) хуже проникают через фильтр, чем нейтральные частицы того же радиуса, поскольку отрицательный заряд на стенках клубочкового фильтра отталкивает эти ионы. Если небольшие молекулы связаны с белками плазмы, то эта фракция практически не фильтруется.
| |
| − | | |
| − | Считается, что молекулы, захваченные клубочковым фильтром, элиминируются фагоцитами и клубочковыми подоцитами.
| |
| − | | |
| − | === Канальцевый эпителий ===
| |
| − | Эпителиальные клетки, выстилающие почечные канальцы и собирательную трубочку, полярные. Так, их обращенная в просвет со стороны мочи (апикальная) мембрана значительно отличается от базолатеральной мембраны (со стороны крови). Апикальная мембрана проксимального канальца покрыта густой щеточной каемкой, которая значительно увеличивает контакт мембраны с канальцевой жидкостью (особенно проксимальных извитых канальцев). Базолатеральная мембрана этого сегмента канальцев увеличена за счет многочисленных отростков, которые, переплетаясь, образуют систему широких каналов - базолатеральный лабиринт, находящийся в близком контакте с внутриклеточными митохондриями, производящими АТФ, необходимый для работы Na<sup>+</sup>-К<sup>+</sup>-АТФазы в базолатеральной мембране (всех эпителиальных клеток). Большая площадь поверхности (около 100 м2) клеток проксимальных канальцев обеих почек необходима для реабсорбции большей части растворенных веществ в течение контактного времени в несколько секунд. Клеткам постпроксимальных канальцев микроворсинки очень нужны, так как количество реабсорбированных веществ резко снижается от проксимального к дистальному сегменту канальцев.
| |
| − | | |
| − | Проводимость этих двух мембран имеет решающее значение для трансцеллюлярного транспорта (реабсорбция, секреция), а герметичность плотных контактов определяют парацеллюлярную проводимость эпителия для воды и растворенных веществ, которые пересекают эпителий при помощи парацеллюлярного транспорта. Плотные контакты проксимальных канальцев относительно проницаемы для воды и небольших ионов на большом участке поверхности клеточной мембраны, делая эпителий хорошо оснащенным для пара- и трансцеллюлярного транспорта (Г, колонка 2). Тонкий сегмент петли Генле достаточно «протекаем», тогда как толстый сегмент восходящего колена и остальные канальцы, а также собирательная трубочка имеют «умеренно плотный» эпителий. На более плотном эпителии может развиться гораздо более высокий химический и электрический градиенты, чем на «протекающем» эпителии.
| |
| − | [[Image:Naglydnay_fiziologiya150.jpg|250px|thumb|right|В. Важные транспортные процессы вдоль нефрона]]
| |
| − | === Измерения реабсорбции, секреции и экскреции ===
| |
| − | | |
| − | По концентрации данного вещества в моче нельзя определить, будет ли отфильтрованное клубочками вещество реабсорбировано или секретировано в канальцах и собирательной трубочке, и в какой степени. Причиной является тот факт, что его концентрация увеличивается из-за реабсорбции воды. Отношение концентраций инулина (или креатинина) в моче и в плазме, Uin/Pin, является мерой реабсорбции воды. Инулин и креатинин могут быть использованы в качестве индикаторов, поскольку они не реабсорбируются и не секретируются. Таким образом, изменение концентрации индикаторов по длине канальцев происходит только вследствие реабсорбции Н2О (А). Если Uin/Pin = 200, то концентрация инулина во вторичной моче в 200 раз выше, чем в исходном фильтрате. Это подразумевает, что фракция экскреции воды (ФЭH<sub>2</sub>O) составляет 1/200, или 0,005, или 0,5% от СКФ. Определение концентрации вещества X (свободно фильтруемого и, возможно, дополнительно секретируемого) в тех же образцах мочи или плазмы, в которых было измерено соотношение UJPjn, дает Ux/Px. Учитывая, что отношение Uin/Pin - это фракция экскреции вещества X, ФЭХ можно рассчитать по формуле (А и Г, в %, колонка 5):
| |
| − | | |
| − | ФЭХ= (Ux/Px)/(Uin/Pin)[7.9]
| |
| − | | |
| − | Уравнение 7.9 можно также вывести из отношения Cx/Cjn, упростив для VU. Фракция реабсорбции вещества X (ФРx) определяется как
| |
| − | | |
| − | ФРХ = 1-ФЭХ. [7.10]
| |
| − | | |
| − | === Реабсорбция в различных сегментах канальцев ===
| |
| − | [[Image:Naglydnay_fiziologiya151.jpg|250px|thumb|right|Г. Реабсорбция, секреция и экскреция]]
| |
| − | Концентрация вещества X (TFx) и инулина (TFin) в канальцевой жидкости может быть измерена при помощи микропункции (А). Эти величины можно использовать для вычисления нереабсорбируемой фракции (фракции доставки, ФД) свободно фильтруемого вещества X следующим образом:
| |
| − | | |
| − | ФД = (TFx/Px)/(TFin/Pin),
| |
| − | | |
| − | где Рх и Pin-соответствующие концентрации в плазме (более точно: в пересчете на воду, содержащуюся в плазме).
| |
| − | | |
| − | Фракция реабсорбции (ФР) до тестируемого участка может быть получена как 1 - ФД (Г, колонки 2 и 3, в %).
| |
| − | | |
| − | Реабсорбция и секреция различных веществ. Кроме H<sub>2</sub>O, многие неорганические ионы (Na<sup>+</sup>, Cl<sup>-</sup>, К<sup>+</sup>, Са<sup>2+</sup>, Мg<sup>2+</sup>) и органические вещества (например, HCO<sub>3</sub>, D-глюкоза, L-аминокислоты, мочевина, лактат, витамин С, пептиды и белки; В, Г) также подлежат канальцевой реабсорбции (Б1-3). Эндогенные продукты метаболизма (например, мочевина, глюкурониды, гиппураты, сульфаты) и чужеродные вещества (например, пенициллин, диуретики, ПАГ) поступают в мочу путем транс-целлюлярной секреции (Б4, В). Многие вещества, такие как аммиак (NH<sub>3</sub>) и Н<sup>+</sup>, сначала продуцируются клетками канальцев, а потом выходят в канальцы при клеточной секреции. NH<sub>3</sub> входит в просвет канальцев путем пассивного транспорта (Б5), тогда как ионы Н<sup>+</sup> секретируются путем активного транспорта (ББ).
| |
| − | | |
| − | Транспорт ионов Na<sup>+</sup> и К<sup>+</sup>, осуществляемый Na<sup>+</sup>/К<sup>+</sup>-АТФазой базолатеральной мембраны канальцев и собирательной трубочки, служит своеобразным «мотором» для большинства этих транспортных процессов. Путем первичного активного транспорта, происходящего за счет прямого потребления АТФ, Na<sup>+</sup>/К<sup>+</sup>-АТФаза откачивает Na<sup>+</sup> из клетки в кровь и К<sup>+</sup> - в противоположном направлении. Это создает две движущие силы для транспорта многих веществ (включая Na<sup>+</sup> и К<sup>+</sup>): первая - химический градиент Na<sup>+</sup> ([Na<sup>+</sup>]o > [Na<sup>+</sup>]/) («/> - внутри клетки, «о» - из клетки) и вторая - мембранный потенциал ([K+]i > [К<sup>+</sup>]о; внутренняя сторона клетки заряжена отрицательно относительно внешней), т. е. существует электрический градиент, способствующий ионному транспорту.
| |
| − | | |
| − | Трансцеллюлярный транспорт подразумевает, что вещество пересекает две мембраны, обычно по двум разным механизмам. Если вещество (D-глюкоза, ПАГ и т. д.) активно транспортируется через эпителиальный барьер (т. е. против электрохимического градиента), то по крайней мере одна из двух стадий мембранного транспорта также должна быть активной.
| |
| − | | |
| − | Взаимодействие транспортеров. Процессы активного и пассивного транспорта обычно тесно взаимосвязаны. Активное поглощение растворенных веществ, таких как Na<sup>+</sup> или D-глюкоза, например, приводит к образованию осмотического градиента, ведущего к пассивной абсорбции воды. Когда вода абсорбируется, некоторые растворенные вещества следуют за ней [захват растворенного вещества), тогда как другие субстраты внутри канальцев концентрируются. Последние (например, Cl<sup>-</sup> или мочевина) затем возвращаются в кровь путем пассивной реабсорбции по градиенту концентрации. Электрогенный ионный транспорт и ионсопряженный транспорт могут деполяризовать или гиперполяризовать только люминальную или только базолатеральную мембраны клеток канальцев. Это вызывает трансэпителиальный потенциал, который в некоторых случаях служит движущей силой для парацеллюлярного ионного транспорта.
| |
| − | | |
| − | Поскольку неионизованные формы слабых электролитов более жирорастворимы, чем ионизованные, они способны лучше проникать через мембрану (неионная диффузия: Б2). Таким образом, pH мочи имеет большее влияние на пассивную реабсорбцию путем неионной диффузии. Размер молекул также влияет на диффузию: чем меньше молекула, тем больше коэффициент диффузии.
| |
| − | | |
| − | == Реабсорбция органических веществ ==
| |
| − | [[Image:Naglydnay_fiziologiya152.jpg|250px|thumb|right|А. Реабсорбция глюкозы и аминокислот]]
| |
| − | '''Фильтрационная нагрузка вещества''' - произведение концентрации этого вещества в плазме на скорость клубочковой фильтрации (СКФ). Поскольку СКФ высокая (примерно 180 л в сутки], каждые сутки в первичную мочу выходят огромные количества разных веществ (например, 160 г D-глюкозы в сутки).
| |
| − | | |
| − | Фракция экскреции (ФЭ) D-глюкозы очень мала (» 0,4%). Практически полная ее реабсорбция достигается при помощи вторичного активного транспорта (симпорт Na<sup>+</sup>-глюкозы) в клеточной мембране с люминальной стороны канальца (Б). Примерно 95% этой активности проявляется в проксимальных канальцах.
| |
| − | [[Image:Naglydnay_fiziologiya153.jpg|200px|thumb|right|Б. Реабсорбция органических -веществ]]
| |
| − | Если концентрация глюкозы в плазме превышает 10-15 ммоль/л, как при сахарном диабете (норма 5 ммоль/л), то развивается глюкозурия, и концентрация глюкозы в моче растет (А). Реабсорбция глюкозы демонстрирует кинетику насыщения (кинетика Михаэлиса-Ментен). Приведенный выше пример иллюстрирует преренальную глюкозурию. Почечная глюкозурия может развиваться, если один из канальцевых транспортеров глюкозы имеет дефекты.
| |
| − | | |
| − | За реабсорбцию глюкозы отвечают переносчики (транспортеры) с низким сродством в клеточной мембране просвета извитых канальцев (транспортер Na<sup>+</sup>-глюкозы 2-го типа, SGLT2) и переносчики с высоким сродством в прямых канальцах (SGLT1). В обоих случаях это достигается за счет котранспорта D-глю-козы и Na<sup>+</sup>, при соотношении 1:1 в случае SGLT2 и 1:2 в случае SGLT1. Энергия для данного типа вторичного активного транспорта глюкозы поставляется электрохимическим градиентом Na<sup>+</sup>, направленным во внутреннее пространство клетки. Поскольку SGLT1 осуществляет котранспорт 2Na<sup>+</sup> на одну молекулу глюкозы, градиент для этого транспортера в 2 раза больше градиента для SGLT2. Унипортер GLUT2 (транспортер глюкозы 2-го типа) со стороны кровотока облегчает пассивный транспорт аккумулированной внутриклеточной глюкозы из клетки [облегченная диффузия). D-галактоза также использует SGLT1-транспортер, тогда как D-фруктоза пассивно абсорбируется клетками канальцев (GLUT5).
| |
| − | | |
| − | Плазма содержит более 25 [[Аминокислоты|аминокислот]], и ежедневно фильтруется около 70 г аминокислот. Аналогично D-глюкозе, большинство L-аминокислот реабсорбируется в клетках проксимальных канальцев путем Na<sup>+</sup>-сопряженного вторичного активного транспорта (Б). В проксимальных канальцах находятся по крайней мере 7 переносчиков аминокислот, и некоторые из них транспортируют одинаковые аминокислоты. Jmax и Км и, следовательно, растворимость и способность к реабсорбции варьируют в зависимости от типа аминокислоты и переносчика. Фракция экскреции большинства аминокислот составляет примерно 1% (от 0,1% для L-валина до 6% для L-гистидина).
| |
| − | | |
| − | Иногда развивается повышенная экскреция аминокислот с мочой (гипераминоацидурия). Предпочечна ипераминоацидурия происходит при повышении концентрации аминокислот в плазме (и при выходе реабсорбции на плато насыщения, как на А), а причиной почечной гипераминоацидурии является недостаточный транспорт. Такая дисфункция может быть специфической (например, цистинурия, когда повышенной экскреции подвергаются только L-[[цистеин]], L-[[аргинин]] и L-лизин) или неспецифической (например, синдром Фанкони, когда повышенной экскреции подвергаются не только аминокислоты, но также глюкоза, фосфаты, бикарбонаты и т. д.).
| |
| − | | |
| − | Некоторые вещества (лактат, сульфат, фосфат, дикарбоксилаты и т. д.) тоже реабсорбируются в проксимальных канальцах путем Na cимпорта, тогда как мочевина подлежит пассивной обратной диффузии.
| |
| − | | |
| − | И ураты, и оксалаты реабсорбируются и секретируются, причем для урата преобладает реабсорбция (ФЗ » 0,1), а для оксалата - секреция (ФЭ > 1). Если концентрация в моче этих слаборастворимых веществ поднимается выше нормы, то они начинают осаждаться (увеличивается риск образования мочевых камней). Подобным же образом повышенная экскреция цистеина может вести к образованию цистеиновых камней.
| |
| − | [[Image:Naglydnay_fiziologiya154.jpg|200px|thumb|right|В. Реабсорбция олигопептидов]]
| |
| − | Олигопептиды, такие как глутатион и ангиотензин II, так быстро расщепляются люминальными пептидазами на щеточной каемке, что могут реабсорбироваться в качестве свободных аминокислот (В1). Дипептиды (например, карнозин), устойчивые к гидролизу в просвете канальца, должны абсорбироваться как интактные молекулы. Симпорт-переносчик (РерТ2), приводимый в действие направленным внутрь градиентом ионов Н<sup>+</sup>, транспортирует молекулы в клетку (третичный активный Н<sup>+</sup>-симпорт). Затем внутри клетки дипептиды гидролизуются (В2). Переносчик РерТ2 также используется некоторыми лекарствами и токсинами.
| |
| − | [[Image:Naglydnay_fiziologiya155.jpg|200px|thumb|right|Г. Реабсорбция белков путем эндоцитоза]]
| |
| − | '''Белки'''. Хотя альбумин имеет низкий коэффициент фильтрации (0,0003), в сутки фильтруется 2400 мг альбумина при его концентрации в плазме 45 г/л (180 д/суг • 45 г/л • 0,0003 = 2400 мг/сут). При этом за сутки экскретируется только от 2 до 35 мг альбумина (ФЭ » 1%). В проксимальных канальцах альбумин, лизоцим, а1-микроглобулин, β2-микроглобулин и другие белки реабсорбируются путем рецепторопосредованного эндоцитоза и «перевариваются» лизосомами (Г).
| |
| − | | |
| − | Поскольку этот тип реабсорбции при нормальных фильтрационных нагрузках по белкам происходит почти на плато насыщения, повышенная концентрация белка в плазме или повышенный коэффициент фильтрации белка ведет к протеинурии.
| |
| − | | |
| − | 25-ОН<sup>-</sup>холекальциферол, связанный в плазме и в клубочковом фильтрате с D-СБ (витамин D-связывающим белком), реабсорбируется (в комбинации с D-СБ) путем рецепторопосредованного эндоцитоза.
| |
| | | | |
| | == Экскреция органических веществ == | | == Экскреция органических веществ == |
| Строка 182: |
Строка 21: |
| | | | |
| | В противоположность секреции ОА- активная стадия секреции OС+ происходит через люминальную мембрану клеток проксимальных канальцев (аккумуляция в просвете происходит после преодоления отрицательного мембранного потенциала внутри клетки). Мембрана содержит: (а) прямые АТФ-зависимые переносчики органических катионов (mdr1; первичный активный транспорт 0С+; В1); (б) мультиспецифический антипортер OС+/Н<sup>+</sup> (третичный активный транспорт; В2). Катионы OС+ пассивно диффундируют из крови в клетку при помощи мультиспецифического транспортера органических катионов ГОСТ; ВЗ). | | В противоположность секреции ОА- активная стадия секреции OС+ происходит через люминальную мембрану клеток проксимальных канальцев (аккумуляция в просвете происходит после преодоления отрицательного мембранного потенциала внутри клетки). Мембрана содержит: (а) прямые АТФ-зависимые переносчики органических катионов (mdr1; первичный активный транспорт 0С+; В1); (б) мультиспецифический антипортер OС+/Н<sup>+</sup> (третичный активный транспорт; В2). Катионы OС+ пассивно диффундируют из крови в клетку при помощи мультиспецифического транспортера органических катионов ГОСТ; ВЗ). |
| − |
| |
| − | == Реабсорбция Na<sup>+</sup> и Cl<sup>-</sup> ==
| |
| − | [[Image:Naglydnay_fiziologiya158.jpg|250px|thumb|right|А. Электрохимический градиент Na]]
| |
| − | Примерно 99% фильтруемого Na<sup>+</sup> реабсорбируется (—27 000 ммоль/сут), т. е. фракция экскреции Na<sup>+</sup> (ФЭNa<sup>+</sup>) составляет около 1%. ФЭNa<sup>+</sup> (от 0,5 до 5%) регулируется альдостероном, атриопептином и другими гормонами (Б9).
| |
| − |
| |
| − | '''Участки реабсорбции Na<sup>+</sup>'''. Реабсорбция происходит во всех частях почечных канальцев и собирательной трубочки. Примерно 65% фильтруемого Na<sup>+</sup> реабсорбируется в проксимальном канальце, при постоянной концентрации Na<sup>+</sup> в просвете. Еще 25% реабсорбируются в петле Генле, где концентрация Na<sup>+</sup> в просвете резко снижается. Дистальные извитые канальцы и собирательная трубочка также реабсорбируют Na<sup>+</sup>. Собирательная трубочка является участком тонкой гормональной регуляции экскреции Na<sup>+</sup>.
| |
| − | [[Image:Naglydnay_fiziologiya159.jpg|250px|thumb|right|Б. Реабсорбция Na<sup>+</sup> и CI]]
| |
| − | '''Механизмы реабсорбции Na<sup>+</sup>'''. Na<sup>+</sup>-К<sup>+</sup>-АТФаза откачивает ионы Na<sup>+</sup> из клетки, при этом проводя ионы К<sup>+</sup> в клетку (А); таким образом создается химический градиент Na<sup>+</sup> (А4). Обратная диффузия К<sup>+</sup> (АЗ) ведет к формированию мембранного потенциала (А4). Суммарный результат -высокий электрохимический градиент Na<sup>+</sup>, который обеспечивает движущую силу для пассивного входа Na<sup>+</sup> и имеет свои особенности в разных сегментах нефрона (Б).
| |
| − |
| |
| − | *В проксимальных канальцах ионы Na<sup>+</sup> пассивно диффундируют из просвета канальцев внутрь клеток посредством: (а) электронейтрального Na<sup>+</sup>/Н<sup>+</sup>-обменника 3-го типа (NHE3), переносчика - Na<sup>+</sup>/H+-антипорта для электронейтрального обмена Na<sup>+</sup> на Н<sup>+</sup> (Б1); (б) различных переносчиков Na<sup>+</sup>-симпорта для реабсорбции D-глюкозы и т. д. (Б1). Поскольку большинство этих переносчиков сим-порта электрогенны, клеточная мембрана просвета канальцев поляризована и на ней образуется ранний проксимальный люмен-отрицательный трансэпителиальный потенциал (ЛОТП).
| |
| − |
| |
| − | *В толстом сегменте восходящего колена (ТСВК) петли Генле (Б6) Na<sup>+</sup> реабсорбируется при помощи буметанидчувствительного котранспортера BSC, Na<sup>+</sup>-K+ -2СГ-симпортера. Хотя BSC преимущественно электронейтрален, абсорбированный К<sup>+</sup> рециркулирует назад в просвет канальца через К<sup>+</sup>-канал. Это гиперполяризует мембрану просвета канальца, что приводит к образованию на ней люмен-положительного трансэпителиального потенциала (ЛПТП).
| |
| − |
| |
| − | *В дистальном извитом канальце (ДИК) (Б8) Na<sup>+</sup> реабсорбируется при помощи триазидчувствительного котранспортера TSC, электронейтрального Ма+-Cl<sup>-</sup>-симпортера.
| |
| − |
| |
| − | • В главных клетках соединительных канальцев и собирательной трубочки (Б9) Na<sup>+</sup> выходит из просвета через Na<sup>+</sup>-каналы, активируемые альдостероном и антидиуретическим гормоном (АДГ) и ингибируемые простагландином и атриопептином.
| |
| − |
| |
| − | Поскольку эти четыре стадии пассивного транспорта Na<sup>+</sup> в люминальной мембране последовательно соединены с активным транспортом Na<sup>+</sup> в базолатеральной мембране (Na<sup>+</sup>-К<sup>+</sup>-АТФаза), связанная с этим трансэпителиальная реабсорбция Na<sup>+</sup> также происходит активно. Она составляет около 1/з от общей реабсорбции Na<sup>+</sup> в проксимальных канальцах, и на 3 абсорбированных иона Na<sup>+</sup> потребляется 1 молекула АТФ. Остальные 2/3 от общей реабсорбции Na<sup>+</sup> обусловлены пассивным и парацеллюлярным транспортом.
| |
| − |
| |
| − | За этот процесс отвечают две движущие силы: (1) ЛПТП в средней и дальней части проксимальных канальцев (Б5) и петле Генле (Б7) проводит Na<sup>+</sup> и другие катионы на эпителий со стороны кровотока; (2) захват растворителем: когда реабсорбируется вода, то растворенные вещества «захватываются» благодаря силе трения (как кусок древесины дрейфует вместе с потоком воды). Поскольку движущие силы (1) и (2) - непрямые результаты активности Na<sup>+</sup>-К<sup>+</sup>-АТФазы, энергетический баланс возрастает примерно до 9 ионов Na<sup>+</sup> на 1 молекулу АТФ в проксимальных канальцах (и до 5 Na<sup>+</sup> на молекулу АТФ в остальных отделах почек).
| |
| − |
| |
| − | На базолатеральной стороне ионы Na<sup>+</sup> покидают клетку проксимального канальца при помощи Na<sup>+</sup>-К<sup>+</sup>-АТФазы и переносчика, осуществляющего симпорт Na<sup>+</sup>—ЗHCO<sub>3</sub>. В последнем случае Na<sup>+</sup> покидает клетку за счет третичного активного транспорта, тогда как вторичная активная секреция Н<sup>+</sup> (на противоположной стороне клетки) приводит к внутриклеточной аккумуляции ионов HCO<sub>3</sub>.
| |
| − |
| |
| − | Фракция экскреции CI (ФЗСl) колеблется от 0,5 до 5%. Примерно 50% всей реабсорбции Сl~ происходит в проксимальных канальцах. Ранний проксимальный ЛВТП проводит Cl через парацеллюляр-ные пространства из просвета канальца (БЗ). Реабсорбция Cl<sup>-</sup> отстает по сравнению с реабсорбцией Na<sup>+</sup> и Н2О, и концентрация Cl<sup>-</sup> в просвете возрастает. В результате Cl начинает диффундировать парацеллюлярно по своему химическому градиенту вдоль средней и дальней части проксимального канальца (Б4), таким образом создавая ЛПТП (обращение потенциала, Б5). В тонком сегменте нисходящего колена (ТСНК) и дистальном извитом канальце (ДИК) Cl<sup>-</sup> входит в клетку путем вторичного активного транспорта и выходит пассивно через активируемые АДГ базолатеральные Cl<sup>-</sup>-каналы (Б6, 8).
| |
| − |
| |
| − | == Реабсорбция воды ==
| |
| − |
| |
| − | Механизм концентрирования мочи Клубочковый фильтр пропускает около 180 л жидкости (плазмы) ежедневно (СКФ). По сравнению с этим количеством выход мочи в норме (VU) относительно мал (от 0,5 до 2 л/сут). Отклонения от нормы называются антидиурезом (низкая скорость VU) или диурезом (высокая скорость VU). Выход мочи выше уровня нормы называется полиурией, а ниже уровня нормы - олигоурией (< 0,5 л/сут) или анурией (< 0,1 л/сут). Осмоляльность плазмы и клубочкового фильтрата составляет около 290 мОсм/кг HgO (= Posm)', а осмоляльность вторичной мочи Wosm) колеблется от 50 (гипотоническая моча при увеличенном водном диурезе) до 1200 мОсм/кг НдО (гипертоническая моча с максимальной концентрацией). При водном диурезе происходит экскреция больших объемов воды без одновременной потери NaCI и других растворенных веществ, поэтому эта патология известна как «экскреция свободной воды» или «свободный водный клиренс» (СН2O). Это позволяет почке, например, нормализовать снижение осмоляльности плазмы. СН2O - объем воды, который теоретически может быть экстрагирован, чтобы моча достигла той же осмоляльности, что и плазма:
| |
| − |
| |
| − | СН2O = VU(1 - Uosm/Posm). [7.11]
| |
| − |
| |
| − | == Системы противотока ==
| |
| − | [[Image:Naglydnay_fiziologiya160.jpg|250px|thumb|right|А. Противоточная система]]
| |
| − | Простой теплообменик (А1) состоит из двух трубок, в которых текут параллельные (в одном направлении) потоки воды, один холодный (О °С), а другой - горячий (100 °С). Благодаря теплообмену выходящая из обеих трубок вода будет иметь температуру около 50 °С, т. е. компенсируется начальный большой температурный градиент в 100 °С.
| |
| − |
| |
| − | В противоточиом теплообменнике (А2) жидкость в трубках течет в противоположных направлениях. Поскольку градиент температуры присутствует вдоль всей длины трубок, теплообмен происходит также по всей длине трубок. В обмене могут участвовать также молекулы растворенных веществ, если стенки трубок проницаемы для них и если для данного вещества существует градиент концентрации.
| |
| − |
| |
| − | Если теплообмен происходит в противоточной системе в трубке в виде петли (шпильки), перегиб которой находится в контакте со средой, а температура этой среды отличается от температуры внутри трубки теплообменника (лед, АЗ), жидкость, выходящая из трубки, скоро будет немного холоднее, чем входящая в трубку, поскольку тепло всегда передается от более теплого колена петли к более холодному.
| |
| − |
| |
| − | Противоточный обмен воды в прямом сосуде в мозговом веществе почек (А6) происходит в том случае, если гипертоничность мозгового 170 вещества увеличивается по отношению к сосочкам (см. ниже) и если прямой сосуд проницаем для воды. Часть воды диффундирует путем осмоса из нисходящего прямого сосуда к восходящему, таким образом обходя внутренний слой мозгового вещества (А4). Вблизи почечных сосочков концентрация всех компонентов крови возрастает благодаря экстракции воды. Осмоляльность плазмы в прямом канальце при этом непрерывно изменяется, стремясь к осмоляльности интерстиция, осмоляльность которого увеличивается по направлению к сосочкам. Ге-матокрит в прямом сосуде также возрастает. И наоборот, вещества, переходящие в кровь в мозговом веществе почек, диффундируют из восходящего прямого сосуда в нисходящий участок при условии, что стенки обоих сосудов проницаемы для них (например, для мочевины: В). Противоточный обмен в прямом сосуде обеспечивает необходимый приток крови к мозговому веществу почек, не изменяя в значительной степени высокой осмоляльности мозгового вещества и не ухудшая концентрационной емкости почек.
| |
| − |
| |
| − | В противоточиом усилителе, таком как петля Гейле, градиент концентрации между двумя коленами поддерживается с затратой энергии (А5). Противоток усиливает относительно небольшой градиент во всех точках между коленами (локальный градиент —200 мОсм/кг НдО) до достаточно высокого градиента вдоль колена петли (—1000 мОсм/кг Н2О). Чем длиннее петля и чем выше градиент в одном колене, тем больше усиление градиента. Кроме того, он обратно пропорционален квадрату скорости потока в петле.
| |
| − | == Реабсорбция воды ==
| |
| − | [[Image:Naglydnay_fiziologiya161.jpg|250px|thumb|right|Б. Реабсорбция и экскреция воды]]
| |
| − | Примерно 65% СКФ обусловлено реабсорбцией в проксимальных извитых канальцах (ПИК) (Б). Движущая сила этого процесса - реабсорбция растворенных веществ, особенно Na<sup>+</sup> и Cl<sup>-</sup> Это немного разбавляет мочу в канальце, но Н2О немедленно следует по этому осмотическому градиенту, поскольку ПИК «протекают». Реабсорбция воды происходит парацеллюлярно (через протекающие плотные контакты) или трансцеллюлярно, т. е. через водные каналы (аквапорины типа 1 = AQP1) в двух клеточных мембранах. Моча в ПИК, таким образом, остается практически изотонической. Онкотическое давление в перитубулярных капиллярах обеспечивает дополнительную движущую силу для реабсорбции воды. Чем больше воды фильтруется в клубочках, тем выше онкотическое давление. Таким образом, реабсорбция воды в проксимальных канальцах до определенной степени выравнивается в соответствии с клубочково-канальцевый равновесием (ККР).
| |
| − |
| |
| − | Поскольку нисходящее колено петли Генле содержит аквапорины CAQP1), которые делают его проницаемым для воды, моча в нем в основном находится в осмотическом балансе с гипертоническим межклеточным пространством, которое становится все более гипертоническим при приближении к сосочкам (А5). Моча, таким образом, при продвижении в этом направлении становится все более концентрированной. В тонком сегменте нисходящего колена, которое мало проницаемо для солей, это приводит к увеличению концентрации Na<sup>+</sup> и Cl<sup>-</sup>. Большая часть воды из межклеточного пространства удаляется по прямому канальцу (Б). Поскольку тонкий и толстый сегменты восходящего колена петли Генле почти непроницаемы для воды, Na<sup>+</sup> и Cl<sup>-</sup> диффундируютпассивно (тонкий сегмент), но транспортируются активно (толстый сегмент) наружу, в межклеточную жидкость (Б). Вода не может быть удалена, и поэтому моча, выходящая из петли Генле, гипотонична.
| |
| − |
| |
| − | Активная реабсорбция Na<sup>+</sup> и Cl<sup>-</sup> из тонкого сегмента восходящего колена петли Генле (ТСВК) создает локальный градиент (примерно 200 мОсм/кг H<sub>2</sub>O; А5) во всех точках между ТСВК нисходящей петли с одной стороны и внеклеточной жидкостью мозгового вещества почек - с другой. Поскольку высокая осмоляльность внеклеточной жидкости мозгового вещества почек является причиной, по которой вода экстрагируется из собирательной трубочки (см. ниже), активный транспорт NaCI является АТФ-зависимым «мотором» почечного механизма, концентрирующего мочу, и регулируется постоянной стимуляцией секреции АДГ.
| |
| − | [[Image:Naglydnay_fiziologiya162.jpg|250px|thumb|right|В. Мочевина в почках]]
| |
| − | По ходу дистальных извитых канальцев и в конце собирательной трубочки, где есть аквапорины и рецепторы АДГ типа V2 (см. ниже), жидкость в канальцах снова становится изотонической (в осмотическом равновесии с изотонической внеклеточной жидкостью коры почек), если присутствует АДГ, т. е. при антидиурезе. Хотя Na<sup>+</sup> и Cl<sup>-</sup> здесь все еще реабсорбируются, осмоляльность значительно не меняется, так как вода реабсорбируется (примерно 5% от СКФ) во внеклеточную жидкость под действием осмотического давления и осмоляльность канальцевой жидкости все больше определяет мочевина.
| |
| − |
| |
| − | Конечная корректировка объема выводящейся мочи происходит в собирательной трубочке. В присутствии антидиуретического гормона (АДГ) (который связывается с базолатеральными Уд-рецепторами, названными так по названию гормона, АДГ = вазопрессин), аквапорины (AQP2) люминальной мембраны главных клеток (в отсутствие аквапоринов водонепроницаемой) экстрагируют воду из мочи,
| |
| − |
| |
| − | проходящей через все более гипертоническое мозговое вещество почек. Таким образом, Uosm возрастает и становится примерно в 4 раза выше, чем Posm Uosm/Posm = 4), что соответствует максимальному антидиурезу. Отсутствие АДГ приводит к водному диурезу, когда Uosm/Posm может упасть вплоть до < 0,3. К концу ТСВК Uosm может упасть даже ниже осмоляльности, поскольку реабсорбция Na<sup>+</sup> и Cl<sup>-</sup> продолжается в дистальном извитом канальце и собирательной трубочке, но вода вряд ли может за ними следовать.
| |
| − |
| |
| − | Мочевина также играет важную роль в формировании концентрированной мочи. Богатая белком диета приводит к увеличению образования мочевины, что увеличивает способность почек концентрировать мочу. Примерно 50% фильтрованной мочи покидает проксимальные канальцы путем диффузии (В). Поскольку нисходящее колено петли Генле, дистальный извитой каналец, а также кортикальный и внешний мозговой участки собирательной трубочки лишь незначительно проницаемы для мочи, ее концентрация увеличивается ниже этих частей нефрона ( В). АДГ может (при помощи Уд-рецепторов) вводить переносчики мочевины (транспортер мочевины 1-го типа, UT1) в люминальную мембрану, таким образом делая собирательную трубочку во внутреннем слое мозгового вещества проницаемой для мочевины. Мочевина теперь диффундирует назад в межклеточное пространство (при высокой осмоляльности половина приходится на мочевину) с помощью UT1 и затем с помощью UT2 транспортируется назад в нисходящее колено петли Генле, завершая рециркуляцию мочевины (В). Нереабсорбируемая фракция мочевины экскретируется: ФЭмочевины = 40%. Экскреция мочевины увеличивается при водном диурезе и снижается при антидиурезе, вероятно, по причине активации переносчика UT2.
| |
| − |
| |
| − | Нарушения процесса концентрирования мочи в основном происходят (а) из-за очень высокого кровотока в мозговом веществе почек (вымывание Na<sup>+</sup>, Cl<sup>-</sup> и мочевины); (б) при приеме осмотических диуретиков; (в) при приеме петлевых диуретиков; (г) дефиците секреции или неэффективности АДГ, как при центральном или нефрогенном несахарном диабете соответственно.
| |
| − |
| |
| − | == Гомеостаз жидкостей организма ==
| |
| − | [[Image:Naglydnay_fiziologiya163.jpg|250px|thumb|right|А. Водный баланс]]
| |
| − | Жизнь не может существовать без воды. Вода является начальным и конечным продуктом бесчисленных биохимических реакций. Она служит растворителем, транспортным средством, теплоизолятором, охладителем, а также имеет множество других функций. Вода присутствует в клетках в виде внутриклеточной жидкости, а также окружает клетки в составе внеклеточной жидкости. Она обеспечивает постоянство окружающей среды (внутренней среды) для клеток организма, чем похожа на среду первичного океана, окружавшего первые одноклеточные организмы.
| |
| − |
| |
| − | Объем циркулирующей жидкости в организме остается относительно постоянным, если должным образом поддерживается водный баланс (А). В среднем потребление жидкости составляет —2,5 л в сутки (в виде напитков, твердой пищи, а также продуктов метаболического окисления). Потребление жидкости должно быть достаточно высоким, чтобы компенсировать потери воды вследствие мочеиспускания, дыхания, испарения и дефекации. Средний дневной оборот воды составляет 2,5 л/70 кг (1/30 массы тела) у взрослых и 0,7 л/10 кг (1/10 массы тела) у младенцев. Таким образом, у младенцев водный баланс более подвержен отклонениям.
| |
| − | [[Image:Naglydnay_fiziologiya164.jpg|250px|thumb|right|Б. Общее содержание воды в организме (ДВ)]]
| |
| − | В организме могут быть значительные увеличения оборота воды, но в норме они должны адекватно компенсироваться. Потеря воды при дыхании происходит, например, в результате гипервентиляции на большой высоте и в результате испарения при высокой температуре окружающей среды (например, пешие прогулки на солнце или особые температурные условия на работе - металлургическое производство). И то и другое может приводить к потере нескольких литров воды в течение часа, что должно быть компенсировано путем соответственного увеличения потребления жидкостей (и соли). И наоборот, увеличенное потребление жидкостей приводит к увеличению объема экскретируемой мочи.
| |
| − |
| |
| − | '''Содержание воды в организме'''. Доля воды (ДВ) составляет от 0,46 (46%) до 0,75 общей массы тела (МТ = 1) в зависимости от возраста и пола (Б). У младенцев ДВ составляет 0,75, у молодых мужчин (женщин) 0,64 (0,53), а у пожилых мужчин (женщин) всего 0,53 (0,46). Различия, связанные с полом (как и индивидуальные различия), определяются в основном разным содержанием жира в теле. У молодых взрослых людей в среднем доля воды в большинстве тканей составляет около 0,73 (ср. 0,2 в жировой ткани) (Б).
| |
| − | [[Image:Naglydnay_fiziologiya165.jpg|250px|thumb|right|В. Жидкостные компартменты организма]]
| |
| − | '''Жидкостные компартменты'''. У человека в среднем ДВ —0,6, причем около 3/s ДВ (0,35 МТ) - внутриклеточная жидкость, а другие 2/s ДВ (0,25 МТ) - внеклеточная жидкость. Внутриклеточная и внеклеточная жидкости разграничены плазматической мембраной клеток. Внеклеточная жидкость находится между клетками (межклеточная жидкость, интерстиций, 0,19 МТ), в составе крови (вода в составе плазмы, 0,045 МТ) и в «трансцеллюлярных» компартментах (0,015 МТ): плевральные, перитонеальные и перикардиальное пространства, полость спинномозгового канала и мозговых желудочков, камеры глаз и просвет кишечника, протоки почек и желез (В). Плазма крови отделена от окружающих тканей эндотелием, а эпителий отделяет интерстициальное пространство от трансцеллюлярных компартментов (В). По концентрации белка плазма существенно отличается от состава остальной внеклеточной жидкости. Более того, существует фундаментальная разница в ионном составе внеклеточной и внутриклеточной жидкостей (с. 99В). Поскольку ионы Na<sup>+</sup> в основном находятся во внеклеточном пространстве, по общему содержанию Na<sup>+</sup> в организме можно определить объем внеклеточной жидкости (с. 176).
| |
| − |
| |
| − | Измерение объемов жидкостных компартментов. В клинической медицине объемы жидкостных компартментов тела обычно измеряют с использованием индикаторов методом разбавления. При условии что индикаторное вещество S, введенное в кровоток, проникает только в компартмент-мишень (В), объем У можно рассчитать по формуле
| |
| − |
| |
| − | V[л] = S [моль]/Сs [моль/л], [7.12],
| |
| − |
| |
| − | где Сs - концентрация индикатора S в компартменте-мишени (определяется по анализам крови). Объем внеклеточной жидкости обычно измеряется с использованием в качестве индикатора инулина или бромида натрия (он не входит в клетки), а ДВ - с использованием антипирина, тяжелой воды (DpO) или меченой НдО. Объем внутриклеточной жидкости примерно равен разности объемов распространения антипирина и инулина. Меченый альбумин или эванс синий, который полностью связывается белками плазмы, может быть использован для измерения объема плазмы. Объем крови можно найти как отношение объема плазмы к разности [1 - гематокрит], а межклеточный (интерстициальный) объем - как разность объемов внеклеточной жидкости и плазмы. (Так как после центрифугирования оказывается, что 0,1 объема плазмы приходится на эритроциты, при расчете общего объема крови следует брать не 1, а 0,91.) Объем крови также можно измерить при введении эритроцитов, содержащих радиоактивную метку 51 Сr; тогда объем плазмы получают, умножая объем крови на (0,91 - Hct).
| |
| − |
| |
| − | == Регуляция содержания солей и воды ==
| |
| − | [[Image:Naglydnay_fiziologiya166.jpg|250px|thumb|right|А. Потребление и выведение воды из клетки]]
| |
| − | '''Осморегуляция'''. Осмоляльность большинства жидкостей тела составляет примерно 290 мОсм/кг Н2О, так что внутри- и внеклеточная жидкости (ICF и ECF) находятся в осмотическом равновесии. Любое увеличение осмоляльности внеклеточной жидкости, например из-за абсорбции NaCI или потери воды, приводит к оттоку жидкости из клеток (сжатие клеток, А1). Падение внеклеточного осмотического давления при поглощении или введении больших объемов воды или при потере Na<sup>+</sup> (например, при дефиците альдостерона) приводит к тому, что вода из ECF устремляется в клетку (набухание клеток, А2). И то и другое представляют риск для нормального функционирования клетки, но клетка имеет механизмы защиты.
| |
| − |
| |
| − | Плазматическая мембрана клетки содержит механорецепторы, которые участвуют в регуляции баланса потоков ионов и воды - например, выход К<sup>+</sup> и Cl<sup>-</sup> при увеличении объема клетки и вход Na<sup>+</sup>, К<sup>+</sup> и Cl<sup>-</sup> при плазмолизе. Эти механизмы также контролируют баланс при увеличении объема клеток из-за усиленного поглощения Na<sup>+</sup> и глюкозы в слизистой оболочке кишечника или из-за кратковременной гипоксии (со снижением активности К<sup>+</sup>-Na<sup>+</sup>-АТФазы).
| |
| − |
| |
| − | Клетки, физиологическая активность которых связана со значительными перепадами осмоляльности (например, в почках), также способны регулировать собственную осмоляльность с помощью образования/абсорбции или выведения/ресорбции низкомолекулярных веществ, известных как органические осмолитики (например, бетаин, таурин, миоинозит, сорбит).
| |
| − | [[Image:Naglydnay_fiziologiya167.jpg|250px|thumb|right|Б. Реляция солевого и водного баланса]]
| |
| − | Осмоляльность внеклеточной жидкости должна точно регулироваться, чтобы защитить клетки от больших флуктуаций объема. Осморегуляция контролируется центральными осморецепторами (или осмосенсорами), находящимися в циркумвентрику-лярных органах (SF0 и 0VLT, см. далее). Колебания объема Н2О в ЖКТ регистрируются периферическими осмосенсорами в области воротной вены и передаются в гипоталамус по афферентным нейронам блуждающего нерва.
| |
| − |
| |
| − | '''Водный дефицит (Б1)'''. Общая потеря воды (ги-поволемия), например, из-за потоотделения, мочеиспускания или дыхания делает внеклеточную жидкость гипертоничной. Увеличение осмоляльности на 1-2% или более (= 3-6 мОсм/кг Н2О) достаточно для стимуляции секреции АДГ (антидиуретический гормон = вазопрессин) задней долей гипофиза (В1). АДГ снижает экскрецию Н2О с мочой
| |
| − |
| |
| − | Однако также необходимо поступление воды в организм извне. Сходным же образом гипертоническая спинномозговая жидкость (СМЖ) через осморецепторы в сосудистом органе конечной пластинки (0VLT) и субфорникальном органе гипоталамуса (SF0) стимулирует секрецию ангиотензина II (AT II), который вызывает гиперосмотическую жа-хгду (В). Изотоническая гиповолемия, например вследствие кровопотери или в результате гипонатриемии (Г1), также вызывает жажду (гиповолеми-ческая жажда, В), но относительный дефицит межклеточной жидкости в этом случае больше (>10%), чем относительное увеличение осмоляльности при гиперосмотической жажде (1-2%). Рецепторы гиповолемии в основном представлены предсердными сенсорами. Через афферентные тракты и ядро одиночного тракта (NTS) запускается секреция центрального AT II в SF0 (В, И), а через периферическую нервную систему и почечные бета1-адренорецепторы активируется периферическая ренин-ATII система (А4). Падение среднего кровяного давления ниже 85 мм рт. ст. обусловливает значительное повышение уровня секреции ренина непосредственно в почке. Как и центральный, периферический AT II может вызывать жажду и повышенный Na<sup>+</sup>-аппетит, так как SF0 и 0VLT расположены за пределами ГЭБ.
| |
| − |
| |
| − | Релаксин, пептидный гормон, синтезируемый желтым телом у беременных, связывается с рецепторами в SF0 и 0VLT. Он вызывает жажду и стимулирует секрецию АДГ. Несмотря на пониженную осмоляльность плазмы, которая могла бы подавлять жажду и секрецию АДГ в период беременности, релаксин обеспечивает нормальное или даже повышенное потребление жидкости в это время.
| |
| − | [[Image:Naglydnay_fiziologiya168.jpg|250px|thumb|right|В. Жажда: активация и подавление]]
| |
| − | '''Жажда''' - субъективное ощущение и мотивация к поиску жидкостей и питью. Жажда - реакция организма на гиперосмоляльность или гиповолемию (более 0,5% массы тела - порог жажды), что стимулирует первичное питье. Первичное питье подавляет жажду до того, как осмоляльность полностью нормализуется. Такое досрочное снижение жажды является невероятно точным механизмом, так как связано с определением объема через афферентные сигналы от волюмо- и осморецепторов горла, ЖКТ и печени. Первичное питье, однако, является скорее исключением в условиях постоянной доступности жидкости, пригодной для питья. Обычно человек пьет, потому что у него пересохло во рту или во время еды, но может и без необходимости -например, по привычке или потому, что так принято. Такое повседневное питье называется вторичным питьем.
| |
| − |
| |
| − | В пожилом возрасте 30% людей 65-74 лет реже испытывают жажду, а 50% людей старше 80 лет пьют слишком мало жидкости. 0 возрастом способность к концентрированию мочи и секреции АДГ и альдостерона также понижается, что ведет к сопутствующему водному дефициту. Вследствие рассеянности и забывчивости потребление жидкости снижается, что порождает порочный круг. Некоторые пожилые люди стараются бороться с ночным и учащенным мочеиспусканием путем потребления меньшего количества жидкости, что также обезвоживает организм.
| |
| − |
| |
| − | '''Избыток воды''' (Б2). Абсорбция гипотонической жидкости, включая, например, промывание желудка или введение раствора глюкозы (глюкоза быстро метаболизируется до СОд и НдО), снижает ос-моляльность внеклеточной жидкости. Этот сигнал ингибирует секрецию АДГ, что приводит к водному диурезу и нормализации осмоляльности плазмы менее чем за 1 час.
| |
| − |
| |
| − | Водная интоксикация происходит, когда избыточные количества воды абсорбируются слишком быстро, что ведет к симптомам тошноты, рвоты и шоку. Данное состояние вызывается несвоевременным падением осмоляльности плазмы до того, как происходит адекватное ингибирование секреции АДГ.
| |
| − | [[Image:Naglydnay_fiziologiya169.jpg|250px|thumb|right|Г. Регуляция солевого баланса]]
| |
| − | '''Регуляция объема'''. За сутки в организме всасывается примерно 8-15 г NaCI. Почки должны одновременно экскретировать такое же количество, чтобы сохранить количество Na<sup>+</sup> в организме на постоянном уровне и обеспечить гомеостаз внеклеточной жидкости. Поскольку Na<sup>+</sup> является основным внеклеточным ионом (баланс Cl<sup>-</sup> поддерживается во вторую очередь), изменения содержания Na<sup>+</sup> в организме ведут к изменению объема внеклеточной жидкости. Это регулируется в основном следующими факторами.
| |
| − |
| |
| − | *Ренин-ангиотензиновая система (РАО AT II не только индуцирует жажду и солевой аппетит, но также снижает скорость клубочковой фильтрации и усиливает секрецию АДГ и альдостерона, что, в свою очередь, подавляет выведение Na<sup>+</sup> (Г2) и, несмотря на потребление воды, устойчиво поддерживает солевой аппетит.
| |
| − |
| |
| − | *Окситоцин, синтезируемый гипоталамусом нейромедиатор, ингибирует активность нейронов, которые поддерживают постоянный солевой аппетит, и посредством нервной регуляции повышает выведение NaCI.
| |
| − |
| |
| − | *А триопептин (натрийуретический пептид предсердия, ANP или ПИП) - это пептидный гормон, секретируемый специальными клетками предсердия в ответ на увеличение объема внеклеточной жидкости и, следовательно, предсердного давления. ПНП подавляет жажду и понижает уровень секреции АДГ. Он способствует выведению Na<sup>+</sup> почками путем увеличения фильтрационной фракции и ингибирует реабсорбцию Na<sup>+</sup> в собирательной трубочке. ПНП, таким образом, функционирует как антагонист ренин-ангиотензиновой системы (РАС).
| |
| − |
| |
| − | *АДГ. Секреция АДГ стимулируется путем: (а) увеличения осмоляльности плазмы и СМЖ\ (б) рефлекса Гаера-Генри, который запускается, когда волюморецепторы в предсердии предупреждают гипоталамус о снижении (>10%) объема внеклеточной жидкости (давления в предсердиях). AT II является ключевым фактором в данном процессе.
| |
| − |
| |
| − | *Прессорный диурез, вызванный повышенным артериальным давлением, например, из-за увеличенного объема внеклеточной жидкости, приводит к повышенной экскреции Na<sup>+</sup> и воды, таким образом снижая объем внеклеточной жидкости и кровяное давление. Эта система обратной связи считается основным механизмом долговременной регуляции кровяного давления.
| |
| − | [[Image:Naglydnay_fiziologiya170.jpg|250px|thumb|right|Д. Нарушения водно-солевого гомеостаза]]
| |
| − | '''Дефицит соли''' (Г1). Если гипонатриемия развивается в условиях нормального первичного содержания воды в организме, то осмоляльность крови и секреция АДГ снижаются, временно уменьшая выведение воды. Объем внеклеточной жидкости, объем плазмы и кровяное давление последовательно снижаются (И). Это, в свою очередь, активирует РАС, что вызывает гиповолемическую жажду из-за секреции AT II и индуцированного секрецией альдостерона удержания Na<sup>+</sup> в результате. Удержание Na<sup>+</sup> увеличивает осмоляльность плазмы, что ведет к секреции АДГ и в итоге к удержанию воды. Дополнительное потребление жидкостей в ответ на жажду также помогает нормализовать объем внеклеточной жидкости.
| |
| − |
| |
| − | '''Избыток соли''' (Г2). Ненормально высокое содержание NaCI в организме, например, после потребления соленой жидкости ведет к возрастанию осмоляльности плазмы, удержанию воды организмом (жажда питье) и секреции АДГ. Таким образом, объем внеклеточной жидкости растет, и активность РАС сдерживается. Дополнительная секреция атриопептина, возможно, вместе с натрийуретическим гормоном с более долгим временем полужизни, чем у атриопептина (уабаина), ведет к увеличению выведения NaCI и Н2О и, следовательно, к нормализации объема внеклеточной жидкости.
| |
| − |
| |
| − | Если осмоляльность остается нормальной, нарушения солевого и водного гомеостаза (Д1,4) воздействуют только на объем внеклеточной жидкости. Когда осмоляльность внеклеточной жидкости возрастает (гиперосмоляльность) или снижается (гипоосмоляльность), вода во внеклеточных и внутриклеточных компартментах перераспределяется (Д2, 3, 5, 6). Основные причины этих нарушений перечислены в Д (оранжевый фон). Эффектами этих нарушений являются гиповолемия в случаях 1, 2 и 3, клеточный отек Iнабухание) при нарушениях 3 и 5 (например, отек мозга) и интерстициальный отек (задержка воды, легочный отек) при нарушениях 4, 5 и 6.
| |
| | | | |
| | == Диурез и диуретики == | | == Диурез и диуретики == |
| Строка 324: |
Строка 44: |
| | [[Тиазидные диуретики]] ингибируют резорбцию в дистальных канальцах. Подобно петлевым диуретикам, они увеличивают реабсорбцию в нижних сегментах канальцев, что приводит к потерям К<sup>+</sup> и Н<sup>+</sup>. | | [[Тиазидные диуретики]] ингибируют резорбцию в дистальных канальцах. Подобно петлевым диуретикам, они увеличивают реабсорбцию в нижних сегментах канальцев, что приводит к потерям К<sup>+</sup> и Н<sup>+</sup>. |
| | | | |
| − | '''Калийсберегающие диуретики'''. Амилорид блокирует Na<sup>+</sup>-каналы в главных клетках соединительных канальцев и собирательной трубочки, что ведет к уменьшению выделения К<sup>+</sup>. Антагонисты альдо-стерона (например, спиролактон), которые блокируют цитоплазматические рецепторы альдостерона, также оказывают калийсберегающий эффект. | + | '''Калийсберегающие диуретики'''. Амилорид блокирует Na<sup>+</sup>-каналы в главных клетках соединительных канальцев и собирательной трубочки, что ведет к уменьшению выделения К<sup>+</sup>. Антагонисты альдостерона (например, спиролактон), которые блокируют цитоплазматические рецепторы альдостерона, также оказывают калийсберегающий эффект. |
| | | | |
| − | == Почки и кислотно-основный баланс == | + | == Тубулогломерулярная обратная связь, ренин-ангиотензиновая система == |
| − | [[Image:Naglydnay_fiziologiya172.jpg|250px|thumb|right|Секреция Н<sup>+</sup>]]
| + | [[Image:Naglydnay_fiziologiya181.jpg|250px|thumb|right|А. Юкстагломерулярный аппарат]] |
| − | Основные функции почечной экскреции Н<sup>+</sup> (А):
| + | '''Юкстагломерулярный аппарат (ЮГА)''' состоит из (а) юкстагломерулярных клеток приносящей артериолы (включая ренинсодержащие и симпатически иннервируемые гранулярные клетки) и выносящей артериолы, (б) клеток плотного пятна толстого сегмента восходящего колена петли Генле и (в) юкстагломерулярных мезангиальных клеток (полкиссен, А) нефрона (А). |
| − | | |
| − | *реабсорбция отфильтрованного бикарбоната (Б),
| |
| − | | |
| − | *экскреция ионов Н<sup>+</sup>, измеряемая как титруемая кислотность (В];
| |
| − | | |
| − | *неионный транспорт NH^, т. е. в форме NH<sub>3</sub> (Г1, 2).
| |
| − | | |
| − | 1. Очень большие количества ионов Н<sup>+</sup> секретируются в просвет проксимальных канальцев (А1) при помощи: (а) первичного активного транспорта посредством Н<sup>+</sup>-АТФазы\ (б) при помощи вторичного активного транспорта посредством злектронейтрального Na<sup>+</sup>-H+-антипортера (переносчика NHE3). pH в просвете снижается от 7,4 (фильтрат) до примерно 6,6. На каждый секре-тируемый ион Н<sup>+</sup> один ион ОН<sup>-</sup> остается внутри клетки; ион ОН<sup>-</sup> реагирует с СОз - образуется HCO<sub>3</sub> (что ускоряется карбоангидразой-ll, см. ниже). Ион HCO<sub>3</sub> покидает клетку и переходит в кровь, где связывает один ион Н<sup>+</sup>. Таким образом, каждый ион Н<sup>+</sup>, декретируемый в просвет (и экскретируемый), способствует удалению из организма одного иона Н<sup>+</sup>, за исключением тех случаев, когда секреция иона Н<sup>+</sup> сопровождается секрецией NH<sub>3</sub> (см. ниже).
| |
| − | | |
| − | 2. В соединительных канальцах и собирательной трубочке (А2) вставочные клетки типа А декретируют ионы Н<sup>+</sup> при помощи Н<sup>+</sup>-К<sup>+</sup>-АТФазы и Н<sup>+</sup>-АТФазы, что вызывает падение pH в просвете до 4,5. Остаточный 0Н~ в клетке реагирует с СОд с образованием HCO<sub>3</sub>, который высвобождается на базолатеральной мембране через анионные транспортеры АЕ1 (= SLC 4 AD (А2). При метаболическом алкалозе вставочные клетки типа В могут декретировать HCO<sub>3</sub> через пендрин (SLC 26 А4) (АЗ).
| |
| − | | |
| − | Карбоангидраза (КА) играет важную роль во всех случаях, когда ионы Н<sup>+</sup> выходят с одной стороны клетки и/или ионы HCO<sub>3</sub> выходят с другой стороны, например, в клетках почечных канальцев, которые содержат КА" в цитоплазме и KAIV на наружной стороне люминальной мембраны (А, Б, Г), как в желудке, тонком кишечнике, протоке поджелудочной железы и эритроцитах, и т. д. КА катализирует реакцию
| |
| − | | |
| − | H<sub>2</sub>O + СO<sub>2</sub> ⇆ Н<sup>+</sup> + HCO<sub>3</sub> .
| |
| − | | |
| − | Угольная кислота (Н2СО3) часто считается промежуточным продуктом этой реакции, но с КА, вероятно, соединяется ОН" (а не H<sub>2</sub>O). Поэтому, реакции Н2О ⇆ ОН" + Н<sup>+</sup> и ОН" + СОз HCO<sub>3</sub> лежат в основе вышеупомянутой суммарной реакции.
| |
| − | | |
| − | '''Реабсорбция HCO<sub>3</sub>'''
| |
| − | [[Image:Naglydnay_fiziologiya173.jpg|250px|thumb|right|Б. Реабсорбция HCO<sub>3</sub>.]]
| |
| − | Количество HCO<sub>3</sub>, фильтруемое каждый день, в 40 раз больше количества, присутствующего в крови. Следовательно, для поддержания кислотно-основного баланса ион HCO<sub>3</sub> должен быть реабсорбирован. Ионы Н<sup>+</sup>, секретируемые в просвет проксимальных извитых канальцев, реагируют примерно с 90% фильтруемого HCO<sub>3</sub> с образованием СO<sub>2</sub> и H<sub>2</sub>O (Б). KAIV, закрепленная на мембране, катализирует эту реакцию. СОд диффундирует в клетку, возможно, с помощью аквапорина 1 (Б). КА" катализирует превращение СO<sub>2</sub> + Н2О в Н<sup>+</sup> + HCO<sub>3</sub> внутри клетки (Б). Ионы Н<sup>+</sup> снова декретируются, тогда как ионы HCO<sub>3</sub> выходят через базолатеральную мембрану клетки посредством электрогенного переносчика (NBC1 = NBCel = SSCL4 А4, см. Б) - 1 Na<sup>+</sup> в котранспорте с 3 HCO<sub>3</sub> (и/или 1 HCO<sub>3</sub> + 1СО3-?). Таким образом, HCO<sub>3</sub> транспортируется из просвета через мембрану в форме СO<sub>2</sub> (движущая сила: A/fod и выходит из клетки через базолатеральную мембрану как HCO<sub>3</sub> (движущаяся сила - мембранный потенциал).
| |
| − | | |
| − | Гипокалиемия ведет к снижению мембранного потенциала (уравнение Нернста) и, таким образом, к увеличению базолатерального транспорта HCO<sub>3</sub>. Это приводит к увеличению секреции Н<sup>+</sup> и, следовательно, к гипокалиемическому алкалозу.
| |
| − | | |
| − | '''Выведение мочевой кислоты'''. Если потребление белков с пищей составляет 70 г в сутки , то после расщепления аминокислот ежедневно в организм поступает 190 ммоль Н<sup>+</sup>. HCI (из аргинина, лизина и гистидина), H2SO4 (из метионина и цистина), Н3РО4 и молочная кислота - вот главные источники ионов Н<sup>+</sup>. Это нелетучие кислоты, которые, в отличие от СO<sub>2</sub>, не удаляются при дыхании. Поскольку для распада органических анионов (глутамата, аспартата, лактата и т. д.) используется около 130 ммоль Н<sup>+</sup> в сутки, общая продукция Н<sup>+</sup> составляет около 60 (40-80) ммоль/сут. Хотя ионы и нейтрализуются в месте их образования, для регенерации буферных свойств они должны выводиться.
| |
| − | | |
| − | В экстремальных случаях pH мочи может возрастать примерно до 8 (высокий уровень экскреции HCO<sub>3</sub>) или падать до 4,5 (максимальная концентрация Н<sup>+</sup> составляет 0,03 ммоль/л). При ежедневной экскреции около 1,5 л мочи почки выводят <1% производимых ионов Н<sup>+</sup> в свободной форме.
| |
| − | [[Image:Naglydnay_fiziologiya174.jpg|250px|thumb|right|В. Экскреция титруемых кислот]]
| |
| − | Титруемые кислоты (80% фосфата, 20% мочевой кислоты, лимонная кислота и т. д.) составляют значительную фракцию (10-30 ммоль/л) выводимых Н<sup>+</sup> (В1). Это количество ионов Н<sup>+</sup> можно определить путем титрования мочи щелочью NaOH до pH плазмы (7,4) (В2). Примерно 80% фосфата (рКа = 6,8) в крови существует в форме НР04, тогда как в кислой моче почти весь фосфат присутствует как Н2РО4, т. е. секретируемые ионы Н<sup>+</sup> нейтрализуются i фильтруемыми ионами НРО<sub>4</sub>. Нереабсорбированный фосфат (5-20% фильтруемого количества), следовательно, связывает ионы Н<sup>+</sup>, причем примерно половина находится в проксимальных канальцах (pH 7.4 → 6.6). а остальные - в собирательной трубочке (pH 6,6 → 4.5) (В1). При ацидозе мобилизуется из костей и экскретируется повышенное количество фосфата. Результирующее увеличение выведения Н<sup>+</sup> превосходит усиление образования NH<sub>4</sub><sup>+</sup>, связанное с ацидозом (см. ниже).
| |
| − | | |
| − | '''Экскреция ионов аммония''' (NH4 ⇆ NH<sub>3</sub> + Н<sup>+</sup>) составляет примерно 25-50 ммоль/сут при среднестатистической диете и эквивалентна расходу Н<sup>+</sup>. Таким образом, NH<sub>4</sub><sup>+</sup> является непрямой формой выведения Н<sup>+</sup> (Г). NH<sub>4</sub><sup>+</sup> не является титруемой формой кислоты. В отличие от НРО<sub>4</sub> + Н<sup>+</sup>⇆ Н2РО4, реакция NH<sub>3</sub> + Н<sup>+</sup> ⇆NH<sub>4</sub><sup>+</sup> не действует как буфер из-за высокого значения рКа ~ 9,2. Однако на каждый экскретируемый почками ион NH<sub>4</sub><sup>+</sup> один ион HCO<sub>3</sub> запасается печенью. Это эквивалентно одному расходуемому иону Н<sup>+</sup>, поскольку один запасаемый ион HCO<sub>3</sub> может связать один ион Н<sup>+</sup> (и как следствие осуществить «непрямое» выведение Н<sup>+</sup>). При среднем потреблении белка с пищей метаболизм аминокислот приводит к образованию примерно эквимолярных количеств ионов HCO<sub>3</sub> и NН4+ (примерно 700-1000 ммоль/сут). Печень утилизирует примерно 95% этих двух веществ, образуя мочевину (И):
| |
| − | 2HCO<sub>3</sub>- + 2NH<sub>4</sub><sup>+</sup> ⇆ H<sub>2</sub>N-C-NH<sub>2</sub> + С0<sub>2</sub> + ЗH<sub>2</sub>O О [7.131
| |
| − | [[Image:Naglydnay_fiziologiya175.jpg|250px|thumb|right|Г. Секреция и экскреция NH<sub>4</sub><sup>+</sup> =NH<sub>3</sub>]]
| |
| − | Таким образом, на каждый ион NН4+, поступающий из печени в почки, потребляется и выводится с мочой один ион HCO<sub>3</sub>. Перед экспортом NH<sub>4</sub><sup>+</sup> в почки печень включает его в глутамат, что приводит к образованию глутамина, и только небольшая часть достигает почек в виде свободного NH<sub>4</sub><sup>+</sup>. Высокие концентрации NH<sub>4</sub><sup>+</sup> NH<sub>3</sub> токсичны.
| |
| − | | |
| − | В почках глугемин входит в клетки проксимальных канальцев при помощи Na<sup>+</sup>-симпорта и расщепляется митохондриальной глутаминазой, образуя NH<sub>4</sub><sup>+</sup> и глутамат (Glu). Glu далее превращается глутаматдегидрогеназой в а-кетоглуторат с образованием второго иона NH<sub>4</sub><sup>+</sup> (Г2). NH<sub>4</sub><sup>+</sup> может достигнуть просвета канальцев двумя путями: (1) он диссоциирует внутри клетки с образованием NH<sub>3</sub> и Н<sup>+</sup>, позволяя NH<sub>3</sub> диффундировать (не по ионному механизму) в просвет, где он вновь соединяется с отдельно секретируемыми ионами Н<sup>+</sup>; (2) переносчик NHE3 секретирует NH<sub>4</sub><sup>+</sup> (вместо Н<sup>+</sup>). Как только ион NH<sub>4</sub><sup>+</sup> поступает в тонкий сегмент восходящего колена петли Генле (Г4), переносчик BSC реабсорбиру-ет NH<sub>4</sub><sup>+</sup> (вместо К<sup>+</sup>), так что тот остается в мозговом веществе почек. Рециркуляция ионов NH<sub>4</sub><sup>+</sup> через петлю Генле приводит к образованию очень высокой концентрации NH<sub>4</sub><sup>+</sup> ⇆ NH<sub>3</sub> + Н<sup>+</sup> в направлении почечных сосочков (ГЗ). Тогда как ионы Н<sup>+</sup> активно закачиваются в просвет собирательной трубочки и, возможно, NH<sub>3</sub>-транспортерами (гликопротеины RhB и RhC) (Я2, Г4), молекулы NH<sub>3</sub> поступают сюда путем неионной диффузии (Г4). Градиент NH<sub>3</sub>, необходимый для осуществления этой диффузии, образуется благодаря тому, что очень низкое значение pH просвета (около 4,5) ведет к гораздо меньшей концентрации NH<sub>3</sub> в просвете, чем в мозговом межклеточном пространстве, где pH выше примерно на две единицы, и концентрация NH<sub>3</sub>, следовательно, тоже выше, чем в просвете, примерно в 100 раз.
| |
| − | | |
| − | '''Нарушения кислотно-основного метаболизма'''. Когда развивается хронический нереспираторный ацидоз непочечной природы, экскреция возрастает по сравнению с нормальным уровнем в течение 1-2 дней примерно в 3 раза благодаря параллельному увеличению образования глутамина печенью (за счет мочевины) и активности почечной глутаминазы. Нереспираторный алкалоз только снижает почечную продукцию NH<sub>4</sub><sup>+</sup> и секрецию Н<sup>+</sup>. Это происходит вместе с увеличением фильтруемого HCO<sub>3</sub> (повышенная концентрация в плазме), приводя к быстрому увеличению экскреции HCO<sub>3</sub> и вслед за этим к осмотическому диурезу. Для компенсации респираторных нарушений важно, что повышенный (или пониженный) уровень Род, приводит к увеличенной (или уменьшенной) секреции Н<sup>+</sup> и, следовательно, увеличенной (или уменьшенной] резорбции HCO<sub>3</sub>. Рецепторы CO2 и HCO<sub>3</sub> на базолатеральной поверхности клетки регулируют этот процесс.
| |
| − | | |
| − | Почки также могут быть первичной причиной кислотноосновных нарушений (почечный ацидоз), при этом дефект может быть или генерализованным, или изолированным. При генерализованном дефекте, как например при почечной недостаточности, ацидоз развивается из-за снижения экскреции ионов Н<sup>+</sup>. При изолированном дефекте с нарушением проксимальной секреции ионов Н<sup>+</sup> большие количества фильтруемого HCO<sub>3</sub> не реабсорбируются, что ведет к проксимальному почечному канальцевому ацидозу. Когда ослабление выделения ионов Н<sup>+</sup> почками происходит в собирательной трубочке (например, при нарушении функции гена АЕ1), моча больше не может закисляться (pH > Б, несмотря на ацидоз), и экскреция титруемых кислот и NH<sub>4</sub><sup>+</sup> закономерно ухудшается (дистальный почечный канальцевый ацидоз)
| |
| − | | |
| − | == Реабсорбция и экскреция фосфата, Са<sup>2+</sup> и Мg<sup>2+</sup> ==
| |
| − | [[Image:Naglydnay_fiziologiya176.jpg|250px|thumb|right|А. Реабсорбция фосфата, Са<sup>2+</sup> и Мg<sup>2+</sup> ]] | |
| − | === Метаболизм фосфатов ===
| |
| − | Концентрация фосфатов в плазме обычно находится в диапазоне 0,8-1,4 ммоль/л. Каждый день фильтруется соответствующее количество неорганического фосфата Фн (НР042-⇆ Н2PO4-) (примерно 150-250 ммоль/суг), и большая его часть реабсорбируется. Фракция экскреции (А1), которая колеблется между 5 и 20%, необходима для поддержания баланса Фн, Н + и Са<sup>2+</sup>. Экскреция Фн возрастает при избытке Фн (повышенный уровень Фн в плазме) и падает при дефиците Фн. К фосфатурии и увеличению экскреции Н<sup>+</sup> также приводит ацидоз (титруемая кислотность). Это происходит и при фосфатурии от других причин. Гипокальциемия и паратиреоидный гормон (паратгормон) тоже индуцируют увеличение экскреции Фн (АЗ).
| |
| − | | |
| − | Фн реабсорбируется в проксимальных канальцах (А2, 3). Мембрана их просвета содержит 3-й тип 3Na<sup>+</sup>-Фн-симпортера (NaPi-З). Этот переносчик связывает ионы НР042- и Н2РО4 и котранспортирует их путем вторичного активного транспорта.
| |
| − | | |
| − | === Регуляция реабсорбции Фн ===
| |
| − | Дефицит Фн, алкалоз, гиперкальциемия и низкий уровень паратгормона приводят к усиленному включению транспортера NaPi-З в мембрану просвета, тогда как избыток Фн, ацидоз, гипокальциемия и увеличенная секреция паратгормона приводят (по отрицательной обратной связи) к интернализации и последующему расщеплению NaPi-З в лизосомах (АЗ).
| |
| − | | |
| − | === Метаболизм кальция ===
| |
| − | В отличие от метаболизма Na<sup>+</sup> метаболизм кальция регулируется в основном путем абсорбции Са<sup>2+</sup> в желудке и, во вторую очередь, путем почечной экскреции. Общий кальций плазмы (связанный кальций + ионизованный кальций) в среднем составляет 2,5 ммоль/л. Примерно 1,3 ммоль/л кальция присутствует как свободный, ионизованный Са?+, 0,2 ммоль/л образует комплексы с фосфатом, цитратом и т. д., а остальные 1 ммоль/л связаны с белками плазмы и, следовательно, не подлежат клубочковой фильтрации. Фракция экскреции Са<sup>2+</sup> (ФЭСа в моче - 0,5-3% (А1).
| |
| − | | |
| − | Реабсорбция Са<sup>2+</sup> происходит почти по всему нефрону (А1, 2). Реабсорбция фильтрованного Са<sup>2+</sup> примерно на 60% происходит в проксимальных канальцах, на 30% - в толстом сегменте восходящего колена (ТСВК) петли Генле, и является парацеллюлярной, т. е. пассивной (А4а). В основном движущая сила для этого вида активности обеспечивается люмен-положительным трансэпителиальным потенциалом (ЛПТП). Поскольку реабсорбция Са<sup>2+</sup> в ТСВК зависит от реабсорбции NaCI, петлевые диуретики ингибируют реабсорбцию Са<sup>2+</sup>. Всасывание Са<sup>2+</sup> в ТСВК обеспечивает паратгормон, так же как и в дистальных извитых канальцах, где Са<sup>2+</sup> реабсорбируется при помощи трансцеллюлярного активного транспорта (А4б). Таким образом, приток Са<sup>2+</sup> в клетку является пассивным процессом и происходит при помощи Са2*-каналов просвета, а отток Са<sup>2+</sup> - активный процесс и осуществляется посредством Са<sup>2+</sup>-АТФазы (первичный активный транспорт Са<sup>2+</sup>) и 3Na<sup>+</sup>-1Са<sup>2+</sup>-антипорта (вторичный активный транспорт Са<sup>2+</sup>). Ацидоз ингибирует реабсорбцию Са<sup>2+</sup> неизвестными пока механизмами.
| |
| − | | |
| − | Мочевые камни обычно состоят из фосфата кальция или оксалата кальция. Когда увеличиваются концентрации Са<sup>2+</sup>, Фн или оксалата, может достигаться произведение растворимости фосфорных и оксалатных солей кальция; обычно же лиганды, образующие с кальцием комплексы (например, цитрат), и ингибиторы кристаллизации (например, нефрокальцин) допускают некоторую степень пересыщения. Образование камней может произойти при дефиците этих веществ, или если в моче присутствует очень высокая концентрация Са<sup>2+</sup>. Фн или оксалата (применимо ко всем трем при ярко выраженном антидиурезе).
| |
| − | | |
| − | === Метаболизм магния и реабсорбция ===
| |
| − | Поскольку часть магния в плазме связана с белками (0,7-1,2 ммоль/л), концентрация магния в фильтрате составляет только 80% его концентрации в плазме. Фракция экскреции Мg<sup>2+</sup> (ФЭмд) составляет 3-8% (А1,2). Однако в отличие от Са<sup>2+</sup>, только 15% фильтрованных ионов Мg<sup>2+</sup> покидают проксимальные канальцы. Около 70% Мg<sup>2+</sup> подлежит парацеллюлярной реабсорбции в ТСВК (А4). Другие 10% Мg<sup>2+</sup> всасываются трансцеллюлярно в дистальных канальцах (А4б), вероятнее всего как Са<sup>2+</sup> (см. ранее).
| |
| − | | |
| − | Экскреция Мдг+ стимулируется гипермагнезиемией, гиперкальциемией, гиперволемией и петлевыми диуретиками, а ингибируется дефицитом Мg<sup>2+</sup>. Дефицит Са<sup>2+</sup>, дефицит объема, а также паратгормон и другие гормоны в основном оказывают влияние в ТСВК.
| |
| − | | |
| − | Почки содержат рецепторы для двухвалентных катионов, таких как Са<sup>2+</sup> и Мg<sup>2+</sup>. При активации рецепторы в ТСВК ингибируют реабсорбцию NaCI, который, как и петлевые диуретики, уменьшает движущую силу парацеллюлярной резорбции катионов, таким образом уменьшая в норме активное всасывание Мg<sup>2+</sup>.
| |
| − | | |
| − | == Баланс калия ==
| |
| − | [[Image:Naglydnay_fiziologiya177.jpg|250px|thumb|right|А. Регуляция внеклеточной концентрации К<sup>+</sup>]]
| |
| − | Потребление К<sup>+</sup> с пищей составляет примерно 100 ммоль/сут (минимальное потребление 25 ммоль/сут). Примерно 90% К<sup>+</sup> выводится с мочой и 10% - с фекалиями. Концентрация К<sup>+</sup> в плазме крови в норме колеблется от 3,5 до 4,8 ммоль/л, тогда как внутриклеточная концентрация К<sup>+</sup> может быть более чем в 30 раз выше (из-за активности Na<sup>+</sup>-К<sup>+</sup>-АТФазы; А). Таким образом, около 98% из 3000 ммоль ионов К<sup>+</sup> в организме присутствует в клетке. Хотя внеклеточная концентрация К<sup>+</sup> составляет только 2% от общего К<sup>+</sup> организма, она тем не менее очень важна, потому что (а) необходима для регуляции гомеостаза К<sup>+</sup> и (б) относительно небольшие изменения в клеточном К<sup>+</sup> (приток или отток) могут вести к значительным изменениям в концентрации К<sup>+</sup> в плазме (и связанному с этим риску сердечной аритмии). Регуляция гомеостаза К<sup>+</sup>, следовательно, подразумевает распределение К<sup>+</sup> во внутриклеточных и внеклеточных компартментах и баланс выведения К<sup>+</sup> и его потребления.
| |
| − | [[Image:Naglydnay_fiziologiya178.jpg|250px|thumb|right|Б. Резорбция и секреция К<sup>+</sup> в почках]]
| |
| − | Срочная регуляция внеклеточной концентрации К<sup>+</sup> достигается путем внутреннего смещения концентрации К<sup>+</sup> между внеклеточной и внутриклеточной жидкостью (А). Этот относительно быстрый процесс предотвращает или смягчает опасные повышения внеклеточного К<sup>+</sup> (гиперкалиемия) в тех случаях, когда присутствуют большие количества К<sup>+</sup> из-за его потребления с пищей или внутриклеточного высвобождения К<sup>+</sup> (например, при внезапном гемолизе). Данные сдвиги в концентрации К<sup>+</sup> в основном подлежат гормональной регуляции. Инсулин, который выделяется после еды, стимулирует Na<sup>+</sup>-К<sup>+</sup>-АТФазу и распределяет К<sup>+</sup>, поступивший с растительной или животной пищей, по клеткам тела. Данный тип регуляции используется также при гиперкалиемии, не связанной с питанием: сама по себе гиперкалиемия вызывает секрецию инсулина. Адреналин подобным же образом увеличивает потребление К<sup>+</sup> клетками, которые задействованы при мышечной работе и при травме - двух причинах, ведущих к увеличению К<sup>+</sup> в плазме крови. В обоих случаях повышенный уровень адреналина способствует поглощению К<sup>+</sup> в этих и других клетках. Увеличение внутриклеточной концентрации К<sup>+</sup> вызывает также альдостерон (см. далее).
| |
| − | [[Image:Naglydnay_fiziologiya179.jpg|250px|thumb|right|В. Факторы, действующие на секрецию и экскрецию К<sup>+</sup>]]
| |
| − | Изменения pH тоже влияют на внутриклеточное и внеклеточное распространение К<sup>+</sup> (А). Это происходит в основном по той причине, что широко распространенный Na<sup>+</sup>-К<sup>+</sup>-антипортер работает быстрее при алкалозе, чем при ацидозе (А). Следовательно, при ацидозе вход Na<sup>+</sup> уменьшается, работа Na<sup>+</sup>-К<sup>+</sup>-АТФазы замедляется и внеклеточная концентрация К<sup>+</sup> возрастает (особенно при нереспираторном ацидозе; на 0,6 ммоль/л на 0,1 единицы изменения pH). Алкалоз приводит к гипокалиемии.
| |
| − | | |
| − | Постоянная регуляция гомеостаза К<sup>+</sup> в основном осуществляется почками (Б). К<sup>+</sup> подлежит свободной клубочковой фильтрации, и большая часть фильтруемого К<sup>+</sup> обычно реабсорбируется [общая реабсорбция). Экскретируемое количество в некоторых случаях может превышать фильтруемое (общая секреция, см. далее). Около 65% фильтрованного К<sup>+</sup> обычно реабсорбируется ранее конца проксимальных канальцев, независимо от запасов К<sup>+</sup>. Это сравнимо с процентом реабсорбции Na<sup>+</sup> и Н2О (Б1). Ионы К<sup>+</sup> транспортируются в основном парацеллюлярно, т. е. пассивно. Движущими силами этого процесса являются захват растворенного вещества и положительный на люминальной стороне трансэпителиальный потенциал, ЛПТП (Б1) в среднем и конечном сегментах проксимальных канальцев. В петле Генле еще 15% фильтрованного К<sup>+</sup> реабсорбируется парацеллюлярно и параэпителиально (Б2). В соединительных канальцах и собирательной трубочке можно определить количество экскретируемого К<sup>+</sup>. Затем, в зависимости от потребностей, большие или меньшие количества К<sup>+</sup> или реабсорбируются, или секретируются. В экстремальных случаях в ответ на высокий уровень поглощения К<sup>+</sup> фракционная экскреция К<sup>+</sup> (ФЭk) может возрастать более чем на 100% или при дефиците К<sup>+</sup> падать примерно на 3-5% (Б).
| |
| − | [[Image:Naglydnay_fiziologiya180.jpg|250px|thumb|right|Г. Секреция, действие и деградация альдостерона]]
| |
| − | Клеточные механизмы почечного транспорта К<sup>+</sup>. Соединительные канальцы и собирательная трубочка содержат главные клетки (БЗ), которые реабсорбируют Na<sup>+</sup> и секретируют К<sup>+</sup>. Аккумулированный внутриклеточный К<sup>+</sup> может выходить из клеток через К<sup>+</sup> -каналы с любой стороны клетки. Решающее значение для оттока К<sup>+</sup> через мембрану имеет электрохимический градиент. Мембрана просвета главных клеток также содержит Na<sup>+</sup>-каналы, через которые Na<sup>+</sup> входит в клетку. Это деполяризует мембрану просвета, потенциал на которой достигает примерно -20 мВ, в то время как базолатеральная мембрана поддерживает свой нормальный потенциал величиной примерно -70 мВ (БЗ). Движущая сила оттока К<sup>+</sup> (Em - Ek), следовательно, выше на стороне просвета. Таким образом, К<sup>+</sup> покидает клетку предпочтительно в направлении просвета [секреция). Это является основной причиной того, что секреция К<sup>+</sup> сопряжена с всасыванием Na<sup>+</sup>, т. е. чем больше Na<sup>+</sup> реабсорбируется главными клетками, тем больше секретируется К<sup>+</sup>.
| |
| − | | |
| − | Другая видимая причина заключается в том, что связанное с всасыванием увеличение внутриклеточной концентрации Na<sup>+</sup> снижает движущую силу обмена 3Na<sup>+</sup>/Са<sup>2+</sup> на базолатеральной мембране, что приводит к увеличению концентрации Са<sup>2+</sup> в цитозоле. Это повышение действует как сигнал для более частого открывания К<sup>+</sup>-каналов просвета.
| |
| − | | |
| − | Добавочные клетки типа А (Б4) в дополнение к секреции ионов Н<sup>+</sup> могут активно реабсорбировать К<sup>+</sup>. Для этой цели люминальная мембрана этих клеток, как и у париетальных (обкладочных) клеток желудка, содержит Н<sup>+</sup>/К<sup>+</sup>-АТФазу.
| |
| − | | |
| − | Факторы, влияющие на экскрецию К<sup>+</sup> (В):
| |
| − | | |
| − | 1. Увеличенное потребление К<sup>+</sup> повышает внутриклеточную концентрацию К<sup>+</sup> и его концентрацию в плазме крови, что, в свою очередь, увеличивает химическую движущую силу для секреции К<sup>+</sup>.
| |
| − | | |
| − | 2. pH крови: внутриклеточная концентрация К<sup>+</sup> в клетках почек увеличивается при алкалозе и падает при остром ацидозе. Это ведет к одновременному падению экскреции К<sup>+</sup>, которая опять возрастает при хроническом ацидозе. Причинами этого является то, что (а) ацидоз-зависимое ингибирование Na<sup>+</sup>-К<sup>+</sup>-АТФазы уменьшает проксимальную реабсорбцию Na<sup>+</sup>, что приводит к увеличенному дистальному оттоку мочи, и (б) результирующая гиперкалиемия стимулирует секрецию альдостерона (см. п. 4).
| |
| − | | |
| − | 3. Если существует увеличенный отток мочи в соединительных канальцах и собирательной трубочке (например, по причине большой реабсорбции Na<sup>+</sup>, осмотического диуреза или других факторов, ингибирующих реабсорбцию Na<sup>+</sup>), то будут экскретироваться большие количества К<sup>+</sup>. Этим объясняется эффект потери калия при употреблении некоторых диуретиков. Причиной данного эффекта, возможно, является ограничение секреции К<sup>+</sup> при определенной концентрации этого иона в просвете. Следовательно, чем больше сотношение объем/время, тем больше К<sup>+</sup> удаляется со временем.
| |
| − | | |
| − | 4. Альдостерон ведет к удержанию Na<sup>+</sup>, увеличению клеточного объема, умеренному усилению секреции Н<sup>+</sup> (росту клеточного pH) и повышенной экскреции К<sup>+</sup>. Это также увеличивает количество молекул 1Na<sup>+</sup>-К<sup>+</sup>-АТФазы в клетках-мишенях и ведет к хроническому увеличению плотности митохондрий при адаптации к повышенному содержанию К<sup>+</sup> (см. далее).
| |
| − | | |
| − | Клеточные механизмы эффектов альдостерона. Усиленное обратное всасывание достигается путем увеличения синтеза транспортных белков, называемых альдостерОН<sup>-</sup>ин-дуцируемыми белками. Этот генетически обусловленный эффект начинается примерно через 30-60 мин после введения или секреции альдостерона. Максимальный эффект наступает через несколько часов. Альдостерон увеличивает реабсорбцию Na<sup>+</sup>, деполяризуя мембрану просвета (БЗ). Вслед за этим он увеличивает движущую силу секреции К<sup>+</sup> и проводимость К<sup>+</sup> путем увеличения pH клетки. Оба эти эффекта ведут к увеличению выведения К<sup>+</sup>. Кроме того, альдостерон имеет очень быстрый (от нескольких секунд до нескольких минут] не связанный с генетикой эффект на клеточную мембрану, физиологическая значимость которого еще должна быть исследована.
| |
| − | | |
| − | Емкость К<sup>+</sup>-выводящего механизма возрастает в ответ на длительное увеличение притока К<sup>+</sup> (К<sup>+</sup>-адаптация) Даже когда работа почек нарушена, этот механизм в основном способен поддерживать баланс К<sup>+</sup> в оставшихся интактных частях канальцевого аппарата. Взять на себя выведение более чем 1/3 общего количества К<sup>+</sup> может также прямая кишка.
| |
| − | | |
| − | '''Минералокортико(стеро)иды'''. Альдостерон - зто наиболее распространенный минералокортикоидный гормон, синтезирующийся и секретирующийся в гломерулярной (клубочковой) зоне коры надпочечников (Г). Как и другие стероидные гормоны, альдостерон не хранится, а образуется при необходимости. Основная функция альдостерона состоит в регуляции транспорта Na<sup>+</sup> и К<sup>+</sup> в почках, желудке и других органах (Г). Секреция альдостерона возрастает в ответ на (а) падение объема крови и кровяного давления (опосредованное ангиотензином II) и (б) гиперкалиемию (Г). Синтез альдостерона ингибируется атриопептином. | |
| − | | |
| − | Нормальная концентрация кортизола не влияет на рецепторы альдостерона только потому, что кортизол превращается в кортизон 11 бета-гидроксистероид-оксидоредуктазой в клетках-мишенях альдостерона.
| |
| − | | |
| − | '''Гиперальдостеронизм''' может быть либо первичным (секретирующие альдостерон опухоли в коре надпочечников, что наблюдается при синдроме Конна), либо вторичным (при уменьшении объема жидкости). Удержание Na<sup>+</sup> приводит к большому объему внеклеточного пространства и повышенному кровяному давлению с одновременными потерями К<sup>+</sup> и, как следствие, гипокалиемическому алкалозу. Когда более чем 90% коры надпочечников разрушено, например, по причине аутоиммунного воспаления надпочечников, метастазирующего рака или туберкулеза, развивается первичная хроническая недостаточность коры надпочечников (болезнь Аддисона). Дефицит альдостерона ведет к резкому увеличению экскреции Na<sup>+</sup>, что приводит к гиповолемии, гипотензии и удерживанию К<sup>+</sup> (гиперкалиемии). Когда одновременно развивается также дефицит глюкокортикоидов, осложнения могут быть опасны для жизни, особенно при серьезных инфекциях и травмах. Если разрушена только одна железа, АКТГ вызывает гипертрофию другой. | |
| − | | |
| − | Тубулогломерулярная обратная связь, ренин-ангиотензиновая система Юкстагломерулярный аппарат (ЮГА) состоит из (а) юкстагломерулярных клеток приносящей артериолы (включая ренинсодержащие и симпатически иннервируемые гранулярные клетки) и выносящей артериолы, (б) клеток плотного пятна толстого сегмента восходящего колена петли Генле и (в) юкстагломерулярных мезангиальных клеток (полкиссен, А) нефрона (А).
| |
| | | | |
| | '''Функции ЮГА''': (1) локальное проведение тубулогло-мерулярной обратной связи (механизм саморегуляции) в своем собственном нефроне при помощи ангиотензина II (ATII) и (2) системная продукция ангиотензина II как части ренин-ангиотензиновой системы (РАС). | | '''Функции ЮГА''': (1) локальное проведение тубулогло-мерулярной обратной связи (механизм саморегуляции) в своем собственном нефроне при помощи ангиотензина II (ATII) и (2) системная продукция ангиотензина II как части ренин-ангиотензиновой системы (РАС). |
| | | | |
| − | Тубулогломерулярная обратная связь (механизм саморегуляции). Поскольку через почки ежедневно проходит в 10 раз больше жидкости, чем общий объем внеклеточной жидкости, выведение воды и соли должно точно соответствовать их поглощению. Резкие изменения в СКФ отдельного нефрона (СФН) и количества NaCI, фильтруемого в единицу времени, могут происходить по нескольким причинам. Повышение значения СФН ассоциируется с риском того, что дистальные механизмы реабсорбции NaCI перегружены, и слишком много NaCI и НгО будет потеряно с мочой. Заниженный показатель СФН означает, что слишком много NaCI и НдО удерживается. Степень реабсорбции NaCI и Н2О в проксимальных канальцах определяет, как быстро канальцевая моча проходит по петле Генле. Когда меньшее количество абсорбируется в верхней части, моча быстрее проходит по толстому сегменту восходящего колена петли, что приводит к уменьшению степени разбавления мочи и большей концентрации NaCI в плотном пятне, [NaCI]MD. Если величина [NaCI]MD становится слишком большой, гладкие мышцы стенки приносящей артериолы сокращаются, чтобы не изменилась СКФ через данный нефрон в течение 10 с, и наоборот (отрицательная обратная связь). Механизм регуляции неясен, но рецепторы ангиотензина II типа 1А (АТ1A) играют в этом ведущую роль. | + | '''Тубулогломерулярная обратная связь (механизм саморегуляции)'''. Поскольку через почки ежедневно проходит в 10 раз больше жидкости, чем общий объем внеклеточной жидкости, выведение воды и соли должно точно соответствовать их поглощению. Резкие изменения в СКФ отдельного нефрона (СФН) и количества NaCI, фильтруемого в единицу времени, могут происходить по нескольким причинам. Повышение значения СФН ассоциируется с риском того, что дистальные механизмы реабсорбции NaCI перегружены, и слишком много NaCI и НгО будет потеряно с мочой. Заниженный показатель СФН означает, что слишком много NaCI и НдО удерживается. Степень реабсорбции NaCI и Н2О в проксимальных канальцах определяет, как быстро канальцевая моча проходит по петле Генле. Когда меньшее количество абсорбируется в верхней части, моча быстрее проходит по толстому сегменту восходящего колена петли, что приводит к уменьшению степени разбавления мочи и большей концентрации NaCI в плотном пятне, [NaCI]MD. Если величина [NaCI]MD становится слишком большой, гладкие мышцы стенки приносящей артериолы сокращаются, чтобы не изменилась СКФ через данный нефрон в течение 10 с, и наоборот (отрицательная обратная связь). Механизм регуляции неясен, но рецепторы ангиотензина II типа 1А (АТ1A) играют в этом ведущую роль. |
| | | | |
| | Однако, если изменения [NaCI]MD обусловлены хроническими изменениями общего количества NaCI в организме и связанными с этим изменениями объема внеклеточной жидкости через механизм саморегуляции (обратной связи), нарушения зависимости СФН от [NaCI]MD могут иметь фатальные последствия. Поскольку увеличение в течение длительного времени объема внеклеточной жидкости уменьшает реабсорбцию NaCI в проксимальных канальцах, [NaCl]MD будет возрастать, приводя к снижению СКФ и дальнейшему увеличению объема внеклеточной жидкости. В обратной ситуации объем внеклеточной жидкости уменьшается. Для предотвращения таких эффектов зависимость [NaCl]MD/СФН может быть смещена в соответствующем направлении с помощью определенных веществ. Оксид азота (N0) смещает кривую при увеличении объема внеклеточной жидкости (увеличение СФН при прежнем значении [NaCI]MD), а (только локально эффективный) ангиотензин II сдвигает кривую в противоположном направлении при уменьшении объема. | | Однако, если изменения [NaCI]MD обусловлены хроническими изменениями общего количества NaCI в организме и связанными с этим изменениями объема внеклеточной жидкости через механизм саморегуляции (обратной связи), нарушения зависимости СФН от [NaCI]MD могут иметь фатальные последствия. Поскольку увеличение в течение длительного времени объема внеклеточной жидкости уменьшает реабсорбцию NaCI в проксимальных канальцах, [NaCl]MD будет возрастать, приводя к снижению СКФ и дальнейшему увеличению объема внеклеточной жидкости. В обратной ситуации объем внеклеточной жидкости уменьшается. Для предотвращения таких эффектов зависимость [NaCl]MD/СФН может быть смещена в соответствующем направлении с помощью определенных веществ. Оксид азота (N0) смещает кривую при увеличении объема внеклеточной жидкости (увеличение СФН при прежнем значении [NaCI]MD), а (только локально эффективный) ангиотензин II сдвигает кривую в противоположном направлении при уменьшении объема. |
| − | [[Image:Naglydnay_fiziologiya181.jpg|250px|thumb|right|А. Юкстагломерулярный аппарат]]
| + | |
| | '''Ренин-ангиотензиновая система (РАС)'''. Если среднее артериальное давление в почках внезапно падает ниже 90 мм рт. ст., почечные барорецепторы запускают высвобождение ренина, таким образом увеличивая общую концентрацию ренина в плазме. Ренин - это пептидаза, которая катализирует отщепление ангиотензина от субстрата ренина ангио-тензиногена (выделяемого печенью). Примерно через 30-60 мин после падения артериального давления ангиотензинпревращающий фермент (АПФ), который синтезируется в легких и других органах, отщепляет две аминокислоты от ангиотензина I с образованием ангиотензина II (Б). | | '''Ренин-ангиотензиновая система (РАС)'''. Если среднее артериальное давление в почках внезапно падает ниже 90 мм рт. ст., почечные барорецепторы запускают высвобождение ренина, таким образом увеличивая общую концентрацию ренина в плазме. Ренин - это пептидаза, которая катализирует отщепление ангиотензина от субстрата ренина ангио-тензиногена (выделяемого печенью). Примерно через 30-60 мин после падения артериального давления ангиотензинпревращающий фермент (АПФ), который синтезируется в легких и других органах, отщепляет две аминокислоты от ангиотензина I с образованием ангиотензина II (Б). |
| | [[Image:Naglydnay_fiziologiya182.jpg|250px|thumb|right|Б. Ренин-ангиотензиновая система (РАС)]] | | [[Image:Naglydnay_fiziologiya182.jpg|250px|thumb|right|Б. Ренин-ангиотензиновая система (РАС)]] |
| Строка 443: |
Строка 62: |
| | Если средний кровоток снижается только в одной почке (например, в результате стеноза поврежденной почечной артерии), то поврежденная почка начинает высвобождать больше ренина, что, в свою очередь, приводит к почечной гипертензии в остальной системе кровообращения. | | Если средний кровоток снижается только в одной почке (например, в результате стеноза поврежденной почечной артерии), то поврежденная почка начинает высвобождать больше ренина, что, в свою очередь, приводит к почечной гипертензии в остальной системе кровообращения. |
| | | | |
| − | Эффекты ангиотензина II. Помимо действия на миокард и кровеносные сосуды (в основном посредством АТд-рецепторов), ангиотензин II имеет следующие срочные или отложенные эффекты, опосредованные рецепторами АТ1 (А). | + | '''Эффекты ангиотензина II'''. Помимо действия на миокард и кровеносные сосуды (в основном посредством АТд-рецепторов), ангиотензин II имеет следующие срочные или отложенные эффекты, опосредованные рецепторами АТ1 (А). |
| | + | |
| | + | *[[Физиология сердца и сердечно-сосудистой системы|Сосуды]]. Ангиотензин II имеет потенциальное вазоконст-рикторное и гипертензивное действие, что (посредством эндотелина) влияет на артериолы (срочное действие). |
| | + | |
| | + | *[[Центральная нервная система|ЦНС]]. Ангиотензин II оказывает действие на гипоталамус, что приводит (через циркуляторный центр) к вазоконст-рикции (быстрое действие). Он также увеличивает секрецию АДГ в гипоталамусе, что стимулирует жажду и потребность в соли (отложенное действие). |
| | | | |
| − | *Сосуды. Ангиотензин II имеет потенциальное вазоконст-рикторное и гипертензивное действие, что (посредством эндотелина) влияет на артериолы (срочное действие). | + | *[[Почки]]. Ангиотензин II играет основную роль в регуляции почечного кровообращения и СКФ путем сужения приносящих и/или выносящих артериол (отложенное действие, ср. саморегуляция). Он прямо стимулирует реабсорбцию Na<sup>+</sup> в проксимальных канальцах (отложенное действие). |
| | | | |
| − | *ЦНС. Ангиотензин II оказывает действие на гипоталамус, что приводит (через циркуляторный центр) к вазоконст-рикции (быстрое действие). Он также увеличивает секрецию АДГ в гипоталамусе, что стимулирует жажду и потребность в соли (отложенное действие). | + | *[[Надпочечники]]. Ангиотензин II стимулирует синтез альдостерона в коре надпочечников (отложенное действие) и ведет к высвобождению адреналина в мозговом веществе надпочечников (срочное действие). |
| | | | |
| − | *Почки. Ангиотензин II играет основную роль в регуляции почечного кровообращения и СКФ путем сужения приносящих и/или выносящих артериол (отложенное действие, ср. саморегуляция). Он прямо стимулирует реабсорбцию Na<sup>+</sup> в проксимальных канальцах (отложенное действие).
| + | == Читайте также == |
| | | | |
| − | *Надпочечники. Ангиотензин II стимулирует синтез альдостерона в коре надпочечников (отложенное действие) и ведет к высвобождению адреналина в мозговом веществе надпочечников (срочное действие). | + | *[[Почки]] |
| | + | *[[Анатомия почки]] |
| | + | *[[Почки как орган выделения]] |
| | + | *[[Кислотно-щелочной баланс]] |
| | + | *[[Клубочковая фильтрация и клиренс]] |
| | + | *[[Транспорт в нефроне]] |
| | + | *[[Реабсорбция в почках]] |
| | + | *[[Гомеостаз жидкостей организма]] |
| | + | *[[Почечная недостаточность и спорт (тренировки с одной почкой)]] |
Почки регулируют выведение из организма воды и солей с целью поддержания постоянного объема внеклеточной жидкости и осмоляльности, помогают поддерживать кислотно-основной гомеостаз; удаляют конечные продукты метаболизма и чужеродные вещества; предотвращают выведение полезных веществ (например, глюкозы) путем реабсорбции; продуцируют гормоны (например, эритропоэтин) и активаторы гормонов (ренин); выполняют метаболические функции (катаболизм белков и пептидов, глюконеогенез и т. д.).
Пища поставляет необходимые питательные вещества, но в ней есть и вредные компоненты. Организм обычно способен отсортировать их сразу же во время еды по запаху и вкусу, или, если они уже съедены, путем расщепления специфическими ферментами и с помощью абсорбирующих механизмов в кишечнике (например, D-глюкоза и (.-аминокислоты всасываются, а D-аминокислоты и L-глюкоза нет). Похожие механизмы работают и при выведении через печень (желчь - стул): полезные желчные кислоты почти полностью всасываются в кишечнике при помощи специальных транспортеров, тогда как отходы метаболизма, такие как билирубин, в основном удаляются с фекалиями. Подобным же образом, почки плохо реабсорбируют все бесполезные или вредные вещества (включая конечные продукты, например креатинин). Важные же вещества (такие как D-глюкоза и L-аминокислоты) реабсорбируются при помощи специальных транспортеров и, таким образом, избегают экскреции.
Печень и почки также способны модифицировать эндогенные отходы и инородные компоненты (ксенобиотики), лишая их токсичности (если они токсичны) и подготавливая их к быстрому выведению. В незаряженной форме или после ферментативного присоединения групп ОН или СООН эти вещества объединяются с глюкуроновой кислотой, сульфатом, ацетатом или глутатионом и формируют конъюгаты. Конъюгированные вещества затем секретируются в желчь и в просвет проксимальных канальцев (с дальнейшей метаболической обработкой или без таковой).

А. Секреция и экскреция л-аминогиппурата (ПАГ)
Проксимальные канальцы используют механизмы активного транспорта для секреции многочисленных отходов и ксенобиотиков. Это осуществляется при помощи переносчиков органических анионов (ОА-) и органических катионов (ОС+). Секреция этих веществ позволяет поднять их клиренс выше клиренса инулина и, таким образом, увеличить их фракцию экскреции (ФЭ) выше 1 (100%) для более эффективного удаления (А, ср. красную и синюю кривые). Секреция осуществляется переносчиками и, следовательно, подчиняется кинетике насыщения. В отличие от реабсорбируемых веществ, таких как D-глюкоза, фракция экскреции органических анионов и катионов снижается с ростом их концентрации в плазме (А, кривая секреции ПАГ достигает плато, а наклон кривой экскреции ПАГ снижается). Некоторые органические анионы (например, ураты и оксалаты) и катионы (например, холин) и секретируются, и реабсорбируются (двунаправленный транспорт), что приводит к суммарной реабсорбции (ураты, холин) или секреции (оксалаты).
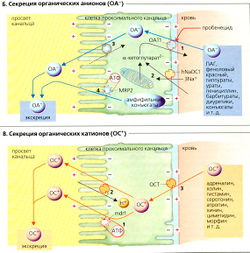
Б. Секреция органических анионов (ОА~) В. Секреция органических катионов (ОС*)
К секретируемым органическим анионам (OА~) относятся индикаторы, такие как ПАГ (л-аминогиппурат) и феноловый красный; эндогенные вещества, такие как ураты, оксалаты, гиппураты; лекарства: пенициллин G, барбитураты и многочисленные диуретики; а также конъюгированные вещества (см. выше), содержащие глюкуронат, сульфат или глутатион. Пробенецид, по причине большой аффинности к транспортным системам, является потенциальным ингибитором секреции 0А~.
Активная стадия секреции ОА- (Б) осуществляется через базолатеральную мембрану клеток проксимальных канальцев и аккумулирует в клетках органические анионы, чтобы преодолеть отрицательный внутренний потенциал. Мембрана имеет переносчик с широкой специфичностью (ОАТ1 - транспортер органических анионов 1-го типа), который транспортирует ОА- из крови в клетки канальцев в обмен на дикарбоксилат, например сукцинат2- или а-кетоглуторат2- (Б1). Последнее вещество происходит из клеточного метаболизма глутамина; переносчик Na+-дикарбоксилата у человека hNADC-1 также проводит дикарбоксилат (вместе с 3Na+) в клетку путем вторичного активного транспорта (Б2). Поэтому транспорт ОА- называется третичным активным транспортом. Выход ОА- в просвет канальца происходит пассивно (облегченная диффузия; БЗ). Для секреции амфифильных конъюгатов, таких как связанные с глутатионом липофильные токсины, также используется АТФ-зависимый конъюгатный насос (MRP2 = белок, отвечающий за мультимедикаментозную резистентность 2-го типа) в мембране просвета канальцев (Б4).
К секретируемым органическим катионам (ВС+) относятся эндогенные вещества (адреналин, холин, гистамин, серотонин и т. д.) и лекарственные вещества (атропин, морфин, хинин и т. д.).
В противоположность секреции ОА- активная стадия секреции OС+ происходит через люминальную мембрану клеток проксимальных канальцев (аккумуляция в просвете происходит после преодоления отрицательного мембранного потенциала внутри клетки). Мембрана содержит: (а) прямые АТФ-зависимые переносчики органических катионов (mdr1; первичный активный транспорт 0С+; В1); (б) мультиспецифический антипортер OС+/Н+ (третичный активный транспорт; В2). Катионы OС+ пассивно диффундируют из крови в клетку при помощи мультиспецифического транспортера органических катионов ГОСТ; ВЗ).
Увеличение выделения мочи свыше 1 мл/мин (диурез) может иметь следующие причины:
- Водный диурез: Снижение осмоляльности плазмы и/или увеличение объема крови ведут к уменьшению уровня АДГ и, следовательно, к удалению «свободной воды» . * •
- Осмотический диурез происходит, когда в почечные канальцы попадает активное вещество, нереабсорбируемое осмотически (например, маннит). Эти вещества удерживают воду в просвете канальца, после чего она выводится. Осмотический диурез может также иметь место в том случае, если концентрация реабсорбируемого вещества (например, глюкозы) превышает абсорбционную емкость канальцев, что приводит к гипергликемии. Глюкозурия при сахарном диабете, следовательно, сопровождается диурезом и вторичным увеличением жажды. Гипербикарбонатурия по этой же причине может приводить к осмотическому диурезу.
- Прессорный диурез развивается в том случае, если осмоляльность в мозговом веществе почки снижается при увеличении кровотока, что имеет место чаще всего при повышенном кровяном давлении.
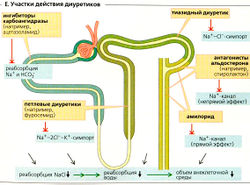
Е. Участки действия диуретиков
- Диуретики (Е) - это лекарства, индуцирующие диурез. Большинство из них (кроме осмотических диуретиков наподобие маннита) действует в основном путем ингибирования реабсорбции NaCI (салуретики) и уже потом путем снижения реабсорбции воды. Терапия диуретиками, например, при лечении отеков и повышенного давления вызывает понижение объема внеклеточной жидкости.
Несмотря на то что диуретики в основном ингибируют транспорт NaCI по всему телу, они имеют большую почечную «специфичность», поскольку действуют из просвета канальцев, где становятся очень концентрированными благодаря секреции и реабсорбции воды в канальцах. Таким образом, дозировки, не вызывающие нежелательных системных эффектов, являются терапевтически эффективными в просвете канальцев.
Диуретики типа ингибиторов карбоангидразы (например, ацетазоламид, бензоламид) снижают обмен Na+/H+ и реабсорбцию HCO3 в проксимальных канальцах. Степень развивающегося диуреза незначительна, поскольку дистальные сегменты канальцев реабсорбируют NaCI, не реабсорбируемый выше, а также потому, что происходит снижение СКФ благодаря канальцево-клубочковой обратной связи. В добавление к этому, повышенная экскреция HCO3 также ведет к нереспираторному (метаболическому) ацидозу. Следовательно, этот тип диуретиков используется только для пациентов с сопутствующим алкалозом.
Петлевые диуретики (например, фуросемид и буметанид) высокоэффективны. Они ингибируют буметанидчувствительный котранспортер BSC, Na+-2К+-симпорт-переносчик в толстом сегменте восходящего колена (ТСВК) петли Генле. Это не только снижает реабсорбцию NaCI, но также блокирует «мотор» механизма концентрирования мочи. Поскольку положительный люминальный трансэпителиальный потенциал (ЛПТП) в ТСВК падает, парацеллюляр-ная реабсорбция Na+, Са2+ и Мg2+ также ингибируется. Так как количество нереабсорбируемого Na+, поступающего в собирательную трубочку, увеличивается, секреция К+ растет, одновременная потеря Н+ ведет к гипокалиемии и гипокалиемическому алкалозу.
Петлевые диуретики ингибируют BSC в плотном пятне, таким образом «обманывая» юкстагломерулярный аппарат (ЮГА), заставляя его «поверить», что в просвете канальцев нет больше NaCI. Затем СКФ увеличивается по механизму канальцево-клубочковой обратной связи, что, в свою очередь, вызывает диурез.
Тиазидные диуретики ингибируют резорбцию в дистальных канальцах. Подобно петлевым диуретикам, они увеличивают реабсорбцию в нижних сегментах канальцев, что приводит к потерям К+ и Н+.
Калийсберегающие диуретики. Амилорид блокирует Na+-каналы в главных клетках соединительных канальцев и собирательной трубочки, что ведет к уменьшению выделения К+. Антагонисты альдостерона (например, спиролактон), которые блокируют цитоплазматические рецепторы альдостерона, также оказывают калийсберегающий эффект.
Тубулогломерулярная обратная связь, ренин-ангиотензиновая система[править | править код]
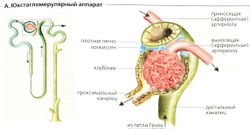
А. Юкстагломерулярный аппарат
Юкстагломерулярный аппарат (ЮГА) состоит из (а) юкстагломерулярных клеток приносящей артериолы (включая ренинсодержащие и симпатически иннервируемые гранулярные клетки) и выносящей артериолы, (б) клеток плотного пятна толстого сегмента восходящего колена петли Генле и (в) юкстагломерулярных мезангиальных клеток (полкиссен, А) нефрона (А).
Функции ЮГА: (1) локальное проведение тубулогло-мерулярной обратной связи (механизм саморегуляции) в своем собственном нефроне при помощи ангиотензина II (ATII) и (2) системная продукция ангиотензина II как части ренин-ангиотензиновой системы (РАС).
Тубулогломерулярная обратная связь (механизм саморегуляции). Поскольку через почки ежедневно проходит в 10 раз больше жидкости, чем общий объем внеклеточной жидкости, выведение воды и соли должно точно соответствовать их поглощению. Резкие изменения в СКФ отдельного нефрона (СФН) и количества NaCI, фильтруемого в единицу времени, могут происходить по нескольким причинам. Повышение значения СФН ассоциируется с риском того, что дистальные механизмы реабсорбции NaCI перегружены, и слишком много NaCI и НгО будет потеряно с мочой. Заниженный показатель СФН означает, что слишком много NaCI и НдО удерживается. Степень реабсорбции NaCI и Н2О в проксимальных канальцах определяет, как быстро канальцевая моча проходит по петле Генле. Когда меньшее количество абсорбируется в верхней части, моча быстрее проходит по толстому сегменту восходящего колена петли, что приводит к уменьшению степени разбавления мочи и большей концентрации NaCI в плотном пятне, [NaCI]MD. Если величина [NaCI]MD становится слишком большой, гладкие мышцы стенки приносящей артериолы сокращаются, чтобы не изменилась СКФ через данный нефрон в течение 10 с, и наоборот (отрицательная обратная связь). Механизм регуляции неясен, но рецепторы ангиотензина II типа 1А (АТ1A) играют в этом ведущую роль.
Однако, если изменения [NaCI]MD обусловлены хроническими изменениями общего количества NaCI в организме и связанными с этим изменениями объема внеклеточной жидкости через механизм саморегуляции (обратной связи), нарушения зависимости СФН от [NaCI]MD могут иметь фатальные последствия. Поскольку увеличение в течение длительного времени объема внеклеточной жидкости уменьшает реабсорбцию NaCI в проксимальных канальцах, [NaCl]MD будет возрастать, приводя к снижению СКФ и дальнейшему увеличению объема внеклеточной жидкости. В обратной ситуации объем внеклеточной жидкости уменьшается. Для предотвращения таких эффектов зависимость [NaCl]MD/СФН может быть смещена в соответствующем направлении с помощью определенных веществ. Оксид азота (N0) смещает кривую при увеличении объема внеклеточной жидкости (увеличение СФН при прежнем значении [NaCI]MD), а (только локально эффективный) ангиотензин II сдвигает кривую в противоположном направлении при уменьшении объема.
Ренин-ангиотензиновая система (РАС). Если среднее артериальное давление в почках внезапно падает ниже 90 мм рт. ст., почечные барорецепторы запускают высвобождение ренина, таким образом увеличивая общую концентрацию ренина в плазме. Ренин - это пептидаза, которая катализирует отщепление ангиотензина от субстрата ренина ангио-тензиногена (выделяемого печенью). Примерно через 30-60 мин после падения артериального давления ангиотензинпревращающий фермент (АПФ), который синтезируется в легких и других органах, отщепляет две аминокислоты от ангиотензина I с образованием ангиотензина II (Б).
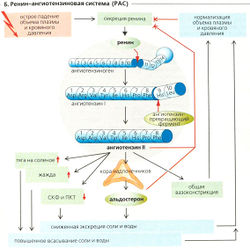
Б. Ренин-ангиотензиновая система (РАС)
Регуляция РАС (Б). Порог артериального давления для высвобождения ренина увеличивается при помощи а1-адренорецепторов, а базальная секреция ренина увеличивается при помощи бета1-адренорецепторов. Ангиотензин II и альдостерон являются наиболее важными эффекторами РАС. Ангиотензин II стимулирует высвобождение альдостерона корой надпочечников (см. далее). Оба гормона прямо (срочное действие) или косвенно (отложенное действие) ведут к новому увеличению артериального давления (Б), и высвобождение ренина, таким образом, снижается до нормы. Кроме того, оба гормона ингибируют высвобождение ренина (отрицательная обратная связь).
Если средний кровоток снижается только в одной почке (например, в результате стеноза поврежденной почечной артерии), то поврежденная почка начинает высвобождать больше ренина, что, в свою очередь, приводит к почечной гипертензии в остальной системе кровообращения.
Эффекты ангиотензина II. Помимо действия на миокард и кровеносные сосуды (в основном посредством АТд-рецепторов), ангиотензин II имеет следующие срочные или отложенные эффекты, опосредованные рецепторами АТ1 (А).
- Сосуды. Ангиотензин II имеет потенциальное вазоконст-рикторное и гипертензивное действие, что (посредством эндотелина) влияет на артериолы (срочное действие).
- ЦНС. Ангиотензин II оказывает действие на гипоталамус, что приводит (через циркуляторный центр) к вазоконст-рикции (быстрое действие). Он также увеличивает секрецию АДГ в гипоталамусе, что стимулирует жажду и потребность в соли (отложенное действие).
- Почки. Ангиотензин II играет основную роль в регуляции почечного кровообращения и СКФ путем сужения приносящих и/или выносящих артериол (отложенное действие, ср. саморегуляция). Он прямо стимулирует реабсорбцию Na+ в проксимальных канальцах (отложенное действие).
- Надпочечники. Ангиотензин II стимулирует синтез альдостерона в коре надпочечников (отложенное действие) и ведет к высвобождению адреналина в мозговом веществе надпочечников (срочное действие).





