Генный допинг
Генный допинг[править | править код]
Английская "TIMES" 1 августа 2008 г. со своих страниц заявила, что "исследователи обнаружили и протестировали на мышах два вещества, способных существенно повысить силу и выносливость мышц. Одно из этих соединений продемонстрировало способность улучшать физические возможности животных даже в отсутствие тренировки". Руководитель исследования, сотрудник Института Говарда Хьюга Р. Эванс, как сообщала газета, некоторое время назад сумел вдвое повысить выносливость мышей, встроив в геном животных модифицированную версию гена ядерного клеточного рецептора PPAR-δ (ППАР-дельта), регулирующего процессы метаболизма в клетках. Это было расценено как начало эры генного допинга. Затем Р. Эванс и его коллеги из Института биологических исследований Солка попытались достичь аналогичного эффекта при помощи экспериментальных лекарств. Путем длительного подбора ученые идентифицировали химическое соединение под названием GW 1516. Результат эксперимента оправдал ожидания лишь отчасти. Получавшие его мыши не демонстрировали никаких экстраординарных способностей без тренировки, однако после начала физических упражнений их сила и выносливость увеличивались значительно быстрее, чем у обычных мышей после таких же нагрузок. Однако, к сожалению, газета "TIMES" не упомянула, что GW 1516 был обнаружен в процессе изучения механизмов влияния антидиабетических препаратов нового поколения на синтез гликогена и утилизацию глюкозы (более ранее название GW1516 — GSK 516 — вполне может указывать на связь изучаемого вещества с действием фермента киназы гликогенсинтазы — ГСК, играющей важную роль в метаболизме углеводов).
За две недели до старта летнего чемпионата мира-2009 по легкой атлетике Антидопинговая комиссия Всероссийской федерации легкой атлетики (ВФЛА) со страниц своего официального сайта выступила с заявлением о том, что генный допинг, об опасности которого говорили последнее время в научных и спортивных кругах, выходит на широкий нелегальный рынок. В заявлении говорилось, что два препарата под названием GW 1516 и AICAR активно рекламируются в Интернете. Об этих препаратах как о потенциальной угрозе уже несколько лет предупреждают специалисты в области спортивной медицины и функционеры международных антидопинговых служб. Известный российский специалист по борьбе с допингом, глава медицинской комиссии Континентальной хоккейной лиги, а в прошлом глава антидопинговой службы Росспорта, Николай Дурманов присоединился к этому заявлению, подчеркнув в своих интервью для широкой общественности огромную опасность использования таких препаратов. В интервью Интернет-изданию "infox.ru" он рассказал, что такое GW 1516 и AICAR, и почему ВФЛА назвала этот допинг смертельным: GW 1516 и AICAR перестраивают работу генов в организме человека. Мыши, обработанные этими препаратами, бегают на 60—70 % дольше и дальше, чем их обычные собратья. Эти вещества влияют на гены мышечных клеток, и опыты на животных показали, что они якобы значительно увеличивают выносливость организма, многократно превосходя по своему действию все имеющиеся "традиционные" допинги. Ученые крайне озабочены тем фактом, что разрекламированные "магические" свойства этих препаратов приведут к их быстрому распространению в спортивном мире. При этом не было проведено достаточных исследований по влиянию препаратов на организм человека. В частности, большую настороженность вызывает потенциальное воздействие этих веществ на сердечно-сосудистую систему человека, что может привести к таким катастрофичным последствиям, как инфаркт миокарда. Специалисты-медики из Антидопинговой комиссии ВФЛА считают своим долгом предупредить спортсменов, тренеров, врачей о серьезной опасности, связанной с приемом этих веществ. Как отметил Н. Д. Дурманов, "пусть никого не обманывает легкомысленная реклама и искусственный ажиотаж вокруг этих генных допингов. Они смертельно опасны. К сожалению, в прессе и Интернете распространены заявления, что уже налажено подпольное производство запрещенного товара, так как сама структура этих веществ не очень сложная, и имеются указания, где их можно приобрести".
Когда сведения о AICAR и GW 1516 появились в научной литературе, средства массовой информации назвали их "таблетками зарядки". В самом обобщенном виде механизм их действия связан с воздействием на процессы выработки энергии. В частности, новые субстанции повышают образование и последующее окисление жиров (липидов), служащих одним из важных источников энергии при физической нагрузке, и увеличивают скорость кровотока, что обеспечивает стабильный транспорт липидов к местам их метаболизма. Кроме того, и AICAR, и GW 1516 связаны с процессами метаболизма углеводов — главной энергетической субстанцией при длительной физической нагрузке.
Еще в 2004 г. в российском Интернет-журнале "Коммерческая биотехнология" появилась научно-популярная статья А. Чубенко о генном допинге, в которой указывалось, что уже тогда под руководством Р. Эванса проводились исследования по модификации мышечных волокон. Однако целью поиска являлось совсем не повышение спортивных результатов. Посылка исследователей была совсем иной. Известно, что мышечные волокна делятся преимущественно на два типа: медленносокращающиеся, но выносливые, волокна типа I требуют хорошего снабжения кислородом и глюкозой и содержат много митохондрий; быстросокращающиеся волокна типа II быстро "устают", зато длительно способны работать в анаэробных условиях, получая энергию за счет распада гликогена. В любой мышце есть волокна обоих типов, однако в мышцах туловища, выполняющих в основном статические нагрузки, больше волокон типа I, в мышцах конечностей — типа II, приспособленных к динамическим нагрузкам. Склонность к ожирению и сахарному диабету II типа связана с уменьшением в мышцах именно волокон типа I, и ученые из двух калифорнийских и одного сеульского университетов под руководством Р. Эванса в поисках способа борьбы с ожирением создали "мышь-марафонца".
Биохимические механизмы превращения мышечных волокон из одного типа в другой под влиянием тренировочных занятий открыты совсем недавно. В частности, большую роль в таком превращении играет сигнальный белок PGC-1-α, один из кофакторов транскрипции коактиватора бета-рецептора (или, как его чаще называют, γ-рецептора), который активирует пролиферацию пероксисом (transcriptional cofactor Peroxisome proliferator-activated receptor-gamma coactivator) — PGC. PGC участвует в процессе пролиферации (роста и деления) митохондрий, активизируя белок PPARδ — рецептор активатора пролиферации пероксисом. Вариант δ выбрали потому, что другие изоформы того же белка в процессе превращения мышечных волокон намного менее эффективны: α — в 10, a γ — в 50 раз. Чтобы проверить, как PPAR-δ повлияет на обмен веществ, ученые ввели в мышиные эмбрионы его модифицированный ген, соединенный с промотором (участком гена, дающим команду к его считыванию) человеческого актина — белка, который вместе с миозином обеспечивает сокращение мышц. Без этого ген мог бы заработать не в мышечной, а в любой другой ткани. Синтезированный в мышцах белок, с кровотоком попавший в жировую ткань, эффективно препятствовал ее росту и ускорял сжигание жира: через три месяца пребывания на "диете по Аткинсу" (35 % жира против обычных 4 %), трансгенные мыши растолстели втрое меньше, чем обычные. При этом структура мышечной ткани у них настолько изменились, что при биопсии это было видно невооруженным глазом. Из-за увеличения концентрации миоглобина трансгенные мышцы были заметно краснее, чем такие же мышцы обычных мышей. Число волокон типа I в них было намного больше обычного (например, в такой типично смешанной по составу волокон мышце, как икроножная, — в 2 раза). Концентрация ферментов, необходимых для окисления глюкозы и синтеза АТФ, тоже существенно возросла.
В заключение А. Чубенко отмечает, что на одной генетике, без тренировки, стройные и мускулистые трансгенные мыши при занятии на тредмиле могли бежать на 2/3 (на 1 ч) дольше и почти в 2 раза (на 1 км) дальше, чем обычные. И это результат работы всего одного из сотен генов, которые изучают в надежде разработать методы лечения наследственных заболеваний и которые можно использовать для создания генетически модифицированных спортсменов. О "мышах-марафонцах" писали много, тем более что в электронной версии журнала "PLOS Biology" статья о них появилась во время Игр XXVIII Олимпиады. Но в популярных изданиях от широкой спортивной общественности скрыли самое главное, а именно, что такое же снижение массы тела наблюдалось у обычных мышей, когда им через желудочный зонд вводили вещество под кодовым названием GW501516. О его составе в статье группы Р. Эванса не сказано — по понятным причинам: обычно такими буквенно-цифровыми индексами обозначают потенциальные лекарственные препараты, пока они не получат одобрения медицинских властей и торгового названия. Известно было только, что это агонист (позитивный модулятор) PPARδ. С момента появления в Интернет-изданиях этих статей интерес спортивных функционеров к использованию GW 1516 и AICAR многократно возрос.
Все известные до того момента виды генного допинга, начиная с использования рекомбинантного гена эритропоэтина, ускоряющего синтез эритроцитов и гемоглобина, и заканчивая модификацией ростового фактора эндотелия сосудов (VEGF) для ускорения роста новых капилляров и артерий и, соответственно, скорости кровотока, влияли на спортивный результат опосредованно. Новые разработки ученых привели к появлению средств, непосредственно влияющих на ключевые звенья успеха в спорте— механизмы энергообеспечения и качество и длительность эффективного мышечного сокращения. Не случайно вскоре после появления упомянутых статей (в российском Интернет-журнале "Коммерческая биотехнология" и в "PLOS Biology") тогдашний директор WAD А Ричард Паунд в интервью газете "Тайме" в феврале 2004 г. заявил: "Не думаю, что мы столкнемся с генным допингом в Афинах, и очень сомневаюсь насчет Олимпиады в Пекине в 2008 г. Но в 2012 это будет вполне возможно". Он несколько ошибся в прогнозе — это произошло гораздо раньше.
Оба упомянутых выше средства (никак нельзя назвать их препаратами, поскольку они еще не имеют торгового зарегистрированного названия), последствия действия которых были описаны в онлайн-режиме в научном журнале "Cell" 31 июля 2008 г., по состоянию на 1 января 2009 г. уже были внесены в пункт М 3 "Генный допинг" Списка запрещенных веществ и методов. И хотя ранее подразумевалось, что при использовании генного допинга используются инъекционные формы, два выше названных вещества могут употребляться в виде таблеток. Что представляют собою GW 1516 и A1CAR?
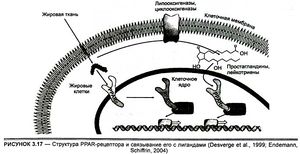
Анализ научных публикаций относительно упомянутых выше новых видов генного допинга (а корректнее — химических субстанций) показал, что GW 1516, реже называемый GW-501516, или GSK-516 (в русскоязычной литературе иногда ГСК 1516), является агонистом активатора пролиферирующего пероксисомного δ-рецептора (Peroxisome proliferator-activated receptor-δ). Пероксисомы — клеточные органеллы, с помощью которых организм избавляется от токсических веществ. Пероксисом-пролифератор-активирующие рецепторы — это семейство (PPARs) компактных белковых молекул, имеющих в своем составе около 500 аминокислотных остатков и расположенных вблизи ДНК внутри ядер клеток (Desvergne et al., 1999; Endemann, Schiffrin, 2004). Пролифераторы, т. е. активаторы пероксисом, действуют именно через PPAR. Известно, что в молекулярной биологии семейство этих рецепторов, включающее α-, β- (в США последние называют δ) и γ-формы PPAR, представляют собой группу ядерных рецепторов белков, которые функционируют как транскрипционные факторы, регулирующие экспрессию генов (многоступенчатый процесс преобразования генетической информации в функциональный продукт, обычно белок), в ответ на связывание соответствующими активаторами - лигандами (рис. 3.17).
PPARs активируются, связываясь с лигандами, и затем присоединяются к специфическим участкам ДНК. При связывании со специфическим лигандом PPAR изменяет свою конформацию (структуру), что позволяет включать один или несколько белков-активаторов. Каждый из PPARs управляет активностью определенного ансамбля генов, контролирующих многие процессы внутриклеточного обмена, рост и апоптоз (запрограммированная клеточная смерть) некоторых клеток, и ряд патологических процессов, в частности, воспаления и канцерогенеза. PPARs имеют важное значение в регуляции дифференцировки клеток, транкрипции (считывании информации, заложенной в генах), метаболизме углеводов, липидов, белков у высших организмов. Все PPARs в молекулярном плане тесно связаны с определенными ДНК-сгруктурами (нуклеотидными последовательностями) различных генов, что и дает возможность PPARs влиять на их транскрипцию и экспрессию (Feige et al., 2006). Функции PPARs могут варьировать в зависимости от способа прикрепления их лиганда к промоторной части гена, а также от количества коактиваторов и корепрессоров (веществ, способствующих угнетению функции) белков, наличие которых может стимулировать активность или препятствовать функционированию перокисомного рецептора (Yu, Reddy, 2007).
Когда оказалось, что PPARs играют гораздо более многогранную роль в жизнедеятельности высших организмов, агенты, активирующие PPAR, были названы лигандами. PPARα преимущественно содержится в печени, почках, миокарде и скелетных мышцах, жировых тканях, а γ- и δ-формы PPAR преобладают в жировой ткани и коже, а также в эндотелии сосудов. Поскольку γ-рецепторы имеют три подвида (γl, γ2 и γЗ), экспрессирующиеся в различных тканях, то следует уточнить, что γ, присутствует практически везде, но особенно заметно его действие в сердце, мышечной ткани, тонкой кишке, почках, поджелудочной железе и селезенке. PPAR-γ2 максимально экспрессируется преимущественно в бурой жировой ткани, а γЗ — в макрофагах, толстом кишечнике, белой жировой ткани (Berger, Moller, 2002). Эти агонисты (PPARα и -γ) были обнаружены в начале 80-х годов XX в. в ткани печени лягушек и грызунов во время поиска молекулярной мишени для группы агентов, называемых "пероксисомы", для увеличения чувствительности тканей к инсулину (Dreyer et al., 1992). В 1992 г. в организме человека были найдены PPARδ (Schmidt et al., 1992), которые находятся в равной мере во всех тканях организма. Их функция также связана с регуляцией жирового обмена (Collins et al., 2001).
PPARα и PPARγ являются молекулярной мишенью многих разрешенных препаратов, в частности, как указывалось, на основе фибратов и тиазолидиндионов. Для PPARα такими агентами являются, во первых, фибраты (гемфиброзил, уфибрат, безофибрат и т. д.), широко распространенные в лечении сердечно-сосудистых заболеваний, сахарного диабета II типа, ожирения, а, во-вторых, нестероидные противоспалительные средства (НПВП), особенно часто используемые для снятия болевого синдрома, связанного с повреждением мышечных и костно-суставных структур. Для PPARγ, повышающих чувствительность к инсулину, синтетическими активаторами также являются прежде всего тиазолидиндионы, в меньшей степени — фибраты (Buzzetti et al., 2004; Meirhaeghe et al., 2004).
В организме одними из важнейших лигандов для PPARs являются свободные ненасыщенные жирные кислоты с длинной цепью: линолевая, линоленовая и арахидоновая (в основном для с-формы) и эйкозаноиды (предшественники и метаболиты простагландинов и других сходных по структуре биологически активных веществ). Например, PPARγ активируется простагландином PGJ2, a PPARα — медиатором воспаления лейкотриеном В4 (Haraguchi et al., 2003).
PPARs играют важную роль в метаболизме свободных жирных кислот, триацилглицеролов и холестерола в организме. Активация α-формы PPAR, посредством изменения активности транскрипции генов, участвующих в метаболизме липопротеидов, способствует снижению содержания атерогенных ЛПНП в сыворотке крови, повышает активность транспорта холестерола из периферических тканей в печень. В эксперименте показано, что при дефиците PPARα в условиях голодания концентрация глюкозы в крови через 24 ч снижается на 50 %, что свидетельствует о важной роли PPARα в гомеостазе глюкозы. PPARα обладают также противовоспалительными эффектами. Эти свойства были документально подтверждены главным образом в экспериментах in vitro, а также в опытах на животных.
Что касается действия веществ, усиливающих действие PPARs, то недавно было продемонстрировано, что у пациентов с сахарным диабетом II типа агонисты PPARα фибратной структуры уменьшают риск возникновения инфаркта миокарда и снижают частоту необходимости проведения коронарной реваскуляризации, что свидетельствует о благоприятных эффектах этих препаратов у данной категории пациентов. В модельных исследованиях с изолированными человеческими клетками на фоне стимуляции избыточной экспрессии PPARα до настоящего времени не выяснено, приводит ли активация PPARα к нежелательным эффектам со стороны сердца у людей, как это отмечалось в эксперименте на животных. Отсутствуют также какие-либо убедительные научные свидетельства о том, что терапия агонистами PPARα способна увеличить риск развития хронической сердечной недостаточности у человека (Kim et al., 2006).
Известно, что генный допинг на основе тиазолидиндионов, а именно пиоглитазон и троглитазон (последнее поколение — розиглитазон, торговое название Авандия), являются одними из самых современных для лечения сахарного диабета II типа. Они повышают чувствительность тканей к инсулину, позволяя контролировать уровень глюкозы. Активация PPARγ с помощью этих препаратов регулирует транскрипцию инсулин-чувствительных генов, участвующих в контроле синтеза, транспорта и утилизации глюкозы. Кроме этого, лиганды PPARγ на основе тиазолидиндионов влияют также на регуляцию обмена жирных кислот. Однако препараты этого класса имеют некоторые побочные эффекты, например, гепатотоксичность, особенно при превышении терапевтической дозы.
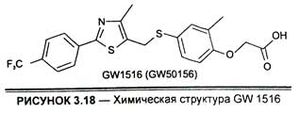
GW 1516, вокруг которого за столь короткий период сломано столько копий, по структуре представляет собой 2-[2-метил1-4-([4-метил-2-(4-(трифлуорометил)фенил)-1,3-тиазол-5-ил] метилсульфанил-феноксиацетат с молекулярной массой 453,498 г моль"1 (рис. 3.18).
На сегодняшний день метаболизм, биодоступность, период полужизни, пути экскреции, тератогенные эффекты и терапевтические дозировки GW 1516 не описаны. Разработана эта субстанция совместно сотрудниками институтов Хьюга и Солка в Сан-Диего по заказу фармацевтической корпорации "GlaxoSmith Kline" под руководством Р. Эванса. Уже одно упоминание о фармацевтической компании, занимающей одно из лидирующих мест в мире по производству многих жизненно необходимых препаратов, указывает, что никто специально не занимался разработкой допинговых субстанций, и задачи исследования были чисто терапевтическими. Первые сообщения именно об этом веществе появились в биохимической научной литературе в 2003 г. (Sznaidman et al., 2003). Оно, как свидетельствуют результаты исследований, опубликованные только в феврале 2008 г., продемонстрировало у страдающих ожирением мужчин с предиабетом возможность обратной трансформации возникших метаболических аномалий путем, вероятнее всего, стимулирования окисления свободных жирных кислот (Risurus et al., 2008). GW 1516 активирует аденозинмонофосфат-активированную протеинкиназу (фермент, участвующий в процессах энергообеспечения) и таким образом стимулирует поглощение глюкозы тканями скелетных мышц, а также утилизацию свободных жирных кислот (Kremer et al., 2007). В настоящее время проводится II фаза клинических испытаний относительно возможности использования GW 1516 в качестве средства для профилактики атеросклероза и лечения дислипидемий.
Когда в 2008 г. результаты экспериментов показали возможность повышения работоспособности на 68 % путем использовании GW 1516 при беге мышей на тредмиле, то еще до Игр XXIX Олимпиады были высказаны опасения относительно использования данного вещества в качестве допинга (Narkar et al., 2008). Тогда же Р. Эванс, руководивший экспериментальными исследованиями по изучению влияния GW 1516 на различные физиологические процессы в организме, в том числе, и на работоспособность, разработал тесты для обнаружения этой субстанции в моче и предоставил соответствующую информацию в распоряжение МОК и WADA medical-weight-loss-guide.com/AICAR.html..
Другим, запрещенным в 2009 г., видом генного допинга, является AICA ribonucleotide или AICAR (aminoimidazole carboxamide ribonucleotide) — интермедиат (промежуточный продукт) генерирования инозинмонофосфата, выступающего в качестве агониста АМР-активированной протеинкиназы (АМРК) (Corton al., 1995). Субстанция AICAR стимулирует поглощение в скелетных мышцах глюкозы и увеличивает экспрессию р38-митоген-активированной протеинкиназы типов а и β (Lemieux et al., 2003), а также предотвращает процесс апоптоза путем торможения образования свободных радикалов, прежде всего химически активного атомарного кислорода, внутри клетки (Kim et al., 2008). Следует отметить, что достаточно давно биохимиками-теоретиками на молекулярном уровне установлена связь между действием АМРК и функционированием Na+-K+-АТФ-азы (натрий-калиевый насос), гидролизующей с образованием энергии 25 % всех запасов АТФ в клетке. Потому активность АМРК является сверхчувствительным сенсором энергозависимых процессов и отображает процессы выработки энергии и, в частности, нижней границы образования АТФ, инактивируется увеличением нижней границы соотношения АМФ/АТФ (Lingrel, Kuntzweiler, 1994).
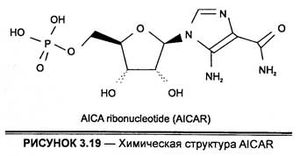
По химической структуре AICAR является комплексом соединения на основе имидазольного кольца с рибонуклеотидом, а именно 5-амино-имидазол-4-карбоксиамид-1 -β-D-рибофуранозидом (рис. 3.19).
В 2008 г. исследователи Института Солка под руководством Дж. Кима обнаружили что AICAR, в зависимости от интенсивности нагрузки, при использовании его в течение четырех недель у экспериментальных мышей значительно повышает их работоспособность на тредмиле в упражнениях на выносливость путем, по-видимому, преобразования быстросокращающихся мышечных волокон в более энергоэффективные, липидогенерирующие, медленносокращающиеся мышечные волокна. Было показано, что этот процесс опосредован торможением пальмитат-индуцированной клеточной смерти (апоптоза) эндотелиальных клеток путем угнетения процессов перекисного окисления липидов в них (Kim et al., 2008).
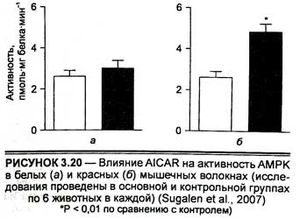
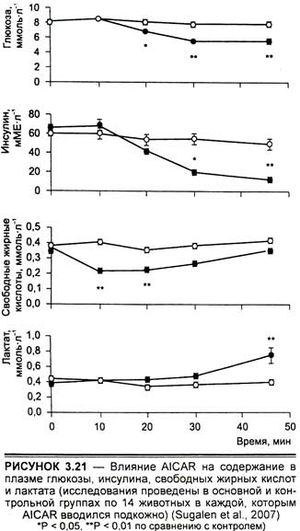
В эксперименте на крысиных и человеческих клетках установлено, что АМРК регулирует стимулированную при гиперкапнии накоплением С02 альвеолярную эпителиальную дисфункцию и соответственно улучшает легочную вентиляцию (Vadusz et al., 2008). Как показывают недавние исследования, в частности, проведенные на изолированных клетках миокарда и мышечных клетках, АМРК также стимулирует поглощение глюкозы этими структурами (Sugalen et al., 2007). Отсюда следует, что эффективные агонисты АМР-активированной протеинкиназы могут быть точкой приложения для стимуляции механизмов энергообеспечения. Как активатор АМР-активированной протеинкиназы, AICAR в эксперименте на животных увеличивает содержание свободных жирных кислот в обоих (быстрых и медленных) типах мышечных волокон через изменение уровней адипонектина и лептина (белков, участвующих в липидном обмене) и повышение содержания глюкозы в белых мышечных волокнах (рис. 3.20).
Кроме того, AICAR способствует увеличению содержания глюкозы, инсулина, свободных жирных кислот, а также снижению лактата в плазме крови экспериментальных животных (рис. 3.21). Последний факт может оказаться очень важным для понимания тонких механизмов энергообеспечения физической нагрузки и механизмов восстановительных процессов.
Следует отметить, что такие исследования велись одновременно в нескольких научных центрах. Так, еще в 2005 г. было показано, что 5-амино-имидазол-4-карбоксиамид-1 -β- D-рибо-фуранозид и фенформин активируют АМР-активированную протеинкиназу путем угнетения транспорта натрия в клетках легких, что является одним из путей поддержания баланса жидкости в тканях (Woollhead et al., 2005). AICAR способен также стимулировать фосфорилирование АМРК и активировать гликолиз путем увеличения поглощения глюкозы в клетках. В условиях низкого содержания глюкозы увеличение соотношения АМФ/АТФ стимулирует оба процесса в астроцитарных клетках мозга. Активация (через сложный биохимический механизм синтеза модулятора TSC2 и mTOR) этих сигнальных путей помогает сэкономить количество энергии, необходимой для синтеза белка и гликолиза, и, тем самым, предотвратить апоптоз нервных клеток (Mukheijee, 2008). Приведенные данные убедительно доказывают, что активация АМРК с помощью агонистов сопровождается выраженными многочисленными эффектами со стороны различных органов и систем, что и может объяснять многостороннее влияние модуляторов активности этого фермента на функциональное состояние организма.
Практически одновременно с исследованиями физиологической и биохимической активности AICAR, под руководством В. Наркара и Р. Эванса, были проведены эксперименты, показавшие, что у нетренированных мышей AICAR, особенно в сочетании с GW 1516, активирует около 40 % генов, которые включаются при реальных интенсивных физических нагрузках. Исследователи сделали вывод, что при совместном применении двух агонистов, возможно, удастся достичь эффекта тренировки без фактических физических нагрузок (Narkar et al., 2008). Результаты этих исследований были опубликованы как раз накануне Игр XXIX Олимпиады и косвенно указывали на возможность использования данных веществ в качестве допинга для стимуляции работоспособности и выносливости спортсменов. В связи с этим руководители исследования срочно разработали и передали в распоряжение МОК и WADA тесты для обнаружения AICAR в моче спортсменов. Такие действия исследователей никак не могут быть объяснены только желанием создать запрещенную в спорте субстанцию; скорее было обнаружено побочное действие веществ, тестируемых для создания новых терапевтических препаратов, которое выразилось в триггерных изменениях в организме, свойственных физической нагрузке, и улучшающих процессы энергообеспечения, особенно за счет липидов, а также повышения чувствительности к инсулину (Iglesias et al., 2004). В настоящее время совместно с Медицинской комиссией МОК и WAD А Р. Эванс и его сотрудники разрабатывают систему сертификации тестов, способных уловить присутствие метаболитов новых генных допингов — AICAR и GW 1516 — и ретроспективно тестировать спортсменов, участвовавших в Олимпийских играх в 2008 г., поскольку на момент проведения Игр методы допинг-контроля на присутствие обоих субстанций еще не были сертифицированы.
Когда в 2004 г. Р. Эванс и его коллеги провели генетическое модифицирование молодых мышей с изменением состава и структуры их мышц, то получили животных, практически вдвое более устойчивых к нагрузкам, чем обычные мыши. Эти "мыши-марафонцы" не набирали избыточную массу тела и не увеличивали объем мышц, имели низкий уровень сахара и высокий — свободных жирных кислот в крови, что сделало их, по выражению исследователя, "замечательными бегунами". Исследователи доказали, что можно перепрограммировать работу мышц, используя методы генетической инженерии у молодых животных. В интервью "Нью-Йорк Таймс" Р. Эванс подчеркнул, что неизвестно, можно ли делать с помощью лекарств такое генетическое перепрограммирование у взрослых особей, когда весь мышечный аппарат уже сформирован, и за короткое время необходимо изменить свойства большой массы скелетных мышц.
Исследователи считают, что преимущества, полученные при использовании AICAR и GW 1516, обусловлены взаимодействием между клеточными АМРК и PPAR-δ сигнальными путями. Данные генетического анализа подтверждают эту гипотезу относительно того, что AICAR и GW 1516 по отдельности активируют только незначительную подгруппу генов, экспрессируемых при физической нагрузке. При этом по отдельности агонисты и АМР-активированной протеинкиназы (AICAR), и пролиферирующего пероксисомного дельта-, а по некоторым данным, и бета-рецептора PPAR (GW 1516), могут имитировать некоторые показательные эффекты, присущие физической нагрузке. В то же время активация обоих путей (комбинация AICAR и GW 1516 с физической нагрузкой) приводит к экспрессии значительно большего числа генов, ремоделирующих большое количество метаболических путей в организме, в том числе, и метаболизм мышечной ткани (Lemieux et al., 2003).
В фундаментальной статье, написанной группой известных специалистов (Knopp et al., 1997), авторы обсуждали дискуссионные вопросы, связанные с неоднозначностью трактовки МОК и спортивными врачами понятия "генный допинг", а также пытались сформулировать, где же проходит граница между формальными и истинными границами разумности и обоснованности применения тех эргогеных средств, которые приводятся в постоянно расширяющемся Списке запрещенных веществ и методов. Поэтому история с появлением новых видов допинга, в настоящее время уже генного, далеко не нова.
Однако пока в клинических испытаниях не получено убедительных доказательств, к каким негативным эффектам может приводить использование AICAR и GW 1516, каковы могут быть разумные дозы и побочные эффекты препаратов на основе этих субстанций, а также могут ли полученные генетические модификации закрепляться и воспроизводиться, нельзя, вероятно, однозначно отвергать возможность использования препаратов на основе AICAR и GW 1516 в спорте, особенно высших достижений. Напротив, в книге "Генная и клеточная терапия" (Templeton, 2003) убедительно доказывается важнейшая роль генетических модификаций и использования субстанций, модифицирующих собственный ответ организма, при лечении многих тяжелых заболеваний, в частности, сахарного диабета типа II, атеросклероза, гемофилии, болезнях Альцгеймера и Паркинсона. В последних научных работах на эту тему приводятся данные, которые пока не доказывают присутствие негативных эффектов влияния AICAR и GW 1516 на сердечно-сосудистую и другие системы организма; напротив, авторы полагают, что препараты на этой основе могут стать "золотым стандартом" лечения заболеваний сердца и сосудов (Warden et al., 2008). Возможно, применение стимуляторов генетической активности открывает новую эру в развитии физических возможностей спортсменов и повышении зрелищности спортивных состязаний, особенно с учетом того, что предел собственных возможностей организма человека практически достигнут.
С постоянным ужесточением требований WADA можно дойти до полного абсурда, поскольку в состав очень широко распространенного препарата нафтизин для местного лечения насморка тоже входит... запрещенная субстанция! Стратегия WADA, по нашему мнению, в случае появления новых средств, влияющих на работоспособность, должна выражаться не в немедленном запрещении любых инноваций, способствующих повышению порога возможностей человека, а в разработке и повсеместном внедрении современного, адекватного, в том числе, и на генетическом уровне, алгоритма обследования всех спортсменов, рационально организованной фармакологической поддержке и медицинской помощи во время тренировочного и соревновательного процессов.