Жировая ткань
Содержание
Жировая ткань
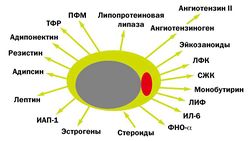
В конце 80-х годов было обнаружено, что жировая ткань является местом интенсивного метаболизма половых стероидов. А выделение затем ряда активных молекул, секретируемых адипоцитами, и особенно открытие в 1994 году лептина убедили нас в том, что жировая ткань является сложным гормонально активным органом, играющим жнейшую роль в регуляции энергетического баланса и гомеостаза всего организма в целом (рис.1).
Было обнаружено, что секретируемые жировой тканью вещества — адипокины — обладают разнообразными метаболическими эффектами. Оказывая воздействие ауто/паракринным способом, они регулируют рост, развитие и метаболизм адипоцитов. Поступая в общую циркуляцию, адипокины действуют как эндокринные сигналы, оказывая влияние на функцию различных органов и систем организма: мозг, печень, мышцы, почки, эндотелий, иммунную систему и др. Было также показано, что адипоциты секретируют важные регуляторы липопротеинового метаболизма, такие как липопротеиновая липаза, аполипопротеин Е, переносящий эфиры холестерина протеин.
К тому же было обнаружено, что жировая ткань экспрессирует ряд рецепторов, позволяющих ей реагировать на афферентные сигналы из эндокринных органов и центральной нервной системы.
Содержащиеся в жировой ткани нервные, стромальные и иммунные клетки также обладают определенной секреторной активностью. Многие гормоны — катехоламины, инсулин, кортикостероиды, андрогены и др. в свою очередь оказывают влияние как на функцию адипоцитов, так и на эффекты адипокинов.
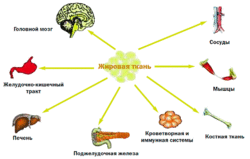
Таким образом, помимо депонирования энергии, жировая ткань через адипокины обладает способностью взаимодействовать с различными органами и системами, включая и ЦНС, и тем самым участвовать в регуляции разнообразных функций организма (рис. 2), а через взаимодействие с нейроэндокринной системой в адаптации организма к различным внешним воздействиям, таким как голод, стресс, переедание.
Неблагоприятные метаболические последствия, развивающиеся как при избытке, так и при недостатке жировой ткани, подтверждают важность ее секреторной активности для нормального функционирования организма. К настоящему времени накоплена обширная информация о каузальной связи между ожирением и такими заболеваниями как сахарный диабет, сердечнососудистые, онкологические и др. Избыточное развитие жировой ткани, особенно в висцеральной области, прямо коррелирует с инсули-норезистентностью, гипергликемией, дислипидеми-ей, артериальной гипертензией, протромботическим и провоспалительным состояниями. Распространенность ожирения и связанных с ним метаболических нарушений и заболеваний в последние годы достигли эпидемических размеров. По сведениям ВОЗ, около 1,7 млрд человек на планете имеют избыточную массу тела. Распространенность ожирения колеблется от 7,65% в Китае и Японии до 25% в странах Западной Европы и 30% в США. В России, по данным выборочных исследований, ожирение предположительно имеют 25% трудоспособного населения.
Ожирение — самый важный модифицируемый фактор риска развития сахарного диабета 2 типа (СД-2), около 90% больных СД-2 имеют избыточную массу тела или ожирение. Ожирение сопровождается развитием таких тяжелых заболеваний как артериальная гипертензия (АГ), дислипидемия, ишемическая болезнь сердца (ИБС), онкологические заболевания, синдром обструктивных апноэ во сне, заболевания желудочнокишечного тракта, опорно-двигательного аппарата.
Ожирение является независимым фактором риска сердечно-сосудистых осложнений: сочетание ожирения с АГ увеличивает риск ишемической болезни сердца в 2—3 раза, мозговых инсультов — в 7 раз. Женщины с ожирением имеют высокую частоту ановуляций, нарушений менструального цикла, бесплодия; мужчины — эректильной дисфункции, вторичного гипогонадизма.
Адипокины, секретируемые жировой тканью, и их эффекты:
Строение жировой ткани
Это скопление жировых клеток. В соответствии наличию 2 типов жировых клеток различают 2 разновидности жировой ткани:
- Белый жир (скопление белых жировых клеток) - имеется в подкожной жировой клетчатке, в сальниках, вокруг паренхиматозных и полых органов;
Функции белого жира: запас энергетического материала и воды;
механическая защита; участие в терморегуляции (теплоизоляция).
- Бурый жир (скопление бурых жировых клеток) - имеется у человека только в период новорожденности и в раннем детском возрасте.
Функции бурого жира: участие в терморегуляции - жир сгорает в митохондриях липоцитов, тепло выделяющееся при этом согревает кровь в проходящих рядом капиллярах
Ферменты, участвующие в метаболизме стероидных гормонов
Наряду с секрецией адипокинов, жировая ткань содержит целый арсенал ферментов, способных активировать, взаимопревращать и инактивировать половые стероиды — цитохром Р450 зависимая ароматаза, 3β-гидроксистероидная дегидрогеназа (ГСД), 3αГСД, 11βГСД1, 17βГСД, 7α-гидроксилаза, 5α-редуктаза и др. Учитывая массу жировой ткани, относительный вклад ее в пул половых гормонов в организме вполне значимый. Так, у женщин в постменопаузе жировая ткань является источником практически всех циркулирующих эстрогенов, у женщин в пременопаузе — 50% тестостерона.
Различия в топографии жировой ткани у мужчин и женщин свидетельствуют о вовлечении половых стероидов в регуляцию специфики распределения жира в организме. Причем имеет значение не только уровень циркулирующих половых гормонов и различия в экспрессии их рецепторов, но и особенности их метаболизма в различных депо жировой ткани. Так в подкожной жировой ткани экспрессия 17βГСД относительно ниже, чем ароматазы, а в висцеральной — наоборот. Известно, что ароматаза осуществляет превращение слабых андрогенов и эстрогенов в более активные: андростендиона в эстрон и тестостерона в эстрадиол. 17βГСД способствует превращению андростендиона в тестостерон и эстрона в эстрадиол. Соотношение 17βГСД и ароматазы положительно коррелирует с центральным ожирением и свидетельствует о локальном увеличении продукции андрогенов в висцеральных жировых депо.
В последние годы все большее внимание уделяется изучению метаболизма глюкокортикоидов в жировой ткани. Преимущественно в висцеральной жировой ткани содержится фермент 11β-гидрокси-стероидная дегидрогеназа-1, катализирующий превращение неактивного 11β-кетоглюкокортикоида — кортизона в активный 11β-гидроксистероид — кортизол. Показано, что 11βГСД-1 определяет в основном локальную концентрацию глюкокортикоидов в жировой ткани и существенно не влияет на их концентрацию в системной циркуляции. Тем не менее значимость метаболизма глюкокортикоидов под влиянием 11βГСД 1 подтверждена в эксперименте: повышение экспрессии 11βГСД1 в адипоцитах приводит к развитию у животных висцерального ожирения и проявлений метаболического синдрома: инсулинорезистентности, дислипидемии, гипертензии и стеатоза печени. Фармакологическая инактивация 11βГСД1 сопровождается улучшением чувствительности к инсулину и уменьшением вышеназванных нарушений.
Ожирение и эндокринная функция жировой ткани
Жировая ткань, секретируя молекулы, обладающие аутокринными, паракринными и эндокринными свойствами, является органом, влияющим на многие аспекты энергетического обмена, регулирующим адекватность и специфику отложения жира в организме, различные метаболические процессы в нем.
Ожирение характеризуется увеличением размеров (гипертрофия) и числа (гиперплазия) адипоцитов, приводящим к количественным, а, возможно, и качественным изменениям продукции цитокинов, способствующим развитию инсулинорезистентности и изменений системного метаболизма. Как инсулинорезистентность, так и происходящие при этом изменения липолиза и липогенеза, функциональной активности нейроэндокринной системы, например, активация гипоталамо-гипофизарно-надпочечниковой оси, в начальных стадиях развития ожирения носят адаптационный характер, в процессе же постоянного нарастания веса они становятся дезадаптивными, патологическими и приводят к развитию осложнений, наблюдаемых у лиц с избыточным весом или ожирением.
Практически все цитокины, секретируемые адипоцитами, оказывают прямое или косвенное влияние на реализацию эффектов инсулина в периферических тканях. Можно сказать, что цитокины образуют «систему», регулирующую действие инсулина в организме. Развивающееся при ожирении снижение чувствительности тканей к инсулину (инсулинорезистентность) имеет исключительное значение в механизмах развития сахарного диабета и сердечно-сосудистых заболеваний, являющихся спутниками избыточного отложения жира в организме.
Так, имеющиеся при ожирении гиперлептинемия и лептинорезистентность могут быть одним из ведущих факторов в развитии инсулинорезистентности, а также нарушении функции р-клеток и ускорении процессов атерогенеза. Сочетание периферической леп-тинорезистентности, повышенной концентрации в плазме свободных жирных кислот, триглицеридов, липопротеинов низкой плотности и хиломикронов, развивающееся на фоне гиперкортизолемии, приводят при ожирении к развитию липотоксических нарушений, конечным результатом которых являются проявления метаболического синдрома: инсулинорезистентность, гиперлипидемия, гипергликемия, повышение АД, кардиомиопатия.
В условиях лептинорезистентности усиливается также влияние лептина на кальцификацию сосудов, аккумуляцию холестерина макрофагами, инициацию оксидативного стресса, повышение тонуса симпатической нервной системы, повышение АД. Все эти процессы в совокупности способствуют ускоренному развитию атеросклеротических изменений сосудов при ожирении.
Нарастание жировой массы в организме сопровождается повышением секреции ФНО-α, ИАП-1, ИЛ-6, способствующих, в свою очередь, также развитию инсулинорезистентности, активации клеточного транскрипционного фактора каппа В (ЯТФ-КВ), воспалительных реакции в сосудистой стенке, внутриклеточной адгезии моноцитов и всего каскада оксидативного стресса. Протективные механизмы адипонектина в отношении развития атеросклероза вследствие снижения его секреции также утрачиваются при ожирении, особенно при его висцеральной форме. Увеличение секреции ангиотензина II, являющегося проатерогенным белком, стимулирующим внутриклеточную адгезию молекул в сосудистую стенку, образование свободных радикалов, нарушение целостности сосудистой стенки, также провоцирует развитие эндотелиальной дисфунции.
Наблюдаемая при ожирении повышенная секреция ИЛ-6, хотя и способствует снижению активности ЛПЛ и тем самым некоторому ограничению нарастания веса, в то же время через воздействие на печень содействует развитию дислипидемии и нарушениям свертывающей системы крови.
Жировая ткань различной локализации отличается по уровню экспрессии и секреции как адипокинов, так и специфических рецепторов. Например, экспрессия и секреция ИЛ-6, ИАП-1 и адипонектина, экспрессия ангиотензиновых рецепторов 1 типа, βЗ-адренергических, глюкокортикоидных и андрогенных рецепторов, а также 11βГДГ относительно выше в висцеральной жировой ткани, лептина — в подкожной. Более того, адипокины, секретируемые висцеральной жировой тканью, вследствие ее топографических особенностей поступают преимущественно в портальную систему и печень, тогда как из подкожных депо в системный кровоток. В связи с этим, висцеральная жировая ткань оказывает, главным образом, влияние на метаболические процессы, происходящие в печени. Увеличенное поступление свободных жирных кислот в печень приводит к снижению связывания инсулина гепатоцитами, обуславливая развитие инсулинорезистентности на уровне печени, снижение экстракции инсулина печенью и развитие системной гиперинсулинемии. Свободные жирные кислоты также подавляют тормозящее действие инсулина на глюконеогенез, способствуя увеличению продукции глюкозы печенью; обуславливают увеличение синтеза триглицеридов липопротеинов очень низкой плотности и нарушения метаболизма липидов.
Топографические и функциональные особенности различных компартментов жировой ткани лежат в основе известных метаболических различий между висцеральным и глютеофеморальным типами ожирения. Однако важно учитывать, что размеры различных депо жировой ткани могут определять их относительный вклад в развитие нарушений метаболизма при ожирении и даже нивелировать метаболические различия между основными типами ожирения
Висцеральная жировая ткань менее эффективна, чем подкожная в регуляции энергетического баланса, осуществляемой через продукцию лептина.
Имеющаяся функциональная гетерогенность различных депо жировой ткани позволяет высказать предположение, что жировая ткань может быть не единым, а, возможно, группой схожих, но единственных в своем роде эндокринных органов.
Развивающиеся эндокринные и метаболические изменения по мере развития ожирения нарушают энергетический гомеостаз. Причем при ожирении увеличивается не только продукция адипокинов, но и происходят изменения биоактивности цитокинов через нарушение выделения растворимых рецепторов.
Таким образом, профиль цитокинов и жирных кислот, выделяемых жировой тканью, определяется метаболическими нуждами организма (характером питания, уровнем стресса, физической активностью, репродуктивной активностью), он также формируется и зависит от степени развития и особенностей распределения жировой ткани в организме, качественных и количественных изменений ее функциональной активности.
При постоянном, избыточном поступлении энергии развивается дисфункции жировой ткани, которая и лежит в основе прогрессирования ожирения и развития совокупности метаболических нарушений и заболеваний, сопровождающих избыточное накопление жира в организме.
Источники
- Дедов И. И., Мельниченко Г. А. Жировая ткань как эндокринный орган //Ожирение и метаболизм. – 2006. – №. 1.