Обезболивающие препараты
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
Содержание
Обезболивающие средства
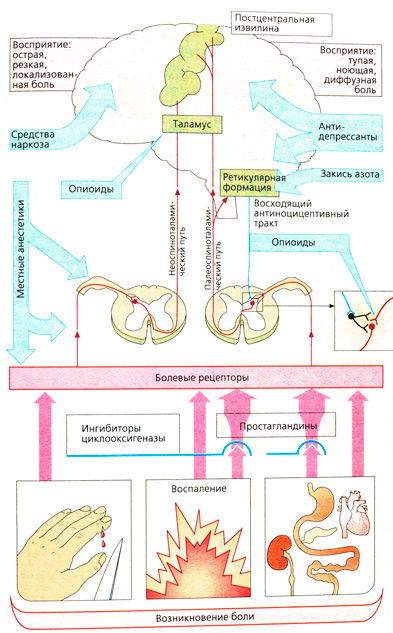
Возникновение и распространение боли
Боль — это ощущение, разное по характеру и степени выраженности, от неприятной до непереносимой. Болевые раздражители воспринимаются различными рецепторами (сенсорами), представляющими собой свободные нервные окончания. Тела биполярных, афферентных первых нейронов находятся в спинальном ганглии. В передаче болевого импульса участвуют немиелинизированные (С-волокна, скорость проведения импульса 0,5-2 м/с) и миелинизированные волокна (Ad-волокна, 5-30 м/с). Свободные нервные окончания Ad-волокон реагируют на давление или повышение температуры, тогда как нервные окончания С-волокон реагируют на химические раздражители (Н+, К+, гистамин, брадикинин и т. д.), которые появляются при повреждении тканей. Вне зависимости от природы раздражителя — химического, механического или теплового — реакция может усиливаться простагландинами.
Химическое раздражение возникает при воспалении или нарушении кровотока (стенокардия, инфаркт миокарда). Сильные боли при перерастяжении или спазме гладких мышц органов брюшной полости обусловлены гипоксией (висцеральные боли).
Ad- и С-волокна входят через задние корешки в спинной мозг, переключаются на последующий нейрон, который переходит на другую сторону и в составе передне-бокового столба спинного мозга достигает головного мозга. Различают две ветви спиноталамического тракта: неоспиноталамический и палеоспиноталамический путь. Ядра таламуса, на которых оканчиваются волокна Т. neospinothalamicus, посылают импульсы в определенные зоны постцентральной извилины. Боль, распространяющаяся по этому пути, имеет резкий характер и точную локализацию. Болевой импульс, проходящий по пути Т. palaeospinothalamicus, проецируется диффузно в постцентральную извилину, и поэтому больной ощущает боли диффузного характера, сверлящие, жгучие, без определенной локализации.
Переключение первого афферентного нейрона неоспиноталамического тракта на второй нейрон на противоположной стороне осуществляется с помощью медиатора — субстанции Р. Эти синапсы не подвержены влиянию антиноцицептивной системы (острая, сильная боль на поверхности тела). Возбуждение первого нейрона палеоспино-таламического тракта переключается на вставочный нейрон, который активируется серотонином (восходящий антиноцицептивный тракт), а при высвобождении энкефалина (эндогенный опиоид) блокирует синапсы с субстанцией Р. Именно здесь находится спинальная точка приложения действия морфина и других опиатов.
На восприятие боли можно воздействовать следующими путями:
- ликвидация причины боли,
- снижение чувствительности болевых рецепторов (антипиретические анальгетики, местные анестетики),
- прерывание проведения боли (местные анестетики),
- препятствие переключению болевого импульса в спинном мозге (опиоиды),
- блокада восприятия боли (опиоиды, наркотики),
- влияние на «перерабатывание» боли (антидепрессанты как коанальгетики).
Местные анестетики
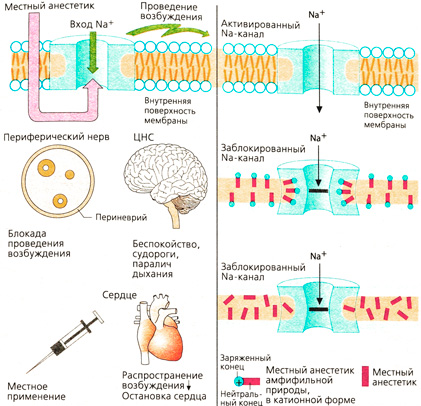
Местные анестетики обратимо блокируют возникновение и проведение электрического возбуждения в нейронах. Такая блокада чувствительных нервных окончаний необходима при выполнении оперативных вмешательств, например хирургических или стоматологических.
Механизм действия. Проведение возбуждения в нейронах осуществляется при возникновении потенциала действия. Деполяризация сопровождается быстрым входом ионов Na+ внутрь аксона через белковый канал в мембране, который в открытом (активированном) состоянии пропускает Na+ по химическому градиенту ([Na+]CHapyXM ~ 150 мМ, [Na+]BHyrpvi ~ 7 мМ). Местные анестетики блокируют быстрый вход Na+: возникновение и проведение возбуждения тоже блокируется.
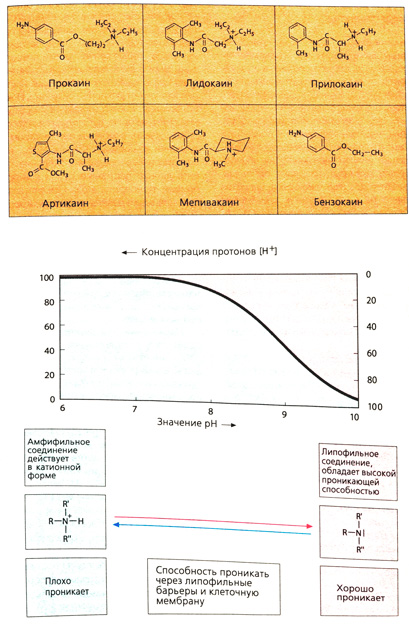
Большинство местных анестетиков являются амфифильными молекулами в катионной форме. Благодаря физико-химическим свойствам местные анестетики включаются в мембрану в пограничной зоне между полярными и неполярными слоями. Такие зоны существуют в фосфолипидных мембранах и в белках ионных каналов. Блокада Na-каналов под воздействием местных анестетиков, по всей вероятности, обусловлена их присоединением к белку Na-канала. Достоверно известно, что вещество оказывает влияние лишь после проникновения через мембрану в цитозоль.
Незаряженные соединения также могут действовать как местные анестетики; вероятно, они присоединяются к неполярной зоне канального белка или окружающей липидной мембране.
Побочные действия местных анестетиков, обусловленные механизмом действия. Вход Na+ блокируется не только в чувствительных нервных окончаниях, но и в других возбудимых тканях, поэтому местные анестетики назначают для местного применения. Нежелательная при местной анестезии блокада прохождения возбуждения в сердце может иметь лечебное значение при сердечной аритмии.
Виды местной анестезии. Местные анестетики вводятся в ткани инфильтрационно (инфильтрационная анестезия) или путем инъекции в область нервного сплетения, из которого отходят нервные окончания к тканям зоны обезболивания (проводниковая анестезия, спинальная анестезия на спинном мозге), а также нанесением вещества на кожу или слизистые (поверхностная анестезия). В любом случае местный анестетик должен проникать из места его введения в нервные окончания.
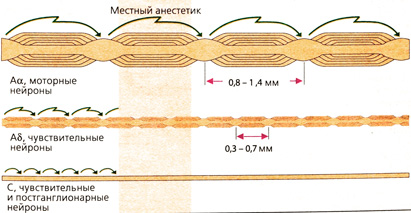
Мотонейроны имеют низкую чувствительность, а чувствительные нервные окончания — высокую. Возбуждение чувствительных нейронов по сравнению с мотонейронами блокируется меньшими дозами местных анестетиков. Такой эффект обусловлен более высокой частотой проведения импульсов и более длительным потенциалом действия чувствительных нервных окончаний. Возможно, играют роль также Толщина нервных окончаний и расстояние между перехватами Ранвье. При скачкообразном проведении импульса деполяризуется только мембрана в области перехватов. Поскольку при блокаде 3-4 перехватов деполяризация все еще может возникать, то для мотонейронов зона блокады должна быть больше и концентрация местных анестетиков должна быть выше.
Отсюда ясно, почему передача возбуждения с чувствительных рецепторов по миелинизированным нервам А5-типа блокируется местными анестетиками позже и хуже, чем возбуждение, передаваемое через С-волокна. Вегетативные постганглионарные волокна, поскольку они не содержат миелина, также блокируются местными анестетиками. Снижение симпатического тонуса приводит к расширению сосудов в зоне анестезии, что нежелательно (см. ниже).
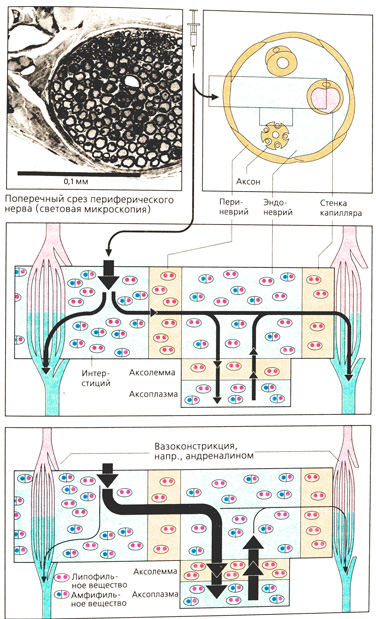
Проникновение и действие. Для диффузии в аксон чувствительного нерва от места инъекции (интерстиция соединительной ткани) местные анестетики должны преодолеть периневрий. Многослойный периневрий образован клетками соединительной ткани, которые соединены друг с другом посредством Zonula occludens и образуют закрытый липофильный барьер.
Местные анестетики представляют собой третичные амины, которые при физиологическом значении pH ведут себя как липофильные основания (изображено в виде частиц с двумя красными точками) либо как положительно заряженные катионные амфифильные молекулы (частицы с синими и красными точками). Незаряженная форма проникает через периневрий, попадает в эндоневрий, где получает частичный заряд в зависимости от значения pH в этой зоне. Такой же путь проходит местный анестетик при проникновении через мембрану аксона (аксолемму) в его цитоплазму (аксоплазму). Оттуда, а также при диффузии из эндоневрия через эндотелий капилляров в кровь он оказывает влияние на Na-каналы.
Концентрация местного анестетика в месте его действия зависит от скорости его проникновения в эндоневрий и в капилляры. Для того чтобы вещество поступало с достаточной скоростью, необходимо создать высокий градиент концентрации между соединительной тканью и эндоневрием. Растворы с низкой концентрацией не оказывают действия, тогда как растворы с очень высокой концентрацией быстро проникают в кровь и вызывают системное токсическое действие.
Для продления местного действия и минимального системного влияния местные анестетики вводят вместе с сосудосуживающими препаратами (адреналин, реже норадреналин или производные вазопрессина). Кровоток при этом ослабевает, и диффузия местного анестетика из эндоневрия в кровь уменьшается, так как градиент концентрации между эндоневрием и кровью резко падает. Введение сосудосуживающих препаратов также способствует уменьшению кровопотерь в зоне операции.
Побочными эффектами применения катехоламинов являются реактивная гиперемия в зоне операции после прекращения действия препарата, а также повышение возбудимости сердца под действием адреналина. Вместо адреналина применяют производное вазопрессина — фелипрессин (менее выражена реактивная гиперемия, не вызывает аритмии, однако сохраняется опасность сужения коронарных сосудов). Сосудосуживающие препараты нельзя применять при операциях на пальцах рук и ног.
Особенности химической структуры. Местные анестетики имеют схожее строение. Чаще всего это третичные или вторичные амины. Азот через цепочку углеродных атомов связан с липофильной областью молекулы, как правило, содержащей ароматическое кольцо. Наличие аминогруппы означает, что в зависимости от своей константы диссоциации (рКа) и pH среды местные анестетики могут находиться в форме незаряженного амина или содержать положительно заряженный аммонийный азот (протонированная, т. е. катионная, форма). Значение рКа указывает pH, при котором 50% молекул находятся в протонированной форме. Типичные местные анестетики имеют рКа от 7,9 до 9. Молекула в протонированной форме имеет полярный гидрофильный участок (протонированный азот) и неполярный липофильный участок (ароматическое кольцо), т. е. является амфифильной частицей.
При физиологическом значении pH в незаряженной липофильной форме находится от 5 до 50% вещества (в зависимости от его рКа). В такой форме местные анестетики могут преодолевать липидные барьеры (с. 32), а в катионной форме оказывают фармакологическое действие.
Обычно применяемые местные анестетики по своей химической природе Щ эфиры или амиды (это различие не играет большой роли в их действии). Вещества с дополнительной метильной группой в углеводородной цепи, например, хлорпромазин, имипрамин действуют как местные анестетики. Местные анестетики, содержащие эфирную связь в углеводородной цепи, инактивируются гидролизом. Это, с одной стороны, является их преимуществом, поскольку уменьшает риск системного действия препаратов, но, с другой стороны, быстрая инактивация означает короткий период действия лекарства.
Прокаин нельзя применять для поверхностной анестезии, так как скорость его инактивации больше скорости проникновения через кожу и слизистые оболочки.
Лидокаин инактивируется в печени путем окислительного дезалкилирвоания по азоту.
У мепивакаина азот, расположенный на конце цепочки, входит в циклогексановое кольцо.
Прилокаин и артикаин слабо подвергаются биотрансформации из-за соседнего с азотом замещенного атома углерода. Артикаин имеет карбоксиметильную группу в тиофеновом кольце. Расщепление эфира приводит к образованию СОО"-группы, что сопровождается нарушением амфифильной структуры и потерей активности метаболита.
В бензокаине нет атома азота, который может протонироватъся при физиологическом pH. Этот препарат применяется исключительно для поверхностной анестезии.
К другим местным анестетикам, используемым для поверхностной анестезии, относится незаряженный полидоканол и катионный амфифильный тетракаин, а также лидокаин (например, в виде 5%-ой мази).
Побочное действие местных анестетиков. Действие местных анестетиков в клетке происходит в «быстром» Na-канале, при открытии которого возникает потенциал действия. Этот канал блокируется местными анестетиками. От работы этого канала также зависит возникновение быстрой деполяризации в других тканях: нервных клетках мозга, мышечных и проводящих раздражение клетках сердца. Действие местных анестетиков не ограничено нервной тканью, они не являются органоспецифичными. Серьезные побочные действия проявляются тогда, когда местные анестетики проникают в кровь быстро или в высоких концентрациях. На сердце распространение возбуждения затруднено, может произойти атриовентрикулярная блокада и в наихудшем случае — остановка сердца. В ЦНС могут нарушаться функции различных участков; как следствие --1потеря сознания и судороги. Против местных анестетиков нет специфического антидота, поэтому необходимы срочные симптоматические противомеры: при нарушении сердечной функции -г адреналин в/в, при появлении признаков отравления ЦНС — противосудорожные средства (например, диазепам в/в).
Анальгетики группы морфина
Опиоиды и опиаты
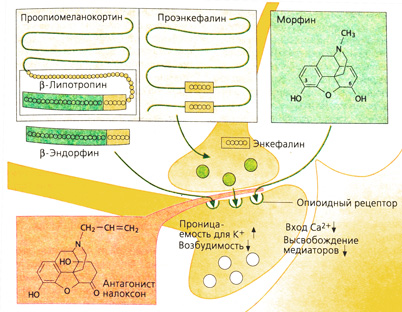
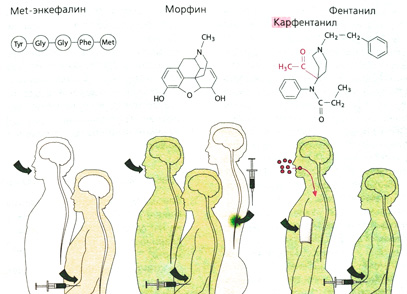
Происхождение опиоидов. Алкалоид морфин (или морфий) — один из компонентов опия. Кроме морфина, в опие содержатся также кодеин и другие алкалоиды, которые не оказывают анальгетического действия (например, папаверин — спазмолитик). Все синтетические (пентазоцин, петидин, метадон, фентанил) и полусинтетические (гидроморфон) производные, оказывающие аналогичное морфину обезболивающее действие, называют опиатами. Анальгетическое действие этих препаратов основано на их сродстве к опиоидным рецепторам, которые в организме связывают эндогенные опиоиды (энкефалины, β-эндорфин, динорфин) (А). Опиоидные рецепторы расположены на нервных клетках в различных областях головного и спинного мозга, а также в интрамуральных сплетениях желудочно-кишечного тракта и мочеполовой системы. Существует несколько типов опиоидных рецепторов (μ-, к-, δ-), относящихся к G-белок-зависимым рецепторам.
Эндогенные опиоиды пептиды, которые образуются в организме из предшественников: проэнкефалина, проопиомеланокортина и продинорфина. Все они имеют аминокислотную последовательность пентапептида (метионин- или лейцинэнкефалины) (А). Действие опиоидов полностью блокируется антагонистами (А) (например, налоксоном; однако последний не полностью снимает эффект от бупренорфина).
Механизм действия опиоидов. Большинство нервных клеток реагируют на опиоиды гиперполяризацией (повышенная способность к проведению калия). Поскольку в этот момент вход кальция в нервную клетку затруднен, нарушается высвобождение возбуждающих медиаторов и синаптическая передача (А). В зависимости от места расположения рецептора в нервной системе данная блокада влияет как на тормозные, так и на возбуждающие стимулы (Б).
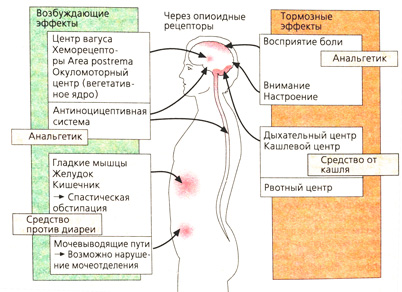
Терапевтическое действие опиоидов (Б). Анальгетический эффект опиоидов обусловлен влиянием на спинной мозг (блокада переключения импульса) и головной мозг (ослабление распространения импульса, торможение болевого восприятия). Внимание и способность концентрироваться снижаются. Изменение настроения зависит от исходной ситуации. Помимо облегчения, наступающего при прекращении сильной боли, наблюдается эйфория и даже дурман, особенно при быстром поступлении вещества в головной мозг после внутривенного введения. Желание продлить данное состояние путем повторного приема препарата может оказаться непреодолимым: развивается зависимость.
При попытке прекратить регулярное употребление появляются физические (нарушение кровообращения) и психические (беспокойство, страх, депрессия) симптомы отмены.
Употребление опиоидов приводит к наркомании: психической и физической зависимости, а также необходимости в повышении дозы.
Назначение большинства опиоидов регулируется определенными правилами (как для наркотиков). Некоторые опиоидные анальгетики (кодеин и трамадол) могут выписываться в обычном порядке, так как риск возникновения зависимости от этих препаратов невелик. Различие в активности опиоидов и их способности вызывать зависимость обусловлено сродством к различным типам рецепторов и наличием или отсутствием внутренней активности. Вещество не может действовать одинаково на все типы рецепторов: по отношению к одному типу рецепторов оно — агонист, к другому — антагонист или частичный агонист/антагонист. Способность вещества вызывать зависимость в основном связана с фармакокинетическими свойствами, так как только при его быстром поступлении в кровь наступает состояние эйфории. При передозировке опиоидов возникает опасность паралича дыхательного центра. Более безопасны частичные агонисты/антагонисты (пентазоцин, напбуфин).
Противокашлевой эффект вследствие блокады кашлевого центра не зависит от анальгетического действия, а обусловлен влиянием на дыхательный центр (противокашлевые препараты: кодеин, носкапин).
Рвота при первом приеме опиоидов возникает из-за возбуждения хеморецепторов Area postrema. При регулярном применении рвота прекращается из-за блокады рвотного центра.
Опиоиды сужают зрачок (миоз), поскольку повышают парасимпатическую активность ядра глазодвигательного нерва.
Периферическое действие на сократимость и тонус гладких мышц желудочно-кишечного тракта: маятникообразные движения усиливаются, пропульсивная моторика тормозится. Тонус сфинктеров резко повышается (спастический запор). Антидиарейный эффект находит лечебное применение (лоперамид). Опорожнение желудка замедляется (спазм желудочного сфинктера), выделение желчи и панкреатического сока снижается из-за сокращения сфинктера Одди. Аналогичным образом изменяется функция мочевого пузыря: опорожнение нарушается из-за повышения тонуса сфинктера.
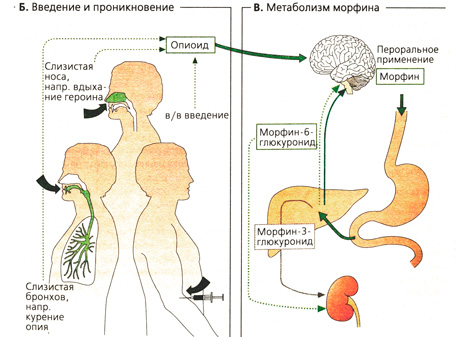
Фармакокинетические свойства опиоидов. Естественные опиоиды (например, Met-энкефалин, Leu-энкефалин, β-эндорфин) не могут применяться в лечебных целях, из-за своей белковой природы они быстро разрушаются, не успевая проникнуть через ГЭБ, и даже при парентеральном введении не достигают целевого органа приложения (А). Морфин назначают перорально, парентерально и эпидурально. Фентанил обладает сильным действием и высокой проникающей способностью, его можно назначать накожно в форме пластыря (А). Наркоманы чаще всего употребляют героин (диацетилморфин). Для более быстрого проникновения наркотика в головной мозг его вводят инъекционно; вероятно, при этом достигается максимальный психический эффект. Кроме того, используют другие способы введения наркотиков: опиум курят, героин вдыхают (Б). Полноценное морфийное опьянение наступает лишь при быстром поступлении опиоида в ЦНС.
Метаболизм (В). Морфин, как и другие опиоиды, содержащие свободную гидроксильную группу, связывается с глюкуроно-вой кислотой и выводится почками. Глюку-ронизация по ОН-группе в положении 6, в отличие от ОН в положении 3, не влияет на сродство к рецепторам.
Развитие толерантности. При многократном введении опиоидов развивается привыкание: для достижения анальгетического эффекта необходимо повышение дозировки. Развитие толерантности меньше сказывается на периферических эффектах. Запоры даже могут стать причиной для отмены обезболивающей терапии. Слабительные следует назначать часто.
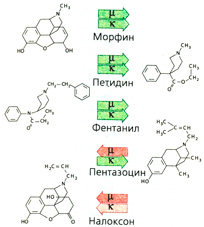
Антагонисты и частичные агонисты морфина. Антагонисты налоксон и налтрексон блокируют действие опиоидов вне зависимости от типа рецепторов (А). Введение этих препаратов не оказывает на здоровых людей никакого действия. При опиоидной зависимости развиваются симптомы отмены. Налоксон подвергается быстрому пресистемному выведению и поэтому применяется только парентерально. Нал трек-сон назначается перорально. Налоксон является хорошим антидотом при угнетении дыхания, вызванном опиоидами. Следует помнить, что он выводится быстрее опиоидов и поэтому должен вводится повторно. Налтрексон применяют как дополнительное средство при лечении опиоидной зависимости.
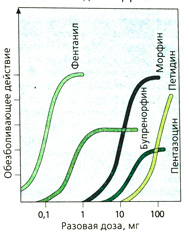
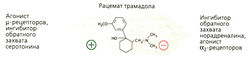
Бупренорфин является частичным агонистом/антагонистом μ-рецепторов, а пентазоцин — антагонистом μ-рецепторов и агонистом х-рецепторов (рис. А). Оба препарата не имеют столь выраженного анальгетического действия, как морфин и фентанил (опиоиды с «низким потолком действия») (Б). Интоксикацию бупренорфином нельзя купировать налоксоном, так как он очень медленно диссоциирует из комплекса с опиоидными рецепторами. Трамадол обладает сильным анальгетическим эффектом и практически не вызывает зависимости. Эффективная доза (пероральная или парентеральная) в 10 раз превышает дозу морфина: 50-100 мг, максимально 400 мг/суг. В такой дозировке дыхательный центр не блокируется. Механизм анальгетического действия комплексный. Препарат трамадол представляет собой рацемат: (+)энантиомер имеет сродство к бета-рецепторам и более активен по отношению к ним по сравнению с (-)энантиомером. О-Десметилметаболит обладает еще большим сродством. Кроме того, препарат блокирует обратный нейрональный захват норадреналина и серотонина (В). Побочным эффектом является рвота (в -10% случаев). Трамадол не помогает наркоманам при морфиновом абстинентном синдроме.
Необходимо особо упомянуть фентанил, действующий в -20 раз сильнее, чем морфин. Его применяют в виде пластыря при длительной болевой терапии. Специфическое действие может быть значительно усилено, если в молекулу фентанила ввести дополнительный заместитель (рис. А: дополнительный заместитель выделен красным). Этот синтетический опиоид карфентанил с длительным периодом действия в 5000 раз сильнее морфина; применяется в ветеринарии для введения в наркоз крупных животных. Препарат может использоваться в водном растворе как аэрозоль. Действие прерывается антагонистами морфина, правда, необходимы чрезвычайно высокие дозы. По сообщениям СМИ, при освобождении заложников Театрального центра на Дубровке в Москве (2002 г.) одна из заложниц скончалась после введения аэрозоля карфентанила, поскольку не оказалось достаточного количества антидота.
Два основных показания к применению опиоидов.
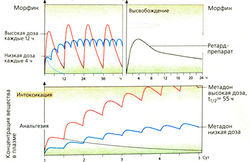
1) Острые сильные боли при травме, инфаркте миокарда и т. п., необходимость торможения дыхательного центра при тяжелом отеке легких. В этих случаях вводят морфин (в/в или п/к). Такое кратковременное применение не приводит к развитию толерантности или зависиости.
2) Сильные постоянные боли, в основном у онкологических больных, когда требуется длительное присутствие анальгетика в крови. Препарат необходимо назначать до наступления боли, а не только тогда, когда пациент уже страдает от сильнейших болей. Морфин, а также многие другие анальгетики (гидроморфон, петидин, пентазоцин, кодеин) быстро выводятся, длительность их действия составляет около 4 ч, поэтому их следует применять каждые 4 ч. Для лечения более тяжелых хронических болевых состояний принимают ретардированные препараты морфина перорально.
Преимущества перорального приема:
1) благодаря медленному повышению концентрации препарата в плазме крови не наступает состояние эйфории и не развивается наркотическая зависимость;
2) действие препарата продолжается дольше;
3) большие количества морфина в этих условиях преобразуются в 6-глюкуронид и оказывают центральное действие;
4) пациент может самостоятельно регулировать прием морфина (принять следующую ретард-таблетку до возникновения более сильной боли).
Альтернативой ретардиро ванным таблеткам морфина является пластырь с фентанилом. Когда онкологический больной находится в терминальной стадии болезни, допускается развитие толерантности. Эйфория может в данном случае играть даже положительную роль.
При определенных обстоятельствах (невозможность перорального приема, непереносимость периферических побочных эффектов) опиоиды можно вводить через постоянный катетер или аппликационно в область спинного мозга (преимущество: значительное снижение дозы и постоянная концентрация в крови; недостаток: катетер).