Ожирение и климакс у женщин
Содержание
Ожирение и климакс у женщин
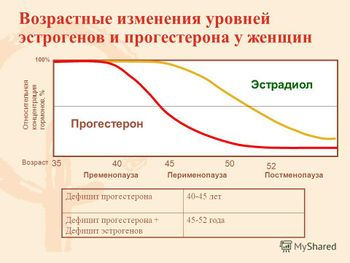
У женщин с возрастом отмечается прогрессивное снижение уровней многих гормонов: прогестерона, эстрогенов, дегидроэпиандростерона, а также гормона роста, что способствует изменениям телосложения и прибавке массы тела.
После менопаузы скорость метаболизма «в покое» замедляется, что подтверждается результатами исследования E.T Poehlman и соавт., которые при динамическом наблюдении зафиксировали постоянную скорость метаболизма «в покое» у здоровых женщин в возрасте до 48 лет и значительное замедление обменных процессов (на 4-5% в каждое десятилетие жизни) в группе старшего возраста. Установлено, что степень снижения скорости метаболизма «в покое» после менопаузы соответствует накоплению энергии 60 000-80 000 кДж за год, что эквивалентно увеличению массы тела на 3—4 кг. При длительном наблюдении за женщинами одинакового возраста показано, что в постменопаузе скорость метаболизма «в покое» снижается примерно на 420 кДж/день, а при сохраненной функции яичников подобный эффект отсутствует. Из-за метаболических последствий длительного периода нарушения регуляции баланса энергии не только растет масса жировой, но и сокращается количество мышечной ткани. В частности, с помощью рентгеновской денситометрии установлено, что масса нежировых тканей после менопаузы уменьшается примерно на 3 кг.
Быстрая прибавка массы тела в перименопаузе отмечается примерно у 60% женщин. По данным Исследования здоровых женщин (Healthy Women’s Study), в первые три года после менопаузы масса тела в среднем увеличивается на 2,3 кг (у 20% женщин - на 4,5 кг и более), а через восемь лет - на 5,5 кг.
Механизм изменений в фигуре
Рассматривается несколько возможных патогенетических механизмов увеличения массы тела у женщин после менопаузы. Установлено, что на фоне снижения секреции гормонов яичников растет общее количество жира и происходит его перераспределение в область передней брюшной стенки, а масса мышечной и костной ткани уменьшается. В нескольких исследованиях показано, что изменения составляющих массы тела после менопаузы: потеря костной плотности, уменьшение мышечной и увеличение жировой массы — происходят независимо от изменений общей массы тела. С помощью денситометрии продемонстрировано, что у пациенток в пери- и постменопаузе общее количество жира (особенно на туловище) на 8-9% больше, а жировой и мышечной массы на бедрах меньше, чем у женщин с сохраненной функцией яичников. Причем у женщин репродуктивного возраста, получавших агонисты гонадотропин-рилизинг-гормона, которые создают медикаментозную, временную менопаузу, отмечены такие же изменения, как и после естественной менопаузы: повышение количества жира на фоне снижения костной и мышечной массы.
С увеличением возраста отмечается повышение способности внегонадных тканей синтезировать эстрогены. Анализ экспрессии генов показал, что количество транскриптов, кодирующих ароматазы, было больше в ягодичной области, чем в абдоминальной независимо от пре- или постменопаузы. Назначение заместительной гормональной терапии не влияло на экспрессию гена ароматазы ни в одном из регионов тела. Контролируют эту экспрессию глюкокортикоиды, ИЛ-6 и факторы роста.
По-видимому, активацию ароматазы в жировой ткани в постменопаузе можно рассматривать как своеобразную компенсаторную реакцию организма женщины в ответ на закономерное возрастное снижение и выключение функции яичников. Это способствует более плавной биологической трансформации женского организма, кроме того, это своеобразная защита от развития остеопороза, старческого слабоумия и болезни Альцгеймера. Установлено, что низкий индекс массы тела (<19 кг/м2) является фактором риска постменопаузального остеопороза и болезни Альцгеймера.
Однако повышенный синтез эстрогенов в жировой ткани может явиться фактором риска развития рака в репродуктивных органах, хотя данные последних лет, отражающие пути метаболизма эстрогенов, указывают на более важную роль не столько уровня эстрогенов, сколько путей метаболизма их посредством образования 2-гидроксиэстрона или 16α-гидроксиэстрона. Установлена связь между уровнем 16α-гидроксиэстрона и риском развития опухолей в эстрогенза-висимых тканях. Однако при повышении уровня 2-гидроксиэстрона наблюдалась тенденция к гибели опухолевых клеток и профилактике их дальнейшего образования.
Дефицит прогестерона в пери- и постменопаузе отчасти объясняет замедление метаболизма после менопаузы. В постменопаузе снижаются уровни глобулина, связывающего половые гормоны (ГСПС), что приводит к росту концентрации свободного тестостерона, относительной гиперандрогении и вносит определенный вклад в формирование абдоминального ожирения. Уровни тестостерона в крови напрямую связаны с количеством абдоминального жира.
Пути решения проблемы
E.T Poehlman и соавт. зафиксировали связь уровней ИРФ-I, массы тела и соотношения количества различных тканей у женщин после менопаузы. Секреция гормона роста с возрастом снижается, чем, в частности, объясняют увеличение общей массы тела и жировой ткани у женщин в постменопаузе. Заместительная терапия гормоном роста уменьшает общую массу тела и количество жира. Представляют интерес выводы B.W. Hartmann и соавт. о том, что прибавка массы тела в течение первого месяца терапии на фоне перорального 17β-эстрадиола происходит лишь у женщин со значительным снижением секреции гормона роста и небольшим повышением уровней ИРФ-I.
После менопаузы уровни β-эндорфина снижаются, а заместительная терапия эстрогенами повышает их. Предполагают, что в постменопаузе также происходит усиление глюкокортикоидной стимуляции, что ведет к увеличению размеров адипоцитов и формированию абдоминального ожирения. Уровни норадреналина в крови в постменопаузе повышены, и более выражено стрессиндуцированное увеличение его концентраций по сравнению с показателями у пациенток репродуктивного возраста. После шестинедельного лечения эстрадиолом эти эффекты значительно ослабляются.
Вывод
Следовательно, половые гормоны и их дефицит взаимосвязаны с жировой тканью и синтезируемыми ею биологически активными веществами прямо и опосредованно через изменение активности ферментов (липопротеинлипазы, ароматазы и др.), цитокинов, норадреналина как на местном, так и на гипоталамическом уровне за счет изменения секреции пептидов, регулирующих аппетит (β-эндорфина, нейропептида-Y, ПОМК и др.).
Источники
- ПОЛОВЫЕ ГОРМОНЫ И ЖИРОВАЯ ТКАНЬ. Сметник В.П. Ожирение и метаболизм. 2007. № 3. С. 17-22.