Дисплазия соединительной ткани
Источник: «Спортивная медицина»
Автор: Под ред. С.П. Миронова, 2013 г.
Содержание
- 1 Соединительнотканные дисплазии
- 2 Дифференцированные соединительнотканные дисплазии
- 3 Недифференцированные соединительнотканные дисплазии
- 3.1 Малые аномалии развития сердца
- 3.2 Открытое овальное окно
- 3.3 Аневризма межпредсердной перегородки
- 3.4 Двустворчатый аортальный клапан
- 3.5 Удлиненный евстахиев клапан
- 3.6 Дилатация корня аорты
- 3.7 Дилатация синусов Вальсальвы
- 3.8 Идиопатическое расширение легочной артерии
- 3.9 Функционально узкая аорта
- 3.10 Аномалии подклапанного аппарата
- 3.11 Ложные (дополнительные) хорды левого желудочка
- 3.12 Пролапс митрального клапана
- 3.13 Пролапс трехстворчатого клапана
- 4 Читайте также
- 5 Список литературы
Соединительнотканные дисплазии
Дисплазия соединительной ткани - это нарушение развития соединительной ткани в эмбриональном и постнатальном периодах вследствие генетически измененного фибриллогенеза внеклеточного матрикса, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений висцеральных и локомоторных органов с прогредиентным течением.
Все свойственные синдрому дисплазии соединительной ткани признаки могут быть разделены на три группы, соответствующие первичной закладке органов в эмбриогенезе (Земцовский Э.В., 1998).
- Мезодермальные аномалии - проявляются соответствующими отклонениями со стороны скелета (деформации грудной клетки, позвоночника и других костей), мягких тканей (гипоплазия мускулатуры и жировой ткани, гипермобильность суставов и сухожилий), внутренних органов (пороки сердца, пролапс митрального клапана, увеличение диаметра аорты и легочной артерии, уменьшение долей легких) и глаз (выраженная миопия, аниридия, голубые склеры).
- Эктодермальные аномалии - проявляются отклонениями со стороны глаз (эктопия и подвижность хрусталика, афакия и появление колобом), ЦНС (анизокория, асимметрия сухожильных рефлексов, нистагм, пирамидные расстройства) и гипофизарно-адреналовой системы (высокий рост, акромегалоидные расстройства, несахарный диабет, вегетативные расстройства).
- Эндодермальные аномалии - проявляются изменениями со стороны кишечника (чрезмерно длинный и гипопластичный кишечник).
Большинство авторов разделяют наследственные заболевания соединительной ткани на дифференцированные и недифференцированные.
Дифференцированные дисплазии соединительной ткани характеризуются определенным типом наследования, отчетливо очерченной клинической картиной, а в ряде случаев - установленными и достаточно хорошо изученными генными или биохимическими дефектами. Наиболее частые представители этой группы - синдром Марфана , 11 типов синдрома Элерса-Данло , несовершенный остеогенез и синдром вялой кожи (cutis laxa). Эти заболевания относят к группе наследственных заболеваний коллагена - коллагенопатиям. Они встречаются достаточно редко и определяются генетиками довольно быстро.
Недифференцированные дисплазии соединительной ткани диагностируют, когда у пациента набор фенотипических признаков не укладывается ни в одно из дифференцированных заболеваний.
В 1990-1995 гг. в Омске прошли пять ежегодных съездов, посвященных проблемам дисплазии соединительной ткани. На одном из них была утверждена классификация, предложенная профессорами В.М. Яковлевым и Г.И. Нечаевой. Эта классификация предполагает выделение: 1) диспластикозависимых изменений органов и систем при дисплазии соединительной ткани (локомоторных, кожных, висцеральных) и 2) состояний, ассоциированных с дисплазией соединительной ткани. Если набор диспластикозависимых изменений укладывается в описанный системный наследственный синдром, то выставляется нозологический диагноз: синдром Марфана, синдром Элерса-Данло и т.д.
Комитетом экспертов Всероссийского научного общества кардиологов (секция «Дисплазии соединительной ткани сердца») в 2009 г. были уточнены рекомендации в распознавании наследственных нарушений структуры и функции соединительной ткани (ННСТ), а также подходов к диагностике наиболее распространенных диспластических синдромов и фенотипов. Основными документами при подготовке рекомендаций послужили: Берлинская нозология наследственных нарушений соединительной ткани (Beighton P. et al., 1988); Международные рекомендации диагностики синдрома Марфана - Гентские критерии (Ghent criteria, De Paepe A. et al., 1996); Международные рекомендации диагностики синдрома Элерса-Данло - Вилльфраншские критерии (Villefranche criteria, Beighton P. et al., 1998); Международные рекомендации диагностики синдрома гипермобильности суставов (СГМС) - Брайтонские критерии (1998) с последующей их ревизией R. Grahamе (2000); Руководство по лечению пациентов с клапанными болезнями сердца (Bonow R.O. et al. ACC/AHA, 2006); аналитический обзор «Диспластические синдромы и фенотипы. Диспластическое сердце»- Э.В. Земцовский (2007).
Согласно этим рекомендациям выделяют:
- наследственные нарушения соединительной ткани - гетерогенная группа моногенных заболеваний, обусловленных генетическими дефектами синтеза и/или распада белков внеклеточного матрикса либо нарушением морфогенеза соединительной ткани;
- дисплазию соединительной ткани - наследственные нарушения соединительной ткани, объединенные в синдромы и фенотипы на основе общности внешних и/или висцеральных признаков и характеризующиеся генетической неоднородностью и многообразием клинических проявлений от доброкачественных субклинических форм до развития полиорганной и полисистемной патологии с прогредиентным течением;
- малые аномалии развития - наследственные или врожденные отклонения органов от нормального анатомического строения, не сопровождающиеся клинически значимыми нарушениями функции. Часть малых аномалий развития исчезает с возрастом, другая, при определенных условиях, способна стать причиной развития патологии;
- порок развития - отклонение органа от нормального анатомического строения, приводящее к клинически значимым нарушениям его функции.
Чрезвычайно велико число ННСТ, группирующихся в сходные по внешним и/или висцеральным признакам синдромы и фенотипы, идентифицировать которые из-за трудностей проведения молекулярно-генетических исследований зачастую не представляется возможным. Именно такие ННСТ допустимо называть дисплазиями соединительной ткани.
Все проявления ННСТ разделяются на группы в зависимости от органов, систем и тканей, вовлеченных в диспластический процесс.
Внешние и висцеральные признаки могут в одном случае выступать как самостоятельный изолированный дефект соединительной ткани, а в другом - как проявление системной наследственной патологии и плейотропного действия дефектных генов.
Наиболее распространенные синдромы и фенотипы, включенные в понятие «дисплазия соединительной ткани», следующие:
- пролапс митрального клапана (ПМК);
- марфаноидная внешность;
- марфаноподобный фенотип;
- элерсоподобный фенотип;
- синдром гипермобильности суставов (СГМС);
- синдромы со смешанным фенотипом;
- неклассифицируемый фенотип. Cиндромы и фенотипы 1-3 частично совпадают по клиническим проявлениям с синдромом Марфана. Фенотипы и синдромы 4-5 имеют много общих черт с классическим и гипермобильным типами синдрома Элерса-Данло.
Клинико-морфологические проявления дисплазии соединительной ткани
- Скелетные изменения: астеническое телосложение, долихостеномелия (непропорционально длинные конечности), арахнодактилия (длинные тонкие пальцы), различные виды деформации грудной клетки, сколиозы, кифозы и лордозы позвоночника, синдром прямой спины, плоскостопие и др. Эти изменения связаны с нарушением строения хряща и задержкой созревания эпифизарной зоны роста, что проявляется удлинением трубчатых костей. В основе деформаций грудной клетки лежит неполноценность реберных хрящей.
- Изменения со стороны кожи: гиперэластичность, истончение, склонность к травматизации и образованию келоидных рубцов или шрамов в виде «папиросной бумаги».
- Изменения со стороны мышечной системы: уменьшение мышечной массы, в том числе сердечной и глазодвигательной мускулатуры, что приводит к снижению сократительной способности миокарда и миопии.
- Патологические изменения суставов: чрезмерная подвижность (гипермобильность ), склонность к вывихам и подвывихам, обусловленная слабостью связочного аппарата.
- Патологические изменения со стороны органов зрения: одно из самых частых проявлений дисплазии соединительной ткани, представленное миопией различной степени, дислокацией хрусталика, увеличением длины глазного яблока, плоской роговицей, синдромом голубых склер.
- Поражения сердечно-сосудистой системы: весьма разнообразны и нередко определяют прогноз. Обычно диагностируют анатомические изменения клапанов сердца: дилатацию фиброзных колец и пролапсы, аномальные хорды, расширение восходящего отдела аорты и легочной артерии с последующим формированием мешотчатой аневризмы. Кроме того, деформации грудной клетки и позвоночника приводят к развитию различных типов торакодиафрагмального сердца.
- Поражения сосудов: проявляются аневризматическими расширениями артерий среднего и мелкого калибра и (очень часто) варикозным расширением вен нижних конечностей.
- Бронхолегочные поражения: касаются как бронхиального дерева, так и альвеол. Чаще всего диагностируют бронхоэктазы, простую и кистозную гипоплазию, буллезную эмфизему и спонтанный пневмоторакс.
- Патологические изменения почек: нефроптоз и реноваскулярные изменения.
Для экспресс-анализа выявления синдрома дисплазии соединительной ткани рекомендуют использовать следующие маркеры.
- Длина тела более 95 центилей по перцентильной шкале.
- Относительное удлинение конечностей (частное от деления размаха рук на длину тела больше 1,03).
- Масса тела менее 10 центилей по перцентильной шкале.
- Индекс Варге меньше нормы.
Индекс Варге рассчитывают по формуле:
ИВ = (масса тела, г /рост2, см) - (возраст, годы /100).
В норме индекс Варге равен или больше 1,5; у здоровых лиц в возрасте от 7 до 17 лет он существенно выше 1,5, а у здоровых лиц в возрасте 21-55 лет превышает 2,0; при полном симптомокомплексе синдрома Марфана индекс Варге не достигает 1,3.
- Переразгибание в коленных суставах более чем на 10о.
- Переразгибание в локтевых суставах более чем на 10о.
- Переразгибание пальцев кисти (при пассивном тыльном сгибании кисти пальцы располагаются параллельно предплечью).
- Признак большого пальца (при положении кисти под углом 90? к предплечью большой палец активно может быть приведен к предплечью).
- Признак запястья (при обхвате запястья I и V пальцами последние заходят друг за друга).
- II палец кисти длиннее IV.
- Арахнодактилия (длинные, паукообразные пальцы).
- Деформация грудной клетки (воронкообразная или килевидная грудь, а также комбинированные дефекты при отклонении от передней поверхности грудной клетки более чем на 1 см).
- Изменения положения позвоночника во фронтальной плоскости в различных его отделах.
- Сглаженность (выпрямление) грудного кифоза.
- Грудной гиперкифоз.
- Поперечное плоскостопие (маркерами поперечного плоскостопия являются: а) деформация и распластывание переднего отдела стопы; б) отведение большого пальца внутрь; в) увеличение угла расхождения между пальцами).
- Продольное плоскостопие.
- Х- и О-образная форма ног.
- Изменение формы пяток (девиация пяточной кости внутрь или наружу).
- Варикозное расширение вен.
- Близорукость.
- Подвывих хрусталика.
- Высокое нёбо.
- Атрофические полосы на коже в области поясницы, плеча, бедра или груди (если они не могут быть объяснены значительным изменением массы тела или другими физическими факторами).
- Пролапс митрального клапана и др.
Дифференцированные соединительнотканные дисплазии
Марфаноидная внешность
Диагноз «марфаноидная внешность» должен ставиться в соответствии с Гентскими критериями при наличии признаков вовлечения костной системы, но при отсутствии клинически значимых признаков вовлечения зрительного аппарата, сердечно-сосудистой и дыхательной систем. Костная система вовлечена, если выявляются: не менее двух больших признаков или один большой и два малых признака. Кроме того, вовлечение костной системы может быть диагностировано при наличии четырех малых признаков, характеризующих долихостеномелию. В диагностике вовлечения костной системы следует использовать более мягкие критерии изменения костной системы, чем те, которые приведены в Гентских критериях (Malfait F. et al., 2006).
В основу алгоритма диагностики синдрома Марфана положено выделение больших и малых критериев, характеризующих выраженность изменений соединительной ткани в различных органах и системах. Большие критерии свидетельствуют о наличии в соответствующей системе патологически значимых изменений. Малые критерии, а в некоторых случаях - один большой критерий, свидетельствуют о вовлечении той или иной системы в патологию соединительной ткани. Перечень больших и малых критериев приведен в табл. 1.
Таблица 1. Гентские критерии диагностики синдрома Марфана (De Paepe et al., 1996)
|
Большие признаки |
Малые признаки |
|
Костно-скелетная система | |
|
Наличие 4 признаков из 8 нижеследующих: 1. Килевидная деформация грудной клетки 2. Воронкообразная деформация грудной клетки, требующая хирургического вмешательства 3. Отношение верхнего и нижнего сегментов тела <0.36 или отношение между размахом рук и ростом 2:1.05 4. Положительный тест лучезапястного сустава и большого пальца (Штейнберг) 5. Сколиоз >20° или спондилолистез 6. Выпрямление локтевого сустава до 170° и менее 7. Медиальное смещение медиальной лодыжки, приводящее к плоскостопию 8. Протрузия вертлужной впадины любой степени (подтвержденная рентгеновским снимком) |
Умеренная воронкообразная деформация грудной клетки Гипермобильность суставов Арковидное нёбо со скученностью зубов Деформации черепа (долихоцефалия*, гипоплазия скуловых костей, энофтапьм, скошенные глазные щели, ретрогнатия) |
|
Изменения в костно-скелетной системе соответствуют большому критерию — патологически значимые изменения, если выявляется не менее четырех из вышеназванных восьми больших признаков. Костно-скелетная система вовлечена, если выявляют, не менее двух больших признаков или один большой и два малых признака. | |
|
Зрительная система | |
|
Подвывих хрусталика |
Аномально плоская роговица (по результатам кератометрических измерений) Удлинение переднезадней оси глазного яблока пс данным УЗИ) с миопией Гипопластическая радужка и гипоплазия сфинктера зрачка |
|
Зрительная система вовлечена, если выявлены два малых признака. | |
|
Сердечно-сосудистая система | |
|
Расширение восходящей аорты с аортальной регургитацией или без таковой и вовлечением как минимум синусов Вальсальвы, или Расслоение восходящей аорты Оценку степени расширения проводят с учетом возраста и величины поверхности тепа по номограммам |
Пролапс митрального клапана Расширение ствола легочной артерии при отсутствии клапанного или периферического легочного стеноза или любой другой очевидной причины е возрасте до 40 лет. Обызвествление митрального кольца в возрасте до 40 лет Расширение либо расслоение стенки грудной или брюшной аорты в возрасте до 50 пет |
|
Сердечно-сосудистая система вовлечена, если выявлен один большой или один малый критерий. | |
|
Легочная система | |
|
Отсутствуют |
Спонтанный пневмоторакс Апикальные буллы, подтвержденные рентгенограммой грудной клетки |
|
Легочная система вовлечена, если выявляется один малый признак. | |
|
Кожные покровы | |
|
Отсутствуют |
Атрофические стрии, не связанные с выраженными изменениями массы тела беременностью или частым локальным механическим воздействием Рецидивирующие или послеоперационные грыжи |
|
Кожа вовлечена, если выявлен один малый признак. | |
|
Твердая мозговая оболочка | |
|
Пояснично-крестцовая дуральная эктазия, выявленная при КТ или МРТ** |
Отсутствуют |
|
Отягощенная наследственность | |
|
Наличие близких родственников, которые удовлетворяют данным диагностическим критериям - наличие мутации в FBN1. известней в качестве причины возникновения синдрома Марфана: или - наличие ДНК маркеров синдрома Марфана |
Отсутствуют |
|
Вовлечение при наличии одного большого признака | |
* Некоторые члены комитета экспертов полагают, что правильнее говорить не о долихоцефалии, а об акроцефалиии, т.е. о черепе, вытянутом вертикально.
** Пояснично-крестцовую эктазию твердой мозговой оболочки (мешотчатое расширение истонченной твердой мозговой оболочки) по данным компьютерной или магнитно-резонансной томографии диагностируют путем измерения диаметра дурального мешка на уровне L1-S1.
Требования к диагностике синдрома Марфана различаются в зависимости от данных наследственного анамнеза.
Для обследуемого пациента:
- если семейный или наследственный анамнез не отягощен, синдром Марфана устанавливают при наличии больших критериев, по меньшей мере, в двух различных системах и вовлеченности третьей системы органов;
- в случае установления мутации, которая известна как вызывающая синдром Марфана у других, достаточно одного большого критерия в одной системе органов и вовлеченность второй системы органов.
Для лиц, находящихся в родственных отношениях с пациентом, у которого диагностирован синдром Марфана, достаточно наличие большого критерия в семейном анамнезе, а также одного большого критерия в одной системе органов и вовлеченности другой системы органов.
В случае выполнения Гентских критериев диагностики синдрома Марфана следует провести молекулярно-генетическое исследование для поиска мутаций генов, кодирующих фибриллин.
С позиций формальной логики в том случае, когда у обследуемого отсутствуют два больших критерия в двух системах и признаки вовлечения третьей системы, диагноз «синдром Марфана» не может быть поставлен. Однако недавно проведенное международное исследование 1009 пациентов с генетически подтвержденной мутацией гена фибриллина показало, что опасность осложнений (диссекция аорты и необходимость в оперативном вмешательстве) у пациентов с неполным набором Гентских критериев практически не отличается от такового в группе пациентов с полным набором критериев (Faivre L. et al., 2008).
Из сказанного следует, что многие пациенты, не отвечающие Гентским критериям, требуют не меньшего внимания и медицинского наблюдения. Очевидно, что таких пациентов нельзя отнести к группе здоровых людей, и выраженные отклонения структуры и функции соединительной ткани, выявленные у них при обследовании, следует обозначать как марфаноподобный фенотип. Помимо синдрома Марфана авторы Гентских критериев выделяют сходные по фенотипическим проявлениям ННСТ.
Признаки марфаноидной внешности:
- Арахнодактилия (симптомы большого пальца + запястья).
- Сколиотическая деформация позвоночника.
- Воронкообразная деформация грудной клетки.
- Килевидная деформация грудной клетки.
- Отношение размаха рук к росту равно или более 1,03.
- Отношение верхнего (до лонного сращения) и нижнего сегментов тела менее 0,89.
- Отношение длины руки к росту более 11%.
- Отношение длины стопы к росту более 15%.
- Марфаноидная внешность может быть самостоятельным синдромом (Loeys- Dietz syndrome, type 2B; LDS2B-610380) или проявлением других ННСТ (синдром Марфана, первичный ПМК, MASS-синдром, врожденная контрактурная арахнодактилия и др.).
Марфаноподобный фенотип
Марфаноподобный фенотип диагностируют при наличии признаков вовлечения костной системы в сочетании с патологическими изменениями в одной из висцеральных систем или признаками вовлечения еще двух висцеральных систем. Для оценки патологических изменений и/или вовлечения костной системы необходимо проведение рентгенологического исследования тазобедренных суставов и компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) позвоночника. Марфаноподобный фенотип может включать в себя как случаи синдрома Марфана с неполными Гентскими критериями, так и целый ряд родственных с синдромом Марфана ННСТ. При отсутствии полного набора Гентских критериев, как показали недавно проведенные исследования (Faivre L. et al., 2008), признаки расширения аорты появляются в более позднем возрасте, что, однако, не снижает опасность развития осложнений.
Экспертная оценка. Допуск к занятиям спортом может быть разрешен только при отсутствии следующих признаков.
- Костные:
- Килевидная деформация грудной клетки.
- Воронкообразная деформация грудной клетки, требующая хирургического вмешательства.
- Сколиоз >20? или спондилолистез.
- Протрузия вертлужной впадины любой степени (подтвержденная рентгеновским снимком).
- Зрительная система: подвывих хрусталика.
- Сердечно-сосудистая система:
- Расширение восходящей аорты с аортальной регургитацией или без таковой и вовлечением как минимум синусов Вальсальвы.
- Расслоение восходящей аорты.
- Пролапс митрального клапана II и III степени.
- Обызвествление митрального кольца.
- Расширение либо расслоение стенки грудной или брюшной аорты.
- Легочная система:
- Спонтанный пневмоторакс в анамнезе.
- Апикальные буллы, подтвержденные рентгенограммой грудной клетки.
- Кожные покровы: рецидивирующие или послеоперационные грыжи.
- Твердая мозговая оболочка: пояснично-крестцовая дуральная эктазия, выявленная при КТ или МРТ
- Отягощенная наследственность:
- Наличие близких родственников, которые удовлетворяют данным диагностическим критериям.
- Наличие мутации в FBN1, известной в качестве причины возникновения синдрома Марфана; или
- Наличие ДНК маркеров синдрома Марфана.
При допуске к занятиям спортом подобные лица нуждаются в динамическом контроле за результатами УЗИ сердца и различных отделов аорты (не менее двух раз в год).
Элерсоподобный фенотип
Элерсоподобный фенотип включает в себя широкий диапазон состояний от «неполного» синдрома Элерса-Данло (см. ниже) до весьма легких и клинически менее значимых состояний. Главное условие отнесения к элерсоподобному фенотипу - наличие не менее двух малых признаков вовлечения кожи. Лиц с элерсоподобным фенотипом нередко отбирают в спортивную и художественную гимнастику, акробатику, прыжки на батуте, плавание.
Экспертная оценка. Допуск к занятиям спортом разрешен, но необходимо динамическое наблюдение.
Синдром гипермобильности суставов
Впервые существование у людей повышенной подвижности суставов отметил Гиппократ. В 1891 г. московский врач А.Н. Черногубов на заседании Московского дерматовенерологического общества сделал сообщение о своеобразном заболевании, симптомами которого были повышенная растяжимость кожи, разболтанность суставов со склонностью к подвывихам, хрупкость сосудов и легкая ранимость кожи, что было расценено как проявление системной неполноценности соединительной ткани. После описаний Элерса в 1901 г. и Данло в 1908 г. это заболевание было названо синдромом Элерса-Данло («гиперэластическая кожа», «эластическая фибродисплазия», «каучуковый человек»). В дальнейшем первичное увеличение подвижности суставов было отмечено при целом ряде синдромов и заболеваний, имеющих наследственное происхождение. В случае сочетания повышенной подвижности суставов с различными изменениями суставной и мышечной систем принято говорить о синдроме гипермобильности.
В настоящее время убедительно доказано существование наследственной предрасположенности к возникновению гипермобильности суставов и синдрома гипермобильности. Однако тип наследования однозначно не установлен - возможны как аутосомно-доминантный, так и аутосомно-рецессивный. По некоторым данным, гипермобильность суставов наследуется доминантно, сцепленно с полом (Гребенев Д.А., 1989).
Этиология и патогенез гипермобильности суставов окончательно не ясны. Существует предположение о ее связи с изменением структуры и соотношения различных типов коллагена. У женщин с гипермобильностью суставов в коже было обнаружено достоверное (по сравнению с контролем) увеличение соотношения типов коллагена III/III+I, уменьшение количества «толстых» и увеличение «тонких» коллагеновых волокон, а также повышение содержания основного вещества, эластина и фиброцитов в ретикулярной строме.
Принято считать, что у женщин частота и выраженность гипермобильности больше, чем у мужчин (6,6:1; 8:1), однако результаты исследований в этом плане достаточно противоречивы. С возрастом гипермобильность уменьшается, особенно быстро в детстве. В некоторых этнических группах, например у индейцев, она наблюдается значительно чаще, чем у европейцев (Грэхем Р., 1992).
Лица с гипермобильностью суставов предрасположены к возникновению различных мышечно-скелетных изменений, в частности артралгий, вывихов суставов, синовиитов, повреждений связок, сухожилий и менисков, синдрома шатающейся спины, спондилеза, спондилолистеза. Кроме того, у них достоверно чаще обнаруживаются пролапс митрального клапана, варикозное расширение вен нижних конечностей, грыжи, переломы костей, у женщин - опущение матки, нарушения менструального цикла, невынашивание беременности вследствие истмико-цервикальной недостаточности.
Характерны также увеличенная эластичность и истончение кожи, наличие кровоподтеков и гематом вследствие хрупкости артериальной сосудистой стенки, мышечная гипотония, миотония, птоз, косоглазие, изменения роговицы, глаукома. Встречаются дивертикулез, бронхоэктазы, патология мочевыводящих путей и желчного пузыря (деформации, нарушения моторной функции).
У женщин чаще наблюдаются генерализованные артралгии (боли в пояснице, коленях, плечах, локтях, кистях рук) и пролапс митрального клапана, у мужчин - разрывы сухожилий, связок, повреждения менисков и межпозвонковых дисков. Существует предположение, что лица с гипермобильностью суставов склонны к развитию у них раннего остеоартроза. Этот процесс может быть обусловлен двумя механизмами. С одной стороны, увеличение подвижности может привести к возникновению значительной биомеханической перегрузки в суставе и его повреждению в связи с неполноценностью коллагена как непосредственно суставных поверхностей, так и его опорных структур. С другой стороны, генетические дефекты, затрагивающие продукцию всех типов коллагена, могут приводить к независимому развитию клинической картины гипермобильности суставов и раннего остеоартроза (Гребенев Д.А., 1989).
Диагностика СГМС основана на Брайтонских критериях, ревизованных позднее R. Grahamе (2000). СГМС диагностируется лишь на основе общности клинических проявлений и генетически неоднороден. Он может включать в себя не только случаи мутации гена тенаскина-Х, но и других генов, ответственных за формирование структуры и функции иных белков внеклеточного матрикса.
Гипермобильными следует считать суставы с избыточным диапазоном движений. Оценивая диапазон, следует учитывать возраст, пол и этническое происхождение пациента. Известно, что у здоровых людей суставная мобильность снижается с возрастом, у женщин ее уровень выше, чем у мужчин, у выходцев из Азии она наибольшая, а у европейцев наименьшая (Beighton P. et al., 1999). Выраженность гипермобильности суставов оценивают по девятибалльной шкале (табл. 2).
Гипермобильность является результатом слабости связок, которая носит наследственный характер. Особую роль в этом отношении играют мутации генов, кодирующих коллаген, эластин, фибриллин и тенаскин-Х.
Таблица 2. Девятибалльная шкала гипермобильности P.Beighton (1998)
|
Тест |
Суставы | |
|
Способность: 1) пассивно отогнуть назад палец в пястно-фаланговом суставе более чем на 90°: 2) пассивно привести I палец к ладонной поверхности руки; 3) пассивно разогнуть локтевой сустав >0°; 4) пассивно разогнуть коленный сустав >10°: 5) интенсивно прижать ладони к полу, не сгибая коленей |
Правый 1 1 1 1 1 |
Левый 1 1 1 1 1 |
|
Итого |
9 | |
|
Один балл может быть получен для каждой стороны при манипуляциях 1-4. поэтому показатель гипермобильности составляет максимально 9 баллов. | ||
Гипермобильность может быть приобретенной, поскольку объем движений в суставах бывает увеличен до гипермобильного диапазона под воздействием тренировок. Балетным танцовщикам, которые не обладают наследственной высокой растяжимостью связок, приходится развивать гипермобильность определенных суставов. При этом изначально неизмененные околосуставные ткани защищают их от травм (McCormack M. et al., 2004).
Синдромом гипермобильности следует называть сочетание признаков гипермобильности суставов с клинической симптоматикой. Речь идет о частых вывихах и подвывихах суставов, артралгиях, вовлечении вегетативной нервной системы (вегетативная дисфункция). Таким образом, для понимания взаимоотношений между гипермобильностью суставов и СГМС существует формула Р. Грэхема (Keer R., Grahame R., 2003): гипермобильность суставов + симптоматика = синдром гипермобильности суставов.
Ниже приведены критерии для распознавания СГМС (Grahame R. et al., 2000) (табл. 3).
Таблица 3. Пересмотренные диагностические критерии синдрома гипермобильности суставов*
|
Большие критерии |
Малые критерии |
|
1. Показатель Бейтона 4/9 или выше (как в момент обследования. так и в прошлом)** 2. Артралгия четырех или более суставов более 3 мес** |
1. Показатель Бейтона 1.2 или 3/9 (0,1, 2 или 3, при возрасте пациента 50 и бол ее лет)** 2. Артралгия (>3 мес) в 1-3 суставах или боль в спине (>3 мес). спондилез, спондилез/слондилолистез** 3. Смещение/подвывих более одного сустава или одного сустава с неоднократным повторением 4. Воспаление мягких околосуставных тканей. Три или более повреждений (эпикондилит, тендосиновит, бурсит) 5. Марфаноидная внешность 6. Аномалии кожи: стрии. гиперрастяжимость, тонкая кожа, образование рубцов по типу папиросной бумаги 7. Признаки связанные с органами зрения: эпикант, или миопия, или антимонголоидный разрез глаз 8. Варикозные вены, или грыжа, или выпадение матки прямой кишки |
* Критерии применимы для пациентов от 16 до 85 лет.
** Сочетание больших и малых критериев под номером 1 и 2 соответственно взаимоисключается.
СГМС диагностируют при наличии двух больших критериев либо одного большого и двух малых критериев или четырех малых критериев. Два малых критерия достаточны, если имеется близкий родственник, страдающий данным заболеванием. СГМС исключают при наличии синдромов Марфана или Элерса-Данло, иных типов, кроме гипермобильного типа ЭДС (ранее - EDS III), в соответствии с определениями, предусмотренными Гентскими (De Paepe, 1996) и Вилльфраншскими (Beighton et al., 1998) критериями.
В настоящее время принято выделять 11 типов синдрома Элерса-Данло . В литературе имеется подробное описание восьми из них: I, II, III типы характеризуются повышенной подвижностью суставов и гиперрастяжимостью кожи. Эти изменения наиболее выражены у больных с синдромом I типа. При II типе гиперподвижность ограничивается суставами пальцев кистей и стоп, а у больных с III типом поражения суставов и кожи малозаметны. Для IV типа характерны разрывы сосудов среднего и крупного калибра. У больных с синдромом гипермобильности V типа отмечается значительная растяжимость кожи при минимальной гиперподвижности суставов. VI тип проявляется глазными симптомами, включая разрывы глазного яблока и роговицы, а также отслойку сетчатки. VII тип характеризуется подвывихами и вывихами суставов, VIII - генерализованным периодонтитом с резорбцией альвеолярных лунок и выпадением зубов (Ткачев В.А. и др., 1992).
Экспертная оценка. Допуск к занятиям спортом при полном синдроме Элерса-Данло запрещен.
Недифференцированные соединительнотканные дисплазии
Малые аномалии развития сердца
К малым аномалиям развития сердца относят анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функции сердечно-сосудистой системы. Этиологической причиной малых аномалий развития сердца является наследственно детерминированная соединительнотканная дисплазия, имеющая различные клинические проявления, зависящие от степени пенетрантности гена. Ряд малых аномалий может иметь дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов: физическое, химическое воздействие, нарушение микроэлементного гомеостаза, влияние геопатогенных зон.
Согласно мнению многих специалистов, когда идет речь об отнесении какоголибо структурного дефекта в сердце к малым аномалиям развития, необходимо помнить, что принцип оценки по функциональной значимости является условным. Так, двустворчатый аортальный клапан обычно не приводит к нарушению аортального кровотока, однако именно при этой аномалии развития частота внезапной смерти выше, чем в популяции. В то же время преувеличение функциональной значимости стигмы в сердце также не оправданно. В каждом конкретном случае структурная аномалия в сердце должна быть оценена в прогностическом плане.
Открытое овальное окно
Открытое овальное окно (ООО) - малая аномалия сердца, характеризующаяся частичным или полным сохранением естественного внутриутробного межпредсердного сообщения в результате постнатального незаращения левопредсердной клапанной заслонки сердца.
В период внутриутробного развития и фетального кровообращения овальное отверстие, наряду с открытым артериальным протоком и венозным (аранциевым) протоком, обеспечивает «обходной» сброс крови из венозной системы большого круга и легочной артерии в левые отделы сердца и аорту. После рождения клапан ООО из-за изменения градиента давления между предсердиями плотно прилегает к межпредсердной перегородке, перестает функционировать, и отверстие считается функционально закрытым. В оптимальных условиях происходит процесс сращения краев клапана с отверстием и истинное (анатомическое) закрытие овального окна. На месте закрытого овального окна остается овальная ямка в виде углубления, занимающего до 28% площади межпредсердной перегородки в средней ее части. В случае незаращения эмбрионального овального отверстия у взрослого человека остается открытое овальное окно.
Е.Ф. Онищенко (2000), изучив 107 препаратов сердца взрослых пациентов, умерших от внесердечных причин, выявил 24 (22,4%) случая ООО.
Анатомическая форма ООО может быть разнообразной. Е.Ф. Онищенко чаще всего наблюдал различные модификации туннелевидной формы - в виде прямого или извитого канала, свободно проходимого или заполненного рыхлой тканью, со стенками в виде слепого кармана. Несколько реже имела место классическая створчатая форма, при которой со стороны левого предсердия наблюдается складка эндокарда, прикрывающая отверстие в виде заслонки. При отсутствии наглядной створчатой формы - щелевидная форма. И наконец, реже всего встречалась окончатая форма, открыто зияющая в месте овальной ямки.
Принципиальное анатомическое различие между ООО и вторичным ДМПП заключается в том, что при ДМПП имеется органический дефект - отсутствие большей или меньшей части перегородки (минус ткань), в то время как при ООО имеется незаращение предсердной заслонки (клапана) или недостаточность клапана овального отверстия. В то же время наличие створки не гарантирует надежность запирательной функции и в ряде случаев может сопровождаться противоклапанным потоком. Считается, что в большинстве случаев ООО существует практически бессимптомно и трудно выделить какие-либо его специфические клинические проявления.
Литературные данные демонстрируют неоднозначный подход в оценке клинической роли этой малой межпредсердной коммуникации.
Некоторые авторы рассматривают ООО как вариант нормы развития межпредсердной перегородки. В частности, Н.А. Белоконь, В.П. Подзолков (1991), О.А. Мутафьян (2002) полагают, что при этом пороке не происходит нарушений гемодинамики и не требуется хирургической коррекции. Н. Шиллер и М.А. Осипов (1993) принципиально отличают дефект межпредсердной перегородки типа ostium secundum от ООО, считая последнее вариантом нормы. При наличии хорошо выраженной клапаноподобной дупликатуры эндокарда с левой стороны межпредсердной перегородки ее плотный прижим к краям отверстия предотвращает даже минимальный левоправый шунт. Это дало основание R.F. Schroeckenstein и соавт. (1972) ввести в употребление термин «клапанно-полноценное» ООО («valvular competent foramen ovale»).
Однако, наряду с признанием ООО в качестве практически не значащей аномалии, существуют факты, указывающие на возможность возникновения на его фоне серьезных жизнеугрожающих осложнений. В первую очередь это касается проблемы парадоксальной эмболии (Gleysteen Т.J., Silver D., 1970; Leonard R.С. F. et al., 1981; Loscalzo J., 1986) и гипоксемических состояний (Begin R. et al., 1981; Kas per W. et al., 1992; Silver M.T. et al., 1994). Они обусловлены активизацией патологических потоков крови через межпредсердное отверстие. В таких случаях ООО начинает функционировать как дефект межпредсердной перегородки (Pagtakhan R.D. et al., 1967).
Ю.Н. Беленков и И.Е. Чазова (1999) приводят пример случая наличия ООО как варианта гемодинамически активного дефекта межпредсердной перегородки. Главной причиной этого называют несостоятельность клапана овального окна, которая приводит к возникновению клапанно-неполноценного ООО вследствие растяжения межпредсердной перегородки (при дилатации предсердий). Закономерно сочетание ООО с аневризмами межпредсердной перегородки, сетью Хиари и удлиненным евстахиевым клапаном.
Морфологические изменения структуры межпредсердной перегородки позволяет выявить чреспищеводная ЭхоКГ. Методом, определяющим предрасположенность к парадоксальным эмболиям, является пролонгированная инфузионная контрастная ЭхоКГ с внутривенной капельной инфузией 0,3% раствора перекиси водорода. К стресс-тестам, предложенным Е.Ф. Онищенко и Н.В. Крашенинниковой (2001) при пролонгированной инфузионной контрастной ЭхоКГ, относятся пробы с инспираторным напряжением, Вальсальвы, кашлевая, с нитроглицерином. Они обеспечивают провокацию праволевого межпредсердного шунта, в подавляющем случае отсутствующего в покое у пациентов с ООО.
При допуске к занятиям спортом особое значение имеет дифференциальная диагностика между физиологической и патологической формой ООО.
Физиологическая форма - это, как правило, клапанно-компетентное отверстие, не сопровождающееся гемодинамически значимыми межпредсердными шунтами и готовностью к парадоксальной эмболии как в покое, так и при физических нагрузках или провокационных пробах.
Патологическая форма может проявляться несколькими вариантами:
- гемодинамическим аналогом дефекта межпредсердной перегородки с появлением осложнений межпредсердного шунтирования крови (с выраженным преобладанием левоправого шунта);
- эмболически опасным вариантом вследствие готовности к парадоксальной эмболии (с транзиторным праволевым шунтом) или тромбообразования in situ в ООО.
Все варианты патологической формы должны расцениваться как факторы ограничения при медицинских экспертизах, требующие активных профилактических или лечебных мер пропорционально степени нарушения кровообращения (при аналоге ДМПП) или степени риска ПЭ.
Особое значение имеет выявление данной патологии у спортсменов. В большинстве исследований убедительно показано, что при наличии ООО у лиц, занимающихся подводными погружениями, риск развития тяжелых проявлений декомпрессионной болезни прямо пропорционален размерам ООО (Schwerzmann M. et al., 2001; Torti S.R. et al., 2004). В связи с этим им рекомендуется закрытие ООО. Патологическая форма ООО через механизм активации гипоксемических нарушений оказывает неблагоприятное влияние и на занимающихся видами спорта на выносливость, а также видами спорта, где часто используются упражнения с задержкой дыхания, когда возможны эпизоды транзиторного праволевого межпредсердного шунта, что обусловливает высокую готовность к парадоксальной эмболии.
При эхокардиографическом обследовании 971 спортсмена (Гуревич Т.С., 2009) открытое овальное окно было выявлено у 5,2%.
Экспертная оценка. Лица с физиологической формой ООО являются практически здоровыми людьми, однако необходимо иметь в виду, что они представляют группу риска по нарушениям ритма и проводимости. В связи с этим, кроме ежегодного эхокардиографического обследования, им необходимо периодически проводить суточное мониторирование ЭКГ и при каждой регистрации обычной ЭКГ делать длинную запись (1-3 мин). При выявлении нарушений ритма и проводимости показана чреспищеводная стимуляция предсердий.
Аневризма межпредсердной перегородки
Аневризму межпредсердной перегородки достоверно чаще, чем в целом в популяции, встречают при дисплазиях соединительной ткани. Отмечено сочетание аневризмы межпредсердной перегородки с пролабированием митрального клапана. Аневризма чаще располагается в области fossa ovale. Возникновение аневризматического выпячивания перегородки может быть связано со спонтанным закрытием дефекта у детей в возрасте до 5-6 лет. Клинически аневризма может быть заподозрена по наличию щелчков в сердце, аналогичных таковым при пролапсе митрального клапана.
В настоящее время аневризму межпредсердной перегородки считают сочетанным фактором эмболообразования у пациентов с ООО. Подвижные аневризмы являются аномалией, способствующей развитию кардиоэмболических осложнений, в том числе криптогенных ишемических инсультов. Кроме этого, пациенты с аневризмой межпредсердной перегородки представляют группу риска по нарушениям ритма и проводимости.
При выявлении аневризм межпредсердной перегородки необходимо проведение чреспищеводной эхокардиографии.
Экспертная оценка. Допуск детей и подростков к занятиям профессиональным спортом нежелателен. Когда же речь идет о квалифицированных спортсменах, при продлении допуска необходимо углубленное обследование с целью исключения всех вышеперечисленных факторов риска.
Двустворчатый аортальный клапан
Значение врожденной двустворчатости (или одностворчатости) аортального клапана определяется тем, что она встречается чаще другой врожденной аномалии сосудов и сердца (среди больных, страдающих врожденной патологией сердечнососудистой системы, аномалия развития аортального клапана встречается в 2-5% случаев), но при этом долгое время протекает бессимптомно и в детском возрасте практически не выявляется. В последующем эта патология может привести ко вторичному тяжелому пороку клапана и практически всегда сопровождается грубыми диагностическими ошибками с плохим прогнозом.
Во время диастолы желудочков выпячивание большей створки бикуспидального клапана может приводить к ее пролабированию и несостоятельности клапана. Двустворчатый клапан аорты не вызывает стенозирования выходного отдела, но отсутствие третьей створки нарушает нормальную работу клапана. Нарушенный кровоток из-за турбулентности и постоянного механического травмирования аномального клапана может привести со временем к асептическому воспалению, сращению, деформации, утолщению, обызвествлению и склерозу створок клапана. Стенозирование происходит постепенно и, как правило, после второйтретьей декады жизни, чаще после 40-50 лет (Бокерия Л.А., 1999; Банкл Г., 1980; Friedman W.F, 1995). Клапанные стенозы составляют 70% случаев стеноза аорты, из них в 1/3 случаев - это стенозы на фоне двустворчатого аортального клапана.
Таким образом, гемодинамически незначимая в детском и подростковом возрасте малая аномалия сердца - двустворчатый аортальный клапан - может с возрастом трансформироваться в сочетанный аортальный порок с преобладанием стеноза (Белоконь Н.А., Кубергер М.Б., 1987; Мутафьян О.А., 2002; Банкл Г., 1980).
Клиническая картина. До появления местных нарушений гемодинамики клинические проявления врожденной аномалии аортального клапана отсутствуют и развиваются только по мере формирования вторичного порока сердца (кальциноза). Жалобы вначале отсутствуют. При случайном обследовании могут быть выявлены шумы над областью сердца, происхождение которых вначале трудно объяснить. В этих случаях ошибочно ставят диагнозы ревматизма, атеросклероза, коарктации аорты и т.д. На почве вторичного порока сердца может развиваться инфекционный эндокардит. По мнению Н. Шиллера и М.А. Осипова (1998, 2005), данная аномалия должна быть отнесена к врожденным порокам сердца. В 10-15% случаев двустворчатый АК сочетается с другими малыми аномалиями и пороками сердца.
Выявление врожденной аномалии аортального клапана, и особенно вторичного кальциноза, обусловливает необходимость проведения профилактики инфекционного эндокардита и постановки вопроса о своевременном оперативном вмешательстве.
Внутрисердечный кальциноз - патологическое отложение кальция в различные внутриполостные структуры сердца - фиброзные основания клапанов, хордальные нити и пристеночные склеротические утолщения эндокарда. Наибольшее клиническое значение имеет кальциноз клапанных структур сердца (кальциноз клапанов).
Кальциноз клапанов сердца подразделяют на первичный и вторичный.
Первичный кальциноз клапанов является эссенциальным (идиопатическим), с неустановленной этиологией, по-видимому, неспецифического характера. При этом отмечают выраженную зависимость первичного кальциноза от возраста больных.
Этиология вторичного кальциноза обычно хорошо известна. Возникает он, как правило, на почве эндокардитов инфекционного или аллергического происхождения. Кроме того, вторичный кальциноз закономерно возникает в результате дистрофических изменений клапанов (аортального и реже пульмонального) при их врожденной аномалии (аортального и реже пульмонального).
Внутрисердечный кальциноз у спортсменов (цит. по: Земцовскому Э.В., 1995). Диссертационное исследование А.А. Балябина (1989), который обследовал 143 спортсмена различной направленности тренировочного процесса в возрасте от 13 до 57 лет, позволило существенно расширить наши представления о роли физических перегрузок в развитии внутрисердечного кальциноза. Из 143 обследованных спортсменов высокой квалификации у 30 (21% случаев) при ЭхоКГ-исследовании был обнаружен внутрисердечный кальциноз, у 5 из 30 имелось сочетание кальциноза аортального кольца со склеротическим уплотнением или кальцинозом митрального кольца. У остальных 25 был выявлен изолированный кальциноз аортального кольца. Важно, что у всех спортсменов старше 40 лет (всего 10 человек) было выявлено отложение солей кальция в аортальном кольце.
С точки зрения автора, формирование внутрисердечного кальциноза при занятиях спортом можно рассматривать как одно из возможных проявлений дистрофии миокарда физического перенапряжениия.
Врачебная тактика в случае выявления внутрисердечного кальциноза у действующих спортсменов определяется не столько выраженностью кальциноза, сколько состоянием адаптации аппарата кровообращения к физическим нагрузкам Э.В. Земцовский (1995) приводит следующий случай двустороннего аортального клапана у спортсменов.
Спортсмен С., 30 лет, I разряд по хоккею, направлен на консультацию по поводу выявленного при профилактическом осмотре грубого систолического шума над грудиной справа во втором межреберье. Заподозрен стеноз устья аорты. При осмотре жалоб не предъявляет. Пульс 65 уд./мин, АД 130/75 мм рт.ст. Сердце увеличено влево на 2 см. Аускультативно: I тон приглушен над верхушкой сердца, акцент II тона над аортой, вдоль левого края грудины и во втором межреберье справа от грудины грубый систолический шум «изгнания». Других отклонений при физикальном исследовании не выявлено.
На ЭКГ - синусовый ритм 68 уд./мин. Признаки гипертрофии левого желудочка с его систолической перегрузкой (увеличена амплитуда зубцов R и инверсия Т в левых грудных отведениях).
На ЭхоКГ - признаки бикуспидального аортального клапана. Створки аортального клапана утолщены. Признаки гипертрофии задней стенки левого желудочка и межжелудочковой перегородки (задняя стенка левого желудочка - 12 мм, межжелудочковая перегородка - 12 мм).
Установлен диагноз: бикуспидальный аортальный клапан без клинически значимых нарушений центральной гемодинамики. Рекомендовано прекратить спортивные занятия с переходом на регулярные оздоровительные физические тренировки.
Экспертная оценка. При выявлении двустворчатого аортального клапана допуск к занятиям профессиональным спортом детей и подростков нежелателен. Когда же речь идет о высококвалифицированных спортсменах, при продлении допуска необходимо углубленное обследование с целью исключения пограничных значений левых отделов сердца, стеноза аортального клапана, аортальной регургитации, кальциноза створок и изменений на ЭКГ.
Удлиненный евстахиев клапан
Клапан (заслонка) нижней полой вены (v. venae cavae inferioris, PNA; v. venae cavae inferioris Eustachii, синонимы: евстахиев клапан, евстахиева заслонка) образован эндокардом, ограничивает устье нижней полой вены, имеет полулунную форму; у зародыша направляет струю крови к овальному отверстию. Располагается на уровне передней арки нижней полой вены, после периода новорожденности не превышает в длину 1 см или полностью рудиментируется. По данным секционного материала, евстахиев клапан обнаруживается у 86% детей. При популяционных исследованиях с использованием эхокардиографии необычно длинный евстахиев клапан (более 1 см) определяется у 0,20% населения и рассматривается как стигма. По мнению Ю.М. Белозерова и соавт. (2004), он может рефлекторно вследствие раздражения пейсмекерных образований предсердия предрасполагать к суправентрикулярным аритмиям.
По данным Т.С. Гуревич (2009), удлиненный евстахиев клапан зарегистрирован у 9,2% спортсменов, направленных на ЭхоКГ (у лиц без ПМК - 0,46%, при ПМК I степени - 18,7%, ПМК II степени - 38,9%).
Экспертная оценка. Удлиненный евстахиев клапан не является противопоказанием к занятиям спортом, но его наличие обусловливает необходимость систематического кардиологического контроля за спортсменами.
Дилатация корня аорты
Дилатация корня аорты является индикатором дисплазии соединительной ткани и наблюдается при синдромах Марфана, Элерса-Данло и других наследственных соединительнотканных заболеваниях. Однако эта малая аномалия развития сердца может наблюдаться и в изолированном виде без внешних проявлений заболевания (идиопатическая дилатация корня аорты). При выявлении дилатированного корня аорты (90 и более центилей кривой распределения) необходимо исключить постстенотическую дилатацию, аортоартериит, артериальную гипертензию и другие заболевания. Дети с широкой аортой без признаков соединительнотканного заболевания часто имеют как внешние признаки дизэмбриогенеза (аналогичные первичному пролапсу митрального клапана), так и другие малые аномалии развития сердца (дополнительная трабекула левого желудочка, дилатация ствола легочной артерии, эктазия митрального кольца). Считают, что идиопатическая дилатация корня аорты является проявлением нарушения диспропорционального онтогенетического развития у детей с наследственно обусловленной предрасположенностью к слабости соединительной ткани.
Дилатация корня аорты, не сопровождающаяся недостаточностью аортального клапана, была диагностирована Т.С. Гуревич (2009) у 7,2% спортсменов; в 81,2% случаев она сочеталась с ПМК и дополнительными хордами левого желудочка.
Экспертная оценка. Дилатация корня аорты, не сопровождающаяся недостаточностью аортального клапана, не является противопоказанием к занятиям спортом.
Дилатация синусов Вальсальвы
Дилатация синусов Вальсальвы, в отличие от аневризмы, не сопровождается какими-либо клиническими и гемодинамическими нарушениями функции сердца. Обычно наблюдают дилатацию бескоронарного синуса в пределах 3-7 мм. Эти дети, как и при идиопатической дилатации корня аорты, имеют внешние стигмы соединительнотканной дисплазии. Аускультативно могут быть выслушаны непостоянные щелчки. Прогностическая значимость дилатации синусов в детском возрасте не определена.
Экспертная оценка. Дилатация синусов Вальсальвы не является противопоказанием к занятиям спортом.
Идиопатическое расширение легочной артерии
Данная аномалия характеризуется расширением ствола при отсутствии порока сердца и патологии легких. Дилатация ствола легочной артерии происходит на фоне наследственно обусловленной патологии соединительной ткани, что подтверждается одновременным обнаружением других маркеров соединительнотканной дисплазии сердца и частым выявлением расширения при наследственно детерминированных синдромах, например при синдроме Марфана. При аускультации может быть систолический шум средней интенсивности на основании сердца, уменьшающийся при вертикальном положении.
Экспертная оценка. Идиопатическое расширение легочной артерии не является противопоказанием к занятиям спортом, однако подобные лица должны быть всесторонне обследованы и за ними устанавливается динамическое наблюдение.
Функционально узкая аорта
Под функционально узкой аортой понимают значения диаметра аорты, соответствующие 3-10 центилям нормального распределения популяции.
При исследовании в популяции диаметра аорты у детей от 3 до 15 лет выявлено варьирование данного размера в широких пределах. В этом периоде онтогенетического развития просвет аорты увеличивается в 1,5-2 раза. Сравнение эхометрических показателей корня аорты у 1800 детей в возрасте 3-15 лет выявило взаимо связь диаметра аорты с антропометрическими показателями. Узкая аорта является генетически детерминированной, врожденной малой аномалией развития сердца. Дети с функционально узкой аортой имеют характерную функционально-структурную организацию внутрисердечной гемодинамики - у 91,2% мальчиков и 95,4% девочек выявляют пограничные значения диаметра правого желудочка, соответствующие 90-97 центилям. Конечно-диастолический диаметр левого желудочка у детей до 7 лет имеет тенденцию к увеличению (90- 97 центилей), в то время как у детей старшего возраста соответствует 25 центилям. Напротив, поперечный диаметр левого предсердия у детей до 7 лет обычно соответствует 25-75 центилям, а в старшем возрасте увеличивается и в большинстве случаев превышает 75 центиль.
У детей с функционально узкой аортой часто отмечают повышение мышечной массы левого желудочка, о чем свидетельствуют значения диастолической толщины его задней стенки и межжелудочковой перегородки. Отмечено сочетание функционально узкой аорты с другими аномалиями сердца - дисфункцией митрального клапана, пролапсом митрального клапана, дополнительными трабекулами в полости левого желудочка.
Экспертная оценка. Данные малые аномалии развития не являются противопоказанием к занятиям спортом, однако следует иметь в виду, что дети с погранично низкими значениями диаметра аорты имеют предрасположенность к возникновению аритмий и сниженную толерантность к физическим нагрузкам. Рекомендован динамический контроль ЭКГ и ЭхоКГ.
Аномалии подклапанного аппарата
Подклапанный аппарат левого атриовентрикулярного клапана имеет большое разнообразие строения. Наиболее часто в детском возрасте встречают нарушенное распределение хорд к передней или задней створке митрального клапана. Эктопическое крепление сухожильных нитей (к межжелудочковой перегородке или задней стенке левого желудочка) бывает значительно реже. Аналогичные изменения обнаруживают со стороны трикуспидального клапана. Данные аномалии, вероятно, могут явиться одним из факторов, предрасполагающих к ревматическому и инфекционному эндокардиту, а также пролабированию митрального клапана у детей и, как следствие, его недостаточности у пожилых людей. Значение таких микроаномалий до конца не раскрыто. Обычно эти отклонения в детском возрасте не вызывают клапанной регургитации и/или препятствия току крови и проявляются лишь функциональным систолическим шумом, иногда имитирующим врожденный порок сердца.
Экспертная оценка. Данные аномалии не являются противопоказанием к занятиям спортом, однако необходимо иметь в виду, что подобные лица нуждаются в систематическом кардиологическом контроле.
Ложные (дополнительные) хорды левого желудочка
Ложные хорды левого желудочка - это мышечно-соединительнотканные тяжи, обособленно располагающиеся в полости левого желудочка и не связанные со створками митрального клапана. Впервые W. Turner (1893) описал морфологию ложных хорд левого желудочка, назвав их аномальными мышечными пучками, которые являются вариантом нормы. H.C. Lam и соавт. (1970) разработали морфологическую классификацию ложных хорд левого желудочка, четко отделив истинные хорды от ложных. В отличие от истинных ложные хорды левого желудочка прикрепляются не к створкам клапанов, а к стенкам желудочков и представляют собой дериват внутреннего мышечного слоя примитивного сердца, возникающего в эмбриональном периоде при отшнуровке папиллярных мышц (Frank D., 1970). При гистологическом исследовании ложные хорды левого желудочка имеют фиброзное или смешанное фиброзно-мышечное строение (Suwa M. et al., 1989). В 95% случаев ложные хорды располагаются в полости левого желудочка, в 5% - в полости правого желудочка.
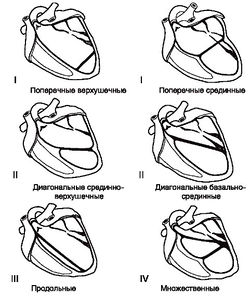
Согласно Т.Ф. Перетолчиной (1995) топографические варианты ложных хорд левого желудочка выглядят следующим образом:
- I - поперечные (верхушечные, срединные и базальные);
- II - диагональные (срединно-верхушечные, базально-срединные);
- III - продольные.
Они могут быть единичными или множественными (Gullace G. et al., 1988) (рис. 3-1).
Истинная хорда ЛЖ - фиброзный тяж, соединяющий папиллярную мышцу со створкой митрального клапана.
Ложная хорда ЛЖ - фиброзно-мышечный или фиброзный тяж, соединяющий папиллярные мышцы между собой или со стенкой левого желудочка.
Нормальная трабекула - мышечный тяж, плотно прилегающий к эндокарду желудочка.
Аномальная трабекула - мышечный или фиброзно-мышечный тяж, неплотно примыкающий к эндокарду и соединяющий стенки желудочка.
Feigenbaum (1994) считает, что клиническое значение ложных хорд левого желудочка остается не вполне ясным. По мнению Э.В. Земцовского (1998), клиническая значимость и симптоматика ложных хорд зависят от выраженности соединительнотканной дисплазии сердца и внутрисердечной топографии самих ложных хорд. Согласно M. Suwa и соавт. (1988) клиническое значение дополнительных хорд левого желудочка (ДХЛЖ) заключается в том, что они являются одной из возможных причин нарушений ритма сердца у молодых людей.
Многие авторы к наиболее клинически значимым относят поперечно-базаль ные и множественные хорды, которые довольно часто формируют систолический шум, ведут к нарушениям внутрисердечной гемодинамики и диастолической дисфункции сердца, способствуют возникновению сердечных аритмий (Земцов ский Э.В., 1998; Лобанов М.Ю., 2000; и др).
По другим данным, наиболее аритмогенными являются продольные ложные хорды левого желудочка (Степура О.Б. и др., 1997). Отмечают, что частота желудочковых экстрасистол возрастает и с увеличением толщины хорды.
Е.Ф. Онищенко (2000) по эхокардиографической структуре выделяет дополнительные хорды «нитчатого» и «балочного» типов. «Нитчатый» тип характеризуется однородной структурой, представлен гиперэхогенной тканью и имеет небольшую толщину. Хордам «балочного» типа, по мнению автора, присуща неоднородная структура, близкая по эхогенности к эндокарду, и в отличие от хорд «нитчатого» типа для них характерен большой диаметр. Наличие у дополнительных хорд «балочного» типа в центральной части ткани низкой эхогенности, аналогичной плотности миокарда, дает основание считатать, что такие хорды содержат мышечные волокна, содержащие электрофизиологически активные проводящие фибриллы Пуркинье, что, по мнению автора, делает возможным расценивать хорды «балочного» типа как особо неблагоприятные в отношении возникновения нарушений ритма сердца.
Единого мнения о механизмах развития нарушений ритма при ДХЛЖ не существует. Некоторые исследователи считают ДХЛЖ дополнительными путями проведения возбуждения, так как они могут содержать в себе волокна Пуркинье. Другим возможным механизмом аритмий у пациентов с ДХЛЖ является изменение электрофизиологических свойств гладкомышечных клеток, возникающее в связи с деформацией хорд турбулентным током крови. Отдельные авторы рассматривают ДХЛЖ как одну из причин образования тромбов в полости левого желудочка.
Следует отметить, что экстрасистолия у пациентов с ложными хордами левого желудочка, как правило, исчезает при физической нагрузке, но плохо поддается медикаментозным воздействиям. Исчезновение экстрасистолии при нагрузке может быть объяснено уменьшением степени натяжения ложных хорд левого желудочка вследствие уменьшения размеров сердца.
Экспертная оценка. Наличие дополнительных хорд левого желудочка не является противопоказанием для занятий спортом, однако при этом необходимо иметь в виду следующее.
Располагаясь в путях притока или оттока левого желудочка, ложные хорды могут способствовать возникновению локального феномена сверхвысоких скоростей (aliasing-феномен) и, как следствие, приводить к травмированию или развитию фиброза.
Являясь аномальным путем проведения возбуждающего импульса, ложные хорды могут стать причиной возникновения желудочковых аритмий, в том числе фибрилляции желудочков.
Лицам с дополнительными хордами «балочного» типа рекомендован более частый и тщательный медицинский контроль с целью выявления ранних признаков аритмического варианта перенапряжения сердечно-сосудистой системы.
Пролапс митрального клапана
Пролапс митрального клапана (ПМК) занимает ведущее место в структуре сердечно-сосудистых заболеваний.
Заболевание впервые описано W. Osler (1880) как аускультативный феномен, обнаруживаемый у молодых людей в виде систолического шума, перемежающегося непостоянными систолическими кликами (щелчками). В 1963 г. J. Barlow и соавт. с помощью ангиографических исследований показали, что причиной позднего систолического шума и мезосистолических кликов является прогибание (провисание) створок митрального клапана в левое предсердие, сопровождаемое определенным рядом клинических и электрокардиографических изменений. Термин «пролапс митрального клапана» предложен J. Griley и соавт. (1966). Заболевание описывается также терминами «папиллярный синдром», «синдром хлопающего клапана», «синдром мезосистолического клика и телесистолического шума», «синдром Барлоу» и др.
Состояние может быть обусловлено нарушением архитектоники внутрисердечных образований, неполным функциональным соответствием между собой отдельных клапанных структур митрального комплекса, врожденной, наследственной или приобретенной неполноценностью соединительнотканных структур, миксоматозным перерождением тканей сердца, малыми аномалиями створок, фиброзного кольца, хорд и папиллярных мышц, изменением конечного диастолического объема левого желудочка, нарушением нейрогуморальной регуляции функции митрального клапана.
ПМК определяется по данным допплер-ЭхоКГ как выбухание одной и/или обеих створок митрального клапана в полость левого предсердия на 2 мм и более над уровнем митрального кольца в парастернальной позиции - с миксоматозной дегенерацией створок или без нее, с митральной регургитацией или без нее (Bonow R.O. et al., ACC/AHA, 2006).
ПМК может быть безобидным ЭхоКГ-феноменом, возникающим из-за избыточной длины створок или их высокой эластичности у молодых людей, особенно у молодых женщин, часто сопровождающим другие классифицируемые и неклассифицируемые диспластические синдромы, или самостоятельным клинически и прогностически значимым синдромом. Речь идет о первичном семейном ПМК.
Для диагностики генетически детерминированного первичного ПМК не следует ограничиваться только формально проведенным ЭхоКГ-исследованием в стандартных позициях, необходимо учитывать результаты обследования семьи, фенотипические данные и клиническую картину заболевания.
При отсутствии признаков миксоматозной дегенерации створок необходима дифференциальная диагностика между синдромом ПМК как одной из малых аномалий и ПМК - вариантом нормы. Диагностика синдрома ПМК должна основываться на клинических и ЭхоКГ-данных. Синдром ПМК - это сочетание ЭхоКГпризнаков пролабирования створок/створки с клиническими данными (наличие систолического клика и систолического шума, гипотензия и ортостатическая недостаточность, вегетативная дисфункция, аритмический синдром и изменения на ЭКГ). При исключении синдрома ПМК выбухание створок на 2 мм и более над уровнем митрального кольца может быть расценено как один из вариантов малых аномалий развития сердца, число которых, как известно, тесно коррелирует с количеством выявляемых внешних признаков дисплазии соединительной ткани (Ягода А.В., Гладких Н.Н., 2007). Следует помнить и о возможности отнесения случаев выбухания створок на 2 мм над уровнем митрального кольца без митральной регургитации и миксоматозной дегенерации к варианту нормы.
Многие авторы основное значение в этиопатогенезе пролапса митрального клапана придают нарушению обмена микроэлементов. При этом дефицит магния рассматривают как основной этиопатогенетический фактор, приводящий к пролабированию клапана (Durlach J. et al., 1992).
Некоторые авторы связывают возникновение пролапса митрального клапана с нарушением клапанной иннервации, возникающей при различных вегетативных и психоэмоциональных нарушениях.
Вторичный пролапс митрального клапана является проявлением наследственной патологии соединительной ткани (синдром Марфана, Элерса-Данло, эластической псевдоксантомы и др.), клапанно-желудочковой диспропорции, нейроэндокринных аномалий (гипертиреоз).
Результаты комплексного обследования детей с первичным ПМК (Белозеров Ю.М., 2004) позволяют считать, что в возникновении пролабирования створок имеют значение одновременно несколько факторов, основными из которых являются неполноценность соединительнотканных структур клапана, минорные аномалии клапанного аппарата и психовегетативная дисфункция, способствующая гемодинамической дисрегуляции.
Согласно данным популяционных исследований ПМК у детей обнаруживают с частотой от 3-5 до 10-14% случаев.
Частота выявления ПМК у молодых спортсменов колеблется в широких пределах - от 0,52-8,0 до 23,0-37,7% и выше (Андреев Э.Ф. и др., 1991; Guerrini F. et al., 1986). Вероятно, подобные расхождения связаны с различным отбором и численностью обследуемого контингента спортсменов. Так, при массовом обследовании 8600 спортсменов Jucrrini и соавт. (1986) выявили ПМК только в 0,52% случаев, в то время как при выборочном эхокардиографическом обследовании молодых спортсменов в связи с обнаруживаемыми у них систолическими шумами или нарушениями фазы реполяризации на ЭКГ пролапс митрального клапана выявлялся уже в 23,0-37,7% случаев (Андреев Э.Ф. и др., 1991; Земцовский Э.В., 1980). Частота встречаемости ПМК у молодых спортсменов в исследованиях Э.В. Белоцерковского, В.Л. Карпмана (1991), И.Б. Гитель и соавт. (1991) составила 10-15%.
ЭКГ при пролапсе митрального клапана. По данным Т.С. Гуревич, обследовавшей 971 спортсмена (653 - без ПМК, 187 - с ПМК-I, 131 - с ПМК-II), у лиц с ПМК наблюдались более частые и выраженные изменения конечной части желудочкового комплекса в виде сглаженности и инверсии зубца Т - в 28,5% наблюдений. Из них: снижение зубцов Т и неглубокая инверсия в III, aVF, V5-V6 отведениях имела место в 27,8% случаев при ПМК-I и в 29,1% - при ПМК-II, у лиц без ПМК аналогичные изменения наблюдались в 15,3% случаев.
При неспецифических изменениях конечной части желудочкового комплекса (ST и Т) в каждом случае пролабирования створок митрального клапана требуется индивидуальная динамическая оценка электрокардиограммы, поскольку этиология пролабирования створок митрального клапана и изменения конечной части желудочкового комплекса могут быть различны. Для объяснения генеза изменений зубца Т и сегмента ST при пролабировании створок митрального клапана предложено несколько гипотез. Сторонники миокардиальной гипотезы утверждают, что изменения конечной части желудочкового комплекса обусловлены локальной или распространенной миокардиопатией (миокардиодистрофией), приводящей к нарушению процесса реполяризации или биоэлектрической нестабильности сердца. Согласно положениям «клапанной» гипотезы пролабирование створок митрального клапана способствует выраженной тракции папиллярных мышц левого желудочка. Натяжение препятствует кровоснабжению или вызывает спазм мелких коронарных сосудов, в результате чего возникает ишемия определенных зон левого желудочка с вовлечением папиллярных мышц.
Положительная динамика зубца Т при проведении пробы с физической нагрузкой объясняется многими авторами тем, что изменения реполяризации при ПМК связаны не столько с нарушениями электролитного баланса или миокардиодистрофией, сколько с экстракардиальными факторами.
ПМК у спортсменов часто сочетается с синдромом ранней реполяризации.
Многие авторы указывают на сочетание синдрома ПМК с удлинением интервала Q-T (корригированный показатель интервала более 440 мс).
А.Г. Дембо, Э.В. Земцовский (1979), Г.В. Минтян (1981) показали, что занятия спортом повышают склонность к возникновению аритмий при наличии ПМК.
ЭхоКГ при ПМК. K. Joseph и соавт. (1987) рекомендуют определять степень пролабирования створок следующим образом.
В норме - тела створок располагаются в полости ЛЖ, ниже кольца митрального клапана. При ПМК-I - тела створок (или одной из створок) незначительно прогибаются во время систолы ЛЖ в полость левого предсердия; концы створок находятся в полости ЛЖ, ниже линии кольца митрального клапана.
При ПМК-II - тела створок МК (или створки) более значительно прогибаются в левое предсердие, концы створок - на линии кольца МК.
При ПМК-III - тела створок (створки) находятся в полости левого предсердия, выше линии кольца МК.
Согласно рекомендациям Н.М. Мухарлямова (1981) степень ПМК по данным ЭхоКГ соответствует следующим показателям:
- I степень - пролабирование до 6 мм;
- II степень - пролабирование 6-9 мм;
- III степень - пролабирование свыше 9 мм.
H. Feigenbaum (1986) различает степени митральной регургитации таким образом:
- I степень - регургитация на уровне створок МК;
- II степень - регургитация в полости ЛП не более чем 10-15 мм;
- III степень - регургитация до середины предсердия;
- IV степень - регургитация по всей камере ЛП.
По Г.М. Соловьеву (2003), три степени митральной регургитации определяются следующим способом:
- I степень - на уровне створок МК;
- II степень - до середины ЛП;
- III степень - до «крыши» ЛП.
Изменение структуры митрального клапана. Одной из составляющих структуры митрального клапана является длина створок: по данным Т.С. Гуревич, из 318 спортсменов, имевших пролапс митрального клапана, умеренное удлинение передней створки (до 30 мм) наблюдалось у 15,4%, задней створки (до 20 мм) - у 39,3%. Сочетанное удлинение створок (передней и задней) регистрировалось в 11,9% случаев ПМК. Значительное удлинение - более 30 мм - передней створки наблюдалось у 6,1% спортсменов. Сочетанное значительное удлинение обеих створок имело место у 15,4%. Длина створок не была увеличена у 11,9% спортсменов.
В.М. Яковлевым и соавт. (2003) было предложено учитывать не только показатели длины створок, но и количественные характеристики фиброзного кольца митрального клапана, в первую очередь его диаметр, меняющий свои значения в различные фазы сердечного цикла. Авторы считают целесообразным выявлять достоверное увеличение диаметра митрального кольца в разные фазы сердечного цикла и показатель прироста растяжения диаметров кольца в систолу и диастолу. В частности, ими описан показатель, отражающий патологическую линейную величину створок - индекс длины створок, определяемый как разность общей длины обеих створок клапана и диаметра митрального кольца в диастолу. По мнению Т.С. Гуревич (2009), спортсмены, имеющие большой диаметр (>30 мм) и высокий показатель прироста растяжения фиброзного кольца (>5 мм), а также выраженную величину индекса длины створок (>10 мм), представляют группу риска по возникновению митральной регургитации.
Особое внимание должно быть уделено определению толщины створок (миксоматозное перерождение), поскольку некоторые авторы выделяют его как критерий тяжести ПМК (Weissman C., 1994). Миксоматозная дегенерация трактуется J. Maron и соавт. (1976) как «деструкция и утрата нормальной клапанной структуры, сопровождающиеся увеличением основного вещества и незначительной воспалительной реакцией».
T.T. Takamoto (1991) впервые отметил толщину створок как эхокардиографический морфологический признак и разработал критерии миксоматозной дегенерации створок и хорд клапана. Было доказано, что утолщение створок более 4 мм у пациентов с ПМК является его миксоматозной дегенерацией. В последующем Г.И. Сторожаков (1998) разработал классификацию миксоматозной дегенерации митрального клапана у пациентов с ПМК, включающую три степени в зависимости от толщины створок. Известно, что миксоматозной дегенерации могут подвергаться не только створки клапанов, но также фиброзное кольцо и хорды. По данным J.E. Barber и соавт. (2001), в 38% случаев миксоматозная дегенерация митрального клапана распространяется на хордальный аппарат, при этом гистологические изменения в хордах аналогичны таковым в пролабирующих створках. Миксоматозная дегенерация хордального аппарата лежит в основе подклапанного варианта пролабирования створок митрального клапана. Миксоматозная дегенерация более 5 мм является прогностическим признаком, определяющим возникновение митральной регургитации.
Т.С. Гуревич (2009) отмечала признаки миксоматозной дегенерации I степени (от 3 до 5 мм) у 14,7% спортсменов с ПМК, Т.Ф. Перетолчина при этом у 2,8% спортсменов - с захватом и хорд митрального клапана. Удлинение хорд МК было зарегистрировано автором в 21,1% случаев.
Диастолическая функция миокарда при ПМК. По данным Т.С. Гуревич, использующей методику определения диастолической дисфункции миокарда по М.Ю. Лобанову (1999, 2000), у спортсменов с ПМК имеет место достоверное снижение индекса диастазиса: 18,11 ? 1,1 усл.ед. - по сравнению с атлетами без ПМК [29,19?1,2 усл.ед. (p <0,005)].
Это свидетельствует об увеличении «жесткости» функционирования сердечнососудистой системы у пациентов с соединительнотканной дисплазией сердца, когда происходит изменение фазовой структуры диастолы, проявляющееся в большем укорочении диастазиса.
Осложнения при ПМК. В большинстве случаев пролапс митрального клапана протекает благоприятно и только в 2-4% случаев приводит к серьезным осложнениям (Hradec J., 1992). Основными осложнениями первичного пролапса митрального клапана являются острая или хроническая митральная недостаточность, бактериальный эндокардит, тромбоэмболия, жизнеугрожающие аритмии, внезапная смерть.
Частота митральной регургитации при пролапсе митрального клапана колеблется от 42 до 100%. С.Л. Дземешкевич и Л.У. Стивенсон (2000) выделили следующие причины неревматической недостаточности митрального клапана: избыточную площадь створок, расширение фиброзного кольца, удлинение и разрыв хорд. Однако даже в тех случаях, когда имеет место избыточность ткани створок митрального клапана, результаты гистологических исследований свидетельствуют о значительных изменениях с дезорганизацией и дефицитом волокнистых структур, т.е. «минус» ткань.
Митральная регургитация, возникающая при пролабировании створок, ведет к быстрым изменениям конечно-диастолического объема и конечнодиастолического давления в левом предсердии. Значительное и длительное повышение среднего давления в полости левого предсердия и соответственно легочных венах не характерно для данной патологии. В последующем меняется геометрия левого предсердия, развиваются гипертрофия левого желудочка, его дилатация, что может привести к расширению неразвитого фиброзного митрального кольца и объема регургитации.
Хроническая митральная недостаточность у больных с синдромом ПМК является возрастнозависимым феноменом (Murakami H. et al., 1991). Показано, что у взрослых людей в основе митральной недостаточности в 60% случаев лежит пролапс митрального клапана (Luxereau P. et al., 1991). Митральная недостаточность чаще развивается и носит более выраженный характер при преимущественном пролапсе задней створки клапана (Kim S. et al., 1994).
Факторами риска развития «чистой» (невоспалительной) митральной недостаточности при синдроме пролабирования, по данным двухмерной эхокардиографии являются дилатация левого атриовентрикулярного отверстия, пролапс преимущественно задней митральной створки, утолщенность задней митральной створки (Weisman N.J. et al., 1994).
Острая митральная недостаточность возникает из-за отрыва сухожильных нитей от створок митрального клапана (синдром «болтающегося» клапана - «floppy mitral valve»). В детском возрасте она наблюдается казуистически редко; у взрослых людей в основном связана с травмой грудной клетки на фоне миксоматозной дегенерации хорд. При этом возникает легочная венозная гипертензия, обусловленная большим объемом регургитации в недостаточно растяжимое левое предсердие.
Значение пролапса митрального клапана в возникновении инфекционного эндокардита до конца не определено. Принято считать, что абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза. Однако в случаях пролапса митрального клапана без систолического шума риск инфекционного эндокардита почти такой же, как и в общей популяции, - 0,0046%. Частота инфекционного эндокардита у пациентов с пролапсом митрального клапана увеличивается с возрастом, поэтому у детей данный синдром редко является причиной инфекционного эндокардита и встречается с частотой 1 случай на 500 больных.
Наличие измененных створок при ПМК повышает риск развития инфекционного эндокардита, хотя в целом его вероятность в популяции пациентов с ПМК является низкой (Clemens J.D. et al., 1982; Devereux R.B. et al., 1994).
Имеются данные, позволяющие рассматривать миксоматозную дегенерацию створок митрального клапана как фактор риска возникновения бактериального эндокардита при ПМК (Bansal R.C., 1995; Duruck D.T., 1994). В связи с этим обсуждается вопрос о необходимости превентивной антибактериальной терапии у больных с ПМК. При этом большинство исследователей настаивают на ее проведении только у пациентов с повышенным риском возникновения бактериального эндокардита, т.е. при миксоматозной дегенерации створок.
Диагностика инфекционного эндокардита при пролапсе митрального клапана представляет значительные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита имеет клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, спленомегалия и др.), появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Примером осложненного инфекционным эндокардитом течения пролапса митрального клапана может быть случай из практики Т.С. Гуревич (2005).
Спортсмен А., 14 лет, баскетбол. Направлен на ЭхоКГ-обследование из спортивного лагеря, где мальчик перенес ОРВИ, сопровождавшуюся высоким подъемом температуры в течение 2 дней. После литического снижения, несмотря на выраженную слабость, спортсмен приступил к тренировкам. При ЭхоКГ- выраженная дилатация всех камер сердца: левый желудочек - 76,3 мм, левое предсердие - 49,8 мм, правое предсердие - 41,8 мм, правый желудочек - 51 мм. В перикарде в области боковой, задней стенок и верхушки левого желудочка - жидкость (9 мм). Створки митрального клапана выраженно утолщены на концах. Выраженная регургитация в области митрального и трехстворчатого клапанов (соответственно IV и III степени). С диагнозом «инфекционный эндокардит, дилатационная кардиомиопатия (вторичная)» в крайне тяжелом состоянии был госпитализирован (рис. 3-2).
Несмотря на проведенные реанимационные мероприятия, спортсмен умер.
Мозговая эмболия является основной причиной неврологической симптоматики (транзиторные ишемические атаки и инсульты) у пациентов с ПМК, риск эмболии у которых выше, чем в общей популяции (Wilson L.A. et al., 1977; Barnett H.J. et al., 1980).
Внезапная смерть является редким осложнением ПМК (менее 2% случаев при длительном наблюдении, с ежегодной смертностью менее 1%). Основной причиной внезапной смерти при ПМК являются желудочковые тахиаритмии (Vohra J. et al., 1993), в основном при семейных формах ПМК.
Прирост физической работоспособности у лиц с ПМК в процессе занятий спортом ниже, чем в контрольной группе.
Внезапная смерть при ПМК
По данным J. Bourdarias (1991), риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50-100 раз.
В большинстве случаев внезапная смерть у больных с ПМК носит аритмогенный генез и обусловлена внезапным возникновением идиопатической желудочковой тахикардии (фибрилляции), в том числе на фоне синдрома удлиненного интервала Q-T.
В редких случаях в основе внезапной сердечной смерти у пациентов с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу (Nelson-Piercy C. et al., 1990).
Основными факторами риска внезапной смерти у детей с синдромом ПМК являются:
- желудочковые аритмии III-V градации по Lown;
- удлинение корригированного интервала Q-T более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки;
- кардиогенные обморочные состояния в анамнезе.
Определенную роль в развитии нарушений ритма и проводимости при ННСТ могут играть вегетососудистая дистония (ВД) и нарушения баланса электролитов (гипомагниемия, гипокалиемия).
Экспертная оценка. При диагностировании пролапса митрального клапана, в целях прогнозирования возможных кардиологических осложнений, необходимо учитывать следующее.
- Жалобы.
- Фенотипические признаки соединительнотканной дисплазии.
- Нарушения ритма на ЭКГ.
- Наличие дополнительных (ложных) хорд левого желудочка, «балочного» типа (поперечно-базальных, множественных); синдрома ранней реполяризации на ЭКГ. При сочетании этих признаков рекомендовано электрофизиологическое исследование сердца с целью определения дополнительного пути проведения и своевременного выявления тяжелых нарушений ритма.
- Пролабирование створок митрального клапана - более 5 мм.
- Длину створок митрального клапана: более 30 мм - передней и более 20 мм - задней.
- Наличие трех диагностически значимых показателей: индекса длины створок (более 10 мм), диаметра (свыше 30 мм) и показателя прироста растяжения кольца митрального клапана (более 5 мм).
- Миксоматозную дегенерацию створок и подклапанных структур - толщину свыше 5 мм.
- Наличие постоянной митральной регургитации
- Прогностически неблагоприятным признаком в плане возникновения митральной недостаточности и нарушения ритма сердца является миксоматозное перерождение створок. Миксоматозная дегенарация свыше 5 мм является маркером высокого риска для спортсменов.
- Наличие постоянной митральной недостаточности I степени у спортсменов с ПМК является противопоказанием для занятий спортом.
При появлении митральной регургитации в текущих обследованиях спорсмены должны освобождаться от тренировок, дополнительно обследоваться с целью исключения эндокардита и качественно пролечиваться. Лечебные и реабилитационные мероприятия осуществляются в зависимости от результатов обследования. Сохранение митральной регургитации после перечисленных мероприятий является показанием для отстранения от занятий профессиональным спортом.
Для решения вопроса о допуске к занятиям спортом лиц с пролапсом митрального клапана необходим индивидуальный подход с учетом в каждом конкретном случае возраста, специфики вида спорта, спортивной квалификации и спортивного стажа. В отношении детей и подростков необходимо иметь в виду, что прогноз ухудшается при выявлении пролапса митрального клапана в детском возрасте. Особого внимания заслуживают дети высокого роста, занимающиеся такими видами спорта, как баскетбол, волейбол, прыжки в высоту. У них нередко отмечаются признаки дисплазии соединительной ткани (астеническое телосложение, плоская грудная клетка, деформации грудной клетки и др.). В этих случаях необходимо проведение медико-генетических консультаций для исключения наследственной патологии (например, болезни Марфана).
К занятиям нетравмоопасным видом спорта могут быть допущены лица с асимптоматическим, нерезко выраженным (не выше I степени) первичным идиопатическим пролапсом митрального клапана при отсутствии:
- митральной регургитации больше +;
- миксоматозной дегенерации клапанов;
- изменений на ЭКГ (как правило, в отведениях III, aVF);
- ишемии миокарда в ходе велоэргометрического теста;
- патологической реакции на физическую нагрузку;
- экстрасистол (II-V классы при холтеровском мониторировании).
Лицам с ПМК I степени для окончательного решения вопроса допуска к занятиям спортом обязательным является проведение ЭхоКГ, допплер-ЭхоКГ, в отдельных случаях - велоэргометрического теста. Особой экспертной оценке подлежат лица с сочетанными малыми аномалиями сердца, а также с ПМК и синдромом ранней реполяризации. В этих случаях, кроме перечисленных выше методов обследования, рекомендуется проведение холтеровского мониторирования ЭКГ и чреспищеводной эхокардиографии.
Следует иметь в виду также необходимость тщательной санации у лиц с ПМК очагов хронической инфекции (хронический тонзиллит, кариес зубов и др.), а при проведении любых хирургических вмешательств - профилактической антибактериальной терапии, учитывая возможность развития бактериального эндокардита (Гитель И.Б. и др., 1990).
Пролапс трехстворчатого клапана
Данная аномалия реже встречается в изолированном виде, чаще сочетается с пролабированием митральных створок. Т.С. Гуревич (2009) диагностировала ПТК у высококвалифицированных спортсменов в 5,3% случаев при ПМК-I и в 6,1% - при ПМК-II, в то время как у спортсменов без ПМК - только в 1,6%. Наиболее частым осложнением ПТК является недостаточность трехстворчатого клапана.
Недостаточность трехстворчатого клапана, как и митрального, может быть органической или относительной (функциональной). Основными причинами порока трикуспидального клапана и органической регургитации являются: ревматизм; инфекционный эндокардит (особенно у наркоманов); аномалия Эбштейна; идиопатическая миксоматозная дегенерация клапана с пролапсом его створки во время систолы. При ревматизме недостаточность трехстворчатого клапана часто сочетается с его стенозом, а также с митральным или аортальным пороком.
Наличие ПТК и регургитации может давать ложную диагностику повышения систолического давления в легочной артерии. Приклапанная регургитация в области ТК не является патологией, требующей дополнительного обследования.
Экспертная оценка. При отсутствии изменений створок трехстворчатого клапана, подклапанных структур и выраженной регургитации ПТС не является противопоказанием для занятий спортом, однако подобные лица должны быть всесторонне обследованы и за ними устанавливается динамическое наблюдение.
Читайте также
- Медицинское обследование спортсменов
- Прогнозирование состояния здоровья спортсмена
- Пограничные состояния
- Гипертония и спорт (повышенное артериальное давление)
- Гипотония (пониженное артериальное давление)
- Обследование опорно-двигательного аппарата
- Медицинский контроль спортсменов
- Неврологическое обследование спортсменов
- Кардиологическое обследование спортсменов
- Лабораторная диагностика в спорте
- Тестирование общей физической работоспособности
Список литературы
- Автандилов А.Г. Значение информационных характеристик эхокардиографических параметров при диагностике нейроциркуляторной дистонии и гипертонической болезни в подростковом возрасте // Кардиология. - 1998. - № 6. - С. 55-57.
- Белозеров Ю.М., Болбиков В.В. Ультразвуковая семиотика и диагностика в кардиологии детского возраста. - М.: Медпресс, 2001.- 172 с.
- Бобров А.Л., Бойцов С.А., Темнов А.Н. Электро- и эхокардиографические особенности синдрома ранней реполяризации желудочков // Сердечная недостаточность. - 2002. - № 4. - С. 565-569.
- Бобров А.Л., Шуленин С.Н. Новая классификация синдрома ранней реполяризации желудочков: клиническое значение и применение // Кардиология СНГ. - 2006. - Т. 4. - № 1. - С. 123.
- Бова А.А. Малые аномалии сердца (клиническое значение, диагностика, осложнения): Инструкция по применению / А.А. Бова, Е.Л. Трисветова. - Минск: БГМУ, 2001. - 16 с.
- Бутченко Л.А., Веневцева Ю.Л., Бутченко В.Л. Синдром преждевременной реполяризации желудочков сердца у спортсменов // Теория и практика физической культуры. - 1983. - № 12. - С. 16-17.
- Воскресенская С.Е. Особенности артериальной гипотензии при дисплазии соединительной ткани: Автореф. дис. ? канд. мед. наук / С.Е. Воскресенская. - Омск, 1999. - 23 с.
- Воробьев Л.П., Грибкова И.Н., Петрусенко Н.М. и др. Взаимоотношения синдрома ранней реполяризации желудочков, пролапса митрального клапана и добавочных хорд левого желудочка // Кардиология. - 1991. - Т. 31. - № 9. - С. 106-108.
- Гитель И.Б., Коган-Ясный В.В., Ромм Н.В. Синдром пролабирования митрального клапана во врачебно-спортивной практике: Сб. науч. тр. «Клинические аспекты спортивной медицины». - М., 1990. - С. 3-22.
- Граевская Н.Д., Долматова Т.И. Спортивная медицина. - М.: Советский спорт, 2004. - 358 с.
- Дембо А.Г., Земцовский Э.В. Спортивная кардиология. - Ленинград: Медицина, 1989. - 461 с.
- Дисплазия соединительной ткани: Материалы симпозиума. Омск, 1 ноября 2002 г. / Под ред. Г.И. Нечаевой. - Омск, 2002. - 167 с.
- Земцовский Э.В. Соединительнотканные дисплазии сердца. - СПб.: Политекс, 2000.- 95 с.
- Земцовский Э.В Диспластические синдромы. Диспластическое сердце. - СПб.: Ольга, 2007. - 80 с.
- Кадурина Т.И. Наследственные коллагенопатии: клиника, диагностика, лечение, диспансеризация. - СПб.: Невский диалект, 2000. - 270 с.
- Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани. - СПб.: Элби, 2009. - 702 с.
- Клеменов А.В. Недифференцированная дисплазия соединительной ткани: клинические проявления, возможности диагностики и патогенетического лечения. - М.: Медицина, 2005. - 136 с.
- Майкели Л., Дженинкс М. Энциклопедия спортивной медицины. - Спб.: Лань, 1997. - 301 с.
- Макарова Г.А. Спортивная медицина. - М.: Советский спорт, 2003. - 478 с.
- Макарова Г.А. Справочник детского спортивного врача: клинические аспекты. - М.: Советский спорт, 2008. - 437 с.
- Мутафьян О.А. Малые аномалии сердца у детей и подростков. - СПб.: Издательский дом МАПО, 2005. - 479 с.
- Наследственные нарушения соединительной ткани. Российские рекомендации комитета экспертов Всероссийского научного общества кардиологов. -М., 2009. - 65 с.
- Онищенко Е.Ф., Крашенинникова Н.В. Пролонгированная инфузионная контрастная эхокардиография с перекисью водорода: Учебное пособие. - СПб.: МАПО. - 2001. - С. 28.
- Орджоникидзе З.Г., Павлов В.И. Гипертония и физическая активность // Медицина и спорт. - 2005. - № 1. - С. 15-16.
- Павлов В.И., Орджоникидзе З.Г., Дружинин А.Е., Иванова Ю.М. Особенности ЭКГ спортс мена // Функциональная диагностика. - 2005. - № 4. - С. 65-74.
- Скоробогатый А.М. Синдром ранней реполяризации желудочков // Кардиология. - 1986. - Т. 26. - № 11. - С. 89-94.
- Смоленский А.В., Михайлова А.В. Дисплазия соединительной ткани сердца (часть 1) // Медицина и спорт. - 2005. - № 4. - С. 31-32.
- Смоленский А.В., Михайлова А.В. Дисплазия соединительной ткани сердца (часть 2) // Медицина и спорт. - 2005. - № 5-6. - С. 46-47.
- Филявич А.Е. Электрокардиографический атлас спортсмена / А.Е. Филявич. - Кишинев: Штиинца, 1982. - 104 с.
- Хрущев С.В. Спортивное сердце (исторический очерк) // Физкультура в профилактике, лечении и реабилитации. - 2008. - № 2 (25). - С. 55-64.
- Циммерман Ф. Клиническая электрокардиография. - СПб.: Бином, 1998. - 448 с.
- Шиллер Н., Осипов М.А. Клиническая эхокардиография. - М.: Практика, 2005. - 344 с.
- Boitsov S., Bobrov A. Correlations between connective tissue dysplasia and early repolarization syndrome // Eur. Heart J. - Vol. 24. - Abstr. Suppl. - September, 2003. - P. 49.
- Вoudoulas H., Wooley C.F. Mitral Valve: Floppy Mitral Valve, Mitral Valve Prolapse, Mitral Valve Regurgitation. - NY. Futura Publishing Company, 2000. - P. 753.
- Corrado et al. Cardiovascular pre-participation screening of young competitive athletes for prevention of sudden death: proposal for a common European protocol. Consensus Statement of the Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology // Eur. Heart J. - 2005. - Vol. 26. - P. 516-524.
- Corrado D., Biffi A., Basso C., Pelliccia A., Thiene G. 12-lead ECG in the athlete: physiological versus pathological abnormalities // BJSM. - 2009. - Vol. 43. - P. 669-676.
- Dalen J.E. Are patients with a patent foramen ovale at increased risk of stroke? A billion dollar question // Am. J. Med. - 2007. - Vol. 120. - P. 472-474.
- Fagard R. Athlete?s heart // Heart. - 2003. - Vol. 89. - P. 1455-1461.
- Maisch B., Seferovic P.M., Ristic A.D. et al. Task Force on the Diagnosis and Management of Pricardial Diseases of the European Society of Cardiology. Guidelines on the diagnosis and management of pericardial diseases executive summary; The task force on the diagnosis and management of pericardial diseases of the European Society of Cardiology // Eur. Heart J. - 2004. - Vol. 25. - Suppl. 7. - P. 587-610.
- Maron B.J., Chaitman B.R., Ackerman M.J. et. al. Recommendations for physical activity and recreational sports participation for young patients with genetic cardiovascular diseases // Circulation. - 2004, Jun. 8. - Vol. 109. - Suppl. 22. - P. 2807-2816.
- Pelliccia A. The athlete?s heart: remodeling, electrocardiogram and preparticipation screening /
- A. Pelliccia, F.M. Di Paolo, B.J. Maron // Cardiol. Rev. - 2002. - Vol. 10. - P. 85-90.
- Poh K.K., Low A., Tan H.C., Chia B.L. Early repolarization pattern occurring with the Wolff- Parkinson-White syndrome // Asian Cardiovasc. Thorac. Ann. - 2003. - Vol. 11. - Suppl. 3. - P. 263-265.
- Rosamond W., Flegal K., Furie K. et al. Heart disease and stroke statistics - 2008 update: A report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee // Circulation. - 2008. - Vol. 117. - P. 25-146.
- 36th Bethesda Conference Eligibility Recommendations for Competetive Athletes with Cardiovascular Abnormalities // J. Am. Coll. Cardiol. - 2005. - Vol. 45. - P. 8.