Ванкомицин
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Ванкомицин
Историческая справка
Ванкомицин — антибиотик, вырабатываемый Streptomyces orientalis. Этот представитель актиномицетов был выделен из почвы, взятой в Индонезии и Индии. Другой гликопептидный антибиотик, тейкопланин, применяют только в Европе (Bemareggi et al., 1992; Biavasco et al., 1997). Новые гликопептиды даптомицин и оритаванцин в настоящее время проходят испытания.
Химические свойства
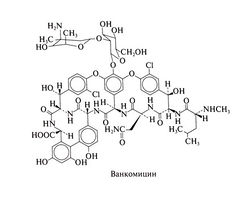
Ванкомицин представляет собой сложный по строению трициклический гликопептид с молекулярной массой около 1500. Его химическая формула была определена с помощью рентгеноструктурного анализа (Sheldrick et al., 1978):
Антимикробная активность
Ванкомицин действует в основном на грамположительные бактерии. Штаммы считаются чувствительными, если МПК для них < 4 мкг/мл. Для Staphylococcus aureus и Staphylococcus epidermidis, включая метициллиноустойчивые штаммы, МПК обычно составляет 1—4 мкг/мл. Выделены умеренно устойчивые к ванкомицину (МПК 8 мкг/мл) штаммы Staphylococcus aureus (Hiramatsu et al., 1997; Sieradzki et al., 1999a; Smith et al., 1999) и других стафилококков (Schwalbe et al., 1987; Del’ Alamo et al., 1999; Garrett et al., 1999). Поданным клинических и экспериментальных исследований, инфекции, вызванные этими штаммами, не поддаются лечению ванкомицином (Climo et al., 1999). Такие штаммы устойчивы также к метициллину и ко многим другим антибиотикам. Устойчивые к ванкомицину штаммы стафилококков представляют большую опасность, ведь прежде ванкомицин был единственным антибиотиком, к которому эти микроорганизмы всегда оставались чувствительными. К ванкомицину были раньше чувствительны и все штаммы энтерококков. Теперь же устойчивые к ванкомицину энтерококки, в первую очередь Enterococcus faecium, стали основными возбудителями больничных инфекций в США (Murray, 2000). У Enterococcus faecium и Enterococcus faecalis гены, кодирующие устойчивость к ванкомицину, расположены в транспозоне, который входит в состав трансмиссивной плазмиды. Поэтому устойчивость может легко распространяться среди энтерококков, а возможно, и среди других грамположительных бактерий (Walsh, 1993; Arthur and Courvalin, 1993). На устойчивые к ванкомицину штаммы энтерококков обычно не действуют и многие другие антибиотики, в том числе стрептомицин, гентамицин и ампициллин, которые, таким образом, постепенно теряют свою ценность как препараты второго ряда для лечения энтерококковых инфекций. Особую тревогу вызывает распространение устойчивости к стрептомицину и гентамицину, поскольку комбинация аминогликозида и препарата, подавляющего синтез клеточной стенки, — единственный способ добиться бактерицидного эффекта в отношении энтерококков.
К ванкомицину чувствительны Streptococcus pyogenes, Streptococcus pneumoniae и зеленящие стрептококки. Рост Corynebacterium spp. подавляется при концентрации препарата менее 0,04—3,1 мкг/мл. Для большинства видов Actinomyces МПК равна 5—10 мкг/мл, а для Clostridium spp. — 0,39—6 мкг/мл. Почти все микобактерии и грамотрицательные палочки устойчивы к ванкомицину (Cunha and Ristuccia, 1983).
Механизм действия и устойчивость
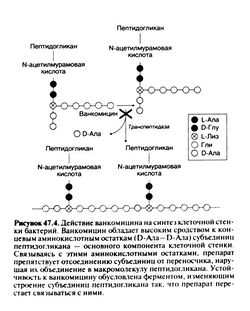
Ванкомицин угнетает синтез клеточной стенки, связываясь с концевыми аминокислотными остатками (D-Ала—D-Ала) субъединиц пептидогликана — основного компонента клеточной стенки (рис. 47.4). На делящиеся бактерии препарат действует бактерицидно.
Устойчивость энтерококков к ванкомицину обусловлена заменой D-Ала—D-Ала на D-Ала—D-лактат или D-Ала—D-Сер (Walsh, 1993; Arias et al., 2000). С измененными аминокислотными остатками ванкомицин не об разует водородной связи. Замена аминокислотных остатков происходит с участием нескольких ферментов кодируемых кластером генов van.
Описаны несколько типов устойчивости энтерококков к ванкомицину. Штаммы с фенотипом Van А устойчивы как к ванкомицину, так и к тейкопланину. Этот тип устойчивости характерен для Enterococcus faecium и Enterococcus faecalis и индуцируется самими антибиотиками. У штаммов с фенотипом Van В устойчивость индуцируется ванкомицином (но не тейкопланином), поэтому многие штаммы остаются чувствительными к тейкопланину. Этот тип устойчивости тоже обнаружен у Enterococcus faecium и Enterococcus faecalis. Штаммы с фенотипом Van С конститутивно устойчивы только к ванкомицину. Этот тип устойчивости имеет наименьшее клиническое значение, хуже всех изучен и встречается только у Enterococcus faecalis и Enterococcus faecium. Описаны также фенотипы Van D и Van Е (возможно, будут обнару. жены и другие фенотипы). Генетические и биохимические механизмы устойчивости стафилококков к ванкомицину изучены плохо. Известно, что в развитии устойчивости участвуют несколько генов, в которых должна произойти не одна мутация. Многие из этих генов кодируют ферменты, участвующие в синтезе клеточной стенки (Hanaki et al., 1998; Sieradzki and Tomasz 1999; Sieradzki et al., 1999b).
Фармакокинетика
Ванкомицин плохо всасывается при приеме внутрь и в значительном количестве выводится с калом. Препарат не следует вводить в/м, только в/в. Через 1 ч после окончания часовой или двухчасовой инфузии в дозе 1 г сывороточная концентрация препарата составляет 15—30 мкг/мл. Т1/2 составляет примерно 6 ч (Matzke et al., 1986). Около 30% ванкомицина связывается с белками плазмы. Препарат проникает в биологические жидкости, в том числе в СМЖ, желчь, плевральный и перикардиальный выпот, синовиальную и асцитическую жидкость (Levine, 1987). При воспалении мозговых оболочек концентрация ванкомицина в СМЖ составляет 7—30% сывороточной. Примерно 90% введенной дозы выводится почками путем клубочковой фильтрации. При почечной недостаточности препарат накапливается, поэтому дозу необходимо снижать (Moellering et al., 1981), Ванкомицин быстро выводится при гемодиализе через высокопроницаемую мембрану (Lanese et al., 1989; Quale et al., 1992).
Применение
Для в/в введения ванкомицин выпускают в виде стерильного порошка для приготовления инъекционного раствора. Во избежание побочных эффектов (см. ниже) длительность инфузии должна быть не менее 1 ч. Суточная доза для взрослых составляет 30 мг/кг; ее разделяют на 2—4 введения. При менингите препарат назначают в дозе 60 мг/кг/сут; суточную дозу разделяют на 4 введения (Quagliarello and Scheld, 1997). У больных с нормальной функцией почек средняя сывороточная концентрация в стационарном состоянии составляет около 15 мкг/мл (Moellering et al., 1981). По поводу терапевтического диапазона ванкомицина единого мнения нет, как правило, рекомендуемая минимальная сывороточная концентрация равна 5—15 мкг/мл. За максимальной сывороточной концентрацией обычно не следят из-за длительной стадии распределения препарата. Однако для избежание ототоксического действия эта концентрация не должна превышать 60 мкг/мл.
у детей насыщающая доза составляет 15 мг/кг. Далее препарат вводят в следующих дозах (в зависимости от возраста): новорожденным на первой неделе жизни —10 мг/кг каждые 12 ч, детям в возрасте от 8 сут до месяца — 10 мг/кг каждые 8 ч, детям постарше — 10 мг/кг каждые 61 (Schaad et al., 1980). При почечной недостаточности дозу снижают (Приложение II). Препарат можно применять у больных с нефункционирующими почками (находящихся на диализе); доза составляет 1 г (около 15 мг/кг) 1 раз в неделю.
При псевдомембранозном колите ванкомицин назначают внутрь (препарат выбора при этом заболевании — метронидазол): взрослым — 125—250 мг каждые 6 ч, детям — 40 мг/кг/сут в 3—4 приема. Для приема внутрь ванкомицин выпускают в виде капсул и раствора.
Ванкомицин следует назначать только при тяжелых инфекциях. Особенно это касается инфекций, вызванных метициллиноустойчивыми стафилококками (пневмония, эмпиема плевры, эндокардит, остеомиелит, абсцессы мягких тканей), а также тяжелых стафилококковых инфекций у больных с аллергией к пенициллинам и цефалоспоринам (Geraci, 1977). Однако бактерицидное действие ванкомицина слабее, чем у любого из бета-лактамных антибиотиков, активных в отношении стафилококков (таких, как нафциллин или цефазолин), поэтому его клиническая эффективность может быть ниже (Levine et al., 1991; Small and Chambers, 1990). Ванкомицин эффективен и удобен в применении при стафилококковой бактериемии и инфицировании артериовенозных шунтов у больных с ХПН, находящихся на гемодиализе или перитонеальном диализе, поскольку препарат можно вводить 1 раз в неделю или добавлять в диализирующий раствор. В ряде случаев при инфекциях ЦНС, не поддающихся лечению ванкомицином в/в, применяли внутрижелудочковое введение препарата через шунт или резервуар Оммайя (Visconti and Peter, 1979; Sutherland et al., 1981).
Ванкомицин применяют при эндокардите, вызванном зеленящими стрептококками, у больных с аллергией к пенициллинам. При энтерококковом эндокардите у больных с тяжелой аллергией к пенициллинам ванкомицин комбинируют с аминогликозидами. Ванкомицин эффективен при лечении инфекций, вызванных Flavobacterium spp. и Corynebacterium spp. Кроме того, его успешно применяют в тех случаях, когда известно или предполагается, что инфекция вызвана пенициллиноустойчивыми штаммами пневмококков (Friedland and McCracken, 1994).
Побочные эффекты
Из аллергических реакций наблюдаются пятнистая сыпь и анафилактический шок. Флебит и боль в месте венепункции встречаются нечасто. Возможны озноб и лихорадка. При быстром введении иногда возникает анафилактоидная реакция, проявляющаяся покраснением лица, шеи и верхней части туловища, крапивницей, тахикардией и артериальной гипотонией. Из-за сильного покраснения кожи этот побочный эффект получил название «синдрома краснокожего» (Newfield and Roizen, 1979; Davis etal., 1986).
Ванкомицин может вызвать нарушение слуха, которое нередко (хотя и не всегда) носит стойкий характер. Ототоксическое действие развивается при высокой сывороточной концентрации препарата (60—100 мкг/мл). Раньше ванкомицин часто оказывал нефротоксическое действие (вероятно, из-за неправильного подбора дозы). Теперь этот побочный эффект встречается редко, поскольку дозу подбирают в соответствии с функцией почек и следят за концентрацией препарата в крови. Особую осторожность следует соблюдать при одновременном назначении других ототоксичных или нефротоксичных препаратов, например аминогликозидов (Farberand Moellering, 1983).