Цефалоспорины
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Цефалоспорины
Историческая справка
Источники. Плесневой гриб Cephalosporium acremonium — первый источник цефалоспоринов — был выделен итальянским ученым Бротцу в 1948 г. из загрязненной сточными водами морской воды на побережье Сардинии. Под действием неочищенного фильтрата из колоний этого гриба рост Staphylococcus aureus in vitro замедлялся, а больные стафилококковыми инфекциями и брюшным тифом выздоравливали. В питательной среде, в которой рос Cephalosporium acremonium, обнаружили три антибиотика — цефалоспорины Р, N и С. Выделив основу цефалоспорина С — 7-аминоцефалоспорановую кислоту — и присоединяя к ней различные боковые радикалы, удалось получить полусинтетические препараты, активность которых была намного выше, чем у их предшественников.
Химические свойства
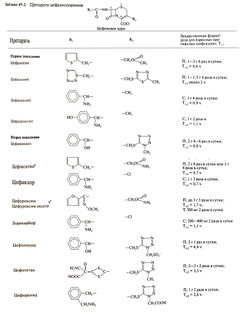
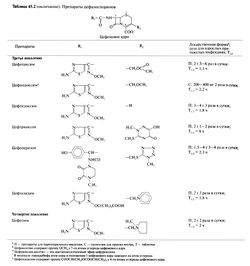
Цефалоспорин С содержит боковой радикал — производное D-a-аминоадипиновой кислоты, — который соединен с дигидротиазиновым β-лактамным кольцом (7-аминоцефалоспорановой кислотой). Последняя придает препаратам относительную стабильность в слабокислой среде и высокую устойчивость к пенициллиназе независимо от сродства к этому ферменту и строения бокового радикала.
В кислой среде цефалоспорин С гидролизуется до 7-аминоцефалоспорановой кислоты. Все полусинтетические цефалоспорины были получены путем присоединения к этой кислоте различных боковых радикалов. От строения бокового радикала у 7-го атома углерода р-лактамного кольца зависит антибактериальная активность препаратов, а от бокового радикала у 3-го атома углерода — особенности их фармакокинетики.
Цефотетан, цефокситин, цефметазол содержат метоксильную фуппу при 7-м атоме углерода р-лактамного кольца. Химические формулы цефалоспоринов приведены в табл. 45.2.
Механизм действия
Подобно пенициллинам, цефалоспорины ингибируют синтез клеточной стенки.
Классификация
За последние 10 лет получено множество новых цефалоспоринов, и классификация их еще не завершена. Цефалоспорины можно разделить по химическому строению, фармакологическим свойствам, устойчивости к β-лакгамазам или антимикробному спектру. По поколениям эти препараты распределены в какой-то степени случайно, тем не менее эта классификация оказалась наиболее удобной и получила широкое распространение (табл. 45.3).
В основе классификации по поколениям лежит антимикробная активность препаратов (Karchmer, 2000). Цефалоспорины первого поколения (цефазолин, цефалотин)
Препараты цефалоспоринов обладают высокой активностью в отношении грамположительных и несколько меньшей — в отношении грамотрицательных бактерий. К этим препаратам чувствительны большинство грамположительных кокков (кроме энтерококков, Staphylococcus epidermidis и метициллиноустойчивых штаммов Staphylococcus aureus). За исключением Bacteroidesspp., к цефалоспоринам чувствительны анаэробы ротовой полости. Цефазолин и цефалотин довольно активны в отношении Moraxella catarrhalis, Escherichia coli, Klebsiella pneumoniae и Proteus mirabilis.
Активность цефалоспоринов второго поколения в отношении грамотрицательных бактерий несколько выше, но не достигает таковой у препаратов третьего поколения. Так, цефалоспорины второго поколения цефокситин, цефотетан и цефметазол действуют и на Bacteroides spp. Препараты третьего поколения слабее цефазолинаи цефалотина в отношении грамположительных кокков, но намного активнее в отношении энтеробактерий, в том числе штаммов, вырабатывающих β-лактамазы. Цефтазидим и цефоперазон активны и в отношении Pseudomonas aeruginosa, но по действию на грамположительные кокки они уступают другим цефалоспоринам третьего поколения (Donowitzand Mandell, 1988). По сравнению с препаратами третьего поколения у цефалоспоринов четвертого поколения (например, цефепима) шире спектр действия и выше устойчивость к гидролизу β-лактамазами, кодируемыми как хромосомными, так и плазмидными генами. Препараты четвертого поколения могут оказаться весьма эффективными при лечении инфекций, вызванных устойчивыми к цефалоспоринам третьего поколения аэробными грамотрицательными палочками.
Механизмы устойчивости бактерий к цефалоспоринам
Таких механизмов три: один препятствует проникновению антибиотика к месту действия, другой связан с изменением пенициллин-связываюших белков (мишени цефалоспоринов), при котором снижается их сродство к препаратам. Наконец, цефалоспорины разрушаются β-лактамазами. Чтобы пневмококки стали устойчивыми к цефалоспоринам третьего поколения, достаточно лишь изменения двух пенициллинсвязывающих белков — 1А и 2Х. Остальные три пенициллинсвязывающих белка пневмококков изначально обладают низким сродством к цефалоспоринам (Spratt, 1994).
Среди всех механизмов устойчивости к цефалоспоринам преобладает их разрушение β-лактамазами. Как уже говорилось, многие грамположительные бактерии выделяют достаточно большие количества этих ферментов. Грамотрицательные бактерии выделяют меньше β-лактамаз, но последние накапливаются в периплазматическом пространстве, а так как мишени цефалоспоринов находятся на поверхности цитоплазматической мембраны бактериальной клетки, то эти препараты, подобно пенициллинам, больше подвержены разрушению β-лактамазами именно грамотрицательных бактерий. Однако чувствительность цефалоспоринов к β-лактамазам неодинакова. Так, цефазолин легче разрушается β-лактамазами Staphylococcus aureus, чем цефалотин. Цефокситин, цефуроксим и цефалоспорины третьего поколения более устойчивы к гидролизу β-лактамазами грамотрицательных бактерий, чем препараты первого поколения. Цефалоспорины третьего поколения чувствительны к индуцируемым β-лактамазам (тип I), кодируемым хромосомными генами. Когда инфекции, вызванные аэробными грамотрицательными палочками (особенно Enterobacter spp., Citrobacter freundii, Morganella spp., Serratia spp., Providencia spp. и Pseudomonas aeruginosa), начинают лечить цефалоспоринами второго или третьего поколений или имипенемом/цилстатином, то вызванная этими препаратами индукция β-лактамаз типа 1 может привести к устойчивости ко всем цефалоспоринам третьего поколения. По сравнению с препаратами третьего поколения цефалоспорины четвертого поколения (например, цефепим) в меньшей степени индуцируют β-лактамазы типа 1 и более устойчивы к этим ферментам.
Важно помнить, что цефалоспорины не действуют на пенициллиноустойчивые Streptococcus pneumoniae; метициллиноустойчивые Staphylococcus aureus. Staphylococcus epidermidis и другие коагулазаотрицательные стафилококки: Enterococcus spp., Listeria monocytogenes, Legionella pneumophila, Legionella micdadei, Clostridium difficile, Stenotrophomonas maltophi-lia, Campylobacter jejuni и Acinetobacter spp.
Общие свойства цефалоспоринов
Цефалексин, цефрадин, цефаклор, цефадроксил, лоракарбеф, цефпрозил, цефиксим, цефподоксим, цефтибутен и цефуроксим аксетил хорошо всасываются из ЖКТ, и их можно назначать внутрь. В/м инъекции цефалотина и цефапирина болезненны, поэтому их чаще назначают в/в. Другие препараты можно вводить и в/м, и в/в.
Цефалоспорины выводятся главным образом почками, поэтому больным с почечной недостаточностью назначают меньшую дозу. Пробенецид угнетает канальцевую секрецию большинства цефалоспоринов. Исключение составляют цефпирамид и цефоперазон — они элиминируются в основном с желчью. Цефалотин, цефапи-рин и цефотаксим в организме подвергаются деацетили-рованию; их производные обладают меньшей антимикробной активностью, чем исходные препараты, и также выводятся почками. Другие цефалоспорины, по-видимому, выводятся в неизмененном виде.
Цефуроксим, цефотаксим, цефтриаксон, цефепим и цефтизоксим в достаточных концентрациях поступают в СМЖ, поэтому их используют для лечения менингита (см. ниже). Цефалоспорины проходят через плацентарный барьер и в высоких концентрациях накапливаются в синовиальной и перикардиальной жидкостях. При системном применении цефалоспорины третьего поколения довольно хорошо проникают в водянистую влагу и с трудом — в стекловидное тело. Все же, по некоторым данным, этих концентраций достаточно для лечения глазных инфекций, вызванных грамположительными и некоторыми грамотрицательными бактериями. Высокие концентрации цефалоспоринов, особенно цефоперазона и цефпирамида, обнаруживают в желчи.
Таблица 45.3. Классификация цефалоспоринов по поколениям
|
Поколение |
Представители |
Спектр действия" |
|
Первое |
Цефазолин Цефалотин Цефалексин |
Streptococcus spp.; Staphylococcus aureus" |
|
Второе |
Цефуроксим Цефаклор |
Escherichia coli, Klebsiella spp., Proteus spp., Haemophilus influenzae, Moraxella catarrhalis. По сравнению с препаратами первого поколения менее активны в отношении грамположительных бактерий |
|
Цефокситин Цефотетан |
Уступают цефуроксиму по активности в отношении Staphylococcus aureus, но активнее последнего в отношении Bacteroides fragilis и других Bacteroides spp. | |
|
Третье |
Цефотаксим Цефтриаксон Цефтазидим |
Энтеробактерии; Pseudomonas aeruginosa; Serratia spp.; Neisseria gonorrhoeae. По действию на Staphylococcus aureus, Streptococcus pneumoniae и Streptococcus pyogenes сходны с препаратами первого поколения. Слабее цефокситина и цефотетана действуют на Bacteroides spp. |
|
Четвертое |
Цефепим |
По антимикробному спектру близок к препаратам третьего поколения, но обладает большей устойчивостью к некоторым бета-лактамазам |
Отдельные препараты
Цефалоспорины первого поколения
Цефалотин плохо всасывается при приеме внутрь, и его вводят только парентерально. В/м инъекции болезненны, поэтому чаще препарат вводят в/в. Так как из всех цефалоспоринов цефалотин наиболее устойчив к бета-лактамазам стафилококков, то его с успехом применяют при тяжелых стафилококковых инфекциях, например при инфекционном эндокардите.
Антимикробный спектр цефазолина сходен с таковым у цефалотина, но цефазолин активнее в отношении Escherichia coli и Klebsiella spp. и несколько более чувствителен к стафилококковым β-лактамазам. Как в/м, так и в/в введение цефазолина хорошо переносится, а сывороточная концентрация препарата при в/м (64 мкг/мл при дозе 1 г) или в/в введении выше, чем у цефалотина. Т1/2 также заметно больше — 1,8 ч. Почечный клиренс цефазолина меньше, чем цефалотина, — вероятно потому, что выведение цефазолина происходит путем клубочковой фильтрации, а цефалотина — и клубочковой фильтрации, и канальцевой секреции. Цефазолин примерно на 85% связывается с белками плазмы. Благодаря большому Т1/2 цефазолин можно вводить реже, чем другие цефалоспорины первого поколения, поэтому его используют чаше других.
Цефалексин выпускают для приема внутрь. Его антимикробный спектр такой же, как у других препаратов первого поколения, но активность в отношении стафилококков, вырабатывающих пенициллиназу, несколько ниже. При приеме внутрь 0,5 г цефалексина максимальная сывороточная концентрация составляет 16 мкг/мл. Этого достаточно для подавления роста многих чувствительных к цефалотину грамположительных и грамотрицательных бактерий. Цефалексин выводится в неизмененном виде, на 70—100% — путем почечной экскреции.
Цефрадин сходен с цефалексином по строению и активности in vitro. Цефрадин быстро всасывается из ЖКТ и выводится с мочой в неизмененном виде. Назначают его внутрь, в/м или в/в. При приеме внутрь цефрадин по действию практически неотличим от цефалексина; некоторые специалисты считают эти препараты взаимозаменяемыми. Благодаря хорошему всасыванию сывороточные концентрации цефрадина при приеме внутрь и в/м введении почти одинаковы.
Цефадроксил отличается от цефалексина наличием дополнительной гидроксильной группы в составе бокового радикала. Концентрации цефадроксила в плазме и моче несколько выше, чем цефалексина. Препарат можно назначать внутрь I —2 раза в сутки для лечения инфекций мочевых путей. По активности in vitro он напоминает цефалексин.
Цефалоспорины второго поколения
Цефамандол обладает большей активностью в отношении некоторых видов грамотрицательных бактерий, чем цефалоспорины первого поколения.
В состав препарата входит N-метилтиотетразольная группа (у 3-го атома углерода β-лактамного кольца), поэтому употребление алкоголя на фоне лечения цефамандолом может вызвать антабусную реакцию. Кроме того, подавляя образование активной формы витамина К, цефамандол приводит к гипопротомбинемии. Спектр действия цефамандола и других цефалоспоринов второго поколения шире, чем у препаратов первого поколения, и включает Enterobacterspp., индол положительные Proteus spp. и Klebsiella spp. Штаммы Haemophilus influenzae, содержащие β-лактамазы типа ТЕМ-1, кодируемые плазмидными генами, устойчивы к цефамандолу. Т1/2 составляет 45 мин; препарат в неизмененном виде выводится с мочой При в/м введении 1 г цефамандола его сывороточная концентрация достигает 20—36 мкг/мл.
Цефокситин вырабатывается Streptomyces lactamdurans. Препарат устойчив к некоторым р-лактамазам грамотрицательных бактерий (Barradell and Bryson, 1994). Цефокситин активнее цефалотина в отношении ряда грамотрицательных микроорганизмов, хотя и слабее, чем цефамандол, действует на Enterobac-ter spp. и Haemophilus influenzae. Цефокситин менее активен в отношении грамположительных бактерий, чем цефамандол и цефалоспорины первого поколения. Среди цефалоспоринов первого и второго поколений (кроме цефотетана) цефокситин обладает наибольшей активностью в отношении анаэробов, особенно Bacteroides fragilis (Appleman et al., 1991). При в/м введении 1 г препарата его сывороточная концентрация достигает 22 мкг/мл. Т1/2 — около 40 мин. Цефокситин применяют главным образом для лечения некоторых анаэробных и смешанных -аэробных и анаэробных — инфекций, в том числе воспалительных заболеваний матки и придатков и абсцесса легкого (Sutter and Finegold, 1975; Bach etal., 1977; Chow and Bednorz, 1978).
Цефаклор принимают внутрь. При приеме внутрь одинаковых доз цефалексина и цефаклора сывороточная концентрация цефаклора в 2 раза ниже, однако он более активен в отношении Haemophilus influenzae и Moraxella catarrhalis (хотя среди них встречаются штаммы, устойчивые к этому препарату за счет выработки β-лактамаз; Joigensen et al., 1990).
Лоракарбеф также принимают внутрь. По активности он напоминает цефаклор, но более устойчив к некоторым β-лактамазам (Jorgensen et al., 1990). Т1/2 равен 1,1ч.
Цефуроксим по строению и антимикробной активности in vitro близок к цефамандолу (Smith and LeFrock, 1983), но, в отличие от него, менее токсичен, так как не содержит N-метилти-отетразольной группы. Кроме того, цефуроксим немного более устойчив к β-лактамазам. Т1/2 у него больше, чем у цефамандола (1,7 и 0,8 ч соответственно), таким образом, препарат достаточно назначать 3 раза в сутки. Концентрация цефуроксима в СМЖ составляет около 10% сывороточной, поэтому он эффективен (хотя уступает цефтриаксону) при лечении менингита, вызванного Haemophilus influenzae (включая штаммы, устойчивые к ампициллину), Neisseria meningitidis и Streptococcus pneumoniae (Schaad et al., 1990).
Цефуроксим аксетил — это ацетилоксиэтиловый эфир цефуроксима. При приеме внутрь всасывается 30—50% препарата, затем он гидролизуется с образованием цефуроксима. Сывороточная концентрация непостоянна.
Антимикробная активность цефоницида in vitro сходна с таковой цефамандола. Т1/2 — около 4 ч. При некоторых инфекциях, вызванных чувствительными микроорганизмами, цефони-цид достаточно принимать 1 раз в сутки (Gremillion etal., 1983).
Цефотетан, подобно цефокситину, высокоактивен в отношении Bacteroides fragilis и ряда других представителей рода Bacteroides. Он немного сильнее цефокситина действует на грамотрицательных аэробов. При в/м введении 1 г цефотетана максимальная сывороточная концентрация составляет в среднем 70 мкг/мл. Т1/2 равен 3,3 ч (Phillips etal., 1983; Wexlerand Finegold, 1988). У истощенных больных лечение цефотетаном может вызвать гипопротромбинемию и кровотечения — побочный эффект, связанный с наличием N-метилтиотетразольной группы. Этого можно избежать, назначая цефотетан в сочетании с витамином К.
Цефоранид по строению и антибактериальному спектру напоминает цефамандол, но менее активен в отношении некоторых штаммов Haemophilus influenzae (Barriere and Mills, 1982) T1/2 цефоранида — около 2,6 ч, поэтому назначают его в/м им в/в 2 раза в сутки.
Цефпрозил — препарат для приема внутрь, который по срав нению с цефалоспоринам и первого поколения более активен отношении пенициллиночувствительных стрептококков, Esch erichia coli, Proteus mirabilis, Klebsiella spp. и Citrobacterspp. T, цефпрозила составляет 1,2—1,4 ч (Barriere, 1992).
Цефалоспорины третьего поколения
Цефотаксим обладает выраженной устойчивостью ко многим бактериальным β-лактамазам (кроме ферментов расширенного спектра действия) и высокоактивен в отношении многих грамположительных и грамотрицательных аэробных бактерий. Однако по сравнению с клиндамицином и метронидазолом на Bacteroides fragilis он действует слабо (Neu et al., 1979). Т1/2 цефотаксима — около 1 ч, поэтому при тяжелых инфекциях препарат вводят в/в от 3 до 6 раз в сутки. В организме цефотаксим превращается в дезацетилце-фотаксим, активность которого в отношении большинства бактерий меньше, чем у исходного препарата. Однако дезацетилцефотаксим способен усиливать действие цефотаксима на некоторые микроорганизмы (Neu, 1982). Цефотаксим успешно применяют при менингите, вызванном Haemophilus influenzae, пенициллиночувствительными Streptococcus pneumoniae, Neisseria meningitidis (Landesman etal., 1981; Cherubin etal., 1982; Mul-laney and John, 1983).
По спектру действия in vitro цефтизоксим очень близок к цефотаксиму, но отличается меньшей активностью в отношении Streptococcus pneumoniae и большей в отношении Bacteroides fragilis (Haas et al., 1995). Больше у него и Т1/2 (1,8 ч), поэтому при тяжелых инфекциях достаточно 1—2 в/в инъекций цефтизоксима в сутки. Цефтизоксим на 90% выводится с мочой в неизмененном виде (Neu et al., 1982).
Цефтриаксон по активности in vitro напоминает цефтизоксим и цефотаксим, но имеет более длительный Т1/2 — 8 ч. При менингите препарат вводят в/в или в/м 1 или 2 раза в сутки (Del Rio et al., 1983; Brogden and Ward, 1988), при других инфекциях — 1 раз в сутки (Baumgartner and Glauser, 1983). Примерно половина дозы выводится с мочой, а остальное, по-видимому, поступает в желчь. Для лечения гонококкового уретрита, цервицита, проктита и фарингита достаточно однократного в/м или в/в введения цефтриаксона (125—250 мг), даже если возбудитель вырабатывает пенициллиназу (Rajan et al., 1982; Hands-field and Murphy, 1983).
Цефиксим назначают внутрь. По сравнению с цефалоспоринами второго поколения для приема внутрь он менее активен в отношении грамположительных кокков, но сильнее действует на энтеробактерий, а также на Haemophilus influenzae, вырабатывающих β-лактамазы, Moraxella catarrhalis и Neisseria gonorrhoeae. Препарат малоактивен в отношении Staphylococcus aureus. Т1/2 составляет примерно 3 ч.
Цефподоксим — препарат для приема внутрь. По антимикробному спектру он сходен с цефиксимом, но чуть активнее последнего в отношении Staphylococcus aureus. Т1/2 равен 2,2 ч. Цефалоспорины третьего поколения с высокой активностью в отношении Pseudomonas spp. Активность цефоперазона в отношении грамположительных и многих грамотрицательных бактерий ниже, чем у цефотаксима. По действию на грамотрицательных бактерий он уступает и латамоксефу. Цефоперазон активнее обоих препаратов в отношении Pseudomonas aeruginosa, но все же менее активен, чем цефтазидим. К сожалению, во время лечения могут появиться устойчивые штаммы. На Bacteroides fragilis цефоперазон действует так же, как цефотаксим.
Цефоперазон несколько менее устойчив к β-лактамазам, чем препараты группы цефотаксима, а также цефметазол, цефокситин и цефотетан (Klein and Neu, 1983). Большая часть препарата выводится с желчью, в мочу попадает лишь 25% дозы. Поэтому при почечной недостаточности дозу цефоперазона снижать не нужно, но нарушения функции печени и обструкция желчных путей могут замедлить элиминацию препарата. Т1/2 — около 2 ч. Концентрация цефоперазона в желчи выше, чем у других цефалоспоринов, а сывороточная концентрация в 2—3 раза выше, чем цефотаксима. Из-за наличия N-метилтиотетразольной группы цефоперазон может вызывать гипопротромбинемию и кровотечения. Во избежание этого одновременно с цефоперазоном назначают витамин К. Употребление алкоголя на фоне приема цефоперазона может спровоцировать антабусную реакцию.
Цефтазидим активнее цефотаксима в отношении грамположительных бактерий на 25—50% и почти не отличается от него по действию на энтеробактерий. Главное преимущество цефта-зидима — очень высокая активность в отношении Pseudomonas spp. и других грамотрицательных бактерий. Цефтазидим малоактивен в отношении Bacteroides fragilis (Hamilton-Miller and Brumfitt, 1981). T1/2 составляет примерно 1,5 ч. Препарат выводится в неизмененном виде. In vitro цефтазидим более активен в отношении Pseudomonas spp., чем цефоперазон и пиперациллин (Edmond et al., 1999; Sahm et al., 1999).
Цефалоспорины четвертого поколения
В эту группу входят цефепим и цефпиром. Первый разрешен к применению в США, второй — нет. Цефепим устойчив ко многим из уже упоминавшихся здесь β-лактамаз (типов ТЕМ-1, ТЕМ-2 и SHV-1), кодируемых плазмидными генами. Бета-лактамазы типа I, кодируемые хромосомными генами, он индуцирует слабо и относительно устойчив к ним, а также к некоторым р-лактамазам расширенного спектра действия. Это определяет активность цефепима в отношении энтеробактерий, устойчивых к другим цефалоспоринам именно за счет выработки β-лактамаз типа I. Тем не менее этот препарат разрушается некоторыми β-лактамазами расширенного спектра действия (например, ТЕМ-3 и ТЕМ-10), кодируемыми плазмидными генами. In vitro активность цефепима в отношении грамотрицательных бактерий, не растущих на обычных средах (Haemophilus influenzae, Neisseria gonorrhoeae, и Neisseria meningitidis), такая же или выше, чем цефотаксима. По действию на Pseudomonas aeruginosa цефепим близок к цефтазидиму, но слабее последнего в отношении других Pseudomonas spp. и Stenotrophomonas maltophilia. Он активнее цефтазидима в отношении стрептококков и чувствительных к метициллину Staphylococcus aureus и действует на них примерно так же, как цефотаксим (Sanders, 1993). Цефепим неактивен в отношении метициллиноустойчивых Staphylococcus aureus, пенициллиноустойчивых пневмококков, энтерококков, Bacteroides fragilis, Listeria monocytogenes, Mycobacterium avium и Mycobacterium scrofulaceum, а также Mycobacterium tuberculosis. Препарат почти полностью выводится почками, поэтому при почечной недостаточности необходима коррекция дозы. Опыты на лабораторных животных показали, что при менингите цефепим хорошо проникает в СМЖ. При введении обычной дозы для взрослых (2 г в/в 2 раза в сутки) максимальная сывороточная концентрация составляет 126—193 мкг/мл. равен 2 ч.
Побочные эффекты
Самые частые из них — аллергические реакции (Petz, 1978), но данных, свидетельствующих о большей или меньшей способности отдельных препаратов вызывать аллергию, нет. Проявления аллергии к цефалоспоринам, видимо, такие же, как у пенициллинов, что может объясняться сходством в химическом строении (Bennett et al., 1983). Из аллергических реакций немедленного типа встречаются анафилактический шок, бронхоспазм, крапивница. Чаще, однако, наблюдают лишь пятнисто-папулезную сыпь, которая возникает спустя несколько дней от начала лечения и иногда сопровождается лихорадкой и эозинофилией.
Из-за сходства химического строения пенициллинов и цефалоспоринов возможна перекрестная аллергия к препаратам обеих групп. Серологические исследования выявляют перекрестную аллергию к цефалоспоринам у 20% больных с аллергией к пенициллинам (Levine, 1973), при клинических же исследованиях частота оказывается намного меньше — около 1% (Saxon et al., 1984). Кожные пробы для определения аллергии к цефалоспоринам не разработаны.
Сыпь и другие проявления аллергии к цефалоспоринам редко возникают у больных, у которых аллергические реакции на пенициллины имели место давно или протекали легко. Однако больным с недавними тяжелыми реакциями немедленного типа на пенициллины цефалоспорины следует назначать с большой осторожностью и только при крайней необходимости. У больных, получающих большие дозы цефалоспоринов, часто выявляют положительную пробу Кумбса. Гемолиз возникает редко, хотя такие случаи описаны. Изредка введение цефалоспоринов вызывает угнетение костного мозга, проявляющееся нейтропенией (Kammer, 1984).
Цефалоспорины могут вызывать поражение почек, однако в этом отношении они менее опасны, чем аминогликозиды и полимиксины (Barza, 1978). Описаны случаи острого канальцевого некроза при введении более 4 г цефалоридина в сутки, поэтому в США этот препарат изъят из продажи. Другие цефалоспорины менее токсичны и редко оказывают нефротоксическое действие в терапевтических дозах (при монотерапии). В высоких дозах цефалотин может стать причиной острого канальцевого некроза, обычные же дозы (8— 12 г/сут) могут представлять опасность лишь для больных с уже имеющимися поражениями почек (Pasternack and Stephens, 1975). Показано, что при одновременном назначении цефалотин и аминогликозиды (гентамицин или тобрамицин) усиливают нефротоксичность друг друга (Wade etal., 1978), особенно у больных старше 60 лет. При лечении цефалоспоринами иногда развивается понос. Этот побочный эффект более характерен для цефоперазона, возможно, потому, что он выводится главным образом с желчью. При приеме препаратов, содержащих N-метил-тиотетразольную группу (цефамандол, цефотетан, лата-моксеф, цефоперазон), отмечается антабусная реакция. При применении некоторых бета-лактамных антибиотиков могут возникать тяжелые кровотечения, связанные с гипопротромбинемией (обусловленной действием N-метилтиотетразольной группы), тромбоцитопенией или нарушением функции тромбоцитов (Bank and Kammer, 1983; Sattleret al., 1986). У пожилых, истощенных больных и при почечной недостаточности это осложнение наблюдается, видимо, чаше, особенно при лечении латамоксефом.
Применение
Цефалоспорины широко используются в клинике. К сожалению, многие бактерии к ним устойчивы. Клинические испытания показали, что цефалоспорины целесообразно применять как для лечения, так и для профилактики различных инфекций (Donowitz and Mandell, 1988).
Цефалоспорины первого поколения высокоэффективны при инфекциях кожи и мягких тканей, вызванных Staphylococcus aureus и Streptococcus pyogenes. В случаях, когда есть риск попадания в рану микрофлоры кожи, цефазолин назначают однократно — непосредственно перед операцией. При операциях на толстой и прямой кишке, когда важно подавить анаэробную микрофлору кишечника, чаше используют цефалоспорины второго поколения (цефокситин и цефотетан).
Сегодня цефалоспоринам второго поколения все чаше предпочитают препараты третьего поколения. По сравнению с последними цефалоспорины второго поколения слабее действуют на пенициллиноустойчивых Staphylococcus pneumoniae, уступая в этом отношении и ампициллину. Поэтому цефалоспорины второго поколения не следует назначать для эмпирического лечения менингита или пневмонии. Цефалоспорины второго поколения для приема внутрь можно использовать при лечении инфекций дыхательных путей, но при пневмонии, вызванной пенициллиноустойчивыми Streptococcus pneumoniae, эти препараты менее эффективны. Цефокситин и цефотетан помогают при инфекциях, вызванных факультативно-анаэробными грамотрицательными бактериями (инфекциях брюшной полости, воспалительных заболеваниях матки и придатков, диабетической стопе).
Цефалоспорины третьего поколения, иногда в сочетании с аминогликозидами, — это препараты выбора при тяжелых инфекциях, вызванных Klebsiella spp., Enterobacter spp., Proteus spp., Providencia spp., Serratia spp. и Haemophilus spp. Цефтриаксон хорошо действует при всех формах гонореи и при тяжелой Лаймской болезни. Высокая антибактериальная активность, способность хорошо проникать в СМЖ и клиническая эффективность цефотаксима и цефтриаксона позволяют рекомендовать их в сочетании с ванкомицином и ампициллином для эмпирической терапии менингита у взрослых и детей старше 3 мес с нормальным иммунитетом. Цефалоспорины третьего поколения — лучшее средство для лечения менингита, вызванного Haemophilus influenzae, чувствительными Streptococcus pneumoniae, Neisseria meningitidis и энтеробактериями. Цефотаксим не помогает при менингите, вызванном устойчивым к этому препарату Streptococcus pneumoniae (Friedland and McCracken, 1994). При псевдомонадном менингите лучше использовать цефтазидим в сочетании с одним из аминогликозидов. Цефалоспорины третьего поколения малоактивны в отношении Listeria monocytogenes и пенициллиноустойчивых пневмококков, которые также могут вызывать менингит.
По антимикробному спектру цефотаксим и цефтриаксон прекрасно подходят для лечения внебольничных пневмоний, вызванных пневмококками (сывороточные концентрации препаратов превышают МПК для большинства пенициллиноустойчивых штаммов), Haemophilus influenzae или Staphylococcus aureus.
Цефалоспорины четвертого поколения показаны для эмпирического лечения больничных инфекций, когда есть вероятность, что возбудитель устойчив к антибиотикам за счет индуцируемых β-лактамаз, кодируемых хромосомными генами, либо β-лактамаз расширенного спектра действия. Так, цефепим эффективнее цефтазидимаи пиперациллина в отношении больничных штаммов Еп-terobacterspp., Citrobacterspp. и Serratia spp. (Jonesetal., 1998).