Заболевания ЦНС (центральной нервной системы)
Категория:
«Фармакология».
Содержание
- 1 Патофизиология и заболевания центральной нервной системы
- 2 Антипсихотические средства
- 3 Эмоциональные расстройства
- 4 Стабилизаторы настроения
- 5 Тревожные расстройства
- 6 Анксиолитики
- 7 Пищевые расстройства
- 8 Эпилепсия
- 9 Противоэпилептические средства
- 10 Нарушения сна
- 11 Снотворные средства
- 12 Нарколептический синдром
- 13 Для лечения нарколепсии используют стимуляторы ЦНС
- 14 Апноэ во сне
- 15 Периодическое двигательное расстройство
- 16 Нарушения ритма сна и бодрствования
- 17 Деменция
- 18 Болезнь Паркинсона
- 19 Средства, которые усиливают дофаминергическую активность
- 20 Средства, которые ингибируют стриарную холинергическую активность
- 21 Болезнь Хантингтона
- 22 ИНСУЛЬТ
- 23 ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ИНФЕКЦИИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
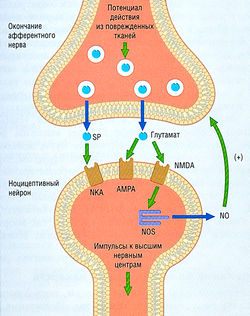
- 24 БОЛЬ
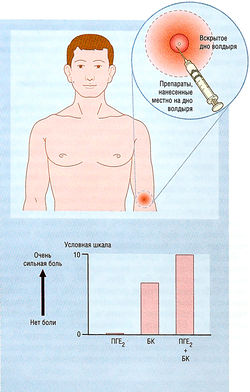
- 25 Испытание болеутоляющих лекарств
- 26 Лекарственная терапия боли
- 27 ЛЕКАРСТВА, ВЫЗЫВАЮЩИЕ ПРИСТРАСТИЕ
- 28 Опиоиды
- 29 Кокаин
- 30 Амфетамины
- 31 Никотин
- 32 Кофеин
- 33 Барбитураты
- 34 Бензодиазепины
- 35 Этанол (спирты)
- 36 Фенциклидин (общеанестезирующие средства)
- 37 Растворители
- 38 ЛСД (галлюциногены)
- 39 Каннабиноиды
- 40 Читайте также
- 41 Литература
Патофизиология и заболевания центральной нервной системы[править | править код]
Психоз[править | править код]
Психоз — умственное состояние, характеризуемое утратой связи с реальной действительностью. Пациент может описывать разнообразные отклонения в восприятии, мыслях и идеях. Психоз — не определенная болезнь, т.к. психотические симптомы могут наблюдаться при депрессии и других изменениях настроения и медицинских состояниях, связанных с нарушением функции мозга. Психические болезни: шизофрения, шизоаффективное состояние, бредовые нарушения и некоторые депрессивные и маниакальные болезни. Наиболее распространенная психическая болезнь, которая включает все кардинальные психические симптомы, — шизофрения.
Основная статья: шизофрения
Антипсихотические средства[править | править код]
Антипсихотические (нейролептические) лекарственные средства — неоднородный фармакологический класс лекарств (табл. 11). Типичные нейролептики вызывают каталепсию (оцепенение) у животных, блокируя D2-рецепторы. Атипичные нейролептики в терапевтических дозах ее не вызывают.
К фенотиазинам относятся:
- лекарственные средства с алифатическими боковыми цепочками типа хлорпромазина;
- пиперидиновые производные (например, тиоридазин);
- пиперазиновые производные (например, трифлуоперазин и флуфеназин).
Другие классы антипсихотических средств:
- тиоксантены (например, флупентиксол и зуклопентиксол);
- бутирофеноны (например, галоперидол и дроперидол);
- дифенилбутилпиперидины (например, пимозид);
- замещенные бензамиды (например, сульпирид и амисульпирид);
- дибензодиазепины (например, клозапин);
- бензиксазолы (например, рисперидон);
- тиенобензодиазепины (например, оланзапин);
- дибензотиазепины (например, кветиапин);
- имидазолидиноны (например, сертиндол).
Читайте также: побочные эффекты нейролептиков.
Атипичные нейролептики[править | править код]
Читайте основную статью: Атипичные нейролептики
Эмоциональные расстройства[править | править код]
Первичные эмоциональные расстройства — глубокое депрессивное расстройство и биполярное эмоциональное расстройство.
Глубокое депрессивное расстройство[править | править код]
Читайте основную статью: депрессия
Стабилизаторы настроения[править | править код]
Литий[править | править код]
Литий — наиболее широко используемый стабилизатор настроения:
- применяют для предотвращения повторения маниакально-депрессивного психоза и текущего униполярного депрессивного расстройства (т.е. не мания);
- эффективен для лечения острой мании;
- используют иногда при стойкой депрессии, чтобы повысить эффективность антидепрессанта. Литий ингибирует путь, который фиксирует инозитол для ресинтеза полифосфоинозитидов. Поскольку поступление инозитола в мозг относительно мало, этот эффект лития может уменьшать концентрацию липидов, необходимых для трансдукции сигнала в головном мозге.
До начала приема лития необходимо проверить почечную функцию и функцию щитовидной железы
Вследствие неблагоприятных эффектов и противопоказаний перед начальной терапией необходимо проверить почечную функцию (мочевина, креатинин, электролиты) и функцию щитовидной железы. После начала терапии нужно проверять концентрацию лития в плазме каждые 5 дней с увеличениями дозы, пока концентрация не достигнет 0,6-1,0 мМ/л. Во время терапии каждые 2-3 мес нужно контролировать концентрацию лития наряду с почечной функцией. Функцию щитовидной железы необходимо определять каждые 6 мес.
ПОБОЧНЫЕ ЭФФЕКТЫ. В начале терапии литием пациенты обычно жалуются на жажду, тошноту, неоформленный стул, мелкий тремор и полиурию, но эти эффекты обычно исчезают при длительной терапии. Другие неблагоприятные эффекты: увеличение массы тела, отеки и кожные высыпания. Длительным неблагоприятным эффектом может быть несахарный диабет, ведущий к полидипсии, т.к. литий ингибирует действие вазопрессина в почке, что приводит к потере воды. Зоб и явный гипотиреоз (реже) могут возникать из-за нарушений высвобождения гормона щитовидной железы.
Первыми признаками токсичности при концентрации лития в плазме, равной 1,5-2,0 мМ/л, являются анорексия, рвота, диарея, грубый тремор, атаксия, дизартрия, спутанность сознания и сонливость. Более поздние признаки (при концентрации лития в плазме более 2,0 мМ/л): нарушение сознания, нистагм, мышечные подергивания, гиперрефлексия и конвульсии. Кома и летальный исход происходят при более высоких концентрациях. При первых признаках токсичности нужно срочно измерить концентрацию лития в плазме. Если она высокая, необходимо прекратить поступление лития и провести мероприятия для увеличения выведения лития, включая гемодиализ.
Взаимодействие лития с другими лекарствами часто ведут к повышению концентрации лития в плазме. Такими препаратами являются:
- нейролептики (особенно галоперидол), которые увеличивают нейротоксичность;
- НПВС (кроме аспирина), которые увеличивают концентрацию лития в плазме за счет уменьшения экскреции;
- диуретики (особенно тиазиды), которые увеличивают концентрацию лития в плазме за счет уменьшения экскреции;
- кардиоактивные средства (дигоксин, ингибиторы ангиотензинпревращающего фермента), которые увеличивают риск нейротоксичности, возможно вторично из-за мембранных эффектов.
Читайте также: Препараты для лечения маний
Карбамазепин[править | править код]
Карбамазепин может быть так же эффективен, как литий, в предотвращении повторений БЭР и в лечении острой мании. Он обычно показан при быстрой, циклически повторяющейся биполярной болезни.
Карбамазепин используют совместно с литием. Механизм действия, вероятно, обусловлен эффектами на систему вторичных посредников. Карбамазепин ингибирует приток кальция через NMDA- и ГАМКв-рецепторы. Кроме того, лечение карбамазепином ведет к натриевой канал-зависимой мембранной стабилизации и потенцированию а2-адренорецепторов.
В начале терапии карбамазепин стимулирует собственные катаболические ферменты в печени, поэтому, чтобы установить дозу, необходимо проверить концентрацию в плазме.
Неблагоприятные эффекты карбамазепина включают сонливость, диплопию, тошноту, атаксию, сыпь и головную боль. Гематологическими нарушениями могут быть агранулоцитоз и лейкопения, поэтому пациентов необходимо обследовать и предупредить о возможной лихорадке и инфекциях, которые могут вызывать агранулоцитоз. Рекомендуется измерение концентрации карбамазепина в плазме и проведение полного анализа крови каждые 2 нед в течение первых 2 мес терапии.
Острая токсичность карбамазепина проявляется диплопией, атаксией, гиперрефлексией, клонусом, тремором и угнетением.
Взаимодействие карбамазепина с другими лекарствами:
- с литием: возможны неблагоприятные эффекты на ЦНС карбамазепина и карбамазепиновая токсичность, несмотря на нормальную концентрацию карбамазепина в плазме. Однако комбинации лития и карбамазепина могут быть более эффективны, чем применение одного препарата;
- с нейролептиками: вызывает сонливость и атаксию;
- с ТЦА: уменьшение концентрации ТЦА в плазме в результате индукции фермента карбамазепином;
- с MAOI: ускорение «сырной реакции». Карбамазепин — индуктор ферментов (см. главу 4), поэтому он влияет на концентрацию в плазме многих лекарственных средств, метаболизирующихся в печени.
Натрия вальпроат и натрия дивальпрокс[править | править код]
Вальпроат — эффективный стабилизатор настроения. Его можно использовать как препарат первой линии терапии или в качестве дополнения в рефрактерных случаях. Дивальпрокс — смесь вальпроата натрия и вальпроевой кислоты; улучшает биодоступность и толерантность. Активная часть представлена вальпроатом.
Механизм действия вальпроата до конца не выяснен. Известно, что он увеличивает синтез, оборот и высвобождение ГАМК, а также ингибирует поступление Са2+ в клетку через активацию NMDA-рецептора. Возможно связанный с этими двумя действиями вальпроат увеличивает функцию серотонинергической системы и уменьшает функцию дофаминергической системы.
Неблагоприятные эффекты вальпроата: гастроинтестинальные (тошнота, рвота, диарея), на ЦНС (угнетение, атаксия, дизартрия, тремор) и на печень (постоянное повышение активности печеночных трансаминаз, редко — гепатотоксичность с летальным исходом). Препарат может также вызвать потерю волос.
Новые противоэпилептические средства для лечения биполярного эмоционального расстройства[править | править код]
Для лечения биполярного эмоционального расстройства разрабатывают все новые противоэпилептические средства, но только ламотриджин превосходит существующие средства терапии. Ламотриджин, как полагают, ингибирует нейрональное возбуждение. Он ингибирует токи натрия, селективно взаимодействуя с натриевым каналом и приводя его в неактивное состояние, и впоследствии подавляет высвобождение глутамата (возбуждающей аминокислоты).
Полученные данные свидетельствуют, что препарат эффективен при толерантности к лечению биполярного эмоционального расстройства, а также может иметь значение при терапии депрессивной стадии заболевания.
Тревожные расстройства[править | править код]
Психологические симптомы тревожного расстройства: рассеянность, неприятное и неопределенное предчувствие, которое часто сопровождается физическими симптомами автономного возбуждения в виде головной боли, потоотделения, трепета, желудочного расстройства, стеснения в груди и беспокойства. Беспокойство поддерживается чувством неизбежно надвигающейся опасности и подталкивает пациента к действиям, чтобы противостоять угрозе, которая является обычно неизвестной, внутренней, неопределенной или имеет конфликтное происхождение (со стимуляцией противоположных эмоций, например волнения и вины). Это беспокойство отличается от опасения, которое является ответом на угрозу, которая известна, внешняя, определенная или имеет неконфликтное происхождение. Беспокойство — общий симптом различных психических заболеваний и преобладающий признак при фобиях, панических нарушениях и одержимо-навязчивом состоянии. Другие тревожные расстройства включают генерализованное тревожное расстройство, посттравматические стрессовые расстройства и истерические конверсионные реакции.
ГАМК и 5-НТ— два нейромедиатора, наиболее вовлеченные в этиологию тревожных расстройств
Норэпинефрин также играет определенную роль, особенно в панических расстройствах. Отсутствуют доказательства, подтверждающие роль этих нейромедиаторов, но функциональное отображение бен-зодиазепиновых рецепторов в головном мозге показало различия в рецепторном связывании в височных долях у пациентов с паническими расстройствами и у нормальных субъектов. Бензодиазепины действуют на ГАМК-рецепторный комплекс.
Тревожные расстройства лечат анксиолитиками и антидепрессантами. Читайте также: Препараты для лечения депрессии и тревоги
Анксиолитики[править | править код]
Бензодиазепины[править | править код]
Действие бензодиазепинов (табл. 14) осуществляется через потенцирование действия ГАМК, главного тормозного нейромедиатора в ЦНС. Бензодиа-зепиновый рецептор лежит в пределах ГАМКа-рецепторного комплекса, и бензодиазепины увеличивают тормозную активность (рис. 31). Бензодиазепины уменьшают тревогу, а продолжительность их действия в некоторой степени зависит от периода полувыведения препарата (см. далее).
|
Таблица 14 Механизм действия лекарственных средств для лечения тревожности | ||
|
Лекарства |
Механизм действия |
Применение |
|
Анксиолитики | ||
|
Бензодиазепины (диазепам, альпразолам) |
Действуют на ГАМК-рецепторы |
Кратковременное лечение тревожности |
|
Буспирон |
Действует на 5-НТ1а-рецептор |
Может быть эффективен при генерализованных тревожных расстройствах |
|
Автономная супрессия | ||
|
Пропранолол |
Ингибирует β-адренорецепторы |
Применяеют при социальных тревожных расстройствах |
|
Антидепрессанты | ||
|
Имипрамин |
Три циклический антидепрессант |
Наиболее исследовано лечение панических расстройств |
|
Фенелзин, моклобемид |
Ингибиторы MAOI |
Применяют при социальных фобиях и панике, а также при посттравматическом стрессовом расстройстве |
|
Флуоксетин, сертралин |
Ингибиторы обратного захвата серотонина |
Доказана эффективность при одержимонавязчивом состоянии и панических расстройствах |
Неблагоприятные эффекты бензодиазепинов: появление зависимости и возможность злоупотребления. Толерантность к их эффектам развивается в пределах 14 дней, затем эффективность снижается. Внезапное прекращение приема после длительного применения бензодиазепинов может вызвать синдром отмены, характеризующийся бессонницей, тревогой, тремором, потерей аппетита, звоном в ушах и нарушениями восприятия. Контролируемую отмену бензодиазепинов проводят путем переключения на эквивалентную дозу бензодиазепина с длительным периодом полувыведения (например, диазепама) и постепенного сокращения дозы на 1/8 часть каждые 2 нед. Этот процесс может продолжаться от нескольких недель до одного года, в зависимости от степени толерантности.
Общие неблагоприятные эффекты бензодиазепинов — сонливость, атаксия и замедленность психомоторной реакции выполнения действия. Необходимо соблюдать осторожность при вождении транспорта или управлении промышленным оборудованием. Эти побочные эффекты могут стать более заметными через несколько недель, т.к. длительный период полувыведения некоторых бензодиазепинов ведет к накоплению препарата. Может происходить растормаживание пациента с появлением агрессии, но это наблюдается редко и более вероятно для бензодиазепинов с коротким периодом действия (например, мидазолама).
Бензодиазепины показаны только для краткосрочного применения при неприемлемо тяжелой тревоге
Серьезное беспокойство может сочетаться с бессонницей или быть краткосрочным психосоматическим, органическим или психическим заболеванием. Диазепам (5-20 мг/сут) — наиболее часто назначаемый анксиолитик. Использовать бензодиазепины для лечения непродолжительного умеренного состояния тревоги нецелесообразно, т.к. зависимость и синдром отмены после приема бензодиазепинов, предписанных как анксиолитики, более проблематичны, чем принимаемые в качестве снотворных средств. Альпразолам эффективен при панических атаках.
Периоды полувыведения бензодиазепинов
- Диазепам: 14-70 час (при монотерапии активен до 200 час)
- Нитразепам: 15-30 час
- Лоразепам: 8-24 час
- Темазепам: 3-25 час
- Оксазепам: 3-25 час
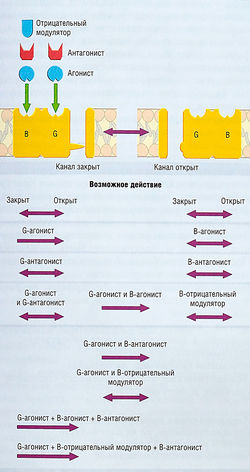
рис. 31 Действие агонистов и антагонистов бензодиазе-пинового и ГАМК-рецепторов. С1-канал, часть рецептор-связанного канала (РСК), существует в открытом и закрытом состоянии. Этот РСК имеет два определенных лиганд-распознающих центра: участок ГАМК (С) и участок бензодиазепина (В). Равновесие между закрытым и открытым состоянием С1-канала определяется агонистами ГАМК. Ни агонисты, ни антагонисты бензодиазепиново-го участка рецептора сами по себе не вызывают открытие канала. Однако ГАМК-агонист-индуцированное открытие канала облегчается сопутствующими агонистами бензодиазепина. Более того, отрицательные модуляторы бензодиазепина уменьшают способность ГАМК открывать каналы, а антагонисты бензодиазепина могут заблокировать эффект негативных модуляторов. G- и В-распознающие центры, вероятно, взаимодействуют аллостерически, причем В-участок функционирует как модулятор G-участка.
Азапироны[править | править код]
Буспирон — первый из нового класса лекарственных средств, названных азапиронами, которые действуют, уменьшая 5-НТ-нейротрансмиссию, являясь частичным агонистом 5-НТ1А-рецепторов. 5-НТ1А-рецепторы — ингибирующие пресинаптические рецепторы; в результате их активации уменьшается возбудимость нейронов 5-НТ. Буспирон не действует на бензодиазепиновый ГАМК-рецепторный комплекс, поэтому препарат нельзя использовать для облегчения бензодиазепинового синдрома отмены. Буспирон — не снотворное.
Неблагоприятные эффекты буспирона: нервозность, головная боль и легкое головокружение.
Буспирон предназначен для краткосрочного использования при генерализованном тревожном расстройстве
Анксиолитический эффект буспирона развивается постепенно — через 1-3 нед. В отличие от бензодиазепинов, у буспирона отсутствует седативный эффект и ухудшение когнитивной функции, риск привыкания и зависимости минимален. Препарат не потенцирует угнетающее действие алкоголя.
Антагонисты β-адренорецепторов[править | править код]
Антагонисты β-адренорецепторов (типа пропранолола) уменьшают частоту сердечных сокращений и другие проявления возбуждения β-адренорецепторов (симпатическая активность).
Пропранолол:
- ослабляет соматические проявления тревоги, характеризующиеся заметным симпатическим автономным возбуждением (например, сердцебиением и тремором);
- полезен при социальной фобии и уменьшает признаки автономного возбуждения, предотвращая увеличение тревожности;
- уменьшает состояние тревожности у музыкантов, для которых важен прекрасный двигательный контроль.
Антидепрессанты[править | править код]
Некоторые антидепрессанты имеют определенные показания к применению при специфических тревожных расстройствах:
- имипрамин дает прекрасный эффект у 60-70% пациентов с паническими расстройствами, при которых используемая доза выше, чем для лечения депрессии; терапию необходимо продолжать после наступления улучшения;
- MAOI используют при некоторых тревожных расстройствах, включая панические расстройства, агорафобию, социальную боязнь и посттравматическое стрессовое расстройство; MAOI превосходят обычные ТЦА;
- SSRI, особенно флуоксетин, и ТЦА кломипрамин наиболее эффективны в лечении одержимонавязчивого состояния. Однако дозы выше, чем те, которые используют для лечения депрессии; для получения очевидного терапевтического эффекта может потребоваться 1-3 мес.
Пациенты часто имеют смешанную картину тревоги и депрессии (ажиатированная депрессия). В этом случае показаны антидепрессанты, главное использовать наиболее седативное средство.
Пищевые расстройства[править | править код]
Известны два пищевых расстройства — нервная анорексия и нервная булимия. Есть значительное наложение между этими двумя расстройствами, которое переходит из одного в другое. Лечение — в основном только психотерапия, хотя такие расстройства часто сопровождаются депрессией, для устранения которой, возможно, нужна лекарственная терапия.
Эпилепсия[править | править код]
- Основная статья: Эпилепсия и спорт
Эпилепсия характеризуется повторяющимися неспровоцированными приступами. Эпилептический приступ — специфическое поведение, вызванное измененной неврологической функцией в результате пароксизмальных разрядов нейронов в коре головного мозга. Приступы иногда называют судорогами или припадками.
Около 10% населения США испытывают один или несколько таких приступов в течение жизни, но эпилепсия в дальнейшем разовьется примерно у 1,5% населения.
Поведение во время приступа варьирует от неподвижности и легких подергиваний до сильных интенсивных тонико-клонических судорог или даже целенаправленной активности в зависимости от формы эпилепсии.
Клеточные механизмы эпилепсии неизвестны, но, возможно, они связаны с измененным метаболизмом ГАМК.
Адекватная лекарственная терапия зависит от природы эпилепсии
Диагноз «эпилепсия» ставят на основании истории болезни пациента, природы приступа (табл. 15) и электроэнцефалографии (ЭЭГ).
Частичные, или фокальные, приступы возникают из ограниченной области коры мозга. Конечный эффект зависит от вовлеченной области мозга и может быть сенсорного (включая зрительные расстройства) или двигательного характера. Моторное поведение может быть весьма целенаправленно. Сознание спутано, обычно больной не помнит о приступе.
Таблица 15 Классификация эпилептических приступов
|
Парциальные (фокальные, локальные) приступы |
|
Простые парциальные приступы (сознание не утрачено): моторные симптомы, соматосенсорные или специальные сенсорные симптомы и психические симптомы Сложные парциальные приступы (спутанность сознания): простое парциальное начало, сопровождаемое спутанностью сознания, сознание нарушено в начале приступа Парциальные приступы, развивающиеся в генерализованные приступы (тонические, клонические или тонико-клонические) Простые парциальные приступы, развивающиеся в генерализованные приступы Сложные парциальные приступы, развивающиеся в генерализованные приступы Простые парциальные приступы, развивающиеся в сложные парциальные приступы, приводящие к генерализованным приступам |
|
Генерализованные приступы (конвульсивные или неконвульсивные) |
|
Типичные абсансы: фиксированный взгляд, подмигивание, неподвижность Атипичные абсансы: связанные с движением Миоклонус Клонические приступы Тонические приступы Тонико-клонические приступы Атонические приступы |
|
Commission on Classification and Terminology of the International League Against Epilepsy. |
Генерализованные приступы могут быть конвульсивными или неконвульсивными, а диапазон - от пустого (отсутствующего) взгляда до генерализованных тонико-клонических приступов:
- абсансы — наиболее типичная неконвульсивная форма приступа. Обычно бывают у детей, иногда путают с мечтательностью;
- миоклонус — быстрые симметричные аритмичные судорожные подергивания конечностей или всего тела;
- тонические приступы характеризуются напряжением тела и конечностей, могут приводить к переломам;
- атонические приступы вызывают потерю мышечного тонуса и могут привести к падению;
- генерализованные тонико-клонические приступы начинаются с повышения тонуса мышц (напряжения), которое сопровождается клоническими подергиваниями в течение нескольких минут. Этому состоянию может сопутствовать вокализация, цианоз и недержание мочи и/или кала. После приступа больной находится в состоянии заторможенности и усталости.
Приступы можно классифицировать на различные эпилептические синдромы на основании:
- вида приступа;
- других клинических особенностей, например возраста, в котором началось заболевание;
- анатомической локализации;
- этиологии (например, лихорадка). Эпилептический статус описывает состояние непрерывных приступов.
Лекарственная терапия может контролировать, но не излечивать 60-90% рецидивов приступов, поэтому лечение длительное
Цель лекарственной терапии состоит в том, чтобы управлять приступами без побочных эффектов препарата, но это не всегда возможно. Парциальные приступы удается контролировать только в 45% случаев, несмотря на оптимальное лечение. Адекватность применения препарата зависит от характера эпилепсии (табл. 16).
Лечение всегда должно начинаться с применения одного препарата, который следует использовать оптимизированно перед добавлением второго
Оптимизация лекарственной терапии — это увеличение дозы одного препарата до токсических проявлений. Неблагоприятные эффекты были зарегистрированы у 22% пациентов на монотерапии, у 34% — применявших два противоэпилептических средства и у 44% — использовавших три лекарства, поэтому предпочтительнее монотерапия.
Таблица 16 Лекарственные средства, используемые для лечения эпилепсии
|
Тип приступа |
Средства первой линии |
Средства второй линии |
|
Парциальные и/или генерализованные тонико-клонические приступы |
Карбамазепин, фенитоин |
Фенобарбитал, примидон, вальпроат |
|
Абсанс |
Этосуксимид, вальпроат |
Клоназепам |
|
Миоклонические приступы |
Вальпроат |
Примидон |
Чтобы получить максимальный терапевтический эффект, необходимо учитывать фармакокинетические свойства и побочные эффекты противоэпилептического препарата. Обязательно нужно мониторировать концентрацию фенитоина в крови (из-за его нулевой фармакокинетики) и соотношение между его концентрацией и терапевтическими и токсическими эффектами (см. главу 4).
Неблагоприятные эффекты противоэпилептических средств нужно рассматривать в начале лечения, т.к. такие препараты используют длительно (даже пожизненно). Лекарственные взаимодействия (см. главу 4) противоэпилептических средств особенно важны, поскольку:
- противоэпилептические средства используют длительное время;
- существуют незначительные различия между терапевтическими и потенциально токсическими концентрациями в крови некоторых противоэпилептических средств.
Противоэпилептические средства[править | править код]
- Читайте основную статью:Противосудорожные препараты
БАРБИТУРАТЫ (ФЕНОБАРБИТАЛ И ПРИМИДОН). Фенобарбитал — первое противоэпилептическое средство, которое применяют для лечения тонико-клонических приступов, несмотря на наличие более новых средств, т.к. он эффективен и недорог. Противоэпилептическая доза фенобарбитала лимитируется седацией, которая уменьшается при длительном использовании препарата. Иногда фенобарбитал у детей вызывает возбуждение вместо угнетения.
Примидон — структурный аналог фенобарбитала, превращающийся в организме в фенобарбитал. Клеточный механизм действия барбитуратов, вероятно, связан с синаптическим ингибированием, что расширяет эффекты ГАМК. Известно, что фенобарбитал и другие барбитураты действуют на ГАМКд-рецепторы.
Не все барбитураты используют как противоэпилептические препараты из-за выраженного угнетения в противоэпилептических дозах. Неизвестно, почему фенобарбитал в меньших дозах оказывает седативное действие.
Фенобарбитал — индуктор цитохрома Р-450, и, таким образом, он вовлечен в лекарственные взаимодействия. Его период полувыведения в плазме крови — 100 час.
Фенитоин[править | править код]
Фенитоин (дифенилгидантоин) используют в лечении тонико-клонических приступов. На молекулярном уровне он замедляет восстановление Na+-каналов после инактивации, таким образом сокращая нейрональную возбудимость, что может быть причиной его противоэпилептической активности.
Использование фенитоина усложняется его характерной токсичностью, нулевой фармакокинетикой и необходимостью длительного применения. Нулевая фармакокинетика подразумевает, что, когда концентрация фенитоина в крови приближается к уровню, при котором будут насыщаться ферменты, метаболизирующие фенитоин, незначительное увеличение дозы может привести к непропорционально большому увеличению в плазме концентрации препарата, заканчивающейся токсичностью. Этот эффект можно частично предотвратить, контролируя концентрацию фенитоина в плазме.
Побочные эффекты фенитоина могут быть дозозависимыми или дозонезависимыми:
- дозозависимые неблагоприятные эффекты касаются мозжечково-вестибулярной системы — нарушения зрения, атаксия, гиперактивность и тревожность, возможны гастроинтестинальные нарушения;
- другие неблагоприятные эффекты — кожная сыпь, гиперпластический гингивит, лимфаадено-матоз и гирсутизм. Фенитоин является тератогенным препаратом.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ. Фенитоин -индуктор фермента и может взаимодействовать с изониазидом, варфарином, хлорамфениколом, эритромицином и циметидином.
Карбамазепин[править | править код]
Карбамазепин химически связан с ТЦА. Противоэпилептическая активность карбамазепина такая же, как у фенитоина. Карбамазепин также используют при невралгии тройничного нерва и при лечении маниакально-депрессивного психоза. Подобно фенитоину, карбамазепин блокирует Ка+-каналы, с чем может быть связана его противоэпилептическая активность. Сывороточные концентрации карбамазепина не коррелируют с его терапевтическими эффектами.
Карбамазепин — индуктор ферментов, включая его собственные. Период полувыведения в плазме укорачивается при длительном применении.
Неблагоприятные эффекты карбамазепина: сонливость, головокружение и атаксия. Он, вероятно, тератогенен, как фенитоин.
Натрия вальпроат[править | править код]
Натрия вальпроат применяют для уменьшения частоты тонико-клонических приступов, особенно абсансов. Подобно фенитоину и карбамазепину, натрия вальпроат взаимодействует с Nа+-каналами, а также увеличивает содержание ГАМК в мозге при длительном применении. Концентрации натрия вальпроата в крови не коррелируют с терапевтическими эффектами.
Неблагоприятные эффекты: желудочно-кишечные расстройства и, что более важно, печеночная недостаточность. Гепатотоксичность при использовании вальпроата наблюдается чаще, чем у других противоэпилептических препаратов. Печеночные пробы не позволяют предсказать гепатотоксичность.
Этосуксимид[править | править код]
Этосуксимид — средство выбора для лечения абсансов. Полагают, что препарат ингибирует низкопороговые токи Са2+ (Т-токи) в таламусе, что, как думают, является источником абсансов. Концентрации этосуксимида в плазме не коррелируют с терапевтической эффективностью.
Неблагоприятные эффекты этосуксимида: гастроинтестинальные расстройства, сонливость, летаргия, эйфория, уртикарные повреждения кожи и, наиболее важно, лейкопения; в редких случаях возможна депрессия костного мозга.
Бензодиазепины[править | править код]
Клоназепам эффективен при абсансах и миоклонусе, в то время как диазепам и лоразепам эффективно контролируют эпилептический статус (непрерывные приступы). Бензодиазепины увеличивают ГАМК-индуцированную С1-проводимость, что, вероятно, обусловливает их противоэпилептическую активность.
Общий неблагоприятный эффект бензодиазепинов — угнетение. Внутривенное введение диазепама может угнетать дыхание, поэтому при терапии эпилептического статуса должен быть доступен аппарат искусственной вентиляции легких. Повторные приступы могут повреждать мозг и быть опасными для жизни, поэтому эпилептический статус необходимо контролировать.
Новые противоэпилептические средства[править | править код]
Роль новых противоэпилептических средств — габапентина и ламотриджина — в терапии приступов еще не определена.
ГАБАПЕНТИН. Габапентин — высоколипофильная молекула. Препарат был разработан для подражания эффектам ГАМК в ЦНС. Это полезная дополнительная терапия для пациентов с парциальными приступами, имеющая мало неблагоприятных эффектов, кроме сонливости, головокружения и усталости.
ЛАЛЛОТРИДЖИН. Ламотриджин предназначен для использования при парциальных приступах и действует на Na+-каналы. Известны следующие неблагоприятные эффекты препарата: головокружение, атаксия, нарушение зрения и гастроинтестинальные расстройства.
Ламотриждин метаболизируется в печени, образуя глюкурониды. Назначение одновременно фенитоина, карбамазепина или уменьшенной дозы фенобарбитала укорачивает период полувыведения ламотриджина в сыворотке с 24 до 15 час, возможно стимулируя конъюгацию ламотриджина с глюкуроновой кислотой в печени. Напротив, натрий вальпроат ингибирует метаболизм ламотриджина и увеличивает его период полувыведения до 60 час.
Другие новые противоэпилептические средства: агонист ГАМК-рецептора зонизамид, но точный механизм действия этого препарата в уменьшении приступов неясен. Зонизамид имеет длительный
период полувыведения в плазме (около 15 час). Наиболее частые неблагоприятные эффекты: сонливость, анорексия, головокружение, головная боль, тошнота и раздражительность. Недавно для лечения эпилепсии был предложен блокатор Nа+-канала оксарбазепин наряду с фосфенитоином, ингибиторами нейронального обратного захвата ГАМК тиагабином и леветирацетамом (точный механизм действия последнего остается неизвестным).
Нарушения сна[править | править код]
Нормальный сон[править | править код]
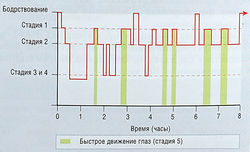
Нормальный сон характеризуется определенной электрической активностью, которую можно зарегистрировать на ЭЭГ. На основе этих данных сон делят на пять стадий. Стадии сна 1-4 характеризуются небыстрыми движениями глаз (NREM-сон), а стадия сна 5 — период быстрого движения глаз (REM-сон) (рис. 32):
- Стадия 1 составляет 5% сна; это поверхностный сон;
- Стадия 2 составляет 45% сна и характеризуется на ЭЭГ волнами «веретено сна»;
- Стадии 3 и 4 — самые глубокие стадии сна, составляющие 12 и 13% сна соответственно. Эти стадии часто классифицируют вместе как медленно-волновой сон, или 5-ритмы;
- Стадия 5 составляет 25% сна; на ЭЭГ отражается низковольтажными десинхронизированными зубчатыми волнами.
Время между началом сна и инициацией первой части REM-сна называют латентным REM-chom (обычно 90 мин). NREM — спокойное состояние с низким давлением крови и сердечной и дыхательной нормой. В течение этих стадий происходят беспокойные движения, а сновидения ясные и содержательные. В течение REM-сна тонус мышц тела уменьшен, и субъект неподвижен. Однако давление крови, сердечная и дыхательная функции повышены, происходит частичная или полная эрекция, сновидения абстрактны и нереальны.
Центральный контроль сна — сложный процесс, в котором участвуют:
- серононинергические нейроны в ядрах шва;
- норадренергические нейроны голубоватого пятна;
- АХ-содержащие нейроны в пределах ядра варо-лиевого шва, которые играют центральную роль в продукции REM-сна.
Биоэлектрическая активность колебаний сна может управляться мелатонином, накапливаемым в эпифизе, который в свою очередь управляется гипоталамусом. Вероятно, что переключатель сна “on-off” расположен в гипоталамусе как часть нейрональной схемы, подключающей гипоталамус к ретикулярной активирующей системе.
Нормальная продолжительность сна для взрослых — 6-9 час. Отсутствие REM-сна приводит к раздражительности, летаргии и последующему рикошету в REM-сон. Длительное полное лишение сна может привести к летальному исходу.
Разнообразие нарушений сна было отмечено при изучении психических заболеваний:
- при депрессии есть заметное уменьшение латентного REM-сна и увеличение REM-сна;
- болезнь Альцгеймера ведет к уменьшению латентного REM-сна и медленно-волнового сна. Различные лекарственные средства изменяют биоэлектрическую активность сна:
- бензодиазепины и в меньшей степени антидепрессанты уменьшают REM-coh;
- средства, которые увеличивают высвобождение дофамина (например, амфетамин), увеличивают и период бодрствования.
Бессонница[править | править код]
Бессонница — общее и неопределенное нарушение сна, которое может быть обнаружено у 40-50% людей. Из этих случаев:
- 30-35% — бессонница из-за психического заболевания;
- 15-20% — психофизиологическая, или первичная, бессонница;
- 10-15% — бессонница из-за алкоголя или лекарств;
- 10-15% — бессонница из-за периодических двигательных нарушений;
- 5-10% — бессонница из-за апноэ во сне;
- 5-10% — бессонница из-за болезни.
В этом списке соотношение женщины/мужчины составляет 2:1с преобладанием случаев в более низких социально-экономических группах.
Прогноз, этиология и лечение бессонницы зависят от основной причины
Чтобы установить проблему, необходимо собрать анамнез (начальная или средняя бессонница либо ранее пробуждение) и определить основную причину: физическая (например, боль или кашель) или из-за факторов окружающей среды (например, шума). Лечение должно быть ориентировано на основную причину.
Во многих случаях соблюдение гигиены сна (например, сокращение потребления кофеина, изменение привычек сна или облегчение боли) более предпочтительно, чем применение седативного средства. Раннее пробуждение — одна из биологических особенностей депрессии, следовательно антидепрессант мог бы стать средством выбора. Бессонницу без очевидной основной причины считают первичной (психофизиологической). Серьезную первичную бессонницу лечат снотворными средствами.
Снотворные средства[править | править код]
Бензодиазепины[править | править код]
Бензодиазепины действуют, потенцируя ГАМКергическую нейропередачу, увеличивают угнетающую активность. Бензодиазепины стимулируют сон, продолжительность их действия обусловлена в некоторой степени их фармакокинетикой.
Бензодиазепины используют как снотворные средства только 1 нед при серьезной, вызывающей потерю трудоспособности или чрезвычайно беспокоящей бессоннице
Бензодиазепины нельзя использовать как снотворные средства более 3 нед и при хронической бессоннице.
Другие средства для лечения бессонницы[править | править код]
Хлоралгидрат используют преимущественно у пожилых пациентов. Зопиклон, залеплон и золпидем — небензодиазепиновые снотворные средства, но они связываются со специфическими подтипами бензодиазепинового рецептора. Препараты действуют быстро, имеют короткий фармакокинетический период полувыведения = 2 час и минимальные эффекты «феномена отдачи». Длительное (более 4 нед) применение не рекомендуется.
Нарколептический синдром[править | править код]
Нарколептический синдром — относительно редкое нарушение, которое происходит у взрослых в 20-160 случаях из 100 тыс. Признаки синдрома: чрезмерная дневная сонливость и катаплексия (внезапная потеря тонуса мышц в ответ на эмоциональные стимулы типа смеха, боли и страха). Катаплексия затрагивает челюсть, шею, ноги или все тело, приводя к коллапсу. Ассоциативный симптом: сонный паралич, при котором наблюдается неспособность двигать в течение нескольких минут ни одной мышцей при сохраненном сознании (наблюдается у 40% нарколептиков). Короткий сонный паралич (длительностью несколько секунд) может быть нормальным явлением, как и предшествующие видения (иногда называемые гипнагогическими галлюцинациями), которые происходят у 30% людей с нарколепсией.
Приступы сна могут происходить в любое время дня, и их невозможно избежать. Они обычно манифестируют в позднем подростковом возрасте и продолжаются до 30-летнего возраста. Приступы могут прогрессировать по тяжести и частоте или достигать плато. Спонтанные ремиссии редки.
Электробиологическая активность ночного сна нарушена с заметно уменьшенным временем латентного REM-сна и начала REM-сна в пределах 10 мин.
Нарколепсию лечат стимуляторами ЦНС
Первая стратегия терапии при нарколепсии состоит в том, чтобы поощрить пациента постоянно дремать днем, иногда это может практически исключить приступы сна. Однако большинству пациентов необходимо лечение.
Для лечения нарколепсии используют стимуляторы ЦНС[править | править код]
Метилфенидата гидрохлорид и амфетамин[править | править код]
И метилфенидата гидрохлорид, и амфетамин — опосредованно действующие симпатомиметики. Их первичный эффект — вызвать высвобождение катехоламинов из пресинаптических нейронов. Препараты также ингибируют обратный захват катехоламинов. Эти действия ведут к стимуляции многих адренергических областей мозга, включая восходящую ретикулярную активирующую систему и полосатое тело. Неблагоприятные эффекты метилфенидата гидрохлорида и амфетамина: беспокойство, раздражительность, бессонница, дисфория, повышение артериального давления и тахикардия. Длительный побочный эффект: бред, подобный шизофреническому. Передозировка ведет к психозу, сердечно-сосудистым симптомам и эпилептическим приступам.
Модафинил[править | править код]
Модафинил — центрально действующий стимулятор, эффективное средство лечения чрезмерной дневной сонливости. Препарат может уменьшать приступы нарколепсии и имеет меньшие побочные эффекты и менее выраженное привыкание, чем симпатомиметики. Механизм действия модафинила неясен, но известно, что препарат является агонистом агадренорецепторов.
Другие средства лечения нарколепсии[править | править код]
Для лечения нарколепсии также используют:
- ингибитор МАОв селегилин;
- антихолинергические средства для лечения катаплексии;
- SSRI (например, флуоксетин) и SNRI (например, венлафаксин) для улучшения катаплексии;
- антагонисты дофаминовых рецепторов (например, натрий оксибат).
Апноэ во сне[править | править код]
Апноэ во сне характеризуется нарушенным сном ночью и чрезмерной сонливостью днем. Апноэ во сне является относительно частым нарушением сна, особенно у тучных и пожилых людей. Периоды апноэ удлиняются под воздействием алкоголя.
Минимальное фармакологическое лечение, например модафинилом, может помочь тем пациентам, организм которых не реагирует на продолжительную положительную дыхательную терапию.
Периодическое двигательное расстройство[править | править код]
Подобно апноэ во сне, периодическое двигательное расстройство характеризуется нарушенным ночным сном и дневной сонливостью. Однако механизм этого расстройства менее понятен, чем механизм апноэ или нарколепсии. До 30% пациентов старше 60 лет и 10% людей с бессонницей имеют это нарушение.
Ночными симптомами обычно бывает стереотипное вытяжение больших пальцев ног со сгибанием лодыжки и колена, что приводит к частичному пробуждению. Если это происходит более 30 раз в течение ночи, то дневная сонливость неизбежна.
Прогноз и этиология нарушения неизвестны, но расстройство наблюдается и при других нарушениях сна, и при паркинсонизме и ухудшается ТЦА и MAOI.
Наиболее эффективными лекарственными средствами являются клоназепам, селегилин (ингибитор МАОв) и леводопа (предшественник дофамина, используемый при лечении болезни Паркинсона).
Нарушения ритма сна и бодрствования[править | править код]
Эта группа нарушений сна затрагивает большинство людей.
Наиболее общие причины этих нарушений:
- сдвиг рабочего времени, особенно к противоположным концам дня и ночи;
- реактивная задержка, если пациент путешествовал с востока на запад или наоборот (за пределы одного часового пояса);
- синдром отсроченной стадии сна, который затрагивает подростков, особенно мужского пола. При этом синдроме начало сна и времени пробуждения устойчиво приближается к 1-2 час дня, пока больной десинхронизирован.
Нарушения ритма сна и бодрствования обычно самоограничиваются. Однако возможно восстановление нормального ритма с помощью снотворных средств с легким воздействием. Экспериментально показано, что мелатонин — гормон, накапливаемый эпифизом, вовлечен в циркадианные ритмы. Его можно использовать для восстановления нормального ритма сна и бодрствования при синдроме отсроченной стадии сна и реактивной задержке.
Деменция[править | править код]
Деменция — глобальное ухудшение высших корковых функций в отсутствие помрачения сознания, касающихся памяти, способности решать ежедневные проблемы, выполнять приобретенные перцепционные моторные навыки (например, играть на музыкальном инструменте), использовать социальные навыки, управлять эмоциональными реакциями. Состояние часто необратимо и прогрессирует. Краткое определение деменции — «приобретенное общее ухудшение интеллекта, памяти и индивидуальности, но без ухудшения сознания».
Общие причины деменции
- Болезнь Альцгеймера
- Мультиинфарктная (сосудистая) деменция
- Болезнь Пика
- Болезнь Паркинсона
- Болезнь Хантингтона
- Болезнь Крейтцфельдта-Якоба
Болезнь Альцгеймера[править | править код]
Болезнь Альцгеймера (БА), или старческая деменция, — наиболее частая причина деменции, составляет 50-60% всех случаев. Сенильная (старческая) и пресенильная (до 65 лет) деменция у женщин встречается в 2 раза чаще, чем у мужчин после 70 лет, но одинаково часто в более молодые годы. Продолжительность болезни — 5-10 лет, и этот период растет соответственно увеличению продолжительности жизни населения.
Признаки БА: прогрессирующая глобальная потеря памяти, патология париетальной лобной функции с потерей пространственной ориентации, ухудшение социальных навыков, утрата стремлений, инициативы и интеллекта, депрессия, беспокойство, агрессия, эмоциональная неустойчивость, беззаботность, смешение суточных ритмов.
Лекарственное лечение болезни Альцгеймера направлено на холинергическую систему и воспаление
При фармакологическом лечении БА используют несколько подходов (табл. 17):
- комбинирование NMDA-антагонистов и ингибирования высвобождения глутамата (мемантина гидрохлорид);
- использование предшественника АХ типа лецитина. Но в то же время на крысах было показано, что увеличение у них в ЦНС концентрации
Таблица 17 Тактика лечения болезни Альцгеймера
|
Тактика |
Лекарственные средства |
|
Лекарства, увеличивающие концентрацию ацетилхолина в синапсах или стимулирующие холинергические рецепторы мозга напрямую с использованием прекурсора |
Лецитин |
|
Препараты, усиливающие высвобождение ацетилхолина |
Гидергин |
|
Ингибиторы холинэстеразы |
Такрин, велнакрин, донепезил, ривастигмин, талантамин |
АХ не дает никакого очевидного улучшения познавательной способности;
- использование у крыс средств типа гидергин (эрголоид мезилат), которые увеличивают высвобождение АХ кортикальными слоями, но препарат еще не прошел испытания с участием добровольцев;
- применение ингибиторов холинэстеразы типа такрина, донепизила, ривастигмина, галантамина и велнакрина, которые значительно лучше, чем плацебо, увеличивают краткосрочную память, селективное внимание, языковые способности и практические функции при БА. Однако клинические результаты в целом весьма скромны: только у 10% пациентов наблюдалось улучшение. Неблагоприятные эффекты такрина и велнакрина: абдоминальные судороги, тошнота, полиурия и диарея. Серьезные неблагоприятные эффекты были отмечены у такрина, включая постоянное повышение активности трансаминаз печени у 15-30% пациентов, т.к. препарат обладает значительной гепатотоксичностью из-за индуцированного препаратом умеренного дозозависимого гепатита. Предложенные ранее ингибиторы холинэстеразы донепизил, ривастигмин и галантамин лучше переносятся пациентами, чем такрин и велнакрин, но имеют побочные эффекты в виде тошноты, рвоты и диареи, которые усугубляются при более высоких дозах и при быстром титровании.
Мультиинфарктная деменция[править | править код]
Мультиинфарктная деменция (МИД), или сосудистая деменция, является второй по частоте деменцией (15-30% всех случаев деменции). Хотя некоторые эксперты полагают, что болезнь диффузных телец Леви встречается более часто. МИД может сочетаться с другими дегенеративными деменциями, что составляет 15% всех деменций.
МИД чаще наблюдается у мужчин и у лиц с высоким риском сердечно-сосудистых заболеваний. Начало деменции обычно относительно острое, а прогрессирование пошаговое (с каждым случаем инфаркта). Зона и размер инфарктов определяют познавательные дефициты. Неврологические признаки в целом более общие, чем при БА.
Типичные клинические особенности МИД: резкое начало, эмоциональная несдержанность, пошаговое ухудшение, гипертензия в анамнезе, неустойчивость сознания, инсульты в анамнезе, атеросклероз, относительное сохранение индивидуальности, депрессии, очаговые неврологические симптомы и признаки, соматические жалобы и неоднородные когнитивные дефициты.
Фармакологическую терапию МИД проводят с целью уменьшения риска дальнейшего мозгового инфаркта
Гипертензию необходимо лечить соответствующими антигипертензивными средствами, также нужно проводить терапию сопутствующих состояний, которые предрасполагают к эмболии (например, сердечные аритмии, пороки клапанного аппарата). Каждому пациенту с подозрением на МИД показан ежедневный прием аспирина как антиагреганта. Если есть сопутствующие характерные признаки БА, могут быть предписаны лекарственные средства, влияющие на холинергическую иннервацию (см. ранее).
Согласно новому докладу[1], прогулки на свежем воздухе 3 раза в неделю, могут усилить функцию мозга и навыки мышления людей с сосудистой деменцией. Результаты исследования показывают, что ходьба несколько раз в неделю может изменить траекторию болезни и улучшить физическое благополучие людей, у которых развивается общая форма потери памяти по возрасту, которая в противном случае имеет несколько методов лечения.
Болезнь Паркинсона[править | править код]
Болезнь Паркинсона — неврологическое расстройство, характеризуемое нарушением произвольных движений. Произвольные движения контролируются центральными нейрональными путями, которые распространяются в пирамидных (кортикоспинальных) трактах из двигательной зоны коры вниз к спинному мозгу, к нижележащим двигательным нейронам (мотонейронам). Эти мотонейроны непосредственно управляют произвольной деятельностью мышц. Помимо главных нейрональных трактов нейрональные влияния других источников также оказывают некоторое воздействие на пирамидные тракты. Эти дополнительные пути обеспечивают экстрапирамидное влияние, которое успокаивает произвольные движения. Один из основных экстрапирамидных источников — базальные ганглии (хвостатое ядро, скорлупа и бледный шар — палиостриатум). Болезнь этих структур (например, болезнь Паркинсона) затрагивает процесс выполнения произвольных движений.
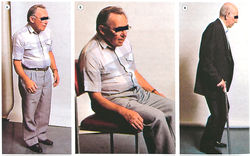
Основные симптомы болезни Паркинсона:
- гипокинезия (медленное инициирование движений);
- тремор в покое (движения типа «катание пилюль»);
- мышечная ригидность (сопротивление пассивным движениям конечностей);
- неправильное положение тела (рис. 33). Признаки, идентифицированные у пациентов с болезнью Паркинсона:
- характерная переминающаяся походка;
- отсутствующее выражение лица;
- ухудшение речи;
- неспособность выполнять квалифицированные задачи.
Болезнь наблюдается в основном в пожилом возрасте и без лечения прогрессирует.
Паркинсонизм обычно является идиопатическим заболеванием, но может быть вызван нейролептиками
Обычно причина возникновения болезни Паркинсона неизвестна, но поскольку заболевание связано с потерей дофаминергических нейронов в базальном ганглии, вероятно, что болезнь может быть вызвана токсическими факторами окружающей среды. Например, 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) (химическая примесь, произведенная при незаконном синтезе аналога героина) вызывает у приматов необратимое повреждение нигростриарного дофаминергического тракта и ведет к развитию признаков, подобных идиопатической болезни Паркинсона у людей. Предположительно в этом процессе участвует метаболит МПП+, образуемый МАОв из МФТП, а ингибиторы МАОв (например, селегилин) могут предотвращать повреждение, вызванное МФТП.
Паркинсонизм может быть вызван средствами, блокирующими дофаминергические рецепторы полосатого тела (например, нейролептиками типа хлорпромазина). Действительно, когда подобные лекарственные средства используют в лечении шизофрении, может возникать паркинсоноподобный синдром как побочный эффект. Паркинсоноподобный синдром вызывают и лекарственные средства, исчерпывающие дофамин в нервах черной субстанции (например, резерпин). В посмертных исследованиях установлено, что в мозге больных болезнью Паркинсона содержится существенно меньшая концентрация дофамина (менее 10% нормы) в полосатом теле и черной субстанции.
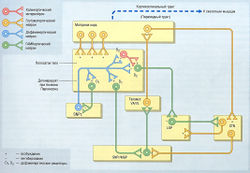
Холинергическая гиперактивность полосатого тела также связана с развитием болезни Паркинсона. Обычно активность этого нейронального пути противопоставляется дофаминергическому тракту, который идет от черной субстанции (рис. 34).
рис. 34 Система базальных ганглиев, повреждаемая при болезни Паркинсона. При болезни Паркинсона ингибирующее действие дофаминергической системы на экстрапирамидные пути, идущие от компактной части черной субстанции (SNPc) к стриарным ГАМКергическим нейронам, уменьшается на 20-40%, обычно из-за нейродегенерации. Это приводит к ничем не уравновешиваемому холинергическому возбуждению в ГАМКергических нейронах, что ведет к патологическим проявлениям болезни Паркинсона. В норме 2 нейрональных пути от базальных ганглиев регулируют вклад таламической обратной связи от двигательной коры для обеспечения плавности движений. Оба пути активируются глутаматергическими нейронами двигательной коры. Прямой путь состоит из стриарных ГАМКергических нейронов, которые посылают ингибирующий сигнал к ретикулярной части черной субстанции (SNPr) и медиальной части бледного шара (MGP), что ведет к устранению ингибирования на таламус и, таким образом, позволяет осуществлять таламическую обратную связь с двигательной зоной коры. Обратный путь также состоит из других групп стриарных ГАМКергических нейронов, которые посылают ингибирующий сигнал к латеральной части бледного шара (LGP), чтобы предотвратить ингибирование им возбуждающего нейронального сигнала от субталамического ядра (STN) к ретикулярной части черной субстанции и медиального бледного шара. Возбуждение последних ведет к ингибированию таламической обратной связи с моторной корой и влияет на плавность выполнения движений. Относительная активность этих двух путей регулируется действием дофаминергических нейронов с компактной части черной субстанции к полосатому телу. Ацетилхолин найден в интернейронах непрямого пути. VA — вентральное переднее ядро; VL — вентральное латеральное ядро.
Лечение болезни Паркинсона вызывает усиление стриарной дофаминергической активности и ингибирование стриарной холинергической мускариновой активности
Лечение болезни Паркинсона основано на коррекции дисбаланса в базальном ганглии между дофаминергической и холинергической системами. Используют две основные группы средств:
- средства, усиливающие дофаминергическую активность между черной субстанцией и полосатым телом;
- средства, ингибирующие стриарную холинергическую мускариновую активность.
Клиническая эффективность имплантированных хирургическим путем тканей, богатых дофамином (например, хромаффинные клетки надпочечников), в полосатое тело для улучшения дофаминергической активности сомнительна. Изучаются возможности генной терапии. С целью увеличения содержания дофамина в полосатом теле трансформируют ген тирозингидроксилазы к полосатому телу, что увеличивает уровень синтеза дофамина.
Средства, которые усиливают дофаминергическую активность[править | править код]
Леводопа[править | править код]
Леводопу используют вместо дофамина (последний не проникает через гематоэнцефалический барьер) для увеличения содержание дофамина в полосатом теле. Леводопа — предшественник, из которого путем декарбоксилирования образуется дофамин (рис. 35). Леводопа проникает через гематоэнцефалический барьер, подвергается декарбоксилированию и увеличивает содержание дофамина, что позволяет противостоять чрезмерной стриарной холинергической активности и восстановить равновесие между этими системами.
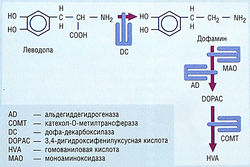
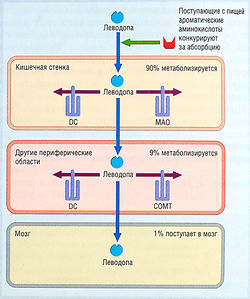
Леводопа быстро абсорбируется из тонкой кишки активной транспортной системой для ароматических аминокислот. Его абсорбции могут мешать диетические ароматические аминокислоты, повышенная желудочная кислотность, замедление эвакуации желудочного содержимого и присутствие пищи. Пиковые концентрации в плазме достигаются через 1-2 час после приема дозы препарата. Период полувыведения в плазме — 1-3 час из-за интенсивного метаболизма в стенке кишечника (рис. 36). Леводопа также метаболизируется в крови и периферических тканях, и только = 1% назначенной дозы достигает мозга. Дофамин — главный периферический продукт метаболизма леводопы, который ответственен за большинство периферических неблагоприятных эффектов леводопы. Другие продукты метаболизма — гомованиловая и 3,4-дигидрофенилуксусная кислоты (см. рис. 35). Периферический метаболизм леводопы означает, что для получения терапевтических эффектов в мозге нужно назначать большие дозы, но такие дозы вызывают много неблагоприятных эффектов.
рис. 36 Процентное соотношение леводопы, поступающей в мозг после перорального введения. Значительный метаболизм происходит в стенке кишечника с участием дофа-декарбоксилазы (DC) и, в меньшей степени, моноаминоксидазы (МАО). Леводопа также метаболизируется в крови и периферических тканях с помощью катехол-О-метилтрансферазы (СОМТ) и DC. Степень периферического метаболизма составляет 99%, позволяя лишь около 1% введенной леводопы проникнуть в мозг и оказать свое терапевтическое действие.
Периферические побочные эффекты леводопы можно уменьшить комбинацией с периферическим ингибитором дофа-декарбоксилазы или одновременным назначением домперидона или селегилина
Побочные эффекты можно уменьшить, комбинируя леводопу с периферическим ингибитором дофа-декарбоксилазы типа карбидопы или бенсеразида. Оба препарата уменьшают периферический метаболизм леводопы так, что ее можно использовать в более низких дозах. Ни карбидопа, ни бенсеразид не проникают через гематоэнцефалический барьер, следовательно, они блокируют метаболизм только на периферии.
Однако эта комбинация препаратов не только максимализирует терапевтические эффекты леводопы, но и усиливает нежелательные центральные эффекты дофамина. Дополнительно назначенный пиридоксин (витамин В6), который обычно увеличивает периферический метаболизм леводопы, не мешает терапевтической эффективности лекарственной комбинации.
Некоторые из периферийных неблагоприятных эффектов леводопы также можно уменьшить назначением дофаминергического антагониста D2-рецепторов домперидона, который не проникает через гематоэнцефалический барьер.
Селегилин, ингибитор МАО, который селективно блокирует МАОв, можно использовать для селективного ингибирования метаболизма в мозге. МАОв — преобладающая изоформа МАО, ответственная за метаболизм дофамина в головном мозге (МАОА преобладает на периферии). В отличие от неселективных ингибиторов МАО, селегилин не ингибирует периферический метаболизм тира-мина и, таким образом, стимулирует «сырную реакцию» (см. ранее). Хотя селегилин используют главным образом с леводопой, для пролонгирования и усиления центральных дофаминергических эффектов селегилин можно применять как монотерапию на ранних стадиях паркинсонизма, чтобы замедлить прогрессирующую потерю дофаминергических нейронов в базальном ганглии.
Другой терапевтический подход к усилению центральных эффектов леводопы включает назначение ингибиторов катехол-О-метилтрансферазы (например, энтакапон, толкапон). Эти средства предотвращают превращение леводопы в 3-0-метилдопу, что проявляется у обоих лекарств периферически, а у толкапона, который проникает через гематоэнцефалический барьер, — центрально.
ЭФФЕКТЫ ЛЕВОДОПЫ ВО ВРЕМЯ ЛЕЧЕНИЯ. При первом применении леводопы симптомы паркинсонизма (ригидность, дискинезия и тремор, а также отсутствующее выражение лица, речь и почерк) обычно улучшаются. Однако после нескольких лет лечения возможно уменьшение эффективности из-за прогрессирующей потери дофаминергических нейронов со временем.
Полезные эффекты леводопы могут варьировать во время терапии и приводить к ухудшению симптомов (например, ригидности и дискинезии). Это явление, названное «релейный эффект» (см. далее), приводит к затруднению инициации движения даже при ходьбе или попытке встать со стула. Механизм этого явления непонятен, но «релейный эффект» происходит, когда падает концентрация леводопы в плазме. Более частые, но меньшие дозы леводопы, а также дополнение бромокриптина более низкими дозами леводопы могут уменьшить частоту возникновения этого эффекта.
Полезные эффекты леводопы реализуются главным образом через D2-peцепторов
D2-рецепторы распределены постсинаптически на ГАМКергических нейронах, которые формируют часть косвенного пути от базального ганглия, регулирующего таламическую обратную связь к двигательной зоне коры. На клеточном уровне активация D2-рецепторов ингибирует адеиилилциклазу, и, как следствие, происходит уменьшение продукции вторичного посредника цАМФ. Уменьшение цАМФ противостоит возбуждающим эффектам холинергических межнейронов на ГАМКергических нейронах (косвенный путь). Следовательно, ГАМКергические нейроны выступают противовесом таламической обратной связи к двигательной зоне коры. Есть доказательство, что D1рецепторы распределены постсинаптически на другой группе ГАМКергических нейронов таламуса, которые формируют часть прямого пути базального ганглия, облегчающего обратную связь от таламуса к двигательной зоне коры. Активация D1-рецепторов ведет к возбуждению аденилилциклазы и увеличению цАМФ, что активизирует прямой базально-ганглиевый путь и, как следствие, облегчает обратную связь от таламуса к двигательной коре (см. рис. 34).
В результате этих действий дофамин восстанавливает регулирующий контроль за нейрональным высвобождением от базального ганглия до таламуса (см. рис. 34), который посылает соответствующие нервные импульсы к двигательной коре для плавного выполнения движений и облегчения симптомов болезни Паркинсона.
Побочные эффекты леводопы:
- тошнота, рвота и анорексия;
- гипотензия и сердечные аритмии;
- непроизвольные движения (дискинезы);
- эффект “on-off”;
- изменения поведения.
Тошнота, рвота и анорексия — результат возбуждения дофаминергических рецепторов в хеморецепторной триггерной зоне области рвотного центра. Эффекты уменьшаются или домперидоном, или ингибитором дофа-декарбоксилазы (например, карбидопой), назначенным с леводопой.
Эффекты леводопы на сердце (обычно тахикардия или экстрасистолия) возникают из-за увеличенного катехоламинового возбуждения после чрезмерного периферического метаболизма леводопы. Хотя такое объяснение гипотензии сомнительно, но есть свидетельства, что возможно центральное воздействие с симпатической активностью. Однако у многих пациентов гипотензия уменьшается при длительном лечении леводопой.
Побочные эффекты леводопы
- Непроизвольные движения
- Эффект “on-off”
- Рвота
- Гипотензия
- Некоторые сердечные аритмии
После длительного лечения леводопой развиваются дискинезии, которые вовлекают главным образом мышцы лица и конечностей, особенно когда леводопу используют в комбинации с ингибитором дофа-декарбоксилазы или когда предприняты другие меры к увеличению центрального дофамина. Нарушения движения можно уменьшить путем понижения дозы леводопы, таким образом сокращая центральную дофаминовую концентрацию, но ригидность может появляться вновь.
Эффект “on-off” — это быстрые колебания клинических проявлений: от увеличенной подвижности и общего улучшения к увеличенной ригидности и общему ухудшению способностей пациента выполнять произвольные движения. Эффект возникает внезапно и продолжается от нескольких минут до нескольких часов. В настоящее время нет убедительного объяснения этого эффекта, но подобное ухудшение может происходить, когда падает концентрация леводопы в плазме крови (см. ранее).
Психические изменения включают бессонницу, расстройство и другие нарушения, которые обычно отмечают при шизофрении. При шизофрении увеличивается дофаминергическая активность в мезолимбической области мозга, что можно контролировать нейролептиком типа клозапин.
Другой дофаминовый агонист, мелевдопа, и орально активный агонист D3-рецептора прамипексол также используют для лечения болезни Паркинсона.
Бромокриптин[править | править код]
Бромокриптин — препарат из группы средств, полученных из алкалоидов спорыньи, включая перголит и лизурида малеат.
Бромокриптин используют в лечении болезни Паркинсона в качестве агониста дофаминовых D2-рецепторов в полосатом теле. Однако он также активирует другие сайты центрального D2-рецептора (например, в задней доле гипофиза) и D1рецептора. Препараты группы алкалоидов спорыньи также можно использовать для лечения гиперпролактинемии и подавлять высвобождение гормона роста при акромегалии (см. главу 11).
Бромокриптин часто добавляют к леводопе при лечении болезни Паркинсона, когда недостаточно леводопы или когда пациенты испытывают серьезные эпизоды эффекта “on-off”. Обычно комбинация состоит из субмаксимальных доз леводопы и бромокриптина, но иногда используют полные дозы одного бромокриптина. Хорошие результаты получены при обоих режимах, однако четко не установлено, что бромокриптин эффективен у пациентов, которые стали невосприимчивыми к леводопе. Период полувыведения бромокриптина в плазме более длительный (6-8 час), чем у леводопы, хотя пиковые концентрации в плазме обоих средств достигаются в течение одинакового периода (1-3 час) после перорального введения.
Неблагоприятные эффекты бромокриптина такие же, как у леводопы, за исключением того, что у некоторых пациентов гипотензия может быть достаточно серьезной и вызывает обморок, особенно часто после первой дозы. В связи с этим рекомендуется перед началом лечения бромокриптином провести тестирование на восприимчивость пациента к гипотензивному эффекту, назначив тест-дозу 1 мг препарата после еды пациенту, лежащему на кровати. Другие нежелательные эффекты: визуальные и слуховые галлюцинации, эритромелалгия с вовлечением ног и рук. Дискинезия возникает гораздо реже, чем при леводопе, возможно потому, что эффект агониста D2-рецептора в полосатом теле больший, чем частичный агонистический эффект на D1-рецептор в этой области.
Перголид уменьшает симптомы болезни Паркинсона так же эффективно, как и бромокриптин
Перголид и лизурид — агонисты D2-рецепторов. Перголид уменьшает признаки болезни Паркинсона так же эффективно, как и бромокриптин.
Перголид также является агонистом D1-рецепторов, поэтому реже вызывает тошноту, рвоту и гипотензию.
Другие выявленные агонисты D2-рецепторов: кеберголин (производное спорыньи), ропинирол и прамипексол. Эти препараты рекомендуется комбинировать с леводопой для уменьшения эффектов “on-off” и двигательных флюктуаций, что позволяет использовать более низкие дозы леводопы.
Амантадин[править | править код]
Амантадин применяют в лечении болезни Паркинсона. Препарат увеличивает центральное высвобождение дофамина. Однако амантадин менее эффективен, чем агонисты дофаминовых рецепторов, возможно, из-за различного механизма действия, который, как полагают, заключается в облегчении высвобождения нейронального дофамина и ингибировании его обратного захвата в нервы. Небольшой антихолинергический эффект также вносит вклад в его терапевтическую эффективность. Поскольку эффективность амантадина основана на его дофаминергическом механизме действия, то в результате прогрессирования дегенерации дофаминергических нейронов черной субстанции, через которые амантадин осуществляет свои терапевтические эффекты при болезни Паркинсона, препарат дает только краткосрочное улучшение, и эффективность утрачивается примерно через 6 мес после начала лечения. Если добавить к терапии амантадином леводопу, то это приведет к синергическим эффектам и улучшению терапии.
Амантадин обычно назначают орально; он хорошо абсорбируется из желудочно-кишечного тракта.
Лекарственная терапия болезни Паркинсона
- Лекарственные средства используют, чтобы восстановить нигростриарную дофаминергическую активность или ингибировать стриарную холинергическую гиперактивность
- Леводопа, предшественник дофамина, является основным лекарственным препаратом, который может проникать через гематоэнцефалический барьер и превращаться в дофамин в ЦНС
- Эффективность леводопы сохраняется лишь около 2 лет, т.к. ее центральное превращение в дофамин постепенно уменьшается вследствие прогрессирующей потери дофаминергических нейронов
- Терапевтическая польза леводопы максимальна при назначении в комбинации с ингибитором периферической дофа-декарбоксилазы (например, карбидопой) или селективным ингибитором моноаминоксидазы В (например, селегилином), или ингибитором катехол-О-метилтрансферазы
- Периферические неблагоприятные эффекты леводопы можно предотвратить путем комбинирования его с домперидоном — периферическим антагонистом дофамина
- Бромокриптин (агонист дофамина), амантадин (увеличивающий высвобождение дофамина) и антихолинергические средства (например, тригексифенидила гидрохлорид и бензтропина мезилат) также используют для лечения болезни Паркинсона
- Антихолинергические средства более эффективны в контролировании тремора, чем других симптомов болезни
Период полувыведения в плазме — 2-4 час, но при почечной недостаточности он накапливается, т.к. экскретируется с мочой в неизмененном виде.
Неблагоприятные эффекты амантадина аналогичны таковым леводопы — галлюцинации, расстройство, кошмары и анорексия, но менее серьезны. Длительное использование амантадина может привести к развитию сетчатой мраморной кожи, связанной с катехоламиновой вазоконстрикцией в нижних конечностях.
Средства, которые ингибируют стриарную холинергическую активность[править | править код]
Ингибирование стриарной холинергической активности полезно для лечения болезни Паркинсона. Наиболее часто используют мускариновые антагонисты, т.к. стриарное холинергическое возбуждение противостоит дофаминергическому ингибированию стриарной ГАМКергической активности нерва (см. рис. 34). Главная задача в лечении болезни Паркинсона — уменьшение чрезмерной стриарной холинергической активности.
Прототип этой группы средств — тригексифенидила гидрохлорид. Другие средства: бензтропина мезилат, бипериден, орфенадрина гидрохлорид (который является также антагонистом Н1рецептора) и проциклидина гидрохлорид. В целом их терапевтическая эффективность меньше, чем у леводопы, но тремор уменьшается больше, чем ригидность и брадикинезия. Препараты также уменьшают чрезмерную саливацию, связанную с болезнью Паркинсона. Эти средства назначают внутрь. Какого-либо существенного различия в терапевтической эффективности среди препаратов этой группы нет.
Ожидаемые периферические антихолинергические побочные эффекты (сухость во рту, нарушения зрения, задержка мочи и запор) — общие для препаратов этой группы. Более часто пациенты переживают различные побочные эффекты на ЦНС, включая умственные расстройства, бред, галлюцинации, сонливость и изменения настроения. Паркинсонизм может прогрессировать, если не продолжать прием лекарств; любое завершение лечения должно быть постепенным.
Болезнь Хантингтона[править | править код]
Болезнь Хантингтона — расстройство, выражающееся в нарушении движений из-за дефектов в базальном ганглии и связанных структурах. Однако, в отличие от болезни Паркинсона, это гиперкинетическое расстройство, характеризующееся чрезмерными и неправильными движениями. Движения непроизвольные, нерегулярные и судорожные; вовлечены различные группы мышц лица, туловища и шеи. Расстройство также характеризуется прогрессирующей деменцией.
Болезнь Хантингтона наследственная и часто проявляется в зрелом возрасте. Симптомы связаны с биохимическими дефектами в базальном ганглии, многие из которых являются зеркальным отображением дефектов при болезни Паркинсона. Например, у пациентов с болезнью Хантингтона в посмертных исследованиях были найдены увеличенные концентрации дофамина. Уменьшенная активность декарбоксилазы глютаминовой кислоты (фермента, который синтезирует ГАМК) и холин-ацетилтрансферазы коррелируют с недостаточным уровнем ГАМК и АХ в базальном ганглии. Надо полагать, что эта недостаточность уменьшает ингибирующее влияние (через стриарные ГАМК-нейроны) на нигростриарные дофаминергические нейроны (см. рис. 34) и ведет к дофаминергической гиперактивности, связанной с болезнью Хантингтона. Дальнейшее развитие этого патофизиологического процесса подтверждается наблюдениями устранения признаков болезни Хантингтона препаратами, блокирующими дофаминовые рецепторы, и ухудшением состояния в результате приема препаратов, которые увеличивают дофаминергическую активность базального ганглия.
Лечение болезни Хантингтона использованием лекарств, которые уменьшают дофаминергическую активность базального ганглия
Средствами, которые истощают центральные запасы дофамина, блокируя поступление в нейрональные везикулы, являются резерпин (используемый в малых дозах 0,25 мг/сут; больше применяемый в Великобритании) и тетрабеназин. Нежелательные эффекты этих средств: гипотензия, депрессия, угнетение и расстройства желудочно-кишечного тракта. Эти эффекты наблюдаются реже при использовании тетрабеназина.
Средствами, уменьшающими дофаминергическую активность путем блокирования рецепторов, являются фенотиазины (например, перфеназин) и бутирофеноны (например, галоперидол). Главные побочные эффекты, связанные с их использованием: возбужденное состояние и паркинсонизм.
ИНСУЛЬТ[править | править код]
Инсульт — одна из ведущих причин смерти либо длительной недееспособности в западных странах. Контроль инсульта значительно изменился, поскольку теперь появилась возможность повлиять на неврологические дефициты у многих пациентов, если лечение начато тотчас после развития симптомов. Ввиду этого инсульт нужно рассматривать в том же контексте, что и острый инфаркт миокарда, при котором быстрое обращение в учреждение экстренной медицинской помощи влияет на исход.
Начальный диагноз «инсульт» прежде всего клинический и обсуждаться здесь не будет. Дифференциальную диагностику между ишемическим и геморрагическим инсультом необходимо проводить быстро, т.к. для этих двух видов инсульта раннее лечение и терапия, нацеленная на вторичную профилактику, весьма различны.
Компьютерная томография (КТ) мозга, а в некоторых случаях и магнитно-резонансная томография (МРТ), могут быть наиболее полезными методами для дифференциальной диагностики. Ишемический инсульт обычно вызван окклюзией мозговой артерии. Клинические дефициты из-за локальной утраты нейрональных клеточных функций, обнаруженные на ранней стадии ишемического инсульта, могут быть обратимы, если удается быстро восстановить мозговой кровоток. Временной отрезок для этой возможности точно не определен. Как только он превышен, повреждение будет прогрессировать к необратимой стадии, связанной с нейрональной клеточной смертью. Тромболитическая терапия показана для многих пациентов с ишемическим инсультом, но противопоказана пациентам с кровоизлияниями.
Тромболитическая терапия острых инсультов[править | править код]
Обзоры многих исследований свидетельствуют о пользе тромболитической терапии, особенно в уменьшении неврологического дефицита в зависимости от момента оценки через 3-6 мес. Хотя тромболитическая терапия тканевым активатором плазминогена (tPA), стрептокиназой или урокиназой может вызвать интракраниальное кровотечение, польза такой терапии превышает риск кровотечения. Кроме того, для пациентов с ишемическим инсультом, получивших терапию в пределах 3 час после начала события, риск интракраниального кровотечения существенно меньше. Результаты клинических испытаний показали чрезвычайную важность лечения ишемического инсульта. Дальнейшие исследования необходимы для характеристики использования tPA у пациентов с сопутствующими заболеваниями типа диабета и гипертензии, но уже существующие данные свидетельствуют о пользе терапии tPA в ранней стадии инсульта. В то же время эта терапия абсолютно противопоказана пациентам, получающим антикоагулянты или имеющим нарушения свертываемости или тромбоцитопению. Использование tPA при тромболитических состояниях описано в главе 10. Возможна незначительная польза применения аспирина на ранних стадиях острого инсульта. Потенциальная польза антикоагулянтов в лечении острого инсульта не установлена.
Профилактика инсульта[править | править код]
Аспирин полезен для профилактики инсультов, особенно у пациентов с приступами транзиторной ишемии или атеросклерозом сонной артерии. Аспирин и другие антитромбоцитарные препараты обсуждены в главе 10. Антикоагулянт варфарин полезен для предотвращения инсульта у пациентов с фибрилляцией предсердий. Использование и терапевтическое мониторирование варфарина обсуждены в главе 10.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ИНФЕКЦИИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ[править | править код]
Инфекции могут возникать в любой области центральной нервной системы:
- менингиты (воспаление твердых оболочек);
- радикулиты (воспаление спинальных нервных корешков);
- миелиты (воспаление спинного мозга);
- энцефалиты (воспаление головного мозга);
- абсцесс мозга (локальное скопление гноя).
Кроме того, новые методы визуализации (например, МРТ) показали, что многие области ЦНС демонстрируют динамически флюктуирующие воспалительные процессы еще не известных синдромов. Причина этих повреждений не установлена, возможно это вирус или другой инфекционный агент.
ЦНС защищена черепом, спинным столбом и менингеальными мембранами, но доступна инфекционным агентам:
- через любое повреждение в защите ЦНС (например, перелом черепа);
- через кровь (например, сепсис с последующим формированием абсцесса);
- через нервы (например, вирус бешенства);
- иными способами (например, вирус простого герпеса, ВИЧ).
Локальный иммунный ответ ЦНС на инфекцию зависит от реакции организма на инфекционный агент. Степень и характер ответа на различные микробные агенты весьма разнообразны.
Организмы, инфицирующие ЦНС, могут быть различными: от гельминтных паразитов (например, Trichinella spiralis, нематоды), грибов и бактерий (например, Coccidioides immitis и Mycobacterium tuberculosis) до вирусов (например, ВИЧ) и подвирусных белков (например, прионы при болезни Крейтцфельдта-Якоба и бычьем губковидном энцефалите).
Диагноз инфекции ЦНС основан на анамнезе, физикальном и лабораторном исследованиях
Признаки и симптомы зависят от возбудителя: лихорадка, возбудимость вплоть до конвульсий, измененный процесс мышления, измененная двигательная функция, усталость, сонливость или кома. Абсцессы и паразитарные кисты, как значительные по площади повреждения, могут вызывать симптомы и признаки, возникающие в результате давления или деструкции примыкающих структур (например, дефекты полей зрения из-за давления или разрушения зрительного нерва).
Может быть полезно исследование СМЖ:
- повышенное начальное давление и увеличенная концентрация белка в СМЖ предполагают инфекцию;
- микроскопическое исследование может выявить лейкоцитоз (бактериальная инфекция), лимфоцитоз (вирусная инфекция) или эозинофилию (паразитарная инфекция);
- окраска по Граму может выявить менингококк (Neisseria meningitidis) или Streptococcus pneumoniae, синее окрашивание — некоторые патогенные грибковые инфекции;
- биохимический анализ может показать присутствие вирусов или паразитов или их соответствующих антител;
- специальное обследование ЦНС с помощью компьютерной аксиальной томографии или МРТ также помогает в постановке диагноза, особенно абсцесса или другого пространственного повреждения.
Если бактерии попадают в кровоток, есть вероятность, что разовьется абсцесс мозга. Довольно редко это может произойти после стафилококковой кожной инфекции.
Энцефалиты могут развиваться как с воспалением твердых оболочек, так и без воспаления, но часто энцефалиты возникают вместе с менинге-альным раздражением из-за инфекции или присутствия в СМЖ индуцирующей воспаление субстанции (например, крови). Специфические признаки энцефалитов и признаки менингеального раздражения:
- ригидная шея;
- боль при сгибании шеи;
- боль, сопровождающая ограниченный пассивный подъем прямой ноги.
При наличии этих признаков необходимы дальнейшие исследования.
Использование лекарственных средств для контроля или устранения инфекций ЦНС
После идентификации инфекционного агента необходимо выбрать препарат с наибольшей селективной токсичностью к агенту.
Препарат должен проникать через гематоэнцефалический барьер и достигать очага инфекции в адекватных концентрациях (абсцессы необходимо удалять хирургически в дополнение к фармакологическому лечению).
Использование лекарственных средств при инфекциях ЦНС для контроля реакции организма на инфекцию
Такими реакциями могут быть судороги, которые купируют противоэпилептическими препаратами, а также аллергические и другие иммунологические ответы, которые лечат глюкокортикостероидами (см. главу 11).
Антибиотики и антивирусные препараты плохо проникают в ЦНС
Относительная концентрация пенициллина G в СМЖ, по сравнению с концентрацией в сыворотке, составляет 5%, ампициллина — 15%, нафциллина — 5%, ванкомицина — 10%, хлорамфеникола -30%, гентамицина — 20%, цефотаксима — 15%, цефтриаксона — 5% и цефтазидима — 20%. Антибиотики и антивирусные средства более детально рассмотрены в главе 6.
На вопрос, нужно ли антибиотики вводить непосредственно в СМЖ, ответа нет, но уровень смертности детей с менингитом, вызванным грамотрицательными возбудителями, увеличивался, когда гентамицин вводили в желудочки мозга. Таким образом впрыскивание антибиотиков в СМЖ представляет значительный риск.
Вирусный менингит и энцефалит[править | править код]
Практически любой вирус может вызвать энцефалит с различной степенью менингеального воспаления, включая вирус краснухи или вирус паротита, разнообразные вирусы герпеса, типы 1 и 2, вирус Эпштейна-Барр, цитомегаловирус, вирус ветряной оспы, вирус Коксаки и вирус иммунодефицита человека (см. Лечение вирусных заболеваний).
Для лечения используют соответствующий антивирусный препарат (если таковой существует), и почти всегда необходимо внутривенное введение:
- ацикловира — препарата выбора для лечения энцефалита, вызванного HSV-1. Использование ацикловира уменьшило смертность с 80 до 20%;
- фоскарнета — для лечения ацикловир-резистент-ного энцефалита, вызванного HSV-1;
- соривудина — для лечения инфекций, вызванных VZV;
- ганцикловира — для лечения цитомегаловирусного энцефалита, но препарат нужно использовать с осторожностью из-за его токсичности в отношении костного мозга; поскольку ганцикловир экскретируется прежде всего почками, необходимо проверить почечную функцию.
Лечение церебральной болезни у пациентов с ВИЧ затрагивает проблемы терапии ВИЧ или других агентов (грибы или паразиты), вызывающих патологию (см. далее).
Некоторые вирусы, которые вызывают энцефалит (например, вирус бешенства), не восприимчивы к антивирусным средствам.
Бактериальный менингит и энцефалит[править | править код]
Способность бактерии вызывать менингит зависит от возраста пациента. Наиболее частые причины бактериального менингита:
- грамотрицательные бациллы и стрептококки группы В (у младенцев до 1 мес);
- Haemophilus influenzae, N. meningitidis и S. pneumoniae (у детей в возрасте от 1 мес до 15 лет);
- N. meningitidis, S. pneumoniae и стафилококк у людей старше 15 лет.
Бактериальные инфекции ЦНС необходимо диагностировать как можно быстрее, чтобы использовать определенные антибиотики. Для идентификации бактерий культурируют спинномозговую жидкость и определяют чувствительность к антибиотикам.
Если этиология инфекции ЦНС неизвестна, но есть уверенность, что она бактериальная, то первоначально используют антибиотики, перечисленные в табл. 19. Если бактериальная этиология известна, то используют антибиотики для начальной терапии, перечисленные в табл. 20.
Туберкулез и сифилис ЦНС[править | править код]
Mycobacterium tuberculosis и Treponema pallidum являются основными причинами инфекций ЦНС.
М. tuberculosis (возбудитель туберкулеза) может инфицировать ЦНС и вызывать менингит, туберкулезные абсцессы или широко распространенный милиарный туберкулез головного и спинного мозга. Эти серьезные заболевания требуют соответствующих антибиотиков (см. Противотуберкулезные средства (антимикобактериальные)).
Сифилитический менингит и нейросифилис — проявления инфекции, вызванной Т. pallidum во время вторичного и третичного сифилиса. Нейросифилис часто сопровождается изменениями интеллекта и может принимать другие формы ментальной болезни. Во время третичного сифилиса в ЦНС могут формироваться сифилитические гуммы (области фокальной дегенерации мозговой ткани, подобно абсцессам). После диагностирования все стадии сифилиса должны быть пролечены пенициллином; после лечения пенициллином даже гуммы редуцируют.
Грибковые инфекции ЦНС[править | править код]
Различные грибы могут вызвать менингит и/или фокальные повреждения в головном и спинном мозге, особенно у пациентов с иммунодефицитом (например, у людей со СПИДом или у больных, получающих противоопухолевые или иммуносупрессивные средства). К таким грибам относятся С. immitis и Histoplasma capsulatum. Эти организмы напоминают М. tuberculosis, которые попадают в организм человека воздушным путем, в результате заболевание обычно поражает легкие, но может вовлекаться и ЦНС. СМЖ содержит комплементфиксированное антитело в 95% случаев концидиоидомикоза; обнаружение таких антител обусловливает начальную антимикотическую терапию. С. immitis можно обнаружить при микроскопическом исследовании СМЖ приблизительно в 50% случаев. Сопутствующие антитела менее часты при гистоплазмозе, этот диагноз зависит от выделения Н. capsulatum в культуре.
Таблица 19 Начальная антибиотикотерапия менингитов и энцефалитов, если этиология неизвестна, но есть уверенность, что она бактериальная
|
Группа пациентов |
Антибиотики |
|
Новорожденные до 1 мес |
Ампициллин + гентамицин или цефтриаксон, или цефотаксим |
|
Дети от 1 мес до 1 5 лет |
Ампициллин + хлорамфеникол или цефтриаксон, или цефотаксим |
|
Взрослые (т.е. старше 15 лет) |
Ампициллин или пенициллин С |
|
Взрослые с иммунодефицитом |
Ампициллин + цефтриаксон или цефотаксим + гентамицин |
|
Пациенты после краниотомии |
Нафциллин + цефтриаксон или цефотаксим + гентамицин |
|
Таблица 20 Рекомендации по антибиотикотерапии бактериального менингита и энцефалита при известном возбудителе | |
|
Возбудитель |
Антибиотик |
|
S. pneumoniae, стрептококки групп А и В, Listeria monocytogenes, N. meningitidis |
Пенициллин С |
|
Н. influenzae (β-лактамазонегативная гемофильная палочка) |
Ампициллин |
|
Метициллин-чувствительный S. aureus (золотистый стафилококк) |
Нафциллин |
|
Метициллин-резистентный S. aureus (золотистый стафилококк) и Н. influenzae (β-лактамазопозитивная гемофильная палочка) |
Ванкомицин Цефотаксим или цефтриаксон |
|
Escherichia coli, Klebsiella и Proteus | |
|
Pseudomonas aeruginosa (синегнойная палочка) |
Гентамицин + цефтазидим |
Лечение и концидиоидомикоза, и гистоплазмоза — сложный процесс, который базируется на амфотерицине В.
Протозойные инфекции ЦНС[править | править код]
МАЛЯРИЯ. Церебральная малярия, возникающая из-за инфицирования Plasmodium falciparum (см. главу 6), — наиболее серьезная и частая инфекция ЦНС. Каждый год регистрируют около 2 млн летальных исходов в результате малярии, из которых 0,5 млн приходится на детей с церебральной малярией в Африке. Показатель смертности от этого заболевания составляет ~ 20%, несмотря на эффективное общее лечение, которое включает хинин (или хинидин) или производные алкалоида полыни артемизина.
ТОКСОПЛАЗМОЗ. Инфекции, вызванные Toxoplasma gondii, могут встречаться у пациентов с иммуносупрессией. Если иммуносупрессия не связана со СПИДом, то лишь 2-5% инфекций ЦНС обусловлено этим возбудителем, но у пациентов со СПИДом частота повышается до 25-80%. При этих состояниях часто присутствуют повреждения мозга, которые лучше выявляются с помощью МРТ. В зависимости от локализации повреждений могут быть мышечная слабость, гемипарезы и конвульсии.
Средствами выбора для лечения токсоплазмоза являются пириметамин плюс сульфонамид. Однако из-за антифолатного действия пириметамина может возникнуть депрессия костного мозга. Антифолат триметоприм при этой болезни имеет небольшое значение. Можно применять антибиотик-макролид кларитромицин.
Гельминтные инфекции ЦНС[править | править код]
Инфицировать ЦНС могут три гельминта: Trichinella spiralis, Taenia solium и Echninococcus granulosis. Первые два попадают в организм человека при употреблении инфицированной, неадекватно приготовленной свинины или дичи (например, мяса медведя). Е. granulosis заселяют собак, яйца гельминтов выделяются с фекалиями, откуда могут попасть к людям. В какой-то момент паразит из кишечника может транспортироваться кровью в головной мозг, где вызовет большие пространственные повреждения мозга. Эти повреждения выявляют на МРТ или КТ. Неврологические симптомы будут зависеть от локализации повреждений.
Трихиноз с поражением ЦНС считается окончательно диагностированным при выявлении в СМЖ личинок. Заболевание обычно лечат преднизоном для подавления иммунного ответа на нематоды, который часто сопровождается значительной эозинофилией в СМЖ. Для подавления паразита назначают мебендазол.
Личинки Т. solium развиваются в мозге. Окончательный диагноз можно поставить с помощью биопсии одного из цистных повреждений. Лечение: глюкокортикостероиды для подавления иммунного ответа плюс албендазол или празиквантел.
Эхинококковые цисты обычно появляются в печени или легких, но если цисты разрываются, яйца гельминтов могут попасть в мозг, где разовьются новые цистные повреждения. Такие цисты часто обнаруживают при МРТ или КТ.
Хирургическое удаление цисты — радикальная терапия, но ни в коем случае цисту нельзя разрывать, т.к. яйца попадут с кровотоком в другое место в организме человеке. Применение албендазола во время операции может уменьшить риск распространения инфекции.
Рассеянный склероз[править | править код]
Рассеянный склероз — хроническое воспалительное состояние ЦНС. Обнаружено, что интерферон β уменьшает тяжесть и частоту рецидивов. Его назначают 1 раз в день или через день в виде инъекций, но возможны неблагоприятные гриппоподобные эффекты: боль в мышцах и озноб. Недавно для лечения рецидивов рассеянного склероза стали использовать глатирамера ацетат, который, вероятно, действует как агонист IL-4-, IL-6- и IL-10-рецепторов. В более поздней стадии клинического развития рассеянного склероза для лечения используют множество а4-интегрин-антагонистов типа натализумаба (рис. 37). Однако испытания с натализумабом были остановлены из-за множества летальных исходов от лейкоэнцефалопатии.
рис. 37 Рассеянный склероз, (а)Интегрин связывается с молекулой адгезии VCAM1, которая запускает Т-клеточный диапедез и, следовательно, аутоиммунное повреждение нижележащего нейрона, (б) Антитело натализумаб, связываясь, блокирует Т- клеточную адгезию и каскад, ведущий к нейрональному аутоиммунному повреждению нейронов и прогрессированию рассеянного склероза.
БОЛЬ[править | править код]
Боль — важнейший компонент защитной системы организма, сигнализирующий о повреждении. Интенсивная боль драматично ухудшает качество жизни пациента. Боль часто связана с целым рядом физиологических и центральных нарушений (например, беспокойством, депрессией, бессонницей, анорексией) и глубокими изменениями автономной функции (например, частотой сердечных сокращений, кровяным давлением, непроизвольным мочеиспусканием).
Боль имеет две формы:
- острая боль, которая носит кратковременный характер, обычно продолжается только во время повреждения ткани; представляет собой естественную, физиологическую защитную реакцию организма;
- хроническая боль, которая сохраняется даже при нормальных механизмах выздоровления, а также при таких болезнях, как ревматоидный артрит; может длиться в течение нескольких недель, месяцев или даже лет.
Физиологические функции хронической боли, если таковые вообще имеются, неизвестны. Однако ясно, что боль является важным компонентом ответа на различные травмы (например, ожоговые повреждения), хирургические вмешательства (например, послеоперационные боли) и заболевания (например, артрит, рак, болезни сердца, серповидноклеточный криз).
Болевое ощущение рассматривается как процесс, состоящий из трёх стадий
Понимание процессов, которые управляют восприятием боли в поврежденных тканях, спинном мозге и более высоких мозговых центрах, необходимо для адекватного устранения боли. Очень упрощенно восприятие боли может быть представлено тремя стадиями:
- болевая детекция в периферических тканях после активации специализированных рецепторов боли (ноцицепторов);
- передача болевой информации от периферии к дорсальным рогам спинного мозга, где она ингибируется или усиливается комбинацией локальных (спинных) нейрональных цепей и нисходящих трактов от более высоких мозговых центров;
- передача информации о боли к более высоким мозговым центрам, которые инициируют ответ.
Каждая из этих стадий управляется разнообразными местными гормонами в периферических участках и нейротрансмиттерами в центральных участках. Взаимодействия между различными нейротрансмиттерами очень сложны и до конца не изучены.
Первый шаг в восприятии боли — активация ноцицепторов в периферических тканях
В отличие от других чувствительных рецепторов, которые воспринимают такие стимулы, как механическое давление или температурные изменения, ноцицепторы (рис. 38) плохо определены анатомически. Вероятно, они являются простыми нервными окончаниями в коже, мышцах и глубже во внутренних органах. Как именно ноцицепторы активируются, например при повреждении ткани, остается загадкой, хотя множество медиаторов воспаления, присутствующих в участке повреждения ткани, могут стимулировать ноцицепторы и вызывать боль (см. рис. 38), включая гистамин (также вызывает зуд) и брадикинин (БК).
Гистамин и БК при нанесении в низких дозах на поверхность вскрытого волдыря на коже у добровольцев вызывают боль (рис. 39). БК действует через G-белок-связанные рецепторы (В2 и В2), чтобы вызвать различные провоспалительные эффекты, включая расширение сосудов и отек. Возбуждение рецепторов БК также активизирует на мембране фермент фосфолипазу А2, деятельность которой, в свою очередь, вызывает мембранную деэтерификаию, ведя к высвобождению арахидоновой кислоты
Определения, связанные с болью
- Боль — неприятное сенсорное и эмоциональное ощущение, связанное с фактическим или потенциальным повреждением ткани
- Острая боль — недавно начавшаяся боль ограниченной продолжительности. Обычно имеет известную причину: повреждение или заболевание
- Хроническая боль — боль, которая сохраняется в течение длительного периода, обычно превышающего время заживления ткани; причина не всегда может быть установлена
- Гипералгезия — чувствительность и/или боль, возникающая при относительно безобидной стимуляции
- Повреждающий стимул — стимул, который повреждает или потенциально разрушителен для ткани
- Ноцицепция — процесс обнаружения и передачи сигналов о наличии повреждающего стимула. Этот термин часто используют для описания процесса в экспериментах на животных
- Болевое поведение — поведение, которое должен обнаружить информированный наблюдатель, чтобы заключить, что человек или экспериментальное животное испытывает боль
- Алгоген — химический посредник, обеспечивающий проведение боли; обычно образуется при заболеваниях или повреждениях тканей
- Болеутоляющее средство — препарат или терапия, которые эффективно устраняют или по крайней мере уменьшают болевую чувствительность
- Антиноцицептивное средство — препарат или терапия, которые эффективно устраняют или по крайней мере уменьшают болевые ощущения (эйкозатетраеновой кислоты) и последующему биосинтезу простагландинов (ПГ) (например, ПГЕ2 и ПГ12) циклооксигеназой (ЦОГ).
Не удивительно, что простагландины найдены в месте воспалительного ответа (например, в синовиальной жидкости, полученной из суставов пациентов с ревматоидным артритом или остеоартрозом). ПГ вызывают гипералгезию, но не алгезию. Физиологические концентрации ПГЕ2 и ПГ12 не вызывают боль, когда их наносят на открытую ожоговую поверхность у добровольцев или после внутрикож-ного введения животным. Однако такие концентрации ПГ мощно потенцируют болевой эффект от механического или химического раздражения, аналогично нанесению гистамина и БК (см. рис.8.38, 8.39). 5-НТ — другой местный гормон, который вызывает болевой ответ через периферические ноцицепторы, вероятно более выраженный, чем вызываемый БК или гистамином. Разнообразие метаболических веществ, высвобождающихся из поврежденных клеток (например, АТФ, молочная кислота, К+) и ацидотические состояния, наблюдаемые во время воспаления, также обусловливают болевую активность.
Второй шаг в восприятии боли — передача информации от стимулированных внешних ноцицепторов к спинному мозгу
Информация передается от стимулированных ноцицепторов с периферии к спинному мозгу:
- миелиновые Аδ-волокна передают информацию быстро, со скоростью =15 м/сек, и вызывают острое и интенсивное болевое ощущение;
- безмиелиновые С-волокна передают информацию медленнее, со скоростью * 1 м/сек, и вызывают менее локализованную боль, обычно описываемую, как ноющая и пульсирующая. Тела нейронов и Аδ- и С-волокон лежат в пределах спинномозговых нервных узлов. Волокна входят в спинной мозг через задние спинальные корешки к синапсам — так называемым ноцицептивным нейронам, расположенным в поверхностном слое I и II и во внутреннем слое V в меньшей степени (только Аδ-волокна) (рис. 40; см. рис. 38). Возбуждающие аминокислоты типа глутамата и такие нейрокинины, как субстанция Р и нейрокинин А, действуют как нейротрансмиттеры между первичными центростремительными нервными окончаниями и спинномозговыми нейронами, воспринимающими боль.
рис. 40 Механизм восприятия боли. Активация периферических ноцицепторов в поврежденных или воспаленных тканях рядом алгетических и гипералгетических химических медиаторов, стимулирующих А8- и С-волокна афферентных нервов, которые прерываются в поверхностных пластинах I и II и внутренней пластине спинного мозга. Оксид азота (N0) является ретроградным трансмиттером, увеличивает выделение субстанции Р (SP) и глутамата, чтобы вызвать ощущение боли. АМРА — 2-амино-3,3-гидрокси-5-метилизооксазол-4-ил пропионовая кислота; NKA — нейрокинин A; NMDA - N-метил-О-аспартат-рецепторы; NOS — синтаза оксида азота.
Электрофизиологический анализ мембранных потенциалов клеток заднего рога в ответ на периферические повреждающие стимулы свидетельствует о сложном профиле их электрической активности
Происходит ранняя быстрая мембранная деполяризация, которую связывают с активацией АМРА-рецепторов глутаматом, высвобождающимся из первичных центростремительных нервов. За этим начальным ответом следует более медленно развивающаяся вторичная деполяризация. Глутамат, действующий на NMDA-рецепторы, и субстанция Р, которое считаются главным нейротрансмиттером в этом участке, а также другие нейропептиды типа вазоактивного интестинального полипептида, соматостатина и холецистокинина также могут регулировать этот процесс.
Дополнительная важная роль глутамата, действующего на NMDA-рецепторы, расположенные на спинальных ноцицептивных нейронах, заключается в индукции спинального «вовлечения».
Это «вовлечение» — электрофизиологическое явление, аналогичное «долгосрочному потенцированию» в других областях мозга. Его можно определить как увеличение амплитуды мембранной деполяризации в спинальных ноцицептивных нейронах после повторного возбуждения их С-волокон болевыми стимулами.
«Вовлечение» может объяснить, почему повреждение (например, неосторожный удар молотком по пальцу) не только вызывает мгновенную боль (обусловленную Аδ-волокнами), но и тупое пульсирующее болезненное ощущение в поврежденных областях через несколько минут или даже часов. Такая вторичная реакция запускается формированием провоспалительных болевых посредников типа БК и гистамина в поврежденной ткани. Начинается воспаление, и суммарная активация ноцицепторов ведет к прохождению импульсов по сенсорным С-волокнам, постепенно «вовлекая» ноцицептивные нейроны в спинном мозге. В итоге процесс достигает такой стадии, что обычно безвредные стимулы типа легкого прикосновения к пострадавшему пальцу или применение липкого пластыря вызывают гипералгезию.
«Вовлечение» спинного мозга объясняет, почему острая боль иногда переходит в хроническую спонтанно и без всякой видимой физиологической причины. Клеточный механизм этого «вовлечения», как полагают, включает следующие шаги:
- активация NMDA-рецепторов глутаматом либо непосредственно на ноцицептивном нейроне, либо на смежных нейронах;
- открытие NMDA-связанных Са2+-каналов в этих нейронах;
- активация Са2+-кальмодулин-зависимой синтазы оксида азота для высвобождения NO.
NO — свободно диффундирующий и хорошо растворимый в липидах медиатор, который быстро проходит ретроградно к первичному центростремительному окончанию нерва, чтобы увеличить выделение глутамата (и, возможно, также субстанция Р).
Таким образом, начальный выброс даже очень маленького количества глутамата от сенсорных терминалов С-волокон способен вызвать выделение все большего количества глутамата, усиливая деполяризацию ноцицептивных нейронов и завершая процесс «вовлечения». В связи с этим можно предсказать, что прерывание этого круга путем назначения ингибиторов NOS типа метилового эфира L-NG-нитроаргинина у экспериментальных животных облегчает боль. Будут ли такие лекарства эффективны при хронической боли, зависит от новых формул ингибиторов NOS с меньшим количеством побочных эффектов.
Электрическая активность спинальных ноцицептивных нейронов «настроена» на нейротрансмиттеры, высвобожденные из спинальных нейронов и главного супраспинального нисходящего нервного пучка
Местный контроль над болевой чувствительностью спинного мозга обеспечивается опиоидными пептидами, в особенности мет-энкефалином и β-эндорфином и в меньшей степени лей-энкефалином и динорфином. Каждый из этих пептидов расположен в пределах нейронов I и II пластин дорсальной части спинного мозга и обеспечивает анальгетический агонизм определенных опиоидных рецепторов (μ, δ и к).
Эпидурально введенные опиоиды (например, морфин) снимают боль, действуя на спинальном уровне. При системном введении опиоиды также влияют на восприятие боли в более высоких мозговых центрах. Механизм действия опиоидов в спинном мозге заключается в ингибировании выделения субстанции Р и глутамата из терминалей С-волокон, хотя клеточный механизм этого неясен.
Опиоидные рецепторы μ, δ, к2 и к2 принадлежат к семейству G-белок-связанных рецепторов
Активация опиоидных рецепторов приводит к различным клеточным последствиям, включающим ингибирование аденилилциклазы, что вызывает уменьшение внутриклеточной концентрации цАМФ. Полагали, что такое падение содержания нейронального цАМФ полностью объясняет болеутоляющий эффект опиоидов, но недавние исследования указывают на важность других клеточных механизмов:
- открытие К+-каналов, что вызывает гиперполяризацию нейронов, таким образом уменьшая возбудимость;
- блокирование открытия потенциал-зависимых Са2+-каналов, что нарушает высвобождение глутамата и субстанции Р из первичных центростремительных окончаний.
Другие нейротрансмиттеры также играют определенную роль, например ГАМК, обнаруженная в дорсальной части спинного мозга при мечении синтетическим ферментом глутаматдекарбоксилазой. Подобно опиоидам, ГАМК действует на ГАМКв-рецепторы, расположенные пресинаптически на первичных центростремительных волокнах нерва, и, вероятно, уменьшает высвобождение глутамата и субстанции Р. Таким образом, баклофен, который является агонистом ГАМКв-рецепторов, вызывает поведенческую антиноцицепцию у экспериментальных животных.
Третий шаг в восприятии боли — восходящее распространение болевой информации к более высоким мозговым центрам
Множество возбуждающих и угнетающих нейрональных импульсов, действующих на ноцицептивные нейроны в спинном мозге, свидетельствуют о значимости этих нейронов в передаче информации от тканевых ноцирецепторов к головному мозгу. Эта функция лежит в основе теории «контрольнопропускной службы» или «болевых ворот», выдвинутой Melzack и Wall в середине 1960-х гг. Согласно этой теории, ответственные за боль нейроны в I и II пластинах действуют как «интеллектуальные сторожа», т.е. контролируют афферентный поток болевых импульсов между поврежденными тканями и мозгом. Информация, которую они получают, изменяется и спинальными, и супраспинальны-ми воздействиями перед передачей как «сумму» знаний о болевом стимуле к более высоким центрам. Восходящие ноцицептивные пути, вовлеченные в эту заключительную стадию процесса, проходят в вентролатеральных и дорсолатеральных канатиках спинного мозга и заканчиваются главным образом в таламусе и ретикулярной формации. Далее восходящие тракты заканчиваются в мозговой коре и лимбической системе, где координируются когнитивные и эмоциональные аспекты боли.
Испытание болеутоляющих лекарств[править | править код]
Существуют разнообразные методы, позволяющие оценить болеутоляющие лекарства. Испытания на добровольцах включают:
- наложение шины на верхнюю часть руки и измерение отрезка времени, в течение которого доброволец может переносить дискомфорт, вызванный ишемией;
- воздействие лучистого тепла или давления на кожу;
- возбуждение кожи или пульпы зуба электрическим шоком;
- холодовые тесты, при которых руку или ладонь помещают в ледяную воду и фиксируют период времени до момента удаления ее из воды;
- воздействие на ожоговую поверхность вскрытого волдыря.
Разнообразные измерения для количественного определения степени восприятия боли
Объективно измерить боль трудно, поэтому используют экспериментальные методы, чтобы выразить степень восприятия боли. Для этого применяют скользящую шкалу для устных ответов (например, от 0 при отсутствии боли до 10 при сильнейшей боли) или визуальных (например, размещение отметок на 10-сантиметровой линейке, градуируемой соответствующим образом). Очевидно, что такую систему трудно использовать у маленьких детей. В подобных случаях детей можно попросить нарисовать лицо: от счастливого при отсутствии боли до грустного при сильнейшей боли. Понятно, что все эти тесты высокосубъективны, и необходим соответствующим образом обученный персонал и строгая статистическая оценка результатов, чтобы избежать ложных или искаженных выводов. Кроме того, личность индивидуума и такие факторы, как обстановка, в которой проходит
испытание, и отношение исследователя, могут заметно повлиять на ответ. Таким образом, существует потребность в рандомизации субъектов на группы. Однако каждый из описанных тестов можно использовать с различной степенью успешности для демонстрации индуцированной лекарствами анальгезии.
Лекарственная терапия боли[править | править код]
Нестероидные противовоспалительные средства[править | править код]
Нестероидные противовоспалительные средства блокируют синтез гипералгезивных и провоспалительных ПГ и образуют химически неоднородную группу лекарств (см. главу 9). Фармакологически НПВС проявляют умеренную болеутоляющую активность в дополнение к противовоспалительной и жаропонижающей активности. Повреждение ткани (связанное, например, с воспалением), сопровождающееся нарушением плазматической мембраны, активизирует фермент фосфолипазу А2, которая высвобождает свободную арахидоновую кислоту из мест ее связывания с фосфолипидной мембраной и делает ее восприимчивой к атаке циклооксигеназой (ЦОГ или PGH-синтазой). Все НПВС ингибируют ферменты ЦОГ, и этот эффект лежит в основе их болеутоляющей активности. Были идентифицированы две отдельные изоформы ЦОГ:
- ЦОГ-1 — конституционный (присутствующий постоянно) фермент, найденный в большинстве клеток тела. Он поддерживает образование ПГ, вовлеченных в управление сосудистым потоком через отдельные органы, регулирование агрегации тромбоцитов и т.д.);
- ЦОГ-2 начинает синтезироваться в воспалительных клетках типа нейтрофилов и тучных клеток после воздействия на них стимулов в виде бактериальных эндотоксинов и/или цитокинов (например, фактор некроза опухолей и интерлейкин-1β). ЦОГ-2 отвечает за образование ПГ в месте повреждения и/или воспаления ткани. Большинство доступных НПВС демонстрируют низкую или отсутствующую селективность как ингибиторы обеих изоформ ЦОГ. Некоторые вещества, такие как мелоксикам или нимесулид, преимущественно ингибируют фермент ЦОГ-2, хотя селективность этих веществ в отношении ЦОГ-1 небольшая. Доступны высокоселективные ингибиторы ЦОГ-2 (целекоксиб, прекоксиб и рофекоксиб), хотя рофекоксиб недавно был запрещен к применению в США по причине возросшего риска нежелательных сердечно-сосудистых эффектов (см. главу 9). Селективные ингибиторы угнетают ЦОГ-2 в несколько раз сильнее, чем ЦОГ-1, и проявляют выраженную противовоспалительную и анальгетическую активность. Дополнительное преимущество этих веществ связано со значительно меньшим числом побочных эффектов со стороны желудочно-кишечного тракта (следствие ингибирования ЦОГ-1), чем у классических НПВС.
Аспирин, являющийся наиболее типичным НПВС, был впервые использован клинически в 1899 г. Аспирин действует путем ковалентного модифицирования остатков серина как в ЦОГ-1 (серии 530), так и в ЦОГ-2 (серин 516), эффективно предотвращая дальнейший биосинтез простагландинов.
В течение последних 30 лет были открыты многие другие НПВС. Их лучше всего классифицировать по химической структуре: (1) салицилаты (например, аспирин, дифлунизал, олсалазин и натрия салицилат); (2) производные парааминофенолов (в частности, ацетаминофен); (3) индоловые кислоты (индометацин и сулиндак); (4) арилуксусные кислоты (толметин и кеторолак) и арилпропионовые кислоты (ибупрофен, флурбипрофен, напроксен и кетопрофен); (5) антраноловые кислоты, включая мефенамовую кислоту; (6) еноловые кислоты (пироксикам и теноксикам). В отличие от аспирина, большинство этих более новых веществ обратимо связываются с изоферментами ЦОГ-1 и ЦОГ-2. При лечении боли НПВС обычно назначают перорально, и анальгетическая активность обычно сохраняется в течение 6-8 час, хотя эффект некоторых НПВС, таких как пироксикам, лорноксикам и фенилбутазон (запрещен к применению в США), может длиться значительно дольше (от 12 час до нескольких дней).
НПВС оказывают эффективное обезболивающее действие при слабых и умеренных болях, таких как:
- боль, ассоциированная с воспалительным компонентом (например, подагра, ревматоидный артрит, остеоартроз, зубная боль, индуцированный ультрафиолетом солнечный ожог);
- боль при раковых метастазах, повреждениях (например, переломах костей, хирургических процедурах) и некоторых видах головной боли, которые также связаны с воспалительной реакцией;
- дисменорея, которая является результатом повышенного образования ПГ в матке.
В этом отношении наиболее часто используемыми НПВС являются аспирин и разнообразные салицилаты. В клинических условиях выбор между различными классами НПВС обычно очень мал. Однако некоторые НПВС (например, ацетаминофен и кеторолак) являются хорошими обезболивающими, но проявляют относительно низкую противовоспалительную активность. Ацетаминофен — относительно слабый ингибитор ферментов ЦОГ, точный механизм его действия в контролировании боли неизвестен. Однако следует отметить, что НПВС обычно неэффективны при сильной боли (в частности, висцерального происхождения), при которой значительно лучше применять опиоиды. Максимальная степень болеутоления, достигаемая с НПВС, меньше, чем при использовании опиоидов.
Неблагоприятные эффекты НПВС: желудочные кровотечения и изъязвления, особенно от аспирина (реже бывают у НПВС типа нимесулида). Ингибирование образования в желудке ПГЕ2 и ПГ12 (вазо-
Побочные эффекты нестероидных противовоспалительных средств
- Желудочные кровотечения и язвы
- Снижение агрегации тромбоцитов
дилататоров и цитопротекторов) является важным процессом в развитии этого неблагоприятного эффекта. Заместительная терапия синтетическими ПГ (например, 15-метил-ПГЕ2) приемлема, если желудочное повреждение является главной проблемой. НПВС также ингибируют агрегацию тромбоцитов и ускоряют время кровотечения в результате ингибирования образования тромбоцитами тромбоксана А2, который является вазоконстриктором и проагрегантом. Другие неблагоприятные эффекты: головокружение, головная боль, задержка воды и хлорида натрия (все неблагоприятные эффекты пироксикама). Наконец, большие дозы аспирина (1000-1500 мг/сут) и других НПВС могут вызывать слуховые и визуальные расстройства, сопровождаемые лихорадкой и изменениями pH крови, а иногда комой.
Опиоиды[править | править код]
Все опиоидные лекарственные средства, как встречающиеся в природе (типа морфия), так и синтезируемые химическим путем, связываются с определенными опиоидными рецепторами, чтобы произвести свой фармакологический эффект.
Существует три главных класса опиоидных рецепторов - μ, δ и к. Был предложен четвертый опиоидный рецептор (а), но множество других неопиоидных лекарств, оказывается, также действуют как лиганды на этом участке, поэтому сомнительно, нужно ли этот рецептор рассматриваться в качестве истинного опиоидного рецептора. Дальнейшая подклассификация некоторых опиоидных рецепторов (например, на μ1 и μ2) возможна, но ни фармакологическое, ни клиническое значение этого неясны. Лекарства связываются с опиоидными рецепторами или как полные агонисты (например, морфин и метадон), или как частичные агонисты, или как смешанные агонисты (полный агонист одного опиоидного рецептора, но частичный агонист другого, например пентазоцин и буторфанол), или как антагонисты типа налоксона и налтрексона (см. главу 3). В настоящее время доступными опиоидами (с показанной в скобках главной целью опиоидного рецептора) являются морфин (μ > к), метадон (μ), эторфин и бремазоцин (μ, δ и к), леворфанол (μ и к), фентанил (μ) и суфентанил (в основном μ).
Опиоиды используют для устранения боли от умеренной до сильной, особенно онкологической или послеоперационной
Опиоиды менее эффективны при нейропатической боли типа невралгии тройничного нерва или фантомной боли. В дополнение к болеутоляющим эффектам опиоидные лекарства оказывают множество других эффектов на ЦНС, не все из которых положительны. Например, опиоиды вызывают эйфорию, сопровождаемую общим чувством умиротворения и удовлетворенности, которая объясняет притягивающий характер таких лекарств для наркоманов (см. далее).
Это успокаивающее действие, несомненно, вносит вклад в их болеутоляющую эффективность, помогая снять беспокойство и дискомфорт, связанный с болью. Это важно в лечении, например, острого инфаркта миокарда и застойной сердечной недостаточности. Оказалось, что индуцированная морфием эйфория достигается активацией μ- и/или к-рецепторов, вероятно, в пределах лимбической системы.
Опиоидные анальгетики назначают системно (перорально, внутримышечно или подкожно) или непосредственно в спинной мозг (эпидурально). Обычно дается базовая доза в сопровождении поддерживающей, чтобы гарантировать устойчивую концентрацию в плазме.
ТОЛЕРАНТНОСТЬ И ЗАВИСИМОСТЬ. Устойчивость к болеутоляющему эффекту опиоидов развивается быстро и часто может проявляться в течение 12-24 час. В результате, чтобы достигнуть того же клинического эффекта, необходимы все большие дозы препарата, что ведет к увеличению частоты и тяжести побочных эффектов. Может развиться физическая зависимость, которая характеризуется абстинентным синдромом после прекращения применения препарата.
Этот синдром характеризуется сложной смесью раздражительного и иногда агрессивного поведения и чрезвычайно неприятных соматических проявлений типа лихорадки, потоотделения, зевоты и расширения зрачков (см. далее).
ПОБОЧНЫЕ ЭФФЕКТЫ. Эти эффекты ограничивают дозу, которую можно применять, и уровень достигаемой анальгезии. Все неблагоприятные эффекты — прямое последствие активации опиоидных рецепторов и в значительной мере связаны с преобладанием опиоидных рецепторов в мозге и периферической нервной системе. Такие эффекты могут ингибироваться антагонистами опиоидных рецепторов типа налоксона.
Наиболее серьезный неблагоприятный эффект -угнетение дыхания вследствие снижения чувствительности мозговых дыхательных центров к углекислому газу. Угнетение дыхания — наиболее частая причина летальных исходов от передозировки опиоидов.
Другой частый неблагоприятный эффект — запор, возникающий из-за снижения тонуса гладких мышц нижних отделов желудочно-кишечного тракта, что ведет к снижению перистальтики. Другими неблагоприятными эффектами могут быть сужение зрачка (миоз) и рвота через действие на хемо-рецепторную триггерную зону (ХТЗ) в мозге. Противокашлевый эффект опиоидов — побочный эффект, который используют клинически, поэтому
Неблагоприятные эффекты опиоидных препаратов
- Угнетение дыхания (μ-, δ- и к-рецепторы)
- Запоры (μ- и к-рецепторы)
- Тошнота и рвота
- Сужение зрачков (μ-> δ-рецепторы)
- Быстрое развитие толератности
- Физическая зависимость и абстинентный синдром
кодеин и декстрометорфан часто включают в состав лекарств от кашля (см. главу 14).
Фармакологические особенности анальгезии[править | править код]
БЕНЗОДИАЗЕПИНЫ. Сильная боль ведет к эмоциональным расстройствам, поэтому считают полезной терапию сопутствующей тревоги. Препаратами выбора обычно являются бензодиазепины диазепам и лоразепам, обеспечивающие эффективное анксиолитическое прикрытие на длительный период и обладающие умеренным амнестическим эффектом, который, несмотря на преимущество для отдельных пациентов, может приводить к беспокойству и заторможенности, особенно у пожилых больных.
ЗАКИСЬ АЗОТА (N20). Этот анестезирующий газ, применяемый при острых болезненных процедурах короткой продолжительности (например, стоматологические процедуры, роды), — анальгетик сам по себе. Анальгезия, достигаемая при его вдыхании (иногда в 50% смеси с воздухом), быстро наступает и быстро проходит.
КЕТАЛЛИН. Первоначально был представлен только как анестезирующее средство, но оказался также полезен в качестве кратковременного болеутоляющего, хотя неблагоприятные побочные эффекты типа бреда и причудливых галлюцинаций ограничивают его широкое применение.
Опиоиды и НПВС — стандартные обезболивающие, которые тем не менее не могут рассматриваться как «идеальные» анальгетики
И опиоиды, и НПВС относительно эффективны при различных типах боли, но сравнительно высокая частота побочных эффектов и другие проблемы, связанные с их клиническим использованием, означают, что ни одна группа не может рассматриваться в качестве «идеального» анальгетика. Можно надеяться, что дальнейшее изучение физиологической основы боли приведет к появлению более мощных и безопасных болеутоляющих средств.
ЛЕКАРСТВА, ВЫЗЫВАЮЩИЕ ПРИСТРАСТИЕ[править | править код]
Лекарства, которые влияют на ЦНС, могут воздействовать на эмоции, настроение и поведение, поэтому не удивительно, что такие препараты используют в нетерапевтических целях. Это нетерапевтическое использование лекарств рассматривают как злоупотребление лекарствами. Более точным может быть термин «токсикомания», т.к. иногда для фармакологического эффекта вдыхают обычные вещества типа бензина и растворителей. Кроме того, вещества типа этанола, кофеина и никотина во всех их формах не расценивают как лекарства в терапевтическом смысле этого слова, но эти вещества оказывают эффект на человеческий мозг, поэтому нельзя, с точки зрения фармакологии, отделять эти вещества от наркотиков. Даже чрезмерное потребление еды вообще или специфических типов пищевых продуктов является таким же злоупотреблением, как и злоупотребление препаратами. Обычно целью такого чрезмерного потребления является желание получить психологическое удовлетворение.
В основе зависимости человека от лекарств, вызывающих пристрастие, лежат механизмы, которые являются общими и для других млекопитающих, что было установлено при использовании соответствующей экспериментальной парадигмы на других видах.
Все наркотики и вещества, которые принимают с нетерапевтической целью, имеют собственный профиль различных свойств. Наиболее важный из них — фармакологическое действие.
Наркотики, которыми злоупотребляют, имеют широкий спектр фармакологических эффектов. Их можно разделить, по крайней мере, на четыре категории: депрессанты, стимуляторы, опиоиды и галлюциногены.
Признано, что средства первой группы снижают активность ЦНС (лекарства типа барбитуратов и общих анестезирующих средств) вплоть до комы и смерти. Термин «депрессант» не точен. Лекарства-стимуляторы индуцируют тревожность, возбуждение и эйфорию и, возможно, ими злоупотребляют именно по этим причинам. Опиоидные лекарства — агонисты опиоидных рецепторов, и помимо эйфории также имеют депрессантные свойства. Галлюциногенные лекарства вызывают изменения восприятия, особенно в отношении времени и пространства, т.е. галлюцинации. Чисто анестезирующие средства, помимо эффекта анестезии, также вызывают галлюцинации.
Степень, начало и продолжительность перечисленных эффектов зависят от пути введения и фармакокинетических свойств препарата. Чтобы достичь наибольшего эффекта быстрее всего, используют внутривенное введение. Альтернатива — интраназальное введение (особенно кокаин и никотин), когда поступление в кровь происходит очень быстро и отсутствует эффект первого прохождения через печень. Аналогичный путь — вдыхание в легкие в форме дыма, что относится к никотину, гашишу и опиатам. Пероральный путь, являющийся самым легким, часто не предпочтителен, т.к. происходит неизбежная задержка между приемом и наступлением эффекта.
Существует множество классов лекарств, которыми злоупотребляют. Многие из них влияют на ЦНС и могут стимулировать появление устойчивости и зависимости, что лучше всего иллюстрируют опиоиды.
Опиоиды[править | править код]
Опиоиды известны как лекарства, вызывающие зависимость, ими часто злоупотребляют с различными экономическими и социальными последствиями. Во многих странах существует обширная незаконная сеть создания и продажи лекарств, вызывающих пристрастие, что особенно характерно для опиоидов, кокаина, марихуаны и наркотиков типа «экстази». Опиум производят из мака Papaver somniferum. Опиоидный латекс собирают из маковой коробочки, затем различными способами обрабатывают для местного использования или экспорта. Относительно простой химический процесс преобразовывает главный алкалоид морфин в героин, который выбирают те, кто предпочитает внутривенный путь введения.
Люди, зависимые от опиоидов, могут проявлять устойчивость и психическую зависимость от наркотических эффектов, а также иметь синдром отмены при прекращении приема опиоидов после длительного использования. Устойчивость, или физиологическая зависимость, возникает, когда для достижения того же эффекта необходимы все большие дозы наркотика. Оказалось, что механизмы, лежащие в основе устойчивости к опиатам, включают адаптацию к длительному присутствию наркотика, т.е. нейроадаптацию: происходит восходящая и нисходящая регуляция рецепторов и нейротрансмиссии в попытке поддержать нормальную функцию. В экспериментах на животных было замечено, что физиологическая зависимость, или толерантность, может развиться за несколько часов.
Психологическая зависимость возникает, когда препарат используют неоднократно с целью наслаждения или освобождения от боли и беспокойства. Этот положительный эффект относится к главному фармакологическому действию препарата. В любой психологической зависимости есть элемент формирования привычки, причем разница между устоявшейся привычкой и психологической зависимостью к препарату может быть очень небольшой.
Признаки и симптомы отмены часто противоположны по характеру острым фармакологическим эффектам препарата. Синдром отмены стимуляторов часто проявляется депрессией, в то время как синдром отмены депрессантов отмечен возбуждением. Кроме того, некоторые из изменений, наблюдаемых после отмены, сопровождаются автономными реакциями на сопутствующее напряжение.
В зависимости от вида опиата, его фармакологических действий и фармакокинетики устойчивость, психологическая зависимость и синдром отмены могут быть выраженными или умеренными. Морфин и героин вызывают значительную физиологическую и психологическую зависимость и синдром отмены, в то время как у метадона они выражены гораздо меньше. Многие из этих различий могут быть приписаны фармакокинетическим факторам, а именно более медленной экскреции метадона. Лекарства, которые медленно выводятся из организма, вызывают меньший эффект отмены.
При рассмотрении лекарств, вызывающих пристрастие, необходимо обратить внимание на их общественную опасность, связанную со злоупотреблением, а также угрозу для самого зависимого. Лицо, зависимое от опиатов, в целом не представляет непосредственную угрозу для общества, т.к. острые фармакологические эффекты опиатов ведут к социальной изоляции и пассивности. Но после длительного употребления, зависимость приобретает социальную значимость с точки зрения преступной деятельности, связанной с незаконным получением наркотиков, а также с точки зрения межличностных отношений. Фармакологическими и токсикологическими побочными эффектами опиатов являются заторможенность и угнетение дыхания. Способ введения препарата также несет в себе большой риск, если для внутривенного введения героина и других наркотиков используют грязные иглы и растворы. Риск заболевания СПИДом среди наркоманов, которые вводят наркотики внутривенно, очень высок.
ЛЕЧЕНИЕ. Первичным лечением героиновой и морфиновой зависимости является замена их метадоном, активным при оральном применении агонистом опиоидных рецепторов, поскольку его симптомы отмены умеренны, т.к. он медленно выводится из организма. Поддерживающая и симптоматическая терапия — важный компонент в лечении наркотической зависимости.
Свойства опиоидов и характеристики опиоидной зависимости:
- аналоги: морфин, героин, фентанил, метадон;
- пути введения: пероральный, курение, парентеральный, в частности внутривенный;
- тип действия: депрессанты;
- желаемые психологические действия: эйфория, анальгезия, расслабление;
- фармакологические эффекты при передозировке: заторможенность, угнетение дыхания;
- психологическая зависимость: выраженная и развивается быстро, если применяют внутривенный путь введения;
- устойчивость: очень выражена;
- симптомы отмены: могут быть серьезными, но не фатальны — тремор, диарея, дисфория, нарушения сна;
- метадон имеет более медленный метаболизм и менее выраженные эффекты, поэтому его используют для замены опиатов типа морфина и героина.
Кокаин[править | править код]
Свойства и характеристики зависимости:
- аналоги: нет;
- пути введения: пероральный (Южная Америка), назальный, курение, внутривенный;
- тип действия: стимулятор;
- желаемые психологические действия: эйфория и возбуждение;
- фармакологические эффекты при передозировке: психоз, сердечно-сосудистая смерть (аритмии и гипертонические кризы), повреждение тканей в месте приложения или введения, эмбриональное повреждение;
- психологическая зависимость: сильная, особенно при внутривенном пути введения;
- устойчивость: ограниченная;
- симптомы отмены: депрессия, дисфория, нарушения сна.
Амфетамины[править | править код]
Свойства и характеристики зависимости:
- аналоги: метамфетамины («экстази»);
- пути введения: пероральный, иногда парентеральный;
- тип действия: стимулятор;
- желаемые психологические действия: эйфория, возбуждение и усиление состояния бодрствования;
- фармакологические эффекты при передозировке: психоз, сердечно-сосудистая смерть (аритмии и гипертонические кризы), гипертермия;
- психологическая зависимость: сильная, но нарастание симптомов не такое резкое, как при кокаине;
- устойчивость: ограниченная;
- симптомы отмены: депрессия, дисфория, нарушения сна.
Никотин[править | править код]
Свойства и характеристики зависимости:
- аналоги: нет;
- пути введения: курение табака в сигаретах, сигарах, трубке; интраназально (нюхание); жевание табака (за щекой); трансдермальные пластыри; жевательная резинка для лечения никотиновой зависимости;
- тип действия: стимулятор;
- желаемые психологические действия: некоторая эйфория, расслабление и повышенная концентрация;
- фармакологические эффекты при передозировке (вследствие возбуждения никотиновых рецепторов): случайное отравление, т.к. инсектициды никотина поглощаются через кожу, и смерть наступает от сердечно-сосудистых расстройств и блокады нервно-мышечной передачи; курение, нюхание и пероральное применение связаны со злокачественными опухолями (преимущественно легких и ротовой полости); курение приводит к кашлю, бронхитам и эмфиземе;
- психологическая зависимость: может быть удивительно сильной;
- устойчивость: ограниченная;
- симптомы отмены: раздражительность, увеличение массы тела в связи с повышением аппетита, головная боль.
Кофеин[править | править код]
Свойства и характеристики зависимости:
- аналоги: нет ни одного для злоупотребления, но теофиллин используют в терапевтических целях;
- пути введения: в основном перорально в виде напитков (кофе, чай, какао, шоколад, кола и некоторые другие безалкогольные напитки);
- тип действия: стимулятор;
- желаемые психологические действия: повышение внимания и концентрации;
- фармакологические эффекты при передозировке: беспокойство, тремор, аритмии, судороги у детей;
- психологическая зависимость: очень ограниченная;
- устойчивость: ограниченная;
- симптомы отмены: ограниченные.
Барбитураты[править | править код]
Свойства и характеристики зависимости:
- аналоги: существует в большом количестве, но злоупотребляют немногими;
- пути введения: обычно пероральный;
- тип действия: депрессант;
- желаемые психологические действия: успокоение.
- фармакологические эффекты при передозировке: заторможенность, кома, угнетение дыхания, приводящее к летальному исходу.
Бензодиазепины[править | править код]
Свойства и характеристики зависимости:
- аналоги: существует в большом количестве;
- фармакологические эффекты при передозировке: кома и летальный исход из-за угнетения дыхания;
- симптомы отмены: судороги, тремор, дрожь — потенцально наиболее фатальные из всех лекарств.
Этанол (спирты)[править | править код]
Свойства и характеристики зависимости:
- аналоги: другие низкомолекулярные спирты, особенно метанол. Злоупотребление излечивают дисульфирамом. Когда пациент, принимающий дисульфирам, употребляет алкоголь, между алкоголем и дисульфирамом происходит реакция, в ходе которой образуется ацетальдегид — ядовитое вещество, вызывающее пульсирующую головную боль, тошноту и тремор;
- пути введения: пероральный;
- тип действия: депрессант;
- желаемые психологические действия: эйфория, раскрепощение, увеличение общительности;
- фармакологические эффекты при передозировке: волнение, заторможенность, атаксия, кома и летальный исход при острой передозировке. Постоянное злоупотребление ведет к гипертензии и патологии сердца, мозга и печени. Возможно повреждение плода (эмбриональный алкогольный синдром);
- психологическая зависимость: от умеренной до выраженной;
- устойчивость: ограниченная;
- симптомы отмены: судороги, эпилептические приступы, галлюцинации (розовые слоны), могут быть фатальными.
Фенциклидин (общеанестезирующие средства)[править | править код]
Свойства:
- аналоги: кетамин;
- тип действия: галлюциноген.
Растворители[править | править код]
Свойства:
- аналоги: бензин, клей и другие растворители;
- пути введения: ингаляционный;
- тип действия: депрессант.
ЛСД (галлюциногены)[править | править код]
Свойства и характеристики зависимости:
- аналоги: мескалин, пейот;
- пути введения: пероральный, вдыхание для некоторых аналогов;
- тип действия: галлюциноген;
- желаемые психологические действия: галлюцинации, нарушения восприятия места и времени;
- фармакологические эффекты при передозировке: психоз и «ретроспекция»;
- психологическая зависимость: ограниченная;
- устойчивость: ограниченная;
- симптомы отмены: очень редкие, вероятно вследствие нерегулярного использования.
Каннабиноиды[править | править код]
Свойства и характеристики зависимости:
- аналоги: алкалоиды гашиша от Cannabis sativa, преимущественно дельта-9-тетрагидроканнабиноиды;
- пути введения: пероральный или курение;
- тип действия: слабый галлюциноген;
- желаемые психологические действия: расслабление, эйфория, нарушения восприятия времени и места;
- эффект передозировки: незаметный;
- психологическая зависимость: умеренная;
- устойчивость: умеренная или слабая;
- симптомы отмены: ограниченные, нарушение сна, беспокойство.
Читайте также[править | править код]
- Психофармакология
- Препараты для лечения психозов (нейролептики)
- Препараты для лечения маний
- Заболевания периферической нервной системы
- Анатомия центральной нервной системы
- Нейромедиаторы
- Лекарственные средства и нервная система
- Мигрень (лечение)
- Массаж при заболеваниях нервной системы
Литература[править | править код]
- Kedar NP. Can we prevent Parkinson’s and Alzheimer’s disease? J Postgrad Med 2003; 49: 236-245.
- Pinna A, Wardas J, Simola N, Morelli M. New therapies for the treatment of Parkinson’s disease: adenosine A2A receptor antagonists. Life Sci 2005; 77: 3259-3267.
- Robert E Hales, Stuart C, Yudofsky. Essentials of clinical psychiatry. Washington, DC: American Psychiatric Pub., C2004.
- Sadock BJ, Kaplan & Sadocks’s concise textbook of clinical psychiatry/Benjamin James Sadock, Virginia Alcott Sadock. Philadelphia: Lippincott Williams & Wilkins, 2004.