Допинг-контроль: методы и тесты
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Содержание
Исторические аспекты анализа низкомолекулярных веществ в допинг-контроле[править | править код]
Желание искусственным путем увеличить свою силу, способности и выносливость возникло одновременно с появлением первых спортивных соревнований. Уже в сочинениях Филострата и Галена имеются упоминания о попытках атлетов на античных Олимпийских играх увеличить свою силу и выносливость с помощью отваров из грибов и семян растений, а также специальных диет, в частности, предусматривавших употребление в пищу яичек быка (Burstin, 1963; Prokop, 1970, 2002). Более того, спортсмены Древнего Рима проделывали аналогичные манипуляции с животными — они поили своих скаковых лошадей гидромелем — напитком из меда, смешанного с водой, пытаясь таким образом увеличить их силу (Morgan, 1957; Aliens, 1965). Считают, что основной причиной подобного поведения спортсменов, пытавшихся искусственным способом получить решающее преимущество в соревнованиях, были известность, слава и почет, а также денежные награды, которые стали еще более существенными факторами после возникновения профессионального спорта, конных скачек и собачьих бегов. В начале XX столетия русские и австрийские ученые разработали первые экспериментальные методы определения стимуляторов в слюне лошадей, и в 1910—1911 гг. около 220 образцов были подвергнуты анализу с целью обнаружения алкалоидов, применявшихся в качестве допинга. В период между 1938 и 1954 гт. были предложены принципиальные процедуры обнаружения таких стимуляторов, как амфетамины, однако они характеризовались ограниченной чувствительностью и результаты анализа в значительной степени зависели от посторонних активных веществ, присутствующих в биологических образцах (Richter, 1938; Keller, Ellenbogen, 1952; Axelrod, 1954). Однако уже в 1956 г. был предложен получивший широкое распространение метод, основанный на жидкостной экстракции с последующей хроматографией на бумаге и визуализацией результатов разделения (Vidic, 1956). Фатальность применения допинга стала очевидной в 1886 г., когда во время велогонки Париж —Бордо от передозировки кофеина умер велогонщик Линтон (Prokop, 2002). В последующие 70 лет были зафиксированы многочисленные смертные случаи, связанные с применением стимуляторов, в основном среди велогонщиков. Приводим несколько случаев, зарегистрированных только в Италии (Vcnerando, 1963): смерть велогонщика в результате отравления амфетамином (1949); госпитализация велогонщика с тяжелым отравлением чрезмерной дозой амфетамина (1956); велосипедист в состоянии шока, вызванного большой дозой симпатомиметиков (1958); госпитализация велосипедиста с интоксикацией амфетамином и аналептиками (1962). Формирование допинговых комиссий во Франции (1959), Австрии (1962) и Италии (1963), а затем и Медицинской подкомиссии Международного олимпийского комитета (МОК) в 1967 г., положили начало крупномасштабной борьбе против допинга. Первый официальный допинг-контроль был осуществлен во время Олимпийских игр в Гренобле (1968), где впервые для скрининга лиц, применявших стимуляторы, проведен первый анализ (Beckett et al., 1967). В последующие десятилетия список запрещенных препаратов и методов стимуляции многократно изменялся и дополнялся. Было разработано большое количество методов, предназначенных для определения веществ, применяемых в качестве допинга, продуктов их обмена и их влияния на физиологические и биохимические показатели организма.
Классификация стимулирующих препаратов[править | править код]
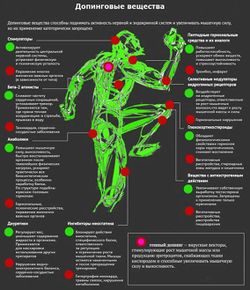
Запрещенные субстанции[править | править код]
Учитывая большое разнообразие запрещенных веществ, не существует списка, в котором все они были бы перечислены. Примеры для каждой группы дополнены фразой "... и аналогичные вещества", результатом чего является запрет на использование всех соединений, близких по фармакологическим или физико-химическим свойствам. Ниже представлена классификация запрещенных субстанций и методов воздействия, предложенная МОК и Всемирным антидопинговым агентством (ВАДА) (International Olympic Committee, 2003). Для некоторых лекарственных препаратов и веществ, таких, как β-блокаторы, кортикостероиды, местные анестетики, марихуана и алкоголь, запрет на применение ограничивается отдельными видами спорта с учетом медицинских показаний.
Классификация запрещенных субстанций и методов воздействия, предложенная Международным олимпийским комитетом (МОК) и Всемирным антидопинговым агентством (ВАДА)
- Запрещенные классы веществ
- Стимуляторы
- Наркотические вещества
- Анаболические препараты
- Диуретики
- Пептидные гормоны, миметики и их аналоги
- Препараты с антиэстрогенной активностью
- Маскирующие препараты
- Запрещенные методы воздействия
- Стимуляция транспорта кислорода
- Фармакологические, химические и физические манипуляции
- Генный допинг
- Классы субстанций, запрещенных в отдельных видах спорта
- Алкоголь
- Каннабиноиды
- Местные анестетики
- Глюкокортикостероиды
- β-блокаторы
СТИМУЛЯТОРЫ
Стимуляторы представляют собой, вероятно, наиболее древний вид субстанций, используемых человеком в качестве допинга. Сюда относятся такие соединения, как амфетамин, эфедрин, кофеин и также кокаин. Последний применяли уже мексиканские инки в XVI ст., потреблявшие листья коки, чтобы преодолеть расстояние более 1000 миль (1609 км) между Куско и Кито за 5 дней (www.g-o.de, 2003), а первое допинговое вещество, обнаруженное в образцах мочи спортсменов в XX ст., относилось к амфетаминам. Поскольку эфедрин входит в состав ряда противопростудпых препаратов, а кофеин содержится во многих холодных и горячих напитках, была установлена граница предельного содержания этих веществ в моче, что требует проведения количественной оценки их содержания в моче. Новые правила, вступившие в силу с января 2004 г., полностью сняли запрет на использование кофеина.
Одним из спорных веществ, запрещенных WADA является ноотропный препарат фенотропил.
НАРКОТИЧЕСКИЕ ВЕЩЕСТВА
Класс наркотических веществ включает такие субстанции, как опиоидные анальгетики морфинового типа и близкие по структуре вещества, за несколькими исключениями, в частности этилморфина и кодеина, сделанными из-за их незначительного анальгетического воздействия. Использование других лекарственных препаратов не опиоидного типа, например ацетилсалициловой кислоты или диклофенака, разрешено.
АНАБОЛИЧЕСКИЕ ПРЕПАРАТЫ
Применение стимуляторов и наркотиков представляет интерес преимущественно во время соревнований, тогда как анаболические препараты являются эффективным средством воздействия в период проведения тренировочных занятий. Вещества, стимулирующие рост мышечной ткани и увеличение силовых показателей, были внесены в список запрещенных субстанций МОК в 1976 г., а после 1993 г. в класс анаболических препаратов были включены не только стероиды — производные тестостерона, но и β2-агонисты, поскольку они также вызывают анаболический эффект при использовании в дозах, существенно превышающих терапевтические (Reedset al., 1998; Wagner, 1989; Stallion et al., 1991; Hoher, TroidI, 1995).
ДИУРЕТИКИ
Диуретики рассматриваются в качестве допинговых препаратов на основании следующих фактов: а) спортсмены, соревнующиеся в видах спорта, где происходит разделение на весовые категории, могут снижать массу тела искусственно стимулированным диурезом, т. е. увеличением выделения мочи; б) увеличение водных потерь приводит к разбавлению мочи и снижению концентрации выделяемых веществ. Таким образом, диуретики могут маскировать применение запрещенных субстанций, для которых установлен количественный порог содержания в моче. Класс диуретиков, в частности, может служить демонстрацией физико-химической гетерогенности одной группы препаратов. На основании химической структуры, места и механизма воздействия диуретические препараты могут быть разделены, но меньшей мере, на 6 групп. Это так называемые тиазиды (например, гидрохлортиазиды), производные сульфамоилбензойной кислоты (например, фуросемид), осмотические диуретики (например, маннитол), ингибиторы карбоангидразы (например, ацетазоламид), производные феноксиуксусной кислоты (например, этакриновая кислота) и калийсберегающие диуретики (например, спиронолактон).
БЕТА-БЛОКАТОРЫ
Препараты, блокирующие β-адренорецепторы (также называемые β-блокаторы), запрещены для применения в таких видах спорта, как стрельба и прыжки на лыжах из-за их седативного эффекта. В общем структурная формула β-блокаторов включает фенольное кольцо с оксипропаноламиновой боковой цепью, которая заканчивается изопропиловым или третбутиловым остатком (как в случае иропранолола и левобунолола), либо фенилэтаноламиноиое ядро с заменами боковых атомов водорода, например на нитритный остаток (нифеналол). Современные β-блокаторы могут иметь и несколько иную структуру, как например лекарственный препарат небиволол. Начиная с 1988 г. этот класс препаратов был включен МОК в список запрещенных к применению субстанций.
В списке запрещенных субстанций, приведенном выше, есть и другие классы запрещенных веществ, таких, как пептидные гормоны, однако здесь мы будем рассматривать только низкомолекулярные химические соединения.
Методы анализа[править | править код]
Первые получившие широкое распространение методики скрининга и доказательств для допинг-контроля заключались в приготовлении препаратов проб с использованием жидкостной экстракции мочи, концентрации полученных экстрактов и разделении анализируемых веществ с помощью газожидкостной хроматографии (ГЖХ) и тонкослойной хроматографии (ТСХ). Для анализа продуктов, разделенных с помощью ГЖХ, использовали плазменно-ионизационный детектор (ПИД), который позволял обнаружить присутствие стимуляторов из группы амфетамина по сигналу с временем удержания, сопоставимым со стандартными образцами аналогичных препаратов. Тонкослойную хроматографию применяли для идентификации стрихнина и таких стимуляторов с гидроксилированным кольцом, как β-гидроксиамфетамин и фенилэфрин (Beckett et al., 1967). В случае позитивных результатов теста дополнительную информацию об анализируемых веществах получали с помощью дериватизации, микроинфракрасной спектроскопии, а также масс-спектрометрии (МС). Совершенствование аналитических методов и появление различных технических новшеств привело к разработке сложных процедур приготовления образцов и появлению разнообразных видов анализа, и наконец, к созданию и выпуску в продажу специального оборудования, что в целом позволяет проводить обширный анализ образцов мочи элитных спортсменов с целью допинг-контроля. В зависимости от свойств анализируемых веществ применяются различные аналитические инструменты. Принципы работы некоторых из них рассмотрим ниже.
В целом предварительное хроматографическое разделение экстрактов, полученных из биологических материалов, таких, как кровь, моча или волосы является в большей или меньшей степени обязательным условием для последующего аналитического анализа. Это позволяет получить более подробную информацию об анализируемых образцах; например, разница во времени удержания позволяет разделить стереоизомеры, кроме того, так можно отделить вещества, представленные в образце в небольших концентрациях, от тех которые составляют его значительную часть. Современные хроматографические системы основаны на применении капиллярной газовой хроматографии или высокоэффективной жидкостной хроматографии, оба эти метода чрезвычайно сложны и развились в отдельные разделы аналитической химии.
Газовая хроматография[править | править код]
Сегодня капиллярные колонки представляют собой наиболее распространенное средство для проведения газовой хроматографии (ГХ) с целью допинг-контроля. Их высокая эффективность с точки зрения качества разделения, износоустойчивость и необыкновенное разнообразие неподвижных фаз обеспечивает широкий выбор для создания различных методик и возможности для решения таких задач, как проведение полного анализа или скрининг специфических веществ. Колонка состоит из трех основных элементов: (а) внешнего защитного покрытия; (б) слоя сорбента из плавленого кварца и (в) неподвижной фазы.
Кварцевое покрытие. Сорбирующий слой изготовлен из синтетического кварцеподобного стекла высокой степени чистоты с низким содержанием примесей оксидов металлов. Такое покрытие благодаря наличию групп силанола имеет чрезвычайно активную поверхность, которая может реагировать с полярными группами анализируемых веществ, такими, как гидроксильные, карбоксильные и тиольные остатки, а также первичными и вторичными аминами, что приводит к появлению "хвостов" у пиков разделяемых веществ и снижению интенсивности пиков. Поэтому при подготовке колонки производится деактивация силанольных групп с помощью подходящей химической обработки, например путем триметилсилилирования. Полученное таким образом покрытие хорошо подходит для нанесения неподвижной фазы.
Неподвижная фаза. Неподвижная фаза в газовой хроматографии играет основную роль, поскольку именно она определяет время удержания, качество разделения и форму пиков анализируемых веществ. Эта особая часть капиллярной колонки состоит либо из полисилоксанов/силиконов, полиэтиленгликолей (ПЭГ) либо из пористого слоя сорбента. Чаще всего в качестве неподвижной фазы используют замещенные полисилоксаны, которые обладают высокой стойкостью и сроком службы. Общая химическая структура неподвижных фаз изображена на основе полисилоксанов, которые представляют собой цепочку из чередующихся кислорода и кремния с боковыми замещающими группами, присоединяющимися по две к каждому атому кремния. Структура и количество замещающих групп являются характеристикой каждой неподвижной фазы. Используют преимущественно четыре замещающие группы в разном соотношении: а) метальные; б) фенильные; в) цианопропильные, г) трифторпропильиыс остатки. Выбор замещающих групп и их относительная представленность в неподвижной фазе определяют полярность ГХ колонки. Еще одним материалом, применяемым для формирования неподвижной фазы в ГХ-колонках, является ПЭГ, основной характеристикой которого является молекулярный вес или длина цепей полимера. Существенное отличие этого материала от полисилоксана заключается в возможности создания неподвижных фаз с определенным значением pH, т. е. кислотных или щелочных колонок, которые демонстрируют лучшие показатели при разделении кислотных или щелочных соединений соответственно. Основным недостатком является высокая чувствительность к кислороду, особенно при повышенных температурах, которая приводит к разрушению неподвижной фазы и сокращает срок службы колонки. Неподвижные фазы для адсорбционной хроматографии состоят из мельчайших частичек пористых материалов (например, полимеров, оксида алюминия, молекулярных сит), которые присоединяют к кварцевому покрытию капилляра с помощью химических линкеров. Благодаря высокой адсорбирующей способности в отношении газообразных веществ такие неподвижные фазы используют преимущественно для хроматографии наиболее летучих компонентов или газов, которые обычно плохо связываются с неподвижными фазами на основе полисилоксанов или ПЭГов, поэтому температуры разделения здесь не превышают 35 ’С. В случае применения так называемых капиллярных ГХ колонок PLOT (porous layer open tubular) твердофазная абсорбция газов является основным механизмом разделения, обеспечивающим эффективное удержание летучих веществ. В то же время сильная адсорбция анализируемого вещества на неподвижной фазе не позволяет использовать такие колонки для деления менее летучих веществ.
Внешняя оболочка. Поскольку капилляры из сплавленного кварца очень хрупкие, для них требуется защитное внешнее покрытие. Для этой цели обычно используют полиимид, который обладает двумя достоинствами: во-первых, колонки с полиимидной оболочкой достаточно прочные и не требуют деликатного обращения, во-вторых, полиимид покрывает и заполняет все трещины в капиллярах из сплавленного кварца, предотвращая увеличение дефектов.
После рассмотрения устройства капиллярной колонки для газовой хроматографии следует отметить еще два параметра, оказывающих заметное влияние на качество хроматографического разделения: размеры колонки, т. е. длина, диаметр и толщина пленки неподвижной фазы, а также газы-носители.
Тогда как длина и диаметр колонки влияют в основном на разрешение пиков, толщина пленки неподвижной фазы определяет емкость колонки и удержание анализируемых веществ. Длина колонки прямо пропорциональна количеству теоретических тарелок, а поскольку разрешение пропорционально корню квадратному количества теоретических тарелок, разрешение также будет пропорционально корню квадратному длины колонки. Иными словами, удвоение длины колонки (а значит, и количества теоретических тарелок) будет приводить к улучшению разрешения не на 100 %, а только на 25—35 %; уменьшение длины колонки на 50 % приведет к ухудшению разделения примерно на 15 — 25 %. Кроме того, количество теоретических тарелок обратно пропорционально диаметру колонки, следовательно, уменьшение диаметра колонки будет увеличивать эффективность газовой хроматографии, т. е., поскольку разрешение пропорционально квадратному корню из количества теоретических тарелок, уменьшение диаметра колонки в два раза также позволит улучшить разделение на 25—35 %, как, например, при замене колонки с внутренним диаметром 0,2 мм2 на колонку с диаметром 0,11 мм2. Емкость колонки непосредственно определяется толщиной пленки неподвижной фазы. Если толщина слоя неподвижной фазы 0,1—0,2 мкм подходит для анализа 20—50 нг вещества, то для анализа количеств больше 125 нг необходима колонка с толщиной неподвижной фазы 0,5 мкм, поэтому толщина пленки должна быть подобрана в соответствии с предполагаемым количеством анализируемых веществ, наносимых на ГХ колонку.
Кроме того, на параметры хроматографического разделения влияет также используемый в качестве носителя газ, эта зависимость описывается кривой Ван Деемтера. В качестве газов-носителей часто используют гелий и водород, причем последний обеспечивает превосходную оптимальную линейную скорость, в результате чего значительно улучшается качество разделения. Явный недостаток водорода щ его высокая воспламеняемость.
Жидкостная хроматография[править | править код]
По сравнению с газовой, принадлежности для жидкостной хроматографии отличаются значительным разнообразием размеров, наполнителей и, поскольку разделение происходит при переносе в жидком носителе, большим набором органических растворителей и буферов. Помимо того, в жидкостной хроматографии (ЖХ) в зависимости от свойств анализируемых веществ могут применяться несколько различных механизмов разделения (нормально-фазовая, обращенно-фазовая, ионообменная и ситовая). В этом кратком обзоре мы коснемся только обращенно-фазовой хроматографии (ОФХ ), которая чаще всего используется при проведении анализов с целью допинг-контроля.
Картриджи. Для использования в ЖХ предлагаются картриджи-колонки различного диаметра. После усовершенствования материалов-наполните-лей (т.е. неподвижной фазы, см. ниже) в лабораториях допинг-контроля для анализа низкомолекулярных соединений чаще всего используют колонки длиной 30—120 мм с внутренним диаметром 1,0— 4,6 мм, тогда как в прежние времена для высокоэффективной жидкостной хроматографии (ВЭЖХ) применялись гораздо более объемные и длинные колонки. Уменьшение длины колонок стало возможным после появления обладающих высокой специфичностью высокоизбирательных масс-анализаторов, которые позволяют осуществлять разделение веществ на основании их масс-спегара, благодаря чему потребность в оптимальном хроматографическом разделении анализируемых веществ стала не столь актуальной. Кроме того, была существенно повышена производительность колонок для ЖХ, и это значительно сократило время, необходимое для разделения пиков.
Неподвижная фаза. Как отмечалось выше, определяющим фактором в хроматографии являются параметры неподвижной фазы и жидкостная хроматография в этом не исключение. Здесь необходимо учитывать различные характеристики, в частности размер частиц (3—50 мкм), особенности носителя (частицы силикагеля сферической или неправильной формы), наличие химически связанной фазы (например, С4, С8, С18) и размер пор (50—4000 А).
Для оценки характеристики эффективности хроматографической колонки часто используют пара-метр "количество тарелок п" или "высоту тарелки h". Уравнение Ван Деемтера в его простейшем виде описывает обратную взаимосвязь размера частиц и высоты тарелки; это означает, что уменьшение размера частиц ведет к улучшению эффективности хроматографии, а именно разрешения (Yamashita, Fenn, 1984а; Engelhardt et al., 1985). Поэтому существует тенденция к уменьшению размера частиц наряду с использованием очень коротких колонок в высокоскоростной хроматографии для обеспечения требуемого разрешения пиков.
Чаще всего в качестве материала для приготовления неподвижной фазы обратно фазовой хроматографии используется силикагель. Представленные в продаже виды силикагеля отличаются по своим физическим характеристикам, таким, как площадь специфической поверхности, средний диаметр пор, специфический объем пор и форма. Предполагая, что частицы имеют открытые поры цилиндрической формы, можно выразить взаимосвязь между первыми упомянутыми переменными следующим уравнением:
0 = 103 х 4 Vр /Оsp ,
где 0 — средний диаметр пор, нм; Vp — специфический объем пор, млт"1; Оsp — специфическая площадь поверхности, м2т~' (Scott, 1982). При средней площади поверхности, равной около 300 м2т~', и диаметре пор 10 им специфический объем пор будет составлять примерно 1 млт"1. В настоящее время как носитель для создания неподвижной фазы в обращенно-фазовой ЖХ в большинстве случаев используют сферические частицы силикагеля, поскольку с помощью его можно достичь более высокой плотности упаковки по сравнению с частицами неправильной формы, полученными при полимеризации кремниевой кислоты. На поверхности такие частицы несут гидроксильные группы (силанольные остатки), которые могут быть использованы для создания химически привитой фазы; она и будет определять свойства колонки для ВЭЖХ. В продаже представлен широкий выбор разнообразных фаз, позволяющий решать самые различные задачи хроматографического разделения, например, часто используют фазы с привитыми феи ильными С18-, С8- и С4-группами, либо более полярные материалы, такие, как фазы с привитыми циано-, амино- и диольными группами. Более того, созданы еше более сложные системы, позволяющие разделять молекулы-стерсоизомеры одного соединения. Самых последних результатов в области высокопроизводительного хроматографического анализа удалось добиться благодаря созданию так называемой монолитной колонны, представляющей собой единый кусок органического полимера или диоксида кремния со сквозными порами в нем, полученный прямой полимеризацией соответствующих мономеров. Такой материал отличается более высокой стабильностью и, что важно, более высокой производительностью по сравнению с обычными колонками, заполненными отдельными частицами.
Подвижная фаза. В случае ОФГ неподвижная фаза является неполярным, а подвижная — полярным компонентом. Обычно в ОФГ применяют буферные системы, состоящие, например, из KH2PO4/H3PO4 или NaH2РО4 в сочетании с такими органическими растворителями, как метанол или ацетонитрил, которые хорошо подходят для анализа с помощью ультрафиолетовых (УФ) детекторов. В то же время применение ВЭЖХ в сочетании с МС предъявляет более серьезные требования к характеристикам элюэнтов, поскольку в отношении ЖХ существуют ограничения на допустимый диапазон pH, выбор растворителя, содержание добавок в растворителе и скорость подачи элюзита, направленные на достижение оптимальных результатов масс-спектрометрии (Wheeler, 1955). Обычно в случае ионизации при атмосферном давлении (например, злектрораспылением) требуется добавление легколетучих растворителем для предотвращения примесей ионов анализируемого вещества, поэтому часто применяемые фосфатные, боратные или сульфатные добавки здесь не подходят, вместо них используют ацетат аммония, формиат аммония или тетраэтиламмониумгидроксид. Более того, при использовании ионизации электрораспыленном не допускаются ингредиенты, которые дают сильные ионные пары, в результате чего после десорбции происходит нейтрализация ионов. Первостепенное значение имеет поддержание pH, особенно в случае ионизации электрораспылепием, поскольку этот параметр усиливает ионизацию анализируемого вещества. Анализ соединений, имеющих щелочную природу, следует производить при кислом pH, применяя такие добавки, как уксусная или муравьиная кислота в концентрации 0,1 —1,0 X. в то время как соединения с кислотными свойствами (например, карбоновые кислоты) легче ионизируются в щелочной среде, которую можно создать, например, добавлением гидроксида аммония. В числе часто используемых органических растворителей те же, что применяются и при обычной ВЭЖХ без МС. т. с. метанол, этанол и ацетонитрил.
Детекторы[править | править код]
Детекция и идентификация разделенных хроматографией веществ в допинг-контроле имеет чрезвычайно важное значение. К настоящему времени разработано множество различных систем детекции, в частности пламенно-ионизационный детектор (ПИД), азотно-фосфорный детектор (АФД), УФ фотометрический детектор, а также масс-спектрометрические детекторы, такие, как квадрупольные, времяпролетные, ионные ловушки, масс-анализаторы ионно-циклотронного резонанса с Фурье-преобразо-ванием, тройные квадрупольныс детекторы, магнитные секторные анализаторы. Кроме того, в продаже имеются приборы, включающие два и более различных типов детектирующих устройств, а также разработаны различные прикладные системы для определения применения запрещенных веществ, которые базируются на использовании специальных методик приготовления образцов в сочетании с хроматографией и детектором, обладающих хорошей чувствительностью и избирательностью.
ПЛАМЕННО-ИОНИЗАЦИОННЫЙ ДЕТЕКТОР
Пламенно-ионизационные детекторы применяются в сочетании с газоном хроматографией уже достаточно давно и являются, пожалуй, одними из наиболее универсальных. Выходящий из хроматографической колонки газ смешивается с воздухом, насыщенным водородом, и воспламеняется с помощью электроподжига. При сгорании водорода в воздухе образуется незначительное количество ионов, однако при пиролизе в пламени водорода большинство органических соединений дает значительное количество ионов и электронов и это приводит к увеличению проводимости. На так называемый коллектор или собирающий электрод подается напряжение, под действием которого возникает электрический ток, величина которого пропорциональна количеству образца, сгоревшего после выхода из хроматографической колонки. Ток регистрируется с помощью амперметра, преобразуется в цифровой сигнал и отображается в виде пика на хроматограмме.
АЗОТНО-ФОСФОРНЫЙ ДЕТЕКТОР
Азотно-фосфорный детектор (АФД) представляет собой разновидность ПИД. Основное различие заключается в том, что непосредственно нал форсункой горелки располагается стеклянный или керамический элемент. Низкое соотношение водород/воздух не позволяет поддерживать пламя, что приводит к снижению ионизации углеводов. Однако щелочные ионы па поверхности керамического элемента способствуют ионизации соединений, содержащих фосфор или азот, облегчая их детекцию па фоне остальных веществ, имеющих преимущественно углеводную природу.
ДЕТЕКТОР ПОГЛОЩЕНИЯ УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ
Тогда как ПИД и АФД могут применять только в сочетании с ГХ, детектор УФ-поглощения, начиная с конца 1960-х гг., является одним из наиболее распространенных анализаторов для ВЭЖХ. Принцип его работы основан на обычной спектрометрии и законе Бера—Ламберта:
Log I0/I = ecd,
где I0 — интенсивность падающего света; I — интенсивность прошедшего света; е — коэффициент экстинкции (поглощения); с — концентрация поглощающего анализируемого вещества; d — толщина слоя поглощающего вещества. На практике элюируемые вещества после ВЭЖХ колонки проходят через ячейку определенной длины, источник света испускает УФ-излучение (например, дейтериевая лампа, 190 — 600 нм) постоянной интенсивности, которое через монохроматор попадает на ячейку, интенсивность пропущенного света определенной длины волны определяется с помощью фотодиодов.
Описанные детекторы позволяют распознавать вещества, разделенные хроматографией — ГХ или ВЭЖХ. Основным недостатком этих детекторов является их низкая специфичность и, соответственно, недостаток подробной информации об анализируемых веществах. Это стало причиной того, что аналитические приборы с масс-спектрометрическими детекторами становятся основным средством при проведении анализов с целью допинг-контроля, которое применяется в сочетании с ГХ и ВЭЖХ и дополняет возможности "традиционной" инструментальной базы на основе ПИД, АФД и УФ-детекторов. Для определения веществ с помощью МС необходимо перевести анализируемое вещество в ионную форму. Этого можно добиться рядом технических приемов, выбор которых происходит с учетом особенностей используемой хроматографической системы. В настоящее время в ГХ-системах, оснащенных масс-спектрометрическим анализатором, используют ионизацию электронным ударом или химическую ионизацию, тогда как в ВЭЖХ-установках применяется ионизация электрораспылепием, химическая ионизация при атмосферном давлении, а также фотоионизация при атмосферном давлении. Далее вкратце рассмотрим принципы ионизации электронным ударом и электрораспылением, а также квадрунольный анализатор и ионную ловушку — инструменты, которые чаще всего используют в лабораториях допинг-контроля.
Способы ионизации[править | править код]
ИОНИЗАЦИЯ ЭЛЕКТРОННЫМ УДАРОМ
Ионизация электронным ударом (EI) широко используется для создания позитивно заряженных ионов анализируемых веществ после разделения на ГХ-колонке. Электроны испускаются с катода (нагретая вольфрамовая или рениевая нить) и, ускоряясь под действием электрического поля, устремляются к аноду. Пучок разогнанных до определенной энергии электронов пересекает под прямым углом поток газа с элюируемыми веществами, поступающий из ГХ. При столкновении электронов, обладающих энергией 70 эВ (напряжение между катодом и анодом устанавливается равным 70 В), с молекулами анализируемого вещества, которое является источником ионов, могут происходить разнообразные процессы ионизации, например:
(1) АВ + е- > АВ+ + 2е-;
(2) АВ + е- > АВ2+ + Зе-;
(3) АВ + е- > АВ-.
В случае позитивной ионизации наиболее важным механизмом является образование позитивно заряженной молекулы (АВ+) при потере электрона, выбитого ускоренным электроном из электронного потока между катодом и анодом (1). Кроме того, анализируемая молекула АВ может потерять два электрона, что приведет к образованию заряженной молекулы АВ2+ (2). Молекула АВ может также захватить свободный электрон и приобрести отрицательный заряд АВ' (3). Помимо описанных выше вариантов воздействия электронного удара на вещество, выходящее с ГХ-колонки, следует принимать во внимание и другие последствия этого способа ионизации. Основным результатом электронного удара является образование высокоэнергетических катион- радикалов, распадающихся на ионы. В результате детекции этих ионов масс-селективным анализатором формируется характерный масс-спектр соответствующего вещества. В зависимости от происходящих перемещений и потерь электронов продуктами ионизации могут быть как радикалы, так и ионы с парным числом электронов.
ИОНИЗАЦИЯ ЭЛЕКТРОРАСПЫЛЕНИЕМ (ИЭР)
За разработку способа мягкой ионизации методом электрораспыления в 2002 г. присуждена Нобелевская премия по химии. Джон Фенн был награжден за фундаментальные исследования процессов ионизации макромолекул, которые были опубликованы еще в 1984 г. Ямашита и Фснном (Yamashita, Fenn, 1984b; Voyksner, 1997). Суть метода заключается в том, что жидкости, содержащие протонированные и депротонированные молекулы, распыляются через капиллярный наконечник при высоком напряжении (1 кВ и выше). При этом формируются заряженные капли, которые уменьшаются в объеме за счет испарения растворителя и последующего дробления, в результате образуются мельчайшие капли, обладающие очень высоким зарядом. В результате из этих мельчайших капель образуются газообразные ионы — этот процесс описывают две различные теории: модель заряженного остатка (Dole et al., 1968) и испарение ионов (Iribame, Thomson, 1976). Схематическое изображение основных процессов, происходящих при ионизации электрораспылением. Сначала распространение электрического ноля по жидкости внутри капилляра приводит к формированию положительного заряда иа поверхности жидкости, в результате чего происходит искажение мениска, формирование конусообразного выступа и распыление капель, обладающих значительным положительным зарядом. При испарении растворителя размер капель уменьшается, тогда как их заряд остается неизменным. Затем под действием нарастающего электростатического отталкивания происходит дальнейшее дробление капель, которое продолжается, пока они не достигнут Релеевского предела устойчивости. Это явление происходит одновременно с дальнейшим испарением растворителя, благодаря чему формируются частицы очень малого размера, обладающие высоким зарядом. В результате, как предполагается (Dole et al., 1968), образуются частицы, имеющие лишь один ион, а испарение растворителя приводит к возникновению газообразного иона (модель заряженного остатка). Альтернативная гипотеза постулирует, что эмиссия ионов происходит непосредственно с поверхности частиц вещества размером менее 10 нм, что также приводит к формированию газообразных ионов (испарение ионов) (Kcbarle, Но, 1997).
Масс-анализаторы[править | править код]
Ионы анализируемого вещества, полученные одним из способов ионизации, далее подвергаются анализу с помощью масс-селективных детекторов, например квадрупольного или ионной ловушки. Для работы обоих этих детекторов необходим глубокий вакуум, их можно использовать в сочетании как с ГХ (и ионизации вещества электронным ударом), так и с ВЭЖХ (например, с ионизацией электрораспылением) системами разделения. Поскольку ионизация электронным ударом происходит в вакууме, для подключения масс-анализатора не требуется никаких специальных приспособлений для выравнивания давлений, однако ионизация электрораспылением осуществляется при атмосферном давлении, поэтому современные системы ГХ-ИЭР-МС оборудованы сложными системами, обеспечивающими поддержание в масс-анализаторе необходимого давления.
КВАДРУПОЛЬНЫЙ АНАЛИЗАТОР
Квадрупольный масс-спектрометр состоит из четырех стержней, которые могут быть изготовлены из различных материалов, например из плавленого кварца, покрытого слоем золота. Противоположные стержни соединены между собой, а расположенные рядом — изолированы друг от друга. Сначала ионы, образовавшиеся в источнике ионов, направляются с ускорением в центр квадруполя. Под действием переменного электрического поля, приложенного к стержням, по направлению к центральной линии квадруполя формируются позитивные или негативные поля, таким образом позитивные ионы, пролетающие вдоль стержней квадруполя, отталкиваются позитивными и притягиваются негативной поляризацией. Степень отклонения прямо пропорциональна приложенному напряжению, его частоте (т. е. продолжительность воздействия переменного поля) и массе ионов. Кроме того, к парам стержней прикладывается постоянное напряжение. В результате ионы с различным соотношением массы и заряда могут перемещаться в двухмерном поле квадруполя, если прикладываемые поочередно постоянное и переменное поля чередуются с частотой, которая обеспечивает устойчивое колебательное движение. Эти параметры можно изменять с целью оптимизации масс-селекции, благодаря чему становится возможным пропускать отдельные ионы или записывать полный спектр, выполняя в течение заданного времени поочередное сканирование в различных диапазонах соотношения масса/заряд (Budzikiewicz, 1998; Lottspeich, Zorbas, 1998).
Ионы, изолированные с помощью квадруполя, могут подвергаться дальнейшим исследованиям, как это происходит в масс-спектрометрах с тройным квадруполом. В таком масс-спектрометре имеются три соединенных между собой квадруполя, первый из которых используется для того, чтобы из пучка ионов, попадающего в масс-спектрометр, отобрать ионы с определенными характеристиками (масса/заряд). Во втором квадруполе, так называемой камере столкновений, отобранные ионы соударяются с молекулами газа (аргон или азот) и подвергаются дальнейшему распаду, степень которого зависит от приложенного ускоряющего напряжения и давления газа в камере для столкновений. Образовавшиеся в результате столкновения ионы измеряются в третьем квадруполе либо путем сканирования полного спектра либо измерения отдельных ионов, что позволяет получить информацию о процессах фрагментации, а также о структуре анализируемого вещества.
КВАДРУПОЛЬНАЯ ИОННАЯ ЛОВУШКА
В качестве альтернативы масс-спектрометрам с квадрупольным анализатором часто используют анализаторы с квадрупольной ионной ловушкой. Еще в 1953 г. Вольфганг Пол с соавторами описал возможность использования трехмерного квадруполя в качестве "ионной ловушки", а в последнее десятилетие на основе этого предположения были созданы сложные масс-спектрометры с ионными ловушками (Louris et al., 1987, 1989; Patterson et al., 2002). Ha рис. 5.10 представлена схема устройства ионной ловушки, которая состоит из двух чашеобразных электродов (один со входом для ионов, а другой с отверстием для их выхода) и кольцевого электрода. Определенное сочетание радиочастотных и постоянных напряжений, прикладываемых к электродам ионной ловушки, позволяет удерживать ионы внутри нее. Ионы, которые формируются во внешнем источнике ионов (например, с использованием ионизации электронным ударом или ялектрораспылением), попадают в ионную ловушку, содержащую газ (гелий или аргон) под давлением равным около 1 мторр. Чаще используют гелий, который замедляет ионы, отклоняя их траекторию к центру ловушки. Кроме того, наличие газа позволяет снизить кинетическую энергию ионов при их столкновениях с молекулами газа, что также способствует захвату ионов ловушкой. Удержание ионов в широком диапазоне значений отношения масса/заряд определяется переменным напряжением, которое подается на кольцевой электрод. Поэтому последовательный выброс ионов, предоставляющий возможность их масс-избиратель-ной детекции, обеспечивается так называемым состоянием неустойчивости, которое создается путем постепенного увеличения переменного напряжения на кольцевом электроде в сочетании с приложением переменного напряжения к чашеобразным электродам на концах ионной ловушки, что приводит к возникновению резонансного движения. Ионы с определенным соотношением масса/заряд выходят на нестабильные траектории и выбрасываются через отверстия на чашеобразном электроде (выход ионов) и детектируются с помощью электронного умножителя.
Помимо эффективного режима сканирования, спектрометры с ионными ловушками предоставляют широкие возможности для МСп экспериментов. Избирательное удаление ионов из ловушки, накопление определенного типа ионов-предшественников с последующей их резонансной активацией позволяет добиться диссоциации, индуцированной столкновениями (collision activated dissociation, CAD). В результате образуется спектр ионных продуктов, предоставляющий объем информации, сопоставимый с тем, который дают эксперименты с использованием тройного квадруполя. Вместе с тем ионная ловушка обладает важным преимуществом, поскольку позволяет отбирать, накапливать и расщеплять иоиы, получаемые в МС/МС-экспериментах, а именно МС3, предоставляя информацию о возможных способах фрагментации и составе образующихся при диссоциации ионах, что представляет значительный интерес, особенно в случае масс-спектрометрии в сочетании с ионизацией электрораспылеиием.
Очистка и приготовление образцов[править | править код]
Согласно установленным правилам, для анализа на запрещенные субстанции при допинг-контроле спортсмены сдают главным образом мочу. Кроме того, в определенных случаях для идентификации конкретных препаратов могут быть получены образцы крови, плазмы/сыворотки и волос. Приготовление образцов является чрезвычайно важным элементом допинг-контроля, поскольку в значительной мере обеспечивает достижение максимально возможной определенности результатов и необходимой чувствительности при проведении анализов. К настоящему времени разработаны разнообразные приемы очистки образцов от солей и других примесей, в частности выделения целевого анализируемого вещества.
Жидкостная экстракция[править | править код]
Чаще всего и, вероятно, дольше всего используется метод приготовления образцов жидкостной экстракции. В одной из первых работ, посвященных идентификации бензедрина (рацемическая смесь амфетаминсульфата) и его метаболитов в моче человека, жидкостная экстракция применялась для определения скорости экскреции (Richter, 1938). В частности, пробы мочи подвергали гидролизу 2 н. гидроксидом натрия и экстрагировали петролейиым эфиром. В последующие десятилетия были описаны многочисленные методики очистки веществ, содержащихся в биологических жидкостях, с применением жидкостной экстракции. В основу всех этих методик был положен один и тот же принцип: изменение pH до необходимого значения и экстракция кислых, нейтральных или щелочных компонентов (Keller, Ellenbogen, 1952; Axelrod, 1954; Beckett, Rowland; 1965; Beckett, Wilkinson, 1965; Kolb, Patt, 1965; Cartoni, Cavalli, 1968). Знание величины pi анализируемых веществ предоставляет возможность многократной экстракции проб и/или повторной экстракции их компонентов при различных pH различными растворителями. Стремление к созданию более детальных, специфических и чувствительных методов анализа сопровождалось совершенствованием и развитием процедур жидкостной экстракции, направленным на снижение количества коэкстрагируемых примесей, создающих помехи при анализе. Разработанные принципы и сегодня используются в методах скрининга и подтверждения при проведении анализов с целью допинг-контроля (Donike et al., 1970; Spyrdaki et al., 2001; Van Eenoo et al., 2001; Thevis et al., 2003b), например, стимуляторы, такие, как амфетамины, эфедрины и их производные, обычно экстрагируют из проб мочи эфирами в щелочных условиях, вещества, экстрагированные органической фазой, концентрируются и подвергаются дальнейшему анализу ГХ-МС и/или ГХ-АФД. Помимо того, жидкостная экстракция применяется для анализа кортикостероидов (Fluri et al., 2001), диуретиков, веществ, блокирующих активность р-рецепторов и анаболических стероидов при различных условиях (т. е. в присутствии минеральных солей, органических растворителей и при разных значениях pH) (Geyer et al., 1997; Thevis et al., 2001; Deventer et al., 2002).
Очень мощным средством оказалась так называемая рсэкстракция или повторная экстракция, которая применялась уже в 1952 г. (Keller, Ellenbogen, 1952). Этот метод применяется для повышения чистоты образцов, которые предстоит подвергнуть анализу. В частности, экстракция анализируемых веществ в щелочных условиях в органический растворитель с последующим перемещением интересующих исследователя веществ из органической в закисленную водную фазу (0,06 н., НС1) доказала свою пригодность для подтверждающих тестов, например для Р2-агониста кленбутерола, благодаря крайне эффективному снижению количества разнообразных биологических примесей (Sigmund et al., 1998).
Твердофазная экстракция[править | править код]
Для ряда веществ используется альтернативный способ очистки и концентрации анализируемых веществ, содержа1цихся в биологических пробах, а именно твердофазная экстракция (ТФЭ ). Применение различных адсорбирующих материалов, в частности полистирола, С18 или ионообменных смол, позволило создать некоторые методики скрининга и получения доказательств, используемых при проведении допинг-контроля. В 1968 г. Брсдлоу продемонстрировал возможность экстракции стероидных коньюгатов нейтральными полимерными смолами (Bradlow, 1968). Дальнейшее совершенствование использованных им материалов и приемов позволило создать методику, пригодную для использования для проведения допинг-контроля, например па применение анаболических стероидов (Donike et al., 1984) и диуретиков (Thieme et al., 2001). Основным достоинством ТФЭ является возможность полной автоматизации процедуры экстракции образцов, включая подготовку картриджей, загрузку проб, промывку и последующую элюцию. Кроме того, в ходе ТФЭ можно производить дериватизацию анализируемых веществ (Lisi et al., 1991).
Иммуноаффинная хроматография[править | править код]
Иммуноаффинную хроматографию (ИАХ ) в качестве средства выделения анализируемых веществ из биологических проб стали применять относительно недавно. Суть метода заключается в том, что моно-или поликлональные антитела, способные образовывать нековалентную связь с различными частями анализируемых молекул, пришивают к носителю, например к сферическим частицам агарозы. Гелем, приготовленным из таких частиц, заполняют колонку с пористым фильтром на одном конце и пропускают через нее пробы мочи или плазмы. При пропускании через колонку искомых анализируемых веществ антитела, связанные с носителем, узнают их и связывают, формируя нековалентные комплексы, тогда как остальные молекулы, не способные взаимодействовать с антителами, элюируются с растворителем. Изменение условий элюирования позволяет разрушить комплекс вещество—антитело, не разрушая при этом самих молекул, и получить анализируемое вещество в очищенном виде, практически без посторонних примесей, для проведения дальнейшего анализа, например с помощью ГХ-МС. Химические реакции, лежащие в основе приготовления адсорбента для наполнения колонки, и основные процессы, положенные в основу метода иммуиоаффинной хроматографии, представлены на схеме 5.5. Чаще всего в качестве носителя используют частицы агарозы, которые предлагаются для продажи рядом фирм. Для того чтобы к этим частицам можно было пришить химическим путем пептиды или белки, поверхность этих частиц активируют. Наиболее часто применяют метод активации цианогенбромидом (CNBr), предложенный в 1967 г. Аксеном (Axen et al., 1967). В щелочных условиях CNBr реагирует с гидроксильными группами на поверхности частиц агарозы с образованием циановых эфиров и имидокарбонатов, которые, в свою очередь, вступают в химическую реакцию с антителами (Hermanson et al., 1992). Частицы агарозы с присоединенными к ним антителами, помещенные в колонку, узнают и избирательно связывают только специфические вещества или классы веществ, присутствующие в биологических образцах. Использование подходящих элюентов, например смеси воды и органических растворителей, позволяет освободить связанное с антителами вещество, сконцентрировать его и анализировать при помощи стандартных методов, в частности МС (Schanzer et al., 1996; Machnik et al., 1999). Снижение количества посторонних примесей приводит к улучшению соотношения сигнал/шум и снижению порога детекции методами ГХ-МС и ЖХ-МС/МС.
Метод дериватизации[править | править код]
ГХ-МС является основным инструментом скрининга и получения доказательств в лаборатории допинг-контроля. Такие системы обладают высокой специфичностью и чувствительностью к многочисленным веществам, занесенным в список запрещенных субстанций МОК и ВАДА. Однако для проведения анализа с помощью ГХ-МС вещества должны быть переведены в газообразную форму. Поскольку это требование для многих анализируемых веществ, например Р2-агонистов, различных диуретиков и блока-торов p-рецепторов, выполнить достаточно сложно, путем реакций с различными реагентами получают их более легколетучие производные. Превращениям подвергают в первую очередь гидроксильные группы и вторичные аминогруппы, поскольку именно их способность к гидрофильным взаимодействиям является одной из причин сниженной летучести. Одной из первых осуществлявшихся модификаций анализируемого вещества было ацетилирование с помощью уксусного ангидрида. Образовавшиеся молекулы необходимо было очищать от остатков уксусной кислоты и уксусного ангидрида, что обычно выполняли с помощью жидкостной экстракции. Поскольку этот способ получения производных для ГХ-МС анализа достаточно сложный и трудоемкий, были разработаны несколько дериватизационных агентов, в состав которых, как правило, входят остатки триметилсилила (ТМС). Приводим некоторые из таких агентов: гексаметилдисилазан (ГМДС), триметилсилилимидазол (ТМСИми) и N-метил-N-триметилсилилтрифторацетамид (МСТФА) (Donike, 1969). Последний является наиболее часто применяемым для дериватизации веществом, в частности в сочетании с иодидом аммония и этаптиолом, который in situ приводит к образованию триметилйодсилана (ТМИС), высокореактивного триметилсилилирующего реагента (Donike, 1973; Donike, Zinunermann, 1980). В присутствии ТМСИ происходит модификация гидроксильных и аминогрупп, а кетоновые остатки превращаются в енол-ТМС эфиры. Несколько других мощных реагентов применялись для введения в анализируемые молекулы трифторацетил (ТФА)-или гептафторбутил (ГФБ)-остатков, а именно N,N-бистрифторацетамид, N-метил-N-бистрифтораце-тамид (МБТФА) (Donike, Derenbach, 1976) или N-метил-N-бисгептафторбутиламид (МБГФБ) соответственно. Трифторацетилирование приводит к формированию более стабильных производных аминогрупп по сравнению с триметилсилилированием, поэтому возможна также избирательная модификация анализируемых веществ ТМС- и ТФА-группами, что делает возможным хроматографическое разделение стереоизомеров таких стимуляторов, как эфедрины (Opfermann, Schanzer, 1996; Thevis et al., 2003b).
Читайте также[править | править код]
- Допинг-контроль: количественный анализ
- Определение (тесты и допинг-контроль) пептидных гормонов
- Количественный допинг-тест пептидных гормонов
- Хорионический гонадотропин: допинг-контроль, тесты
- Эритропоэтин: допинг-контроль, тесты
- Гормон роста: допинг-контроль, тесты
Предупреждение[править код]
![]() Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Литература[править | править код]
- Aguilera, Rv Catlin, D.H., Becchi, M. et al. (1999) Screening urine for exogenous testosterone by isotope ratio mass spectrometric analysis of one pregnanediol and two androstanediols. Journal of Chromatography В 727, 95-105.
- Aliens, E.J. (1965) General and pharmacological aspects of doping. In: Doping (de Schaepdryver, A. & Hebbelink, М., eds.). Pergamon Press, Oxford: 27-50.
- Axelrod, J. (1954) Studies on sympathomimetic amines. II. The bio-transformation and physiological disposition of d-amphetamine, </-p-hydroxyamphetamine and dmethamphetamine. Journal of Pharmacology and Experimental Therapeutics 110, 315-326.
- Axen, R., Porath, J. & Emback, S. (1967) Chemical coupling of peptides and proteins to polysaccharides by means of cyanogen halides. Nature 24, 1302-1304.
- Ayotte, C, Goudreault, D. & Charlebois, A. (1996) Testing for natural and synthetic anabolic agents in human urine. Journal of Chromatography В 687 , 3-25.
- Beckett, A.H. & Rowland, M. (1965) Determination and identification of amphetamine in urine. Journal of Pharmacy and Pharmacology 17, 59-60
- Beckett, A.H. & Wilkinson, G.R. (1965) Identification and determination of ephedrine and its congeners in urine by gas chromatography. Journal of Pharmacy and Pharmacology Y7 (Suppl.), SI 04-S106.
- Beckett, A.H., Tucker, G.T. & Moffat, A.C. (1967) Routine detection and identification in urine of stimulants and other drugs, some of which may be used to modify performance in sport. Journal of Pharmacy and Pharmacology 19, 273-294. de Boer, D., Gainza Bernal, M.E., van Ooyen, R.D. & Maes, R.A. (1991) The analysis of trenbolone and the human urinary metabolites of trenbolone acetate by gas chromatography /mass spectrometry and gas chromatography/ tandem mass spectrometry. Biological Mass Spectrometry 20, 459-466.
- Bowers, L.D. (1998) Athletic drug testing. Clinics in Sports Medicine 17, 299-318.
- Brad low, H.L. (1968) Extraction of steroid conjugates with a neutral resin. Steroids 11, 265-272,
- Budzikiewicz, H. (1998) Massenspektrometrie. Wiley-VCH, New York.
- Burstin, S. (1963) La Lucha contra el Dopage. Revista de Derecho Sportiva 3, 583-636'.
- Cartoni, G.P. & Cavalli, A. (1968) Detection of doping by thin-layer and gas chromatography. Journal of Chromatography 37, 158-161.
- Deventer, K., Delbeke, F.T., Roels, K. & Van Eenoo, P. (2002) Screening for 18 diuretics and probenecid in doping analysis by liquid chromatography-tandem mass spectrometry. Biomedical Chromatography 16, 529-535.
- Dole, М., Mack, L.L., Hines, R.L. et al. (1968) Molecular beams of macroions. Journal of Chemical Physics 49, 2240-2249.
- Donike, M. (1969) N-Methyl-N-trimethylsilyl-trifluoracetamid, ein neues Silylierungsmittel aus der Reihe der silylierten Amide. Journal of Chromatogmphy 42, 103-104.
- Donike, M. (1973) Acylierung mit Bis(Acylamiden): N-Methyl-bis(tri-fluoracetamid) und Bis(trifluoracetamid), zwei neue Reagenzien zur Trifluoracetylierung. Journal of Chromatography 78, 273-279.
- Donike, M. & Derenbach, J. (1976) Die selektive Derivatisierung unter kontrollierten Bedingungen: Ein Weg zum Spuren-Nachweis von Ariiinen. Zeitschrift Analytische Chemie 279, 128-129.
- Donike, M. & Zimmermann, J. (1980) Zur Darstellung von Trimethyl-sllyl-, Triethylsilyl- und tert. -Butyldimethylsilyl-enolathem von Ketosteroiden fur gas-chromatographische und massenspektromet-rische Untersuchungen. Journal of Chromatogmphy 202, 483-486.
- Donike, М., Jaenicke L., Stratmann, D. & Hollmann, W. (1970) Gas chromatographic detection of nitrogen-containing drugs in aqueous solutions by means of the nitrogen detector. Journal of Chromatography 52, 237-250.
- Donike, М., Zimmermann, J., Barwald, K.R. et al. (1984) Routinebestimmung von Anabolika im Ham. Deutsche Zeitschrift fur Sportmedizin 35, 14-24.
- Donike, М., Ueki, М., Kuroda, Y. et al. (1995) Detection of dihydrotestosterone (dht) doping: alterations in the steroid profile and reference ranges for dht and its 5 a-metabolites. Journal of Sports Medicine and Physical Fitness 35, 235-250.
- Engelhardt, H., Miiller, H. & Schon, U. (1985) The column. In: High Performance Liquid Chromatogmphy in Biochemistry (Henschen,
- A., Hupe, K.P., Lottspeich, F. & Voelter, W., eds.). VCH Verlagsgesellschaft, Weinheim: 17-78.
- Fluri, K., Rivier, L., Dienes-Nagy, A. et al. (2001) Method for confirmation of synthetic corticosteroids in doping urine samples by liquid chromatography-electrospray ionization mass spectrometry. Journal of Chromatography A 926, 87-95.
- Geyer, H., Schanzer, W., Mareck-Engelke, U. & Donike, M. (1996) Factors influencing the steroid profile. In: Proceedings of the 14th Cologne Workshop on Doping Analysis (Donike, M. Geyer, H., Gotzmann A. & Mareck-Engelke, U., eds.). Sport & Buch Straufi, Cologne: 95-114.
- Geyer, H., Schanzer, W., Mareck-Engelke, U., Nolteemsting, E. & Opfermann, G. (1997) Screening procedure for anabolic steroids-the control of the hydrolysis with deuterated androsterone glucuronide and studies with direct hydrolysis. In: Proceedings of the 15th Cologne Workshop on Doping Analysis (Schanzer, W., Geyer, H., Gotzmann, A. & Mareck-Engelke, U., eds.). Sport & Buch Straufi, Cologne: 99-101.
- Hermanson, G.T., Mallia, A.K. & Smith, P.K. (1992) Immobilized Affinity Ligand Techniques. Academic Press, San Diego, CA.
- Hoher, J. & Troidl, H. (1995) Doping im Sport. Deutsche Zeitschrift fur Sportmedizin 46, 270-282.
- Horning, S., Geyer, H., Gotzmann, A., Flenker, U. & Schanzer, W. (1998) Detection of exogenous steroids by ,3C/,2C analysis. In: Proceedings of the 16th Cologne Workshop on Doping Analysis (Schanzer, W., Geyer, H., Gotzmann, A. & Mareck-Engelke, U., eds.). Sport & Buch Straufi, Cologne: 135-148.
- International Olympic Committee (IOC) (2003) List of Prohibited Substances and Methods of Doping. IOC, Lausanne.
- Iribame, J.V. & Thomson, B.A. (1976) On the evaporation of small ions from charged droplets. Journal of Chemical Physics 64, 2287-2294.
Kebarle, P. & Ho, Y. (1997) On the mechanism of electrospray mass spectrometry. In: Electrospray Ionization Mass Spectrometry-Fundamentals, Instrumentation and Applications (Cole, R.B., ed.). John Wiley & Sons, New York: 3-63.
- Keller, R.E. & Ellenbogen, W.C. (1952) The determination of (/-amphetamine in body fluids. Journal of Pharmacology and Experimental Therapeutics 106, 77-82.
- Knight, J. (2003) Drugs bust reveals athletes' secret steroid. Nature 425, 752 (News).
- Kolb, H. & Patt, P.W. (1965) Beitrag zum Arzneimitteinachweis in Korperflussigkeiten durch Gaschromatographie. Arzneimittel-Forsdiung 15, 924-927.
- Lang, HJ. & Hropot, M. (1995) Discovery and development of diuretic agents. In: Handbook of Experimental Pharmacology, vol. 117 (Greger, R.F., Knauf, H. & Mutschler, E., eds.). Springer-Verlag, Berlin: 141-172.
- Leinonen, A., Kuuranne, T. & Kostiainen, R. (2002) Liquid chromatography/ mass spectrometry in anabolic steroid analysis-optimization and comparison of three ionization techniques: electrospray ionization, atmospheric pressure chemical ionization and atmospheric pressure photoionization. Journal of Mass Spectrometry 37, 693-698.
- Lisi, A.M., Trout, G.J. & Kaslauskas, R. (1991) Screening for diuretics in human urine by gas chromatography-mass spectrometry with derivatisation by direct extractive alkylation. Jotimal of Chromatography 563, 257-270.
- Lottspeich, F. & Zorbas, H. (1998) Bioanalytik. Spektrum Akade-mischer Verlag, Heidelberg.
- Louris, J.N., Cooks, R.G., Syka, J.E.P. et al. (1987) Instrumentation, applications, and energy disposition in quadrupole ion-trap tandem mass spectrometry. Analytical Chemistry 59, 1677-1685.
- Louris, J.N., Amy, J.W., Ridley, T.Y. & Cooks, R.G. (1989) Injection of ions into a quadrupole ion trap mass spectrometer. International Journal of Mass Spectrometry and Ion Processes 88, 97-111.
- Machnik, М., Geyer, H., Horning, S. et al. (1999) Long-term detection of clenbuterol in human scalp hair by gas chromatography-high-resolution mass spectrometry. Journal of Chromatography В 723, 147-155.
- Masse, R., Ayotte, C, Bi, H.G. & Dugal, R. (1989) Studies on anabolic steroids. III. Detection and characterization of stanozolol urinary metabolites in humans by gas chromatography-mass spectrometry. Journal of Chromatography 497, 17-37.
- Mohrke, W. & Ullrich, F. (1995) Metabolism of diuretics. In: Handbook of Experimental Pharmacology, vol. 117 (Greger, R.F., Knauf, H. & Mutschler, E., eds.). Springer-Verlag, Berlin: 173-200.
- Morgan, C.E. (1957) Drug administration to racing animals. Journal of the American Veterinary Medical Association 130, 240-243.
- Opfermann, G. & Schanzer, W. (1996) Trimethylsilylation-aspects for derivatisation. In: Proceedings of the 14th Cologne Workshop on Doping Analysis (Schanzer, W., Geyer, H., Gotzmann, A. & Ma* reck-Engelke, U., eds.). Sport & Buch Straub, Cologne: 247-252.
- Patterson, G.E., Guymon, A.J., Riter, L.S. et al. (2002) Miniature cylindrical ion trap mass spectrometer. Analytical Chemistry 74, 6145-6153.
- Prokop, L. (1970) The struggle against doping and its history. Journal of Sports Medicine and Physical Fitness 10, 45-48.
- Prokop, L. (2002) Zur Geschichte des Dopings. Sportarztewoche, December 1-7, Kaprun.
- Reeds, P.J., Hay, S.М., Dorward, P.M. & Palmer, R.M. (1988) The effect of b-agonists and antagonists on muscle growth and body composition of young rats (Rattus sp.). Comparative Biochemistry and Physiology С 89, 337-341.
- Richter, D. (1938) A colour reaction for benzedrine. Lancet 238, 1275.
- Schanzer, W. (1996) Metabolism of anabolic androgenic steroids. Clinical Chemistry 42, 1001-1020.
- Schanzer, W. & Donike, M. (1995) Synthesis of deuterated steroids for GC/MS quantification of endogenous steroids. In: Proceedings of the 12th Cologne Workshop on Dope Analysis (Donike, М., ed.). Sport & Buch Straufi, Cologne: 93-112.
- Schanzer, W., Delahaut, P., Geyer, H., Machnik, M. & Horning, S. (1996) Long-term detection and Identification of metandienone and
stanozolol abuse in athletes by gas chromatography-high-resolution mass spectrometry. Journal of Chromatography В 687, 93-108.
- Scott, R.P.W. (1982) Microbore columns in liquid chromatography. In: Techniques in Liquid Chromatography (Simpson, C.F., ed.). John Wiley & Sons, Chichester: 79-96.
- Shackleton, C.H., Phillips, A., Chang, T. & Li, Y. (1997) Confirming testosterone administration by isotope ratio mass spectrometric analysis of urinary androstanediols. Steroids 62, 379-387.
- Sigmund, G., Homing, S., Seinsch, I. & Schanzer, W. (1998) Confirmation of clenbuterol. Proceedings of the 16th Cologne Workshop on Doping Analysis (Schanzer, W., Geyer, H., Gotzmann, A. & Mareck-Engelke, U., eds.). Sport & Buch Straufi, Cologne: 129-133.
- Spyridaki, M.H., Tsitsimpikou, C.J., Siskos, P.A. & Georgakopoulos, C.G. (2001) Determination of ephedrines in urine by gas chromatography-mass spectrometry. Journal of Chromatography В 758, 311-314.
- Stallion, A., Zhang, F.S., Chance, W.T., Foley-Nelson, T. & Fischer, I.E. (1991) Reversal of cancer cachexia in rats by cimaterol and supplemental nutrition. Surgery 110, 678-684.
- Thevis, М., Opfermann, G. & Schanzer, W. (2000) Detection of the plasma volume expander hydroxyethyl starch in human urine. Journal of Chromatography В 744, 345-350.
- Thevis, М., Opfermann, G. & Schanzer, W. (2001) High speed determination of B-receptor blocking agents in human urine by liquid chromatography/tandem mass spectrometry. Biomedical Chromatography 15, 393-402.
- Thevis, М., Schmickler, H. & Schanzer, W. (2002). Mass spectrometric behavior of thiazide-based diuretics after eleetrospray ionization and collision-induced dissociation. Analytical Chemistry 74, 3802-3808.
- Thevis, М., Schmickler, H. & Schanzer, W. (2003a). Effect of the location of hydrogen abstraction on the fragmentation of diuretics in negative eleetrospray ionization mass spectrometry. Journal of the American Society for Mass Spectrometry 14, 658-670.
- Thevis, М., Sigmund, G. & Schanzer, W. (2003b) Confirmation of ephedrines-comparison between GC-MS and LC-MS/MS. In: Proceedings of the 21st Cologne Workshop on Doping Analysis
(Schanzer, W., Geyer, H., Gotzmann, A. & Mareck-Engelke, U., eds.). Sport & Buch Straufi, Cologne: 303-307.
- Thieme, D., Grosse, J., Lang, R., Mueller, R.K. & Wahl, A. (2001) Screening, confirmation and quantification of diuretics in urine for doping control analysis by high-performance liquid chromatography-atmospheric pressure ionization tandem mass spectrometry. Journal of Chromatography A 757, 49-57.
- Van Eenoo, P., Delbeke, F.T., Roels, K. & De Backer, P. (2001) Simultaneous quantitation of ephedrines in urine by gas chromato-graphy-nitrpgen-phosphorus detection for doping control purposes. Journal of Chromatography В 760, 255-261.
- Venerando, A. (1963) Pathologia del doping e mezzi di control lo. Medicina dello Sport 3, 945-959.
- Ventura, R., Segura, J., Berges, R. el al. (2000) Distinction of inhaled and oral salbutamol by urine analysis using conventional screening procedures for doping control. Therapeutic Drug Monitoring 22, 77-282.
- Vidic, E. (1956) Eine Methode zur Identifizierung papierchro-matographisch isolierter Arzneistoffe. Archives of Toxicology 16, 63-73.
- Voyksner, R.D. (1997) Combining liquid chromatography with elec-trospray mass spectrometry. In: Eleetrospray Ionization Mass Spectrometry-Fundamentals, Instrumentation and Applications (Cole, R.B., ed.). John Wiley & Sons, New York: 323-341.
- Wagner, J.C. (1989) Abuse of drugs used to enhance athletic performance. American journal of Hospital Pharmacy 46, 2059-2067.
- Wheeler, A. (1955) Reaction rates and selectivity in catalyst pores. In: Catalysis, vol. 2 (Emmet, P.H., ed.). Reinhold, New York: 105-165.
- Wilhelm, M. & deStevens, G. (1976) Antihypertensive agents. Progress in Drug Research. 20, 197-259.
- Yamashita, M. & Fenn, J.B. (1984a) Eleetrospray ion source. Another variation on the free-jet theme. Journal of Chemical Physics 88, 4451-459.
- Yamashita, M. & Fenn, J.B. (1984b) Negative ion production with the eleetrospray ion source. Journal of Chemical Physics 88, 4671-4675.