Оральные контрацептивы и спорт
Содержание
- 1 Оральные контрацептивы
- 2 Применение оральных контрацептивов и физическая работоспособность
- 3 Общая характеристика нормального менструального цикла
- 4 Общая характеристика оральных контрацептивов
- 5 Механизм действия оральных контрацептивов
- 6 Влияние оральных контрацептивов на спортивные показатели
- 7 Аэробная производительность
- 8 Анаэробные и силовые показатели, а также повреждения мышц
- 9 Переносимость повышенных температур
- 10 Использование различных субстратов и метаболические процессы при физической нагрузке
- 11 Заключение
- 12 Читайте также
- 13 Литература
Оральные контрацептивы[править | править код]
Источник: «Наглядная фармакология».
Автор: X. Люльман. Пер. с нем. Изд.: М.: Мир, 2008 г.
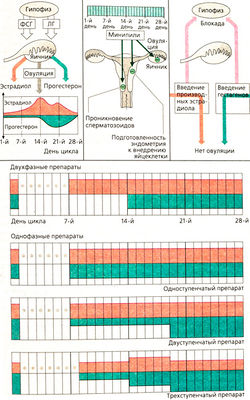
Блокаторы овуляции. Затормозить созревание яйцеклетки и овуляцию можно, используя механизм отрицательной обратной связи. Экзогенное введение эстрогенов (этинилэстрадиола или местранола) в первой половине цикла тормозит выработку ФСГ (как и при введении гестагенов), что приводит к нарушению созревания фолликула, овуляции не происходит. Регуляторные центры мозга не реагируют увеличением выработки ФСГ, так как уровень эстрогенов в крови повышен. Введение эстрогенов в первой половине цикла не препятствует обычным изменениям эндометрия и цервикальной слизи. Дополнительное назначение гестагенов во второй половине цикла может препятствовать развитию фазы секреции эндометрия. После отмены гормональной терапии менструации восстанавливаются.
Физиологический эстроген-прогестероновый цикл учитывается при назначении так называемых двухфазных препаратов (А). В монофазных препаратах эстрогены комбинируют с гестагенами. Раннее введение гестагенов препятствует нормальной пролиферации эндометрия, его готовность к внедрению яйцеклетки нарушается. Кроме того, проникновение сперматозоидов через цервикальную слизь затрудняется. Все эти эффекты препятствуют возникновению беременности. Препараты по дозе гестагена предразделяются на одно-, двух- и трехступенчатые (А). Во всех случаях после прекращения приема гормонов возникает реактивное кровотечение.
Побочные действия. Высокий риск тромбоэмболии объясняется в особенности действием эстрогенных компонентов. Он может быть усилен, по-видимому, определенными гестагенами (гестоден и дезогестрел). Возрастает риск развития инфаркта миокарда, инсульта, доброкачественной опухоли печени. Правда, абсолютная частота таких исходов невелика. Необходимо учитывать фактор предрасположенности (наследственность, курение, избыточный вес, возраст). Риск любых злокачественный новообразований, по-видимому, не слишком высок. Наблюдаются также гипертония, удерживание жидкости, холестаз, тошнота, боли в груди и т. д.
«Минипили». Постоянный прием малых доз гестагенов может препятствовать возникновению беременности. Механизм действия основан на изменениях эндометрия и цервикального канала. Овуляция не нарушается. Препараты не находят широкого применения, так как должны приниматься строго по часам, ненадежны, часто вызывают нарушение менструального цикла.
Посткоитальные препараты содержат высокие дозы гестагенов и эстрогенов и принимаются не позже 48 ч после коитуса. Механизм действия неизвестен.
Стимуляция овуляции. Повышение выработки гонадотропинов достигается импульсным введением ГРГ. Кломифен применяется перорально, в то время как вводимый после него гонадотропин — парентерально. Человеческий менопаузный гонадотропин (ЧМГ или от англ. HMG) получают из мочи женщин, находящихся в менопаузе. При ослаблении функции яичников концентрация гонадотропина в крови повышается, он попадает в мочу. ЧМГ состоит из ФСГ и Л Г. Человеческий хорионический гонадотропин выделяют из мочи беременных женщин. Он действует как ЛГ. Кроме того, ФСГ и ЛГ получают методами генной инженерии.
Применение оральных контрацептивов и физическая работоспособность[править | править код]
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Оральные контрацептивы достаточно широко применяются как среди женщин, занимающихся спортом и восстановительных целях, так и о среде профессиональных спортсменок. Оральные контрацептивы, как правило, представляют собой комбинацию соединений, подобных эстрогену и прогестерону. В зависимости от производителя препарата соотношение этих компонентов в его составе может быть различным. Помимо применения в качестве контрацептивного средства, такие препараты могут назначаться также для регуляции менструального цикла и терапии различных его нарушений (например, аменореи или дисменореи). Побочные эффекты, такие, как увеличение массы тела, нарушение выведения жидкости, тошнота в первое время вынуждали многих женщин, занимающихся спортом, отказываться от приема оральных контрацептивов. Однако после разработки препаратов с низким содержанием действующих компонентов удалось добиться снижения побочных эффектов, и количество женщин, применяющих оральные контрацептивы, существенно возросло. Влияние орального приема овариальных стероидов на физическую работоспособность изучали на протяжении нескольких последних десятилетий. Вместе с тем результаты изучения как позитивного, так и негативного потенциального действия этих веществ на спортивные показатели остаются неполными. Эта глава посвящена рассмотрению эндогенного гормонального контроля менструального цикла, различных типов экзогенных гормонов и механизмов их действия, а также влиянию этих веществ на физическую работоспособность.
Общая характеристика нормального менструального цикла[править | править код]
Регуляция менструального цикла осуществляется главным образом группой из пяти гормонов: гонадолиберином, фолликулостимулирующим гормоном (ФСГ), лютеинизирующим гормоном (ЛГ), эстрогеном и прогестероном. Эти гормоны являются элементами классической системы эндокринной регуляции, а именно гипоталамо-гипофизарно-гонадальной системы. Контроль функции этой системы осуществляется с помощью короткой и длинной цепи обратной связи.
Секреция гонадолиберина происходит в гипоталамусе и имеет пульсирующий характер, взаимосвязанный с менструальным циклом. Такой пульсирующий характер секреции гонадолиберина имеет существенное значение для поддержания регулярности менструального цикла. В среднем частота секреторных выбросов гонадолиберина составляет 90 мин в ранней фолликулярной фазе и 60 — 70 мин — в лютеиновой фазе. Гонадолиберин стимулирует выделение ФСГ и ЛГ, при этом секреция ЛГ более чувствительна к изменениям уровня гонадолиберина (Larsen et al., 2003).
Секреция ФСГ происходит в передней доле гипофиза и имеет важное значение для развития фолликулов. Секреция этого гормона максимальна и имеет наиболее критичное значение на протяжении первой недели фолликулярной фазы. На уровне яичников ФСГ индуцирует секрецию эстрогена и прогестерона, активируя ферменты, ароматазу и 17а-гидроксилазу цитохрома р450. Кроме того, ФСГ стимулирует пролиферацию гранулезных (зернистых) клеток яичника, а также экспрессию рецепторов ЛГ на гранулезных клетках яичника.
ЛГ секретируется в аденогипофизе и необходим как для развития фолликулов до наступления овуляции, так и для лютеинизации (развития желтого тела) и овуляции доминирующего фолликула. На протяжении фолликулярной фазы менструального цикла ЛГ стимулирует синтез андрогенов в клетках внутренней оболочки фолликула, стимулирует пролиферацию, дифференцировку и секреторные процессы клеток внутренней оболочки (теки) фолликула, а также способствует увеличению количества рецепторов ЛГ на поверхности гранулезных клеток. Предшествующий овуляции выброс ЛГ направляет овоцит в первое мейотическое деление и инициирует лютеинизацию клеток внутренней оболочки и гранулезных клеток фолликула. Желтое тело, которое образуется в результате этого процесса, вырабатывает в больших количествах прогестерон и некоторые эстрогены.
Продукция эстрогена производится на уровне яичников и имеет критическое значение для развития полости и созревания Граафова пузырька (везикулярного фолликула). Эстроген является преобладающим гормоном в конце фолликулярной фазы и непосредственно предшествует овуляции. Эстрадиол образуется главным образом из андрогенов, продуцируемых в клетках внутренней оболочки яичников. Андрогены мигрируют из клеток внутренней оболочки в клетки гранулезного слоя, где они при участии фермента ароматазы превращаются в эстрадиол. Действие эстрадиола заключается в индукции рецепторов ФСГ на гранулезных клетках, пролиферации и секреции клеток внутренней оболочки (теки) фолликула, индукции рецепторов ЛГ па гранулезных клетках и пролиферации клеток стомы и эпителия эндометрия. При низком уровне в крови эстрогены оказывают негативное влияние на секрецию ЛГ и ФСГ, в то же время при высоком содержании в крови они стимулируют секрецию ЛГ и ФСГ. Кроме того, эстроген индуцирует пролиферацию клеток гранулезного слоя и экспрессию рецепторов эстрогена, формируя цепь позитивной обратной связи для регуляции собственной секреции. В цикле эндометрия матки эстроген индуцирует пролиферацию желез эндометрия (Knobil, 1999).
В случае пульсирующего характера секреции гонадолиберина гипофизарные и яичниковые гормоны осуществляют взаимный контроль содержания в крови друг друга. Комплексное взаимодействие между гипофизарными и овариальными гормонами включает непосредственный контроль, а также механизмы позитивной и негативной обратной связи. Они также служат для сохранения самовозобновляющегося месячного гормонального цикла. Первый день менструального цикла наступает с началом менструации, которая происходит в начале фолликулярной фазы.
Фолликулярная фаза менструального цикла охватывает период от первого дня менструации до наступления овуляции. Основным предназначением фолликулярной фазы является формирование жизнеспособного фолликула, который сможет перейти к овуляции. Начальные события фолликулярной фазы инициируются возрастанием уровня ФСГ, которые происходят в первый день цикла. Повышение уровня ФСГ может быть обусловлено снижением уровня прогестерона и эстрогена в конце предыдущего цикла и последующим устранением их ингибирующего эффекта на ФСГ. Фолликулостимулирующий гормон стимулирует развитие 15 — 20 фолликулов ежемесячно, а также способствует увеличению секреции в фолликулах эстрадиола благодаря усилению выработки андрогенов внутренней оболочкой фолликулов и индукции рецептора ароматазы в клетках гранулезного слоя (Yen, 1999). Кроме того, ФСГ индуцирует экспрессию рецепторов ФСГ в фолликулах. По мере того как под влиянием ФСГ происходит повышение уровня эстрадиола, этот гормон ингибирует секрецию ФСГ и его уровень снижается.
В обычной ситуации один из фолликулов развивается в доминирующий фолликул, дальнейшей судьбой которого является овуляция, тогда как остальные фолликулы подвергаются атрезии. В настоящее время неизвестно, каким образом происходит выбор доминирующего фолликула, однако показано, что доминирующий фолликул всегда содержит в большом количестве рецепторы ФСГ. По мере снижения уровня ФСГ в конце фолликулярной фазы развивающимся фолликулам приходится конкурировать за относительно небольшие количества ФСГ. Доминирующий фолликул, который содержит рецепторы ФСГ в высокой концентрации, способен связывать ФСГ в большем количестве даже при снижении уровня этого гормона в крови. Это позволяет ему вырабатывать эстрадиол, требующийся для полного созревания. Поскольку остальные фолликулы не могут больше синтезировать эстрадиол в необходимом количестве из-за снижения уровня ФСГ в крови, они прекращают развитие и подвергаются атрезии. Доминирующий фолликул может также выделять паракринные факторы, стимулирующие апоптоз в других фолликулах. По мере созревания доминирующий фолликул продолжает секретировать эстроген в возрастающем количестве. Уровень эстрогена достигает максимального значения в конце фолликулярной фазы менструального цикла. В этот критический момент эстроген оказывает позитивное обратное воздействие на ЛГ (позитивное обратное воздействие обычно взаимосвязано с превышением эстрадиолом концентрации 1100 нмоль-л'1 в течение более 24 ч), что приводит к массированному предовуляторному выбросу Л Г. Важно отметить, что эстроген может оказывать позитивное обратное воздействие на ЛГ только на этой стадии менструального цикла. При искусственном повышении уровня эстрогена на более ранних стадиях менструального цикла овуляция не наступает (Yen, 1999; Larsen et al., 2003).
Лютеиновая фаза характеризуется лютеинизацией тех компонентов фолликула, которые не участвуют в овуляции. Этот процесс инициируется резким повышением концентрации ЛГ. Клетки гранулезного слоя, внутренней оболочки (теки) фолликула и часть окружающей соединительной ткани превращаются в желтое тело, которое со временем подвергается атрезии. Основным последствием резкого увеличения уровня ЛГ является то, что клетки гранулезного слоя за счет экспрессии новых рецепторов Л Г вместо преимущественного превращения андрогенов начинают главным образом синтезировать прогестерон. Это сопровождается ростом выработки прогестерона, а также снижением сродства гранулезных клеток к эстрогену и ФСГ. В целом эти изменения приводят к повышению секреции прогестерона при сохранении определенного уровня продукции эстрогена. Секреция прогестерона желтым телом достигает максимального значения на 5—7-е сутки после овуляции. Высокий уровень прогестерона оказывает негативное регуляторное воздействие па уровень гонадолиберина, из-за чего происходит снижение частоты секреторных выбросов этого гормона. Снижение частоты выбросов гонадолиберина вызывает снижение секреции ЛГ и ФСГ. Наряду с этим клетки желтого тела утрачивают эти рецепторы. Отсутствие стимуляции посредством ФСГ и ЛГ ускоряет процессы атрезии желтого тела и его последующее превращение в белое тело. Снижение уровня эстрогена и прогестерона ведет к устранению негативной обратной связи, подавляющей продукцию ФСГ, вследствие чего уровень этого гормона вновь повышается и инициирует начало нового менструального цикла (Yen, 1999).
Резкое повышение уровня ЛГ необходимо для овуляции. Под влиянием ЛГ первичный овоцит переходит к заключительной стадии первого мейотического деления, в результате которого образуется вторичный овоцит и первое полярное тельце. Выброс ЛГ стимулирует выделение протеолитических ферментов, которые деградируют клетки на поверхности фолликула и стимулируют ангиогенез в стенке фолликула и синтез простагландинов. Эти воздействия ЛГ приводят к набуханию и разрушению фолликула. При овуляции происходит выброс овоцита в полость тела. Овоцит остается удерживаемым яичником, и только мышечные сокращения маточной (фаллопиевой) трубы переводят его в контакт с эпителием яйцевода, после чего начинается его перемещение в матку.
Обычно продукция эстрогена (эстрадиола) происходит непрерывно на протяжении менструального цикла. Его концентрация снижается в начале фолликулярной фазы, достигает пика на протяжении поздней фолликулярной фазы и запускает процесс овуляции. Уровень прогестерона и эстрогена возрастает в лютеиновой фазе и это повышение концентрации эстрогена стимулирует утолщение и созревание эндометрия — внутренней оболочки матки. Прогестерон способствует созреванию эндометрия и его стабилизации. Он также предотвращает дальнейший рост эндометрия и деление его клеток, а также превращает эндометрий в секреторное образование, готовое к имплантации оплодотворенной яйцеклетки. В конце лютеиновой фазы концентрации эстрогена и прогестерона снижаются и это инициирует менструацию и последующее разрушение эндометрия. Разрушение эндометрия происходит в случае, если в этот период не произошло имплантации яйцеклетки.
Ингибин представляет собой гликопротеин, выделенный в виде гетеродимера из двух субъединиц, связанных дисульфидными связями. Две изоформы ингибина называют ингибин А и ингибин Б. У женщин ингибин вырабатывается клетками гранулезного слои и желтого тела (dcKnster, Robertson, 1989; Groome ct a]., 1996). Синтез ингибина и его выделение контролируются гормонами ФСГ (гранулезные клетки) и ЛГ (желтое тело). Уровень ингибина (в сыворотке) достигает наибольшего значения посередине менструального цикла в средней чисти лютеиновой фазы и снижается перед началом менструации (Schcstcd ct at.. 2000). Ингибии обладает способностью подавлять выработку ФСГ и, как было недавно показано, оказывает влияние на иммунную и нервную системы, а также стимулирует гемопоэтическую функцию (dcKrcster, Robertson, 1989; Schcstcd ct а!.. 2000). Кроме того, ингибин может оказывать паракринноое влияние, имеющее отношение к росту и созреванию яичников и классическим эндокринным функциям в созревании гипоталамо-гипофизарно-яичниковой системы (Groome ct al., 1996; Sehoted et ai., 2000). Для полного выяснения роли ингибина в физиологии человека необходимо проведение дополнительных исследований.
Общая характеристика оральных контрацептивов[править | править код]
Препараты оральных контрацептивов доступны в трех основных формах — препараты с фиксированной дозировкой, комбинированные фазные препараты и ежедневные препараты прогестина. Монофазные препараты содержат в фиксированном количестве эстроген и прогестин, принимаемые на протяжении всего менструального цикла. В бифазных и трехфазных (мультифазных) препаратах общее количество принимаемого прогестина снижается на протяжении цикла, подобно тому как это происходит в норме при физиологических процессах. Этинилэстрадиол и местранол представляют собой типичные синтетические эстрогены, используемые в составе оральных контрацептивов. Ранние препараты содержали местранол в более высоких концентрациях (50 мкг) по сравнению с современными препаратами (< 50 мкг эстрогенового компонента этинилэстрадиола или местранола). Первое поколение прогостинов включало норэтиндрон и норэтиндронацетат либо этинодиолдиацетат и норэтинодрел. Второе поколение прогестинов представлено норгестрелом или левоноргострелом (Larsen ct al.. 2003). И наконец, третье поколение прогестинов — это дезогестрел, норэстимат и гестроден. Пропс тины третьего поколения создавались, чтобы обладать высокой специфичностью к рецепторам прогестина. что позволило снизить атерогенные качества этих веществ (Gods!and et al., 1992). Список оральных контрацептивов, применяемых в настоящее время в США. представлен а табл. 19.1. Важно отметить, что новое поколение прогестинов считается менее андрогенным но сравнению с более ранними препаратами. Вместе, с тем вое варианты оральных контрацептивов являются результативными при клиническом лечении различных заболеваний, включая гирсутизм (Thomcycroff, 1999). Считают, что в низких лозах оральные контрацептивы обладают действием, нормализующим липидный обмен, что способствует замедлению процессов атеросклероза у человека.
Первое поколение оральных контрацептивов имело массу отрицательных побочных аффектов, таких, как увеличение массы тела, повышенная утомляемость, головные боли и головокружения (Lebrun et al., 2003). Эти побочные эффекты были сведены к минимуму в препаратах второго и третьего поколения, содержащих действующие компоненты в меньших концентрациях. Количество гормонов в составе этих препаратов было снижено на 30 - 40 %, что привело к заметному уменьшению побочных эффектов (Grocnblatt, 1985). Исследования изменений массы и состава тела у женщин, ведущих малоподвижный образ жизни, и занимающихся спортом, применяющих оральные контрацептивы, подтвердили эти результаты. У женщин, занимающихся спортом (Lebrun ct al., 2003) и ведущих малоподвижный образ жизни (Rosenberg, 1998), отмечали недостоверное увеличение массы тела (-1 кг за период более 6 недель) или отсутствие изменений массы и состава тела соответственно. Вместе с тем, когда речь идет о спортивных показателях профессиональных спортсменок, нельзя недооценивать даже небольших изменений массы и состава тела, связанных с применением оральных контрацептивов.
Механизм действия оральных контрацептивов[править | править код]
Механизм, посредством которого эстроген и прогестерон подавляют овуляцию, заключается в ингибировании повышения концентрации ФСГ и ЛГ в середине менструального цикла. Комбинированные препараты обладают высокой эффективностью в отношении подавления секреции гонадотропного гормона и таким образом предотвращают овуляцию. В то же время препараты, содержащие только прогестины, слабо подавляют овуляцию и их действие опосредовано через ингибирование секреции гонадолиберииа гипоталамусом. За счет этого препараты, содержащие только прогестин, снижают уровень ФСГ, ЛГ, эстрадиола и прогестерона (Spcroff ct al., 1993).
Изменения уровня половых гормонов в крови, вызванные применением оральных контрацептивов, влекут за собой изменения в функции эндометрия. Показаны также изменения в характере транспорта и имплантации яйцеклетки наряду с изменениями состава слизи в шейке матки (увеличение вязкости и снижение объема) (Larsen ct al., 2003). В целом эти изменения уровня гормонов и функции эндометрия матки создают неблагоприятные условия для успешной овуляции, имплантации и развития оплодотворенной яйцеклетки.
Кроме того, оральные контрацептивы оказывают влияние на метаболизм углеводов, белков и жиров. Изменения углеводного обмена зависят от дозы, эффективности и химической структуры прогестина в составе препарата. Роль синтетических эстрогенов на метаболизм глюкозы остается неясной, однако они могут действовать синэргично с прогестинами, вызывая нарушение толерантности глюкозы.
Эпидемиологические исследования свидетельствуют о незначительном риске развития диабета или его отсутствии у лиц, применяющих оральные контрацептивы (последнего поколения). Вместе с тем при назначении оральных контрацептивов будет разумным учитывать состояние организма женщины в отношении метаболизма глюкозы. Для женщин с повышенным риском развития диабета предпочтительны препараты с низким содержанием прогестинов типа норэтиндрона.
Эстрогены в составе оральных контрацептивов повышают содержание в печени различных глобулинов, например факторов V, VII, X и фибриногена. Эти глобулины усиливают процессы тромбоза. Кроме того, синтетические эстрогены стимулируют синтез ангнотензиногена (который превращается в ангиотензин), что у некоторых женщин приводит к повышению артериального давления (Larsen ct al., 2003). Андрогенные прогестины усиливают синтез глобулина, связывающего половой гормон {sex Нот топе binding globulin, SHBG). Этот гормон связывает производные 19-норгсстосгерона, входящие в состав оральных контрацептивов. В целом, в случае применения препаратов последнего поколения вероятность венозного и артериального тромбоза, которая прямо зависит от дозы эстроген, относительно невелика.
Синтетические эстрогены, входящие в состав оральных контрацептивов, способствуют повышению уровня липопротеинов высокой плотности (ЛПВП), общего холестерина и триглицеридов, а также снижению концентрации липопротсилов низкой плотности (ЛПНП) (Larsen ct al., 2003). И наоборот, прогестиновые компоненты вызывают снижение уровня ЛПВП, общего холестерина и триглицеридов, а также повышение содержания ЛПНП. Отрицательное влияние прогестинов в первых оральных контрацептивах было связано с высокой андрогенной активностью этих веществ. В современных оральных контрацептивах количество прогестинов снижено, они обладают более низкой андрогенной активностью, и, вероятно, все это позволило ослабить эффект этих препаратов на уровень липидов. При оценке метаболическом реакции на различные оральные контрацептивы очень важно определить тип, дозу и сочетание всех синтетических гормонов.
Влияние оральных контрацептивов на спортивные показатели[править | править код]
Объем литературных данных в отношении влияния оральных контрацептивов на спортивные показатели за несколько последних десятилетий существенно возрос. Результаты ранних исследований действия препаратов первого поколения с высоким содержанием гормонов часто существенно отличаются от более поздних работ, посвященных оценке мультифазных препаратов с низким содержанием гормонов. Несмотря на то что в этом обзоре основное внимание уделено препаратам второго и третьего поколений, которые применяются сегодня женщинами, занимающимися спортом, там где это уместно будут упомянуты и данные более ранних исследований.
Аэробная производительность[править | править код]
Максимальное потребление кислорода (V02max) часто используется о качестве меры оценки аэробных способностей. В норме цикличные изменения гормонов яичников не влияют на VO,max (Dc Souza et al., 1990; Bemben ct al., 1992, 1995; Lebrun ct al., 1995; Lynch, Nimmo, 1998). Вместе с тем результаты исследований гормональных изменений, индуцированных применением экзогенных гормонов, как и в случае приема оральных контрацептивов, менее однозначны.
Изучение последствий приема экзогенных овариальных гормонов отличаются лозами и типом применявшихся оральных контрацептивов. В ходе исследований, проведенных в начале 1980-х годов, не удалось показать сколь-нибудь достоверных различий в показателях физической работоспособности лиц, применявших оральные контрацептивы, и лиц контрольной группы (McNeill, Mozingo, 1981; Huisveld et al., 1983). Проведенное позднее изучение эффектов кратковременного (21 сутки) применения 1мг норэтиндрона также не выявило достоверных различий в VO.max лиц, применявших контрацептив, и спортсменок контрольной группы (Вгупег et al., 1996). Вместе с тем интересно отметить, что у женщин, занимавшихся тренировкой аэробной выносливости и принимавших монофазные оральные контрацептивы на протяжении шестимесячного периода, наблюдалось достоверное снижение VO.pcak (Notelovitz et al., 1987). Дальнейшая оценка влияния трехфазных препаратов (Casazza et al., 2002) у женщин со средним уровней двигательной активности также показала достоверное (—11 %) VO.pcak после 4 месяцев приема контрацептивов. Вместе с тем отличий в пиковых значениях ЧСС и минутной вентиляции легких обнаружено не было. Эти результаты подтверждает работа Лебрана (Lebrun ct al., 2003), продемонстрировавшего снижение V02raax на 4,7 X после двухмесячного приема трехфазных оральных контрацептивов.
К числу потенциальных факторов, которые могут оказывать влияние на максимальную аэробную мощность, относятся ударный объем, кислородная емкость крови, способность использовать кислород в крови и объем кровообращения в мышечной ткани. Снижение VO}max может быть логически ассоциировано со снижением ударного объема и/или кислородной емкостью крови. Было показано возрастание ударного объема у женщин околоменопаузалыюго возраста после гормонзамещающей терапии (Kamali ct al., 2000). В то же время у женщин, принимающих оральные контрацептивы, не выявлено изменений концентраций ферритина и гемоглобина в состоянии покоя и содержание железа в сыворотке крови не изменялось (Mooij ct al., 1992). Эти данные свидетельствуют о том, что упомянутые выше первичные факторы не вносят существенного вклада в ограничение аэробного потенциала.
Регуляция кровообращения посредством таких механизмов, как активация симпатической нервной системы, также рассматривалась в качестве одного из возможных факторов, ответственных за наблюдаемое снижение максимальной аэробной мощности. Данные исследований различных заболеваний, сопровождающихся повышением уровня овариальных гормонов, дают экспериментальные подтверждения роли данного механизма. При беременности наступает период, когда происходит повышение уровня эстрогена и прогестерона и наблюдается подавление активации симпатической нервной системы в сочетании со снижением содержания катехоламинов в крови (МсМиггеу et al., 1993). Таким образом, снижение активации симпатической нервной системы также может быть одной из причин снижения аэробной мощности, что обнаружено в этих исследованиях.
Анаэробные и силовые показатели, а также повреждения мышц[править | править код]
В настоящий момент литература, посвященная вопросам взаимосвязи приема экзогенных овариальных гормонов и анаэробного метаболизма и/или мышечной силы, крайне ограничена. В ранних работах было показано снижение мышечной силы во время лютеиновой фазы у женщин с нормальным менструальным циклом (Pctrofsky ct al., 1976). Оценка возможности применения оральных контрацептивов для ослабления такого снижения мышечной силы была впоследствии проведена другими исследователями в группе женщин, занимавшихся спортом (Lebrun ct al., 2003). Показатели анаэробной работоспособности в анаэробном скоростном тесте и изокинетическую силу оценивали на динамометре Cybеx до и после приема трехфазного препарата на протяжении двух месяцев. Несмотря на то что в этом исследовании не удалось обнаружить достоверные различия ни в показателях анаэробной производительности, ни в изокинетической силе, влияние повышенного уровня овариальных гормонов на анаэробные и силовые показатели остается в значительной мере неизученным и должно быть подвергнуто дальнейшему изучению, прежде чем будут сделаны окончательные выводы.
Влияние эндогенных и экзогенных эстрогенов на обусловленные физическими нагрузками повреждения мышц изучали на протяжении последней декады. Повреждение ультраструктуры мышц является типичным следствием интенсивных упражнений, как в случае силовой тренировки. Роль эстрадиола в поддержании структуры мембран и их проницаемости оценивали как на животных моделях, так и у человека.
У женщин в ответ на интенсивные физические нагрузки наблюдаются более низкие концентрации креатинкиназы в сыворотке крови по сравнению с мужчинами, что, вероятно, обусловлено меньшей общей мышечной массой у женщин (Shumate et al., 1979; Rogers et al., 1985). Вместе с тем эксперименты на животных подтвердили роль эстрадиола в снижении проницаемости мембран в ответ на физическую нагрузку (Amelink et al., 1988, 1990; Bar, Amelink, 1997).
Результаты оценки роли эстрадиола в повреждении мышц в ответ на физическую нагрузку у женщин, применяющих оральные контрацептивы, ограничены и неоднозначны. Сообщалось об отсутствии какого-либо влияния эстрадиола на активность креатинкиназы после занятий физическими упражнениями (Miles, Schneider, 1993). Взаимосвязь между задержкой начала мышечных болей и приемом оральных контрацептивов была обнаружена у женщин, применявших оральные контрацептивы, по сравнению с контрольной группой после обычного занятия на степ-платформах продолжительностью 50 мин. Прием оральных контрацептивов ассоциировался со снижением величины самостоятельной оценки степени мышечной боли, однако причины обнаруженной взаимосвязи остаются неясными (Thompson et al., 1997).
В более поздних исследованиях использовали физические нагрузки, вызывающие повреждения мышц при эксцентрических сокращениях. Бег под гору (30 мин) использовали, чтобы вызвать повреждения мышц у женщин, принимавших оральные контрацептивы, и лиц контрольной группы (Carter et al., 2001). В обеих группах наблюдалось достоверное повышение уровня креатинкиназы и степени мышечных болей по сравнению с исходным уровнем. Различия между группами отмечались через 72 ч после повреждения мышц и состояли в снижении уровня креатинкиназы у лиц, принимавших оральные контрацептивы, по сравнению с контрольной группой. Эти данные свидетельствуют о протекторной роли эстрогенов в процессах повреждения мышц. Однако при использовании протокола, включавшего 50 повторений эксцентрических сокращений мышц — сгибателей локтя, не было обнаружено никаких отличий в оценках величины мышечных болей, уровня креатинкиназы в сыворотке крови и диапазона подвижности локтевого сустава (Savage, Clarkson, 2002). Однако у лиц, принимавших оральные контрацептивы, наблюдалось замедление восстановления мышечной силы (максимальная изометрическая сила) — через двое суток после повреждения мышц.
Роль экзогенных эстрогенов в процессах восстановления поврежденных при физической нагрузке мышц остается неясной. Исследования на животных свидетельствуют о протекторной роли (антиоксидантные свойства) эстрадиола на проницаемость мембран. Исследования с участием человека характеризуются различием используемых методологических подходов и полученных результатов. Для уточнения возможных положительных эффектов эстрогена па стабильность мышечной ткани после активных физических нагрузок необходимо проведение дальнейших исследований.
Переносимость повышенных температур[править | править код]
Фазы менструального цикла характеризуются различной чувствительностью организма к термическим стрессорам. При выполнении физических упражнений в лютеиновой фазе внутренняя температура оказалась повышенной (на 0,4 °С) по сравнению с фолликулярной фазой (Stachenfeld et al., 2000). Однако у женщин, принимающих оральные контрацептивы, наблюдалась меньшая вариабельность внутренней температуры тела в различные фазы цикла по сравнению с лицами контрольной группы. Основной причиной этих межфазовых колебаний внутренней температуры тела являются изменения уровня прогестерона на протяжении менструального цикла (его повышение в лютеиновой фазе). Использование оральных контрацептивов, содержащих прогестины, может вызывать повышение внутренней температуры тела во время занятий физическими упражнениями, подобно тому как это происходит у женщин в лютеиновой фазе. Влияние прогестерона на внутреннюю температуру тела в дальнейшем было подтверждено при изучении изменений в организме у женщин, в течение длительного времени применявших метод контрацепции с использованием инъекций прогестерона (т. с. Депот-Провера) (Cheung et al., 2000). У этих женщин отмечалось повышение внутренней температуры тела на протяжении 24 — 36 ч после применения препарата. Другие исследователи сообщали о повышении внутренней температуры тела (на 0,3 *С) и ЧСС (на 8уд-ми1Г') у женщин, использовавших оральные контрацептивы, содержащие синтетические прогестины, при выполнении физических упражнений в жару (30 *С, 50 % относительной влажности). Эти изменения внутренней температуры тела и ЧСС подобны тем, которые наблюдаются у женщин при физической нагрузке в жару в лютеиновой фазе. Создастся впечатление, что оральные контрацептивы второго и третьего поколений имитируют терморегуляторные реакции женского организма в ответ на физическую нагрузку при повышенной температуре в лютеиновой фазе. Чтобы лучше понять влияние использования низких доз контрацептивов на физическую работоспособность в условиях повышенной температуры и влажности, необходимо проведение дальнейших исследований.
Использование различных субстратов и метаболические процессы при физической нагрузке[править | править код]
Влияние стероидов в составе оральных контрацептивов на метаболические процессы варьирует в зависимости от состава этих препаратов. В табл. 19.2 показано влияние эстрогенэтинилэстрадиола и 19-нортестостерона — производных прогестинов на обменные процессы. Степень влияния непосредственно определяется количеством и степенью воздействия производных стероидов, входящих в состав препарата. Оценка метаболических эффектов в состоянии покоя производилась в процессе изучения побочных эффектов этих препаратов. И только в последнее время исследователи начали понимать роль применения оральных контрацептивов у женщин, занимающихся спортом, во время выполнения физических упражнений.
Сегодня исследования изменений метаболизма, взаимосвязанных с применением оральных контрацептивов, при выполнении физических упражнений ограничены. При исследовании различных групп населения проводилось сравнение лиц, принимавших оральные контрацептивы, по сравнению с теми, кто их не использовал. В ранних работах сообщалось о достоверном повышении уровня свободных жирных кислот у лиц, принимавших оральные контрацептивы, по сравнению с остальными женщинами в состоянии покоя (Boncn et al., 1991). Похоже, что подобная тенденция наблюдается и при физических нагрузках в сочетании со снижением величины дыхательного коэффициента и возможным усилением окисления липидов, которые также выявлены у женщин, использовавших оральные контрацептивы (Bemben et al., 1995).
Последующие исследования с применением стабильных изотопов для оценки метаболизма глюкозы и липидов при физической нагрузке и в состоянии покоя продемонстрировали снижение скорости появления (rate of appearance, Ra), скорости исчезновения (rate of disappearance, Rd) и скорости метаболического клиренса глюкозы во время выполнения упражнений на велоэргометре (45 % или 65 % V02pcak) у женщин, принимавших оральные контрацептивы (Suh et al., 2003). В условиях аналогичной физической нагрузки проводилась оценка мобилизации триглицеридов с использованием метода определения скорости появления (Ra) глицерина (при внутривенном введении 11,1,2,3,3—2Н 1-глицерина); Ra глицерина достоверно возрастала при обеих интенсивностях физической нагрузки в случае приема оральных контрацептивов. Повышение Ra было ассоциировано с достоверным повышением концентрации кортизона в плазме, при этом различий в величине дыхательного коэффициента обнаружено не было (Casazza et al., 2004). Эти данные позволяют считать, что эндогенные овариальные гормоны играют определенную роль, оказывая влияние на процессы метаболизма глюкозы и липидов при физических нагрузках. Изменения уровня гормонов, вызванные физической нагрузкой, очевидно, определяют особенности изменения метаболических процессов у женщин с нормальным менструальным циклом. Оральные контрацептивы (трехфазные) представляют собой значительный стимул для использования глюкозы и липидов в условиях физической нагрузки. Определяющим фактором в случае подобных метаболических изменений, очевидно, является концентрация овариальных гормонов.
Заключение[править | править код]
Оральные контрацептивы все чаще применяются среди женщин, занимающихся спортом и двигательной активностью. Влияние этих экзогенных овариальных гормонов на показатели физической работоспособности еще предстоит выяснить окончательно. Очевидно, что препараты третьего поколения с пониженным содержанием гормонов обладают менее выраженными побочными эффектами. Такие перемены привели к тому, что прием оральных контрацептивов стал более привлекательным для многочисленной группы женщин, занимающихся спортом, включая профессиональных спортсменок высшего класса.
Снижение аэробной мощности, которое наблюдается у женщин, принимающих оральные контрацептивы, вероятнее всего, обусловлено потенциальными изменениями характера кровообращения, вызванными подавлением активации симпатической нервной системы в сочетании со снижением уровня катехоламинов в крови. Эти изменения подобны тем, которые наблюдаются в период беременности. Изменений показателей анаэробной работоспособности и силы при приеме оральных контрацептивов обнаружить не удалось. Женщины, принимающие оральные контрацептивы, могут столкнуться с проблемой терморегуляции. Вместе с тем выявленные изменения напоминают те, которые наблюдаются при физической нагрузке у женщин в лютеиновой фазе менструального цикла в норме. Наиболее значительным результатом исследования влияния приема оральных контрацептивов является их влияние на использование различных субстратов в процессах метаболизма при физической нагрузке. Исследования с использованием стабильных изотопов позволили более глубоко проанализировать взаимоотношение процессов метаболизма глюкозы и липидов в условиях физической нагрузки у женщин, принимающих оральные контрацептивы.
Литературные источники, посвященные исследованиям последствий применения оральных контрацептивов при занятиях физическими упражнениями, относительно ограничены. Важно принимать во внимание потенциальный негативный или эргогенный эффект использования экзогенных овариальных стероидов у профессиональных спортсменок. Для разработки практических рекомендаций по данному вопросу женщинам, занимающимся спортом, необходимо проведение более продолжительных лонгитудинальных исследований.
Читайте также[править | править код]
- Эстрогены - строение, синтез, действие
- Эстрогеновые рецепторы
- Эстрогены - побочные эффекты
- Эстрогенные препараты - применение
- Модуляторы эстрогеновых рецепторов. Ингибиторы синтеза
- Прогестагены
- Антипрогестагены
- Гормональные контрацептивы
Литература[править | править код]
- Amelink, GJ., Kamp, Н.Н. & Bar, P.R. (1988) Creatine kinase isoenzyme profiles after exercise in the rat: sex-linked differences in leakage of CK-MM. Pflugers Archiv 412, 417-421.
- Amelink, G.J., Root, R.W., Erich, W.B.M., Van Gijn, J. & Bar, P.R. (1990) Sex-linked variation in creatine kinase release, and its dependence on oestradiol, can be demonstrated in an in-vitro rat skeletal muscle preparation. Acta Physiologica Scandinavica 138, 115-124.
- Bar, P.R. & Amelink, GJ. (1997) Protection against muscle damage exerted by oestrogen: hormonal or antioxidant action? Biochemical Society Transactions 25, 50-54.
- Bemben, D.A., Boileau, R.A., Bahr, J.M., Nelson, R.A. & Misner, J.E. (1992) Effects of oral contraceptives on hormonal and metabolic responses during exercise. Medicine and Science in Sports and Exercise 24, 434-441.
- Bemben, D.A., Salm, P.C. & Salm, AJ. (1995) Ventilatory and blood lactate responses to maximal treadmill exercise during the menstrual cycle. Journal of Sports Medicine and Physical Fitness 35, 257-262. Bonen, A., Haynes, F.J. & Graham, T.E. (1991) Substrate and hormonal responses to exercise in women using oral contraceptives. Journal of Applied Physiology 70, 1917-1927.
- Bryner, R.W., Toffle, R.C., Ullrich, I.H. & Yeater, R.A. (1996) Effect of low dose oral contraceptives on exercise performance. British Journal of Sports Medicine 30, 36-40.
- Casazza, G.A., Suh, S.H., Miller, B.F., Navazio, F.M. & Brooks, G.A. (2002) Effects of oral contraceptives on peak exercise capacity. Journal of Applied Physiology 93, 1698-1702.
- Casazza, G.A., Jacobs, K.A., Suh, S.H. et al. (2004) Menstrual cycle phase and oral contraceptive effects on triglyceride mobilization during exercise. Journal of Applied Physiology 97(1), 302-309. Carter, A., Dobridge, J. & Hackney, A.C. (2001) Influence of estrogen on markers of muscle tissue damage following eccentric exercise. Fiziologiia Chclovcka 27, 133-137.
- Cheung, S.S., McLellan, T.M. & Tenaglia, S. (2000) The thermophysiology of uncompensatable heat stress. Physiological manipulations and individual characteristics. Sports Medicine (Auckland, N.Z.) 29, 329-359. deKretser, D.M. & Robertson, D.M. (1989) The isolation and physiology of inhibin and related proteins. Biology of Reproduction 40, 33-47.
- De Souza, M.J., Maguire, M.S., Rubin, K.R. & Maresh, CM. (1990) Effects of menstrual phase and amenorrhea on exercise performance in runners. Medicine and Science in Sports and Exercise 22(5), 575-580.
- Dorflinger, L. (1985) Relative potency of progestins used in oral contraceptives. Contraception 557, 31-37.
- Godsland, I.F., Crook, D. & Wynn, V. (1992) Clinical and metabolic considerations of long-term oral contraceptive use. American Journal of Obstetrics and Gynecology 166, 1955-1964.
- Greenblaat, R.B. (1985) Oral contraceptives: the state of the art. Clinical Therapeutics 8, 6-27.
- Groome, N.P., Illingworth, P.J., O'Brien, M. et al. (1996) Measurement of dimeric inhibin В throughout the human menstrual cycle. Journal of Clinical Endocrinology and Metabolism 81, 1401-1405.
- Huisveld, LA., Haspers, J.E.H. & Bernink, M.J. (1983) The effect of oral contraceptives and exercise on hemostatic and fibrinolytic mechanisms in trained women. International Journal of Sports Medicine 4, 97-103.
- Kamali, P., Muller, Т., Lang, U. & Clapp, J.F., 3rd. (2000) Cardiovascular responses of perimenopausal women to hormone replacement therapy. American Journal of Obstetrics and Gynecology 182, 17-22.
- Knobil, E. (1999) The wisdom of the body revisited. News in Physiological Sciences 14, 1-11.
- Larsen, P.R., Kronenberg, H.M., Melmed, S. & Polonsky, K.S. (2003) Williams Textbook of Endocrinology. W.B. Saunders, Co., Philadelphia, PA.
- Lebrun, CM., McKenzie, D.C., Prior, J.C. & Taunton, J.E. (1995) Effects of menstrual cycle phase on athletic performance. Medicine and Science in Sports and Exercise 27, 437-444.
- Lebrun, CM., Petit, M.A., McKenzie, D.C, Taunton, J.E. & Prior, J.C. (2003) Decreased maximal aerobic capacity with use of a triphasic oral contraceptive in highly active women: a randomized controlled trial. British Journal of Sports Medicine 37 , 315-320.
- Lynch, N.J. & Nimmo, M.A. (1998) Effects of menstrual cycle and oral contraceptive use on intermittent exercise. European Journal of Applied Physiology 78, 565-572.
- McMurray, R.G., Mottola, M.F., Wolfe, L.A. et al. (1993) Recent advances in understanding maternal and fetal responses to exercise. Medicine and Science in Sports and Exercise 25, 1305-1321.
- McNeill, A.W. & Mozingo, E. (1981) Changes in the metabolic cost of standardized work associated with the use of an oral contraceptive. Journal of Sports Medicine 21, 238-244.
- Martin, J.G. & Buono, M.J. (1997) Oral contraceptives elevate core temperature and heart rate during exercise in the heat. Clinical Physiology (Oxford, England) 17, 401-409.
- Miles, M.P. & Schneider, CM. (1993) Creatine kinase isoenzyme MB may be elevated in healthy young women after submaximal eccentric exercise. Journal of Laboratory Clinical Medicine 122, 197-201.
- Mishell, D.R. (1999) Contraception. In: Reproductive Endocrinology: Physiology, Pathophysiology and Clinical Management (Yen, S.S.C., Jaffe, R.B. & Barbieri, R.L., eds.). W.B. Saunders, Co., Philadelphia, PA: 676-708.
- Mooij, P.N.M., Thomas, C.M.G., Doesburg, W.H. & Eskes, T.K.A.B. (1992) The effects of oral contraceptives and multivitamin supplementation on serum ferritin and hematological parameters. International Journal of Clinical Pharmacology and Therapeutics 30, 57-62.
- Notelovitz, М., Zauner, C. & McKenzie, I. (1987) The effect of low-dose contraceptives on cardiorespiratory function, coagulation, and lipids in exercising young women: a preliminary report. American Journal of Obstetrics and Gynecology 156, 591-598.
- Petrofsky, J.S., LeDonne, D.M. & Rinehart, J.S. (1976) Isometric strength and endurance during the menstrual cycle. European Journal of Applied Physiology 35, 1-10.
- Rogers, M.A., Stull, G.A. & Apple, F.S. (1985) Creatine kinase isoenzyme activities in men and women following a marathon race. Medicine and Science in Sports and Exercise 17, 679-682.
- Rosenberg, M. (1998) Weight change with oral contraceptive use and during the menstrual cycle. Contraception 58, 45-49.
- Savage, K.J. & Clarkson, P.M. (2002) Oral contraceptive use and exercise-induced muscle damage and recovery. Contraception 66, 67-71.
- Sehested, A., Juul, A., Andersson, A.M. et al. (2000) Serum inhibin A and inhibin В in healthy prepubertal, pubertal and adolescent girls and adult women: relation to age, stage of puberty, menstrual cycle, follicle-stimulating hormone, luteinizing hormone, and estradiol levels. Journal of Clinical Endocrinology and Metabolism 85, 1634-1640.
- Shumate, J.B., Brooke, М.Н., Carroll, J.E. & Davis, J.E. (1979) Increased serum creatine kinase after exercise: a sex-linked phenomenon. Neurology 29, 902-904.
- Speroff, L., DeCherney, A. & the Advisory Board for the New Progestins (1993) Evaluation of the new generation of oral contraceptives. Obstetrics and Gynecology 81, 1034-1044.
- Stachenfeld, N.S., Silva, С & Keefe, D.L. (2000) Estrogen modifies the temperature effects of progesterone. Journal of Applied Physiology 88, 1643-1649.
- Suh, S.H., Casazza, G.A., Horning, M.A., Miller, B.F. & Brooks, G.A. (2003) Effects of oral contraceptives on glucose flux and substrate oxidation rates during rest and exercise. Journal of Applied Physiology 94, 285-294.
- Thompson, H.S., Hyatt, J.P., De Souza, M.J. & Clarkson, P.M. (1997) The effects of oral contraceptives on delayed onset muscle soreness following exercise. Contraception 56, 59-65.
- Thorneycroft, I.H. (1999) Update on androgenicity. American Journal of Obstetrics and Gynecology 180, 288-294.
- Yen, S.S.C (1999) The human menstrual cycle: neuroendocrine regulation. In: Reproductive Endocrinology: Physiology, Pathophysiology and Clinical Management (Yen, S.S.C, Jaffe, R.B. & Barbieri, R.L., eds.). W.B. Saunders, Co., Philadelphia, PA: 191-217.