Комбинированная антибиотикотерапия — различия между версиями
Zabava (обсуждение | вклад) (→Оценка взаимодействия антимикробных средств) |
Ars (обсуждение | вклад) |
||
| (не показаны 3 промежуточные версии 2 участников) | |||
| Строка 2: | Строка 2: | ||
== Комбинированная антимикробная терапия == | == Комбинированная антимикробная терапия == | ||
| − | Комбинированная антимикробная терапия применяется по строгим показаниям | + | '''Комбинированная антимикробная терапия''' применяется по строгим показаниям. При выборе комбинации препаратов необходимо учитывать возможные [[Взаимодействие лекарственных средств|взаимодействия]] между ними, влияющие как на микро-, так и на макроорганизм. Препараты, действующие на разные мишени, могут усиливать или ослаблять антимикробную активность друг друга. Побочное действие комбинации [[Антибиотики (антимикробные средства)|антимикробных средств]] слагается из [[Побочные эффекты|побочных эффектов]] отдельных препаратов, а иногда и превышает простую сумму их побочных эффектов. Например, [[ванкомицин]] сам по себе не оказывает выраженного нефротоксического действия, но, по некоторым данным, усугубляет нефротоксичность [[Аминогликозиды|аминогликозидов]] (Farberand Moelle-ring, 1983). |
=== Оценка взаимодействия антимикробных средств === | === Оценка взаимодействия антимикробных средств === | ||
| Строка 14: | Строка 14: | ||
Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.[[Image:Gm43_2.jpg|250px|thumb|right|Рисунок 43.2. Оценка взаимодействия антимикробных средств.]] | Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.[[Image:Gm43_2.jpg|250px|thumb|right|Рисунок 43.2. Оценка взаимодействия антимикробных средств.]] | ||
| − | В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, тетрациклины, эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как β-лактамные антибиотики, ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет рифампицин. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны. | + | В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, [[тетрациклины]], эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как [[Бета-лактамные антибиотики|β-лактамные антибиотики]], ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет [[рифампицин]]. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны. |
== Показания к комбинированной антимикробной терапии == | == Показания к комбинированной антимикробной терапии == | ||
| Строка 32: | Строка 32: | ||
In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988). | In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988). | ||
| − | Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro | + | Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro β-лактамные антибиотики, активные в отношении псевдомонад, и аминогликозиды действуют синергично в отношении большинства штаммов Pseudomonas aeruginosa. В экспериментах на животных комбинированная терапия тоже оказалась эффективнее, чем монотерапия указанными препаратами. В некоторых, хотя далеко не во всех, клинических испытаниях (Hilfetal., 1989; Vidal etal., 19%; Leibovici et al., 1997) сочетание β-лакгамных антибиотиков с аминогликозидами увеличивало выживаемость при тяжелых псевдомонадных инфекциях. Комбинированную терапию рекомендуется применять и при инфекциях, вызванных другими грамотрицательными палочками. Однако ее преимущества перед монотерапией во многих случаях остаются недоказанными (Ваглеге, 1992; Rybak and McGrath, 1996). |
Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae. | Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae. | ||
| Строка 49: | Строка 49: | ||
Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается. | Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается. | ||
| + | == Читайте также == | ||
| + | |||
| + | *[[Антибиотики (антимикробные средства)]] | ||
| + | **[[Выбор антибиотика]] | ||
| + | **[[Профилактическая антибиотикотерапия]] | ||
| + | **[[Механизмы действия антибиотиков]] | ||
| + | *[[Антибактериальные средства]] | ||
| + | *[[Сульфаниламиды, триметоприм/сульфаметоксазол]] | ||
| + | *[[Хинолоны и мочевые антисептики]] | ||
| + | *[[Бета-лактамные антибиотики]] | ||
| + | **[[Пенициллины]] | ||
| + | **[[Цефалоспорины]] | ||
| + | **[[Карбапенемы]] | ||
| + | **[[Ингибиторы бета-лактамаз]] | ||
| + | *[[Аминогликозиды]] | ||
| + | *[[Ингибиторы синтеза белка]] | ||
| + | **[[Тетрациклины]] | ||
| + | **[[Левомицетин(хлорамфеникол)]] | ||
| + | **[[Макролиды (эритромицин, кларитромицин, азитромицин)]] | ||
| + | **[[Клиндамицин]] | ||
| + | **[[Хинупристин (дальфопристин)]] | ||
| + | **[[Линезолид]] | ||
| + | **[[Ванкомицин]] | ||
| + | |||
| + | *[[Противотуберкулезные средства (антимикобактериальные)]] | ||
| + | **[[Изониазид]] | ||
| + | **[[Рифампицин]] | ||
| + | **[[Этамбутол]] | ||
| + | **[[Стрептомицин]] | ||
| + | **[[Пиразинамид]] | ||
| + | **[[Прочие противотуберкулезные препараты]] | ||
Текущая версия на 19:17, 21 марта 2015
Источник:
Клиническая фармакология по Гудману и Гилману том 3.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Содержание
Комбинированная антимикробная терапия[править | править код]
Комбинированная антимикробная терапия применяется по строгим показаниям. При выборе комбинации препаратов необходимо учитывать возможные взаимодействия между ними, влияющие как на микро-, так и на макроорганизм. Препараты, действующие на разные мишени, могут усиливать или ослаблять антимикробную активность друг друга. Побочное действие комбинации антимикробных средств слагается из побочных эффектов отдельных препаратов, а иногда и превышает простую сумму их побочных эффектов. Например, ванкомицин сам по себе не оказывает выраженного нефротоксического действия, но, по некоторым данным, усугубляет нефротоксичность аминогликозидов (Farberand Moelle-ring, 1983).
Оценка взаимодействия антимикробных средств[править | править код]
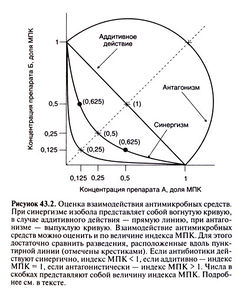
Существует два способа оценки взаимодействия антимикробных средств. В первом случае микроорганизмы высевают на жидкие питательные среды, содержащие разные сочетания последовательных двукратных разведений двух исследуемых препаратов, и инкубируют в течение 18—24 ч. Затем определяют МПК каждого антибиотика в отдельности и в присутствии другого препарата. Если МПК комбинации антибиотиков составляет не более 25% МПК каждого препарата в отдельности, антибиотики действуют синергично. Синергизм может быть обусловлен повышением чувствительности микроорганизма к одному препарату под действием другого. Если МПК комбинации антибиотиков равна половине МПК каждого из них в отдельности, это означает, что препараты действуют независимо друг от друга, а их эффект суммируется (аддитивное действие). Если МПК комбинации антибиотиков меньше, чем МПК каждого из них в отдельности, препараты действуют антагонистически (то есть ослабляют действие друг друга). При сравнении всех (а не только одинаковых) комбинаций двукратных разведений антибиотиков можно построить так называемые изоболы (рис. 43.2). Если антибиотики действуют синергично, изобола представляет собой вогнутую кривую, если аддитивно — прямую линию, если антагонистически — выпуклую кривую. Для каждой точки изоболы можно рассчитать индекс МПК — сумму концентраций, выраженных в долях МПК. Для двух антимикробных средств А и Б его рассчитывают следующим образом:
Индекс МПК = МПК А в присутствии Б/МПКА+МПК Б в присутствии А/МПКБ
В случае аддитивного действия индекс МПК равен единице, при синергизме он меньше 1, при антагонизме — больше. К сожалению, с помощью этого метода нельзя выявить синергичный бактерицидный эффект, так как определяются не МБК, а МПК.
Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.
В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, тетрациклины, эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как β-лактамные антибиотики, ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет рифампицин. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны.
Показания к комбинированной антимикробной терапии[править | править код]
Назначение нескольких антимикробных средств оправдано в следующих случаях: 1) при эмпирической терапии (возбудитель не известен), 2) при лечении смешанных инфекций, 3) при необходимости усилить антимикробное действие в отношении определенного возбудителя, 4) в целях предупреждения лекарственной устойчивости.
Эмпирическая терапия[править | править код]
Это самый частый повод для назначения комбинации антимикробных средств. Чтобы правильно подобрать лечение, необходимо знать особенности инфекции, ее наиболее вероятных возбудителей, а также антимикробные спектры препаратов, которые могут применяться в данной ситуации. Если состояние больного тяжелое, антимикробная терапия должна быть направлена против всех возможных возбудителей. Для этого часто приходится назначать несколько препаратов. Например, при внебольничной пневмонии используют цефуроксим в сочетании с макролидами: первый активен в отношении грамотрицательных бактерий, а вторые — в отношении возбудителей атипичных пневмоний, например Mycoplasma pneumoniae. Но такое лечение не должно быть слишком длительным. В нем нет необходимости, если возбудитель уточнен или выяснилось, что инфекция вообще отсутствует. Комбинированная терапия недешева, увеличивает риск побочных эффектов, способствует развитию суперинфекции и отбору полирезистентных штаммов. Неоправданное применение комбинации антимикробных средств бывает обусловлено тем, что врачи начинают лечение до взятия материала на посев или же, получив данные о возбудителе и его чувствительности, не меняют схему лечения. Конечно, отказаться от терапии, доказавшей свою эффективность, может быть трудно. Тем не менее нужно всегда стремиться назначать препарат с наиболее узким спектром действия и минимальными побочными эффектами. Лечение смешанных инфекций. Комбинированная антимикробная терапия показана при смешанной инфекции, возбудители которой чувствительны к разным антимикробным средствам. Например, абсцессы брюшной полости, печени и головного мозга, а также инфекции половых органов часто бывают вызваны смешанной аэробной и анаэробной микрофлорой.
Усиление действия антимикробных средств[править | править код]
Совместное применение нескольких антимикробных средств может значительно усиливать их действие, хотя преимущества комбинированного лечения перед монотерапией доказаны лишь для небольшого числа инфекций.
Наиболее убедительные доказательства получены для энтерококкового эндокардита (Wilson et al., 1995). In vitro пенициллины оказывают на Enterococcus faecalis и Enterococcus faecium лишь бактериостатическое действие, а в комбинации со стрептомицином или с гентамицином — бактерицидное. Причем после монотерапии пенициллинами рецидивы возникают намного чаше, чем после комбинированной терапии.
In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988).
Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro β-лактамные антибиотики, активные в отношении псевдомонад, и аминогликозиды действуют синергично в отношении большинства штаммов Pseudomonas aeruginosa. В экспериментах на животных комбинированная терапия тоже оказалась эффективнее, чем монотерапия указанными препаратами. В некоторых, хотя далеко не во всех, клинических испытаниях (Hilfetal., 1989; Vidal etal., 19%; Leibovici et al., 1997) сочетание β-лакгамных антибиотиков с аминогликозидами увеличивало выживаемость при тяжелых псевдомонадных инфекциях. Комбинированную терапию рекомендуется применять и при инфекциях, вызванных другими грамотрицательными палочками. Однако ее преимущества перед монотерапией во многих случаях остаются недоказанными (Ваглеге, 1992; Rybak and McGrath, 1996).
Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae.
По данным исследований in vitro и экспериментов на животных, фторцитозин и амфотерицин В действуют синергично в отношении Cryptococcus neoformans. При криптококковом менингите в отсутствие ВИЧ-инфекции фторцитозин позволяет снизить дозу амфотерицина В и сократить продолжительность лечения с 10 до 6 нед; риск побочных эффектов при этом снижается, а эффективность лечения остается прежней (Bennett et al., 1979). Кроме того, при криптококковом менингите на фоне СПИДа эта комбинация позволяет быстрее добиться стерильности СМЖ, чем монотерапия амфотерицином В (van der Horst etal., 1997).
Предупреждение лекарственной устойчивости[править | править код]
Комбинированная терапия препятствует отбору штаммов, устойчивых к одному из препаратов. Если частота появления мутантов, устойчивых к одному антимикробному средству, составляет, например, 10~7, а к другому — 10~6, то вероятность одновременного возникновения обеих мутаций равна произведению этих частот, то есть 10~13. Чтобы это событие произошло, число микроорганизмов должно быть на несколько порядков больше, чем обычно бывает при инфекциях. Предупреждение лекарственной устойчивости лежит в основе комбинированной терапии туберкулеза. При монотерапии микобактерии туберкулеза часто приобретают устойчивость к препарату, а одновременное назначение двух и более противотуберкулезных средств существенно повышает шансы на успех лечения. Другим примером служит лечение стафилококковых инфекций (например, эндокардита протезированных клапанов и остеомиелита) рифампицином. Добавление второго препарата позволяет избежать появления устойчивых к рифампицину штаммов стафилококков (Zim-merli et al., 1998). С той же целью комбинированную терапию назначают и при инфекции, вызванной Helicobacter pylori (Taylor et al., 1997). В отношении прочих инфекций убедительных данных о том, что комбинированная терапия предотвращает возникновение лекарственной устойчивости, нет.
Недостатки комбинированной терапии[править | править код]
К ним относятся повышение риска побочных эффектов, появление полирезистентных штаммов и высокая стоимость. Кроме того, как уже было отмечено, бактериостатические и бактерицидные препараты могут действовать антагонистично. Клиническое значение антагонизма антимикробных средств остается неясным. Хотя in vitro он наблюдается довольно часто, in vivo случаи антагонизма редки. Наиболее яркий пример такого антагонизма—лечение пневмококкового менингита.
В 1951 г. Леппер и Даулинг заметили, что при лечении пневмококкового менингита пенициллином летальность составила 21%, а при одновременном назначении хпортетрациклина она увеличилась до 79% (Lepper and Dowling, 1951). Позднее эти данные были подтвержаены другими исследователями, обнаружившими увеличение летальности бактериального менингита у детей с 4,3 до 10,5% при комбинированной терапии ампициллином, хлорамфениколом и стрептомицином по сравнению с монотерапией ампициллином (Mathies at al., 1967).
Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается.